35
BAB III
METODE PENELITIAN
A. Jenis Penelitian
Jenis penelitian ini adalah eksperimen satu faktor yang menggunakan
pola acak lengkap.
B. Obyek, Waktu dan Tempat Penelitian 1. Obyek Penelitian
Tikus putih (Rattus norvegicvus) sebanyak 20 ekor galur Wistar yang
berjenis kelamin betina, usia 8-10 minggu dengan berat 150-250 gram dan
belum pernah bunting.
2. Waktu
Penelitian ini dilaksanakan pada tanggal 1 November 2016 uji
pendahuluan. dan pada tanggal 1 Januari 2017 dilakukannya uji definitif .
3. Tempat
a. Pembuatan ekstrak biji pepaya (Carica papaya, L.) dilakukan di
Farmasi Biologi UGM Unit II.
b. Pemeliharaan tikus dilakukan di Unit Pengelolaan Hewan Laboratorium
Biologi FMIPA UNY.
c. Pembuatan preparat histologi organ dilakukan di Laboratorium Patologi
36
d. Pengamatan preparat histologi jumlah kelenjar endometrium, jumlah
eritrosit dan lekosit dilakukan di Laboratorium Anatomi dan Zoologi
Jurdik BIOLOGI FMIPA UNY.
C. Teknik Penempatan Sample
1. Penempatan sampel uji pendahuluan
Metode pengambilan sampel yang digunakan yaitu metode acak
lengkap. Dengan mengambil tikus dari keranjang secara acak sebanyak 2
tikus dan diletakkan pada kotak/wadah pertama (perlakuan 1) kemudian
diberi tanda yaitu merah dan biru, selanjutnya dilakukan sama untuk wadah
selajutnya hingga wadah ke 4 (sampai perlakuan ke 3 dan kontrol).
Ulagan tikus Wadah Kontrol (0 mg) Wadah Perlakuan 1 (100 mg/tikus/hari) Wadah Perlakuan 2 (200 mg/tikus/hari) Wadah Perlakuan 3 (300 mg/tikus/hari) Ulangan 1
Merah Merah Merah Merah
Ulangan 2
Biru Biru Biru Biru
2. Penentuan dosis uji pendahuluan
Dosis yang akan digunakan yaitu 0, 100, 200, dan 300 mg/tikus/hari.
Uji pendahuluan dilakukan agar diketahui pasti apakah dosis yang ditentukan
tersebut sudah cukup berpengaruh terhadap jumlah kelenjar endometrium,
jumlah eritrosit dan lekosit tikus putih betina.
37 10% (ekstrak)
Membuat 50 ml ekstrak cair
10 gram + 40 ml aquadesh = 50 ml ekstrak cair
10.000 mg ekstrak kental = 50 ml ekstrak cair
Berarti :
100 mg = ½ ml ekstrak cair (dalam 100 mg ekstrak kental dilarutkan dengan
aquadesh hingga volume 0,5 ml)
200 mg = 1 ml ekstrak cair (dalam 200 mg ekstrak kental dilarutkan dengan
aquadesh hingga volume 1 ml)
300 mg = 1 ½ ml ekstrak cair (dalam 300 mg ekstrak kental dilarutkan
dengan aquadesh hingga volume 1,5 ml)
D. Variabel Penelitian uji pendahuluan 1. Variabel Bebas uji pendahuluan
Pemberian ekstrak biji pepaya dalam konsentrasi yang bervariasi pada
tiap kelompok perlakuan, kelompok kontrol (tanpa pemberuan ekstrak biji
pepaya), perlakuan 1 (100 mg/tikus/hari), perlakuan 2 (200 mg/tikus/hari),
dan perlakuan 3 (300 mg/tikus/hari).
2. Variabel Tergayut :
Jumlah kelenjar endometrium per satuan lapang pandang pada struktur
penampang melintang uterus dengan perbesaran lensa objektif 10x (dilihat
pada layar monitor), jumlah eritrosit dan lekosit tikus putih (Rattus
38 3. Perlakuan standart :
a. Pakan dan minum untuk tikus selalu tersedia setiap saat
b. Waktu pemberian ekstrak biji pepaya pukul 13:00
c. Jenis tikus galur Wistar
d. Ukuran kandang
E. Hasil Data Uji Pendahuluan
1. Hasil uji pendahuluan Pengaruh Pemberian Ekstrak Biji pepaya Terhadap Jumlah Kelenjar Endometrium
Dilakukannya uji pendahuluan untuk mengetahui konsentrasi yang
tepat untuk digunakan pada saat uji definitif.
Tabel 1. Rata-Rata Jumlah Kelenjar Endometrium Uterus Tikus Putih Betina per satuan lapang pandang dengan perbesaran lensa objektif 10x (dilihat pada layar monitor) Sesudah Pemberian Ekstrak Biji Pepaya
Uterus Ulangan K P1 P2 P3
Kanan Rata-rata 39,5 23,5 24 27,5
Kiri Rata-rata 29,5 15,5 11 23
2. Hasil Uji Pendahuluan Pengaruh Pemberian Ekstrak Biji Pepaya Terhadap Jumlah Eritrosit Dan Lekosit Tikus Putih Betina
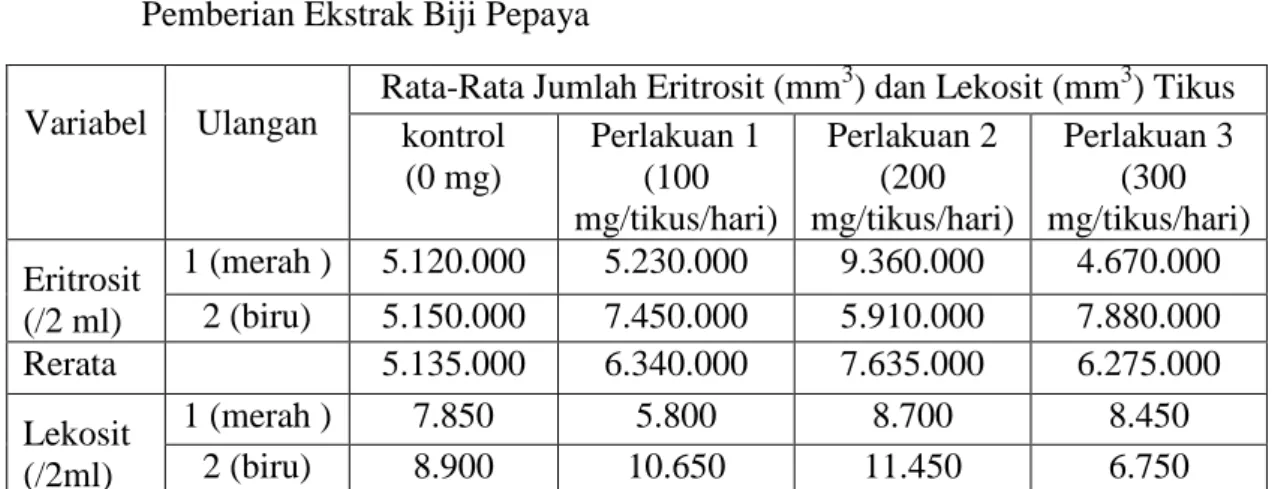
Tabel 2. Rata-Rata Jumlah Eritrosit Dan Lekosit Tikus Putih Betina Sesudah Pemberian Ekstrak Biji Pepaya
Variabel Ulangan
Rata-Rata Jumlah Eritrosit (mm3) dan Lekosit (mm3) Tikus kontrol (0 mg) Perlakuan 1 (100 mg/tikus/hari) Perlakuan 2 (200 mg/tikus/hari) Perlakuan 3 (300 mg/tikus/hari) Eritrosit (/2 ml) 1 (merah ) 5.120.000 5.230.000 9.360.000 4.670.000 2 (biru) 5.150.000 7.450.000 5.910.000 7.880.000 Rerata 5.135.000 6.340.000 7.635.000 6.275.000 Lekosit (/2ml) 1 (merah ) 7.850 5.800 8.700 8.450 2 (biru) 8.900 10.650 11.450 6.750
39
Hasil data uji pendahuluan dari pengaruh ekstrak biji pepaya terhadap
jumlah kelenjar endometrium, jumlah eritrosit dan lekosit tikus putih betina
tidak berpengaruh nyata, dengan hasil signifikasi dari uji Kruskal wallis
jumlah kelenjar endometrium sebelah kanan yaitu 0,238 dan jumlah kelenjar
endometrium sebelah kiri yaitu 0,100 angka ini lebih besar dari taraf uji 0,05.
Artinya Ha ditolak. Hasil uji One Way Anova angka signifikasi jumlah
eritrosit yaitu sebesar 0,640 dan lekosit sebesar 0,696 artinya angka ini juga
lebih besar dari pada taraf uji 0,05. maka dilakukannya pertambahan dosis
untuk uji definitif yaitu sebesar 300, 350, dan 400 mg/ 150 BB tikus/hari.
F. Penempatan Sampel uji definitif
Metode pengambilan sampel yang digunakan yaitu metode acak
lengkap. Mengambil tikus dari kerangjang secara acak sebanyak 5 tikus dan
di letakkan pada kotak/wadah pertama (kontrol) kemudian diberi tanda yaitu
(warna merah , hijau, merah-merah, hijau-hijau, merah-hijau), selanjutnya
40 Ulagan tikus Wadah Kontrol (0 mg) Wadah Perlakuan 1 (100 mg/tikus/hari) Wadah Perlakuan 2 (200 mg/tikus/hari) Wadah Perlakuan 3 (300 mg/tikus/hari) Ulangan 1
Merah Merah Merah Merah
Ulangan 2
Hijau Hijau Hijau Hijau
Ulangan 3
Merah-merah Merah-merah Merah-merah Merah-merah
Ulangan 4
Hijau-hijau Hijau-hijau Hijau-hijau Hijau-hijau
Ulangan 5
Merah-hijau Merah-hijau Merah-hijau Merah-hijau
G. Variabel Penelitian uji definitif 1. Variabel Bebas
Pemberian ekstrak biji pepaya dalam konsentrasi yang bervariasi pada
tiap kelompok perlakuan, kelompok kontrol (tanpa pemberuan ekstrak biji
pepaya), perlakuan 1 (300 mg/tikus/hari), perlakuan 2 (350 mg/tikus/hari),
dan perlakuan 3 (400 mg/tikus/hari).
2. Variabel Tergayut :
Jumlah kelenjar endometrium per satuan lapang pandang pada struktur
penampang melintang uterus dengan perbesaran lensa objektif 10x (dilihat
pada layar monitor), jumlah eritrosit dan lekosit tikus putih (Rattus
norvegicvus) betina (1 ml /tikus/hari). 3. Perlakuan Standart :
a. Pakan dan minum untuk tikus selalu tersedia setiap saat
41 c. Jenis tikus galur Wistar
d. Ukuran kandang
H. Populasi dan Sampel Penelitian 1. Populasi
Tikus putih (Rattus norvegicus) betina galur Wistar yang belum
pernah bunting.
2. Sampel
Sampel dalam penelitian ini adalah 8 ekor tikus untuk uji pendahuluan
pada bulan November 2016, dan 20 ekor untuk uji definitif pada bulan
Januari 2017 tikus putih (Rattus norvegicus) galur Wistar betina usia 8-10
minggu dengan berat 150-250 gram dan belum pernah bunting yang diberi
perlakuan ekstrak biji pepaya. Tikus ini didapatkan / dibeli di (LPPT) UGM.
I. Alat dan Bahan Penelitian 1. Alat yang digunakan
Alat yang digunakan dalam penelitian ini yaitu kandang tikus, tempat
pakan dan minum, alat suntik dan sonde, oven, botol flakon, Timbangan
makro dan mikro, Sarung tangan, kertas label, gunting, gelas benda, cover
glass, mikroskop transmisi, pinset, petri, alat tulis, kuas, bak parafin, cutton
buds, mikroskop, alat bedah, gelas benda, alat pengekstrak, alat-alat pembuatan preparat.
42 2. Bahan yang digunakan
Bahan yang digunakan dalam penelitian ini berupa: alkohol, tikus
putih betina, pakan dan minum tikus, ekstrak biji pepaya, sabun / antiseptik,
aquades, etanol 96%, NaCl, latutan hayem, larutan turk, formalin, methanol,
kloroform, xylol, larutan hematoxylin, larutan eosin, garam fisiologi, gliserin.
J. Prosedur Kerja 1. Tahap Persiapan
a. Menyiapkan tikus putih sebanyak 8 ekor untuk uji pendahuluan dan 20
ekor tikus putih untuk pengambilan data dengan bobot dan umur yang
sama (berat badan rata-rata 150-250 gr dan umur 2 bulan).
b. Menyiapkan kandang tikus sebanyak 4 kandang.
c. Melakukan ektraksi biji pepaya di Farmasi UGM unit II.
d. Menyiapkan ekstrak bij pepaya
2. Pembuatan Ekstrak Biji Pepaya Dengan Teknik Maserasi
Simplisia kering dari biji pepaya dihancurkan, kemudian massa yang
telah halus dimasukkan kedalam maserator dan dituangi dengan etanol 96 %
sampai terdapat selapis cairan penyari di atas simplisia. Proses maserasi yang
dilakukan dengan cara perendaman dibiarkan selama 24 jam. Cairan hasil
ditampung dan sisa ampas simplisia direndam kembali dengan etanol 96%
dan dibiarkan selama 24 jam. Cairan hasil maserasi ditampung kembali dan
dilakukan meserasi kembali pada sisa simplisia hingga didapat tiga cairan
43
menggunakan alat evaporator sehingga di dapat ekstrak kental yang terpisah
dari pelarut etanolnya.
3. Aklimatisasi
a. Menyiapkan sekitar 8 ekor untuk uji pendahuluan dan 20 ekor tikus putih
untuk pegambilan data galur Wistar dengan umur sekitar 2 bulan dan berat
±150-250 gram.
b. Menyiapkan 4 kandang tikus, dan mengambil tikus secara acak sehingga
masing-masing kandang terisi 2 ekor tikus untuk uji pendahuluan dan 5
ekor tikus untuk uji definitif.
c. Pemberian pakan dan minum tikus dilakukan 1 hari sekali.
d. Setiap 3 hari sekali dilakukan pergantian alas dengan mengganti serbuk
gergaji lama dengan yang baru.
e. Proses aklimatisasi dilakukan selama 7 hari di Unit Pengelolaan Hewan
Biologi UNY.
4. Penentuan Dosis
Hasil uji pendahuluan dosis tersebut tidak memberikan pengaruh yang
nyata, maka pada uji definitif dilakukannya penambahan dosis sebesar 300,
350, dan 400 mg/tikus/hari. Hasil pelarutan ekstrak biji pepaya sebagai
berikut:
10.000 mg ekstrak kental = 50 ml ekstrak cair Berarti :
300 mg ekstrak kental = 1,5 ml ekstrak cair 350 mg ekstrak kental = 1,75 ml ekstrak cair 400 mg ekstrak kental = 2 ml ekstrak cair
44 5. Tahap Pelaksanaan
a. Pemberian ekstrak biji pepaya
Ekstrak biji pepaya diberikan secara oral pada tikus perlakuan sesuai
dosisnya masing-masing dan diberikan setiap 1 hari sekali sebelum makan
pada pagi menjelang siang hari selama 21 hari.
b. Pemeliharaan dengan pemberian pakan pellet AD 1 secara rutin.
c. Ulas vagina
dilakukan pada awal sebelum pemberian ekstrak dan setelah selesai
pemeberian ekstrak pada hari ke-22 untuk mengetahui siklus estrusnya. Salah
satu cara untuk mengetahui siklus estrus tikus putih betina dengan cara ulas
vagina, adapun prosedur pembuatan ulas vagina adalah gelas benda
dibersihkan dengan alkohol 70%. Cotton bud dicelupkan ke dalam NaCl
fisiologis, kemudian dimasukkan ke dalam vagina tikus sedalam 1 cm
kemudian diputar secara merata dan perlahan-lahan sehingga diperoleh
jaringan mukosa vagina. Cotton bud yang mengandung mukosa vagina
selanjutnya dioleskan di atas gelas obyek sambil diputar sehingga diperoleh
olesan yang merata. Gelas obyek kemudian dikering anginkan di udara
kemudian difiksasi dengan methanol 70% selama 15 menit. Sediaan dicuci
dengan air mengalir dan dikeringkan pada suhu kamar. Sediaan ulas vagina
kemudian ditetesi dengan cat gymsa selama 5 menit dan dicuci dengan air
mengalir kemudian diamati di bawah mikroskop. Penentuan fase siklus
45
d. Pengamatan jumlah sel darah merah dan putih
pengambilan sel darah dari tikus tersebut dengan meggunakan pipa
hematokrit, di bagian vena orbitalis sebanyak 1 ml, dan meletakkan di atas hemositometer kemudian meneteskan dengan dengan Hayem untuk mengecek jumlah eritrosit dan meneteskan dengan Turk untuk mengecek jumlah lekosit
tikus putih.
1) Penghitungan Jumlah Eritrosit dan Lekosit
Cara penghitungan jumlah eritrosit dan lekosit dengan cara sampling
sebagai berikut (Nurcahyo, 2003: 31,38).
a) Mengambil darah yang ada dalam mikrotube dengan pipet khusus sampai
tanda 0,5 kemudian membersihkan ujung pipet dengan kertas tissue. Hisap
reagent hayem sampai tanda 101 (jangan sampai ada gelembung udara),
kemudian pipet digoyangkan perlahan sampai homogen.
b) Menyiapkan bilik hitung (haemacytometer).
c) Dua tetes pertama larutan darah dalam pipet tersebut dibuang terlebih
dahulu, lalu meneteskan dalam pipet ke haemacytometer yang telah
diletakkan gelas penutup di atasnya lewat tepi sampai merata.
d) Darah yang sudah ada dalam haemacytometer diamati menggunakan
mikroskop dengan perbesaran lensa objektif 100x (dilihat pada layar
monitor).
e) Jumlah sel darah merah yang terhitung dimasukkan dalam rumus sebagai
46 Keterangan:
Angka 10 berasal dari dalamnya pipet 0,1 mm dijadikan 1 mm (10 kali) Angka 5 berasal dari 1/5 dari 1 mm3 (25 kotak)
Angka 200 berasal dari pengenceran 200 kali (0,5 menjadi 101)
Penghitungan sel darah putih, sama halnya dengan langkah kerja pada
penghitungan sel darah merah. Reagent yang digunakan adalah reagent turk
dan pipet khusus yang digunakan bertanda khusus 11. Perhitungan dilakukan
pada 5 kotak besar haemocytometer dan jumlahnya dihitung denganrumus:
Keterangan:
Jumah SDP (a)
Jumlah rata-rata kotak (b)
Angka 20 berasal dari pengenceran 0,5 menjadi 11 (20 kali) Angka 10 berasal dari kedalaman parit 0,1 mm (menjadi 1 mm) Angka 4 berasal dari kotakan (mestinya hanya 1 kamar)
e. Melakukan pembedahan dan pembuatan preparat
Pembedahan dan pembuatan preparat organ uterus yang di dalamnya
mencakup kelenjar endometrium, dan pembuatan preparat eritrosit dan
lekosit.
f. Pembuatan preparat histologi.
Pembedahan dilakukan terhadap tikus pada hari ke 22 pada saat fase
estrus kemudian pengambilan organ uterus, kemudian direndam dalam Jumlah SDM = (SDM yang dihitung x 10 x 5 x 200) mm3
47
formalin 10 %. Pembuatan preparat dilakukan di Fakultas Kedokteran UGM
dengan cara kerja sebagai berikut:
1) Fixation
yang telah dilabeli dimasukkan kedalam fixative, yaitu formalin 10%.
2) Trimming
Triming adalah tahapan yang dilakukan setelah proses fiksasi dengan
melakukan pemotongan tipis jaringan setebal kurang lebih 4 mm.
3) Dehydration (Pengeringan)
Dehidrasi jaringan dimaksudkan untuk mengeluarkan air yang
terkandung dalam jaringan, dengan meggunakan cairan dehidran yaitu
alkohol secara bertingkat dengan waktu yang tertentu yaitu
a) Alkohol 80%, dilakukan 2 jam perendaman
b) Alkohol 96%, dilakukan 2 jam perendaman
c) Alkohol 96%, dilakukan 1 jam perendaman
d) Alkohol absolut, dilakukan 1 jam perendaman
e) Alkohol absolut, dilakukan 1 jam perendaman
f) Alkohol absolut, dilakukan 1 jam perendaman
4) Clearing (Penjernihan)
Proses ini bertujuan untuk menghilangkan alkohol, agar parafin dapat
masuk ke dalam jaringan. Agen penjernihan adalah Xylol dengan cara
bertahap yaitu :
a) Xylol, dilakukan 1 jam perendaman
48 c) Xylol, dilakukan 1 jam perendaman
5) Parafination
Proses infiltrasi dilakukan didalam oven (incubactor) dengan
perbandingan xilol : paraffin = 1:1 selama 120 menit pada suhu 600C.
Pemberian paraffin murni dilakukan selanjutnya pada suhu 600C selama 120
menit kemudian dilanjutkan pemberian paraffin murni pada suhu 600C
selama 120 menit.
6) Embeddingi (Penanaman)
Jaringan berada pada parafin kemudian dilekatkan pada balok kayu
ukuran 3x3 cm atau embedding cassette. Fungsi dari balok kayu atau
embedding cassette adalah untuk pemegang pada saat blok dipotong dengan mikrotom.
7) Sectioning (pemotongan menggunakan mikrotom)
a) Blok parafin yang telah berisi jaringan, diiris menggunakan
scalpelsehingga bagian yang akan diiris dengan pisau mikrotom berbentuk segiempat teratur. Preparat diletak ditengah, kira-kira 3-5
mm dari tepinya.
b) Meletakkan blok parafin pada holder kayu.
c) Memasang holder dengan blok paraffin pada rotary mikrotom yang
direkatkan.
d) Menyiapkan tempat coupes atau pita preparat dan kuas kecil untuk
49
e) Mengatur tebal tipisnya coupes dengan mengatur pada pengaturan di
mikrotom.
f) Memasukkan preparat ke dalam nampan yang berisi air hangat. Hal
tersebut dilakukan agar coupes dapat merentang dan jaringan tidak
melipat.
g) Menempelkan coupes pada gelas benda (pada proses affixing) yang
sebelumnya telah diolesi oleh putih telur atau albumin.
8) Affixing
a) Meletakkan sejumlah coupes (irisan tengah pita preparat) pada kaca
benda yang telah diberi perekat dengan gliserin dan albumin.
b) Memindahkan kaca-kaca gelas benda yang berisi coupes tersebut keatas
hot plate dengan suhu (40-45°C), adanya kelebihan air dihisap dengan menggunakan pipet/kertas saring, dan mengarur letak coupes dengan
parafinnya direntangkan.
9) Pewarnaan menggunakan Hematoxylin-Eosin
a) Mencelupkan kaca benda yang telah ditempeli coupes ke dalam xylol
secara berulang yaitu :
Xylol (I) selama 5 menit Xylol (II) selama 5 menit Xylol (III) selama 5 menit
b) Melakukan dehidrasi berulang yakni:
Alkohol absolut (I) selama 5 menit
50
c) Mencelupkan coupes kedalam aquadest selama 1 menit
d) Mencelupkan kedalam Harris-Hematoxyilin selama 20 menit
e) Mencelupkan coupes kedalam aquadest selama 1 menit
f) Mencelupkan coupes kedalam acid alkohol sebanyak 2-3 celupan
g) Mencelupkan coupes kedalam aquadest selama 1 menit
h) Mencelupkan coupes kedalam aquadest selama 15 menit
i) Kemudian mencelupkan kedalam Eosin selama 2 menit
j) Melakukan dehidrasi berulang lagi yakni:
Alkohol 96% (I) selama 3 menit
Alkohol 96% (I) selama 3 menit
Alkohol absolut (III) selama 3 menit
Alkohol absolut (IV) selama 3 menit
k) Mecelupkan kedalam Xylol yaitu :
Xylol (IV) selama 5 menit Xylol (V) selama 5 menit l) Memounting dengan permount.
g. Pengamatan struktur histologik
Preparat yang telah dibuat di amati dan dihidung dengan cara
sampling dibawah mikroskop per satuan lapang pandang pada struktur
penampang melintang uterus dengan perbesaran objektif 10x (dilihat pada
layar monitor) dan diamati seluruh lapang pandang preparat histologik
kelenjar endometrium, kemudian dibandingkan antara preparat perlakuan dan
51 K. Metode Pengumpulan Data
Metode ini dilakukan dengan memberi perlakuan konsentrasi ekstrak
biji pepaya (0, 300, 350, dan 400 mg/tikus/hari) untuk uji definitif, setelah
dilakukannya uji pendahuluan, yang diberikan dengan cara dicekokkan pada
hewan uji coba, untuk melihat jumlah kelenjar endometrium yang ada pada
struktur struktur histologik endometrium tikus putih (Rattus norvegicus)
betina per satuan lapang pandang pada struktur penampang melintang uterus
dengan perbesaran lensa objektif 10x (dilihat pada layar monitor), yang
belum pernah bunting, juga untuk melihat jumlah sel eritrosit dan lekosit
tikus putih (Rattus norvegicus) betina yang belum pernah bunting. Penelitian
diakhiri setelah hari ke 22, setelah semua tikus telah mengalami fase estrus.
Tikus dimatikan dengan cara dimasukkan ke dalam killing bottle, kemudian
diambil darahnya melalui mata tikus (vena orbitalis) dengan pipa hematokrit
kemudian tikus dibedah dan diambil organ uterusnya untuk dibuat preparat
histologi. Preparat organ uterus, dan preparat eritrosi dan lekosit diamati
menggunakan mikroskop untuk mengetahui akibat pengaruh pemberian
ekstrak biji pepaya terhadap jumlah kelenjar endometrium per satuan lapang
pandang pada struktur penampang melintang uterus dengan perbesaran lensa
objektif 10x (dilihat pada layar monitor), jumlah eritrosit dan lekosit tikus
putih (Rattus norvegicus) betina kemudian dilakukan analisis terhadap hasil
52 L. Desain Penelitian
Desain pada penelitian ini merupakan eksperimen satu faktor pola
acak lengkap. Jenis data dari hasil penelitian ini merupakan eksperimen.
M. Teknik Analisis Data
Data yang diperoleh merupakan data kuantitatif dari hasil pengamatan
dan penghitungan jumlah kelenjar endometrium per satuan lapang pandang
pada struktur penampang melintang uterus dengan perbesaran lensa objektif
10x (dilihat pada layar monitor), jumlah eritrosit dan lekosit tikus putih yang
telah diberi perlakuan, yaitu pemberian ekstrak biji pepaya. Analisis data
menggunakan program SPSS 16 dengan analisis nonparametrik
Kruskal-Wallis untuk mengetahui ada tidaknya pengaruh pemeberian ekstrak biji pepaya terhadap jumlah kelenjar endometrium tikus putih tikus putih. dan
Data jumlah eritrosit dan lekosit pada tikus putih dianalisis menggunakan
analisis kontrol One Way Anova dengan taraf signifikan p<0,05. Analisis
tersebut dilakukan untuk mengetahui ada tidaknya pengaruh ekstrak biji
pepaya terhadap jumlah eritrosit dan lekosit tikus putih betina. Apabila hasil
berpengaruh yang nyata, dilanjutkan dengan uji Duncan’s Multiple Range
Test (DMRT) untuk membandingkan antara kelompok kontrol dengan masing-masing perlakuan, bila tidak maka tidak dilanjutkan uji Duncan’s