PENGENDALIAN BIOFILM Aeromonas hydrophila PADA
PERMUKAAN SISIK IKAN DAN PLASTIK PVC DENGAN
SENYAWA ANTIMIKROBA BAKTERI ASAM LAKTAT
PERAIRAN TAWAR
TESIS
Oleh
DIANNITA HARAHAP
097030010/BIO
PROGRAM PASCASARJANAFAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
M E D A N
2 0 1 3
PENGENDALIAN BIOFILM Aeromonas hydrophila PADA PERMUKAAN SISIK IKAN DAN PLASTIK PVC DENGAN SENYAWA ANTIMIKROBA
BAKTERI ASAM LAKTAT PERAIRAN TAWAR
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh gelar
Magister Sains dalam Program Studi Magister pada Program
Pascasarjana Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Oleh
DIANNITA HARAHAP 097030010/BIO
PROGRAM PASCASARJANA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
M E D A N 2 0 1 3
PENGESAHAN TESIS
Judul Tesis : PENGENDALIAN BIOFILM Aeromonas
hydrophila PADA PERMUKAAN SISIK IKAN
DAN PLASTIK PVC DENGAN SENYAWA ANTIMIKROBA BAKTERI ASAM LAKTAT PERAIRAN TAWAR
Nama Mahasiswa : DIANNITA HARAHAP
Nomor Induk Mahasiswa : 097030010
Program Studi : Magister Biologi
Fakultas : Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Menyetujui
Pembimbing I Pembimbing II
Dr. It Jamilah, M.Sc Dr. Ir. Herla Rusmarilin,
MS. NIP.19631012 199103 1 001 NIP.131420019
Ketua Program Studi, Dekan,
Prof. Dr. Syafruddin Ilyas, M.Biomed Dr. Sutarman, M.Sc
PERNYATAAN ORISINILITAS
PENGENDALIAN BIOFILM Aeromonas hydrophila PADA PERMUKAAN SISIK IKAN DAN PLASTIK PVC DENGAN SENYAWA ANTIMIKROBA
BAKTERI ASAM LAKTAT PERAIRAN TAWAR
TESIS
Dengan ini saya nyatakan bahwa saya mengakui semua karya tesis ini adalah hasil kerja saya sendiri kecuali kutipan dan ringkasan yang tiap satunya telah di
jelaskan sumber nya dengan benar.
Medan, 24 Agustus 2013 Diannita Harahap
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH
UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademika Universitas Sumatera Utara, saya yang bertanda tangan di bawah ini :
Nama : Diannita Harahap
NIM : 097030010
Program Studi : Magister Biologi Jenis Karya Ilmiah : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-Eksklusif (Non-Exclusive
Royalty Free Right) atas Tesis saya yang berjudul :
Pengendalian Biofilm Aeromonas hydrophila Pada Permukaan Sisik Ikan dan Plastik PVC Dengan Senyawa Antimikroba Bakteri Asam Laktat Perairan
Tawar
Beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Non-Eksklusif ini, Universitas Sumatera Utara berhak menyimpan, mengalih data, menformat, mengelola dalam bentuk data-base, merawat dan mempublikasikan Tesis saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan sebagai pemegang dan atau sebagai pemilik hak cipta.
Demikian pernyataan ini dibuat dengan sebenarnya.
Medan, 24 Agustus 2013
Diannita Harahap 097030010
Telah diuji pada
Tanggal : 24 Agustus 2013
PANITIA PENGUJI TESIS
Ketua : Dr. It Jamilah, M.Sc
Anggota : 1. Dr. Herla Rusmarilin, MP 2. Prof. Dr. Erman Munir, M.Sc 3. Prof. Dr. Dwi Suryanto, M.Sc
DAFTAR RIWAYAT HIDUP
DATA PRIBADI
Nama lengkap berikut gelar : Diannita Harahap, S.Pd, M.Si Tempat dan Tanggal Lahir : Jayapura, 22 Maret 1987 Agama : Islam
Nama Ayah : Dian Bahri Harahap Nama Ibu : Hesti Yulianti
Nama Adik : Dian Nirwana Harahap, S.Pd, M.Si Rio Ferdiani Harahap, S. Pd Ricky Harahap
Alamat : Jl. Lapangan Golf Asrama Kodam I/BB Blok Anggrek H-12 Tuntungan, Kabupaten Deli Serdang, Sumatera Utara 20353 e-mail : diannitaharahap@yahoo.com
RIWAYAT PENDIDIKAN
SD : SD Negeri Girirejo Magelang, Jawa Tengah tamat tahun 1998 SMP : SLTP Negeri 9 Medan tamat tahun 2001
SMA : SMU Kartika I-2 Medan tamat tahun 2004
Strata-1 : FMIPA Pendidikan Biologi UNIMED Sumatera Utara tamat tahun 2009 Strata-2 : FMIPA Biologi USU Medan tamat tahun 2013
KATA PENGANTAR
Bismillahirrahmanirrahim,
Puji Syukur yang tak terhingga penulis ucapkan dengan segala kerendahan hati dan diri kepada Allah SWT, Sang Khaliq yang senantiasa mencurahkan segala nikmat Iman, Islam dan Ihsan, serta Shalawat dan salam kepada Rasulullah Muhammad SAW sehingga penulis mampu menyelesaikan penelitian hingga selesainya penulisan tesis dengan baik. Tesis ini berjudul “PENGENDALIAN BIOFILM Aeromonas hydrophila PADA PERMUKAAN SISIK IKAN DAN PLASTIK PVC DENGAN SENYAWA ANTIMIKROBA BAKTERI ASAM LAKTAT PERAIRAN TAWAR”. Tesis ini merupakan salah satu syarat untuk memperoleh gelar Magister Sains (M.Si) Fakultas Matematika dan Ilmu Pengetahuan Alam Universias Sumatera Utara Medan.
Keberhasilan dari penelitian dan penulisan tesis ini tidak terlepas dari bantuan berbagai pihak yang terlibat secara langsung maupun tidak langsung dan telah memberikan dukungan baik secara moril maupun materil. Pada kesempatan ini penulis ingin menyampaikan terima kasih yang tidak terhingga kepada :
Bapak Prof. Dr. Syafruddin Ilyas, M. Biomed selaku Ketua Program Studi Pascasarjana Biologi dan Ibu Dr. Suci Rahayu, M.Si selaku Wakil Program Studi Pascasarjana Biologi beserta seluruh staf atas segala bantuan dan kemudahan yang telah diberikan selama pendidikan.
Ibu Dr. It Jamilah, M.Sc selaku dosen pembimbing I dan Ibu Dr. Herla Rusmarilin, M.S, selaku dosen pembimbing II yang telah dengan sabar meluangkan waktu, tenaga, dan pikirannya serta memberikan masukan, saran, dan petunjuk kepada penulis dalam melakukan penelitian dan penyusunan tesis ini.
Bapak Prof. Dr. Erman Munir, M.Sc dan Bapak Prof. Dwi Suryanto, M.Sc selaku komisi penguji dalam memberikan koreksi, masukan serta saran selama penyususunan tesis ini.
Ibu Tuti Sumiati, S.Pi selaku peneliti Balai Riset Perikanan Budi Daya Air Tawar, Bogor atas kontribusi, diskusi serta masukannya mengenai permasalahan perikanan budi daya air tawar.
Kepala laboratorium Mikrobiologi FMIPA USU, laboratorium Mikrobiologi PTKI beserta staf yang atas segala bantuan dan kemudahan yang telah diberikan selama penelitian.
Ayahanda Kapten Dian Bahri Harahap dan Ibunda Hesti Yulianti yang selalu memberikan dukungan baik moril dan materil sehingga tugas akhir ini dapat terlaksana dengan baik.
Kak Hendro Prayogi atas motivasi besar yang diberikan selama menyelesaikan tesis ini. Sahabat seperjuangan tim penelitian yang selalu mengerti, membantu, dan berbagi dalam suka dan duka, Dewi Rulia Br. Sitepu, M.Si, Ulfayani Mayasari, M.Si dan Deswidya Hutauruk, S.Pd.
Adik-adik asisten laboratorium Mikrobiologi Ria Umeda, Mirza, Imam Aulia, Nur Fadila, Aan serta seluruh saudara dan teman-teman yang selalu mendoakan yang terbaik kepada penulis yang tidak dapat disebutkan satu persatu, yang telah dengan sabar mendengarkan segala keluh kesah dan memberikan masukannya kepada penulis.
Penulis menyadari bahwa tesis ini masih banyak kekurangan. Oleh karena itu, kritik dan saran yang membangun dari pihak pembaca sangat diharapkan demi kesempurnaan tesis ini. Akhir kata semoga tesis ini bermanfaat bagi penelitian dan kemajuan ilmu pengetahuan untuk masa yang akan datang.
Medan, 24 Agustus 2013 Diannita Harahap
PENGENDALIAN BIOFILM Aeromonas hydrophila PADA PERMUKAAN SISIK IKAN DAN PLASTIK PVC DENGAN SENYAWA ANTIMIKROBA
BAKTERI ASAM LAKTAT PERAIRAN TAWAR
ABSTRAK
Wabah penyakit bakteri berdampak terhadap penurunan mutu ikan segar dan penyebab kematian berbagai jenis ikan tawar pada sistem akuakultur. A.
hydrophila ditemukan pada perairan tawar dalam bentuk biofilm sebagai
penyebab motil aeromonas septicemia (MAS). Penelitian ini bertujuan untuk mengendalikan biofilm A. hydrophila dengan memanfaatkan senyawa antimikroba bakteri asam laktat (BAL) yang diisolasi dari usus ikan Nila Sumatera Utara. Isolasi BAL dari usus ikan Nila (Oreochromis niloticus) dilakukan menggunakan media selektif deMan Rogosa Sharpe Agar (MRSA). Seleksi untuk memperoleh kandidat probiotik dilakukan terhadap 21 isolat dengan uji antagonis terhadap A. hydrophila dengan metode difusi cakram. Isolat potensial dengan diameter zona hambat terbesar adalah isolat US6 yaitu 13,3 mm.
A. hydrophila membentuk biofilm dengan jumlah sel tertinggi pada permukaan
sisik ikan sebesar 10 log CFU/lempeng dan pada plastik PVC (Polyvinyl
Chloride) 8 log CFU/lempeng pada hari kelima. Pengendalian biofilm dilakukan
dengan senyawa antimikroba ekstrak kasar isolat US6 selama 1 jam. Sel yang menempel dilepas dengan 0,5 g glass beads. Pengurangan jumlah sel pada lempeng sisik ikan sebesar 4 log CFU/lempeng dan pada plastik PVC 2 log CFU/lempeng. Ketahanan senyawa antimikroba diujikan terhadap berbagai pH, suhu dan surfaktan. Kondisi asam dan basa divariasikan pada pH 2, 4, 6, 8 dan 10. Senyawa antimikroba aktif pada kondisi pH 2 hingga pH 10 serta aktif hingga suhu 80 o
Kata kunci : Biofilm, A. hydrophila, sisik dan plastik PVC, bakteri asam laktat
C. Penambahan EDTA dan Tween 80 mempengaruhi aktivitas senyawa antimikroba dan diperoleh zona sebesar masing-masing sebesar 3 mm dan 5 mm. Senyawa antimikroba BAL isolat US6 menghambat pertumbuhan sel biofilm A.
CONTROLLING BIOFILM OF Aeromonas hydrophila ON FISH SCALES AND PLASTICS PVC SURFACES WITH ANTIMICROBIAL
COMPOUNDS LACTIC ACID BACTERIA FROM FRESHWATER
ABSTRACT
Outbreaks of bacterial diseases could affect on degradation of freshwater fish and cause of death of many species of freshwater fish in aquaculture systems. A.
hydrophila found in freshwater in the form of biofilms and cause of Motile Aeromonas Septicemia (MAS). To overcome of this pathogens attack, a possible
attack effective way to make use of lactic acid bacteria (LAB) as a probiotic agent. Controlling biofilm A. hydrophila has been done starting with LAB isolation in waters, the selection of potential isolates in inhibiting biofilm cells of
A. hydrophila and the control of on fish scales and plastic PVC using a crude
extract of LAB antimicrobial compounds. LAB was isolated from intestinal Nile Tilapia (Oreochromis niloticus) using selective media deMan Rogosa Sharpe
Agar (MRSA). Selection of potential LAB as candidate probiotics was conducted
from antagonistic test against A. hydrophila. Isolate US6 was found as potensial biocontrol agent which should the highest inhibition zone of 13.3 mm. Biofilm with the highest number of cells on the surface of the fish scales by 10 log CFU/chip and the plastic PVC (Polyvinyl Chloride) 8 log CFU/chip on the fifth day. Controlling biofilms was perform had been done with antimicrobial compounds in crude extract US6 isolate for 1 hour contact time. Cells were removed with 0.5 g of glass beads. Reduction in the number of cells on the plate of fish scales by 4 log CFU/chip and the plastic PVC 2 log CFU/chip. Characterization of antimicrobial compounds was tested to by its resistance to pH, temperature and surfactants. Antimicrobial compound was active as pH range of 2 to 10 and actives in temperature 80 oC. The addition of EDTA and Tween 80 that showed by activity in inhibiting clear zone 3 mm and 5 mm. It could be concluded that the antimicrobial compound of lactic acid bacteria inhibits biofilm
A. hydrophila on fish scales and PVC plastic.
Keywords:Biofilm, A. hydrophila, fish scales and plastics PVC, lactic acid bacteria
DAFTAR ISI
Halaman KATA PENGANTAR i ABSTRAK iii ABSTRACT iv DAFTAR ISI vDAFTAR TABEL vii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN ix BAB I PENDAHULUAN 1 1.1 Latar Belakang 1 1.2 Rumusan Masalah 3 1.3 Tujuan Penelitian 3 1.4 Manfaat Penelitian 4
BAB II TINJAUAN PUSTAKA 5
2.1 Bakteri Asam Laktat (BAL) sebagai 5 Probiotik Perairan Tawar
2.2 Senyawa Antimikroba Bakteri Asam Laktat 7
2.3 Biofilm Bakteri 9
2.4 Motil Aeromonas Septicemia (MAS) 12
2.5 Pengendalian Biofilm Bakteri 14
BAB III METODOLOGI PENELITIAN 16
3.1. Waktu dan Lokasi 16
3.2. Bahan dan Alat 16
3.3. Rancangan Percobaan 17
3.4. Isolasi Bakteri Asam Laktat 17
3.5. Seleksi Bakteri Asam Laktat Potensial 17 3.6. Identifikasi Bakteri Asam Laktat Potensial 18
3.6.1 Pengamatan Morfologi 18
3.6.2. Uji Katalase 18
3.7. Pertumbuhan Isolat Bakteri Asam Laktat 19 3.8. Pembentukan Biofilm A. hydrophila 19 3.9. Produksi Senyawa Antimikroba 20 3.10. Pengendalian Biofilm A. hydrophila 20
3.11. Pengaruh pH, Suhu dan Surfaktan Terhadap Aktivitas 21 senyawa antimikroba
3.11.1.Pengaruh pH 21 3.11.2 Pengaruh Suhu 21
3.11.3 Pengaruh Surfaktan 21
BAB IV HASIL DAN PEMBAHASAN 23 BAB V KESIMPULAN DAN SARAN 41 DAFTAR PUSTAKA 42 LAMPIRAN L-1
DAFTAR TABEL
Halaman
Tabel 1 Kerusakan organ dan gejala yang ditimbulkan 13 akibat serangan patogen primer A. hydrophyla
Tabel 2 Pengamatan karakteristik bakteri asam laktat 23 sumber isolasi usus ikan (US), air kolam (AK)
dan sedimen kolam (EK)
Tabel 3 Rata-rata zona hambat isolat BAL terhadap media 24 MHA pada suhu 28 o
Tabel 4 Hasil uji produksi asam dari berbagai karbohidrat 29 C dan waktu inkubasi 48 jam
Tabel 5 Rata-rata jumlah sel biofilm A. hydrophila pada 31 lempeng sisik ikan dan plastik PVC pada media NB selama waktu inkubasi 1, 3 dan 5 hari pada kepadatan sel awal 108
Tabel 6 Rata-rata jumlah sel biofilm A. hydrophila 34 sebelum dan setelah kontak 1 jam dengan senyawa
antimikroba ektrak kasar isolat BAL US6 CFU/mL
Tabel 7 Rata-rata zona hambat senyawa antimikroba 35 ekstrak kasar BAL US6 terhadap A. hydrophila
dengan variasi pH pada suhu inkubasi 28 o
Tabel 8. Rata-rata zona hambat senyawa antimikroba 37 ekstrak kasar BAL US6 dengan beberapa variasi suhu selama 15 menit terhadap A. hydrophila
C selama 48 jam pada media MHA
Tabel 9. Rata-rata zona hambat senyawa antimikroba 39 ekstrak kasar BAL US6 terhadap A. hydrophila
dengan surfaktan pada suhu inkubasi 28 oC selama 48 jam pada media MHA
DAFTAR GAMBAR
Halaman Gambar 1 Infeksi A. hydrophila pada ikan Nila merah 14
Gambar 2 Zona hambat isolat BAL terhadap A. hydrophila 26 kategori baik hingga kuat
Gambar 3 Pewarnaan Gram isolat US6 BAL 27
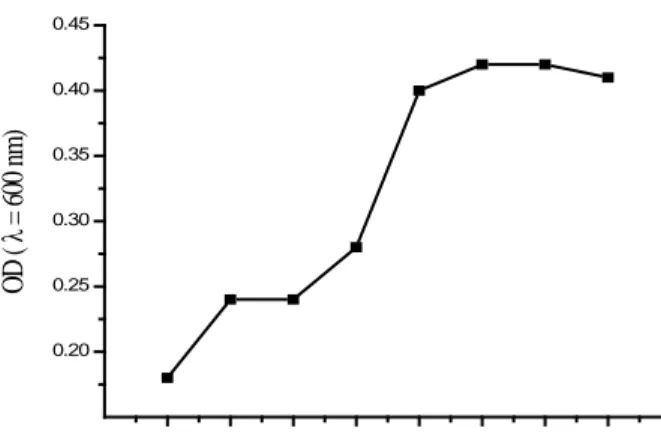
Gambar 4 Grafik pertumbuhan isolat potensial BAL 30
US6 pada media Nutrient Broth (NB) pada suhu 28 oC selama 24 jam dengan panjang gelombang 600 nm.
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Bagan Alir Penelitian L-1
Lampiran 2 Alur kerja Isolasi Bakteri Asam Laktat L-2
Lampiran 3 Alur Kerja Seleksi BAL Potensial Terhadap L-3
A. Hydrophila
Lampiran 4 Alur Kerja Identifikasi Bakteri Asam Laktat L-4 dari Usus Ikan Air Tawar
Lampiran 5 Alur Kerja Pertumbuhan BAL Potensial L-5
Lampiran 6 Pembentukan Sel Biofilm A. hydrophila L-6 pada Permukaan Sisik dan Plastik PVC
Lampiran 7 Alur kerja Produksi Senyawa antimikroba L-7 ekstrak kasar BAL
Lampiran 8 Pengendalian Biofilm A. hydrophila L-8
Lampiran 9 Karakterisasi Pengaruh pH L-9
Lampiran 10 Karakterisasi Pengaruh Suhu L-10
Lampiran 11 Karakterisasi Surfaktan L-11
PENGENDALIAN BIOFILM Aeromonas hydrophila PADA PERMUKAAN SISIK IKAN DAN PLASTIK PVC DENGAN SENYAWA ANTIMIKROBA
BAKTERI ASAM LAKTAT PERAIRAN TAWAR
ABSTRAK
Wabah penyakit bakteri berdampak terhadap penurunan mutu ikan segar dan penyebab kematian berbagai jenis ikan tawar pada sistem akuakultur. A.
hydrophila ditemukan pada perairan tawar dalam bentuk biofilm sebagai
penyebab motil aeromonas septicemia (MAS). Penelitian ini bertujuan untuk mengendalikan biofilm A. hydrophila dengan memanfaatkan senyawa antimikroba bakteri asam laktat (BAL) yang diisolasi dari usus ikan Nila Sumatera Utara. Isolasi BAL dari usus ikan Nila (Oreochromis niloticus) dilakukan menggunakan media selektif deMan Rogosa Sharpe Agar (MRSA). Seleksi untuk memperoleh kandidat probiotik dilakukan terhadap 21 isolat dengan uji antagonis terhadap A. hydrophila dengan metode difusi cakram. Isolat potensial dengan diameter zona hambat terbesar adalah isolat US6 yaitu 13,3 mm.
A. hydrophila membentuk biofilm dengan jumlah sel tertinggi pada permukaan
sisik ikan sebesar 10 log CFU/lempeng dan pada plastik PVC (Polyvinyl
Chloride) 8 log CFU/lempeng pada hari kelima. Pengendalian biofilm dilakukan
dengan senyawa antimikroba ekstrak kasar isolat US6 selama 1 jam. Sel yang menempel dilepas dengan 0,5 g glass beads. Pengurangan jumlah sel pada lempeng sisik ikan sebesar 4 log CFU/lempeng dan pada plastik PVC 2 log CFU/lempeng. Ketahanan senyawa antimikroba diujikan terhadap berbagai pH, suhu dan surfaktan. Kondisi asam dan basa divariasikan pada pH 2, 4, 6, 8 dan 10. Senyawa antimikroba aktif pada kondisi pH 2 hingga pH 10 serta aktif hingga suhu 80 o
Kata kunci : Biofilm, A. hydrophila, sisik dan plastik PVC, bakteri asam laktat
C. Penambahan EDTA dan Tween 80 mempengaruhi aktivitas senyawa antimikroba dan diperoleh zona sebesar masing-masing sebesar 3 mm dan 5 mm. Senyawa antimikroba BAL isolat US6 menghambat pertumbuhan sel biofilm A.
CONTROLLING BIOFILM OF Aeromonas hydrophila ON FISH SCALES AND PLASTICS PVC SURFACES WITH ANTIMICROBIAL
COMPOUNDS LACTIC ACID BACTERIA FROM FRESHWATER
ABSTRACT
Outbreaks of bacterial diseases could affect on degradation of freshwater fish and cause of death of many species of freshwater fish in aquaculture systems. A.
hydrophila found in freshwater in the form of biofilms and cause of Motile Aeromonas Septicemia (MAS). To overcome of this pathogens attack, a possible
attack effective way to make use of lactic acid bacteria (LAB) as a probiotic agent. Controlling biofilm A. hydrophila has been done starting with LAB isolation in waters, the selection of potential isolates in inhibiting biofilm cells of
A. hydrophila and the control of on fish scales and plastic PVC using a crude
extract of LAB antimicrobial compounds. LAB was isolated from intestinal Nile Tilapia (Oreochromis niloticus) using selective media deMan Rogosa Sharpe
Agar (MRSA). Selection of potential LAB as candidate probiotics was conducted
from antagonistic test against A. hydrophila. Isolate US6 was found as potensial biocontrol agent which should the highest inhibition zone of 13.3 mm. Biofilm with the highest number of cells on the surface of the fish scales by 10 log CFU/chip and the plastic PVC (Polyvinyl Chloride) 8 log CFU/chip on the fifth day. Controlling biofilms was perform had been done with antimicrobial compounds in crude extract US6 isolate for 1 hour contact time. Cells were removed with 0.5 g of glass beads. Reduction in the number of cells on the plate of fish scales by 4 log CFU/chip and the plastic PVC 2 log CFU/chip. Characterization of antimicrobial compounds was tested to by its resistance to pH, temperature and surfactants. Antimicrobial compound was active as pH range of 2 to 10 and actives in temperature 80 oC. The addition of EDTA and Tween 80 that showed by activity in inhibiting clear zone 3 mm and 5 mm. It could be concluded that the antimicrobial compound of lactic acid bacteria inhibits biofilm
A. hydrophila on fish scales and PVC plastic.
Keywords:Biofilm, A. hydrophila, fish scales and plastics PVC, lactic acid bacteria
BAB I PENDAHULUAN
1.1 Latar Belakang
Penyakit ikan akibat serangan bakteri merupakan salah satu permasalahan serius karena dapat menimbulkan kerugian yang tidak sedikit bagi para pembudi daya ikan. Aeromonas hydrophila merupakan patogen yang banyak menyerang jenis ikan air tawar dari segala tingkatan umur (Hatmanti et al. 2009). Pada tahun 1980-an terjadi wabah penyakit bakteri pada ikan air tawar yang menyerang beberapa jenis ikan seperti lele, mas, gurame dan gabus. Wabah tersebut bermula menyerang perikanan budi daya di daerah Jawa Barat dan akhirnya meluas ke seluruh wilayah Indonesia dengan tingkat kerugian diperkirakan mencapai ratusan juta rupiah pada masa itu. Hasil studi epidemiologi menyimpulkan bahwa A.
hydrophila merupakan patogen yang paling bertanggung jawab atas hal tersebut
(BPS Kementrian Kelautan dan Perikanan, 2012). Menurut Afrianto dan Liviawaty (1992) bakteri Aeromonas sp. menyerang ikan melalui kontak badan atau melalui air yang sudah tercemar. Bakteri ini menyerang hampir semua jenis ikan air tawar dan bersifat septicaemia (infeksi mengikuti peredaran darah). Pada kondisi kualitas air yang buruk infeksi dapat bersifat akut dalam hitungan hari dengan kematian mencapai 100 %.
Mikroorganisme tersebar pada sistem akuakultur dengan dua pola hidup yaitu secara planktonik yang merupakan sel melayang bebas pada lingkungan air serta sel biofilm yang menempel pada permukaan padat (Flemming, 2008). Bakteri pada lingkungan akuakultur menempel pada permukaan padat biotik maupun abiotik. Saat ini telah diketahui bahwa sebanyak 99% bakteri hidup dalam bentuk biofilm, sisanya sebanyak 1% hidup secara plankton serta sebesar 65% mikroba menginfeksi inangnya diperkirakan terlebih dahulu membentuk biofilm (Mah and O’Toole, 2001; Pamp et al. 2009).
Studi biofilm telah dilakukan mencakup berbagai aspek seperti penempelan pada permukaan padat, struktur matriks ekstrapolimernya dan bermacam-macam produk metabolit yang memungkinkan terjadinya komunikasi interseluler pada sel biofilm (Donlan, 2002). Kemampuan menempelnya sel biofilm pada berbagai permukaan padat telah dipelajari sebelumnya pada bahan kaca, karet, plastik (Mafu et al. 1990, Yu and McFeters, 1994). Peluang biofilm bakteri terbentuk pada tubuh ikan sebagai inang, ketersediaan nutrisi biotik pada tubuh ikan memicu pertumbuhan biofilm. Sisik dan kulit merupakan perlindungan fisik yang memproteksi ikan dari kemungkinan luka dan penting peranannya dalam mengendalikan osmolaritas tubuh (Irianto, 2004).
A. hydrophila adalah salah satu bakteri patogen yang telah diketahui
mampu membentuk biofilm pada permukaan padat stainless steel. Bal’a et al. (1998) menemukan bahwa kultur tunggal A. hydrophila mampu membentuk biofilm 3,5 log CFU/cm2 dalam waktu inkubasi 4 jam pada lempengan stainless
steel. Bakteri ini juga telah diketahui mampu membentuk biofilm pada permukaan
kaca selama 10 hari pada kisaran 107-108 CFU/cm2
Bakteri Asam Laktat (BAL) merupakan salah satu agen probiotik yang dapat mengendalikan pertumbuhan bakteri patogen. Berdasarkan penelitian terdahulu telah dilakukan isolasi senyawa antimikroba plantarisin 35d dari
Lactobacillus plantarum (Messi et al. 2001) dan bakteriosin ST151BR dari L. pentosus ST151BR (Torodov and Dicks, 2004) yang terbukti memiliki efek
penghambatan terhadap A. hydrophila. Demikian juga bakteriosin yang dihasilkan
L. paracasei subsp. paracasei diketahui efektif menghambat Escherichia coli
(Caridi, 2002). Bakteriosin yang dihasilkan oleh BAL memiliki spektrum penghambatan yang luas dalam menekan pertumbuhan patogen Gram positif maupun Gram negatif. Bakteriosin thermophylin yang dihasilkan Streptococcus
thermophilus efektif menghambat E. coli, Yersinia pseudotuberculosis dan Y. enterocolitic yang tergolong bakteri Gram negatif serta menghambat Bacillus sp.,
Listeria monocytogenes dan Salmonella typhimurium yang tergolong bakteri
Gram positif (Ivanova et al. 1998).
Belum ditemukan informasi mengenai kemampuan senyawa antimikroba BAL dalam menghambat pertumbuhan biofilm A. hydrophila, sehingga pada penelitian ini diharapkan memperoleh isolat BAL unggulan Sumatera Utara dalam mengatasi permasalahan biofilm pada budi daya akuakultur.
1.2 Rumusan Permasalahan
Rumusan masalah dalam penelitian ini ialah:
1. Apakah terdapat isolat BAL perairan tawar yang potensial dalam menghambat patogen A. hydrophila ?
2. Apakah isolat A. hydrophila mampu membentuk biofilm pada permukaan sisik ikan dan plastik PVC ?
3. Apakah senyawa antimikroba ekstrak kasar BAL mampu mengendalikan biofilm A. hydrophila pada permukaan sisik ikan dan plastik PVC ?
1.3 Tujuan Penelitian
Tujuan yang akan dicapai pada penelitian ini antara lain :
1. Isolasi dan identifikasi BAL perairan tawar yang potensial dalam menghambat A. hydrophila.
2. Mengetahui kemampuan A. hydrophila membentuk biofilm pada permukaan sisik ikan dan plastik PVC.
3. Mengetahui kemampuan senyawa antimikroba ekstrak kasar BAL dalam mengendalikan biofilm A. hydrophila.
4. Mengetahui karakter senyawa antimikroba BAL terhadap rentang pH dan surfaktan.
1.4 Manfaat Penelitian
Melalui penelitian ini didapatkan isolat potensial BAL perairan tawar yang memiliki kemampuan mengendalikan biofilm bakteri A. hydrophila pada permukaan sisik ikan dan plastik PVC. Penelitian ini juga bermanfaat bagi masyarakat sebagai informasi dalam upaya mengendalikan biofilm A. hydrophila pada berbagai permukaan padat dengan memanfaatkan potensi aktivitas antimikroba bakteri asam laktat sebagai alternatif pemecahan masalah serangan patogen pada perikanan perairan tawar.
BAB II
TINJAUAN PUSTAKA
2.1 Bakteri Asam Laktat (BAL) Sebagai Probiotik Perairan Tawar
Bakteri asam laktat (BAL) adalah sejumlah bakteri Gram positif, tidak membentuk spora, memproduksi asam laktat sebagai hasil akhir fermentasi glukosa. Bakteri asam laktat bersifat katalase negatif. Fermentasi glukosa dibedakan dalam dua jalur utama yaitu glikolisis (Embden-Meyer Pathway) yang menghasilkan produk akhir asam laktat secara keseluruhan dikategorikan dalam jenis homofermentatif dan jalur 6-phosphogluconat/ phosphoketolase yang juga menghasilkan sejumlah besar produk akhir lainnya, seperti etanol, asam asetat dan CO2. Genus Leuconostoc dan beberapa spesies anggota genus Lactobacillus
dikategorikan dalam jenis heterofermentatif obligat (Caplice and Fitzgerald 1999), bakteri genus ini mendegradasi heksosa menjadi asam laktat dan produk sampingan lainnya seperti asam asetat, etanol, CO2, H2O2 dan bakteriosin serta
mendegradasi pentosa menjadi asam laktat dan asam asetat (Lyhs et al. 2002).
Aplikasi BAL sebagai probiotik perairan tawar menjadi salah satu cara yang efektif dalam pemecahan masalah penyakit pada ikan di perairan tawar. BAL dikatakan agen probiotik dengan beberapa kriteria diantaranya: 1) bersifat antagonis terhadap patogen, 2) Pelekatan atau lokasi hidup dari bakteri merupakan salah satu yang terpenting dalam kriteria seleksi bakteri probiotik karena hal ini termasuk dalam prasyarat pembentukan suatu koloni (Verschuere et al. 2000), 3) Probiotik dari habitat aslinya memiliki peluang hidup dan tumbuh yang lebih besar dibandingkan kompetitor asing dari luar sistem (Rengpipat et al. 2003).
Beberapa spesies BAL telah diketahui kemampuannya sebagai agen probiotik perairan tawar. Beberapa diantaranya seperti L. rhamnosus dan L.
2001). Carnobacterium sp. diketahui sebagai probiotik yang memperbaiki sistem imun tubuh ikan (Panigrahi et al. 2005). Kemudian perlekatan Lactococcus lactis pada usus diteliti memiliki efek antagonis terhadap bakteri patogen (Villamil et al. 2002). Pediococcus acidilactici sebagai probiotik ikan rainbow trout (Oncorhynchus mykiss) (Aubin et al. 2005), Streptococcus faecium sebagai
probiotik ikan mas (Bogut et al. 1998), Enterococcus faecium untuk ikan lele (Bogut et al. 2000), serta konsorsium S. faecium dan L. acidophilus untuk ikan Nila (Lara-Flores et al. 2003).
BAL memproduksi substansi antimikroba yang dapat menekan pertumbuhan bakteri patogen. Selain itu BAL memiliki kemampuan untuk menempel pada sel epitel usus, serta akan terjadi peningkatan sel lempengan peyer sebagai indikasi tersekresinya immunoglobulin (IgA) yaitu suatu reaksi terbentuknya kekebalan terhadap infeksi bakteri (Ouwehand and Vesterlund dalam Salminen et al. 2004).
Sistem akuakultur menyumbang efisiensi serta keuntungan produksi yang maksimal, dengan peningkatan sistem intensifikasi dan komersialisasi produksi. Namun demikian kendala di lapangan tetap saja ditemui, diantaranya kasus serangan penyakit pada ikan yang merupakan problem serius pada industri perikanan (Bondad-Reantaso et al. 2005). Komponen mikrobiota pada hewan air sangat berbeda dengan hewan yang hidup di darat. Populasi mikroba di dalam usus dominan keberadaannya dibandingkan yang tersebar di air. Populasi bakteri yang menetap di usus sebagai mikrobiota alami dieksplorasi sehingga mendukung upaya pencegahan bacterial disease yang biasanya menyerang sistem akuakultur (Huber et al. 2004).
Pada usus beberapa jenis ikan tawar tersebar sebagai mikrobiota normal yang diidentifikasi sebagai kelompok BAL (Ringo and Gatesoupe, 1998). Mikrobiota di usus dapat mempengaruhi pertumbuhan dan kesehatan ikan. Bakteri ini dikarakterisasi sebagai bakteri Gram positif, tidak bergerak (non motil), tidak
menghasilkan spora dan memproduksi asam laktat sebagai produk utama fermentasi di dalam proses metabolisme (Azizpour, 2009). Senyawa metabolit yang dihasilkan diantaranya memiliki kemampuan penghambatan pertumbuhan mikroorganisme lainnya yang dikenal dengan senyawa antimikroba. Selain asam laktat bakteri ini juga menghasilkan beberapa komponen antimikroba yaitu karbondioksida, hidrogen peroksida, diasetil, reuterin dan bakteriosin serta asam organik lainnya (Amezquita and Brashears, 2002).
Dari isolasi bakteri yang dilakukan terhadap usus ikan Kerapu Macan (Ephinephelus fuscogatus) didapatkan 9 spesies bakteri yang 5 spesies diantaranya merupakan BAL yaitu Lactococcus sp., Carnobacterium sp., Lactobacillus sp.,
Micrococcus sp. dan Bifidobacterium sp. serta kelompok lainnya juga sebagai
flora normal yaitu Staphylococcus sp., Bacillus sp., Eubacterium sp.,
Pseudomonas sp., Micrococcus sp., (Feliatra dkk, 2004). Studi isolasi juga
dilakukan pada berbagai spesies ikan air tawar oleh Cai et al. (1999) menggambarkan kehadiran genus Lactobacillus sebagai mikrobiota usus paling dominan pada ikan mas (Cyprinus carpio).
2.2 Senyawa Antimikroba BAL
Bakteri asam laktat menghasilkan beberapa komponen antimikroba yaitu asam organik, karbondioksida, hidrogen peroksida, diasetil, reuterin, dan bakteriosin (Amezquita and Brashears, 2002). Karbondioksida (CO2) dapat menghambat
bakteri perusak dan patogen (Kimura et al. 1999). Karbondioksida memiliki sifat antimikrobia dengan menyebabkan lingkungan lebih anaerob, akumulasi karbondioksida pada lipida bilayer akan merusak permeabilitas membran sel (Nilsson et al. 2000).
BAL memproduksi hidrogen peroksida pada kondisi aerob dan berkurangnya enzim-enzim seluler. Bakteri asam laktat mengekskresikan H2O2
bakterisidal. Hidrogen peroksida merupakan salah satu agen pengoksidasi yang kuat dan dapat dijadikan sebagai zat antimikroba melawan bakteri, fungi bahkan virus (Ray and Bhunia, 2008).
Hidrogen peroksida (H2O2) merupakan oksidator, bleaching agent dan anti
bakteri. Hidrogen peroksida murni tidak berwarna, berbentuk cairan. Kemampuan H2O2 untuk mengoksidasi menyebabkan perubahan tetap pada sistem enzim sel
mikroba sehingga digunakan sebagai antimikroba. Senyawa ini juga dapat terdekomposisi menjadi air dan oksigen. Perubahan kondisi lingkungan seperti pH dan suhu mempengaruhi kecepatan dekomposisi H2O2. Peningkatan suhu dapat
meningkatkan keefisienan dalam menghancurkan bakteri, sehingga kecepatan terdekomposisinya juga semakin cepat (Branen, 1993). Kemampuan bakterisidal dari H2O2 beragam tergantung pH, konsentrasi suhu, waktu dan tipe serta jumlah
mikroorganisme. Pada kondisi tertentu, spora bakteri ditemukan paling resisten terhadap H2O2, diikuti dengan bakteri Gram positif, bakteri yang paling sensitif
terhadap H2O2 adalah bakteri Gram negatif, terutama koliform (Ouwehand and
Vesterlund, 2004).
Bakteriosin dalam pembentukan pori harus berinteraksi dengan membran sitoplasma sel target. Lipid membran plasma yang bermuatan negatif merupakan reseptor utama bakteriosin dalam proses pembentukan pori. Interaksi elektrostatik bakteriosin yang bemuatan positif yang bersifat hidrofobik dengan gugus fosfat bermuatan negatif pada membran sel target merupakan tahap awal pengikatan bakteriosin dengan membran target. Bagian hidrofobik bakteriosin masuk membentuk pori (Zhao, 2003).
Mekanisme penghambatan bakteri oleh asam-asam organik berhubungan dengan keseimbangan asam-basa, penambahan proton dan produksi oleh energi sel. Keseimbangan asam-basa pada sel mikroba ditunjukkan dengan pH yang mendekati normal. Interaksi dengan senyawa kimia akan mengganggu
dan fosfolipid dapat rusak oleh perubahan pH. Ketersediaan ion-ion logam akan mengganggu permeabilitas membran, karena membran kurang permeabel terhadap ion dibandingkan dengan molekul yang tidak bermuatan. Perubahan permeabilitas membran akan menghasilkan efek ganda, yaitu mengganggu transpor nutrisi ke dalam sel dan menyebabkan metabolit internal keluar dari sel (Davidson and Branen, 1993).
2.3 Biofilm Bakteri
Biofilm merupakan sel mikroorganisme yang menempel pada permukaan padat pada lingkungan berair yang bersifat irreversibel sehingga tidak mudah berpindah tempat (Donlan, 2002). Biofilm tersusun atas 75-95% glycocalyx dan 5-25% sel bakteri (Pamp et al. 2007). Ketebalan biofilm berkisar antara 5-50 µm, yang tersusun atas campuran polisakarida, substansi polimer lainnya dan air yang seluruhnya diproduksi oleh bakteri. Peningkatan ketebalan koloni bakteri hingga 100-200 µm membentuk seperti tumpukan jamur (Mittelman dalam Paraje, 2011). Biofilm dapat terdiri dari satu spesies ataupun kumpulan dari banyak spesies mikroorganisme. Kumpulan mikroorganisme dalam bentuk biofilm memiliki perbedaan pola hidup dengan mikroorganisme yang planktonik. Perbedaan tersebut menyangkut kecepatan pertumbuhan dan kemampuan untuk bertahan pada kondisi perlakuan terhadap zat antimikroba (Donlan, 2001).
Bakteri dalam bentuk biofilm sukar ditanggulangi dengan prosedur sanitasi. Beberarapa ahli telah meneliti mengenai penempelan bakteri pada permukaan padat. Penelitian telah dilakukan pada alat-alat industri makanan seperti permukaan stainless steel (Ryu and Beuchat, 2005). Zottola (1994) menjelaskan mengenai eksperimennya bahwa bakteri yang mampu membentuk biofilm pada permukaan padat yang tergolong dalam 3 tingkatan yaitu 1) penempelan bakteri pada permukaan padat, 2) bakteri mengenali permukaan dan mulai membentuk polimer, 3) bakteri mengkolonisasi permukaan, bertumbuh dan menggandakan diri pada permukaan. Dalam hal ini pada tahapan kedua
merupakan tahapan penting karena pada fase ini bakteri menghasilkan produk ekstraseluler di permukaan.
Matrik kompleks berupa produk ekstraselular polisakarida berfungsi sebagai pembatas (barrier) interaksi bakteri dengan permukaan padat. Interaksi ini dapat terjadi oleh satu jenis bakteri maupun kumpulan beberapa jenis bakteri. Bakteri bergabung dan saling dihubungkan oleh matrik ekstraseluler polisakarida yang diproduksi pada dinding sel. Matriks polisakarida yang dihasilkan bakteri dianalogikan sebagai perekat padat yang bersifat kohesif (berpadu) pada berbagai permukaan padat di alam. Komponen inilah yang dikenal sebagai biofilm (Barner and Caskey, 2002).
Pembentukan biofilm tergantung pada interaksi antara tiga komponen yaitu sel bakteri, penempelan pada permukaan dan medium yang mengelilinginya (Stoodley et al. 2002). Ada beberapa faktor yang mempengaruhi kecepatan dan perluasan pembentukan biofilm. Mula-mula mikroorganisme harus melekat dan dibiarkan pada permukaan dalam waktu yang cukup panjang agar terbentuk penempelan yang irreversibel (tidak bolak-balik). Kecepatan penempelan sel bergantung pada jumlah dan tipe sel pada cairan permukaan serta karakteristik fisika kimianya. Komponen cairan dapat berubah pada permukaan dan juga mempengaruhi kecepatan penempelan. Penempelan yang bersifat irreversibel dan produksi polisakarida ekstraseluler untuk perkembangan biofilm, kecepatan pertumbuhannya dipengaruhi oleh kecepatan penguraian, komposisi nutrisi pada media pemukaan, konsentrasi zat antimikroba yang ditambahkan dan temperatur lingkungan sekitar (Donlan, 2001). Rantai polisakarida menunjukan susunan kimiawi yang bersifat polar dan sangat sukar terpisah. Polaritas berperan penting terhadap adhesi (perlekatan) dan kohesi (daya lekat) sel. Hal ini yang menjadi salah satu penyebab struktur biofilm sukar untuk dihilangkan. Matriks polisakarida berfungsi sebagai pemisah sekaligus mekanisme perlindungan dari lingkungan luar (Barnes and Caskey, 2002).
Faktor yang mempengaruhi penempelan bakteri pada permukaan meliputi ketersediaan nutrisi pada permukaan, konsentrasi nutrisi, pH, temperatur, konsentrasi elektrolit, aliran material, dan tipe permukaan seperti 1) material permukaan berenergi tinggi, bahan bermuatan negatif diubah menjadi material hidrofilik. Contoh: kaca, logam, mineral. 2) material permukaan berenergi rendah, muatan positif dan negatif diubah menjadi material hidrofobik seperti plastik dan produk polimer organik lainnya. Material permukaan berenergi tinggi menunjukkan aktivitas yang relatif besar terhadap penyerapan pelarut atau nutrisi, yang mempengaruhi angka kolonisasi bakteri pada permukaan (Marshall dalam Kumar and Ramjee, 2006).
Mekanisme perlekatan biofilm pada permukaan diawali dengan perlekatan beberapa bakteri planktonik dan bergerak dengan flagel diantaranya telah diamati pada beberapa bakteri patogen Escherichia coli dan Listeria monocytogenes mendekati permukaan hidup (biotik) maupun tak hidup (abiotik) dan membentuk lapisan pembatas (Pratt and Kolter 1998, Lemon et al. 2007) . Beberapa sel bersentuhan pada permukaan dalam waktu singkat. Proses ini disebut penyerapan reversibel (Marshall, 1992). Penempelan awal didasarkan daya tarik elektrostatik dan gaya fisika tetapi tidak sesuai dengan penempelan secara kimia. Beberapa penyerapan sel reversibel mulai untuk mempersiapkan penundaan beberapa lama oleh pembentukan struktur kemudian mengikat permanen lalu hingga ke permukaan dalam beberapa jam berikutnya, sel perintis terus memproduksi kembali sel anakan dalam bentuk mikrokoloni pada permukaan dan mulai untuk memproduksi matriks polimer yang mengitari koloni tersebut (Mayette, 1992). Tahapan selanjutnya adalah daerah tengah biofilm dibebaskan sel bakteri lalu diperluas menuju daerah lainnya dimana biofilm dapat dibentuk. Mikrokoloni merupakan kelompok kecil yang pada akhirnya akan membentuk biofilm yang bentuknya berlapis-lapis sehingga dapat diamati dengan mata telanjang. Matriks polisakarida berangsur-angsur saling berhubungan, oleh karena itu menguatkan perlekatan pada permukaan serta pembebasan daerah tengah biofilm bakteri untuk kemudian proses perluasan biofilm berlangsung (Barnes and Caskey, 2002).
2.4 Motil Aeromonas Septicemia (MAS)
Genus Aeromonas merupakan mikroorganisme yang banyak ditemukan pada perairan tawar terutama yang mengandung bahan organik tinggi (Ayuningtyas, 2008) dan memiliki suhu optimum pertumbuhan yaitu 20 oC-30 o
Faktor-faktor virulensi muncul dalam dua bentuk yaitu struktur sel terkait dan produk ekstraseluler. Di antara struktur sel terkait adalah pili, flagela, protein luar membran, lipopolisakarida, dan kapsul. Produk ekstraseluler utama termasuk
cytotoxic, cytolytic, hemolytic dan protein enterotoksik. Secara struktural A. hydrophila memiliki fili, flagela, slayer, lipopolisakarida, dan protein membran
luar yang berperan sebagai faktor virulensi (EPA, 2006). Menurut Chopra et al. (2000) A. hydrophila termasuk kedalam bakteri patogen dengan virulensi yang tinggi. Tingkat virulensi bakteri tersebut ditentukan oleh kemampuan bakteri menghasilkan enzim dan toksin yang berperan dalam proses invasi dan infeksi. Sebagai faktor-faktor virulensinya ialah kitinase, lesitinase dan hemolisin. Senyawa ini bekerja dengan mendegradasi jaringan target.
C. Bakteri ini dapat menginfeksi banyak jenis ikan air tawar seperti Catfish, Cyprinidae,
Cichlidae, Rainbow trout, Salmodae, katak, siput dan udang air. Kemampuan A. hydrophila dalam melakukan infeksi pada ikan terkait dengan kemampuan bakteri
dalam menghasilkan toksin, dikelompokkan sebagai bakteri berbentuk batang, motil, memiliki satu flagel di ujung, Gram negatif (Noga, 2000).
Kerusakan sisik atau kulit akan mempermudah patogen menginfeksi inang. Sejumlah mikroba normal pada hewan dapat berperan dalam menghambat atau menghalangi terjadinya infeksi melalui mekanisme antagonisme. Tiga mekanisme utama antagonisme mikroba normal terhadap patogen yaitu 1) kompetisi dalam menempati situs perlekatan atau kolonisasi, 2) antagonisme spesifik melalui produksi senyawa penghambat berupa protein spesifik (bakteriosin) dan 3) antagonisme nonspesifik dengan memproduksi berbagai metabolit atau produk akhir yang menghambat mikroba patogen antara lain berupa asam-asam organik dan peroksidase (Irianto, 2004).
Terjadinya kematian ikan secara massal sering dihubungkan dengan terjadinya akumulasi bahan organik dan penurunan kualitas air. Penurunan kualitas air menyebabkan menurunnya kondisi kesehatan ikan yang dibudi dayakan dan memungkinkan berkembangnya bakteri heterotrofik dan bakteri patogen pada perairan budidaya. Semua jenis ikan mempunyai potensi untuk terinfeksi oleh bakteri. Pada kondisi dan jumlah tertentu infeksi oleh bakteri dapat menyebabkan penyakit bahkan kematian (Camus et al. 1998).
A. hydrophila mampu hidup di berbagai kondisi perairan tawar sehingga
memiliki potensi menjadi patogen bagi ikan air tawar. Bakteri ini juga dianggap sebagai ancaman bagi budi daya ikan air tawar dan merupakan problem besar bagi ekonomi perikanan negara di dunia. Salah satunya sebagai agen penyebaran penyakit dengan gejala haemorragic septicaemia dan epizootic ulcerative
syndrome (UES) pada negara-negara di Asia (Yesmin et al. 2004). Gejala-gejala
yang ditimbulkan oleh serangan A. hydrophila menyebabkan kerusakan sistemik organ-organ pada ikan. Adapun gejala dan organ yang mengalami kerusakan disajikan pada Tabel 1.
Tabel 1. Kerusakan organ dan gejala yang ditimbulkan akibat serangan patogen primer A. hydrophyla
Organ yang
diserang Gejala Referensi
kulit kemerahan, akumulasi cairan dan bisul. Yardimci and Aydin (2011)
otot Nekrosis Carrashi et al. (2012)
perut membesar akibat edema Carrashi et al. (2012)
insang terjadi pendarahan Carrashi et al. (2012)
sirip korosif Yardimci and Aydin (2011).
otot Nekrosis Carrashi et al. (2012)
hati cenderung kehijauan Afifi et al. (2000)
kantung empedu membesar dan dipenuhi butiran hijau Yardimci and Aydin (2011)
Infeksi ikan yang disebabkan oleh bakteri cepat sekali menyebar jika ikan yang sehat berada dalam areal kolam ikan yang sama dengan ikan yang enunjukkan gejala sakit. Beberapa gejala dapat dilihat secara visual terhadap ikan yang sakit pada kolam ikan budi daya UD. Samosir di Kec. Medan Sunggal. Gejala tersebut adalah pergerakan ikan lambat, berenang di permukaan air, kurang agresif terhadap pakan. Infeksi yang ditimbulkan A. hydrophila dapat diamati pada Gambar 1.
Gambar 1. Infeksi A. hydrophila pada ikan nila merah a). kulit menjadi lebih gelap, sirip punggung dan sirip ekor mengalami kerusakan, b). hyperemia pada sirip pektoral c). gejala haemorrhagic pada hati d) bercak abu abu putih di hati, kantung empedu membesar dipenuhi dengan sekret butiran hijau (Yardimci and Aydin, 2011).
2.5 Pengendalian Biofilm Bakteri
Biofilm melindungi sel-sel nya dengan berbagai cara. Kontaminasi sel dalam bentuk baik klinis maupun industri cenderung sukar dikendalikan. Biofilm berevolusi dengan tampilan fenotip sel yang dibedakan atas berbagai jenis yang melakukan fungsi saling melengkapi. Terkait dengan perilaku kooperatif sel bakteri, serta dihubungkan oleh sel-sel komunikasi dan faktor lainnya, memungkinkan suatu peningkatan metabolisme, keragaman dan efisiensi serta peningkatan ketahanan terhadap stres terhadap lingkungan, agen antimikroba dan pertahanan inang yang ditumpangi (Blango and Mulvey, 2009).
Variasi pH media digunakan untuk melihat perbedaan penempelan bakteri patogen pada permukaan padat. Mafu et al. (2011) menjelaskan mengenai daya perlekatan bakteri pada permukaan dan pembentukan biofilm yang merupakan fenomena kompleks dipengaruhi oleh beberapa faktor diantaranya strain bakteri, pH media serta tipe permukaan. A. hydrophila, E.coli dan Staphylococcus
auereus diujikan kemampuan penempelan pada media permukaan Polystyrene
dan kaca dipilih mewakili sifat hidrofobik dan hidrofilik. Perlakuan dilakukan dengan variasi pH 6, 7 dan 8. Pengamatan dilakukan dengan menghitung energi bebas (mJ/m2). Penurunan pH sebanding dengan peningkatan energi bebas yang dibutuhkan pada perlekatan A. hydrophila pada permukaan polystyrene yaitu -38.0 mJ/m2, -37.7 mJ/m2 -35.9 mJ/m2 dan sedangkan energi yang dibutuhkan pada permukaan kaca konstan pada angka 18 mJ/m2
Hood and Zottola (1995) menjelaskan bahwa pengendalian mikroorganisme yang membentuk biofilm pada alat-alat pengolahan makanan serta proses pengolahan makanan telah dilakukan dengan menggunakan metode kontrol fisika dan kimia diantaranya perlakuan panas, high pressure sprays, perlakuan sanitasi kimia melibatkan senyawa hypochlorit, iodophors, amphoteric,
buguanides, aldehydes, peracetic acid, atau quaternary ammonium. Kedua cara
tersebut mengendalikan dan menonaktifkan mikroorganisme pada permukaan alat-alat pada proses pengolahan bahan makanan. Bal’a et al. (1999) telah melakukan pengujian melibatkan perlakuan fisik dan kimia yaitu panas dan
chlorine dalam mengendalikan biofilm A. hydrophila pada permukaan Stainless
Steel. Pengujian menunjukkan penggunaan suhu 60
pada variasi pH 6, 7 dan 8.
o
C selama 1 menit atau dengan pemberian 75 ppm chlorine selama 1 menit dapat menurunkan deteksi sel biofilm A. hydrophila yang terdapat pada permukaan padat. Pengendalian biofilm dengan menggunakan pembersih atau detergen telah diujikan pada beberapa tipe permukaan bahan seperti kaca, karet, polypropylene, stainless steel (Mafu et
BAB III
METODE PENELITIAN
3.1 Waktu dan Lokasi
Penelitian ini akan dilakukan pada bulan November 2012 hingga Juli 2013 di Laboratorium Mikrobiologi FMIPA Universitas Sumatera Utara.
3.2 Bahan dan Alat
Bahan dan alat yang digunakan dalam penelitian ini ialah :
1. Isolat A. hydrophila AHL-13A koleksi Balai Riset Perikanan Air Tawar Sempur, Bogor.
2. Sebanyak 13 isolat yang diisolasi oleh Mayasari dan Rulia (komunikasi pribadi tim kerja) yang terdiri dari 5 isolat air kolam ikan serta 8 isolat sedimen kolam ikan.
3. Usus ikan Nila (Oreochromis niloticus), NaCl fisiologis 0,9 %, akuades steril,
de Man Rogosa Sharpe agar (Oxoid®), Phosphate Buffer Saline (PBS), kristal violet, lugol, safranin, aceton alcohol, H202 3%, membran filter 0,22
µm ((MS® Syringe filter), syringe 1 mL, Muller Hinton Agar (Merck®), tusuk gigi steril, cotton bud steril, kertas cakram (Oxoid®), lempeng plastik PVC ukuran 1 cm2 (lampiran 11), sisik ikan ukuran 1 cm2
4. Alat yang digunakan pada penelitian ini ialah tabung reaksi, rak tabung, pipet volum, jarum ose, spatula, vortex, cawan petri, inkubator, erlenmeyer, botol biakan, gelas ukur, bunsen, hot plate, pH meter, neraca analitik, sentrifugasi dan spektrofotometer, bak sonikator dan lain-lain.
(lampiran 11), glass
beads (lampiran 11), Nutrient Broth (NB), Nutrient Agar (NA), detergen
(sunlight), Plate Count Agar (PCA), EDTA, tween 80, alkohol 70%, alkohol 90%, kapas, spiritus dan lain-lain.
3.3 Rancangan Percobaan
Penelitian merupakan penelitian deskriptif yang dimulai dengan isolasi BAL dari sumber isolasi usus ikan Nila (Oreochromis niloticus) dan menggunakan 5 isolat bersumber dari air kolam serta 8 isolat bersumber dari sedimen kolam ikan BAL. Uji antagonis senyawa antimikroba ekstrak kasar BAL isolat terpilih dengan A. hydrophila pada kepadatan sel 108
3.4 Isolasi Bakteri Asam Laktat
CFU/mL. Pembentukan sel biofilm A. hydrophila pada permukaaan sisik ikan dan plastik PVC. Pengendalian sel biofilm BAL dengan memproduksi senyawa antimikroba ekstrak kasar BAL pada fase stasioner yang diperoleh dari kurva pertumbuhan. Karakterisasi pH senyawa antimikroba BAL pada rentang pH 2 hingga pH 10 serta karakterisasi terhadap surfaktan EDTA dan Tween 80. Data yang diperoleh disajikan dalam tabel maupun grafik.
Isolasi bakteri asam laktat dilakukan menurut metode Bucio et al. (2006) dengan modifikasi. Saluran pencernaan ikan sehat dipisahkan dari rongga tubuh, diambil, disayat untuk kemudian dibersihkan isinya. Tiriskan kemudian dinding usus bagian dalam dikerik dengan menggunakan spatula steril. Cairan mukosa usus diambil sebanyak 1 mL dan dihomogenkan di dalam 9 mL larutan PBS (phosphate buffer saline) kemudian dilakukan pengenceran hingga 10-8 secara berseri. Dari setiap pengenceran 10-4 hingga 10-8 diambil 0,1 ml dan disebarkan pada medium MRS agar, lalu diinkubasi pada suhu 28 oC selama 24-48 jam. Koloni yang tumbuh terpisah, berwarna putih pada MRSA dimurnikan dengan metode kuadran gores hingga memperoleh koloni murni. Kultur murni ditandai dengan morfologi yang seragam (Lampiran 2).
3.5 Seleksi BAL Potensial
Seleksi BAL potensial dalam menghambat bakteri uji dilakukan dengan metode Banerjee et al. (1999) untuk menentukan isolat terpilih yang nantinya akan diteruskan pada pengujian selanjutnya. Patogen uji sebanyak 5-10 ose
dikultur dalam 50 mL media NB dan dinkubasi 24 jam pada suhu 28 oC disetarakan dengan dengan spektrofotometer pada λ = 600 nm OD0,5. Seleksi
BAL kandidat berdasarkan uji antagonis dengan menotolkan kultur bakteri dengan tusuk gigi steril pada media MHA yang telah dipreparasi sebelumnya diusap kultur cair patogen A. hydrophila dengan kepadatan 108 CFU/ mL yang disetarakan dengan OD0,5 dengan cotton bud steril kemudian menghitung
diameter zona bening setelah diinkubasi pada suhu 28 oC selama 24-48 hari (Lampiran 3).
3.6 Identifikasi BAL Potensial
Identifikasi awal dilakukan setelah isolat terpilih sebagai kandidat penghasil senyawa antimikroba terbaik berdasarkan seleksi uji antagonis. Identifikasi awal didasarkan atas pengamatan morfologi dan uji katalase masing-masing isolat BAL berdasarkan ciri-ciri awal tersebut dicocokkan berdasarkan Bergeys Manual of
Determinative of Bacteriology 9th edition (Holt et al. 2000).
1. Pengamatan morfologi
Uji Morfologi dilakukan dengan menumbuhkan isolat murni pada media cair MRSA dan diinkubasi selama 24 jam pada suhu 28 oC kemudian dilakukan pengecatan Gram sekaligus diamati bentuk sel nya (meliputi bentuk, tepi, elevasi, warna dan ukuran koloni) yang tumbuh terpisah. Pengamatan morfologi sel mencakup bentuk dan pengecatan Gram diamati di bawah mikroskop binokuler pada perbesaran 10x dan 40x (Lampiran 4).
2. Uji katalase
Uji katalase dilakukan dengan meneteskan larutan H2O2 3% pada kultur
muda (umur 24 jam). Sifat reaksi terhadap uji katalase ditentukan dengan pemunculan gelembung gas CO2 merupakan hasil positif terhadap pengujian
Identifikasi dilanjutkan dengan pengujian isolat terpilih di Pusat Pangan dan Gizi Universitas Gajah Mada dengan acuan Bergeys Manual of Determinative
of Bacteriology 9th edition (Holt et al. pertumbuhan yang diujikan bervariasi 10
o
C, 15 oC, 25 oC, 30 oC, 37 oC, 40 oC dan 45 o
3.7 Pertumbuhan Isolat BAL
C. Kisaran pH yang diujikan bervariasi pH 4, 5, 8,5, 9 dan 9,5. 2000) terhadap kemampuan sel tumbuh pada suhu dan pH bervariasi. Kisaran suhu Selain itu identifikasi dilakukan terhadap kemampuan isolat dalam memproduksi asam dari berbagai jenis karbohidrat sebagai kunci pembeda spesies BAL.
Sebanyak 5 ose kultur BAL dimasukkan ke dalam 30 mL media cair NB, kemudian diinkubasi 28 oC pada rentang 3 jam selama 24 jam. Nilai kerapatan optik atau optical density (OD) isolat terpilih BAL dihitung dengan menggunakan spektrofotometer menurut metode Hadioetomo (1990) (Lampiran 5).
3.8 Pembentukan Sel Biofilm A. hydrophila
Pembentukan sel biofilm dilakukan menurut metode Jamilah dan Priyani (2012). Lempeng permukaan padat dibuat untuk pengujian in vitro yaitu permukaan sisik ikan dan plastik PVC. Masing-masing lempeng dipotong seluas 1 cm2 diletakkan dalam erlenmeyer berisi sunlight cair dan akuades pada bak sonikator selama 15 menit, kemudian dibilas kembali dengan akuades. Lempeng dibungkus dengan alumunium foil lalu disterilkan pada autoklaf selama 15 menit, tekanan 1 atm pada suhu 121 oC. Masing-masing lempeng permukaan digunakan sebagai analogi permukaan padat di kolam ikan. Isolat murni A. hydrophila ditumbuhkan pada 50 mL media NB pada pH 7 kemudian diinkubasi 24 jam pada suhu 28 oC hingga mencapai OD0,5 pada panjang gelombang 600 nm. Masing-masing jenis lempeng
dimasukkan dalam kultur sebanyak 6 lempeng. Botol uji diinkubasi 28 oC dengan aerasi menggoyang botol searah jarum jam 15 menit/hari. Pembentukan biofilm diamati pada periode 1, 3 dan 5 hari untuk melihat peningkatan jumlah sel biofilm yang terbentuk.
Untuk setiap rentang waktu dilakukan penghitungan jumlah sel bakteri biofilm. Lempeng diangkat dari kultur, dibilas sebanyak 3 kali dengan 10 mL akuades steril kemudian dimasukkan kedalam 9 mL garam fisiologis (NaCl 0,9%) yang ditambah dengan 0,5 g manik-manik kaca (glass beads), divortek untuk melepas sel biofilm. Penghitungan sel dilakukan dengan membuat pengenceran berseri, lalu sebanyak 0,1 mL kultur disebar pada media PCA secara aerobik, diinkubasi pada suhu ruang 28 o
3.9 Produksi Senyawa Antimikroba BAL
C selama 24 jam. Setelah itu dilakukan perhitungan jumlah sel. Perlakuan diulang sebanyak 3 kali. Kontrol berupa lempeng dalam media cair NB tanpa penambahan sel A. hydrophila (Lampiran 6).
Produksi senyawa antimikroba dilakukan dengan memodifikasi metode Delgado (2001) yaitu dengan memproduksi senyawa antimikroba ekstrak kasar BAL yang berasal dari kultur cair berumur 15 jam. Kultur cair ditambahkan sebanyak 10 mL ke dalam 400 mL media NB, inkubasi pada suhu 28 oC selama 15 jam. Kemudian sebanyak 100 mL kultur disentrifugasi dengan kecepatan 10.000 rpm pada suhu 4 oC selama 15 menit. Selanjutnya dilakukan penyaringan senyawa antimikroba dengan kertas saring 0,22 µm (MS®
3.10 Pengendalian Biofilm A. hydrophila
Syringe filter)
sehinggga diperoleh ekstrak kasar senyawa antimikroba BAL (Lampiran 7).
Pengendalian sel biofilm dilakukan dengan metode Jamilah dan Priyani (2012). Lempeng sisik ikan dan plastik PVC dengan biofilm jumlah tertinggi secara terpisah dibilas tiga kali dengan akuades steril. Lempeng dimasukkan kedalam botol steril yang telah berisi 9 mL senyawa antimikroba ekstrak kasar BAL tersebut digoyang pada waterbath shaker 120 rpm pada suhu 28 oC selama waktu kontak 1 jam. Jumlah bakteri yang tersisa dihitung dengan metode total
plate count dengan menyebar 0,1 mL kultur dari pengenceran berseri pada media plate count agar (PCA) secaca aerobik, diinkubasi selama 24 jam pada suhu ruang
media akuades steril sebanyak 9 mL dikontakkan 1 jam kemudian dihitung dengan metode yang sama dengan perlakuan (Lampiran 8).
3.11 Pengaruh pH, Suhu dan Surfaktan Terhadap Aktivitas Senyawa Antimikroba
3.11.1 Pengaruh pH
Pengujian aktivitas senyawa antimikroba BAL terhadap pH dilakukan berdasarkan metode Joshi et al. (2006). Sebanyak 2 mL senyawa antimikroba ekstrak kasar hasil penyaringan ditambahkan dengan HCl 0,1 N dan NaOH 0,1 N secara terpisah kemudian diamati sensitifitasnya terhadap perubahan pH 2, 4, 6, 8, 10. Kontrol dilakukan dengan mencampurkan 2 mL akuades steril dengan HCl 0,1 N dan NaOH 0,1 N secara terpisah untuk memperoleh kondisi asam kuat dan basa kuat. Sebanyak 15 µL diteteskan pada cakram steril, kemudian diletakkan pada MHA padat yang telah diusap dengan kultur A. hydrophila 108 CFU/mL. Pengamatan aktivitas antimikroba dilakukan setelah waktu inkubasi 24-48 jam pada suhu 28 oC dengan menghitung diameter zona hambat yang terbentuk (Lapiran 9).
3.11.2 Pengaruh Suhu
Pengujian aktivitas senyawa antimikroba BAL terhadap suhu dilakukan berdasarkan metode Aslam et al. (2011). Sebanyak 2 mL senyawa antimikroba ekstrak kasar BAL diperlakukan terhadap suhu 40 oC, 60 oC, 80 oC, 100 oC pada inkubator termofil serta kontrol pada suhu ruang 28 oC selama 15 menit. Ekstrak kasar tersebut diujikan aktivitas antimikrobanya terhadap A. hydrophila dengan metode cakram. Sebanyak 15 µL diteteskan pada cakram steril, kemudian diletakkan pada MHA padat yang telah diusap dengan kultur A. hydrophila yang berasal dari kultur dengan 108 CFU/mL Pengukuran diameter zona penghambatan yang terbentuk selama waktu inkubasi 48 jam pada suhu 28 oC (Lampiran 10).
3.11.3 Pengaruh Surfaktan
Pengujian aktivitas senyawa antimikroba BAL terhadap surfaktan dilakukan berdasarkan metode Baljinder and Neena (2012). Sebanyak 1 mL senyawa antimikroba ekstrak kasar BAL hasil penyaringan ditambahkan dengan 1% w/v surfaktan ethylene diamine tetraacetate (EDTA) maupun Tween 80 pada tabung reaksi terpisah. Sebanyak 15 µL diteteskan pada cakram steril, kemudian diletakkan pada MHA padat yang telah diusap dengan kultur A. hydrophila yang berasal dari kultur dengan 108 CFU/mL. Kontrol dilakukan dengan meneteskan surfaktan tanpa senyawa antimikroba BAL. Pengamatan aktivitas antimikroba dilakukan setelah 24-48 jam waktu inkubasi pada suhu 28 oC. dengan menghitung diameter zona hambat yang terbentuk (Lampiran 11).
BAB IV
HASIL DAN PEMBAHASAN
4.1 Isolasi Bakteri Asam Laktat (BAL) Perairan Tawar
Dari hasil isolasi usus ikan Nila dengan didapat 8 isolat berbeda secara morfologi koloni. Penelitian ini juga mengujikan sebanyak 13 isolat yang diisolasi oleh Mayasari dan Rulia (komunikasi pribadi tim kerja) yang terdiri dari 5 isolat air kolam ikan serta 8 isolat sedimen kolam ikan. Pengamatan karakteristik morfologi isolat BAL, pewarnaan Gram serta uji katalase disajikan dalam Tabel 2.
Tabel 2. Pengamatan karakteristik bakteri asam laktat sumber isolasi usus ikan (US), air kolam (AK) dan sedimen kolam (EK) pada media MRSA selama waktu inkubasi 48 jam Kode Isolat Karakteristik Morfologi Penataan sel Katalase Warna koloni
Bentuk koloni Tepi koloni Elevasi
US1 putih susu bergelombang tidak teratur timbul kokus -
US2 putih susu bulat siliat berbukit kokus -
US3 bening bulat halus datar kokus -
US4 putih susu bulat timbul gunung kokus -
US5 putih susu bulat tidak teratur gunung kokus -
US6 putih susu bulat halus timbul kokus -
US7 krem filiform lobat umbonat kokus -
US8 putih susu berfilamen bergelombang berbukit kokus -
AK1 putih susu bulat tidak teratur timbul kokus -
AK2 putih susu menyebar
tidak teratur
gelombang datar
kokus -
AK3 krem bulat tepi
timbul
tidak teratur timbul
kokus -
AK4 bening melebar
permukaan kisut
halus timbul
basil -
AK5 putih susu bulat tepi
timbul
halus timbul
basil -
EK2 putih susu permukaan
kusut
halus timbul basil -
EK4 Putih bulat halus timbul kokus -
EK6 putih susu bentuk-I bergelombang timbul basil -
EK7 putih susu berfilamen lobat berbukit basil -
EK8 putih susu bulat halus datar basil -
EK9 putih susu filiform siliat krateriform basil -
EK10 putih susu berfilamen bergelombang berbukit basil -
EK11 krem bulat tepi
timbul
halus gunung
kokus -
Dari hasil yang diperoleh karakteristik morfologi koloni yang tumbuh pada media MRSA bervariasi, dengan bentuk kokus maupun basil, bentuk, tepi dan elevasi bervariasi, warna koloni dari putih hingga krem serta keseluruhan uji katalase menunjukkan hasil negative (Tabel 2). Pewarnaan Gram menunjukkan bahwa hasil isolat tergolong bakteri Gram positif. Media MRSA lazim digunakan pada isolasi BAL karena media tersebut menyediakan sumber nitrogen yang cukup bagi pertumbuhan serta mendukung aktivitas metabolisme BAL dalam menghasilkan senyawa antimikroba (Kim et al. 2006).
4.2 Seleksi BAL Potensial
Sebanyak 21 isolat bakteri asam laktat diuji antagonis dengan metode Banerjee et
al. (1999). Zona hambat yang terbentuk terhadap A. hydrophila selama waktu
inkubasi 48 jam pada media MHA (Mueler Hinton Agar) diukur berdasarkan kemampuan isolat BAL membentuk zona bening penghambatan pada agar dengan kepadatan sel awal A. hydrophila dengan mengukur OD0,5
Tabel 3. Rata-rata zona hambat isolat BAL terhadap A. hydrophila pada media MHA pada suhu 28
pada panjang gelombang 600 nm. Data penghambatan tersebut secara lengkap disajikan dalam Tabel 3.
o
Kode isolat
C dan waktu inkubasi 48 jam Rata-rata zona hambat (mm) Kode isolat Rata-rata zona hambat (mm)
Kode isolat Rata-rata zona
hambat (mm)
US1 0 EK2 0 AK1 0
US2 4,0 EK4 7,0 AK2 0
US3 0 EK6 0 AK3 0
US4 17,6 EK7 0 AK4 0
US5 0 EK8 0 AK5 0
US6 13,3 EK9 0
US7 0 EK10 5,5
US8 0 EK11 0
Berdasarkan besar zona hambat (Tabel 2) terdapat lima isolat BAL yang memiliki kemampuan dalam menghambat patogen uji A. hydrophila. Tiga isolat dari usus ikan Nila (Oreochromis niloticus) dengan kode US2, US4 dan US6 dengan kategori baik hingga kuat serta dua isolat bersumber sedimen kolam ikan
mengkategorikan zona bening dengan diameter hambat 0-3 mm tergolong kategori penghambatan lemah, diameter hambat 3-6 mm dengan kategori baik sedangkan diameter hambat lebih besar dari 6 mm tergolong kategori kuat. Keasaman sitoplasma dipertahankan pada awal pertumbuhan sel, sehingga semua protein dan enzim yang berada di dalam sel dapat tetap bekerja secara optimal. Isolat mampu melakukan transport aktif pengeluaran proton sehingga nutrisi masih dapat ditranspor dan isolat dapat tumbuh. Tiap isolat memiliki fase pertumbuhan yang berbeda sesuai dengan spesiesnya. Perbedaan waktu isolat dalam mencapai fase kematian terkait dengan ketidakseimbangan pengeluaran dan pemasukan proton. Senyawa antibakteri akan terhenti dihasilkan ketika isolat memasuki fase ini. Keadaan ini memungkinkan bakteri uji untuk bertahan hidup dan zona bening menjadi kecil (Mayasari dkk, 2013). Menurut Hosoya et al. (1998) menyatakan bahwa sel bakteri cenderung menghasilkan senyawa antimikroba jika ada pengaruh patogen lain yang mengancam di sekitarnya.
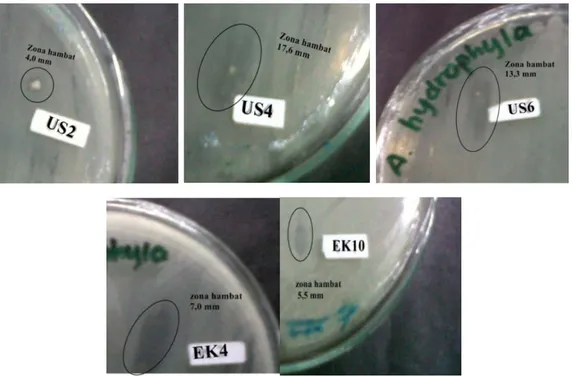
Zona bening yang terbentuk beragam, isolat US2, US4, EK4 dan EK10 memperlihatkan pinggiran zona hambat yang kabur sedangkan isolat US6 dengan pinggiran tegas (Gambar 2). Pinggiran yang kabur diduga merupakan metabolit aktif yang bersifat menghambat pertumbuhan sel bakteri uji. Sementara itu zona hambatan dengan pinggiran yang tegas diduga isolat memiliki kemampuan menghasilkan metabolit yang bersifat bakterisidal, dimana metabolit dapat membunuh sel bakteri uji. Hal ini merupakan dasar peneliti memilih isolat US6 untuk dilanjutkan sebagai isolat terpilih meskipun daerah penghambatannya 13,3 mm lebih kecil dibanding US4 yang memiliki daerah penghambatan 17,6 mm. Sarkono dkk (2010) mengkategorikan zona bening ke dalam karakter penghambatan menghambat dan membunuh bakteri patogen. Rahayu dkk (2004) menyatakan bahwa sifat bakterisidal merupakan kemampuan yang diharapkan dari bakteri probiotik sehingga dapat mengendalikan pertumbuhan bakteri patogen dalam aplikasinya.
Gambar 2. Zona hambat isolat BAL terhadap A. hydrophila kategori baik hingga kuat, US2 = zona tegas ; US4 = zona kabur ; US6 = zona tegas; EK4 = zona tegas ; EK10 = zona
kabur) pada suhu 28 oC, media MHA dan masa inkubasi 48 jam.
Berdasarkan luas diameter zona hambat dipilih tiga isolat sumber usus dan dua isolat sumber sedimen air kolam yang potensial menghambat patogen A.
hydrophila. Dari hasil diatas dapat diasumsikan adanya potensi agen probiotik
dari sumber isolasi usus ikan Nila dan sedimen kolam ikan. Isolasi dari sumber yang sama dalam upaya seleksi probiotik dengan memaksimalkan kemampuan adaptasi BAL pada kondisi perairan dalam aktivitas penghambatan bakteri target
A. hydrophila. Rengpipat et al. (2003) menyatakan probiotik dari habitat aslinya
memiliki peluang hidup dan tumbuh yang lebih besar dibandingkan kompetitor asing dari luar sistem. Isolat yang paling potensial untuk dilanjutkan sebagai agen pengendali biofilm A. hydrophila adalah isolat dari sumber isolasi usus ikan Nila US6 dengan kriteria zona hambat yang tinggi. Isolat dari sumber isolasi usus lebih potensial dibandingkan dengan isolat sumber lainnya. Gutowska et al. (2004) menyatakan mikrobiota usus memiliki aktivitas antagonis terhadap banyak patogen ikan serta melindungi dari infeksi patogen.
Potensi sel BAL terkait dengan kemampuan melekat dan membentuk koloni sebagai suatu prasyarat sebagai bakteri probiotik. Hal ini didukung oleh Verschuere et al. (2000) yang mengelompokkan kemampuan probiotik yaitu 1) bersifat antagonis terhadap patogen, 2) Pelekatan atau lokasi hidup dari bakteri merupakan salah satu yang terpenting dalam kriteria seleksi bakteri probiotik karena hal ini termasuk dalam prasyarat pembentukan suatu koloni.
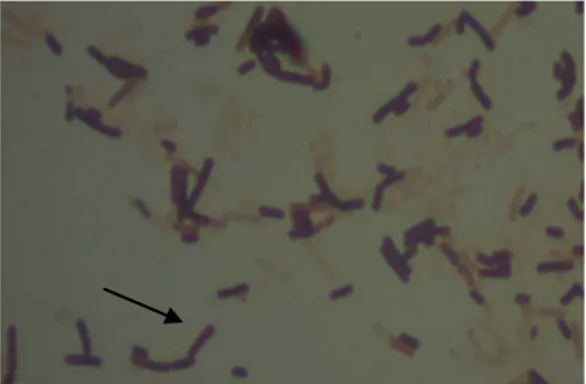
4.3 Identifikasi BAL
Koloni bakteri yang telah digores dengan metode kuadran akan terpisah menjadi koloni murni. Identifikasi morfologi dan fisiologi awal yang dilakukan meliputi pewarnaan Gram dan uji katalase. Hasil uji menunjukkan bahwa isolat BAL potensial US6 memiliki ciri morfologi koloni dengan bentuk kecil, warna putih susu, elevasi halus, Gram positif dan bentuk sel batang (Gambar 3) serta uji katalase negatif. Pengamatan mikroskopis menunjukkan sel bentuk basil. Sebagai asumsi karena ditumbuhkan pada media MRSA maka tergolong BAL dalam genus Lactobacillus ataupun Leuconostoc.
Gambar 3. Pewarnaan Gram isolat US6 BAL
Hasil identifikasi menunjukkan bahwa isolat US6 berukuran panjang 2,0-5,5 µm dan lebar 0,7-1,0 µm, tumbuh dengan baik pada suhu 25 oC, 30 oC, 37 oC, 40 oC dan 45 oC sedangkan sel tidak mampu tumbuh pada suhu rendah 10 oC, 15
o
Isolat potesial BAL tumbuh baik pada kondisi pH yang beragam yaitu pada pH 4, 5, 6, 7,5 dan 8,5. Pengujian juga dilakukan terhadap ketahanan isolat terhadap kadar NaCl 6,5% dan 18% dimana hasil pegujian menunjukkan isolat US6 tidak tumbuh baik pada kondisi ini. Sukamto (1999) menjelaskan bahwa senyawa NaCl akan terurai dalam air menjadi molekul-molekul penyusunnya yaitu ion Na+ dan Cl-. Ion Na+ sangat dibutuhkan oleh bakteri asam laktat sebagai salah satu faktor pendukung pertumbuhannya. Ion-ion Cl- berikatan dengan air bebas pada bahan yang menyebabkan ketersediaan air dalam bahan berkurang sehingga air bebas yang dapat dimanfaatkan oleh mikroba untuk pertumbuhannya menjadi berkurang dan menyebabkan suasana lingkungan menjadi asam karena terbentuknya senyawa HCl.
Uji biokimia dilakukan terhadap 17 jenis sumber karbon. Media fermentasi harus mengandung senyawa yang dapat dioksidasi dan difermentasikan oleh mikroorganisme. Sebanyak 9 sumber karbon diantaranya selobiosa, fruktosa, galaktosa, laktosa, maltosa, manosa, salisia, sukrosa, amilum menunjukkan hasil positif dengan adanya perubahan warna pada media menjadi kuning dan adanya pembentukan gas dalam tabung durham. Perubahan warna medium menjadi kuning disebabkan karena terkandungnya indikator brom timol blue (BTB) dalam medium. Dimana penambahan indikator BTB ke dalam medium yang mengalami fermentasi karbohidrat oleh bakteri menjadi asam dalam keadaan aerob, maka pH akan turun dan akhirnya indikator BTB ini akan berubah warna menjadi kuning. Sedangkan 8 sumber karbon meliputi arabinosa, glukonat, manitol, melozitosa, melibiosa, rafinosa, ramnosa, ribosa menunjukkan hasil negatif terhadap pengujian. Demikian dijelaskan bahwa isolat bakteri tidak mampu mengoksidasi dan memfermentasi sumber karbon dari jenis karbohidrat tersebut (Tabel 4).