i
TESIS
PEMBERIAN SEL PUNCA MESENKIMAL
WHARTON’S
JELLY INTRAVENA MENINGKATKAN JUMLAH SEL
BETA PANKREAS DAN MENURUNKAN KADAR
GLUKOSA DARAH PUASA PADA TIKUS (RATTUS
NORVEGICUS) JANTAN GALUR WISTAR DIABETES
MELITUS
NADIA PERMATASARI NIM 1390761006
PROGRAM MAGISTER
PROGRAM STUDI ILMU BIOMEDIK
UNIVERSITAS UDAYANA
ii
PEMBERIAN SEL PUNCA MESENKIMAL
WHARTON’S JELLY
INTRAVENA MENINGKATKAN
JUMLAH SEL BETA PANKREAS DAN
MENURUNKAN KADAR GLUKOSA DARAH PUASA
PADA TIKUS (RATTUS NORVEGICUS) JANTAN
GALUR WISTAR DIABETES MELITUS
Tesis ini untuk Memperoleh Gelar Magister pada Program Magister, Program Studi Ilmu Biomedik,
Program Pascasarjana Universitas Udayana
NADIA PERMATASARI NIM 1390761006
PROGRAM MAGISTER
PROGRAM STUDI ILMU BIOMEDIK
KEKHUSUSAN ILMU ANTI AGING MEDICINE
UNIVERSITAS UDAYANA
DENPASAR
iii
Lembar Pengesahan
TESIS INI TELAH DISETUJUI PADA TANGGAL 21 APRIL 2016
Pembimbing I Pembimbing II
Prof. Dr. dr. Wimpie Pangkahila, Sp.And., FAACS Prof. Dr. dr. A.A. G. Budhiarta, Sp.PD-KEMD NIP. 194612131971071001 NIP. 194412211972061001
Mengetahui
Ketua Program Magister Ilmu Biomedik Program Pascasarjana Universitas Udayana
iv
PENETAPAN PUNGUJI
Tesis Ini Telah Diuji pada Tanggal 21 April 2016
Panitia Penguji Tesis Berdasarkan SK Rektor
Universitas Udayana, No.:.…./UN14.4/HK/β016, Tanggal………
Ketua : Prof. Dr. dr. Wimpie Pangkahila, Sp.And, FAACS Sekretaris : Prof. Dr. dr. A. A. G. Budhiarta, Sp.PD-KEMD Anggota :
1. Prof. dr. IGM. Aman, Sp.FK
v UCAPAN TERIMA KASIH
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas berkat, rahmat, karunia serta petunjuk-Nya sehingga penulis dapat menyelesaikan tesis yang berjudul “Pemberian sel punca mesenkimal Wharton’s Jelly intravena meningkatkan jumlah sel beta pankreas dan menurunkan kadar glukosa darah puasa pada tikus (Rattus norvegicus) jantan galur wistar diabetes melitus” dalam
rangka memperoleh gelar Magister pada Program Studi Ilmu Biomedik, kekhususan Anti Aging Medicine, di Program Pascasarjana Universitas Udayana, Denpasar Bali.
Selama penelitian ini, penulis mendapat banyak pengalaman berharga yang memperkaya wawasan, serta sebagai proses pembelajaran hidup penulis baik dari segi ilmiah maupun dari segi sosial. Semua ini tidak lepas dari peran serta orang-orang disekeliling penulis yang senantiasa mendukung dengan tulus dan ikhlas. Pada kesempatan ini, perkenankanlah penulis menyampaikan rasa hormat, penghargaan, dan terimakasih yang sebesar-besarnya kepada :
1. Prof. Dr. dr. Wimpie Pangkahila, Sp.And, FAACS, selaku Pembimbing I, yang dengan penuh perhatian memberikan semangat, bimbingan, waktu dan saran yang sangat berharga selama penulis mengikuti program magister, khususnya dalam penyelesaian tesis ini.
2. Prof. Dr. dr. A. A. G. Budhiarta, Sp.PD-KEMD, selaku Pembimbing II, yang dengan penuh perhatian dan kesabaran memberikan bimbingan, waktu dan saran yang sangat berharga kepada penulis selama penulis mengikuti program magister, khususnya dalam menyelesaikan tesis ini. 3. Prof. dr. IGM. Aman, Sp.FK, selaku Penguji, yang telah memberikan
masukan, saran, sanggahan, dan koreksi yang sangat berharga dalam penyusunan tesis ini dan selama penulis mengikuti program magister. 4. Prof. Dr. dr. J. Alex Pangkahila, M.SC., Sp.And, selaku Penguji, yang
telah memberikan masukan, saran, sanggahan, dan koreksi yang sangat berharga dalam penyusunan tesis ini dan selama penulis mengikuti program magister.
5. Dr. dr. Desak Made Wihandani, M.Kes, selaku Penguji, yang dengan penuh perhatian dan kesabaran memberikan semangat, masukan, saran, sanggahan, dan koreksi yang sangat berharga dalam penyusunan tesis ini dan selama penulis mengikuti program magister.
6. Dr. dr. Gde Ngurah Indraguna Pinatih, MSc, SpGK, selaku Ketua Program Studi Ilmu Biomedik yang telah memberikan kesempatan kepada penulis untuk menuntut ilmu di Program Magister Ilmu Biomedik, Universitas Udayana, Denpasar Bali.
7. Prof. Dr. dr. Ketut Suastika, Sp.PD-KEMD, selaku Rektor Universitas Udayana atas kesempatan dan fasilitas yang diberikan kepada penulis untuk mengikuti dan menyelesaikan pendidikan Program Magister di Universitas Udayana, Denpasar Bali.
vi
kepada penulis untuk menjadi mahasiswi pada Program Magister Ilmu Biomedik, Universitas Udayana, Bali.
9. Indra Bachtiar, PhD, selaku pembimbing dari Stem Cell and Cancer Institute (SCI) PT. Kalbe Farma Tbk., ReGeniC (Regenerative and Celular Therapy) Laboratory Jakarta, yang dengan penuh kesabaran, perhatian dalam memberikan ilmu, semangat, dorongan, saran, doa dan waktu yang sangat berharga untuk penulis dalam menyelesaikan tesis ini. 10.Dr. Harry Murti, selaku staf Stem Cell and Cancer Institute (SCI) PT.
Kalbe Farma Tbk., ReGeniC (Regenerative and Celular Therapy)
Laboratory Jakarta, yang telah meluangkan waktu untuk memberikan ilmu, saran dan masukan kepada penulis dalam penyelesaian tesis ini. 11.Prof. drh. Arief Boediono, PhD, selaku Ketua Program Studi FKH IPB,
yang memberikan kesempatan dan fasilitas kepada penulis untuk menyelesaikan proses penelitian tesis ini.
12.drh. Pita Tarigan, selaku staf dan dokter hewan FKH IPB yang dengan penuh kesabaran membantu secara teknis proses penelitian tesis ini.
13.drh. Subangkit, selaku staf dan dokter hewan FKH IPB yang dengan penuh kesabaran membantu secara teknis proses penelitian tesis ini.
14.Ferbian Siswanto, SKH, selaku staf di Laboratorium Reproduksi FKH Universitas Udayana, yang telah membantu, memberikan saran dan masukan penelitian ini.
15.Ketut Tunas, selaku staf dosen statistik Universitas Udayana yang dengan penuh kesabaran membantu, meluangkan waktu, memberikan ilmu serta saran dalam penyelesaian tesis ini.
16.Yudhi Nugraha S. Putra, M. Biomed, PhD candidate of X-Ray Protein Crystallography, Nara Institue of Science and Technology (NAIST), Japan, yang dengan penuh kesabaran memberikan ilmu, mencarikan jurnal-jurnal terbaru, memberikan saran, semangat dan doa yang sangat berharga kepada penulis selama penyelesaian tesis ini.
17.dr. Wahyu Budi Santosa, PhD candidate of Cancer and Immunotherapy, University of Oxford, United Kingdom, yang telah meluangkan waktu untuk mengkoreksi penulisan dan memberikan saran dalam penyelesaian tesis ini.
18.Dr. dr. Reza Yuridian Purwoko, SpKK, dari Mesenchymal Stem Cell Biology Research Unit, ‘erpour Clinic Jakarta, yang dengan penuh perhatian dan kesabaran meluangkan waktu, memberikan ilmu, semangat, saran kepada penulis selama penyelesaian tesis ini.
19.Iis Rosliana, S.Si, selaku staf Mesenchymal Stem Cell Biology Research Unit, ‘erpour Clinic Jakarta, yang telah meluangkan waktu memberikan ilmu, saran, semangat kepada penulis selama penyelesaian tesis ini.
20.dr. Frans Dany, selaku staf LITBANGKES Jakarta, yang telah meluangkan waktu memberikan ilmu, saran, bantuan, semangat kepada penulis selama penyelesaian tesis ini.
vii
22.dr. Alfred Trimulfa Situmorang, Sp.PD, yang telah meluangkan waktu memberikan ilmu, saran, semangat kepada penulis selama penyelesaian tesis ini.
23.dr. I Made Oka Negara, FIAS, yang telah meluangkan waktu memberikan ilmu, saran, bantuan, semangat, doa yang sangat berharga kepada penulis selama penyelesaian tesis ini dan selama penulis mengikuti program magister.
24.Ayahanda tercinta (Syarifudin, MM) dan Ibunda tercinta (Siti Maryati), atas iringan doa, semangat, perhatian dan kasih sayang yang tulus dan tidak terhingga kepada penulis sehingga penulis mampu menyelesaikan tesis ini.
25.Suami tercinta (Alldila Putra Belia, ST) dan anak-anak tersayang (Erlangga Ario Daniswara dan Mahar Bagas Daniswara), atas doa, dukungan, pengertian, cinta kasih dan pengorbanan yang telah diberikan kepada penulis selama penyelesaian tesis ini.
26.Adik tercinta (Sandi Wijaya, ST, MM), atas doa, semangat, cinta kasih yang tidak terhingga kepada penulis sehingga penulis mampu menyelesaikan tesis ini.
27.Seluruh Dosen Ilmu Biomedik Universitas Udayana Bali, yang telah memberikan ilmu yang sangat berharga dan bermanfaat.
28.Para staf Ilmu Biomedik Universitas Udayana Bali, yang telah mendukung, memberikan informasi dan bantuan kepada penulis mulai dari awal sampai akhir menuntut ilmu di bagian Biomedik.
29.Teman-teman angkatan 7, 8, 9 dan 10 Anti Aging Medicine Universitas Udayana, terutama dr. Henrita Ernestia, dr. Soraya Simatupang, dr. Veny Larasati M.Biomed AAM, dr. Lydia M.Biomed AAM, dr. Lisa Silvani M.Biomed AAM, dr. Putu Oka Sidharta, dr. Herna, dr. Fatima Zahra, dr. Orlen Plaudo Sompotan dan dr. Dewi Anggreani Indra M.Biomed AAM yang telah memberikan saran dan dukungan selama penyusunan tesis ini berlangsung.
Semoga Tuhan Yang Maha Esa senantiasa memberikan rahmat-Nya kepada semua pihak yang telah membantu penyelesaian tesis ini. Penulis menyadari bahwa tesis ini jauh dari sempurna, karena itu penulis mengharapkan kritik dan saran yang membangun. Akhir kata penulis ucapkan, semoga hasil penelitian ini dapat memberikan manfaat bagi perkembangan ilmu pengetahuan.
viii
Penulis,
ix
ABSTRAK
PEMBERIAN SEL PUNCA MESENKIMAL WHARTON’S JELLY INTRAVENA MENINGKATKAN JUMLAH SEL BETA PANKREAS DAN
MENURUNKAN KADAR GLUKOSA DARAH PUASA PADA TIKUS (RATTUS NORVEGICUS) JANTAN GALUR WISTAR DIABETES
MELITUS
Diabetes melitus adalah penyakit metabolik yang ditandai dengan hiperglikemik dan kelainan metabolisme karbohidrat, protein dan lemak karena kelainan sekresi insulin, sensitivitas insulin atau keduanya. Berdasarkan penelitian sebelumnya, sel punca mesenkimal Wharton’s Jelly memiliki kemampuan anti-inflammatory, imunoregulasi yang dapat memperbaiki kontrol metabolik serta memiliki kemampuan berdiferensiasi menjadi pancreatic lineage cells yang berfungsi sebagai insulin-producing cells pada kultur in vitro. Tujuan penelitian ini adalah untuk membuktikkan bahwa pemberian sel punca mesenkimal Wharton’s Jelly dapat meningkatkan jumlah sel beta pankreas dan menurunkan kadar glukosa darah puasa pada tikus (Rattus norvegicus) jantan galur wistar diabetes melitus.
Rancangan penelitian yang digunakan adalah eksperimental murni dengan
post test only control group design menggunakan 36 ekor tikus putih jantan. Semua sampel diinduksi dengan Streptozotocin dan Nicotinamide. Sampel yang dipilih dibagi menjadi dua kelompok yaitu kelompok kontrol yang diberikan glibenklamid + NaCl 0,9% dan kelompok perlakuan yang diberikan glibenklamid + sel punca mesenkimal Wharton’s Jelly. Perhitungan jumlah sel beta pankreas dan pengukuran kadar glukosa darah dilakuan setelah 14 hari perlakuan.
Hasil penelitian menunjukkan bahwa pada kelompok perlakuan memiliki jumlah sel beta pankreas yang lebih tinggi dibandingkan dengan kelompok kontrol (105,17±16,379 sel/ lapang pandang vs 54,00±11,366 sel/ lapang pandang) (p< 0,001). Selain itu, kelompok perlakuan memiliki kadar glukosa darah puasa yang lebih rendah dibandingkan dengan kelompok kontrol (109,06±16,71 mg/dl vs 122,78±10,14 mg/dl) (p<0,05).
Disimpulkan bahwa pemberian sel punca mesenkimal Wharton’s Jelly intravena meningkatkan jumlah sel beta pankreas dan menurunkan kadar glukosa darah puasa pada tikus (Rattus norvegicus) jantan galur wistar diabetes melitus.
x
ABSTRACT
ADMINISTRATION OF WHARTON’S JELLY MESENCHYMAL STEM
CELL INTRAVENOUSLY INCREASE NUMBER OF PANCREATIC BETA CELL AND REDUCE FASTING BLOOD GLUCOSE LEVEL IN RAT
(RATTUS NORVEGICUS) MALE WISTAR STRAIN DIABETES MELLITUS
Diabetes mellitus is a metabolic disease characterized by hyperglycemic and abnormal metabolism of carbohydrates, protein and lipid due to abnormal insulin secretion, insulin sensitivity or both. Based on previous research, Wharton’s Jelly mesenchymal stem cells have anti-inflammatory, imunoregulation that can improve metabolic control and have the ability to differentiate into pancreatic lineage cells that function as insulin-producing cells in in vitro culture. The purpose of this study is to prove that the administration of Wharton’s Jelly mesenchymal stem cells can increase number of pancreatic beta cell and reduce fasting blood glucose level in rat (Rattus norvegicus) male wistar strain diabetes mellitus.
The design of the study was a true experimental with post test only control group design using 36 male rats. All samples induced by Streptozotocin and Nicotinamide. Selected samples were divided into two groups: the control group was given glibenclamide + NaCl 0.9% and the treatment group was given glibenclamide + Wharton’s Jelly mesenchymal stem cells. The calculation of the number of pancreatic β cells and measurement of fasting blood glucose level was done after 14 days of treatment.
The results showed that in the treatment group had a number of pancreatic beta cells higher than the control group (105.17 ± 16.379 cells / visual field vs 54.00 ± 11.366 cells / visual field) (p <0.001). In addition, the treatment group had a fasting blood glucose level lower compared with the control group (109.06 ± 16.71 mg / dl vs 122.78 ± 10,14 mg / dl) (p <0.001).
It was concluded that the administration of Wharton’s Jelly mesenchymal stem cells intravenously increase number of pancreatic beta cell and reduce fasting blood glucose level in rat (Rattus norvegicus) male wistar strain diabetes mellitus.
xii
2.3.1 Mekanisme Kematian Sel β Pankreas pada Diabetes Melitus Tipe 1 dan 2…...……... 9
2.3.2 Kriteria Diagnosis Diabetes Melitus...………... 10
2.3.3 Intervensi Farmakologis Diabetes Melitus... 11
2.4 Sel Punca... 11
2.4.1 Karakteristik Sel Punca... 11
2.4.2 Jenis Sel Punca... 12
2.4.2.1 Sel Punca Embrionik (Embrionic Stem Cell). 12
2.4.2.2 Sel Punca Dewasa (Adult Stem Cell)..……... 13
2.4.3
Homing………..…... 15
2.4.4 Mekanisme Regenerasi Jaringan oleh Sel Punca... 16
2.5 Sel Punca Mesenkimal………...
2.5.3 Tingkat Keamanan Sel Punca Mesenkimal
pada Aplikasi Klinis……….. 21
2.5.4 Diabetes melitus mengganggu potensi angiogenik pada adipose-derived stemcell... 22
2.5.5 Penurunan Karakteristik Sel
Punca Mesenkimal………... 23
2.6 Sel Punca Mesenkimal Wharton’s Jelly (Wharton’s Jelly Messenchymal Stem Cell/ WJ-MSC)…... 23
2.6.1 Isolasi Sel Punca Mesenkimal Wharton’s Jelly……. 25
2.6.2 Sel Punca Mesenkimal Wharton’s Jelly
berdiferensiasi menjadi Insulin Producing Cells
In Vitro………...
xiii
2.6.3 Efek dan Keamaan Transplantasi Sel Punca
Mesenkimal Wharton’s Jelly... 28
2.6.4 Jalur pemberian sel punca mesenkimal wharton’s
jelly... 29
2.7 Hewan Percobaan………..……….
31
xiv
4.5 Bahan dan Alat Penelitian……….. 43
4.6.2 Perhitungan dosis sel punca mesenkimal untuk subyek
Penelitian………
46
4.6.3 Cara pemeriksaan kadar glukosa darah puasa tikus... 46
4.6.4 Cara Pembuatan Histopatologi Jaringan Pankreas…. 46 4.6.5 Prosedur pewarnaan Gomori Chrome
xv
BAB VI SIMPULAN DAN SARAN
6.1
Simpulan………. 68
6.2 Saran………...
68
DAFTAR PUSTAKA………...
69
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Analisis Statistik dengan SPSS……… 70
Lampiran 2 Sertifikat POM……….
73
Lampiran 3 Animal Model………
74
Lampiran 4 Hasil Pemeriksaan Imunohistokimia Sel Beta Pankreas………….. 76
Lampiran 5 Ethical Clearance dengan Judul Penelitian “Pemberian Sel Punca
xvii
DAFTAR SINGKATAN
AdMSCs : Adipose Tissue-derived Mesenchymal Stem Cells
ASC : Angiogenik Adipose-Serived Stem Cell
BM : Bone Marrow
BM-MSCs : Bone Marrow Derived Mesenchymal Stem Cells
BMSC : Bone Marrow Stem Cell
CD : Cell Differentiation
DM : Diabetes Melitus
EPC : Endothelial Progenitor Cell
ESRD : End-Stage Renal Disease
GDP : Glukosa Darah Puasa
h AdMSCs : human Adipose Tissue-derived Mesenchymal Stem Cells
hESCs : human Embryonic Stem Cells
HIF-1α : Hypoxia-Inducible Factor 1-Alpha
hMSC : human Mesenchymal Stem Cell
HUCPVCs : Human Umbilical Cord Perivascular Cells
huMSC : human Mesenchymal Stem Cell
IDDM : Insulin Dependent Diabetes Mellitus
IFN- : Interferon- IL-1β : Interleukin-1β
IPC : Insulin Producing Cell
M-CSF : Macrophag-Colony Stimulating Factor
MSC : Mesenchymal Stem Cell
NIDDM : Non-dependent Diabetes Mellitus
NeuroD1 : Neurogenic Differentiation 1
NF-κB : Nuclear Factor-κ B NK : Natural Killer
NO : Nitric Oxide
PDX-1 : Pancreatic and Duodenal Homebox 1
RT-PCR : Real Time-Polymerase Chain Reaction
SH2 : Src Homology 2
SH3 : Src Homology 3
STAT1 : Signal Transducer and Activator of Transcription 1 TNF-α : Tumor Necrosis Factor-α
UC : Umbilical Cord
VEGF : Vascular Endothelial Growth Factor
xviii
DAFTAR TABEL
Halaman
1.1 Diferensiasi dari beberapa Populasi Sel Punca Mesenkimal Menjadi Islet-like
Cells……….…β0
5.1 Hasil Analisis Deskriptif Data Jumlah Sel Beta Pankreas………...55
5.2 Hasil Analisis Deskriptif Data Kadar Glukosa Darah Puasa………...55
5.3 Hasil Uji Normalitas Data sel beta
pankreas………..……….56
5.4 Hasil Uji Normalitas Data Glukosa Darah Puasa……...……….57
5.5 Hasil Uji Homogenitas Data Jumlah Sel Beta Pankreas antar Kelompok...57
5.6 Hasil Uji Homogenitas Data Kadar Glukosa Darah Puasa antar
Kelompok………..………. .58
5.7 Rerata Jumlah Sel Beta Pankreas antar Kelompok Sesudah Perlakuan……. 58
xix
DAFTAR GAMBAR
Halaman
Gambar 2.1 Perbedaan persentase jumlah sel yang berdiferensiasi menjadiadipogenik dan osteogenik ADSC pada pasien
DM dan non DM………..……… 22
Gambar 2.2 Sel punca mesenkimal wharton’s jelly……….. 25
Gambar 2.3 Isolasi dari sel punca mesenkimal wharton’s
jelly………..β5
Gambar 2.4 Kultur sel punca mesenkimal wharton’s jelly hari 1,3 dan 5 setelah passase hari ke
β1………β6
Gambar 2.5 Isolasi dan karakteristik dari WJ-MSC……….. 26
Gambar 2.6 Hasil Diferensiasi………... 27
Gambar 2.7 Kadar glycated hemoglobin, glukosa puasa dan glukosa 2 jam post prandial selama 1β bulan periode penelitian……….. 28
Gambar 2.8 Adhesi MSC pada pulau pankreas……… 30
Gambar 2.9 Evaluasi persentase survival MSC pada pulau pankreas……...…… 48
Gambar 3.1 Konsep Penelitian………..
34
Gambar 4.1 Bagan Alur
Penelitian………..51
Gambar 5.1 Imunohistokimia Pankreas Tikus Kelompok P0……… 54
Gambar 5.2 Imunohistokimia Pankreas Tikus Kelompok P1……… 54
Gambar 5.3 Grafik Perbandingan Jumlah Sel Beta Pankreas Sesudah Perlakuan
antar Kelompok………..
59
Gambar 5.4 Grafik Perbandingan Kadar Glukosa Darah Puasa Sesudah Perlakuan
1
BAB I
PENDAHULUAN
1.1 Latar Belakang
Penuaan adalah proses alami yang terjadi pada mahluk hidup termasuk manu-sia. Siklus ini ditandai dengan mulai menurunnya berbagai fungsi organ tubuh. Penurunan secara progresif ini akan membuat manusia kehilangan daya tahan ter-hadap infeksi dan akan terjadi penumpukan distorsi metabolisme struktural yang dapat menimbulkan penyakit degeneratif (seperti hipertensi, diabetes melitus, kanker, dan lain-lain). Proses penuaan sesungguhnya dapat dicegah, diperlambat atau dihambat bahkan dikembalikan ke kondisi awal yang optimal. Kesadaran ten-tang pentingnya menjaga kesehatan dan menghindari berbagai faktor penyebab proses penuaan dilengkapi dengan pengobatan di negara-negara maju lebih tinggi daripada di negara berkembang sehingga usia harapan hidup di negara maju lebih tinggi daripada di negara berkembang (Pangkahila, 2011).
Salah satu bentuk penurunan fungsi organ akibat proses penuaan adalah tim-bulnya penyakit-penyakit metabolik seperti diabetes melitus, obesitas dan hipertensi. Diabetes melitus (DM) sering dianggap sebagai model biologi proses penuaan dini. Penderita DM lebih awal mengalami proses patologik, yang pada nondiabetes terjadi pada usia jauh lebih lanjut. Oleh karena itu, usia harapan hidup pada pasien DM akan lebih pendek (Pangkahila, 2011).
in-2
sulin atau kedua-duanya (Perkeni, 2011). DM mempengaruhi banyak organ uta-ma, termasuk jantung, pembuluh darah, saraf, mata dan ginjal. Tujuan dari tatalaksana DM adalah untuk mengontrol kadar glukosa darah dalam batas normal dan membantu mencegah komplikasi dini. Komplikasi DM jangka panjang pada akhirnya dapat mengancam jiwa (Nirmala, 2014).
Berbagai penelitian epidemiologi menunjukkan adanya kecenderungan pen-ingkatan angka insidensi dan prevalensi DM tipe 2 di berbagai penjuru dunia. WHO memprediksi kenaikan jumlah penyandang DM di Indonesia dari 8,4 juta pada tahun 2000 menjadi sekitar 21,3 juta pada tahun 2030. Laporan tersebut menunjukkan adanya peningkatan jumlah penyandang DM sebanyak 2-3 kali lipat pada tahun 2030 (Perkeni, 2011).
Berbagai jenis pengobatan antidiabetik telah digunakan selama berabad-abad untuk mengobati penyakit diabetes. Namun, pada beberapa penderita DM sangat sulit untuk mendapat kontrol glukosa dalam batas normal dan kebanyakan dari penderita ini akan membutuhkan terapi insulin (Liu dkk., 2014). Tetapi penggunaan terapi insulin dalam kehidupan sehari-hari sering menyebabkan epi-sode hipoglikemik (Perkeni, 2011). Transplantasi pankreas adalah salah satu tera-pi yang menjanjikan untuk mencegah diabetes retinopati dan berbagai komplikasi lainnya. Namun, tranplantasi pankreas ini memiliki resiko penolakan oleh sistem imun tubuh (Wang dkk., 2011).
Uni-3
versitas California) dkk berhasil membuat galur murni sel punca embrionik manu-sia yang terbukti mampu berdiferenmanu-siasi menjadi sel-sel yang berasal dari ketiga lapisan embrional. Sel punca embrionik ini telah banyak diteliti dan terbukti ber-potensi untuk membentuk populasi sel yang dapat menghasilkan insulin. Namun, penggunaan sel punca embrionik selalu terbentur dengan masalah etika dan poten-si tumorigenik yang dimilikinya. Oleh sebab itu, para peneliti dan praktipoten-si medis berupaya menggunakan sel punca jenis lain, yaitu sel punca yang tergolong se-bagai sel punca dewasa (Halim dkk., 2010).
Beberapa tahun terakhir penelitian mengenai sel punca mesenkimal ( Mesen-chymal Stem Cell/ MSC) sangat berkembang. Dalam hal ini MSC muncul sebagai kandidat yang menarik untuk berbagai aplikasi terapi. Beberapa studi binatang dan uji klinik menunjukkan bahwa transplantasi sel punca mesenkimal dapat memperbaiki kontrol glikemik dan fungsi sel beta pankreas melalui perbaikan in-flamasi dan imunoregulasi (Liu dkk., 2014).
4
Beberapa tahun terakhir ini sel punca mesenkimal Wharton’s Jelly ( Whar-ton’s Jelly Mesenchymal Stem Cell/ WJ-MSC) dari tali pusat mendapat perhatian yang sangat besar karena sel dapat dengan mudah diisolasi (non-invasive proce-dure), tidak terbentur masalah etika dan berasal dari jaringan yang didapat setelah lahir sehingga tidak terdapat penurunan karakteristik MSC (Wang dkk., 2004). WJ-MSC memungkinkan untuk digunakan sebagai alternatif klinis dari sel punca mesenkimal sumsum tulang (bone marrow derived mesenchymal stem cell/ BMMSCs) karena memiliki aksesibilitas yang lebih baik, potensi ekspansi yang lebih tinggi dan imunogenisitas rendah (Quintiliano, 2010).
Sel punca mesenkimal Wharton’s Jelly dapat berdiferensiasi menjadi
Insulin-Producing Cell. Insulin-Insulin-Producing Cells dapat melepaskan insulin dan C-peptide. Implantasi dari MSC yang telah berdiferensiasi ke dalam tikus model diabetes dapat menurunkan kadar glukosa ke tingkat normal. Oleh karena itu IPCs yang berasal dari induksi MSC terlihat sebagai sumber yang sel β yang ideal untuk ter-api cell replacement pada diabetes (Wu dkk., 2014).
5
Penelitian tentang manfaat dan keamanan transplantasi WJ-MSC pada pasien DM tipe 2 menunjukkan bahwa WJ-MSC dapat menurunkan kadar glukosa, memperbaiki kadar C-peptide dan fungsi sel beta, serta menurunkan penanda in-flamasi sistemik dan jumlah T limfosit. Dengan semakin banyaknya penelitian ilmiah diharapkan WJ-MSC akan menjadi agen terapeutik baru untuk pe-natalaksanaan DM (Liu dkk.,2014).
1.2 Rumusan Masalah
Berdasarkan uraian latar belakang di atas maka rumusan masalah pada penelitian ini adalah:
1.Apakah pemberian sel punca mesenkimal Wharton’s Jelly intravena dapat meningkatkan jumlah sel beta pankreas tikus (Rattus norvegicus) jantan ga-lur wistar diabetes melitus?
2.Apakah pemberian sel punca mesenkimal Wharton’s Jelly intravena dapat menurunkan kadar glukosa darah puasa pada tikus (Rattus norvegicus) jantan galur wistar diabetes melitus?
1.3 Tujuan Penelitian
1.3.1 Tujuan umum
Untuk mengetahui efek pemberian sel punca mesenkimal Wharton’s Jelly
6
1.3.2 Tujuan khusus
Tujuan khusus dari penelitian ini adalah untuk membuktikan:
1. Pemberian sel punca mesenkimal Wharton’s Jelly intravena dapat meningkatkan jumlah sel beta pankreas tikus (Rattus norvegicus) jantan galur wistar diabetes melitus.
2. Pemberian sel punca mesenkimal Wharton’s Jelly intravena dapat menurunkan kadar glukosa darah puasa pada tikus (Rattus norvegicus) jantan galur wistar diabetes melitus.
1.4 Manfaat penelitian
Manfaat yang diharapkan dari penelitian ini adalah:
1.4.1 Manfaat ilmiah
Memberikan wawasan pengetahuan tentang pengaruh pemberian sel punca mesenkimal Wharton’s Jelly intravena dalam dunia kedokteran khususnya dalam mengobati pasien DM.
1.4.2 Manfaat aplikatif
7
BAB II
KAJIAN PUSTAKA
2.1 Penuaan
Setelah mencapai usia dewasa, secara alami seluruh komponen tubuh tidak dapat berkembang lagi. Sebaliknya terjadi penurunan akibat proses penuaan. Pada umumnya menjadi tua dianggap hal yang lumrah sehingga semua masalah yang mun-cul dianggap memang seharusnya dialami. Padahal terdapat banyak faktor yang ber-pengaruh terhadap proses penuaan. Faktor-faktor ini dapat dibagi menjadi faktor in-ternal dan faktor eksin-ternal. Beberapa faktor inin-ternal adalah radikal bebas, hormon yang berkurang, dan genetik. Faktor eksternal yang utama adalah pola hidup yang tidak sehat, polusi lingkungan dan stres. Faktor-faktor ini dapat dicegah, diperlambat bahkan mungkin dihambat sehingga kualitas hidup dapat dipertahankan. Lebih jauh lagi usia harapan hidup dapat lebih panjang dengan kualitas hidup yang baik (Pangkahila, 2011).
8
2.2 Penyakit Degeneratif
Penyakit degeneratif adalah istilah medis untuk menjelaskan suatu penyakit yang muncul akibat proses kemunduran fungsi sel tubuh, dari keadaan normal menjadi lebih buruk. Dari berbagai hasil penelitian modern diketahui bahwa munculnya pen-yakit degeneratif memiliki hubungan yang cukup kuat dengan bertambahnya usia seseorang. Penyakit degeneratif dapat dikaitkan pula sebagai penyakit yang mengiringi proses penuaan (Karyani, 2003).
Hal yang menyebabkan terjadinya penyakit degeneratif adalah kerusakan sel-sel dalam jaringan/ organ, sehingga jaringan/ organ tersebut tidak lagi berfungsi sesuai dengan kebutuhan tubuh. Kerusakan ini bersifat irreversible, sehingga obat-obatan yang pada saat ini tersedia, hanya dapat memperlambat atau mencegah terjadinya ke-rusakan jaringan/ organ yang lebih luas (Halim dkk., 2010).
Penyakit degeneratif dapat terjadi karena adanya proses penuaan, tidak termasuk penyakit menular dan berlangsung kronis seperti penyakit jantung coroner, hipertensi, diabetes melitus, obesitas dan lainnya (Powers, 2008).
2.3 Diabetes melitus
Diabetes melitus merupakan suatu kelompok penyakit metabolik dengan karak-teristik hiperglikemia yang terjadi karena kelainan sekresi insulin, kerja insulin atau kedua-duanya (Perkeni, 2011).
9
a. Diabetes melitus Tipe 1 atau Insulin Dependent Diabetes Mellitus/ IDDM. DM tipe 1 terjadi karena adanya destruksi sel beta pankreas karena sebab autoimun.
b. Diabetes melitus tipe 2 atau Insulin Non-dependent Diabetes Mellitus/ NIDDM. Pada penderita DM tipe ini terjadi hiperinsulinemia tetapi insulin tidak bisa membawa glukosa masuk ke dalam jaringan karena terjadi resistensi insulin yang merupakan turunnya kemampuan insulin untuk merangsang pengambilan glukosa oleh jaringan perifer dan un-tuk menghambat produksi glukosa oleh hati.
c. Diabetes melitus tipe lain. DM tipe ini terjadi karena etiologi lain, misalnya pada defek genetik fungsi sel beta, defek genetik kerja insu-lin, penyakit eksokrin pankreas, penyakit metabolik endokrin lain, iat-rogenik, infeksi virus, penyakit autoimun dan kelainan genetik lain.
d. Diabetes melitus gestasional. DM tipe ini terjadi selama masa kehami-lan, dimana intoleransi glukosa didapati pertama kali pada masa ke-hamilan, biasanya pada trimester kedua dan ketiga.
2.3.1 Mekanisme kematian sel βpankreas pada diabetes melitus tipe 1 dan 2
10
tumor necrosis factor (TNF)-α, dan interferon (IFN)- . Apoptosis IL-1β dan/ atau TNF-α plus IFN- induce β-cell terjadi melalui aktivasi dari β-cell gene dibawah kontrol faktor trasnkripsi NF-κB dan STAT-1. Aktivasi NF-κB menyebabkan produksi dari nitric oxide (NO) dan chemokines serta deplesi dari kalsium retikulum endoplasma. Kematian sel β ini terjadi karena aktivasi dari mitogen-activated protein kinase, yang dipacu oleh stress pada retikulum endoplasma serta pelepasan mitochon-drial death signals. Paparan kronik yang menyebabkan kenaikan kadar glukosa dan asam lemak bebas menyebabkan disfungsi dari sel β serta dapat menginduksi apopto-sis sel β pada DM tipe 2. Paparan kadar glukosa yang tinggi memiliki dua efek, yaitu memacu hipersensitisasi glukosa pada tahap awal dan kemudian apoptosis melalui mekanisme yang berbeda. Asam lemak bebas menyebabkan apoptosis sel β melalui stress pada retikulum endoplasma (Cnop dkk., 2005).
2.3.2 Kriteria diagnosis diabetes melitus
11
2.3.3 Intervensi farmakologis diabetes melitus
Dalam konsensus pengelolaan dan pencegahan DM tipe 2 di Indonesia 2011, pe-natalaksanaan dan pengelolaan DM dititikberatkan pada 4 pilar pepe-natalaksanaan DM, yaitu: edukasi, terapi gizi medis, latihan jasmani dan intervensi farmakologis (Perkeni, 2011).
2.4 Sel Punca
Perkembangan sel punca di dunia medis dimulai sejak tahun 1950-an, yaitu ketika ditemukannya sel-sel penyusun sumsum tulang yang mampu membentuk seluruh jenis sel darah dalam tubuh manusia. Secara etimologi, sel punca dapat diartikan se-bagai sel yang menjadi awal mula dari pertumbuhan sel lain yang menyusun kese-luruhan tubuh organisme, termasuk manusia. Selain itu, sel punca juga merupakan awal dari pertumbuhan berbagai jenis sel penyusun tubuh. Dalam bahasa Indonesia, kata punca berarti awal mula. Makna yang terkandung dalam kata sel punca, semakin diteguhkan dengan penemuan keberadaan sel punca pada awal kehidupan manusia, yaitu saat masih embrio. Hal ini tentu semakin menegaskan bahwa sel punca adalah sel yang menjadi awal mula terbentuknya 200 jenis sel yang menyusun tubuh (Halim dkk., 2010).
2.4.1 Karakteristik sel punca
12
1. Belum berdiferensiasi (undifferentiated), yaitu belum memiliki bentuk dan fungsi spesifik layaknya sel-sel lain pada organ tubuh (Halim dkk.,2010). 2. Mampu memperbanyak diri sendiri (self renewal), yang berarti bahwa sel
pun-ca dapat melakukan replikasi dan menghasilkan sel-sel yang mempunyai karakteristik sama dengan sel induknya. Populasi sel punca dalam tubuh terja-ga denterja-gan kemampuannya memperbanyak diri sendiri. Kemampuan ini dapat dilakukan berulang kali, bahkan diduga tidak terbatas. Selain itu, kemampuan ini juga dipertahankan dalam jangka waktu yang panjang (Halim dkk., 2010). 3. Berdiferensiasi menjadi lebih dari satu jenis sel (multipoten atau pluripoten);
bersifat pluripoten apabila stem cell mampu berdiferensiasi menjadi sel tubuh apa pun yang berasal dari ketiga lapisan embrional (ektoderm, mesoderm, dan endoderm); dan sel punca bersifat multipoten apabila mampu berdiferensiasi menjadi beberapa jenis sel yang biasanya berada dalam satu golongan serupa, misalnya sel-sel sistem hematopoietik atau sistem saraf (Halim dkk.,2010).
2.4.2 Jenis sel punca
Berdasarkan tingkat maturasi tubuh yang menjadi sumber keberadaannya, secara praktis sel punca dibagi menjadi dua jenis, yaitu sel punca embrionik (embryonic stem cell) dan sel punca dewasa (adult stem cell) (Halim dkk., 2010).
2.4.2.1 Sel punca embrionik (embryonic stem cell)
13
dalam (inner cell mass) yang terdapat dalam blastosis. Inner cell mass terbentuk saat embrio berusia 3-5 hari, yaitu saat blastosis terbentuk dan akan mengimplantasikan dirinya ke dalam dinding rahim. Dalam tahap perkembangan selanjutnya, sel-sel ini akan berdiferensiasi menjadi sel-sel yang lebih dewasa, yang memiliki kemampuan proliferasi dan diferensiasi yang lebih rendah dibandingkan sel punca embrionik. Sel punca embrionik merupakan awal dari seluruh jenis sel dalam tubuh manusia. Sel punca embrionik tergolong sebagai sel punca yang bersifat pluripoten. Selain sifatnya yang pluripoten, sel punca embrionik juga memiliki daya proliferasi yang tinggi, te-lomer yang panjang, dan aktivitas enzim tete-lomerase yang tinggi (Halim dkk., 2010). 2.4.2.2 Sel punca dewasa (adult stem cell)
14
Beberapa contoh alur diferensiasi dari sel punca dewasa: 1. Sel Punca Hematopoietik
Adalah sel yang mampu membentuk seluruh progenitor sel darah, demi terselenggaranya hematopoiesis dan fungsi imun tubuh. Dengan demikian, sel ini bisa dikatakan sebagai induk dari segala jenis sel darah yang beredar dalam tubuh manusia. Sel punca hematopoietik merupakan hasil dari diferensiasi hemangioblast, yang juga dapat ber-diferensiasi menjadi progenitor sel endotel. Oleh karena itu, sel punca hematopoietik memiliki beberapa kesamaan sifat, terutama dalam hal ekspresi protein permukaan, dengan progenitor sel endotel. Sel punca hematopoietik mampu berdiferensiasi menjadi seluruh jenis sel darah, seperti eritrosit, trombosit, monosit, neutrofil, basofil, eosinofil, lim-fosit B, limlim-fosit T, dan natural killer (NK) cell (Halim dkk., 2010) 2. Sel Punca Jaringan Saraf (Neural):
Mampu berdiferensiasi menjadi tiga golongan utama sel saraf, yaitu astrost, oligodendrosit, dan neuron. Selain itu, sel punca jaringan saraf juga mampu berdiferensiasi menjadi kelompok sel saraf yang memiliki aktivitas dopaminergik (Halim dkk., 2010).
3. Sel Punca Jaringan Kulit:
15
keratinosit, dan sel penyusun lapisan epidermis kulit (Halim dkk., 2010).
4. Sel Punca Mesenkimal:
Mampu berdiferensiasi menjadi osteosit, kondrosit, adiposit, dan berbagai jenis sel penyusun jaringan ikat (Halim dkk., 2010).
5. Sel Punca Jantung:
Mampu berdiferensiasi menjadi tiga jenis sel utama penyusun or-gan jantung, yaitu endotel, kardiomiosit, dan sel otot polos (Halim dkk., 2010).
Khusus untuk sel punca dewasa, walaupun telah disebutkan sebelumnya bahwa potensi diferensiasi yang telah dimilikinya hanya tergolong multipotent, namun jurnal-jurnal ilmiah beberapa tahun terakhir ini: menyatakan bukti dapat terjadinya transdiferensiasi (Halim dkk., 2010).
2.4.3 Homing
16
yang terbukti segera menuju jaringan tubuh hewan yang rusak. Pada penyelidikan selanjutnya, aktivitas sel punca seperti ini diduga dipengaruhi oleh adanya protein spesifik yang dilepaskan oleh sel-sel tubuh yang rusak sebagai bentuk komunikasi seluler. Protein ini bersifat kemoatraktif, sehingga mampu menarik sel punca yang berada di peredaran pembuluh darah, untuk menuju ke arah keberadaan proteinnya (Halim dkk., 2010).
2.4.4 Mekanisme regenerasi jaringan oleh sel punca
17
2.5 Sel Punca Mesenkimal (Mesenchymal Stem Cell/ MSC)
18
dan secara tidak langsung dengan mendukung revaskularisasi, melindungi jaringan dari stres yang disebabkan apoptosis, dan modulasi reaksi inflamasi. Uji klinis hasil terapi berbasis sel MSC di berbagai bidang klinis berdasarkan in vitro dan in vivo te-lah lebih dari 400 yang terdaftar (Kalaszczynska dkk., 2015).
Mesenchymal stem cell awalnya diisolasi dari sumsum tulang (Bone Marrow/ BM) dan populasi sel ini masih dianggap sebagai standar emas untuk aplikasi MSC. Namun demikian BM memiliki beberapa keterbatasan sebagai sumber MSC, terma-suk jumlah MSC yang rendah, prosedur isolasi yang sangat invasif dan terdapat penurunan karakteristik MSC sesuai dengan usia donor. Sejumlah sel punca di-perkirakan mengalami degenerasi seiring dengan semakin lanjut usia, sehingga me-nyebabkan jumlah dalam populasinya pun berkurang. Oleh karena itu para peneliti mencari dan mengidentifikasi sumber-sumber alternatif lainnya untuk MSC (Hass dkk., 2011).
2.5.1 Karakteristik sel punca mesenkimal
Agar dapat dikarakteristikan sebagai MSC, sel harus memiliki karakteristik mampu untuk menempel pada cawan kultur plastik, mengekspresikan antigen membran CD105, CD73, CD90, dan sedikitnya ekspresi CD45 dan CD34, serta mampu berdiferensiasi menjadi garis keturunan kondrogenik dan adipogenik (Halim dkk., 2010).
19
Schuldiner dkk menunjukkan bahwa human embryonic stem cells (hESCs) dapat
berdiferensiasi secara spontan menjadi menjadi IPCs pada saat dikultur. Assady dkk
juga melaporkan bahwa adherent hESCs dapat mengeskpresikan insulin pada saat
dikultur. Namun, efisiensi pola diferensiasi spontan ini masih sangat rendah.
Bebera-pa peneliti menggunakan manipulasi gen untuk memperbaiki efisiensi islet-cell
transduction dengan overexpression dari Pdx1 (pancreatic β-cell development gene)
atau Ngn3. Namun, metode ini memiliki kekurangan untuk digunakan sebagai terapi
sel karena terdapat kontaminasi eksogenus pada DNA. Terdapat 3 tahap
perkem-bangan penting dalam regenerasi sel β pankreas: tahap pertama dengan menginduksi
sel punca menjadi lapisan endoderm definitif, tahap kedua dengan menjadi pancreatic
progenitors atau endocrine progenitors dan tahap ketiga menjadi sel β pankreas.
Masing-masing tahapan terdapat faktor-faktor yang menginduksi diferensiasi.
Se-bagai contoh, Activin A, yang telah digunakan untuk diferensiasi hES menjadi garis
keturunan endoderm, adalah faktor penting untuk diferensiasi endoderm definit pada
sel punca embrionik tikus dan manusia (Wu dkk, 2014).
Sel punca mesenkimal Wharton’s Jelly dapat berdiferensiasi menjadi IPC. Chao dkk mendiferensiasikan WJ-MSC menjadi IPC melalui beberapa tahap kultur menggunakan neuroconditioned medium. Wu dkk melakukan studi banding dengan membandingkan kemampuan WJ-MSC dan BM-MSC berdiferensiasi menjadi IPC
nico-20
tinamide, activin, HGF, exendin-4 dan pentagastrin. Para peneliti tersebut menemukan ekspresi Pdx-1 pada differentiated WJ-MSC yang lebih tinggi dibanding dengan differentiated BM-MSC (Anzalone dkk., 2011).
Human umbilical cord MSC dapat berdiferensiasi menjadi IPCs dibawah medi-um diferensiasi. Wu dkk menggunakan one-step method untuk membentuk islet-like cell cluster yang dapat mengeskpresikan faktor transkripsi pancreatic-specific PDX-1 dan pancreatic-specific marker C-peptide. Medium diferensiasi mengandung suatu jenis hormon pentagastrin selain faktor yang biasanya digunakan seperti activin-A, exendin-4, HGF. Dibawah medium diferensiasi yang sama, bone marrow mesenchy-mal stem cells (BMMSCs) membentuk islet-like cluster yang lebih kecil dan ekspresi pdx-1 sertaC-peptide yang lebih rendah. Tiga langkah induksi spesifik WJ-MSC dapat membentuk insulin-producing cells tanpa pembentukan islet-like cells cluster
(Wu dkk., 2014).
Tabel 1.1
21
Induced Insulin-Producing Cells dapat melepaskan insulin dan C-peptide. Im-plantasi dari MSC yang telah berdiferensiasi ke dalam tikus model diabetes dapat menurunkan kadar glukosa ke tingkat normal. Oleh karena itu IPCs yang berasal dari induksi MSC terlihat sebagai sumber yang sel β yang ideal untuk terapi cell replace-ment pada diabetes (Wu dkk, 2014).
2.5.3 Tingkat keamanan sel punca mesenkimal pada aplikasi kilnis
22
Untuk mengetahui toksisitas dan tumorigenicity dari human adipose tissue-derived mesenchymal stem cells (hAdMCSs), berbagai dosis sel dengan takaran ber-beda diinjeksikan secara intravena pada tikus dengan imunodefisiensi dan diobservasi selama 13 dan 26 minggu. Hasil penelitian menunjukkan bahwa tidak ditemukan adanya efek samping pada pemberian dengan dosis sel tertinggi (2,5 x 108 sel/kgBB) dan tidak ditemukan adanya perkembangan tumor. Uji klinik selama lebih dari 12 bulan pada 8 pasien laki-laki yang menderita spinal cord injury dengan dosis sel 4 x 108 sel/kgBB juga tidak ditemukan reaksi efek samping. Dari hasil penelitian tersebut menunjukkan bahwa transplantasi sistemik hAdMSC aman dan tidak menginduksi perkembangan tumor (Ra dkk., 2011).
2.5.4 Diabetes melitus mengganggu potensi angiogenik adipose-derived stemcell
(ADSC)
Diabetes melitus merusak potensi angiogenik dari ADSC dengan cara deplesi subpopulasi seluler selektif. Secara khusus, pada DM terjadi gangguan pada fungsi diabetes endotelial progenitor sel (EPC) dan populasi kultur jaringan fibroblast in vitro. Selain itu, terdapat pengurangan ekspresi vaskulogenik dan sitokin regeneratif
vaskular endothelial growth factor (VEGF) serta hipoxia induced factor 1-alpha
23
Gambar 2.1Perbedaan persentase jumlah sel yang berdiferensiasi menjadi adi-pogenik dan osteogenik ADSC pada pasien DM dan non DM (Rennert dkk.,
2014)
2.5.5 Penurunan karakteristik sel punca mesenkimal
24
untuk pembentukan jaringan pembuluh darah (neovaskularisasi) berkurang seiring dengan berjalannya usia. Demikian juga dengan bone marrow stem cell (BMSC) yang mengalami penurunan kemampuan imunomodulator seiring berjalannya usia (Kalaszczynska dkk., 2015).
2.6 Sel Punca Mesenkimal Wharton’s Jelly (Wharton’s Jelly Mesenchymal Stem
Cell/ WJ-MSC)
Pada saat ini dikembangkan sumber MSC Wharton’s Jelly yang diperoleh dari tali pusat (Umbilical Cord/ UC). Sel punca mesenkimal Wharton’s Jelly (Wharton’s Jelly Mesenchymal Stem Cell/ WJ-MSC) mendapat perhatian yang sangat besar kare-na sel dapat dengan mudah diisolasi (non-invasive procedure), tidak terbentur masa-lah etika dan berasal dari jaringan yang didapat setemasa-lah masa-lahir sehingga tidak terdapat penurunan karakteristik MSC (Wang dkk., 2004). WJ-MSC memungkinkan untuk digunakan sebagai alternatif klinis dari BMMSC karena memiliki aksesibilitas yang lebih baik, potensi ekspansi yang lebih tinggi serta imunogenisitas rendah (Quintiliano, 2010).
Penelitian tentang manfaat dan keamanan transplantasi WJ-MSC pada pasien DM tipe 2 menunjukkan bahwa WJ-MSC dapat menurunkan kadar glukosa, memperbaiki kadar C-peptide dan fungsi sel beta, serta menurunkan penanda inflamasi sistemik dan jumlah T limfosit (Liu dkk., 2014).
25
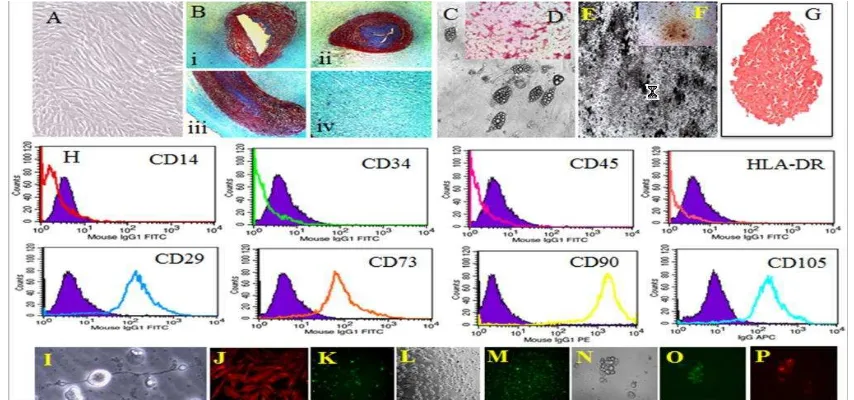
perivascular Cell (HUCPVCs). WJ-MSC dari tali pusat mengandung jaringan ikat mucoid dan fibroblast-like cell. Dengan menggunakan analisis flowcitrometri, sel-sel tersebut mengeksresikan reseptor matriks (CD44, CD105) dan integrin marker
(CD29, CD51) tetapi tidak untuk penanda garis keturunan hematopoietik (CD34, CD45). Sel-sel ini juga mengekspresikan sejumlah besar penanda sel batang mesen-kimal (SH2, SH3) serta memiliki potensi multilineage dan dapat berdiferensiasi men-jadi sel-sel dari garis keturunan adipogenik dan osteogenik (Wang dkk., 2004).
Gambar 2.2 Sel punca mesenkimal Wharton’s Jelly (Baergen, 2011)
2.6.1 Isolasi Sel Punca Mesenkimal Wharton’s Jelly
26
Gambar 2.3 Isolasi dari sel punca mesenkimal Wharton’s Jelly
( Puranik dkk., 2012)
Gambar 2.4 Kultur sel punca mesenkimal Wharton’s Jelly hari 1, 3 dan 5 setelah passase hari ke 21. Tampak adanya pertumbuhan sel punca dan pengelompokan sel punca (tanda panah) tersebut
27
Gambar 2.5 Isolasi dan karakteristik dari WJ-MSC. (A)Pasase 5 WJ-MSC; (B) WJ-MSCs masson’s trichrome
staining; (C) Diferensiasi adiposit WJ-MSCs; (D) Oil Red O Staining; Diferensiasi osteosit, Von kossa Staining (E) and Alkaline Phosphatase staining (F); (G) Diferensiasi kondrosit, Safranin O Staining; (H) Analisis flocitometri WJ-MSC; (I) Diferensiasi neural,
Neuroglia2 immunostaining (J); (K) Smooth muscle actin staining; (L) Diferenasiasi sel photoreseptor, Rhodopsin staining (M); (N) Diferensiasi progenitor pankreatik,
(O) Insulin, (P) PDX1 (Sabapathy dkk., 2014).
2.6.2 Sel punca mesenkimal Wharton’s Jelly berdiferensiasi menjadi
insulin-producing cells in vitro
28
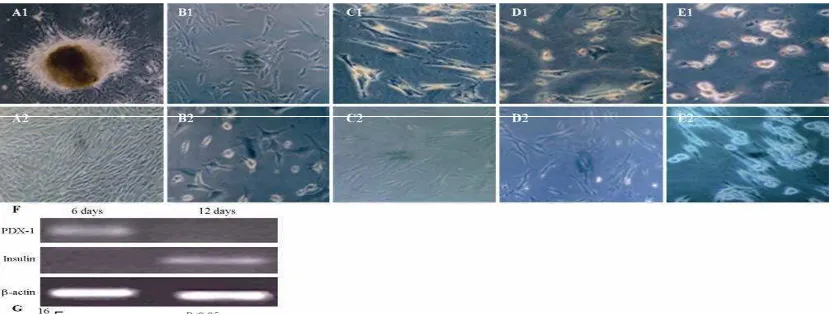
huMSC mengekspresikan insulin dan gen PDX-1 setelah diinduksi (Wang dkk., 2011).
Gambar 2.6 Hasil dari diferensiasi. A1: huMSC, A2: Sel tersebut memiliki mor-fologi fibroblas-like. B1 & B2: Perubahan mormor-fologi pada huMSC setelah
di-induksi nicotinamid & β-mercaptoethanol (perbesaran 200x). C1: ekspresi seluler dari protein glukagon manusia setelah terapi dengan nicotinamid & β -mercaptoethanol. C2 & D2: kelompok kontrol tanpa adanya eskpresi dari
insu-lin atau glukagon (perbesaran 200x). E1: Dithizone staining pada D-HuMSCs menunjukan cytoplasmic staining dengan warna merah kecoklatan dan E2 ada-lah kontrol negatif (perbesaran 200x). F: Analisis RT-PCR human insulin dan
PDX-1 genes setelah induksi. Setelah induksi selama 6 hari, huMSCs mengeskpresikan human PDX-1 gene dan huMSCs mengekspresikan human insulin gene setelah induksi selama 12 hari. G: Insulin leve (Wang dkk., 2011)
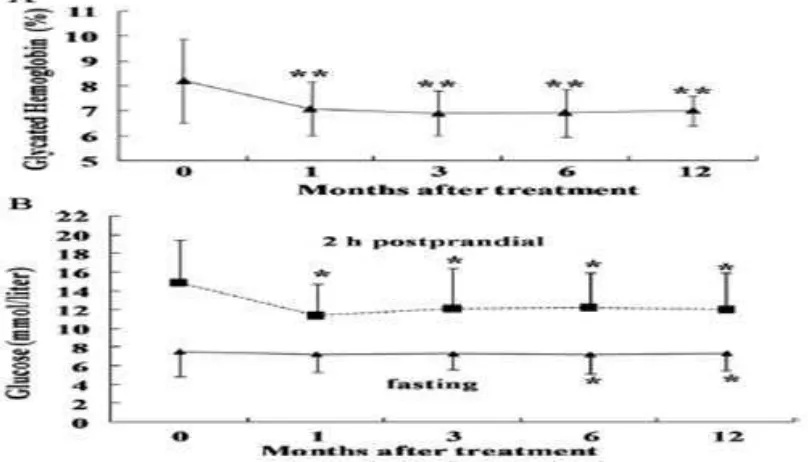
2.6.3 Efek dan keamaan transplantasi sel punca mesenkimal wharton’s jelly
29
penurunan marker inflamasi sistemik dan hitung T limfosit. Tidak ditemukan efek samping (Liu dkk., 2014).
Gambar 2.7 Kadar glycated hemoglobin, glukosa puasa dan glukosa 2 jam post prandial selama 12 bulan periode penelitian (Liu dkk., 2014).
Berdasarkan hasil uji toksisitas dan uji tumorigenicity, Ra JC dkk menyimpulkan bahwa transplantasi hingga 2 x 108 sel/ kgBB Human Adipose Tissue-Derived
Mesen-chymal Stem Cells (hAdMSCs) autologus aman bila diberikan infus intravena secara perlahan (Ra dkk., 2011).
2.6.4 Jalur pemberian sel punca mesenkimal wharton’s jelly
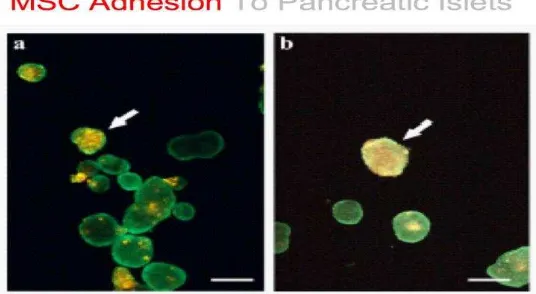
30
pasien yang telah rusak. Metode kedua adalah mengimplantasikan sel punca melalui pembuluh darah, baik yang berada dekat dengan lokasi jaringan/ organ yang telah ru-sak atau pembuluh darah manapun yang terdapat dalam tubuh pasien. Karena kemu-dahan aplikasinya di kemudian hari, maka metode kedua inilah yang paling banyak digunakan dan diuji efektivitasnya. Cara pemberian secara langsung memiliki tingkat kesulitan yang cukup tinggi dalam pelaksanaannya. Sebalikya, administrasi sel punca melalui pembuluh darah jauh lebih mudah dilakukan daripada injeksi sel punca in-tralesi (Halim dkk., 2010).
31
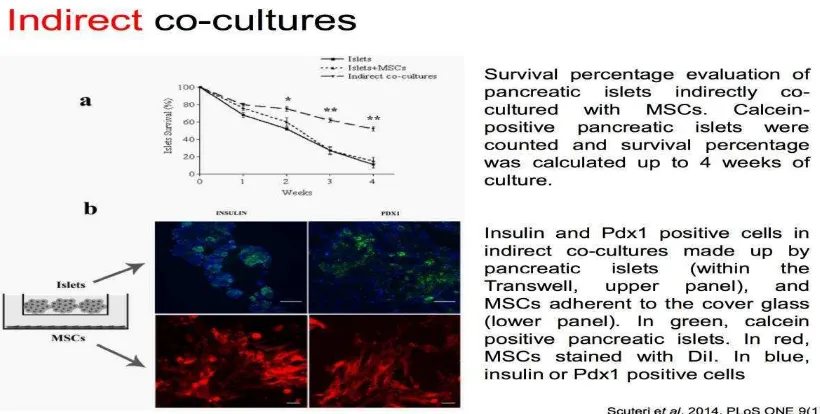
Gambar 2.9 Evaluasi persentase survival MSC pada pulau pankreas (Scuteri dkk., 2014)
2.7 Hewan Percobaan
2.7.1 Tikus putih (Rattus norvegicus) jantan sebagai hewan coba
Percobaan ini menggunakan tikus putih jantan sebagai binatang percobaan kare-na tikus putih jantan dapat memberikan hasil penelitian yang lebih stabil karekare-na tidak dipengaruhi oleh adanya siklus menstruasi dan kehamilan seperti pada tikus putih betina. Tikus putih jantan juga mempunyai kecepatan metabolisme obat yang lebih cepat dan kondisi biologis tubuh yang lebih stabil dibanding tikus betina (Ngatijan, 2006).
32
putih tidak dapat muntah karena struktur anatomi yang tidak lazim di tempat esofagus bermuara ke dalam lubang dan tikus putih tidak mempunyai kandung empedu (Smith dan Mangkoewidjojo, 1988).
Tikus laboratorium jantan jarang berkelahi seperti mencit jantan. Tikus putih dapat tinggal sendirian dalam kandang dan hewan ini lebih besar dibandingkan dengan mencit, sehingga untuk percobaan laboratorium, tikus putih lebih menguntungkan daripada mencit. Usia tikus 2,5 bulan memiliki persamaan dengan manusia usia dewasa muda dan belum mengalami proses penuaan intrinsik (Smith dan Mangkoewidjojo, 1988).
Klasifikasi tikus putih dalam sistematika hewan percobaan adalah sebagai berikut (Smith dan Mangkoewidjojo, 1988) :
Filum : Chordata
Subfilum : Vertebrata
Classis : Mammalia
Subclassis : Placentalia
Ordo : Rodentia
Familia : Muridae
33
Species : Rattus norvegicus
2.7.2 Kriteria tikus diabetes