LAPORAN PRAKTIKUM MIKOLOGI PEMBUATAN SLIDE CULTURE
Tanggal Pelaksanaan Praktikum : 24 September 2013
Disusun oleh : Oksyana Silawati (081014011)
Dosen Asistensi: Dr. Ir. Tini Surtiningsih, DEA
PROGRAM STUDI S-1 BIOLOGI DEPARTEMEN BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
PEMBUATAN SLIDE CULTURE
I. TUJUAN
1. Untuk menumbuhkan biakan murni kapang diatas objek glass/ slide kultur
2. Untuk pengamatan mikroskopis dan mengidentifikasi biakan murni kapang yang terdapat pada slide kultur dengan menggunakan mikroskop.
II. DASAR TEORI
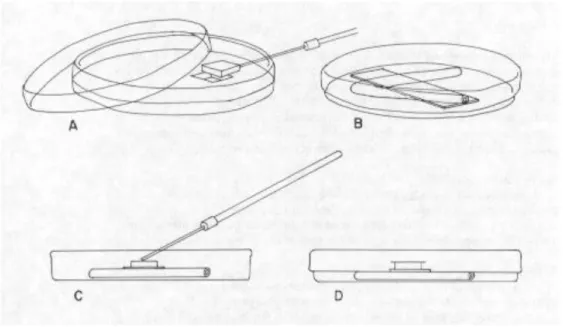
Identifikasi isolat fungi dilakukan melalui dua tahap. Tahap pertama yaitu pengamatan fungi secara makroskopis yang meliputi pengamatan terhadap warna dan bentuk koloni. Tahap kedua yaitu, pengamatan secara mikroskopis yang dilakukan dengan membuat slide kutur yang meliputi pengamatan terhadap bentuk hifa, bentuk, dan ukuran konidia. Tahap pembuatan slide kultur dapat dilihat pada gambar berikut :
Gambar 2.1 Tahap pembuatan slide kultur : (A) Potongan agar yang diambil dari medium PDA. (B) Cawan Petri berisi batang penahan dan gelas objek. (C) Inokulasi fungi pada agar yang disimpan di atas gelas objek. (D) Agar yang telah diinokulasi ditutup dengan kaca penutup. (Sumber : www.botany.utoronto.ca)
Disiapkan sebuah cawan Petri steril yang di dalamnya diberi kertas saring steril yang dipotong bundar dan telah dilembabkan dengan menggunakan akuades steril untuk menjaga kelembaban kultur dalam cawan Petri. Pada cawan Petri tersebut disimpan batang penahan berbentuk segitiga, dan di atas batang penahan tersebut diletakkan sebuah objek gelas steril beserta penutupnya seperti terlihat pada Gambar 2.1. Blok agar
steril kira-kira berikiran satu sentimeter kuadrat dipotong dari medium PDA dalam cawan Petri steril lain (Gambar 2.1 A) dan diletakkan di atas gela objek dengan menggunakan pisau atau alat pemotong steril. Kemudian, fungi diinkubasi pada keempat blok agar (Gambar 2.1 C) dan ditutup oleh gelas penutup steril (Gambar 2.1 D). Setelah beberapa hari diinkubasi dalam suhu kamar, sllide dapat diamati dengan menggunakan mikroskop pada perbesaran rendah sampai tinggi, lalu diidentifikasi. Aspergillus sp. Domain : Eukaryota Kingdom : Fungi Filum : Ascomycota Subfilum : Pezizomycotina Kelas : Eurotiomycetes Ordo : Eurotiales Famili : Trichocomaceae Genus : Aspergillus Spesies : Aspergillus sp.
Genus cendawan ini memiliki konidiofor tegak lurus, sederhana dan pada ujungnya berbentuk bulat (globose) atau clavate. Pada ujung konidiofor berbentuk fialid yang merupakan tempat tumbuh konidia. Konidia berbentuk bulat dan dihasilkan secara basipetal (gambar 3). Karakteristik ini sesuai dengan karakteristik Aspergillus sp yang dikemukan oleh Barnet (1960). Karakteristik lain dari cendawan ini yang dikemukakan oleh Domsch, Gams dan Anderson (1980) ialah adanya konidiofor yang kaku pada bagian ujungnya biasanya ditutupi oleh lapisan palisade seperti selaput dari fialid yang disebut sterigmata atau ditutupi oleh selaput sel-sel subtending (metule). Metula dan fialid menghasilkan rantai konidia secara basipetal.
Penicillium sp. Domain : Eukaryota Kingdom : Fungi Filum : Ascomycota Subfilum : Pezizomycotina Kelas : Eurotiomycetes Ordo : Eurotiales Famili : Trichocomaceae Genus : Penicillium Spesies : Penicillium sp.
Genus cendawan ini memiliki konidiofor yang dibentuk pada miselium tunggal, pembentukan konidia secara apparatus, diujung fialid terdapat konidia yang tersusun seperti rantai, konidia hialin atau berwarna mengkilat, konidia berbentuk globose atau ovoid dan dihasilkan secara basipetal. Karakteristik ini sesuai dengan karakteristik Penicellium sp yang dikemukakan oleh Barnet (1960). Karakteristik lain dari cendawan ini menurut Domsch, Gams dan Anderson (1980), yaitu konidiofornya berbentuk penicilliate, percabangan utamanya merupakan fialid berbentuk verticilliate yang sering disebut sterigmata dan fialid menghasilkan rantai konidia secara basipetal.
Trichoderma sp. Domain : Eukaryota Kingdom : Fungi Filum : Ascomycota Subfilum : Pezizomycotina Kelas : Sordariomycetes Ordo : Hypocreales Famili : Hypocreaceae Genus : Trichoderma Spesies : Trichoderma sp.
Pada media buatan, cendawan ini membentuk koloni berwarna putih, kekuningan atau hijau. Ciri mikroskopik dari cendawan ini adalah percabangan konidiofornya banyak, hifa dan konidiofornya hialin, pada ujung konidiofor tumbuh
sel-sel yang menyerupai botol (fialid), fialidnya tunggal atau membentuk kumpulan, konidianya bersel tunggal, hialin dan berbentuk ovoid (gambar 1). Karakteristik ini sesuai dengan karakteristik Trichoderma sp. Yang dikemukakan oleh Barnet (1960).
Ciri-ciri Trichoderma sp secara umum adalah hifa bersekat, konidiofor berbentuk salib, konidia lonjong atau bulat telur dan warna koloni adalah hijau gelap. Sifat-sifat dari cendawan Trichoderma sp adalah :
a. Dapat ditemukan pada berbagai tempat b. Mudah diisolasi dan dibiakkan
c. Cepat tumbuh pada berbagai substrat d. Spektrumnya luas
e. Mempunyai daya kompetitif
f. Mampu memproduksi antibiotic/gliotoksin/viridian g. Koloni warna hijau gelap
III. ALAT DAN BAHAN 1. Cawan petri 2. Object glass 3. Logam penyangga 4. Beaker glass 5. Pipet volume 6. Skapel 7. Jarum ose 8. Bunsen 9. Aquadest steril 10.Alkohol 11.Media PDA
12.Biakan murni Aspergillus sp. 13.Biakan murni Penicillium sp. 14.Biakan murni Trichoderma sp.
IV. PROSEDUR KERJA
1. Bungkus cawan petri, pipet steril, objek glass, dan logam penyangga, sterilkan dengan autoclave suhu 120ºC selama 20 menit
2. Masukkan 100ml aquadest ke dalam botol serum, tutup mulut botol dengan kapas dan alumunium foil lalu sterilkan
3. Buatlah media PDA, timbang 40gr masukkan ke dalam beaker glass, tambahkan aquadest 100 ml, panaskan diatas kompor listrik sambil diaduk sempurna hingga agar larut, masukkan dalam botol serum, tutup dengan kapas dan alumunium foil lalu sterilkan
4. Setelah sterilisasi selesai, buka bungkusan cawan petri di ruang steril, masukkan 10 ml aquadest steril dengan pipet steril, teteskan larutan media PDA diatas object glass 1 tetes, tutup penutup cawan, biarkan agar membeku
5. Cara menanam biakan kapang pada slide kultur, gunakan jarum ose steril/ dipanaskan pada api bunsen hingga pijar, ambil satu ose biakan murni kapang kemudian letakkan satu titik jarum ose diatas agar slide kultur, tutup cawan petri, beri label, inkubasi kapang selama 7 hari
6. Untuk pengamatan makroskopis/morfologi, tuangkan 15 ml PDA ke dalam cawan petri, biarkan membeku, tanamkan 1 iris biakan murni kapang di tengah cawan, tutup rapat dengan isolasi di sekeliling cawan, inkubasi selama 7 hari
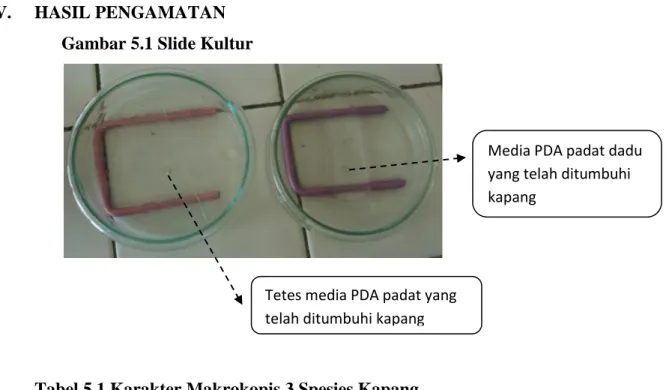
V. HASIL PENGAMATAN Gambar 5.1 Slide Kultur
Tabel 5.1 Karakter Makrokopis 3 Spesies Kapang
Karakter Aspergillus sp. Penicillium sp. Trichoderma sp.
Warna Koloni
Top-side hitam hijau
keabu-abuan
hijau tua
Reverse-side tidak berwarna kuning/coklat kekuningan
tidak berwarna
Tekstur koloni granular beludru beludru
Tetes eksudat tidak ada tidak ada tidak ada
Radial furrow tidak ada tidak ada tidak ada
Zonasi tidak ada tidak ada ada
Tabel 5.2 Karakter Mikroskopis 3 spesies Aspergillus
Karakter Aspergillus sp. Penicillium sp. Trichoderma sp.
Struktur tubuh biseriat uniseriat uniseriat
Hifa (Septat/aseptat) septat septat septat
Warna Konidiofor hialin/coklat hialin hialin
Bentuk vesikel bulat - -
Struktur metula ada tidak ada tidak ada
Tetes media PDA padat yang telah ditumbuhi kapang
Media PDA padat dadu yang telah ditumbuhi kapang
Bentuk konidia bulat bulat bulat
Bentuk konidial head bulat bulat bulat
Tabel 5.3 Hasil Pengamatan Karakteristik 3 Spesies Kapang
Spesies Makroskopis Mikroskopis Top-side Reverse-side Aspergillus sp. Penicillium sp. Trichoderma sp.
VI. PEMBAHASAN
Pada praktikum kali ini bertujuan untuk menumbuhkan biakan murni kapang di atas obyek glass dan untuk melakukan pengamatan mikroskopis dan mengidentifikasi biakan murni kapang yang terdapat pada slide kultur.
Untuk membuat slide kultur pertama-tama melakukan sterilisasi alat-alat yang akan digunakan seperti cawan petri, obyek glass, cover glass, logam penyangga bentuk U, pipet volume, scapel, pinset, dan beaker glass. Selanjutnya pembuatan dan sterilisasi media PDA. Media yang telah dingin di tuang sebagian ke dalam 2 cawan petri steril, satu cawan untuk pengamatan makroskopis dan satu lagi untuk stock media padat yang akan dipotong kecil bentuk dadu. Setelah media memadat, panaskan jarum ose hingga merah berpendar kemudian ambil biakan murni kapang pada agar miring (NA) di tabung kemudian menanamnya ke dalam cawan petri untuk pengamatan makroskopis. Media pada cawan petri yang lain jika sudah memadat dipotong menggunakan scapel steril hingga berukuran dadu, kecil sekitar 0,3-0,5 mm. Ambil cawan petri steril yang didalamnya sudah berisi logam penyangga, obyek glass dan cover glass. Pasang sedemikian rupa dengan pinset steril hingga obyek glass berada di atas logam penyangga. Mengambil media PDA yang masih cair dan dingin dengan pipet volume steril, meneteskan sebanyak satu tetes ke atas obyek glass. Kemudian didiamkan hingga memadat. Selanjutnya media yang telah dipotong kecil berukuran dadu diletakkan di obyek glass yang sama. Jika media yang ada pada obyek glass sudah memadat selanjutnya biakan murni kapang ditanam. Setelah itu, tuang sedikit aquades steril ke dalam cawan petri namun permukaan air tidak sampai menyentuh obyek glass. Selanjutnya inkubasi selama 7 hari dalam suhu kamar.
Setelah masa inkubasi melakukan pengamatan ketiga spesies kapang yaitu Aspergillus sp. ; Penicillium sp. ; dan Trichoderma sp. Pengamatan makroskopis dilakukan secara langsung dengan mengamati koloni yang tumbuh pada cawan petri sedangkan pengamatan mikroskopis dilakukan dengan mengambil slide kultur yang ada dalam cawan petri kemudian diamati di bawah mikroskop.
Pada pengamatan makroskopis nampak koloni Aspergillus sp. memiliki tekstur granular, warna koloni hitam pada top-side dan tak berwarna pada bagian reverse-side, tidak ada tetes eksudat, radial furrow dan zonasi. Sedangkan pada Penicillium sp. memiliki tekstur beludru, warna koloni hijau keabu-abuan pada top-side dan kuning atau coklat kekuningan pada bagian reverse-side, tidak ada tetes eksudat, radial furrow dan zonasi. Trichoderma sp. memiliki tekstur beludru, warna koloni hijau tua pada
top-side dan tak berwarna pada bagian reverse-top-side, tidak muncul radial furrow, ada tetes eksudat dan zonasi.
Pada pengamatan mikroskopis struktur tubuh Aspergillus sp. biseriat (terdapat struktur metula) sedangkan Penicillium sp. dan Trichoderma sp. uniseriat (tidak ada struktur metula, pada konidiofor langsung muncul fialid). Hifa ketiga spesies kapang berseptat dan bercabang. Struktur vesikel hanya ada pada Aspergillus sp. dan konidiofor tidak bercabang sedangkan pada Penicillium sp. dan Trichoderma sp. konidiofor bercabang-cabang langsung muncul fialid. Konidiofor pada Aspergillus sp. berwarna coklat atau hialin sedangkan pada Penicillium sp. dan Trichoderma sp. hialin.
VII. KESIMPULAN
Berdasarkan hasil pengamtan dapat disimpulkan bahwa:
1. Slide kultur merupakan metode khusus untuk menumbuhkan kapang, dan digunakan untuk pengamatan kapang secara mikroskopis. Metode ini menggunakan obyek glass, logam penyangga, cover glass steril, aquades steril, dan media PDA yang diteteskan pada obyek glass juga potongan dadu media.
2. Pengamatan makroskopis mencakup warna koloni, tekstur koloni, zonasi, radial furrow dan tetes eksudat sedangkan pengamatan mikroskopis mencakup struktur hifa, konidiofor, vesikel, metula, fialid, konidia, dan konidiospora atau konidial head.
DAFTAR PUSTAKA
Dwijiseputro, 1978. Pengantar Mikologi. Bandung: Penerbit Alumni.
Gandjar, Indrawati, dkk, 2000. Pengenalan Kapang Tropik Umum. Jakarta: IKAPI DKI. Gandjar, Indrawati, dkk. 2006. Mikologi Dasar dan Terapan. Jakarta: IKAPI DKI.
“Aspergillus sp.” diakses dari http://www.mycology.adelaide.edu.au/FungalDescription.html tanggal 15 Oktober 2013.
“Penicillium sp.” diakses dari
http://www.mycology.adelaide.edu.au/FungalDescriptions.html tanggal 15 Oktober 2013.
“Trichoderma sp.” diakses dari
http://www.mycology.adelaide.edu.au/FungalDescriptions.html tanggal 15 Oktober 2013.
LAMPIRAN
Gambar Keterangan
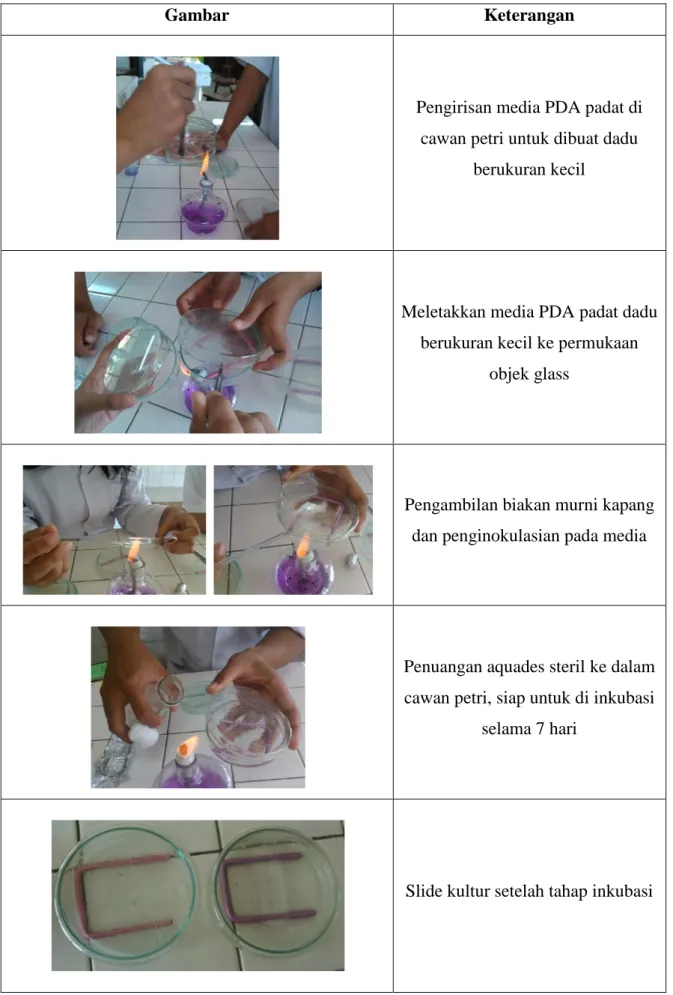
Pengirisan media PDA padat di cawan petri untuk dibuat dadu
berukuran kecil
Meletakkan media PDA padat dadu berukuran kecil ke permukaan
objek glass
Pengambilan biakan murni kapang dan penginokulasian pada media
Penuangan aquades steril ke dalam cawan petri, siap untuk di inkubasi
selama 7 hari
Penampakan makroskopis koloni Penicillium sp.
Penampakan makroskopis koloni Trichoderma sp.
Penampakan makroskopis koloni Aspergillus sp.