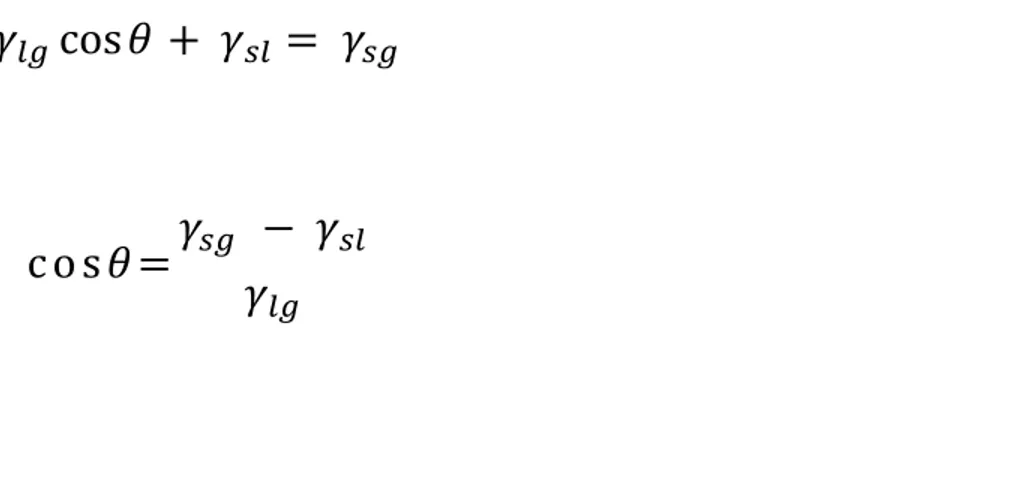BAB I
BAB I
PEDAHULUAN
PEDAHULUAN
Banyak Fenomena-fenomena alam yang kurang kita perhatikan, akan tetapi Banyak Fenomena-fenomena alam yang kurang kita perhatikan, akan tetapi fenomena-fenomena tersebut mempunyai hubungan dengan adanya tegangan fenomena-fenomena tersebut mempunyai hubungan dengan adanya tegangan permukaan. Sering terlihat peristiwa-peristiwa alam yang tidak diperhatikan dengan permukaan. Sering terlihat peristiwa-peristiwa alam yang tidak diperhatikan dengan teliti, misalnya tetes-tetes zat cair pada pipa kran yang bukan sebagai suatu aliran, teliti, misalnya tetes-tetes zat cair pada pipa kran yang bukan sebagai suatu aliran, laba-laba air yang berada di atas permukaan air, mainan gelembung-gelembung sabun, pisau laba air yang berada di atas permukaan air, mainan gelembung-gelembung sabun, pisau silet yang diletakkan perlahan-lahan diatas permukaan zat cair yang terapung, dan silet yang diletakkan perlahan-lahan diatas permukaan zat cair yang terapung, dan naiknya air pada pipa kapiler. Hal tersebut dapat terjadi karena adanya gaya-gaya yang naiknya air pada pipa kapiler. Hal tersebut dapat terjadi karena adanya gaya-gaya yang bekerja pada permukaan zat cair atau pada batas antara zat cair dengan bahan lain. bekerja pada permukaan zat cair atau pada batas antara zat cair dengan bahan lain.
Tegangan permukaan adalah gaya persatuan panjang yang harus dikerjakan Tegangan permukaan adalah gaya persatuan panjang yang harus dikerjakan sejajar permukaan untuk mengimbangi gaya tarikan kedalam pada cairan. Hal tersebut sejajar permukaan untuk mengimbangi gaya tarikan kedalam pada cairan. Hal tersebut terjadi karena pada permukaan, gaya adhesi (antara cairan dan udara) lebih kecil dari terjadi karena pada permukaan, gaya adhesi (antara cairan dan udara) lebih kecil dari pada gaya kohesi antara molekul cairan sehingga menyebabkan terjadinya gaya pada gaya kohesi antara molekul cairan sehingga menyebabkan terjadinya gaya kedalam pada permukaan cairan.
kedalam pada permukaan cairan.
Tegangan antar muka adalah gaya persatuan panjang yang terdapat pada Tegangan antar muka adalah gaya persatuan panjang yang terdapat pada antarmuka dua fase cair yang tidak bercampur. Tegangan antar muka selalu lebih kecil antarmuka dua fase cair yang tidak bercampur. Tegangan antar muka selalu lebih kecil dari pada tegangan permukaan karena gaya adhesi antara dua cairan tidak bercampur dari pada tegangan permukaan karena gaya adhesi antara dua cairan tidak bercampur lebih besar dari pada adhesi antara cairan dan udara.
BAB II
PEMBAHASAN
2.1 TEGANGAN PERMUKAAN DAN SUDUT KONTAK
Tegangan Permukaan
Molekul pada permukaan suatu cairan ditarik kedalam rongga cairan karena gaya tarik dari molekul di bawahnya lebih besar dari pada tarikan oleh molekul uap yang ada pada bagian lain dari permukaan. Tarikan ke dalam ini bila mungkin, menyebabkan permukaan berkontraksi dan menyebabkan terjadinya gaya dalam bidang permukaan. Tegangan permukaan menyebabkan terbentuknya tetesan bulat, kenaikan air dalam kapiler, dan gerak cairan lewat zat berpori. Zat padat juga mempunyai tegangan permukaan, tetapi lebih sukar untuk ditentukan. Kristal cenderung untuk membentuk bidang-bidang dengan tegangan permukaan terendah.
Tegangan permukaan cairan
, adalah gaya per satuan panjang pada permukaan yang melawan ekspansi dari luar permukaan. Definisi ini digambarkan dengan percobaan ideal pada gambar dibawah ini, dimana batang yang bergerak dapat ditarik dengan gaya F untuk mengekspansi film cairan yang terntang seperti film gelembung sabun pada kerangka kawat. Tegangan permukaan adalah :
l ialah panjang batang dan faktor di masukkan karena ada dua permukaan cairan, satu di bagian muka dan satu di bagian belakang.
Tegangan permukaan cairan dapat ditentukan dengan berbagai metoda. Karena bentuk kesetimbangan dari permukaan cairan ditentukan oleh balans dari tegangan permukaan dan gaya gravitasi, analisa tetesan atau bentuk gelembung dapat digunakan untuk penentuan tegangan permukaan. Kenaikan cairan dalam kapiler atau penarikan pelat tipis yang tercelup sebagian dalam cairan dapat ditentukan dan di gunakan untuk menghitung tegangan permukaan dengan cukup teliti. Nilai yang kurang teliti dari tegangan permukaan didapat dari penentuan pada permukaan cairan yang begerak. Metoda-metoda ini mencakup jet cairan, kerutan, berat tetes, dan gaya yang diperlukan untuk merengat permukaan.
Tegangan permukaan cairan turun bila suhu naik dan menjadi lebih kecil beberapa derajat di bawah suhu kritik. Pada suhu kritik tegangan permukaan adalah nol.
Tegangan permukaan logam cair dan garam leleh adalah besar dibandingkan dengan cairan organik. Sebagai contoh, tegangan permukaan merkuri pada 0
adalah 480,3 mNm-1, dan untuk perak pada 800
adalah 800mN m-1.Antarmuka antara dua cairan jenuh dan saling tak larut mengkerut karena adanya tegangan antarmuka. Pada dasarnya, tegangan antarmuka dapat ditentukan dengan semua metoda yang digunakan untuk penentuan tegangan permukaan. Tetapi, karena tegangan antarmuka lebih peka terhadap ketakmurnian daripada tegangan permukaan, penentuan demikian lebih sukar dilaksanakan.
Untuk menambah luas permukaan diperlukan kerja. Kerja yang diperlukan untuk memperbesar luas permukaan film digambarkan pada gambar sebelumnya, yaitu w = Fd = 2
ld = 2
A , dimana d ialah perpindahan batang yang bergerak, A adalah luas, danfaktor 2 timbul kembali dari fakta bahwa film cairan mempunyai dua permukaan. Jadi, secara umum, kerja yang dilakukan untuk memperbesar luas permukaan adalah
A .karena dalam SI kerja dinyatakan dalam joule dan luas dalam meter persegi, jelaslah bahwa tegangan permukaan dapat juga dinyatakan dalam joule per meter persegi.
Sudut Kontak
Gambar dibawah ini menunjukkan suatu cairan dalam kesetimbangan dengan permukaan padat dan gas. Untuk beberapa pasangan cair-padat sudut kontak
adalah nol, dan cairan menyebar sampai menutupi seluruh permukaan padat. Untuk pasangan cair-padat lain sudut kontak
lebih besar dari 90o, dan cairan berupa tetesan kecil dantak membasahi permukaan padat.
Pada kesetimbangan ketiga tegangan antarmuka harus seimbang sepanjang garis kontak. Jadi :
Atau :
Persamaan ini tak berlaku bila
, karena dalam hal ini sistem mempunyai energi Gibbs terendah bila zat padat dibasahi sempurna. Persamaan juga tidak berlaku bila
, sehingga zat padat tak dibasahi sama sekali.2.2 ADSORPSI
Persamaan Adsorpsi Gibbs
Persamaan adsorpsi Gibbs adalah pernyataan termodinamika yang menghubungkan konsentrasi kelebihan permukaan suatu komponen terhadap kedua besaran, tegangan permukaan dan keaktifan komponen. Jadi persamaan adsorpsi Gibbs dapat digunakan untuk menghitung konsentrasi kelebihan permukaan dari penentuan tegangan permukaan larutan yang diketahui konsentrasinya. Sebaliknya, bila konsentrasi permukaan dapat ditentukan langsung, persamaan adsorpsi Gibbs dapat digunakan untuk menghitung efeknya terhadap tegangan permukaan.
Untuk dapat menurunkan persamaan adsorpsi Gibbs, maka dimulai dengan persamaan untuk kelebihan permukaan energi Helmhotz untuk sistem dua-komponen.
A +
Suku yang mencakup potensial kimia pelarut diabaikan, karena pemukaan Gibbs terlokasi sedemikian sehingga
. Diferensial persamaan ini adalah :
A +A
+
+
Persamaan
+
A +∑
untuk dua komponen adalah :
+
A +
Pengurangan persamaan ini dari persamaan
A + A
+
+
menghasilkan,0 =A
+
+
Ini adalah persamaan adsorpsi Gibbs, tetapi biasanya diletakkan dalam bentuk yang lebih sederhana dengan membatasinya pada suhu tetap dan mengeliminasi
dalam mengutamakan aktivitas dengan memasukkan.
adalah aktivitas adsorbat dalam fasa ruah. Jadi,Dibagi dengan A memberikan :
/A =
Jadi konsentrasi kelebihan permukaan dapat dihitung dari penentuan tegangan permukaan
dan pengetahuan mengenai aktivitas zat terlarut dalam fasa ruah
. Untuk pelarut yang menurunkan tegangan permukaan konsentrasi kelebihan permukaan
adalah positif; dan untuk zat terlarut yang menaikkan tegangan permukaan konsentrasi permukaan
adalah negatif. Sabun mempunyai konsentrasi lebih tinggi didekat permukaan daripada dalam fasa ruah dalam air, dan garam anorganik mempunyai konsentrasi lebih rendah didekat permukaan daripada dalam fasa ruah berair.Untuk sistem satu komponen persamaan 0 = A
+
+
adalah bilaentropi per satuan luas dinyatakan oleh
Karena tegangan permukaan turun dengan naiknya suhu, entropi kelebihan permukaan
adalah positif; dengan lain perkataan, entropi untuk satuan luas cairan dalam daerah permukaan adalah lebih besar daripada untuk jumlah yang sama dari cairan ruah. Teori Adsorpsi Dari Langmuir
Langmuir menganggap permukaan suatu zat padat sebagai terdiri dari ruang elementer yang masing-masing dapat mengadsorpsi suatu molekul gas. Ia mengandaikan, bahwa semua ruang elementer adalah identik adalam afinitasnya untuk molekul gas dan adanya molekul gas pada satu ruang tidak mempengaruhi sifat dari ruang yang ada didekatnya.
Bila
adalah fraksi permukaan yang ditempati oleh molekul gas, laju penguapan dari permukaan adalah r
, dengan r sebagai laju penguapan dari permukaan yang tertutup sempurna pada suhu tertentu. Laju adsorpsi molekul pada permukaan adalah sebanding dengan fraksi luas yang tak tertutup (1 -
) dan dengan tekanan gas. Jadi, laju kondensasi dinyatakan dengan k (1-
)P , dengan k sebagai tetapan pada suhu tertentu dan mencakup faktor yang membolehkan fakta, bahwa tak setiap molekul gas yang bertumbukan dengan ruang yang tak ditempati akan melekat.Pada kesetimbangan, laju penguapan gas yang teradsorpsi sama dengan laju kondensasi.
Atau,
Karena volum v dari gas teradsorpsi sebanding dengan
, persamaan
dapat ditulis sebagai :
Dengan v m sebagai volum gas teradsorpsi bila seluruh permukaan tertutup dan
k’ = r/k.
Jadi, v berbanding lurus dengan P pada tekanan sangat rendah, dimanak’/P
1. Bila tekanan diperbesar, volum teradsorpsi bertambah dan mendekati nilai v msecara asimtotik.
Adalah lebih mudah untuk menentukan tetapan k ’ dan v
m dengan mendenahkan 1/v terhadap 1/P , karena :
Penurunan isoterm adsorpsi Langmuir mencakup lima asumsi mutlak: (1) gas yang teradsorpsi berkelakuan ideal dalam fasa uap, (2) gas yang teradsorpsi dibatasi sampai lapisan monomolekul, (3) permukaan adalah homogen, artinya afinitas dari setiap kedudukan ikatan untuk molekul gas adalah sama, (4) tak ada antaraksi lateral antara molekul adsorbat, dan (5) molekul gas yang teradsorpsi terlokalisasi, artinya mereka tak bergerak pada permukaan. Meskipun asumsi pertama baik pada tekanan rendah, yang kedua hampir selalu tak berlaku bila tekanan dari gas yang teradsorpsi bertambah. Bila tekanan gas mendekati tekanan uap jenuh, uap akan berkondensasi tanpa limit pada semua permukaan bila sudut kontak
adalah nol.Asumsi yang ketiga lemah, karena permukaan nyata adalah heterogen; afinitas untuk molekul gas adalah berbeda pada bermacam muka kristal, dan bermacam-macam tempat ikatan dan dimasukkan oleh tepi, retakan, dan imperfeksi kristal. Keheterogenan menuju ke penurunan energi ikatan bila penutupan permukaan bertambah. Ketaktepatan asumsi ke-empat mula-mula ditunjukkan secara ekperimen, sewaktu dalam hal-hal tertentu ditemukan bahwa kalor adsorpsi dapat bertambah dengan konsentrasi permukaan dari molekul teradsorpsi. Efek ini, yang berlawanan dengan apa yang diharapakan dari hasil keheterogenan permukaaan, disebabkan oleh tarikan lateral dari molekul teradsorpsi. Asumsi ke-lima tak tepat, karena ada macam-macam bukti bahwa film permukaan dapat mobil.
Dalam adsorbsi fisik molekul uap dapat teradsorpsi sampai kedalaman beberapa lapisan tunggal. Suatu persamaan isoterm adorpsi telah diturnkan oleh Brunauer, Emmett, dan Teller untuk menerangkan adsorpsi lapisan ganda. Di sini di andaikan bahwa permukaan mempunyai kedudukan terlokalisasi dan seragam dan, bahwa adsorpsi pada satu kedudukan tak mempengaruhi kedudukan tetangganya, tepat seperti apa yang dikemukakan oleh teori Langmuir.
Selanjutnya, diandaikan bahwa molekul gas dapat teradsorpsi pada lapisan kedua, ketiga, ..., dan ke-n dengan luas permukaan yang tersedia untuk lapisan ke- n sama dengan penutupan lapisan ke(n – 1). Energi adsorpsi dalam lapisan pertama, E 1 ,
diandaikan tetap, dan energi adsorpsi dalam lapisan-lapisan berikutnya diandaikan E L,
yaitu enrgi pencairan gas.
Dengan menggunakan asumsi ini, maka mungkin menurunkan suatu persamaan yang mencakup volum gas yang teradsorpsi bila seluruh permukaan adsorben ditutupi oleh lapisan monomolekul sempurna.
Luas permukaan yang ditempati oleh molekul tunggal adsorbat pada permukaan dapat diperkirakan dari rapat massa adsorbat yang dicairkan. Misalnya, luas yang ditempati oleh molekul nitrogen pada -195oC diperkirakan sama dengan 16,2 x 10-20m2
dengan asumi bahwa molekul adalah bulat dan terusun rapat dalam cairan. Jadi, dari nilai v m yang ditentukan, luas permukaan adsorben dapat dihitung. Cara ini digunakan
secara leluasa dalam penentuan luas permukaan katalis padat dan adsoren. Nilai luas yang ditentukan dengan cara ini tampaknya cukup memadai meskipun dengan aproksimasi kasar dari teori.
2.3 ANTARMUKA BERMUATAN
Tegangan antar muka adalah pengukuran kekuatan sebagai usaha yang diperlukan untuk memperluas antar muka antara dua cairan immiscible persatuan luas (Shaw, 1980). Tegangan permukaan merupakan suatu gaya yang timbul sepanjang garis permukaan suatu cairan, sedangkan tegangan antar muka adalah energi yang bergerak melintang sepanjang garis permukaan. Gaya ini timbul karena adanya kontak antara dua cairan yang berbeda fase. Dalam satuan SI (Standard International) besaran tegangan antarmuka dinyatakan dengan mN/m atau dyne/cm.
Turunnya tegangan antarmuka akan menurunkan gaya kohesi dan sebaliknya meningkatkan gaya adhesi. Gaya kohesi adalah gaya antar molekul yang bekerja diantara molekul-molekul yang sejenis, sedangkan gaya adhesi adalah gaya antar molekul yang bekerja diantara molekul-molekul yang tidak sejenis.
2.4 REOLOGI
Rheology berasal dari bahasa yunani mengalir (Rheo) dan Logos (ilmu), digunakan istilah ini untuk pertama kali oleh Bingham dan Crawford (seperti yang dilaporkan Fischer) untuk menggambarkan aliran cairan dan deformasi dari padatan. Viskositas adalah suatu pernyataan tahanan dari suatu cairan untuk mengalir; makin tinggi viskositas, akan makin besar ketahanannya. Cairan sederhana (biasa) dapat diuraikan dalam viskositas absolut. Tetapi sifat-sifat rheology dari dispersi heterogen lebih kompleks dan tidak dapat dinyatakan dalam suatu satuan tunggal (Martin, 1993).
Viskositas (kekentalan) dapat dianggap sebagai gesekan dibagian dalam suatu fluida. Karena adanya viskositas ini, maka untuk menggerakan salah satu lapisan fluida diatas lapisan lainnya, atau supaya suatu permukaan dapat meluncur di atas permukaan lainnya bila diantara permukaan-permukaan ini terdapat lapisan fluida, haruslah dikerjakan gaya. Baik zat cair maupun gas mempunyai viskositas, hanya zat cair lebih kental (viscous) daripada gas. Dalam merumuskan persamaan-persamaan dasar mengenai aliran yang kental, bahwa mirip dengan tegangan (Zemansky, 2004).
Suatu fluida akan mengalir karena adanya tekanan yang diberikan. Tekanan yang diberikan pada suatu benda dengan arah tegak lurus disebut normal stress atau pressure (P) sedangkan bila sejajar dengan bidang, disebut gaya geser ( shear stress).
Fluida yang tidak diberi gaya tidak akan mengalir karena di dalam fluida terdapat suatu hambatan yang menahan aliran, yang disebut dengan kekentalan atau viskositas. Secara molekuler disebabkan oleh gerakan acak dari molekul yang berpindah dari suatu lapisan ke lapisan lain dan resultan dari gerak tersebut menghasilkan suatu hambatan (Wirakartakusumah 1989).
Secara umum terdapat dua jenis sifat aliran bahan, yaitu newtonian dan non-newtonian.
Sifat aliran dari bahan cair dapat digambarkan dengan diagram (kurva) aliran. Kurva ini merupakan plot antara gaya geser (shear stress) dengan laju geser (shear rate). Dimana viskositas merupakan rasio dari gaya geser dengan laju geser pada semua titik sepanjang kurva. Pada kurva cairan newtonian rasio dari gaya geser dengan laju geser pada semua titik nilainya konstan, dan disebut viskositas tunggal ( µ). Jika aliran tidak linier digunakan simbol viskositas nyata ( µapp), yang merupakan slope dari garis
yang menghubungkan sebuah titik pada kurva dengan titik asal (0,0).
Fluida non-newtonian merupakan fluida yang memiliki kurva aliran ( shear stress versus shear rate) tidak linier, dimana viskositas nyata ( µapp) tidak konstan pada suhu
dan tekanan yang diberikan tetapi bergantung pada kondisi aliran seperti geometri aliran, shear rate, dan lain-lain, dan terkadang juga dipengaruhi oleh histori kinematik elemen fluida yang diuji (Chhabra dan Richardson 1999).
2.5 EMULSI DAN BUSA
Emulsi
Emulsi ialah dispersi koloid zat cair dalam zat cair lain yang tidak bercampur. Terbentuknya emulsi berdasarkan teori tegangan permukaan yaitu Molekul memiliki daya tarik menarik antara molekul yang sejenis yang disebut dengan daya kohesi. Selain itu molekul juga memiliki daya tarik menarik antara molekul yang tidak sejenis yang disebut dengan daya adhesi.
Daya kohesi suatu zat selalu sama, sehingga pada permukaan suatu zat cair akan terjadi perbedaan tegangan karena tidak adanya keseimbangan daya kohesi. Tegangan yang terjadi pada permukaan tersebut dinamakan tegangan permukaan.
Dengan cara yang sama dapat dijelaskan terjadinya perbedaan tegangan bidang batas dua cairan yang tidak dapat bercampur. Tegangan yang terjadi antara dua cairan tersebut dinamakan tegangan bidang batas.
Semakin tinggi perbedaan tegangan yang terjadi pada bidang mengakibatkan antara kedua zat cair itu semakin susah untuk bercampur. Tegangan yang terjadi pada air akan bertambah dengan penambahan garam-garam anorganik atau senyawa-senyawa elektrolit, tetapi akan berkurang dengan penambahan senyawa-senyawa organik tertentu antara lain sabun.
Didalam teori ini dikatakan bahwa penambahan emulgator akan menurunkan dan menghilangkan tegangan permukaan yang terjadi pada bidang batas sehingga antara kedua zat cair tersebut akan mudah bercampur.
Busa
Walaupun kita sudah membelah-belah sabun sampai sangat kecil, sama sekali tidak akan ada busa yang keluar. Tetapi kalau kita membasahi sabun lalu menggosokkannya, pasti busa akan langsung keluar. Rahasia busa sabun terletak pada bentuk dan struktur molekul sabun. Molekul adalah satuan terkecil yang membentuk suatu benda. Di dalam molekul sabun terdapat zat hidrokarbon yang mudah menyatu
dengan minyak dan “carboxyl radikal” yang mudah menyatu dengan air. Ketika sabun
Hidrokarbon akan pergi ke arah minyak, atau bila tidak ada minyak, hidrokarbon akan pergi ke arah udara. Sedangkan carboxyl akan pergi ke arah air. Struktur molekul yang berbaris seperti itu disebut struktur Micelle. Molekul sabun yang telah membentuk struktur Micelle mempunyai tegangan permukaan air (tenaga tarik-menarik antara molekul-molekul air) yang lemah. Bila tegangan permukaan lemah, cairan akan membentuk lapisan tipis yang luas.
Dengan kata lain, kalau kita menaruh sabun di air, molekul-molekul sabun akan membentuk lapisan tipis. Setelah lapisan tipis terbentuk, lalu kita menggosok-gosok air sabun dengan tangan, udara akan masuk ke lapisan tadi dengan cepat dan mengambang seperti balon. Inilah yang kita sebut busa. Jadi, kalau kita merendam sabun ke air dan menggosokkannya, berkat kerja molekul-molekul sabun, terciptalah air sabun yang mempunyai tegangan permukaan air lemah, dan setiap kali menggosok, udara akan masuk ke air sabun dan muncullah busa.
2.6 CONTOH SOAL DAN PEMBAHASAN
1. Tegangan antarmuka dari Hg-benzena pada 200C adalah 357 x 10-3N m-1
sedangkan
dan
adalah 484 x 10-3Nm-1. Hitunglah sudut kontak !Jawab :
=
= 0,225
= 76,9802. Volum gas nitrogen
(diukur pada 1 atm dan 00C) yang diperlukan untukmenutupi cuplikan gel silica dengan lapisan monomolekul adalah 129 cm3g-1
gel. Hitung luas permukaan per gram gel bila setiap molekul nitrogen menempati 16,2 x 10-20m2.
Jawab :
(
)(
)
2.7 SOAL-SOAL
1. Hitung sudut kontak antara air dan heksana pada 200C jika tegangan
antarmuka adalah 51,1 x 10-3Nm-1,
= 72,75 X 10-3Nm-1 dan
=18,43 x 10-3Nm-1
2. Hitung permukaan air dari dan benzene yang naik dalam kapiler yang sama masing-masing adalah 9,9 cm dan 4,5 cm, hitung tegangan permukaan benzene.
= 72,75 dyne cm-1pada 200C. Kerapatan H2O dan benzene padaDAFTAR PUSTAKA
Alberty, Robert A., Daniels, Farrington. 1992. Kimia Fisika Jilid 1. Jakarta : Erlalngga Atkins. 1996. Kimia Fisika Jilid 1. Jakarta : Erlangga
Dogra., S. Dogra. 1990. Kimia Fisik dan Soal-soal . Jakarta : Erlangga Sukardjo. 2002. Kimia Fisika. Jakarta: Erlangga