TESIS
PENURUNAN KADAR SUPEROKSIDA DISMUTASE
LENSA BERHUBUNGAN DENGAN
PENINGKATAN DERAJAT KEKERUHAN LENSA
PADA KATARAK SENILIS
(7,6
I PUTU RUSTAMA PUTRA
PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA
DENPASAR
2014
TESIS
PENURUNAN KADAR SUPEROKSIDA DISMUTASE
LENSA BERHUBUNGAN DENGAN
PENINGKATAN DERAJAT KEKERUHAN LENSA
PADA KATARAK SENILIS
(7,6
I PUTU RUSTAMA PUTRA NIM : 0914128203
PROGRAM MAGISTER
PROGRAM STUDI ILMU BIOMEDIK
PROGRAM PASCA SARJANA
UNIVERSITAS UDAYANA
DENPASAR
PENURUNAN KADAR SUPEROKSIDA DISMUTASE
LENSA BERHUBUNGAN DENGAN
PENINGKATAN DERAJAT KEKERUHAN LENSA
PADA KATARAK SENILIS
Tesis Ini Untuk Memperoleh Gelar Magister
Pada Program Magister, Program Studi Ilmu Biomedik (Combined Degree) Fakultas Kedokteran Universitas Udayana
I PUTU RUSTAMA PUTRA NIM : 0914128203
PROGRAM MAGISTER
PROGRAM STUDI ILMU BIOMEDIK
PROGRAM PASCA SARJANA
UNIVERSITAS UDAYANA
DENPASAR
Lembar Pengesahan
TESIS INI TELAH DISETUJUI PADA TANGGAL : 18 JUNI 2014
Pembimbing I, Pembimbing II,
dr. W. G. Jayanegara, SpM(K) dr. AAA. Sukartini Djelantik, SpM(K) NIP. 19640229 1991031002 NIP. 19560420 1982122001
Mengetahui,
Ketua Program Studi Ilmu Biomedik Direktur,
Program Pascasarjana Program Pascasarjana Universitas Udayana Universitas Udayana
Prof.Dr.dr.Wimpie,I.Pangkahila,SpAnd,FAACS Prof.Dr.dr.A.A.Raka Sudewi,SpS(K) NIP. 19461213 1971071001 NIP. 19590215 1985102001
Tesis Ini Telah Diuji Pada Tanggal 18 Juni 2014
Panitia Penguji Tesis Berdasarkan SK Direktur Program Pascasarjana Universitas Udayana No: 1658/UN14.4/HK/2014 , Tanggal 10 Juni 2014
Ketua : dr. I W.Gede Jayanegara, Sp.M(K) Sekretaris : dr. A.A.A. Sukartini Djelantik, Sp.M(K) 1. Prof. Dr. dr. N. Adiputra, M.OH
2. Prof. dr. N.K. Niti Susila,Sp.M(K) 3. dr. Made Agus Kusumadjaja. Sp.M(K)
UCAPAN TERIMA KASIH
Pertama-tama perkenankanlah penulis memanjatkan puji syukur kepada Tuhan Yang Maha Esa, atas berkah-Nya, sehingga tesis ini dapat terselesaikan. Penulis menyadari sepenuhnya tesis ini tidak mungkin dapat selesai tanpa bantuan dari berbagai pihak. Pada kesempatan ini, izinkan penulis dengan setulus hati menghaturkan rasa terima kasih yang tak terhingga kepada :
1. Rektor Universitas Udayana Prof. Dr. dr. Ketut Suastika, SpPD-KEMD dan Dekan Fakultas Kedokteran Udayana, Prof. Dr. dr. Putu Astawa, Sp.OT(K), M.Kes yang telah memberikan kesempatan dan fasilitas untuk mengikuti dan menyelesaikan Program Magister Pascasarjana dan Program Pendidikan Dokter Spesialis 1 di Universitas Udayana.
2. Direktur Program Pascasarjana Universitas Udayana, Prof. Dr. dr. AA Raka Sudewi, SpS(K) atas kesempatan dan fasilitas yang diberikan sebagai mahasiswa Program Pascasarjana Universitas Udayana.
3. Ketua Program Studi Ilmu Biomedik Combined Degree, Prof. Dr. dr. Wimpie, I. Pangkahila, SpAnd., FAACS yang telah memberikan kesempatan untuk mengikuti pendidikan Program Studi Ilmu Biomedik combined degree.
4. Direktur RSUP Sanglah Denpasar, dr. Anak Ayu Sri Saraswati, M.kes atas kesempatan dan fasilitas yang diberikan dalam menjalani Program Pendidikan Dokter Spesialis 1 di Bagian Ilmu Kesehatan Mata.
5. Kepala Bagian Ilmu Kesehatan Mata Fakultas Kedokteran Universitas Udayana, dr. Putu Budhiastra, SpM (K) yang telah memberikan kesempatan mengikuti program
pendidikan spesialisasi dan memberikan bimbingan selama menjalani pendidikan spesialisasi.
6. Ketua Program Studi Ilmu Kesehatan Mata Fakultas Kedokteran Universitas Udayana, dr. AAA Sukartini Djelantik, SpM(K) yang telah memberikan kesempatan mengikuti program pendidikan spesialisasi, memberi petunjuk, serta bimbingan selama menjalani pendidikan spesialisasi.
7. dr. W. G. Jayanegara, SpM(K), sebagai pembimbing I yang telah meluangkan waktu, memberikan petunjuk dan pengarahan, sejak awal penulisan sampai dapat menyelesaikan tesis ini.
8. dr. AAA Sukartini Djelantik, SpM(K) selaku pembimbing II yang selalu memberikan bimbingan dan pengarahan hingga terselesaikannya tesis ini.
9. Prof. Dr. dr. N. Adiputra, M.OH, Prof. N.K. Niti Susila, Sp.M(K) dan dr. Made Agus Kusumadjaja, Sp.M(K) selaku penguji atas semua masukan, koreksi dan saran dalam penyelesaian tesis ini.
10. Direktur RS Indera Denpasar atas kesempatan dan fasilitas yang diberikan untuk melaksanakan penelitian di RS Indera Denpasar.
11. Dr. I G.N. Made Sugiana SpM, sebagai Kepala SMF Mata RS Indera Denpasar, yang telah memberikan kesempatan untuk melaksanakan penelitian di RS Indera Denpasar.
12. Prof. DR. Ir. I.B. Putra Manuaba, M.Phil atas bantuan dan kerjasamanya dalam pemeriksaan sampel penelitian serta memberikan masukan mengenai statistik penelitian.
13. Seluruh Konsulen Ilmu Kesehatan Mata serta dosen Pascasarjana Program Studi Ilmu Biomedik Combined Degree atas segala bimbingannya.
14. Seluruh teman sejawat residen di Bagian Ilmu Kesehatan Mata Fakultas Kedokteran Universitas Udayana atas bantuan dan kerjasamanya selama ini
15. Seluruh paramedik di Poliklinik Mata dan IBS RSUP Sanglah atas bantuan dan kerjasamanya dalam pengumpulan sampel penelitian.
16. Seluruh paramedik di Poliklinik Mata dan Ruang Operasi RS Indera Denpasar atas kerjasamanya dalam pengumpulan sampel penelitian.
Rasa syukur dan sujud kepada Ayahanda dan Ibunda kami I Nengah Sumatra, Ama.Pd. dan Ni Putu Rusmawati, yang telah memberikan doa, kasih-sayang, motivasi dan semangat kepada penulis. Ayahanda dan Ibunda Mertua I Ketut Nilawarsa dan Ni Nyoman Tunas, terimakasih atas dorongannya selama ini. Akhirnya kepada istri tercinta Ni Luh Made Cintia Dewi dan Ananda tersayang I Putu Prema Khamahitha dan I Made Raktha Anantanaya atas doa, dorongan semangat, dan pengertian selama penulis menyelesaikan pendidikan dan penelitian ini.
Semoga tesis ini memberikan manfaat dan sumbangan yang berguna bagi perkembangan pelayanan kesehatan mata serta bagi pendidikan IImu Kesehatan Mata. Terakhir, semoga Sang Hyang Widhi Wasa – Tuhan Yang Maha Esa, selalu melimpahkan rahmat-Nya kepada kita semua.
Denpasar, 18 Juni 2014
ABSTRAK
PENURUNAN KADAR SUPEROKSIDA DISMUTASE LENSA BERHUBUNGAN DENGAN
PENINGKATAN DERAJAT KEKERUHAN LENSA PADA KATARAK SENILIS
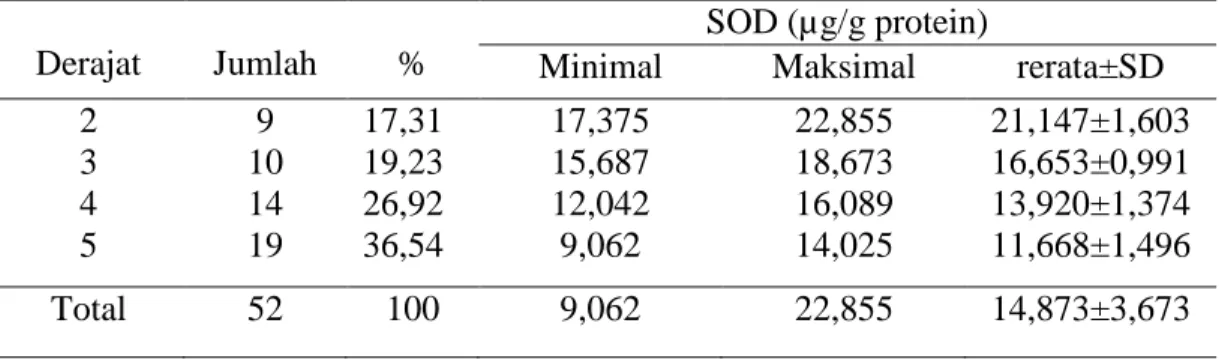
Katarak senilis merupakan penyakit multifaktorial dan salah satu faktornya adalah stres oksidatif. Superoksida dismutase adalah satu antioksidan enzimatik lensa yang melindungi mata dari stres oksidatif. Penelitian ini bertujuan untuk mengetahui hubungan antara penurunan kadar superoksida dismutase (SOD) dengan peningkatan derajat kekeruhan lensa pada katarak senilis. Penelitian ini merupakan penelitian potong lintang analitik yang dilakukan di poliklinik Mata RSUP Sanglah dan RS Indera, Denpasar, Bali, mulai bulan Januari 2014 sampai bulan Mei 2014. Pasien katarak senilis dikelompokkan menjadi 4 kelompok berdasarkan derajat kekeruhan lensa menurut Burrato. Sampel diambil dengan teknik consecutive sampling dan dioperasi atas indikasi visual. Lensa yang diekstraksi diperiksa kadar SOD-nya. Jumlah sampel yang diperiksa sebanyak 52 lensa. Rerata kadar SOD lensa pada Derajat 2 sebesar 21,147±1,603 µg/g protein, Derajat 3 sebesar 16,653±0,991 µg/g protein, Derajat 4 sebesar 13,920±1,374 µg/g protein dan Derajat 5 sebesar 11,668±1,496 µg/g protein. Hubungan kadar SOD lensa derajat kekeruhan lensa dianalisis dengan uji Spearman dan didapatkan hubungan negatif yang sangat kuat (r= - 0,9) dan bermakna secara statistik (p=0,001). Berdasarkan hasil penelitian tersebut dapat disimpulkan bahwa penurunan kadar superoksida dismutase lensa berhubungan dengan peningkatan derajat kekeruhan lensa pada katarak senilis. Penelitian lebih lanjut diperlukan untuk mencari faktor-faktor lain yang ikut berperan dalam etiopatogenesis katarak senilis selain SOD.
Kata kunci : katarak senilis, derajat kekeruhan lensa, kadar superoksida dismutase
ABSTRACT
DECREASED OF LENS SUPEROXIDE DISMUTASE LEVEL CORRELATED WITH INCREASED OF LENS OPACIFICATION GRADE
IN SENILE CATARACT
Senile cataract is a multifactorial disease including oxidative stress. Superoxide dismutase (SOD) is one of the enzymatic antioxidant lenses that protect the lens from oxidative stress. The aim of this study was to determine the correlation between the levels of lens superoxide dismutase and the grade of opacification of the lens in senile cataract. This study was an analytic cross-sectional observasional study conducted in Eye clinic Sanglah Hospital and Indera Hospital, Denpasar, Bali, starting in January 2014 until May 2014. Senile cataract patients classified into 4 groups based on the grade of lens opacification according Burrato criteria. Samples were taken with consecutive sampling technique and operation on visual indication. The extracted lens were examined for SOD level. A total of 52 patients were included in this study. The mean level of lens SOD were 21.147±1.603 µg/g protein in grade 2, 16.653±0.991 µg/g protein in grade 3, 13.920±1.374 µg/g protein in grade 4 and 11.668±1.496 µg/g protein in grade 5. Spearman's correlation test showed that was a very strong negative correlation between lens SOD level and grade of lens opacification in senile cataract (r= -0.9) and statistically significant (p=0.001). The conclusion was the decreased of lens SOD level correlated with increased of lens opacification grade in senile cataract. Further research is needed to look for other factors that play a role in the aetiopathogenesis senile cataract in addition to SOD.
DAFTAR ISI
Halaman
HALAMAN JUDUL……… PRASYARAT GELAR……… LEMBAR PENGESAHAN………. PENETAPAN PANITIA PENGUJI ………... SURAT PERNYATAAN BEBAS PLAGIAT……… UCAPAN TERIMA KASIH……….. ABSTRAK……….. ABSTRACT………. i ii iii iv v vi ix x DAFTAR ISI……… DAFTAR TABEL……… xi xiv DAFTAR GAMBAR………... xv
DAFTAR SINGKATAN DAN LAMBANG……….. xvi
DAFTAR LAMPIRAN ... xvii
BAB I PENDAHULUAN 1.1 Latar Belakang………. 1 1.2 Rumusan Masalah……… 7 1.3 Tujuan Penelitian………. 7 1.4 Manfaat Penelitian………...… 8 1.4.1 Manfaat teoritis ..………...… 8 1.4.2 Manfaat praktis………...…….. 8
BAB II KAJIAN PUSTAKA 2.1 Lensa………... 9
2.1.1 Anatomi dan histologi lensa ... 9
2.1.2 Biokimia lensa ... 11
2.1.3 Fisiologi lensa .………...…….. 13
2.2.1 Definisi dan epidemiologi katarak ...………...…….. 15
2.2.2 Etiologi dan patofisiologi katarak senilis ...……...…….. 16
2.2.3 Derajat kekeruhan lensa katarak senilis ....………... 2.2.4 Indikasi bedah pada katarak senilis……….. 18 18 2.3 Radikal bebas dan Stres Oksidatif... 19
2.3.1 Radikal bebas……...………... 19
2.3.2 Stres oksidatif………... 21
2.3.3 Antioksidan………. ... 22
2.3.4 Superoksida dismutase………...………... 24
2.3.5 Stres oksidatif pada katarak senilis………. 26
BAB III KERANGKA KONSEP DAN HIPOTESIS PENELITIAN 3.1 Kerangka Berpikir .………. 30
3.2 Konsep Penelitian…………...………. 31
3.3 Hipotesis Penelitian ………….………... 31
BAB IV METODE PENELITIAN 4.1 Rancangan Penelitian………... 32
4.2 Lokasi dan Waktu Penelitian………... 32
4.3 Populasi dan Sampel Penelitian……...………... 33
4.3.1 Populasi penelitian...……….. 33
4.3.2 Sampel penelitian ………... 33
4.3.2.1 Kriteria inklusi dan eksklusi penelitian ... 33
4.3.2.2 Besar sampel...………....…. 34
4.3.2.3 Cara pemilihan sampel…...………... 35
4.4 Variabel Penelitian………... 35
4.4.1 Klasifikasi dan identifikasi variabel………... 35
4.4.2 Definisi operasional variabel……….. 36
4.5 Instrumen Penelitian... 37
4.6 Prosedur Penelitian... 37
4.6.2 Pelaksanaan penelitian... 38
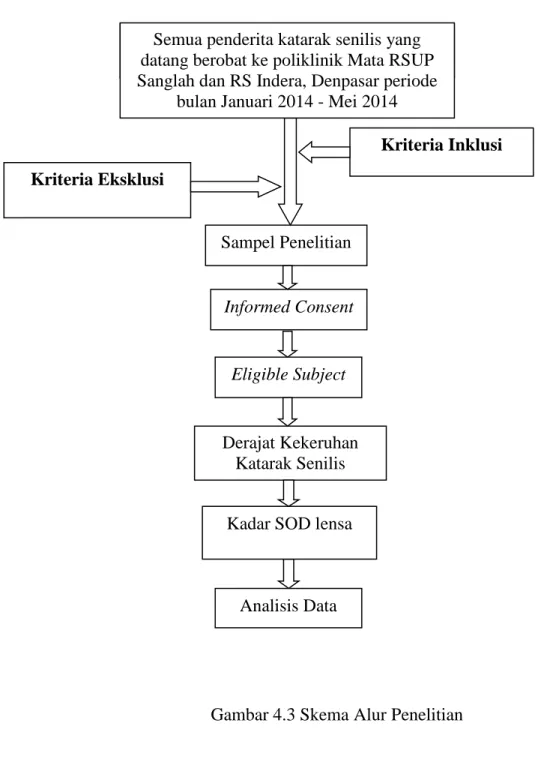
4.7 Alur Penelitian ... 40
4.8 Analisis Data ...……….……... 41
BAB V HASIL PENELITIAN 5.1 Karakteristik Subjek Penelitian……… 42
5.2 Perbedaan Kadar SOD Lensa pada Masing-Masing Derajat Kekeruhan Lensa……….. 43
5.3 Hubungan Kadar SOD Lensa dengan Derajat Kekeruhan Lensa… 45
BAB VI PEMBAHASAN 6.1 Subjek Penelitian……… 46
6.2 Kadar SOD Lensa pada Katarak Senilis……… 50
6.3 Hubungan antara Kadar SOD Lensa dengan Derajat Kekeruhan Lensa pada Katarak senilis……… 56 BAB VII SIMPULAN DAN SARAN 7.1 Simpulan………. 64
7.2 Saran……… 64
DAFTAR PUSTAKA………....……. 65
DAFTAR TABEL
5.1 Karakteristik Subjek Penelitian ……… 43 5.2 Perbedaan Kadar SOD Lensa pada Masing-Masing Derajat
Kekeruhan Lensa……….. 44
DAFTAR GAMBAR
Halaman
2.1 Anatomi Lensa ... 10
2.2 Mekanisme Terjadinya ROS……...………... 21
2.3 Mekanisme Aktivitas ROS dan Antioksidan pada Lensa... 28
3.1 Bagan Konsep Penelitian ... 31
4.1 Rancangan Penelitian ... 32
4.2 Skema Hubungan Antar Variabel ... 35
4.3 Skema Alur Penelitian ... 40
5.1 Grafik Kadar SOD lensa pada Masing-Masing Derajat Kekeruhan Lensa……… 44
DAFTAR SINGKATAN DAN LAMBANG ATP AINS DNA HCl HMP H2O2 GSH GPX GSP GSSG HMP LOOH MDA NADPH Na-K-ATPase O2- OH- PNS RNA ROS SD SMP SMA SOD SICS WHO = Adenosine Triphosphate = Anti inflamasi non steroid = Deoxyribosa Nucleic Acid = Hidrogen Chlorida = Hexose Monophosphate = Hidrogen Peroksida = Glutation = Glutation Peroxidase = Glutation S-Transferase = Glutation Disulfida = Hexose Monophosphat = Lipid Peroksida = Malondialdehyde
= Nicotinamide Adenine Dinucleotide Phosphate = Natrium-Kalium-Adenosine Triphosphatease = Superoksida
= Hidroksil
= Pegawai Negeri Sipil = Ribonucleic Acid
= Reactive Oxygen Species = Sekolah Dasar
= Sekolah Menengah Pertama = Sekolah Menengah Atas = Superoxide Dismutase
= Small Incision Cataract Surgery = World Health Organization
DAFTAR LAMPIRAN
Lampiran 1 Surat Keterangan Kelaikan Penelitian……….. 72
Lampiran 2 Surat Ijin Penelitian di RSUP Sanglah………… 73
Lampiran 3 Surat Ijin Penelitian di RS Indera……… 74
Lampiran 4 Penjelasan Penelitian……….. 75
Lampiran 5 Lembar Persetujuan ... 77
BAB I
PENDAHULUAN
Lampiran 7 Hasil Pemeriksaan Kadar SOD Lensa…………. 80 Lampiran 8 Tabel Induk Penelitian…... 82
1.1 Latar Belakang
Katarak merupakan penyebab kebutaan yang terbanyak di dunia sampai saat ini bila dibandingkan dengan penyakit mata lainnya. Katarak pada umumnya adalah penyakit degeneratif yang terjadi pada usia lanjut. Katarak dapat terjadi tanpa keluhan atau dengan keluhan berupa gangguan penglihatan dari derajat ringan sampai berat bahkan berakhir dengan kebutaan. Kebutaan karena katarak di Indonesia maupun di negara berkembang lainnya akan terus menjadi masalah kesehatan masyarakat.
Menurut World Health Organization (WHO), di dunia pada saat ini jumlah penderita dengan tajam penglihatan terganggu sebanyak 180 juta, dan 37 juta orang di antaranya mengalami kebutaan serta diperkirakan akan meningkat menjadi dua kali lipat pada tahun 2020 (American Academy of Ophthalmology Staff, 2011-2012a). Survei kesehatan indera penglihatan di Indonesia tahun 1993-1996 menunjukkan angka kebutaan 1,47% dari total jumlah penduduk. Penyebab utama kebutaan di Indonesia, yaitu katarak (1,02%), glaukoma (0,16%), kelainan refraksi (0,14%), kelainan retina 0,09%, dan kelainan kornea 0,06% (Depkes RI, 2009).
Katarak senilis merupakan hampir 90% dari seluruh kasus katarak. (American Academy of Ophthalmology Staff, 2011-2012a). Katarak senilis adalah kekeruhan lensa yang menyebabkan penurunan tajam penglihatan yang berkaitan dengan proses degenerasi lensa yang berusia lanjut, yaitu di atas 40 tahun (Gondhowiardjo dan Simanjuntak, 2006; Ilyas, 2008). Jumlah penderita katarak di Indonesia saat ini berbanding lurus dengan jumlah penduduk usia lanjut, yang pada tahun 2000 diperkirakan mencapai 15,3 juta dan cenderung bertambah besar pada tahun 2025 akan mengalami peningkatan sebesar 414 % dibandingkan dengan keadaan pada tahun 1990
(Depkes RI, 2009). Katarak senilis menjadi masalah yang serius di bidang kesehatan (Brian dan Taylor, 2001; Chang dkk., 2008). Jumlah pasien katarak senilis di Bali kemungkinan besar akan meningkat pula dengan bertambahnya jumlah penduduk usia tua.
Penelitian epidemiologi di India melaporkan terjadi peningkatan prevalensi katarak senilis dari 3,44% pada usia di bawah 50 tahun menjadi 60,91% pada penduduk usia 50-60 tahun (Purushottam, 2009). Katarak umumnya terjadi pada usia lanjut, namun 16% katarak di Indonesia terjadi pada usia produktif (40-45 tahun) (Depkes RI, 2009). Masyarakat Indonesia memiliki kecenderungan menderita katarak 15 tahun lebih cepat dibandingkan penderita di daerah subtropik. Peningkatan maturitas atau kekeruhan katarak senilis tentunya diikuti pula dengan semakin berkurangnya tajam penglihatan pasien yang pada akhirnya akan menimbulkan beban baik bagi pasien maupun keluarganya (Soehardjo, 2004).
Sampai sekarang tidak terdapat penanganan medis untuk katarak senilis kecuali pembedahan. Peningkatan maturitas juga berpengaruh pada semakin tingginya kejadian komplikasi baik sebelum maupun pada saat dilakukan tindakan pembedahan katarak (Soehardjo, 2004). Pembedahan katarak masih sulit dijangkau oleh sebagian besar masyarakat akibat kurangnya fasilitas kesehatan, sumber daya manusia belum memadai, besarnya biaya yang diperlukan untuk operasi, sehingga angka backlog katarak di Indonesia masih tinggi. Demikian pula hasil akhir operasi terkadang tidak sesuai harapan (Brain dan Taylor, 2001). Oleh karena itu diperlukan pemahaman yang mendalam tentang etiopatogenesis katarak senilis, sehingga dapat dikembangkan strategi dalam usaha memperlambat perkembangan maturitas katarak senilis (Delcourt
dkk., 2003; Tabin dkk., 2008; Chang dkk., 2013). Proses terjadinya katarak senilis memang tidak dapat dicegah namun usaha untuk menunda onset terjadinya atau menghambat progresivitas katarak dapat mengurangi jumlah operasi katarak (Taylor, 2000). Bila onset terjadinya katarak dapat ditunda sampai 10 tahun, kebutuhan operasi dapat diturunkan sampai setengah dari jumlah keseluruhan penderita yang memerlukan operasi (Brian dan Taylor, 2001; Virgolici dkk., 2009).
Etiopatogenesis katarak bersifat multifaktorial dan sampai saat ini belum sepenuhnya diketahui secara pasti (Beebe dkk., 2010; American Academy of Ophthalmology Staff, 2011-2012a). Salah satu teori tentang etiopatogenesis katarak yang banyak berkembang belakangan ini adalah mekanisme stres oksidatif. Stres oksidatif adalah suatu keadaan ketidakseimbangan antara radikal bebas dengan antioksidan (Palmiere dan Sblendario, 2006; Winarsi, 2007). Stres oksidatif yang terjadi terus-menerus merupakan mekanisme penting yang berpengaruh pada proses terjadinya katarak. Lensa mata sangat sensitif terhadap stres oksidatif. Lensa berada dalam lingkungan endogen yang kaya dengan radikal bebas yang diproduksi oleh konsentrasi oksigen lokal yang tinggi, paparan sinar ultraviolet yang lama dan aktivitas sel-sel epitelial lensa yang patologis (Virgolici dkk., 2009). Lensa mata normal dilengkapi perlindungan dan sistem antioksidan untuk melawan stres oksidatif. Seiring bertambahnya usia dan adanya paparan yang terus-menerus oleh agen dari luar, sehingga terjadi akumulasi radikal bebas yang berlebihan dan akan menyebabkan gangguan mekanisme proteksi antioksidan lensa mata (Cekic dkk., 2010; American Academy of Ophthalmology Staff, 2011-2012a). Hasil akumulasi dari stres oksidatif menyebabkan gangguan fungsi metabolisme lensa, agregasi protein lensa, peningkatan
protein tidak larut air (water insoluble protein), sehingga menyebabkan gangguan transparansi lensa dan terjadi katarak (El-Ghaffar dkk., 2007; American Academy of Ophthalmology Staff, 2011-2012a; Kisic dkk., 2012).
Radikal bebas mempunyai sifat sangat reaktif dan dapat mengubah molekul menjadi radikal. Radikal bebas atau Reaktive Oxygen Species (ROS) merupakan suatu bentukan yang dihasilkan oleh pernapasan secara aerob dan reaksi metabolik yang menggunakan oksigen. Oksigen selama proses oksidasi akan dikonversi menjadi air, tetapi 1-2% akan menjadi oksigen reaktif terutama superoksida (O2-), hidroksil (OH•)
dan hidroperoksida (H2O2). Superoksida ini sangatlah reaktif dan membutuhkan
antioksidan untuk menetralisirnya (William, 2006;Ates dkk., 2010). Radikal bebas ini akan merusak membran sel yang banyak mengandung asam lemak tidak jenuh menjadi peroksida lipid. Peroksida lipid sebagai radikal bebas yang sangat toksik beredar di seluruh tubuh dan akan merusak membran sel yang merupakan awal dari pembentukan katarak. (Vinson, 2006; Winarsi, 2007).
Antioksidan adalah senyawa yang mampu menangkal dampak negatif radikal bebas. Superoksida dismutase (SOD) merupakan salah satu enzim antioksidan penting yang berasal dari tubuh sendiri, berefek sangat kuat dan merupakan pertahanan tubuh garis pertama dalam mengatasi stres oksidatif (Rajkumar dkk., 2008). SOD merupakan antioksidan pencegah yang dapat menghambat sebelum anion superoksida menyebabkan kerusakan. Cara kerja SOD adalah dengan mengkonversi anion superoksida (O2-) menjadi komponen lain yang kurang berbahaya, yaitu hidrogen
peroksida (H2O2) yang selanjutnya dengan bantuan katalase diubah menjadi air (H2O)
ditunjukkan oleh rendahnya kadar aktivitas enzim antioksidan dan tingginya kadar malondialdehid (MDA) pada plasma (Winarsi, 2007; American Academy of Ophthalmology Staff, 2011-2012a). Priyanti (2013), melaporkan kadar MDA pada katarak senilis matur lebih tinggi daripada katarak senilis imatur.
Beberapa penelitian menyebutkan SOD adalah biomarker yang amat penting untuk mengetahui kapasitas antioksidan dalam patogenesis terjadinya katarak senilis namun hasilnya masih bervariasi (Chakraborty dkk., 2007; Rajkumar dkk., 2008). Penelitian Kaur dkk. (2012) di India, menemukan SOD serum pasien katarak senilis (2,0-3,3unit/ml) lebih rendah daripada orang tanpa katarak senilis(2,8-66,6 unit/ml). Deepa dkk. (2011) yang melakukan penelitian di India menemukan aktivitas antioksidan lensa pada katarak senilis matur (0,765±0,059 unit/ml) lebih rendah daripada katarak senilis imatur (0,886±0,069 unit/ml). Chakraborty dkk. (2007) menemukan bahwa terjadi penurunan SOD dalam serum pasien katarak senilis (3,28±0,32 unit/ml) bila dibandingkan dengan kontrol (4,06±0,26 unit/ml) yang merupakan pasien tanpa katarak senilis. Demikian juga penelitian di China yang dilakukan oleh Chang dkk. (2013) menemukan bahwa kadar SOD serum pada pasien katarak senilis (97,26±13,56 unit/ml) lebih rendah daripada orang normal (103,47±18,97 unit/ml). Hasil yang berbeda diperoleh pada penelitian POLA bahwa peningkatan kadar SOD eritrosit dengan peningkatan risiko katarak senilis tipe nuklear (Delcourt dkk., 2003). Nourmohammadi dkk. (2001) pada penelitian di Iran menemukan peningkatan aktivitas SOD eritrosit pada pasien katarak dibandingkan dengan pasien tanpa katarak.
Telah diketahui bahwa hampir setiap sel tubuh manusia menghasilkan SOD yang berfungsi melindungi sel selama metabolisme tubuh yang menggunakan oksigen dengan menangkap radikal bebas dan mengubahnya menjadi bentuk yang kurang berbahaya. SOD bekerja di seluruh organ bahkan di setiap sel demikian pula sel-sel lensa mata. Lensa adalah organ yang spesifik,yaitu avaskular dan seluruh metabolismenya didukung oleh humor akuos. Aktivitas SOD pada lensa mata berbeda dengan organ atau jaringan lainnya (American Academy of Ophthalmology Staff, 2011- 2012a; Kisic dkk., 2012). Selama ini telah banyak penelitian mengenai aktivitas SOD secara sistemik yang diukur dari sampel serum darah dan eritrosit sedangkan penelitian aktivitas atau kadar SOD pada lensa mata masih sedikit. Penelitian ini mengukur kadar SOD pada lensa pasien katarak yang telah menjalani operasi katarak dengan indikasi visual dan diharapkan dapat diketahui kadar SOD langsung pada target organ yang mengalami stres oksidatif.
Penelitian mengenai hubungan kadar SOD lensa dengan derajat kekeruhan lensa pada pasien katarak senilis belum pernah dilakukan sampai saat ini di Bali bahkan di Indonesia. Penduduk pulau Bali umumnya termasuk ras melayu, tinggal di daerah tropis dengan paparan sinar ultra violet yang banyak, umumnya bekerja sebagai petani, tingkat pendidikan yang relatif rendah, dan nutrisi yang tentunya berbeda dibandingkan dengan penelitian sebelumnya yang dilakukan di negara lain tentunya akan memberikan hasil penelitian yang berbeda. Wawasan tentang etiopatogenesis katarak senilis dalam hubungannya dengan stres oksidatif melalui pemeriksaan SOD, diharapkan dapat memberikan masukan dalam pengembangan strategi untuk menunda onset terjadinya katarak senilis.
1.2 Rumusan Masalah
Apakah penurunan kadar SOD lensa berhubungan dengan peningkatan derajat kekeruhan lensa pada katarak senilis?
1.3 Tujuan Penelitian
Untuk mengetahui hubungan antara penurunan kadar SOD lensa dengan peningkatan derajat kekeruhan lensa pada katarak senilis.
1.4 Manfaat Penelitian
1.4.1 Manfaat teoritis
1. Menambah pengetahuan dan pemahaman tentang etiopatogenesis katarak senilis dalam hubungannya dengan stres oksidatif.
2. Menambah pengetahuan dan pemahaman tentang kadar SOD lensa pada masing-masing derajat kekeruhan lensa katarak senilis.
1.4.2 Manfaat praktis
1. Dapat digunakan sebagai bahan pertimbangan, peran SOD dalam menilai dan memprediksi derajat kekeruhan lensa katarak senilis.
2. Dapat digunakan sebagai awal dari sebuah pohon penelitian, sehingga nantinya dapat dilakukan penelitian lebih lanjut untuk mengembangkan strategi dalam memperlambat onset terjadinya katarak senilis.
BAB II
2.1. Lensa
2.1.1 Anatomi dan histologi lensa
Lensa adalah struktur kristalin berbentuk bikonveks dan transparan. Lensa adalah salah satu dari media refraktif terpenting yang berfungsi memfokuskan cahaya masuk ke mata agar tepat jatuh di retina. Lensa memiliki dua permukaan, yaitu permukaan anterior dan posterior. Permukaan posterior lebih cembung daripada permukaan anterior. Lensa bersama dengan iris membentuk diafragma optikal yang memisahkan bilik anterior dan posterior bola mata. Lensa tidak memiliki serabut saraf, pembuluh darah, dan jaringan ikat (Lang, 2000; American Academy of Ophthalmology Staff, 2011-2012b).
Secara histologis, lensa memiliki empat komponen utama, yaitu kapsul lensa, epitelial subkapsular, korteks , dan nukleus. Kapsul lensa terdiri dari kapsul anterior dan kapsul posterior. Kapsul ini merupakan suatu membran basalis dan terutama terdiri atas kolagen tipe IV, beberapa serat kolagen lain dan komponen matriks ekstraselular, seperti glikosaminoglikan, laminin, fibronektin, dan proteoglikan (Sihota dan Tandan, 2007; American Academy of Ophthalmology Staff, 2011-2012b). Epitelial subkapsular terdiri atas sel epitel kuboid yang hanya terdapat pada permukaan anterior lensa. Epitelial subkapsular yang berbentuk kuboid akan berubah menjadi kolumnar di bagian ekuator dan akan terus memanjang dan membentuk serat lensa. Lensa bertambah besar dan tumbuh seumur hidup dengan terbentuknya serat lensa baru dari sel-sel yang terdapat di ekuator lensa. (Kanski, 2003; American Academy of Ophthalmology Staff, 2011-2012b).
Nukleus merupakan serat massa lensa yang terbentuk sejak lahir sedangkan korteks merupakan serat yang terbentuk setelah lahir. Nukleus lensa lebih keras daripada korteks. Serat lensa tersusun memanjang dan tampak sebagai struktur tipis dan gepeng. Serat ini merupakan sel-sel yang sangat terdiferensiasi dan berasal dari sel-sel subkapsular. Serat lensa akhirnya kehilangan inti serta organelnya dan menjadi sangat panjang. Sesuai dengan bertambahnya umur, lensa lama-kelamaan menjadi lebih besar dan kurang elastis. Sel-sel ini berisikan sekelompok protein yang disebut kristalin. Nukleus dan korteks terbentuk dari lamella konsentris yang panjang. Lensa ditahan di tempatnya oleh sekelompok serat yang tersusun radial yang disebut zonula, yang satu sisinya tertanam di kapsul lensa dan sisi lainnya pada badan siliar (Sihota dan Tandan, 2007; American Academy of Ophthalmology Staff, 2011-2012b).
Gambar 2.1 Anatomi lensa
(American Academy of Ophthalmology Staff, 2011-2012b)
Lensa manusia mempunyai konsentrasi protein 33% dari berat keringnya, 2 kali lebih besar daripada di jaringan lainnya. Protein lensa dibagi ke dalam dua kelompok berdasarkan kelarutannya di dalam air, yaitu fraksi yang larut dalam air dan fraksi yang tidak larut dalam air. Fraksi yang larut di dalam air berjumlah sekitar 80% dari protein lensa dan terdiri dari sekelompok protein yang disebut kristalin. Kristalin merupakan protein intraselular yang tersusun di dalam epitelial dan membran plasma dari serat lensa. Kristalin dibagi ke dalam tiga kelompok, yaitu: alfa, beta, dan gamma. Fraksi yang tidak larut di dalam air dibagi lagi menjadi dua fraksi, yaitu yang larut dan tidak larut di dalam urea. Fraksi yang larut dalam urea terdiri dari protein sitoskeletal yang menjadi penyusun struktur sel lensa. Fraksi yang tidak larut di dalam urea menyusun membran plasma serat lensa (Lang, 2006; American Academy of Ophthalmology Staff, 2011-2012a). Lensa membutuhkan suplai energi dalam bentuk adenisine triphosphate (ATP) yang terus-menerus untuk transport aktif ion dan asam amino, mempertahankan keadaan dehidrasi lensa, untuk sintesis protein dan glutation (GSH) secara terus-menerus. Kebanyakan energi yang dihasilkan dipakai oleh sel-sel epitelial sebagai tempat utama proses transpor aktif. Hanya sekitar 10-20% ATP yang digunakan untuk sintesis protein (Kanski, 2003; American Academy of Ophthalmology Staff, 2011-2012a).
Produksi energi sangat bergantung pada metabolisme glukosa. Glukosa memasuki lensa dari humor akuos secara difusi, baik yang sederhana maupun yang terfasilitasi. Metabolisme glukosa pada lensa, 78% dimetabolisme secara anaerob oleh jalur glikolisis, 5% oleh hexose monophosphate (HMP) shunt dan sebagian kecil melalui siklus Krebs (Vavvas dkk., 2002; American Academy of Ophthalmology Staff,
2011-2012a). Kebanyakan glukosa yang ditransport ke dalam lensa difosforilasi menjadi glukosa-6-fosfat (G6P) oleh enzim heksokinase. Kemudian G6P akan memasuki dua jalur metabolisme, yaitu glikolosis anaerob dan HMP shunt (Kanski, 2003; American Academy of Ophthalmology Staff, 2011-2012a).
Jalur yang paling aktif adalah glikolosis anaerob, yang menyediakan ATP dalam jumlah yang banyak yang dibutuhkan untuk metabolisme lensa. Jalur glikolisis anaerob kurang efektif dibandingkan glikolisis aerob karena hanya menghasilkan 2 molekul ATP dari 1 molekul glukosa sedangkan glikolisis aerob menghasilkan 36 ATP. Rendahnya tekanan oksigen di dalam lensa menyebabkan hanya sekitar 3% dari glukosa lensa yang melalui jalur siklus Krebs untuk menghasilkan energi (Lang, 2006; American Academy of Ophthalmology Staff, 2011-2012a).
Jalur yang kurang aktif dalam menggunakan G6P di dalam lensa adalah HMP
shunt atau yang biasa dikenal sebagai jalur pentosa fosfat. Aktivitas HMP shunt di
dalam lensa lebih tinggi daripada jaringan tubuh lainnya. Aktivitas HMP shunt menghasilkan nicotinamide adenine dinucleotide phosphate (NADPH) untuk biosintesis asam lemak dan biosintesis ribosa nukleotida. NADPH juga yang sangat penting untuk glutation reduktase dan untuk aktivitas aldose reduktase di dalam lensa. Produk karbohidrat dari HMP shunt memasuki jalur glikolisis dan dimetabolisme menjadi laktat (Kanski, 2003; American Academy of Ophthalmology Staff, 2011-2012a).
Jalur sorbitol relatif tidak tetap pada lensa normal tetapi jalur ini berperan penting dalam terjadinya katarak pada pasien diabetes dan galaktosemia. Aldose reduktase merupakan enzim kunci dalam jalur sorbitol. Ketika terjadi peningkatan kadar glukosa di dalam lensa, seperti yang terjadi pada keadaan hiperglikemia, jalur sorbitol
lebih diaktifkan daripada jalur glikolisis dan sorbitol terakumulasi. Sorbitol dimetabolisme menjadi fruktosa oleh enzim polyol dehidrogenase. Sebagian kecil glukosa akan mengalami metabolisme aerob melalui siklus Krebs. Metabolisme aerob ini dapat menghasilkan radikal bebas yang dapat mengganggu fisiologi lensa (Vavvas dkk., 2002; Berthoud dan Beyer, 2009; American Academy of Ophthalmology Staff, 2011-2012a).
2.2.3 Fisiologi Lensa
Epitelial merupakan bagian lensa dengan tingkat metabolisme paling tinggi. Pada epitelial lensa terjadinya aktivitas metabolisme dan transport aktif yang membawa keluar seluruh hasil aktivitas sel normal termasuk deoxyribonucleic acid (DNA),
ribonucleic acid (RNA), protein, sintesis lipid, dan ATP. ATP dibutuhkan untuk
transportasi nutrisi, memelihara pertumbuhan sel, dan transparansi lensa. Lensa bersifat avaskular, sehingga humor akuos berfungsi sebagai sumber nutrisi dan mengeluarkan produk sisa metabolik lensa (Vavvas dkk., 2002).
Aspek fisiologi yang terpenting dalam menjaga ketransparanan lensa adalah pengaturan keseimbangan cairan dan elektrolit. Ketransparanan lensa sangat bergantung pada komponen struktural, makromolekular dan hidrasi lensa Lensa mempunyai kadar kalium dan asam amino yang tinggi dibandingkan humor akuos dan korpus vitreus tetapi memiliki kadar natrium dan klorida yang lebih rendah dibandingkan sekitarnya. Keseimbangan elektrolit diatur oleh permeabilitas membran dan pompa natrium dan enzim Na-K-ATPase. Pompa ini berfungsi memompa natrium keluar dan memompa kalium untuk masuk. Kalium dan asam amino ditransportasikan ke dalam lensa secara aktif ke anterior lensa melalui epitelial. Lalu kalium dan asam amino akan berdifusi
melalui bagian posterior lensa sedangkan natrium masuk ke dalam lensa di bagian posterior lensa secara difusi dan keluar melalui bagian anterior lensa secara aktif (American Academy of Ophthalmology Staff, 2011-2012a).
Kadar natrium di dalam lensa sekitar 20 mM dan kadar kalium sekitar 120 mM. Kadar natrium dan kalium di sekitar humor akuos dan korpus vitreus sedikit berbeda. Natrium lebih tinggi sekitar 150 mM sedangkan kalium sekitar 5 mM. Pompa natrium berfungsi memompa ion natrium keluar sedangkan ion kalium masuk. Mekanisme pompa natrium bergantung pada pemecahan ATP dan diatur oleh enzim Na-K-ATPase. Adanya hambatan pada enzim Na-K-ATPase menyebabkan kehilangan keseimbangan kation dan peningkatan air di dalam lensa (Vavvas dkk., 2002 ).
2.2. Katarak Senilis
2.2.1 Definisi dan epidemiologi katarak senilis
Katarak merupakan kekeruhan pada serabut lensa atau bahan lensa mata di dalam kapsul lensa yang diakibatkan hidrasi cairan lensa, denaturasi protein lensa, dan gangguan metabolisme lensa (Ilyas, 2008). Katarak senilis merupakan jenis katarak yang paling banyak ditemukan. Pasien katarak senilis diperkirakan mencapai 90% dari seluruh kasus katarak (American Academy of Ophthalmology Staff, 2011-2012a). Katarak senilis adalah kekeruhan lensa yang terjadi karena proses degenerasi dan biasanya mulai timbul pada usia diatas 40 tahun (Gondhowiardjo dan Simanjuntak, 2006; Ilyas, 2008).
World Health Organization (WHO) melaporkan kurang lebih 37 juta penduduk
dunia mengalami kebutaan dan 47,8% dari jumlah tersebut disebabkan oleh katarak (Tabin dkk., 2008; American Academy of Ophthalmology Staff, 2011-2012a;).
Berdasarkan survei nasional pada tahun 1993-1996, angka kebutaan di Indonesia mencapai 1,47% dari total jumlah penduduk dan merupakan angka kebutaan tertinggi di Asia Tenggara. Dari hasil survei tersebut, katarak merupakan penyebab kebutaan yang terbanyak di Indonesia, yaitu sebanyak 1.02 % (Gsianturi, 2004; Depkes RI, 2009).
Kejadian katarak senilis sangat erat kaitannya dengan umur, hal ini sesuai dengan hasil penelitian dari berbagai ras (Congdon dkk., 200l). Penelitian oleh Leske dkk. (2002) pada Barbados Eye Studies Group menunjukkan bahwa kelompok umur 50-59 tahun mempunyai angka risiko relatif 11 kali dibanding kelompok umur 40-49 tahun dan angka risiko relatif akan terus meningkat dengan bertambahnya umur. Penelitian oleh Eye Diseases Prevalence Research Group di Amerika Serikat tentang prevalensi katarak menunjukkan bahwa prevalensi katarak pada kelompok umur 40-49 tahun 2,5%, meningkat menjadi 25% pada kelompok umur 65-69 tahun dan 68,3% pada kelompok diatas 80 tahun (Friedman dkk., 2004).
2.2.2 Etiopatogenesis katarak senilis
Telah banyak informasi yang diperoleh sehubungan dengan mekanisme biokimia dan metabolism lensa normal maupun katarak pada berbagai binatang percobaan. Informasi sangat membantu menjelaskan perubahan fisik dan kimia yang terjadi akibat radiasi, trauma fisik, obat-obatan, kekurangan nutrisi, katarak pada diabetes. Timbulnya katarak senilis merupakan yang proses yang disebabkan oleh berbagai faktor yang meliputi faktor ekternal dan internal yang terjadi secara akumulasi. Faktor-faktor tersebut mempengaruhi secara berulang-ulang melalui berbagai reaksi kimia, sehingga merusak kejernihan lensa (Li, 2003; Vinson, 2006). Namun untuk menjelaskan proses kataraktogenesis sebagai proses sebab dan akibat pada katarak senilis secara pasti belum
ditemukan. Berbagai penelitian meliputi studi epidemiologi, histologis, analisis biokimia, beberapa faktor risiko kataraktogenesis sudah dan terus berlangsung sampai sekarang. Lensa katarak mempunyai tanda karakteristik berupa degenerasi hidrofik, denaturasi protein, nekrosis, dan gangguan susunan serabut lensa (Vaughan dkk., 2002). Penambahan umur akan mengakibatkan lensa menjadi lebih berat dan lebih tebal, lapisan baru serabut lensa membentuk korteks dan akhirnya nukleus menjadi tertekan kemudian mengeras. Melalui mekanisme kimia, kristalin mengalami agregasi dan berat molekulnya meningkat. Hasil agregasi protein mengakibatkan penurunan kecerahan, perubahan indeks refraksi lensa serta penyebaran sinar (American Academy of Ophthalmology Staff, 2011-2012a). Perubahan kimiawi protein nukleus lensa menghasilkan pigmen yang berlebihan, sehingga warna menjadi kuning atau abu-abu. Pada lensa juga mengalami penurunan kadar glutation dan kalium, peningkatan kadar natrium dan kalsium serta peningkatan hidrasi. Konsumsi antioksidan yang kurang juga dapat dikaitkan dengan berbagai bentuk katarak senilis (Michael dan Bron, 2011). Aktivitas sistem antioksidan enzimatik (SOD, glutation peroksidase, katalase) dan antioksidan nonenzimatik (vitamin C, glutation, sistein) yang menurun pada lensa, humor akuos dan proses penuaan sangat mempengaruhi perkembangan katarak senilis (Ozmen dkk., 2000).
Mengingat penyebab terjadinya katarak senilis bersifat multifaktorial dan belum diketahui secara pasti, maka guna mendapatkan strategi pengendalian perlu dicari beberapa faktor risiko. Berbagai faktor risiko yang dianggap berhubungan dengan terjadinya katarak senilis antara lain diabetes mellitus, hipertensi, paparan sinar ultra violet B, obesitas, merokok, tingkat pendidikan, kekurangan vitamin E serum,
peningkatan asam urat serum, kekurangan riboflavin, myopia, warna iris yang gelap, dan lain-lain (Leske dkk.,2002; Zoric dkk., 2008).
Dewasa ini salah satu teori tentang etiologi katarak senilis yang banyak berkembang adalah mekanisme stres oksidatif. Lensa mata sangat sensitif terhadap terjadinya stres oksidatif. Seiring bertambahnya umur dan adanya paparan yang terus-menerus oleh agen dari luar, akan menyebabkan gangguan mekanisme proteksi antioksidan lensa mata. Hasil akumulasi dari stres oksidatif menyebabkan gangguan fungsi metabolisme lensa, agregasi protein lensa, peningkatan protein tidak larut air (water insoluble protein), sehingga menyebabkan gangguan transparansi lensa dan terjadi katarak (El-Ghaffar dkk., 2007; Cekic dkk., 2010; American Academy of Ophthalmology Staff, 2011-2012a). Secara pasti belum bisa ditentukan pada umur berapa mulai timbulnya katarak dalam hubungannya dengan stres oksidatif karena banyak faktor yang berpengaruh dan berbeda-beda pada masing-masing individu (Spector, 1995; Ates dkk., 2010; Cekic dkk., 2010).
2.2.3 Derajat kekeruhan lensa katarak senilis
Derajat kekeruhan lensa pada katarak senilis dapat dibagi menjadi lima derajat berdasarkan klasifikasi Buratto. Derajat 1 biasanya ditandai dengan visus yang masih lebih baik dari 6/12, lensa tampak sedikit keruh dengan warna agak keputihan dan refleks fundus masih dengan mudah dapat dilihat. Derajat 2 ditandai dengan nukleus yang mulai sedikit berwarna kekuningan, visus antara 6/12 sampai 6/30 dan refleks fundus juga masih mudah diperoleh. Derajat 3 ditandai dengan nukleus berwarna kuning dan korteks yang berwarna keabu-abuan dan visus antara 3/60 sampai 6/30. Derajat 4 ditandai dengan nukleus yang sudah berwarna kuning kecoklatan dengan usia
pasien biasanya sudah lebih dari 65 tahun dan visus biasanya antara 3/60 sampai 1/60. Derajat 5 ditandai dengan nukleus berwarna coklat hingga kehitaman dan visus biasanya 1/60 atau lebih jelek (Sihota dan Tandan, 2007; Ilyas 2008).
2.2.4 Indikasi bedah pada katarak senilis
Indikasi utama bedah pada katarak senilis adalah keinginan pasien untuk meningkatkan tajam penglihatannya. Indikasi bedah katarak lainnya meliputi indikasi medik dan kosmetik. Indikasi medik dilakukan pada pasien glaukoma fakolitik, glaukoma fakomorfik, uveitis fakoantigenik, dislokasi lensa ke bilik mata depan, dan beberapa indikasi tambahan sehubungan dengan katarak yang mengganggu tindakan medik di belakang lensa, misalnya laser pada retina, diagnosis retina, dan vitrektomi (Soehardjo, 2004; American Academy of Ophthalmology Staff, 2011-2012a).
2.3 Radikal Bebas dan Stres Oksidatif
2.3.1 Radikal bebas
Dewasa ini, dunia kedokteran dan kesehatan banyak membahas tentang radikal bebas dan antioksidan. Hal ini karena sebagian besar penyakit diawali oleh adanya reaksi oksidasi yang berlebihan di dalam tubuh. Tampaknya oksigen merupakan sesuatu yang paradoksial dalam kehidupan. Molekul ini sangat dibutuhkan oleh organisme aerob karena memberi energi pada proses metabolisme dan respirasi, namun pada kondisi tertentu keberadaannya dapat berimplikasi pada berbagai penyakit (Vinson, 2006; Winarsi, 2007).
Radikal bebas merupakan spesies kimiawi dengan satu elektron yang tak berpasangan di orbit terluar. Keadaan kimiawi tersebut sangat tidak stabil dan mudah bereaksi dengan zat kimia organik atau anorganik. Saat dibentuk di dalam sel, radikal
bebas segera menyerang dan mendegradasi asam nukleat dan berbagai molekul membran sel. Selain itu radikal bebas menginisasi reaksi autokatalitik, sehingga semakin memperbanyak rantai kerusakan (Mitchel dan Contran, 2008). Target utama radikal bebas adalah protein, asam lemak tak jenuh, lipoprotein, karbohidrat, RNA, dan DNA (Valko dkk., 2005; Winarsi, 2007). Radikal bebas terbentuk dari metabolisme normal sel-sel tubuh, fagositosis sebagai bagian dari reaksi inflamasi, radiasi, polusi, merokok, dan lain-lain. Radikal bebas juga dapat terbentuk dari senyawa lain yang sebenarnya bukan radikal bebas tetapi mudah berubah menjadi radikal bebas, misalnya hidrogen peroksida, ozon, dan lain-lain. Kedua kelompok senyawa tersebut sering disebut sebagai senyawa reaktif oksigen atau Reaktive Oxigen Species (ROS). Telah dikenal tiga jenis ROS, yaitu superoksida (O2-), hidrogen peroksida (H2O2) dan
hidroksil (OH•) (Winarsi, 2007).
Reaktive Oxigen Species juga dapat diproduksi oleh sel dalam kondisi stres
maupun tidak stres. Pada kondisi tidak stres, terdapat keseimbangan antara proses pembentukan dan pemusnahan ROS. Sementara pada keadaan stres, pembentukan ROS lebih tinggi dibandingkan dengan pemusnahannya. Akibatnya sistem pertahanan tubuh terpacu untuk bekerja keras memusnahkan ROS. Antioksidan enzimatis dan nonenzimatis adalah sistem pertahanan yang bekerja menekan ROS yang berlebihan (Mitchel dan Contran, 2008).
Reaktive Oxigen Species adalah produk normal dari metabolisme seluler. ROS
memiliki efek menguntungkan dan efek merugikan. Efek menguntungkan ROS terjadi pada konsentrasi rendah hingga sedang yang merupakan proses fisiologis dalam respon seluler terhadap bahan-bahan yang merugikan, seperti dalam pertahanan diri terhadap
infeksi, dalam sejumlah fungsi sistem sinyal seluler, dan induksi respon mitogenik (Valko dkk., 2006). ROS dapat terjadi melalui beberapa mekanisme yang berbeda, seperti reperfusi-iskemia, aktivasi neutrofil dan makrofag, kimia Fenton, endothelial
cell xanthine oxidase, metabolisme asam lemak bebas dan prostaglandin, dan hipoksia
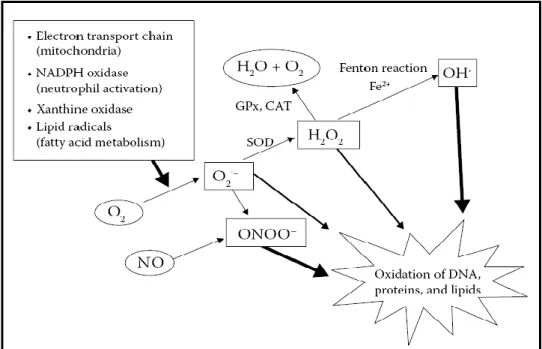
seperti ditunjukkan dalam Gambar 2.2 (Kohen dan Nyska, 2002; Winarsi, 2007; Hiromichi dkk., 2008).
Gambar 2.2 Mekanisme terjadinya ROS (Hiromichi dkk., 2008).
2.3.2 Stres oksidatif
Stres oksidatif didefinisikan sebagai gangguan keseimbangan antara produksi radikal bebas dengan antioksidan yang menyebabkan kerusakan jaringan. Stres oksidatif
dapat diakibatkan oleh pengurangan level antioksidan dan peningkatan produksi radikal bebas ( Winarsi, 2007).
Organisme harus menghadapi dan mengontrol adanya ROS dan antioksidan secara terus-menerus. Keseimbangan kedua faktor ini yang dikenal dengan nama redoks potensial yang bersifat spesifik untuk tiap organel dan lokasi biologis. Hal-hal yang mempengaruhi keseimbangan ke arah manapun menimbulkan efek buruk terhadap sel dan organisme. Perubahan keseimbangan kearah peningkatan ROS yang disebut stres oksidatif akan menyebabkan kerusakan oksidatif. Perubahan keseimbangan kearah peningkatan kekuatan reduksi atau antioksidan juga akan menimbulkan kerusakan yang disebut stres reduktif (Kohen dan Nyska, 2002). Stres oksidatif terjadi akibat reaksi metabolik yang menggunakan oksigen dan menunjukkan gangguan keseimbangan status reaksi oksidan dan antioksidan pada makhluk hidup. ROS yang berlebihan akan merusak lipid seluler, protein maupun DNA dan menghambat fungsi normal sel (Kovacic dan Jacintho, 2001).
2.3.3 Antioksidan
Antioksidan adalah senyawa yang dapat memberikan elektron (electron donors) atau reduktan. Antioksidan mampu menangkal atau meredam dampak negatif radikal bebas dalam tubuh. Antioksidan bekerja dengan cara mendonorkan satu elektronnya kepada senyawa yang bersifat radikal bebas, sehingga aktivitas senyawa tersebut bisa dihambat. Senyawa ini memiliki berat molekul kecil tetapi mampu menginaktivasi berkembangnya reaksi oksidasi dengan cara mencegah terbentuknya radikal bebas. Antioksidan juga dapat menghambat reaksi oksidasi dengan mengikat radikal bebas dan molekul yang sangat reaktif, sehingga kerusakan sel akan dihambat (Winarsi, 2007).
Berkaitan dengan reaksi oksidasi di dalam tubuh, status antioksidan merupakan parameter penting untuk memantau kesehatan seseorang. Tubuh memiliki sistem antioksidan untuk menangkal reaktivitas radikal bebas yang secara kontinu dibentuk sendiri oleh tubuh. Bila jumlah ROS ini melebihi jumlah antioksidan dalam tubuh, kelebihannya akan menyerang komponen lipid, protein, maupun DNA, sehingga mengakibatkan kerusakan-kerusakan yang disebut stress oksidatif. Reaktivitas radikal bebas dapat dihambat melalui 3 cara, yaitu mencegah atau menghambat pembentukan radikal bebas baru, menginaktivasi atau menangkap radikal bebas dan memotong propagasi (pemutusan rantai), dan memperbaiki kerusakan karena radikal bebas (Winarsi, 2007).
Secara umum antioksidan dikelompokkan menjadi 2, antioksidan enzimatis dan antioksidan nonenzimatis. Antioksidan enzimatik, misalnya SOD, katalase, dan glutation peroksidase. Antioksidan nonenzimatik, misalnya vitamin C, E, karotenoid, flavonoid, quinon, bilirubin, asam urat, dan lain-lain. Berdasarkan mekanisme kerjanya, antioksidan dikelompokkan menjadi 3 kelompok, yaitu:
1. Antioksidan Primer (Endogen)
Bekerja dengan cara mencegah pembentukan radikal bebas yang baru serta mengubah radikal bebas menjadi molekul yang tidak berbahaya. Termasuk di dalamnya adalah SOD, glutation peroksidase dan katalase. Antioksidan primer sering juga disebut antioksidant enzimatis.
Berguna untuk menangkap radikal dan mencegah terjadinya reaksi berantai. Termasuk di dalamnya adalah vitamin E (α-tokoferol), vitamin C, β karoten, asam urat, bilirubin dan albumin.
3. Antioksidan Tersier
Berguna untuk memperbaiki kerusakan biomolekuler yang disebabkan oleh radikal bebas. Termasuk didalamnya adalah DNA repair enzyme dan metionin sulfoksida reduktase (Winarsi, 2007).
2.3.4 Superoksida dismutase
Superoksida dismutase merupakan enzim yang mengkatalisis radikal superoksid menjadi hidrogen peroksida dan oksigen. Enzim yang sebenarnya telah ada dalam tubuh tetapi memerlukan bantuan zat-zat gizi mineral, seperti mangan (Mn), seng (Zn) dan tembaga (Cu) (Winarsi, 2007; Pavani dkk., 2012). Terdapat beberapa jenis SOD, seperti Copper-Zinc-SOD (Cu-Zn-SOD) yang terdapat di dalam sitosol terutama di lisosom dan nukleus, manganese-SOD (Mn-SOD) yang terdapat di dalam mitokondria, ekstraseluler SOD (EC-SOD) dan besi-SOD (Fe-SOD) yang hanya ditemukan pada tumbuhan (Chakraborty dkk., 2007; Cemelli dkk., 2009).
Enzim SOD terdapat dalam semua organisme aerob dan sebagian besar berada dalam tingkat subseluler (intraseluler). Organisme aerob selalu membutuhkan oksigen untuk hidupnya, namun dalam setiap aktivitasnya dapat menimbulkan senyawa oksigen reaktif atau ROS. SOD merupakan enzim antioksidan pencegah, yang merupakan suatu antioksidan metalloenzim. SOD berefek sangat kuat dan merupakan pertahanan tubuh pertama dalam menghadapi serangan radikal bebas. SOD adalah enzim antioksidan intraseluler utama yang dapat digunakan untuk menetralisir aktivitas O2-. Secara umum
semua SOD, ion metal mengkatalisa dismutasi O2- melalui mekanisme oksidasi reduksi.
Superoksida dismutase menetralisir O2- menjadi oksigen dan hidrogen peroksida (H2O2).
Selanjutnya H2O2 diubah menjadi molekul air (H2O) oleh enzim katalase dan glutation
peroksidase (Winarsi, 2007):
2O2- + 2H+ O2 + H2O2 (oleh superoksida dismutase)
2H2O2 2H2O + O2 (oleh katalase)
2GSH + H2O2 GSSG + 2H2 (oleh glutation peroksidase).
Menurut Fujiwara dkk. (1992) aktivitas SOD pada lensa mata manusia dominan terlokalisir pada epitelial kapsul lensa, korteks bagian luar dan sedikit ditemukan pada nukleus. Aktivitas SOD sangat penting sebagai barier fotooksidasi. SOD dan GSH menurun secara signifikan pada lensa katarak senilis matur. SOD adalah enzim yang mampu mencegah awal terjadinya katarak (Kisic dkk., 2012). SOD adalah antioksidan yang amat penting bila dibandingkan dengan antioksidan enzimatik lainnya karena merupakan pertahanan pertama dalam melawan radikal bebas (Rajkumar dkk., 2008).
Semua bentuk enzim SOD memiliki inti dan argetnya adalah kompartemen subseluler pada ujung terminal amino. Masing-masing isoenzim SOD diatur secara independen oleh derajat stres oksidatif pada kompartemen subselular. Aktivitas SOD dapat dilihat dari banyaknya produk peroksidasi lipid dari setiap organel. Tingginya aktivitas SOD dapat tergambarkan oleh rendahnya produk oksidasi lipid (Winarsi, 2007). SOD adalah salah satu biomarker yang baik untuk menilai tingkat stress oksidatif pada katarak (Pavani dkk., 2012). Penurunan kadar SOD berimplikasi pada beberapa kondisi dan penyakit, seperti reumatoid artritis, anemia Fanconi, infeksi saluran nafas, katarak, dan infertil (Winarsi, 2007). Aktivitas SOD dapat diukur dengan beberapa cara,
namun sebagian besar pengukurannya dilakukan secara tidak langsung. Salah satu cara adalah dengan menggunakan sistem yang menghasikan superoksida dan indikator. Selanjutnya, indikator akan bereaksi dengan anion superoksida. Warna yang terbentuk diukur dengan menggunakan spektrofotometer (Winarsi, 2007; Rajkumar dkk., 2008)
2.3.5 Stres oksidatif pada katarak senilis
Radikal bebas pada lensa dihasilkan oleh proses metabolisme sel dan dapat juga akibat pengaruh luar, misalnya akibat radiasi. Radikal bebas terbentuk secara terus-menerus dan akan semakin meningkat dengan bertambahnya usia. Struktur dan komposisi biokimiawi lensa mampu menyerap sinar ultraviolet yang bersifat sitotoksis. Keseimbangan antara ketersediaan antioksidan dan terbentuknya radikal bebas mempunyai arti penting dalam menjaga lingkungan di dalam sel. Apabila ketersediaan antioksidan tidak mampu menetralisir radikal bebas, akan timbul stress oksidatif yang berujung pada kerusakan membran sel, lisosom, mitokondria, DNA, maupun serabut lensa. Stress oksidatif diyakini merupakan salah satu faktor yang sangat penting dalam terjadinya katarak (Pavani dkk., 2012).
Peroksidasi lipid membran plasma serabut lensa dianggap sebagai faktor yang berperan timbulnya katarak. Pada proses peroksidasi lipid, bahan teroksidasi akan mengambil atom hidrogen dari asam lemak tidak jenuh, sehingga terbentuk radikal asam lemak dan seterusnya dengan oksigen akan terbentuk radikal peroksi lipid. Reaksi ini dapat memperbanyak rantai, yang menyebabkan pembentukan lipid peroksida (LOOH) serta akhirnya terjadi hasil utama pemecahan berupa MDA. Malondialdehida dihipotesiskan mampu bereaksi silang dengan lipid membran maupun protein membran,
yang akhirnya fungsi normal membran terganggu (Cabrera dan Chihuailaf, 2011; American Academy of Ophthalmology Staff, 2011-2012a).
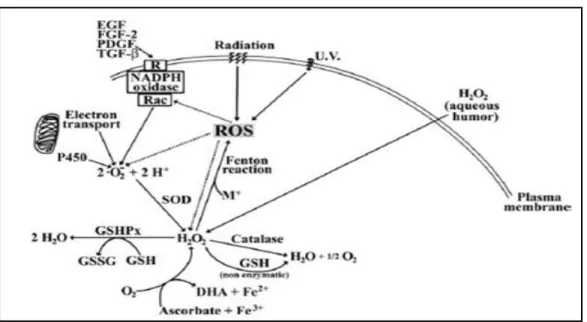
Tekanan oksigen dalam lensa relatif rendah, dengan demikian reaksi radikal bebas mungkin tidak melibatkan molekul oksigen. Radikal bebas dapat bereaksi langsung dengan molekul-molekul DNA dan menimbulkan kerusakan. Kerusakan tersebut sebagian dapat diperbaiki tetapi sebagian bersifat permanen. Radikal bebas dapat juga merusak protein maupun lipid membran sel pada korteks lensa. Kerusakan dalam serabut lensa mengakibatkan polimerisasi dan ikatan silang antara lipid dan protein, serta akhirnya terjadi peningkatan jumlah protein lensa yang tidak larut air (American Academy of Ophthalmology Staff, 2011-2012a). Beberapa peneliti meyakini perkembangan maturitas katarak senilis dipengaruhi oleh stres oksidatif (Spector, 1995; Zoric dkk., 2008; Ates dkk., 2010). Mekanisme perbaikan dan regenerasi sebagai akibat radikal bebas dikatakan aktif terjadi pada epitel lensa dan korteks superfisial, namun mekanisme tersebut hampir tidak ditemukan pada korteks lensa bagian dalam dan pada nukleus. Hal inilah yang menyebabkan kerusakan pada protein lensa dan membran lipid bersifat ireversibel (American Academy of Ophthalmology Staff, 2011-2012b).Lensa mempunyai beberapa enzim yang berfungsi untuk melindungi lensa dari kerusakan akibat radikal bebas atau oksigen. Enzim-enzim ini termasuk SOD, glutation peroksidase dan katalase. SOD mengkatalisis superoksida (O2-) dan menghasilkan
hidrogen peroksida: 2O2- + 2H+ → H2O2 + O2. Katalase dapat memecah peroksida
dengan reaksi: 2H2O2 → 2H2O + O2. Glutation peroksidase mengkatalisis reaksi: 2GSH
+ LOOH → GSSG + LOH + H2O. Glutation disulfida (GSSG) kemudian dikonversi
nukleotida piridin NADPH yang disediakan oleh HMP shunt sebagai agen pereduksi: GSSG + NADPH + H+ → 2GSH + NADP+.
Gambar 2.3 Skema aktivitas ROS dan antioksidan pada lensa (Berthoud dan Beyer, 2009)
Oleh karena itu, SOD sangat berperan dalam mekanisme pertahanan terhadap stres oksidatif. SOD merupakan pertahanan garis pertama dalam melawan ROS. Vitamin E dan asam askorbat juga banyak ditemukan di dalam lensa. Kedua substansi ini dapat bekerjasama sebagai pemecah radikal bebas dan melindungi lensa dari kerusakan oksidatif (Rajkumar dkk., 2008; American Academy of Ophthalmology Staff, 2011-2012b). Antioksidan enzimatik, nonenzimatik, dan aktivitas sistem perbaikan menurun pada lensa lensa dan humor akuos selama proses pada proses perkembangan atau maturitas katarak senilis (Ozmen dkk., 2000).
Telah dilakukan beberapa penelitian yang mendukung peranan penting stres oksidatif khususnya SOD dalam patogenesis katarak senilis. Kisic dkk. (2012) menemukan kadar SOD lensa pada katarak senilis insipien (4,13±2,14 kU/g protein) lebih tinggi daripada katarak senilis matur (2,14±0,91 kU/g protein). Deepa dkk. (2011)
menemukan kadar aktivitas antioksidan lensa imatur (1,320±0,208 mg/mg protein) lebih tinggi daripada katarak senilis matur (0,820±0.085 mg/mg protein). Ohrloff dan Hockwin (1984) menyatakan tidak menemukan aktivitas SOD lensa katarak senilis matur (0,0 U/mg protein) sedangkan SOD pada lensa normal tanpa katarak rata-ratanya sebesar 0,20±0,05 U/mg protein. Chang dkk. (2013) menemukan kadar serum SOD pada pasien katarak senilis (97,26 ±13,56 U/ml) lebih rendah daripada pasien normal tanpa katarak senilis (103,47±18,97 U/mg). Sepanjang pengetahuan peneliti, di Bali dan bahkan di Indonesia sampai saat ini belum pernah diteliti mengenai kadar SOD lensa pada lensa normal maupun pada lensa katarak senilis, sehingga belum ada data mengenai kadar SOD lensa normal pada populasi normal maupun hubungan kadar SOD lensa dengan derajat kekeruhan lensa katarak senilis.
BAB III
KERANGKA BERPIKIR, KONSEP DAN HIPOTESIS PENELITIAN
3.1 Kerangka Berpikir
Katarak senilis merupakan penyakit multifaktorial yang etiopatogenesisnya belum diketahui secara pasti. Salah satu teori tentang etiopatogenesis katarak senilis yang banyak berkembang adalah stres oksidatif. Stres oksidatif adalah suatu keadaan ketidakseimbangan antara radikal bebas dengan antioksidan. Stres oksidatif dapat timbul apabila pembentukan radikal bebas terjadi berlebihan disertai berkurang atau menetapnya sistem pertahanan antioksidan.
Salah satu anti oksidan alami berupa enzim yang terdapat dalam tubuh adalah SOD. SOD mempunyai efek sangat kuat dan merupakan pertahanan tubuh pertama terhadap serangan radikal bebas. SOD mampu mengubah radikal bebas paling reaktif dan paling berbahaya, yaitu superoksida menjadi hidrogen peroksida. Kadar SOD mempengaruhi progresivitas atau derajat kekeruhan lensa pada katarak senilis. Seiring bertambahnya umur, akan terjadi gangguan atau penurunan mekanisme proteksi SOD lensa mata, sehingga terjadi akumulasi radikal bebas yang berlebihan. Kekeruhan lensa juga cenderung meningkat seiring dengan bertambahnya umur.
Beberapa peneliti juga menduga stres oksidatif berperan dalam etiopatogenesis katarak senilis. Kadar SOD dipengaruhi oleh faktor internal dan eksternal. Faktor internal, antara lain adalah umur dan genetik sedangkan yang termasuk faktor eksternal, antara lain paparan sinar ultraviolet, penyakit sistemik kronis, merokok, penggunaan
obat anti inflamasi nonsteroid (AINS), obat kortikosteroid atau obat imunosupresan, vitamin antioksidan, infeksi intraokular, aktivitas fisik, dan stres psikologis.
3.2 Konsep Penelitian
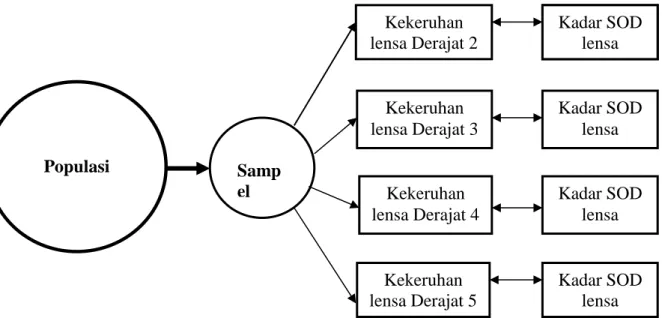
Berdasarkan kajian pustaka dan kerangka berpikir yang telah dikaji, selanjutnya dapat disusun konsep penelitian sebagai berikut (Gambar 3.1):
Gambar 3.1 Bagan Konsep Penelitian
3.3 Hipotesis Penelitian
Penurunan kadar SOD lensa berhubungan dengan peningkatan derajat kekeruhan lensa pada katarak senilis.
Kadar SOD lensa pada masing-masing
derajat kekeruhan lensa pada katarak
senilis Faktor Eksternal
1. Paparan sinar ultraviolet
2. Penyakit sistemik, kronis
3. Merokok
4. Obat anti inflamasi non steroid (AINS), obat kortikosteroid atau obat imunosupresan 5. Vitamin antioksidan 6. Infeksi intraokular 7. Aktivitas fisik 8. Stres psikologis Faktor Internal 1. Umur 2. Genetik
BAB IV
METODE PENELITIAN
4.1 Rancangan Penelitian
Penelitian ini merupakan suatu penelitian observasional analitik dengan pendekatan studi potong lintang (cross-sectional) (Fleiss, 1981) untuk mengetahui hubungan antara penurunan kadar SOD lensa dengan peningkatan derajat kekeruhan lensa pada katarak senilis.
Rancangan penelitian dapat digambarkan dengan skema sebagai berikut:
Gambar 4.1 Rancangan Penelitian
4.2 Lokasi dan Waktu Penelitian
Penelitian ini dilakukan di Poliklinik Mata RSUP Sanglah, Denpasar; RS Indera, Propinsi Bali dan UPT. Laboratorium Kimia Analitik Universitas Udayana, mulai bulan Januari 2014 sampai bulan Mei 2014.
Kadar SOD lensa Kekeruhan lensa Derajat 2 Kekeruhan lensa Derajat 3 Kekeruhan lensa Derajat 4 Kekeruhan lensa Derajat 5 Kadar SOD lensa Kadar SOD lensa Kadar SOD lensa Kadar SOD lensa Populasi Samp el
4.3 Populasi dan Sampel Penelitian
4.3.1 Populasi penelitian
Populasi target penelitian adalah semua pasien katarak senilis. Populasi terjangkau penelitian adalah semua pasien katarak senilis yang datang berobat ke Poliklinik Mata RSUP Sanglah dan RS Indera, Denpasar periode bulan Januari 2014 sampai Mei 2014.
4.3.2 Sampel penelitian
Sampel penelitian adalah semua pasien katarak senilis yang datang berobat Poliklinik Mata RSUP Sanglah, Denpasar dan RS Indera, Propinsi Bali periode bulan Januari 2014 sampai Mei 2014 yang memenuhi kriteria inklusi dan eksklusi.
4.3.2.1 Kriteria Inklusi dan Eksklusi Penelitian
4.3.2.1.1 Kriteria inklusi
Pasien katarak senilis laki-laki atau wanita yang berumur di atas 40 tahun dengan derajat kekeruhan lensa 2, 3, 4, dan 5 dan bersedia dioperasi.
4.3.2.1.2 Kriteria eksklusi
a. Subjek sedang menderita penyakit sistemik yang kronis, seperti diabetes melitus, hipertensi, penyakit kardiovaskular dan penyakit keganasan.
b. Subjek sedang mendapat pengobatan antiinflamasi nonsteroid, kortikosteroid atau obat imunosupresan lainnya dalam satu bulan terakhir.
c. Subjek sedang mengkonsumsi vitamin antioksidan (vitamin A, C, dan E) dalam satu bulan terakhir.
e. Subjek dengan infeksi intraokular pada segmen anterior dan atau segmen posterior bola mata, antara lain konjungtivitis, keratitis, ulkus kornea, uveitis anterior dan posterior.
f. Subjek dengan riwayat atau sedang mengalami kelainan pada segmen posterior mata berupa kelainan vitreus, retinopati, ablasio retina, dan kelainan makula. g. Subjek dengan riwayat operasi intraokular.
h. Katarak senilis dengan komplikasi berupa tekanan intraokular >21 mmHg atau dengan glaukoma sekunder dan uveitis.
4.3.2.2 Besar sampel
Besar sampel pada penelitian ini dihitung dengan menggunakan rumus sebagai berikut (Dahlan, 2009): Zα + Zβ 2 1+ r n = 0,5 ln + 3 1 - r
1. Tingkat kemaknaan yang dikehendaki sebesar 95%, yaitu α = 0,05 dan dipakai Zα = 1,64
2. Power penelitian yang direncanakan sebesar 90%, yaitu β = 0,10 dan Zβ = 1.28
3. Koefisien korelasi (r) = 0,4 (dikutip dari kepustakaan Chakraborty dkk., 2007)
1,64 + 1,28 2 1+ 0,4 n = 0,5 ln + 3 1 - 0,4 = 52 sampel (mata)
Berdasarkan hasil perhitungan dengan menggunakan rumus di atas, diperoleh besar sampel penelitian adalah 52 subjek (mata).
4.3.2.3 Cara pemilihan sampel
Sampel dipilih dengan teknik consecutive sampling dari populasi terjangkau. Sampel yang dipilih adalah pasien katarak senilis yang bersedia menjalani operasi katarak small incision cataract surgery (SICS) dengan persetujuan tertulis dan dilakukan atas indikasi visual.
4.4 Variabel Penelitian
4.4.1 Klasifikasi dan identifikasi variabel
1. Variabel bebas adalah kadar SOD lensa katarak senilis.
2. Variabel tergantung adalah derajat kekeruhan lensa katarak senilis. 3. Variabel kendali adalah umur.
Gambar 4.2 Skema Hubungan antar Variabel Variabel Bebas
Kadar SOD lensa katarak senilis
Variabel Tergantung
Derajat kekeruhan lensa katarak senilis
Variabel Kendali
4.4.2 Definisi operasional variabel
1. Katarak senilis adalah kekeruhan pada lensa yang terjadi pada usia di atas 40 tahun (Gondhowiardjo dan Simanjuntak 2006; Ilyas, 2008).
2. Kadar SOD lensa pada katarak senilis adalah kadar SOD yang diperiksa dengan metode spektrofotometer dari bahan sampel lensa dalam satuan unit/ml dan pemeriksaan dikerjakan di Laboratorium terpusat yang sudah terakreditasi, yaitu UPT. Laboratorium Kimia Analitik Universitas Udayana di Bukit Jimbaran.
3. Derajat kekeruhan katarak senilis adalah derajat kekeruhan katarak senilis derajat 2-5 berdasarkan klasifikasi Buratto (Sihota dan Tandan, 2007; Ilyas, 2008):
Derajat 2 ditandai dengan nukleus yang mulai sedikit berwarna kekuningan, visus antara 6/12 sampai 6/30, dan refleks fundus juga masih mudah diperoleh.
Derajat 3 ditandai dengan nukleus berwarna kuning dan korteks yang berwarna keabu-abuan, visus antara 3/60 sampai 6/30.
Derajat 4 ditandai dengan nukleus yang sudah berwarna kuning kecoklatan, dengan usia pasien biasanya sudah lebih dari 65 tahun dan visus biasanya antara 3/60 sampai 1/60.
Derajat 5 ditandai dengan nukleus berwarna coklat hingga kehitaman dan visus biasanya 1/60 atau lebih jelek.