PENELITIAN PERTANIAN TANAMAN PANGAN VOL. 25 NO. 2 2006
ABSTRACT. Detecti on and Identificati on of Ralstoni a solanacearum strains by Its Polyclonal Antibody Using Indirect ELISA Technique. Several techniques for early and rapid detection of Ralstonia solanacearum have been developed as components in the integrated control of bacterial wilt. The DNA based techniques are highly effective in detecting the bacterium, but they require sophisticated and expensive materials and impractical for field applications. The Enzyme-linked Immunosorbent Assay (ELISA) is one of the serological techniques that is effective for detection and identification of bacterial plant pathogens, because it is relatively rapid, inexpensive, does not require sophisticated equipment, and applicable under field conditions. Modifications had been made by researchers to improve sensitivities of the detection, including those for R. solanacearum, and among them was the Indirect ELISA technique. A laboratory study was done to produce polyclonal antibody (PAb) to R. solanacearum and to apply the antibody for detection of strains of R. solanacearum representing different hosts, races, and biovars using the Indirect ELISA tech-nique. The results showed that PAb to R. solacearum is producible on white rabbits using three different immunization schemes at titers ranging from 128 to 4096. The Indirect ELISA technique using the PAb is applicable for detection of R. solanacearum strains representing Race 1 Biovar 3, Race 2 Biovar 1, and Race 3 Biovar 2, either from pure cultures, soils, or plant parts. The lowest detection level of the ELISA technique is 103 sel/ml.
Keywords: Ralstonia solanacearum, detection and identification, Indirect ELISA, control of bacterial wilt
ABSTRAK. Berbagai teknik deteksi dini dan cepat bakteri Ralstonia solanacearum telah dikembangkan sebagai salah satu komponen pengendalian terpadu penyakit layu bakteri. Teknik deteksi berbasis DNA sangat efektif untuk deteksi patogen ini, tetapi memerlukan peralatan dan bahan yang canggih dan mahal, sehingga tidak praktis digunakan di lapangan. ELISA (Enzyme-linked Immuno-sorbent Assay) merupakan salah satu teknik serologi yang efektif untuk deteksi bakteri patogen tumbuhan, karena tidak memerlukan waktu lama, biaya relatif murah, tidak memerlukan peralatan yang canggih, dan dapat digunakan langsung di lapangan. Beberapa modifikasi teknik ELISA telah dikembangkan oleh peneliti untuk meningkatkan keefektifan deteksinya, di antaranya teknik ELISA Tidak Langsung. Penelitian laboratorium telah dilakukan untuk memproduksi PAb (antibodi poliklonal) R. solanacearum pada kelinci dan mengguna-kannya untuk mendeteksi sejumlah isolat yang mewakili strain R. solanacearum berbeda dengan teknik ELISA Tidak Langsung. Hasil penelitian menunjukkan bahwa PAb R. solanacearum dapat di-produksi pada kelinci dengan tiga cara imunisasi berbeda dengan titer berkisar antara 128-2048. Teknik ELISA Tidak Langsung menggunakan PAb efektif untuk mendeteksi strain R. solanacearum yang mewakili Ras 1 Biovar 3, Ras 2 Biovar 1, dan Ras 3 Biovar 2, baik dari biakan murni, tanah, maupun jaringan tanaman dengan tingkat kepekaan deteksi mencapai 103 sel/ml.
Kata kunci: Ralstonia solanacearum; deteksi dan identifikasi; teknik ELISA Tidak Langsung; pengendalian layu bakteri
P
enyakit layu yang disebabkan oleh bakteri Ralstonia solanacearum (Smith) Yabuuchi et al. (Sin.: Pseudomonas solanacearum Smith) merupakan salah satu penyakit yang sangat merusak tanaman, terutama tanaman pangan dan hortikultura dan secara ekonomis sangat merugikan petani. Ke-rugian hasil yang diakibatkan oleh R. solanacearum pada berbagai komoditas tanaman pertanian sangat beragam dan belum diketahui secara pasti, tetapi diperkirakan 15-35% pada tomat, 35-60% pada kentang, dan 30-65% pada kacang tanah (Hayward 1994). Dalam dekade terakhir, pertanaman pisang di berbagai wilayah Indonesia juga mengalami kerusakan berat oleh penyakit ini dan kehilangan hasil diperkirakan mencapai milyaran rupiah setahun (Sulyo 1992). Berbagai upaya telah dilakukan untuk mengendalikan penyakit layu bakteri, baik menggunakan salah satu atau beberapa komponen pengendalian maupun dengan menerapkan strategi pengendalian terpadu, tetapi hasilnya belum memuaskan (Robinson-Smith 1993).Penyakit layu sulit dikendalikan, terutama karena patogennya memiliki kemampuan bertahan hidup dan beradaptasi dengan ekosistemnya (Hayward 1994). R. solanacearum memiliki wilayah sebar hampir di seluruh dunia, terutama di daerah tropik dan subtropik, mulai dari dataran rendah hingga dataran tinggi > 2500 m dpl. Berdasarkan kisaran inangnya, strain R. solanacearum dikelompokkan menjadi lima ras (Ras 1 - Ras 5) dan memiliki kisaran inang lebih dari 400 spesies tanaman yang tergolong dalam lebih dari 80 famili. Berdasarkan kemampuan menggunakan sumber nutrisi, terutama asam organik dan karbohidrat, strain R. solanacearum terbagi menjadi lima biovar (Biovar 1 - Biovar 5) (Seal and Elphinstone 1994). Patogen ini juga memiliki ke-mampuan bertahan hidup dalam benih, dalam tanah, dan bahkan pada rizosfer tanaman bukan inang (Janse 1988).
Diagnosis penyakit secara dini merupakan langkah pertama dan utama yang sangat menentukan keber-hasilan pengendalian suatu penyakit. Langkah ter-penting dalam diagnosis penyakit adalah mendeteksi dan mengidentifikasi jenis patogennya secara efektif dan efisien, sehingga langkah pengendaliannya dapat
di-Deteksi dan Identifikasi Strain
Ralstonia solanacearum
dengan Teknik ELISA Tidak Langsung
M. Machmud dan Yadi SuryadiBalai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian Jl. Tentara Pelajar 3A, Bogor 16111
lakukan secara cepat dan akurat. Teknik deteksi dan identifikasi yang efektif dan efisien memiliki lima kriteria, yaitu cepat, peka, akurat, dapat langsung digunakan di lapangan, dan biayanya relatif murah (Seal and Elphinstone 1994). Teknik ELISA (Enzyme-linked Immunosorbent Assay) memiliki hampir semua kriteria yang diperlukan. ELISA merupakan teknik serologi yang sangat populer dan menjanjikan untuk mendiagnosis penyakit tumbuhan, terutama yang disebabkan oleh virus dan bakteri (Converse and Martin 1990). Teknik ini telah digunakan oleh para peneliti dan pengguna lain di Indonesia untuk deteksi dan identifikasi patogen tumbuhan (Machmud et al. 1996). Namun demikian, sampai saat ini, baik komponen maupun perangkat ELISA yang digunakan pada umumnya masih harus di-impor dengan harga mahal. Biaya deteksi dan identifikasi satu jenis patogen tumbuhan dari satu sampel tanaman dengan perangkat ELISA impor berkisar antara Rp 15.000-20.000 (Agdia Inc., Leckhart, Indiana). Biaya ini dapat ditekan menjadi lebih murah jika komponen perangkat ELISA diproduksi di dalam negeri.
Menurut Converse dan Martin (1990), teknik ELISA menjadi pilihan utama dalam mendeteksi virus dan bakteri patogen tumbuhan, karena sederhana, cepat, sensitif, dan akurat, serta dapat digunakan langsung di lapangan. Dasar teknik ELISA adalah reaksi antigen (Ag) dengan antibodi (Ab) yang diberi penanda enzim ter-tentu dan dilakukan dalam substrat yang mengandung pewarna, sehingga hasilnya dapat dibaca dengan mata atau dengan alat ELISA Reader (Converse and Martin 1990; McLaughlin and Chen 1990). Teknik ini memerlu-kan ketersediaan Ag murni dan Ab yang spesifik dan bertiter tinggi dalam penggunaannya secara praktis. Berbagai modifikasi teknik ELISA telah dibuat untuk meningkatkan keefektifannya, di antaranya adalah DAS-ELISA (Double Antibody Sandwiched– ELISA), IDAS-ELISA (Indirect DAS-ELISA), ELISA Langsung (Direct ELISA), ELISA Tidak Langsung (Indirect ELISA), dan Dot Blot ELISA (Canale 1983; Stobbs dan Barker 1985; Yadi et al. 1998). Teknik-teknik ini belum pernah dibandingkan keefektifannya untuk deteksi dan identifikasi R. solanacearum, baik dari biakan murni dan tanaman, maupun dari dalam tanah. Sejak tahun 1995, di Balitbio, Bogor, telah dilakukan upaya untuk mengadopsi dan memodifikasi teknik ELISA dengan mengembangkan teknik produksi antibodi poliklonal (PAb) dan komponen perangkat ELISA untuk beberapa jenis virus dan bakteri patogen tumbuhan, termasuk R. solanacearum (Machmud et al. 1996, 1997, 1998). Sasaran utama yang diharapkan dari penelitian adalah memperoleh teknik produksi Ab ELISA yang efektif dan efisien serta merakit sendiri komponen perangkat ELISA, sehingga peng-gunaannya menjadi lebih efektif dengan biaya lebih murah.
Penelitian ini bertujuan untuk: (1) memproduksi antibodi poliklonal R. solanacearum; (2) menguji ke-efektifan tiga teknik ELISA untuk deteksi dan identifikasi R. solanacearum, serta (3) menguji kepekaan teknik ELISA untuk deteksi R. solanacearum dari tanah dan tanaman.
BAHAN DAN METODE
Penelitian dilaksanakan di laboratorium Kelompok Peneliti Rekayasa Protein dan Imunologi, Balai Penelitian Bioteknologi dan Sumberdaya Genetik Tanaman Pangan (Balitbio), Bogor, mulai Juni hingga Oktober 2004. Pe-nelitian terdiri atas tiga kegiatan, yaitu: (1) produksi antibodi poliklonal (PAb) R. solanacearum; (2) uji keefektifan tiga teknik ELISA untuk deteksidan iden-tifikasi R. solanacearum, dan (3) uji keefektifan teknik ELISA Tidak Langsung untuk deteksi R. solanacearum dari tanah dan tanaman.
Produksi Antibodi Poliklonal R. solanacearum
Produksi PAb R. solanacearum dilakukan pada kelinci putih betina turunan hibrida New Zealand yang berumur 5-6 bulan. Sumber Ag adalah dua isolat bakteri R. sola-nacearum, yaitu Ps 9601 yang mewakili Ras 1 Biovar 3, asal tanaman kacang tanah dari Kebun Percobaan Muara, Bogor, dan Ps 2002-09 yang mewakili Ras 3 Biovar 2, asal tanaman kentang dari desa Margahayu, Lembang, Bandung. Masing-masing isolat R. solanacearum di-tumbuhkan pada medium Sucrose Pepton Agar (SPA) (Machmud et al. 1996). Biakan bakteri dari masing-masing isolat berumur 48 jam disuspensikan dalam larutan bufer fosfat salin (Phosphate-Buffered Saline, PBS) 0,1 M, pH 7,2, dan kerapatan selnya ditetapkan 1010 sel/ml dengan menggunakan spektrometer Hitachi U2000.
Perlakuan pada produksi PAb dari masing-masing isolat R. solanacearum terdiri atas 15 perlakuan yang merupakan kombinasi antara tiga macam Ag dan lima teknik imunisasi. Jenis Ag yang digunakan adalah sel R. solanacearum yang dimatikan dengan formalin 2,5% (Ag1), glutaraldehida 2,5% (Ag2), dan pemanasan pada penangas air bersuhu 1000C selama 2 jam (Ag3). Ketiga macam Ag ini disediakan menurut teknik Machmud et al. (1996).
Lima teknik imunisasi digunakan dalampenelitian, yaitu penyuntikan kelinci melalui otot paha ( Intra-muscular, IM), penyuntikan melalui rongga peritoneum (Intraperitoneal, IP), penyuntikan melalui pembuluh vena telinga (Intravenal, IV), kombinasi penyuntikan Intravenal dan Intraperitoneal (IV+IP), dan teknik
imunisasi baku menurut Robinson-Smith (1993) sebagai pembanding. Imunisasi dengan teknik IM, IP, dan IV dilakukan menurut teknik Ball et al. (1990), sedangkan teknik IV+IP menurut teknik Machmud et al. (1996). Setiap kombinasi perlakuan imunisasi dilakukan pada dua ekor kelinci sebagai ulangan. Panen darah kelinci, pemisahan antiserum (As), serta pemurnian dan peng-ukuran titer PAb yang diperoleh dilakukan menurut teknik Ball et al. (1990). Antibodi poliklonal untuk R. solanacearum Ras 1 Biovar 3 diberi kode PAb1 dan untuk Ras 3 Biovar 2 diberi kode PAb2.
Uji kespesifikan reaksi antibodi PAb1 dan PAb2 ter-hadap strain R. solanacearum dilakukan dengan teknik ELISA Tidak Langsung menurut Robinson yang di-modifikasi Machmud et al. (1996). Pada pengujian dua PAb yang masing-masing diproduksi dengan Ag1 dan Ag2, yaitu PAb1 Ag2 dan PAb2 Ag2. diuji kespesifikan reaksinya terhadap sembilan isolat R. solanacearum yang mewakili Ras dan Biovar berbeda, satu spesies bakteri yang berkerabat genetik dekat dengan R. solanacearum (Pseudomonas syzygii), dan dua spesies bakteri patogen lain (P. syringae pv. glycinea dan Xanthomonas axonopodis pv. glycines) (Tabel 2). Hasil pengujian diamati secara visual berdasarkan perubahan warna substrat pada lubang/sumur cawan ELISA. Reaksi ELISA dinilai spesifik atau positif jika PAb bereaksi positif dengan Ag, ditandai dengan terjadinya perubahan warna substrat menjadi biru. Jika warna substrat tidak berubah, maka PAb tidak bereaksi dengan Ag dan reaksinya dinyatakan negatif. Setiap pengujian dibuat dua ulangan.
Perbandingan Kepekaan Teknik ELISA untuk Deteksi R. solanacearum
Tiga teknik ELISA diuji kepekaannya untuk mendeteksi R. solanacearum, yaitu: (a) Teknik ELISA Langsung menurut Robinson-Smith (1993), (b) Teknik ELISA Tidak Langsung menurut Machmud et al. (1996), dan (c) teknik NCM-ELISA (Nitrocellulose Membrane ELISA) menurut teknik Yadi et al. (1998). Pengujian dilakukan dengan antibodi PAb1 Ag2 dan Ag2 dengan kerapatan 1010 sel/ ml. Pada saat pengujian, suspensi Ag2 diencerkan secara seri dengan larutan PBS 0,1 M, pH 7,2, hingga kepekatan menjadi berturut-turut 108, 106, 105, 104, dan 103 sel/ml. Setiap pengujian dibuat lima ulangan. Kepekaan teknik ELISA diukur berdasarkan reaksi positif yang ditunjukkan oleh perubahan warna substrat menjadi kuning pada lubang sumur cawan ELISA yang berisi enceran Ag. Teknik ELISA paling peka adalah yang dapat mendeteksi Ag dengan kerapatan paling rendah.
Uji Kespesifikan PAb R. solanacearum dengan Teknik ELISA Tidak Langsung
Kegiatan ini dilakukan untuk menguji kespesifikan reaksi PAb1 dan PAb2 dengan Ag dari strain R. solanacearum dan spesies bakteri patogen lain. Isolat bakteri yang digunakan sebagai isolat uji terdiri atas 10 isolat R. solanacearum yang mewakili strain berbeda, satu isolat bakteri yang memiliki kekerabatan dekat dengan R. solanacearum (Pseudomonas syzygii), dan dua spesies bakteri patogen lain (P. syringae pv. glycinea dan Xanthomonas axonopodis pv. glycines) (Tabel 2). Pengujian menggunakan teknik ELISA Tidak Langsung dari Machmud et al. (1996). Hasil pengujian diamati secara visual berdasarkan perubahan warna substrat pada cawan ELISA. Reaksi ELISA dinilai spesifik jika PAb yang diuji bereaksi positif dengan Ag, ditandai dengan terjadinya perubahan warna substrat pada lubang cawan ELISA menjadi biru. Jika warna substrat tidak berubah, maka PAb tidak bereaksi dengan Ag yang bersangkutan atau negatif. Setiap pengujian dibuat dua ulangan.
Pengujian Kepekaan Teknik ELISA Tidak Langsung untuk Deteksi R. solanacearum dari Tanah
dan Tanaman
Pengujian kepekaan teknik ELISA Tidak Langsung (Machmud et al. 1996) dilakukan dalam dua tahap, yaitu: (1) pada contoh tanah dan tanaman yang diinokulasi buatan, dan (2) pada contoh tanah dan tanaman dari lapangan. Pengujian menggunakan PAb1 sebagai sumber Ab dan suspensi R. solanacearum dalam PBS dengan kerapatan 1010 sel/ml sebagai sumber Ag. Pengujian Contoh Tanah dan Tanaman yang Diinokulasi Buatan
Sebelum pengujian disediakan contoh tanah asal Cikeumeuh, Bogor, yang telah disterilkan menggunakan otoklaf dengan suhu 1210C selama 30 menit dan tanaman kacang tanah varietas Kelinci berumur sebulan yang ditanam pada pot berisi tanah steril di rumah kaca. Untuk deteksi R. solanacearum dari tanah, mula-mula disediakan enam buah polibag ukuran 1 kg yang masing diisi dengan 500 g tanah steril. Ke dalam masing-masing polibag ditambahkan secara seri suspensi R. solanacearum yang telah disediakan, sehingga kan-dungannya berturut-turut 108, 106, 105, 104, dan 103 sel/g tanah, kemudian diaduk merata. Selanjutnya dari setiap polibag diambil 100 g contoh tanah, ditempatkan dalam gelas Erlenmeyer ukuran 250 ml, disuspensikan dengan 100 ml larutan PBS, dikocok merata, diambil 10 ml cairan ekstrak tanah, disentrifus dengan kecepatan 1000 rpm
selama 10 menit, dan supernatannya diambil untuk digunakan sebagai sumber Ag. Cara ini merupakan modifikasi dari cara Seal et al. (1992) dan Janse (1988). Untuk deteksi R. solanacearum dari tanaman digunakan enam contoh tanaman kacang tanah sehat yang ditanam di rumah kaca. Masing-masing contoh tanaman diblender selama 5 menit dengan menambah-kan 100 ml larutan PBS. Masing-masing ekstrak tanaman dipindahkan ke gelas Erlenmeyer ukuran 250 ml, se-hingga diperoleh enam gelas ekstrak tanaman. Selanjut-nya ke dalam tiap gelas Erlenmeyer ditambahkan secara seri suspensi R. solanacearum yang telah disediakan, sehingga kandungannya berturut-turut 108, 106, 105, 104, dan 103 sel/ml ekstrak tanaman kacang tanah. Selanjut-nya dari setiap gelas Erlenmeyer diambil 10 ml ekstrak, disentrifus dengan kecepatan 1000 rpm selama 10 menit, dan supernatannya diambil untuk digunakan sebagai sumber Ag. Selanjutnya, baik ekstrak tanah maupun ekstrak tanaman yang telah disediakan digunakan sebagai Ag untuk mengetahui kepekaan teknik ELISA Tidak Langsung untuk deteksi R. solanacearum dari tanah dan tanaman. Kepekaan teknik ini dievaluasi berdasarkan kepekatan Ag terendah yang masih mem-berikan reaksi positif.
Pengujian Contoh Tanah dan Tanaman dari Lapangan
Contoh tanah dan tanaman diambil langsung dari lapangan. Contoh ini terdiri atas: (1) biji kacang tanah sehat dan terinfeksi R. solanacearum dari tanaman yang bergejala layu bakteri, (2) tanaman kacang tanah sehat
dan yang bergejala layu bakteri, 3) umbi kentang sehat dan yang terinfeksi R. solanacearum, (4) tanaman kentang sehat dan yang bergejala layu bakteri, (5) tanah dari rizosfer tanaman kacang tanah yang bergejala layu, dan (6) tanah dari rizosfer tanaman kentang bergejala layu bakteri. Masing-masing contoh tanaman diekstraksi dengan cara tersebut di atas. Selanjutnya, ekstrak dari tanah maupun ekstrak tanaman yang telah disediakan digunakan sebagai Ag untuk mengetahui kepekaan teknik ELISA Tidak Langsung dalam mendeteksi R. solanacearum. Kepekaan teknik ini dinilai berdasarkan angka kepekatan Ag terendah yang masih memberikan reaksi positif.
HASIL DAN PEMBAHASAN
Produksi Antibodi Poliklonal
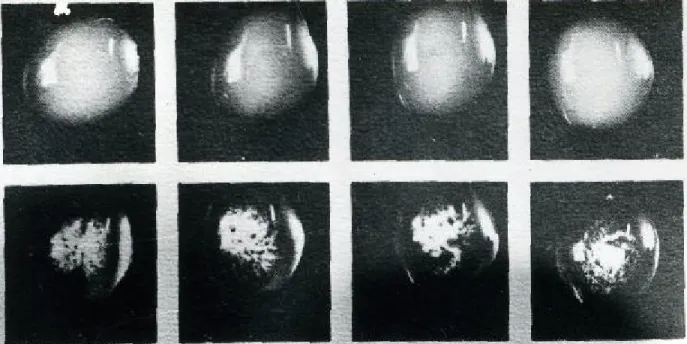
Imunisasi kelinci putih turunan kelinci hibrida New Zealand White dengan 24 perlakuan yang terdiri dua isolat R. solanacearum (Ps 9601 dan Ps2002-09) menggunakan tiga jenis Ag (Ag1, Ag2, dan Ag3) dengan empat teknik yang berbeda (IM, IP, IV, dan IV+IM) menghasilkan PAb dengan titer berkisar antara 256-4096. Titer adalah kebalikan dari angka enceran terkecil PAb yang masih menunjukkan reaksi positif dengan Ag (Ball et al. 1990). Reaksi PAb-Ag positif berdasarkan uji menggunakan teknik mikro-aglutinasi ditunjukkan oleh terjadinya penggumpalan hasil senyawa Pab-Ag yang dapat dilihat langsung secara visual atau dengan binokuler (Gambar 1).
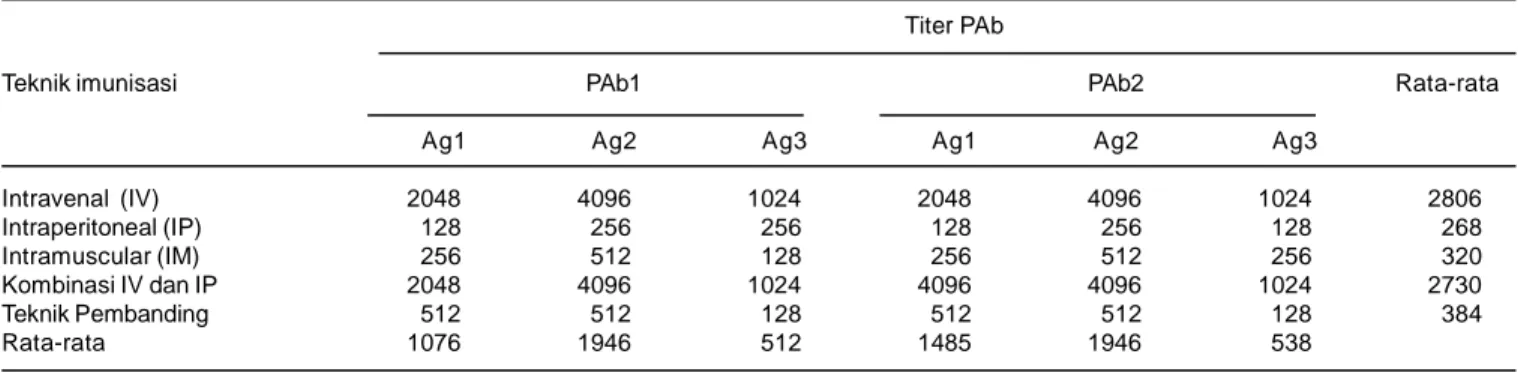
Antibodi yang dihasilkan dari imunisasi kelinci mempunyai titer yang beragam (Tabel 1). Titer antibodi yang dihasilkan tidak terlalu dipengaruhi oleh isolat R. solanacearum yang digunakan, tetapi lebih dipengaruhi oleh jenis Ag dan cara imunisasi kelinci. Titer PAb yang diproduksi dengan isolat R. solanacearum Ps 9601 yang mewakili Ras 1 Biovar 3 hampir sama dengan yang di-produksi menggunakan isolat Ps 2002-09 yang mewakili Ras 3 Biovar 2, berkisar antara 128 - 4096. Jenis Ag yang digunakan untuk imunisasi berpengaruh terhadap titer PAb yang dihasilkan. Sel bakteri yang dimatikan dengan formalin 0,6% (Ag1) atau yang difiksasi dengan larutan glutaraldehida 2,0% (Ag2) menghasilkan PAb dengan titer yang lebih tinggi daripada sel yang dimatikan dengan pemanasan (Ag3), masing-masing dengan titer tertinggi 2048, 4096, dan 1024 pada PAb1 serta 4096, 4096, dan 1024 pada PAb2 (Tabel 1).
Teknik imunisasi kelinci yang digunakan juga sangat berpengaruh terhadap titer PAb yang dihasilkan. Teknik imunisasi IV dan kombinasi IV + IP menghasilkan PAb dan dengan titer tertinggi mencapai 4096 dengan Ag2 pada PAb1 dan dengan Ag1 dan Ag2 pada PAb2. Teknik IP menghasilkan PAb dengan titer paling rendah di-banding teknik imunisasi lainnya, hanya menghasilkan titer tertinggi 256 pada PAb1 maupun PAb2, sedangkan teknik IM dan teknik Robinson-Smith (1993) yang di-gunakan sebagai pembanding menghasilkan PAb dengan titer tertinggi hanya 512. Pada penelitian se-belumnya, Machmud et al. (1996; 1999) memperoleh PAb dengan titer 512-1024 melalui imunisasi kelinci dengan kombinasi teknik IV dan IP menggunakan sel R. solanacearum yang dimatikan dengan pemanasan (Ag1) atau larutan glutaraldehida 2,0% (Ag2). Robinson-Smith (1993) dengan teknik imunisasi IM menggunakan antigen R. solanacearum dari strain yang berbeda meng-hasilkan PAb dengan titer hanya berkisar antara 8-512. Menurut Ball et al. (1990), hasil imunisasi kelinci dinilai
cukup baik jika titer PAb > 512. Dengan demikian, imunisasi melalui pembuluh vena (IV) atau kombinasi melalui vena dan peritoneum (IV + IP) merupakan pilihan terbaik untuk produksi PAb R. solanacearum. Jenis Ag terbaik yang digunakan adalah Ag1 dan Ag2, yaitu sel R. solanacearum yang dimatikan
Kespesifikan PAb R. solanacearum dengan Teknik ELISA Tidak Langsung
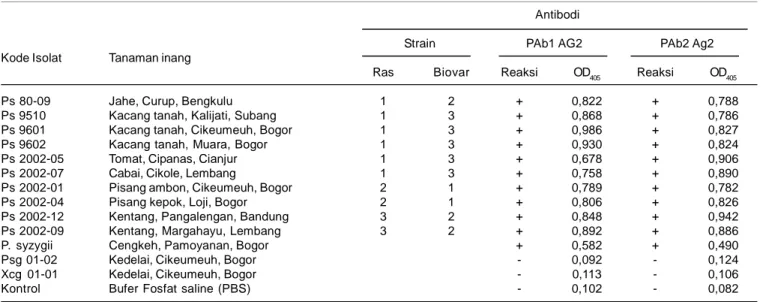
PAb yang diproduksi dengan menggunakan Ag dari dua strain R. solanacearum berbeda yang mewakili Ras 1 Biovar 3 dan Ras 3 Biovar 2 (Ps 9601 dan Ps 2002-09) memiliki reaksi yang spesifik terhadap R. solanaceaum, tetapi bereaksi silang dengan bakteri yang berkerabat dekat secara genetik. Namun, PAb R. solanacearum tidak bereaksi dengan Ag dari spesies bakteri lain (Tabel 2). Reaksi ini diamati secara visual dan dengan ELISA Reader Thermo Lab System Opsys MR berdasarkan angka kerapatan optik dengan panjang gelombang 405 nm (OD405). Antobodi PAb1 Ag2 yang diproduksi dengan Ag Ps 9601, mewakili Ras 1 Biovar 3, dan PAb2 Ag2 yang diproduksi dengan Ag Ps2002-09, mewakili Ras 3 Biovar 2, masing-masing bereaksi positif dengan 10 isolat R. solanacearum yang mewakili Ras 1 Biovar 3, Ras 2 Biovar 1, dan Ras 3 Biovar 2 yang berasal dari inang dan lokasi berbeda. PAb R. solanacearum bereaksi positif dengan Ag P. syzygii, bakteri penyebab penyakit berkas pembuluh cengkeh, yang memiliki kekerabatan genetik dekat dengan R. solanacearum. Hal ini menunjukkan bahwa PAb R. solanacearum tidak bereaksi spesifik terhadap strain tertentu, bahkan bereaksi silang dengan patogen lain yang berkerabat dekat. Sehubungan dengan ini Robinson-Smith (1993) memproduksi antibodi monoklonal yang bereaksi spesifik strain.Kedua PAb yang diuji tidak bereaksi dengan P. syringae pv. glycinea, (Psg 01-02), bakteri penyebab hawar daun Tabel 1. Titer dan spesivisitas antibodi poliklonal (PAb) yang diproduksi pada kelinci dengan lima cara imunisasi yang berbeda. Bogor, 2004.
Titer PAb
Teknik imunisasi PAb1 PAb2 Rata-rata
Ag1 Ag2 Ag3 Ag1 Ag2 Ag3
Intravenal (IV) 2048 4096 1024 2048 4096 1024 2806 Intraperitoneal (IP) 128 256 256 128 256 128 268 Intramuscular (IM) 256 512 128 256 512 256 320 Kombinasi IV dan IP 2048 4096 1024 4096 4096 1024 2730 Teknik Pembanding 512 512 128 512 512 128 384 Rata-rata 1076 1946 512 1485 1946 538
Ag1 = sel yang dimatikan dengan formalin 2,5%; Ag2 = sel yang dimatikan dengan glutaraldehida 2,5%, dan Ag3 = % sel R. solanacearum yang dimatikan dengan pemanasan 1000C selama 2 jam.
Teknik pembanding menggunakan teknik Robinson-Smith (1993). Titer PAb adalah kebalikan dari angka enceran terkecil PAb yang masih menunjukkan reaksi positif berdasarkan uji dengan teknik mikroaglutinasi (Ball et al. 1990).
kedelai, dan Xanthomonas axonopodis pv. glycines (Xcg 01-01), bakteri bisul pada kedelai. Sebelumnya, Ro-binson-Smith (1993) melakukan pengujian kespesifikan reaksi PAb R. solanacearum dengan cara yang sama menggunakan isolat patogen berbeda dengan hasil yang serupa.
Perbandingan Keefektifan Tiga Teknik ELISA Pengujian keefektifan tiga teknik ELISA, yaitu teknik ELISA Langsung, ELISA Tidak langsung dan NCM-ELISA me-nunjukkan bahwa ketiga teknik ini memiliki kepekaan deteksi yang berbeda (Tabel 3). Teknik ELISA Tidak Langsung dapat mendeteksi R. solanacearum hingga kerapatan 103 sel/ml, sedangkan teknik ELISA langsung
dan NCM ELISA hanya sampai 104 sel/ml. Hal ini ditunjuk-kan oleh warna substrat dalam lubang cawan reaksi yang diamati secara visual dan dengan ELISA Reader. Dalam hal ini ELISA Tidak Langsung memiliki kepekaan setingkat lebih tinggi daripada kedua teknik lainnya. Machmud et al. (1996; 1999) dan Robinson-Smith (1993) juga melaporkan hal serupa ketika membandingkan kepekaan beberapa teknik ELISA untuk mendeteksi R. solanacearum maupun patogen lain. Sebelumnya, McLaughlin & Chen (1990) dan Canale et al. (1983) juga menyatakan bahwa mereka cenderung memilih teknik ELISA Tidak Langsung. Menurut mereka, di samping lebih sensitif, teknik tersebut juga menggunakan konjugat-Ab sekunder yang dapat diperoleh secara komersial, sehingga peneliti dapat menyingkat waktu
Tabel 3. Kepekaan tiga modifikasi teknik ELISA berdasarkan hasil pengamatan reaksi secara visual dan angka absorbansi. Bogor, 2004. Reaksi pada kerapatan antigen (sel/ml):
Teknik ELISA Kontrol
108 107 106 105 104 103 negatif
ELISA Tidak Langsung +++ ++ ++ ++ + +
-(0,924) (0,728) (0,682) (0,622) (0,456) (286) (0,126)
ELISA Langsung +++ ++ ++ + - -
-(0,852) (0,706) (0,663) (0,462) (0,209) (0,205) (0,135)
NCM-ELISA +++ +++ ++ + -
-Reaksi + (positif) dan – (negatif) berdasarkan pengamatan visual.
Angka dalam kurung adalah kerapatan optik yang diukur ELISA Reader Thermo Lab System Opsys MR dengan panjang gelombang 405 Tabel 2. Kespesifikan dua PAb R. solanacearum untuk deteksi dan identifikasi strain Ralstonia solanacearum yang berbeda.
Antibodi
Strain PAb1 AG2 PAb2 Ag2 Kode Isolat Tanaman inang
Ras Biovar Reaksi OD405 Reaksi OD405
Ps 80-09 Jahe, Curup, Bengkulu 1 2 + 0,822 + 0,788
Ps 9510 Kacang tanah, Kalijati, Subang 1 3 + 0,868 + 0,786
Ps 9601 Kacang tanah, Cikeumeuh, Bogor 1 3 + 0,986 + 0,827
Ps 9602 Kacang tanah, Muara, Bogor 1 3 + 0,930 + 0,824
Ps 2002-05 Tomat, Cipanas, Cianjur 1 3 + 0,678 + 0,906
Ps 2002-07 Cabai, Cikole, Lembang 1 3 + 0,758 + 0,890
Ps 2002-01 Pisang ambon, Cikeumeuh, Bogor 2 1 + 0,789 + 0,782
Ps 2002-04 Pisang kepok, Loji, Bogor 2 1 + 0,806 + 0,826
Ps 2002-12 Kentang, Pangalengan, Bandung 3 2 + 0,848 + 0,942
Ps 2002-09 Kentang, Margahayu, Lembang 3 2 + 0,892 + 0,886
P. syzygii Cengkeh, Pamoyanan, Bogor + 0,582 + 0,490
Psg 01-02 Kedelai, Cikeumeuh, Bogor - 0,092 - 0,124
Xcg 01-01 Kedelai, Cikeumeuh, Bogor - 0,113 - 0,106
Kontrol Bufer Fosfat saline (PBS) - 0,102 - 0,082
Angka OD405 = angka rata-rata dari dua ulangan; simpangan baku = 0,122
A405 = angka absorbansi yang diukur dengan ELISA Reader Thermo Lab System Opsys MR dengan panjang gelombang 405 nm. + = reaksi positif; - = reaksi negatif
Ps = R. solanacearum; P. syzygii = patogen yang berkerabat genetik dengan R. solanacearum; Psg = P. syringae pv. glycinea; Xcg = Xanthomonas axonopodis pv. glycines
pengerjaannya tanpa harus menyediakan konjugat-Ab primer sendiri, karena memerlukan waktu dan ke-terampilan tersendiri. Pada awalnya teknik ini lebih banyak digunakan untuk identifikasi fitoplasma dan bakteri korineform (De Boer et al. 1988; Lin and Chen 1986; Sinha and Berhamou 1983).
Kepekaan Teknik ELISA Tidak Langsung dalam Deteksi R. solanacearum dari Tanah dan Tanaman Pengujian Contoh Tanah dan Tanaman yang
Diinokulasi Buatan
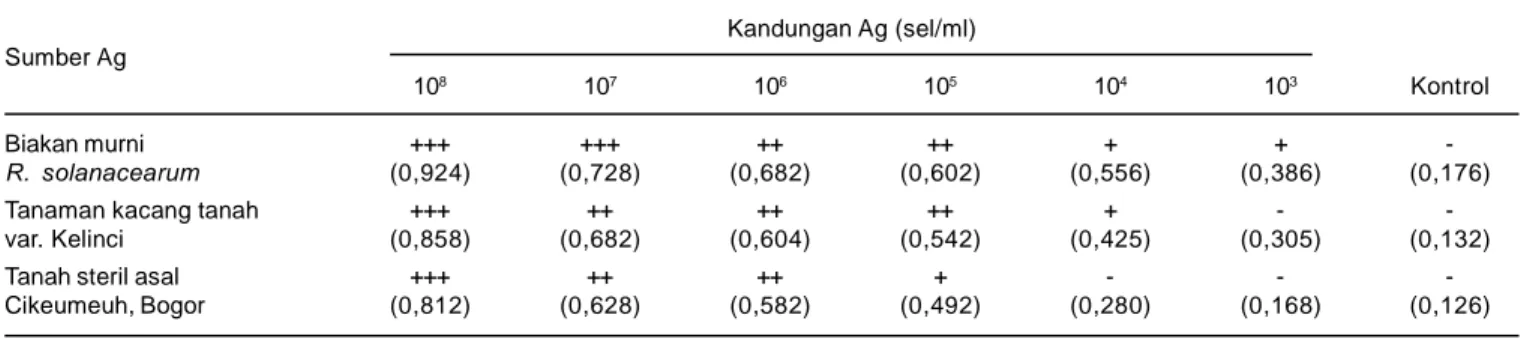
Teknik ELISA Tidak Langsung dapat digunakan untuk mendeteksi R. solanacearum dari ekstrak tanah atau tanaman yang diinfestasi secara buatan (Tabel 4). Berdasarkan hasil pengamatan secara visual dan meng-gunakan ELISA Reader dapat diketahui bahwa kepekaan teknik ELISA ini untuk mendeteksi R. solanacearum dari ekstrak tanaman (104 sel/ml) setingkat lebih rendah dari-pada kepekaan deteksi dari-pada suspensi biakan murni R. solanacearum (103 sel/ml), tetapi setingkat lebih tinggi daripada kepekaan deteksi pada ekstrak tanah (105 sel/ ml). Hal ini sesuai dengan yang dilaporkan Robinson-Smith (1993) dan Machmud et al. (1996). Kepekaan deteksi R. solanacearum dari tanah relatif rendah, tetapi dapat ditingkatkan dengan memodifikasi komponen bufer yang digunakan untuk mengekstraksi tanah de-ngan menambahkan asam kholat dan polivinil pirolidon (PVP) (McLaughlin et al. 1989). Menurut Priou (1997) yang dikutip oleh Yadi et al. (1998), kepekaan teknik deteksi juga dapat ditingkatkan menggunakan metode pengayaan (enrichment), yaitu dengan menumbuhkan ekstrak tanaman yang diduga mengandung R. solana-cearum pada media pengaya (enrichment medium).
Pengujian pada Contoh Tanah dan Tanaman dari Lapangan
Pengujian kepekaan teknik ELISA Tidak Langsung menggunakan contoh tanah dan tanaman yang diambil dari lapangan menunjukkan hasil yang serupa dengan pengujian menggunakan contoh tanah dan tanaman yang diinokulasi buatan (Tabel 5). Teknik ini, dengan menggunakan PAb1 dan PAb2, dapat mendeteksi R. solanacearum dari tanah rizosfer tanaman kacang tanah, kentang, dan tomat yang bergejala layu. Teknik ini juga dapat mendeteksi R. solanacearum secara langsung dari biji kacang tanah, umbi kentang, serta batang kacang tanah dan kentang yang terinfeksi patogen tersebut. Tanaman kacang tanah, kentang, dan tomat yang sehat serta biji kacang tanah dan umbi kentang yang sehat yang diuji sebagai pembanding tidak menunjukkan reaksi positif. Angka OD405 yang tinggi (0,672-680) pada biji dan tanaman yang bereaksi positif menunjukkan populasi R. solanaclarum yang tinggi dalam contoh-contoh tanaman tersebut. Hal ini ditunjuk-kan pada control positif yang menggunaditunjuk-kan suspensi bakteri dengan kepekatan 3 x 108 sel/ml.
Angka OD405 pada contoh tanah rizosfer, baik pada tanaman kacang tanah, kentang, maupun tomat yang bergejala layu, lebih rendah daripada angka OD405 pada contoh biji dan tanaman tersebut (0,468-0,678). Hal ini dapat terjadi karena dua kemungkinan, yaitu: (1) populasi R. solanacearum pada rizosfer tanaman lebih rendah daripada populasinya di dalam tanaman, dan (2) kepekaan teknik ELISA untuk mendeteksi R. solana-cearum dari tanah (rizosfer) tidak optimal karena ada-nya seada-nyawa yang menghambat proses reaksi. Seada-nyawa penghambat yang terdapat di dalam tanah belum banyak diketahui, tetapi di antaranya adalah senyawa fenolik (Janse 1988; Seal et al. 1992; Stobbs 1985).
Tabel 4. Kepekaan teknik ELISA Tidak Langsung untuk deteksi bakteri Ralstonia solanacearum pada tanah dan tanaman yang diambil langsung dari lapangan. Bogor, 2004.
Kandungan Ag (sel/ml) Sumber Ag
108 107 106 105 104 103 Kontrol
Biakan murni +++ +++ ++ ++ + +
-R. solanacearum (0,924) (0,728) (0,682) (0,602) (0,556) (0,386) (0,176)
Tanaman kacang tanah +++ ++ ++ ++ + -
-var. Kelinci (0,858) (0,682) (0,604) (0,542) (0,425) (0,305) (0,132)
Tanah steril asal +++ ++ ++ + - -
-Cikeumeuh, Bogor (0,812) (0,628) (0,582) (0,492) (0,280) (0,168) (0,126)
Tanah dan tanaman kacang tanah dalam bentuk ekstrak yang dicampur dengan suspensi R. solanacearum dengan kerapatan sel berbeda. Reaksi + = positif dan – = negatif berdasarkan pengamatan visual.
Angka dalam kurung adalah kerapatan optik yang diukur dengan ELISA Reader Thermo Lab System Opsys MR dengan panjang gelombang 405 nm (OD405); simpangan baku () = 0,156.
KESIMPULAN DAN SARAN
1. Antibodi poliklonal R. solanacearum dapat di-produksi pada kelinci turunan New Zealand White Hybrid dengan teknik imunisasi yang berbeda dengan titer 128-4096. Imunisasi kelinci secara intravenal atau kombinasi intravenal dan intra-peritoneal paling baik digunakan untuk produksi PAb.
2. Teknik ELISA Tidak Langsung dapat mendeteksi R. solanacearum dengan kepekaan 103 sel/ml, lebih peka daripada teknik ELISA Langsung dan NCM ELISA.
3. Teknik ELISA Tidak Langsung dapat digunakan untuk mendeteksi dan mengidentifikasi R. solanacearum secara langsung dari tanah dan tanaman.
4. Antibodi poliklonal R. solanacearum perlu di-produksi secara massal untuk keperluan ko-mersialisasi dan deteksi serologis strain R. solanacearum.
5. Protokol beserta perangkat teknik ELISA Tidak Langsung dapat dirakit bagi para penggunanya di lapangan, baik untuk keperluan pengkajian ekologi R. solanacearum dan epidemiologi penyakit layu bakteri maupun untuk uji kesehatan benih dan bahan tanaman lainnya dalam kaitannya dengan
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada Endang Windiyati, SSi, dan Wawan SSi, teknisi dan tenaga honorer di Balitbio, Bogor, atas bantuan teknis yang telah mereka berikan dalam pelaksanaan penelitian ini.
DAFTAR PUSTAKA
Anonim. 2004. Crop Protection Compendium. (Commonwealth Agricultural Bureau (CAB) International, Wallingford, England. (CD Rom).
Ball, E. M., R.O. Hampton, S.H. De Boer, and N.W. Schaad. 1990. Polyclonal antibodies. In: Hampton, R., E. Ball, and S. de Boer. 1990. Serological methods for detection and identification of viral and bacterial plant pathogens. A Laboratory Manual. APS Press, St. Paul, Minn. p. 33-54. Canale F., A. Peralta, and M. Colombo. 1983. Comparison of
serological techniques for the detection of P. solanacearum. Fitopatologia 18:48-52.
Converse, R.H. and R.R. Martin. 1990. ELISA methods for plant viruses. In: Hampton, R., E. Ball, and S. de Boer. 1990. Serological methods for detection and identification of viral and bacterial plant pathogens. A Laboratory Manual. APS Press, St. Paul, Minn. p. 179-196.
De Boer, S.H., A. Wieczorek, and A. Kumer. 1988. An ELISA test for bacterial ring rot with monoclonal antibody. Plant Disease 72:874-878.
Hayward, A.C. 1994. Hosts of P. solanacearum, pp. 9-21. In A.C. Hayward and G.L. Hartman (Eds.) Bacterial wilt: The disease Tabel 5. Kepekaan teknik ELISA Tidak Langsung untuk deteksi bakteri Ralstonia solanacearum pada tanah dan tanaman yang diambil
langsung dari lapangan. Bogor, 2004.
Reaksi ELISA dengan:
Contoh uji Asal PAb1 PAb2
Vis. OD405 Vis. OD405
Tanah rizosfer kacang tanah Cikeumeuh, Bogor + 0,678 + 0,620
Tanah rizosfer kentang Cipanas, Cianjur + 0,542 + 0,586
Tanah rizosfer tomat Margahayu, Lembang + 0,468 + 0,568
Biji kacang tanah terinfeksi RS Cikeumeuh, Bogor + 0,860 + 0,840
Umbi kentang terinfeksi RS Cipanas, Cianjur + 0,672 + 0,778
Tanaman kacang tanah terinfeksi RS Cikeumeuh, Bogor + 0,756 + 0,784
Tanaman kentang terinfeksi RS Cipanas, Cianjur + 0,782 + 0,828
Tanaman tomat terinfeksi RS Margahayu, Lembang + 0,816 + 0,860
Biji kacang tanah sehat Cikeumeuh, Bogor - 0,148 - 0,184
Tanaman kacang tanah sehat Cikeumeuh, Bogor - 0,192 - 0,160
Tanaman kentang sehat Margahayu, Lembang - 0,182 - 0,156
Tanaman tomat sehat Margahayu, Lembang - 0,210 - 0,202
Umbi kentang sehat Cipanas, Cianjur - 0,153 - 0,138
Biakan murni Ps 9601 (kontrol positif) Ras 1 Biovar 3 + 0,884 + 0,926
Biakan murni Ps 2002-09 (kontrol positif) Ras 3 Biovar 2 + 0,942 + 0,896
PBS (kontrol negatif) - 0,132 - 0,168
Vis. = pengamatan visual berasarkan warna substrat, + = reaksi positif dan - = reaksi negatif;
A405 = angka absorbansi yang diukur dengan ELISA Reader Thermo Lab System Opsys MR dengan panjang gelombang 405 nm dengan simpangan baku () = 0,128.
and its causative agent, P. solanacearum. CAB International, Wallingford, UK.
Janse, J.D. 1988. A detection method for P. solanacearum in symptomless potato tubers and some data on its specificity and sensitivity. Bulletin OEPP 18:343-351.
Lin, C.P., and T.A. Chen. 1986. Comparison of monoclonal antibodies and polyclonal antibodies in detection of aster yellows mycoplasma-like organism. Phytopathology 76:45-50. Machmud, M., M. Muhsin, Jumanto H., Roechan M., Ifa Manzila,
Yadi Suryadi, dan M. A. Suhendar. 1996. Kajian pengembangan teknik serologi dan biologi molekuler untuk deteksi dan identifikasi patogen tumbuhan serta perakitan perangkatnya. Laporan Hasil Penelitian RPTP 1995/1996. Balitbio, Bogor. Machmud, M., Yadi Suryadi, M.A. Suhendar, Jumanto H., Ifa
Manzila, dan Roechan M. 1997. Produksi perangkat ELISA untuk deteksi virus bilur kacang tanah, virus kerdil kedelai, dan bakteri layu (P. solanacearum). Laporan ROPP Tahun Anggaran 1996/1997. Balitbio, Bogor.
Machmud, M., Jumanto H., Roechan M., Ifa Manzila, Yadi Suryadi, dan M. A. Suhendar. 1998. Perbaikan teknik serologi dan biomolekuler untuk deteksi dan identifikasi patogen tumbuhan serta perakitan perangkatnya guna menunjang program produksi benih. Laporan Hasil Penelitian RPTP 1997/ 1998. Balitbio, Bogor.
Machmud M., Yadi Suryadi, M.A. Suhendar, Jumanto H., dan Roechan M. 1999. Perakitan perangkat ELISA untuk deteksi dan identifikasi Rs, SMV, PSG dan Xcg dengan antibodi poliklonal. Laporan ROPP Tahun Anggaran 1998-1999. UPT Perkebunan, Bogor.
McLaughlin, R.J., and T.A. Chen. 1990. ELISA methods for plant pathogenic prokaryotes. In: R. Hampton and S. H. De Boer (Eds.). Serological Methods for Detection and Identification
of Viral and Bacterial Plant Pathogens. A Laboratory Manual. The APS Press, St Paul, Minnesota. p.197-201.
McLaughlin, R.J., T.A. Chen, and J.M. Wells. 1989. Monoclonal antibodies against Erwinia amylovora: Characterization of a mixture for detection by ELISA. Phytopathology 79:610-613. Morton, D.J., P.D. Dukes, and S.F. Jenkins. 1996. Serological relationships of races 1, 2, and 3 of P. solanacearum. Plant Disease Reporter 50: 275-257.
Robinson-Smith, A. 1993. Serological detection of P. solanacearum by ELISA. In: G.L. Hartman and A.C. Hayward (Eds.). Bacterial Wilt. ACIAR Proc. Internat. Symp., Kaohsiung, Taiwan, 28-30 October 1992. ACIAR Proceedins No. 45, Canberra, Australia. p. 54-61.
Seal, S. E. and J. G. Elphinstone. 1994. Advances in identification and detection of P. solanacearum. In A.C. Hayward and G.L. Hartman (Eds.). Bacterial Wilt: The disease and its causative agent, P. solanacearum. CAB International, Wallingford, England. pp. 35-58.
Seal, S. E. and J. G. Elphinstone, L. Skoglund, and D. Berrios. 1992. Detection of P. solanacearum latent infections in seed potatoes during their multiplication in Burundi. ACIAR Bacterial Wilt Newsletter 8:2-3. Canberra, Australia. Sinha, R.C. and T. Berhamou. 1983. Detection of mycoplasma-like
organism antigens from aster-yellows diseased plants by two serological procedures. Phytopathology 73:1199-1202. Stobbs, L.W. and D. Barker. 1985. Rapid sample analysis with a
simplified ELISA. Phytopathology 75:492-495.
Sulyo, Y. 1992. Major banana diseases and their control. IARD Journal 14(3 & 4): 55-58.
Yadi Suryadi, M. Machmud, Rusmadi, dan M.A. Suhendar. 1998. Detection of P. solanacearum from latently infected potato tubers using ELISA and PCR techniques. J. Biol. Indonesia II(3):142-149.