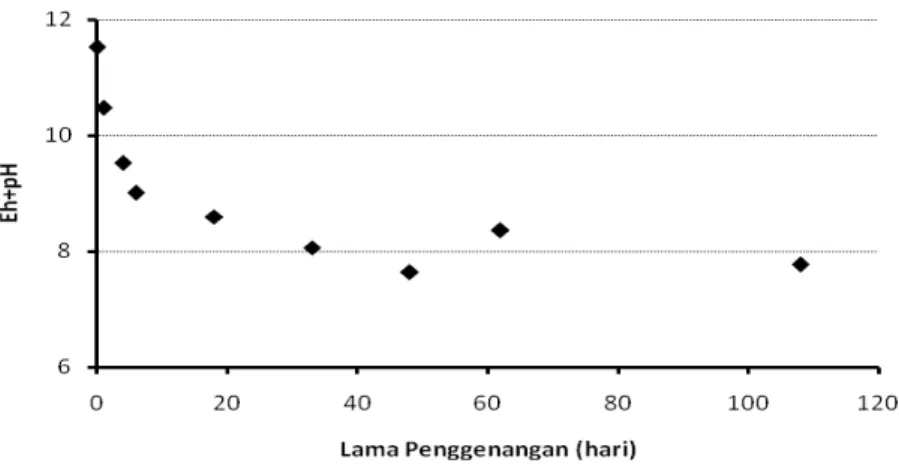
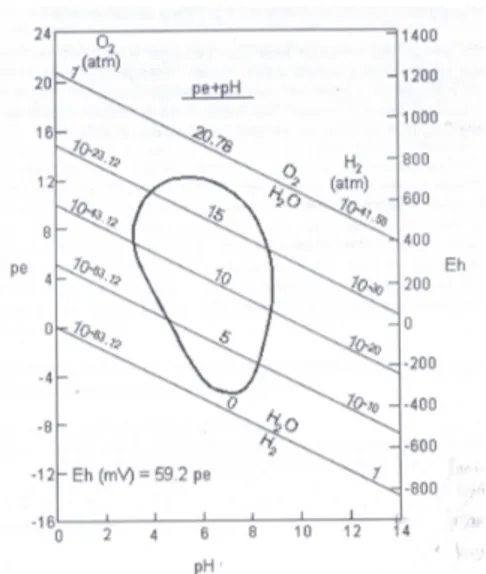
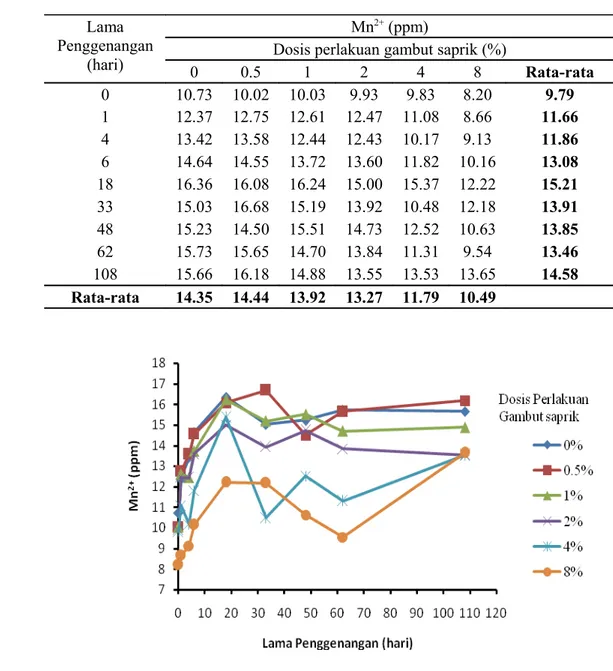
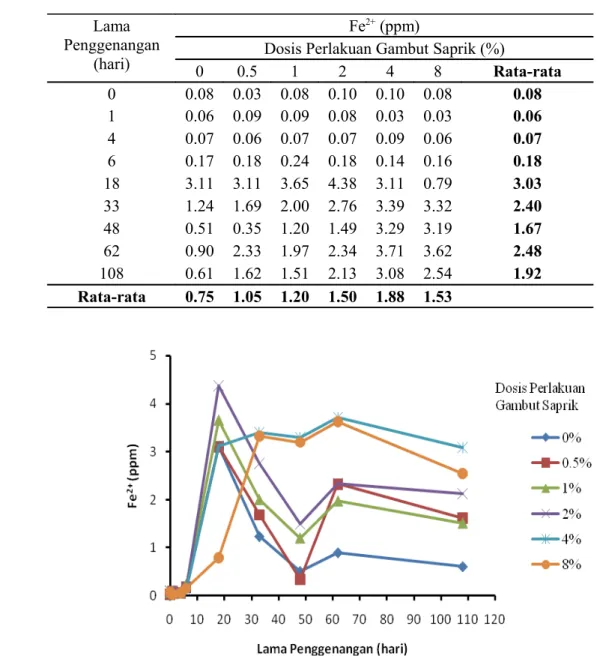
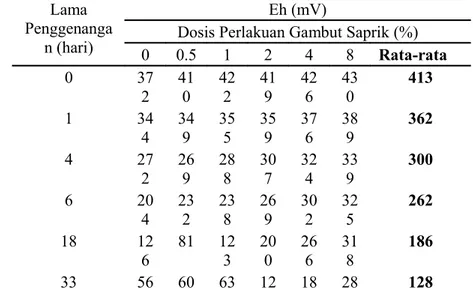
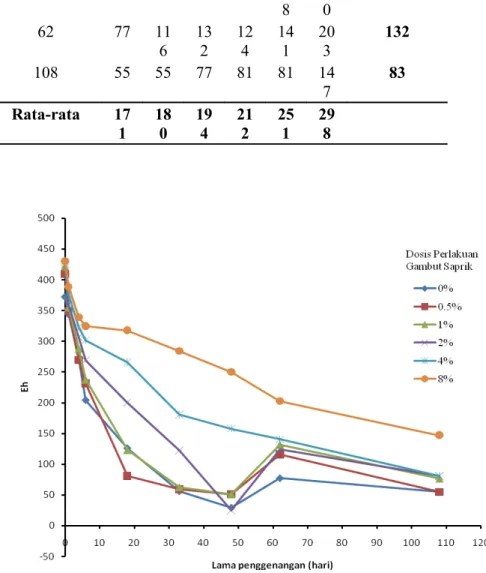
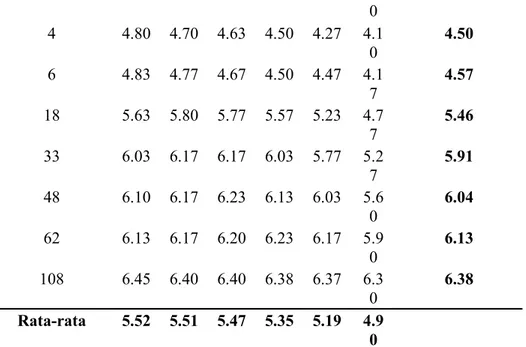
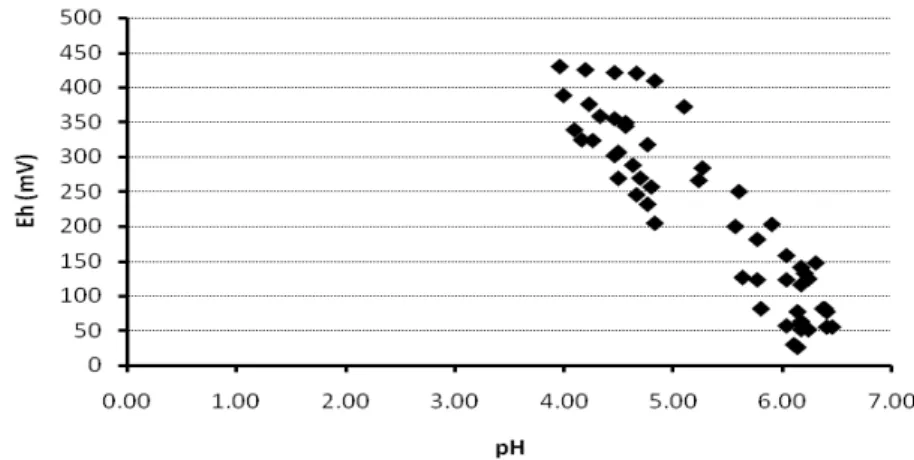
HASIL DAN PEMBAHASAN. (CH 2 O)n + n O 2 n CO 2 + n H 2 O + e - (1) mikrob (CH 2 O)n + nh 2 O nco 2 + 4n e - + 4n H + (2)
Teks penuh
Gambar
Dokumen terkait
Berdasarkan penelitian yang telah dilakukan pada 72 orang siswi SMA Negeri 8 Kendari, menunjukkan bahwa proporsi responden yang memiliki perilaku penggunaan pembalut
Faktor-Faktor yang Berhubungan dengan Penurunan Visus yang Disebabkan Oleh Keiainan Refraksi yang Tidak Terkoreksi Pada Mata Miopia.. Kejadian Miopia Pada Anak Sekolah Dasar di
Therapeutic Lifestyle Changes (TLC) mencakup penurunan asupan lemak jenuh dan kolesterol, pemilihan bahan makanan yang dapat menurunkan kadar LDL, penurunan berat
?~nyayang, yang telah meliMpahkan berkat dan rakhmat-Nya kepada -kita sekalian hingga-pada hari ini tanggal 9 September 1987 kita dalam keadaan sehat ~alafiat
Pendugaan Emisi Gas Rumah Kaca (GRK) dari Lahan Padi Gambut serta Analisis Serapan Karbon Oleh Tanaman. Program Sarjana Institut
JOY Indonesia telah memasuki usia yang ke-28 tahun. Perjalanan pelayanan hingga 28 tahun bukanlah sesuatu yang mudah. Ada banyak suka, duka serta tantangan yang dialami sampai saat
Tingginya jumlah bakteri di tambak udang daerah Percut disebabkan karena merupakan lokasi tambak yang paling dekat dengan kawasan industri, rumah penduduk, dan