PEMANFAATAN KULIT BATANG UBI KAYU SEBAGAI SUMBER
ENZIM PEROKSIDASE UNTUK PENURUNAN KADAR FENOL
Zusfahair dan Santi Nur Handayani
Program Studi Kimia, Jurusan MIPA, FST, UNSOED Purwokerto
ABSTRACT
The using of peroxidase in time to decrease phenol value is often developed. Peroxidase able to transform phenolic compound and derivaties of early soluble into not soluble in water, so separated prosseces become be easier. Peroxidase is produced from stem bark of cassava. The aim of this research is to investigate some effectiveness peroxidase enzyme from stem bark of cassava and used to decrease phenol on optimum conditions with include phenol concentration, ratio phenol with H2O2, pH, amount of enzyme, temperature, and optimum of contact time.
At first is extraction of peroxidase from stem bark of cassava to get crude extract of enzyme, so that determine activity unit. Crude extract of enzyme is produced furthermore used to determine optimum condition is phenol concentration, ratio phenol with H2O2, pH, amount of enzyme, temperature, and optimum of contact time. Phenol value residu is analized using spectrophotometer UV-Vis with λ on 505 nm.
The result showed activity crude extract of peroxidase enzyme from stem bark cassava is 1.734 U/mL. Crude extract of peroxidase enzyme from stem bark cassava can decrease phenol value with optimum condition at concentration 125 mg/L; ratio phenol with H2O2 = 1: 3; pH 8; ratio amount enzyme: buffer = 7,5: 2,5; temperature 25oC; and contact time 150 menit is 21.9379%.
Keyword: crude extract of peroxidase, stem bark cassava, decreasing phenol
INTISARI
Dewasa ini penggunaan peroksidase untuk menurunkan kadar fenol mulai banyak dikembangkan. Peroksidase dapat mengubah senyawa fenol dan derivatnya yang semula larut menjadi tidak larut dalam air, sehingga proses pemisahannya menjadi lebih mudah. Peroksidase dapat dihasilkan dari kulit batang ubi kayu. Penelitian ini bertujuan untuk mengetahui efektivitas peroksidase dari kulit batang ubi kayu dan pemanfaatannya untuk menurunkan kadar fenol pada kondisi optimum yang meliputi konsentrasi fenol, perbandingan fenol dengan H2O2, pH, jumlah enzim,
suhu, dan waktu kontak optimum.
Langkah awal pada penelitian ini adalah mengekstraksi peroksidase dari kulit batang ubi kayu untuk memperoleh ekstrak kasar enzimnya yang kemudian ditentukan unit aktivitasnya. Ekstrak kasar enzim yang diperoleh selanjutnya digunakan untuk menentukan kondisi optimum meliputi penentuan konsentrasi fenol, perbandingan fenol dengan H2O2, pH, jumlah enzim, suhu, dan waktu kontak
optimum. Kadar fenol sisa dianalisis menggunakan spektrofotometer UV-Vis pada λ 505 nm.
Hasil penelitian menunjukkan bahwa aktivitas ekstrak kasar peroksidase dari kulit batang ubi kayu adalah sebesar 1,734 U/mL. Ekstrak kasar peroksidase dari kulit batang ubi kayu dapat menurunkan kadar fenol pada kondisi optimum yaitu pada konsentrasi fenol 125 mg/L; perbandingan fenol dengan H2O2 = 1: 3; pH 8, perbandingan jumlah enzim: buffer = 7,5: 2,5; suhu 25
o
C, dan waktu kontak 150 menit adalah sebesar 21,9379%.
Kata kunci: ekstrak kasar peroksidase, kulit batang ubi kayu, penurunan fenol
PENDAHULUAN
Dewasa ini penggunaan enzim untuk mendetoksifikasi mulai banyak dikembangkan, antara lain peroksidase untuk menurunkan kadar fenol. Peroksidase dapat mengubah senyawa fenol dan derivatnya yang semula larut menjadi tidak larut dalam air, sehingga proses pemisahannya menjadi lebih mudah. Proses enzimatik lebih menguntungkan dari pada proses biologi, kimia dan fisika karena dapat mendegradasi secara selektif, laju reaksi tinggi, dapat beroperasi pada range pH yang luas,
serta prosesnya lebih mudah dikontrol (Kinsley and Nicell, 2000). Penggunaan peroksidase dari tanaman lebih efektif dibandingkan dengan cara mikroba (Hirano, et. al., 2000). Sumber peroksidase seperti Coprinus cinereus, akar horseradish, dan kedelai merupakan sumber peroksidase yang komersial (Ikehata, et al., 2003; Bodalo, et. al., 2006 dan Kennedy, et. al., 2002). Ketiga sumber peroksidase tersebut sulit didapatkan, sehingga perlu dikembangkan aplikasi peroksidase bersumber dari kulit batang ubi kayu.
Selama ini kulit batang ubi kayu belum ada pemanfaatannya. Dewani (2007) menyatakan kulit batang ubi kayu yang sangat potensial sebagai sumber peroksidase. Oleh karena itu penggunaan kulit batang ubi kayu sebagai sumber peroksidase yang potensial dan murah salah satunya untuk penurunan kadar fenol perlu dikembangkan.
Penelitian penurunan kadar fenol ini dilakukan pada skala laboratorium, yang difokuskan pada pemecahan komponen tunggal dengan menggunakan ekstrak enzim kasar. Aktivitas enzim dipengaruhi oleh konsentrasi substrat, jumlah enzim, pH, waktu kontak, dan suhu. Aktivitas peroksidase juga dipengaruhi oleh perbandingan fenol dengan H2O2 ( Villalobos and Buchanan,
2002). Aktivitas enzim optimum terjadi pada saat konsentrasi substrat, perbandingan fenol dengan H2O2, jumlah enzim, pH, suhu, dan waktu kontak optimum. Penelitian bertujuan untuk mengetahui
efektivitas peroksidase yang diperoleh dari kulit batang ubi kayu dan menentukan persentase penurunan kadar fenol dengan penambahan peroksidase dari kulit batang ubi kayu yang dilakukan pada kondisi optimum (konsentrasi substrat, perbandingan fenol dengan H2O2, pH, jumlah enzim,
suhu dan waktu kontak).
Alat dan Bahan
Peralatan yang digunakan dalam penelitian ini adalah gelas, spektrofotometer UV-Vis, pH meter, dan alat sentrifugasi. Bahan-bahan antara lain kulit batang ubi kayu, H2O2, NH4OH, Fenol,
H2SO4, Pirogalol, 4-Aminoantipirin, Buffer Na-fosfat, Buffer Tris-HCl, eter, dan Kalium ferisianida Prosedur Penelitian
Ekstraksi Peroksidase (Zusfahair dan Diastuti, 1998)
Sepuluh gram kulit batang ubi kayu dilarutkan dalam 60 mL aquades bebas mineral pada suhu kamar, kemudian diblender untuk memperoleh sari kasar. Sari kasar daun kulit batang ubi kayu yang diperoleh kemudian disaring dengan kain kasa lalu disentrifugasi dengan kecepatan 4000 rpm selama 20 menit. Supernatan yang diperoleh merupakan ekstrak kasar peroksidase.
Test Aktivitas Enzim Peroksidase(Rustam, 1988)
Aktivitas peroksidase ditentukan dengan metode Wilstatter yang dimodifikasi oleh Summer, Polis, dan Shmukler. Melalui cara ini, pirogalol dioksidasi menjadi purpurogalin oleh H2O2 dengan
adanya peroksidase. Dua ml pirogalol 5% dimasukkan ke dalam tabung, ditambahkan 1 mL H2O2
0,5%, 2 mL buffer fosfat dan air 14 mL. Suhu larutan dijaga pada 200C, selanjutnya ditambahkan 1 mL larutan enzim dan setelah ± 20 detik ditambahkan 1 mL H2SO4 2 M. Purpurogalin yang terbentuk
diekstraksi menggunakan eter sebanyak 3 kali 30 mL. Ekstrak yang mengandung purpurogalin dalam eter dikeluarkan dan dikumpulkan. Larutan yang masih tertinggal dalam corong pisah ditambahkan lagi 10 mL eter, lalu diekstraksi. Larutan purpurogalin yang diperoleh diukur dengan spektrofotometer UV-Vis pada λ 420 nm. Larutan kontrol adalah larutan substrat dan reagen tanpa penambahan enzim. Aktivitas spesifik peroksidasenya dihitung dengan persamaan sebagai berikut:
Unit/mL = A420 (sampel-kontrol) x 8,5 mL larutan
Penurunan Kadar Fenol oleh Peroksidase (Kennedy, et. al., 2002) Penentuan Konsentrasi Substrat (Kennedy, et. al., 2002)
Sebanyak 20 mL larutan fenol dengan konsentrasi 0, 50, 75, 100, 125, dan 150 mg/L pada pH 7 dimasukkan dalam gelas piala, masing-masing dilakukan duplo. Larutan fenol kemudian ditambah 5 mL ekstrak kasar enzim. Ditambahkan 20 mL hidrogen peroksida yang perbandingan konsentrasi molarnya 1:1 dengan konsentrasi fenol. Larutan dikocok selama 1 jam dengan kecepatan 50 rpm/menit pada suhu kamar. Penurunan kadar fenolnya ditentukan dengan spektrofotometri UV-Vis (SNI 06-6989.21, 2004).
Penentuan perbandingan Fenol dan H2O2 (hidrogen peroksida)
Sebanyak 20 mL larutan fenol pada konsentrasi optimum pada pH 7 dimasukkan dalam gelas piala, masing-masing dilakukan duplo. Larutan fenol kemudian ditambah 5 mL ekstrak kasar enzim. Ditambahkan 20 mL hidrogen peroksida dengan perbandingan fenol dan hidrogen peroksida 2:1, 1:1,
1:2, 1:3, 1:4. Larutan dikocok selama 1 jam dengan kecepatan 50 rpm/menit pada suhu kamar. Penurunan kadar fenolnya ditentukan dengan spektrofotometri UV-Vis.
Penentuan pH Optimum (Kennedy, et. al., 2002)
Sebanyak 20 mL larutan fenol pada konsentrasi optimum dimasukkan ke dalam gelas piala dengan variasi pH antara 6 - 9, masing-masing dilakukan duplo. Preparasi fenol pada pH 6-7 menggunakan buffer natrium fosfat, dan preparasi fenol pada pH 8-9 menggunakan buffer Tris-HCl. Larutan fenol kemudian ditambahkan 5 mL larutan ekstrak kasar enzim. Ditambahkan hidrogen peroksida pada perbandingan hidrogen peroksida dan fenol yang optimum. Larutan dikocok selama 1 jam dengan kecepatan 50 rpm/menit pada suhu kamar. Penurunan kadar fenolnya ditentukan dengan spektrofotometri UV-Vis.
Penentuan Jumlah Enzim Optimum
Sebanyak 20 mL larutan fenol pada konsentrasi dan pH optimum dimasukkan ke dalam gelas piala, masing-masing dilakukan duplo. Larutan fenol tersebut kemudian ditambahkan enzim: buffer = 2,5 ; 7,5; 5: 5; 7,5: 2,5; dan 10: 0 sebanyak 10 ml. Ditambahkan 20 mL hidrogen peroksida pada perbandingan hidrogen peroksida dan fenol yang optimum. Larutan dikocok selama 1 jam dengan kecepatan 50 rpm/menit pada suhu kamar. Penurunan kadar fenolnya ditentukan dengan spektrofotometri UV-Vis.
Penentuan Suhu Optimum (Kennedy, et. al., 2002)
Sebanyak 20 mL larutan fenol pada konsentrasi optimum pada pH optimum dimasukkan ke dalam gelas piala, ditambahkan larutan ekstrak enzim kasar pada jumlah optimum, masing-masing dilakukan duplo. Ditambahkan hidrogen peroksida pada perbandingan hidrogen peroksida dan fenol yang optimum. Larutan dikocok selama 1 jam dengan kecepatan 50 rpm/menit pada variasi suhu, yaitu 15, 20, 25, 30, dan 35oC. Penurunan kadar fenolnya ditentukan dengan spektrofotometri UV-Vis.
Penentuan Waktu Kontak Optimum (Kennedy, et. al., 2002)
Sebanyak 20 mL larutan fenol konsentrasi optimum pada pH optimum dimasukkan ke dalam gelas piala, ditambahkan larutan ekstrak enzim kasar pada jumlah optimum, masing-masing dilakukan duplo. Ditambahkan hidrogen peroksida pada perbandingan hidrogen peroksida dan fenol optimum. Larutan dikocok pada kecepatan 50 rpm/menit dengan waktu kontak 30, 60, 90, 120, 150, 180, 210, dan 240 menit. Penurunan kadar fenolnya ditentukan dengan spektrofotometri UV-Vis.
Penentuan Kadar Fenol Hasil Treatmen (SNI 06-6989.21, 2004)
Masukkan ke dalam gelas piala 10 mL larutan fenol hasil degradasi secara duplo, tambahkan 0, 25 mL larutan NH4OH 0,5 N dan atur pH menjadi 7,9 ± 0,1 dengan penambahan larutan penyangga
fosfat. Campuran ditambahkan 0,1 mL larutan 4-aminoantipirin sambil diaduk, dan tambahkan 0,1 mL larutan kalium ferisianida sambil diaduk, diamkan selama 15 menit, larutan dimasukkan ke dalam cuvet pada alat spektrofotometer, baca dan catat absorbansi pada λ 500 nm.
HASIL DAN PEMBAHASAN Uji Aktivitas Peroksidase
Tahap awal dari uji aktivitas adalah isolasi enzim. Ekstrak kasar enzim yang diperoleh ditentukan aktivitasnya menggunakan pirogalol sebagai substrat. Pirogalol merupakan substrat yang ideal bagi aktivitas peroksidase karena dapat membentuk produk purpurogalin yang intensitas warna orangenya sangat tajam dan dapat diukur secara kolorimetri (Tauber, 2008). Pirogalol dan H2O2
dengan bantuan peroksidase akan teroksidasi menjadi purpurogalin. Ekstrak purpurogalin diukur kadarnya dengan spektrofotometer UV-Vis pada λ 420 nm. Purpurogalin yang terbentuk sebanding dengan jumlah peroksidase yang dibutuhkan untuk mengoksidasi 1 mg pirogalol menjadi purpurogalin dalam waktu 20 detik pada pH dan suhu tertentu (Ikehata, et. al., 2003). Aktivitas peroksidase yang diperoleh adalah 1,734 U/mL
Penurunan Kadar Fenol oleh Peroksidase dan H2O2
Menurut Singh and Singh, (2002) fenol dengan adanya peroksidase dan H2O2 akan teroksidasi
radikal. Oksidasi selanjutnya menyebabkan dimer-dimer radikal bergabung satu sama lain membentuk polimer dan oligomer yang stabil dan kurang toksik. Produk yang terbentuk dapat dipisahkan dari larutan dengan mudah karena produk tersebut memiliki kelarutan yang kecil dalam air. Sisa fenol yang tidak bereaksi selanjutnya ditentukan kadarnya dengan metode spektrofotometri pada
λ 505 nm. Kerja peroksidase untuk menurunkan kadar fenol dipengaruhi oleh konsentrasi fenol, perbandingan fenol dengan H2O2, pH, jumlah enzim, suhu, dan waktu kontaknya.
Penentuan Konsentrasi Fenol Optimum
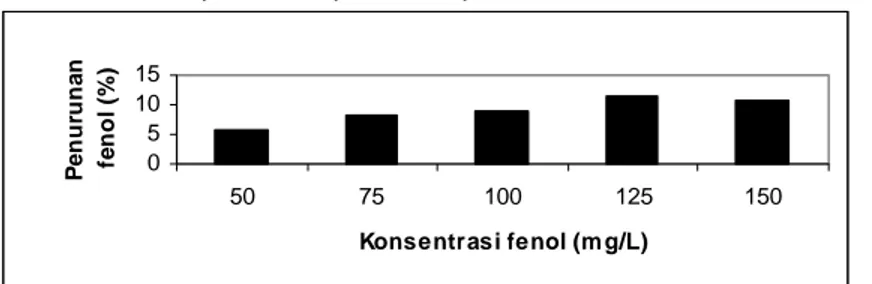
Hasil penurunan kadar fenol optimum dapat dilihat pada Gambar 1.
0 5 10 15 50 75 100 125 150 Konsentrasi fenol (m g/L) P e nur u n a n fe n o l (% )
Gambar 1: Penurunan kadar fenol oleh peroksidase pada konsentrasi fenol optimum
Gambar 1 menunjukkan pada konsentrasi substrat fenol 50 mg/L penurunan kadar fenol masih rendah yaitu sebesar 5,7599%. Hal ini disebabkan hanya sebagian dari enzim yang berikatan dengan substrat sehingga pada konsentrasi substrat masih kecil maka kecepatan reaksi enzim rendah. Konsentrasi substrat diperbesar, maka makin banyak substrat yang berhubungan dengan sisi aktif enzim sehingga kecepatan reaksi bertambah. Kecepatan reaksi bertambah sehingga penurunan kadar fenol juga semakin besar dan mencapai optimum pada konsentrasi fenol 125 mg/L yaitu sebesar 11,2617%. Pada konsentrasi tersebut semua enzim pada hakekatnya berikatan dengan substrat. Pada peningkatan konsentrasi diatas 125 mg/L tidak dapat lagi menghasilkan peningkatan kecepatan reaksi karena tidak tersedianya enzim bebas untuk bereaksi atau semua sisi aktif enzim telah jenuh oleh substrat.
Penentuan Perbandingan Fenol dengan H2O2
Hasil penurunan kadar fenol optimum dapat dilihat pada Gambar 2.
0 5 10 15 2:1 1:1 1:2 1:3 1:4 Perbandingan fenol : H2O2 P e n u ru na n fe n o l (% )
Gambar 2: Penurunan fenol oleh peroksidase pada perbandingan fenol dengan H2O2
Gambar 2 menunjukkan bahwa pada perbandingan fenol dengan H2O2, yaitu 2:1 dan 1: 1
penurunan kadar fenol masih rendah yaitu 9,088% dan 9,3139%. Konsentrasi H2O2 yang terlalu
rendah menyebabkan reaksi terjadi pada kondisi yang terbatas. Penurunan kadar fenol semakin bertambah dengan bertambahnya H2O2. Penurunan kadar fenol optimum terjadi pada perbandingan
fenol dengan H2O2 1: 3 yaitu 12,4641 %. Pada perbandingan H2O2 yang lebih tinggi lagi penurunan
kadar fenol semakin menurun karena H2O2 terlalu tinggi akan menyebabkan deaktivasi enzim
(Kennedy, et. al.,2002).
Penentuan pH Optimum
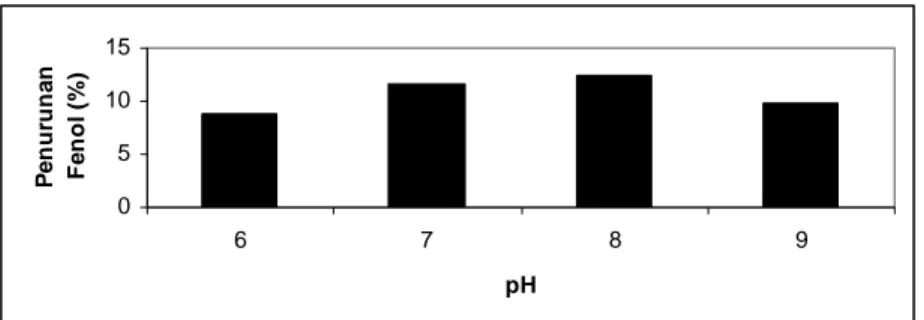
0 5 10 15 6 7 8 9 pH P e n u runa n Fe n o l ( % )
Gambar 3: Penurunan kadar fenol oleh peroksidase pada penentuan pH optimum
Gambar 3 menunjukkan pada pH 6 dan 7 penurunan kadar fenol masih rendah yaitu berturut-turut 8,7020 % dan 11,6904 %. Pada kondisi lingkungan yang asam atau di bawah pH optimum akan menyebabkan kelebihan ion H+ yang akan berikatan dengan sisi aktif enzim atau sisi lain enzim yang bermuatan negatif sehingga struktur enzim menjadi terbuka. Penurunan kadar fenol optimum terjadi pada 8 yaitu 12,4931%. Enzim bekerja pada kisaran pH tertentu, dimana pada pH optimum enzim memiliki struktur 3 dimensi yang tepat dan konformasi terbaik (keadaan ionisasi yang tepat pada sisi aktif enzim) sehingga enzim dapat mengikat dan mengolah substrat dengan efektif pada kecepatan optimum (Sadikin, 2002).
Penentuan Jumlah Enzim
Hasil penurunan kadar fenol pada variasi pH ditunjukkan pada Gambar 4.
16 17 18 19 20 21 22 2,5 : 7,5 5 : 5 7,5 : 2,5 10 : 0 V enzim : V buffer p e nu runa n fe no l (% )
Gambar 4: Penurunan kadar fenol oleh peroksidase pada jumlah enzim optimum.
Pada perbandingan jumlah enzim: bufer yaitu 2,5: 7,5 penurunan kadar fenol hanya 18,4299 %. Jumlah enzim yang semakin besar maka penurunan kadar fenol juga semakin besar yaitu pada perbandingan jumlah enzim: bufer yaitu 5: 5 dan 7,5: 2,5 terjadi penurunan kadar fenol berturut-turut sebesar yaitu 19,1747% dan 21,3957 %. Pada perbandingan jumlah enzim: buffer yaitu 10: 0 terjadi penurunan kadar fenol yaitu sebesar 19,9553%. Hal ini berarti keberadaan buffer sebagai larutan penyangga peranannya cukup besar untuk mempertahankan struktur enzim yang lebih stabil, sehingga mempengaruhi keefektifan kerja enzim.
Penentuan Suhu Optimum
Hasil penurunan kadar fenol pada variasi suhu dapat dilihat pada Gambar 5.
0 5 10 15 20 25 15 20 25 30 35 Suhu (0C) P e nur u n a n f e nol %
Gambar 5: Penurunan kadar fenol oleh peroksidase pada suhu optimum
Gambar 5 menunjukkan pada suhu 150C dan 200C penurunan kadar fenol masih rendah yaitu 13,5878% dan 18,6831% berturut-turut. Hal ini disebabkan suhu yang sangat rendah dapat menyebabkan terhentinya kerja enzim walaupun tidak merusak enzim, dimana enzim dan substrat memiliki energi kinetik yang kecil untuk melakukan benturan membentuk kompleks enzim-substrat sehingga produk yang terbentuk juga sedikit. Suhu bila dinaikkan perlahan-lahan, benturan enzim dan substrat membentuk kompleks enzim-substrat semakin besar sehingga terbentuk produk yang semakin banyak. Keadaan ini berlangsung hingga dicapainya suhu optimum enzim, yaitu suhu yang memberikan aktivitas optimum bagi kerja enzim. Suhu optimum enzim peroksidase dari kulit batang ubi kayu dalam menurunkan kadar fenol terjadi pada suhu 250C, yaitu sebesar 21,2945%. Suhu bila ditingkatkan lagi melebihi suhu optimum, maka enzim terdenaturasi sehingga jumlah enzim yang aktif menghasilkan produk berkurang (Fruton and Simmonds, 1963). Pernyataan ini terbukti pada suhu 300C dan 350C penurunan kadar fenol hanya 19,3305% dan 18,8209%. Penggunaan enzim peroksidase dari kulit batang ubi kayu untuk menurunkan kadar fenol lebih menguntungkan karena dapat dilakukan pada suhu 25oC (suhu kamar).
Penentuan Waktu Kontak Optimum
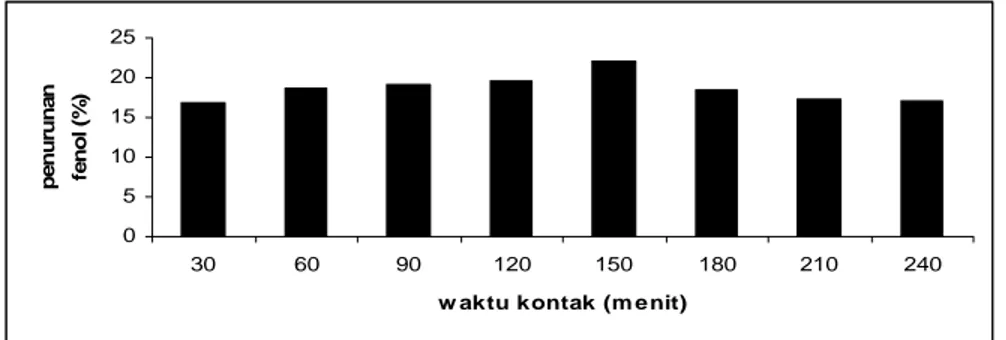
Hasil penurunan kadar fenol pada variasi waktu kontak ada pada Gambar 6. Peroksidase dari kulit batang ubi kayu pada menit ke-30 menurunkan kadar fenol masih sedikit, yaitu 16,9181 %. Penurunan kadar fenol semakin meningkat dengan bertambahnya waktu kontak dan mencapai optimum pada menit ke-150 yaitu mencapai 21,9379%. Penurunan kadar fenol setelah menit ke-150 menurun, hal ini karena endapan yang terbentuk semakin lama dapat menjerat enzim sehingga enzimnya inaktif (Kennedy, et. al., 2002).
0 5 10 15 20 25 30 60 90 120 150 180 210 240
w aktu kontak (m e nit)
pe nur u n a n fe nol ( % )
Gambar 6. Penurunan kadar fenol oleh peroksidase pada waktu kontak optimum
Penurunkan kadar fenol oleh enzim peroksidase dari kulit batang ubi kayu hanya sedikit. Hal ini disebabkan enzim peroksidase yang digunakan masih berupa ekstrak kasar atau belum murni. Penurunan kadar fenol dengan enzim peroksidase dari kulit batang ubi kayu memiliki banyak keuntungan, yaitu kulit batang ubi kayu merupakan limbah, selama ini pemanfaatannya belum ada sehingga hal ini dapat meningkatkan nilai ekonomis dari kulit batang ubi kayu.
Aplikasi cara ini juga lebih mudah dan murah dibanding dengan metode lain yaitu menggunakan mikroba atau karbon aktif. Peroksidase yang diperoleh dengan cara menghaluskan kulit batang ubi kayu dicampur dengan hidrogen peroksida kemudian campuran tersebut langsung dimasukkan dalam kolam penjernih limbah. Perlakukan tersebut langsung dapat mengendapkan senyawa racun seperti fenol.
KESIMPULAN
Ekstrak kasar enzim peroksidase yang diperoleh dari kulit batang ubi kayu cukup efektif dengan nilai aktivitasnya 1,734 U/mL. Ekstrak kasar enzim peroksidase dari kulit batang ubi kayu dapat menurunkan kadar fenol pada kondisi optimum yaitu pada konsentrasi fenol 125 mg/L; perbandingan fenol dengan H2O2 = 1: 3; pH 8, perbandingan jumlah enzim: buffer = 7,5: 2,5; suhu 25
o
C, dan waktu kontak 150 menit adalah sebesar 21,9379%.
Saran
Perlu dilakukan pemurnian terhadap ekstrak kasar enzim peroksidase dari kulit batang ubi kayu sehingga dapat meningkat kemampuannya dalam menurunkan kadar fenol.