10 Kompleksasi dan Pengikatan Protein Tujuan Bab
Pada akhir bab ini siswa harus dapat:
1. Tentukan tiga klausa komplex (senyawa koor dinasiasi) dan kenali plasenta farmasi secara farmatif.
2. Jelaskan khelasi, tariskan sifat fisik, dan apa yang membedakannya dari omplex molekul organik.
3. Deskripsikan e jenis gaya yang saling menempel pada kompleks molekul organik dan berikan contoh.
4. Describ e kekuatan yang terlibat dalam kompleks obat p olymer yang digunakan untuk pengiriman obat dan situasi di mana kompleks reversibel atau ireversibel mungkin menguntungkan.
5. Bahas penggunaan dan berikan contoh-contoh dextrin cyclo dalam aplikasinya. 6. Tentukan rasio stoiciometrik dan konstanta stabilitas untuk pembentukan kompleks. 7. Desak analisis metrik analisis kompleks dan kekuatannya.
8. Diskusikan cara-cara agar protein bi nding dapat mempengaruhi tindakan obat.
9. Jelaskan metode dialisis ekuilibrium dan ultrafilt untuk menentukan protein mengikat. 10. Pahami fakta atau yang mempengaruhi kompleksasi dan pengikatan protein.
11. Pahami dasar termodinamika untuk kestabilan kompleks.
Kompleks atau senyawa koordinasi, sesuai dengan definisi klasik, dihasilkan dari mekanisme donor-akseptor atau reaksi asam basa Lewis antara dua atau lebih kandungan konsentrat basa yang berbeda. Setiap atom atau ion non logam, apakah bebas atau terkandung dalam molekul netral atau dalam senyawa ionik, yang dapat menyumbangkan pasangan elektron dapat berfungsi sebagai donor. The cceptor, atau penyusun yang menerima sha re di udara elektro ns, seringkali merupakan logam, meskipun bisa jadi atom netral. Kompleks dapat dibagi secara luas dalam dua kelas tergantung pada apakah coponent akseptor adalah ion eter atau molekul organik; ini
Intermolekuler untuk ces yang terlibat dalam pembentukan kompleks adalah gaya van der Waals dari dispersi, dipolar, dan tipe dipolar induksi. Ikatan hidrogen memberikan kekuatan yang signifikan dalam kompleks molekul s, dan kovalensi o kordinat lebih baik terjadi pada kompleks logam. Mengisi transf er dan interaksi hidrofobik diperkenalkan kemudian di bab ini.
Kompleks Logam
Pemahaman yang memuaskan tentang kompleksitas ion logam didasarkan pada keakraban dengan struktur atom dan molekul untuk ces, dan pembaca akan melakukannya dengan baik untuk mengkomunikasikan teks pada kimia organik dan organik untuk mempelajari bagian-bagian yang berhubungan dengan struktur elektronik dan hibridisasi sebelum melanjutkan Kompleks anorganik
Molekul amonia dalam klorida heksamminekobalt (III), sebagai komplemen [Co (NH3) 6] 3+ Cl3- disebut, dikenal sebagai ligan dan dikatakan dikoordinasikan dengan ion kobalt. Jumlah koordinasi ion obalt c, atau jumlah kelompok amonia yang terkoordinasi o ion logam, adalah enam. Komplek er kompleks yang termasuk dalam i grou p organik termasuk [Ag (NH3) 2] +, [Fe (C N) 6] 4-, dan [Cr (H2O) 6] 3+.Setiap ligan menyumbangkan sepasang elektron untuk membentuk ikatan kovalen koordinat antara elf dan ion pusat yang memiliki cangkang elektron yang tidak lengkap. Sebagai contoh
Hybidisasi memainkan peran penting dalam senyawa inisation koord di mana orbital ikatan yang cukup tidak biasa tersedia dalam ion logam. Posisi berdiri pembaca hibridisasi akan disegarkan dengan tinjauan singkat tentang argumen yang didukung untuk quadrivalensi karbon. Akan diingat bahwa konfigurasi karbon dasar tanah
Ini tidak bisa jadi konfigurasi ikatan karbon, namun karena saya biasanya memiliki empat bukan dua elektron valensi Pauling 1 menyarankan kemungkinan hibridisasi terhadap akun f atau qua saingan. Menurut proses pencampuran, salah satu dari 2s elektron dipromosikan
Tabel 10-1 Classificatio n dari exe Compl *
B. Chelates C. Tipe olefin
D. Tipe matematis Aro 1. Pi (π) co mplexes 2. Sigma (σ) kompleks
Tabel 10-1 Classificatio n dari exe Compl * I. Kompleks ion logam
A. Tipe anorganik B. Chelates C. Tipe olefin
D. Tipe matematis Aro 1. Pi (π) co mplexes 2. Sigma (σ) kompleks 3. Senyawa "Sandw ich" II. Peka molekul organik A. tipe hidrone Quin B. Tipe asam Picric
C. Kafein dan kompleks obatnya D. Tipe polimer
Inklusi / senyawa kesimpulan A. Cha kisi kisi jenis
B. Tipe lapisan C. Clathrates
Klasifikasi ini tidak berhenti pada juru tulis mekanisme atau jenis ikatan kimia yang terlibat dalam kompleksasi. Hal ini dimaksudkan hanya untuk memisahkan keluar dari jenis yang aneh dari exes compl yang dibahas di liter ature. Klasifikasi electr yang sangat searah terhadap reseptor int ereksi donor diberikan oleh R. S. Mulliken, J. P hys. Chem. 56, 801, 1952 Ini diarahkan ke sudut tetrahedron, dan strukturnya dikenal sebagai hibrida sp3 karena
melibatkan orbital satu s dan tiga p. Dalam ikatan rangkap, atom bon mobil digolongkan ke b e sp2 hibridisasi, dan obligasi kembali diarahkan untuk menangkal penggores segitiga.
Orbital selain orbital 2s dan 2p dapat terlibat dalam hibridisasi. Elemen transisi, seperti besi, tembaga, nikel, co balt, dan seng, nampaknya menggunakan orbital 3d, 4s, dan 4p dalam membentuk hibrida. Hibrida ini menjelaskan geometri yang berbeda yang ditemukan untuk kompleks ion logam transisi. Tabel 10 - 2 menunjukkan beberapa senyawa di mana atom nitral atau ion logam disebarluaskan secara berbeda dan gometri yang dihasilkan.
Ligan itu sebagai H2Ö H3, C -, atau l - menyumbangkan sepasang lectrons dalam membentuk logam kompleks, dan elektron pa r masuk pada orbita yang tidak terisi pada ion logam.
Penggunaan yang tidak diharapkan untuk diikuti dalam memperkirakan jenis hibridisasi dalam campuran ion adalah untuk memilih omplex c di mana ion etal memiliki lekukan 3d yang terisi atau yang dapat menggunakan energi rendah 3d dan 4s
orbital primitif dalam hibridisasi pada. Untuk seperti, g konfigurasi ulang bilangan bulat dari Ni2 + ca n diberikan sebagai
di mana elektron yang disumbangkan oleh ligan ditunjukkan sebagai titik-titik. Struktur dsp 2 atau planar persegi diperkirakan menjadi kompleks med karena menggunakan orbital 3-energi yang lebih rendah. Dengan persiapan dan studi tentang sejumlah kompleks, Werner
menyimpulkan banyak masa lalu bahwa ini memang struktur kompleksnya.
Demikian pula, ion kobalt trivalen, Co (III), memiliki konfigurasi elektronik dari dasar yang paling bawah
dan seseorang mungkin menyelidiki kemungkinan geometri dari com plex [Co (NH3) 6] 3+. Konfigurasi elek tronic ion logam yang menyebabkan tingkat 3d terisi adalah
pembentukan kompleks (Cu (NH3) 4] 2+ memerlukan gerakan pro elektron deng Cu2 + ke tingkat 4p untuk memenuhi konfigurasi 3d yang terisi pada logam kompleks io n, dan struktur dsp atau planar. Diperoleh
Meskipun energi yang dibutuhkan untuk meningkatkan elektron d ke tingkat 4p adalah hal yang dapat dipertimbangkan, pembentukan kompleks planar Setelah ls 3d diisi sepenuhnya lebih dari "membayar" untuk energi yang dikeluarkan.
Ion logam Fe (III) memiliki konfigurasi pada tahap awal
dan dalam pembentukan kompleks [Fe CN) 6] 3-, tidak ada promosi elektron yang berlangsung Karena tidak ada stabilisasi yang didapat di atas bahwa konfigurasi d2sp3 sudah memiliki esensi.
Bilah jenis ini, di mana ligan berbohong "di atas" orbital yang terisi sebagian, disebut di luar kompleks sini; Ketika ligan-ligan terletak "di bawah" orbital yang terisi sebagian, seperti pada contoh sebelumnya, senyawa ini disebut aninner-sp di sini kompleks. Presentasi elektron tidak berpasangan dalam kompleks ion logam dapat dideteksi dengan spektroskopi resonansi putaran electron
Chelate
Chelat menempatkan persyaratan sting tringent pada logam dan ligan. Ion seperti Cu (II) dan N i (II), yang membentuk kompleks planar squar, dan Fe (III) dan Co (III), yang membentuk
octahedral c omplexes, ada dalam salah satu dari orton geometrik. Seiring pertambahan isomer ini, hanya ligan digan berlapis cigan yang berada pada molekul - akan mudah dipasang oleh agen dengan agen pengkelat
seng, bisa menjalani khelasi, menunjukkan bahwa logam terikat sedemikian rupa sehingga meninggalkan dua posisi cis yang tersedia untuk chelat
yang mudah larut. Etil enediaminetet asam raasetat banyak digunakan untuk menyerap dan menghilangkan ion kalsium dari air keras.
Konsep kunci
Chelates
Suatu zat yang menampung dua atau lebih kelompok donor dapat digabungkan dengan logam untuk membentuk tipe kompleks khusus yang dikenal sebagai chelate (Gre ek: "kelos, law"). Beberapa ikatan dalam gugus mungkin bersifat ionik atau prima y kovalen t ype, sedangkan yang lainnya adalah koordinat c ovalen link s. Pada ligan, berikan pada kelompok untuk menempel pada ion pusat, akhir-akhir ini
panggilan ed monodentate Pinus pilocar berperilaku sebagai daerah monodentat d menuju C o (II), Ni (II), dan
Zn (II) membentuk chelate dari geometri psudotetrahed ral.7
Atom donor dari ligan adalah nitrogen tipe piridin dari cincin imidazol pilocarpine. Molekul dengan dua dan tiga kelompok donor disebut bidentatend tridentate, masing-masing ly. Eth lenediamin tetraacetic acid memiliki enam poin untuk keterikatan pada ion logam dan dia sesuai dentate; Namun, dalam beberapa kompleks, hanya empat atau lima kelompok yang
dikoordinasikan. Chelat dapat diterapkan pada uji obat. Metode kalorimetrik untuk pengujian procainamide dalam larutan injeksi didasarkan pada pembentukan komplek prokainamid 1: 1 dengan ion cuprik pada h 4 sampai 4,5. Kompleks ini menyerap radiasi yang tampak pada panjang gelombang maksimum dari 380 nm.4 Banyak penggunaan kompleks logam dan zat pengkelat yang dapat diletakkan dibahas oleh Martell dan Calvin.5
Kompleks Molekul Organik
Senyawa koordinasi organik atau kompleks molekul terdiri dari biaya yang disatukan oleh forc lemah dari jenis akseptor donor atau oleh ikatan hydrogen. Perbedaannya adalah kompleksitas dan pembentukan senyawa organik telah ditunjukkan oleh Clap p.6 Senyawa dimsterlanilin dan 2,4,6-trinitroanisol bereaksi terhadap dingin untuk menghasilkan kompleks molekul:
Garis putus-putus pada persamaan f kompleks (1 0-1) menunjukkan bahwa kedua olecules disatukan oleh suatu kekuatan valensi sekunder. Hal ini tidak boleh dianggap sebagai ikatan yang didefinisikan dengan jelas daripada daya tarik keseluruhan antara dua molekul aromatik.Jenis ikatan yang ada di kompleks molekuler dimana ikatan hidrogen tidak ada bagian yang tidak sepenuhnya dipahami
tetapi mungkin dipertimbangkan untuk saat ini karena melibatkan mekanisme akseptor donor elektron yang sesuai dengan yang ada di kompleks logam namun biasanya jauh lebih lemah. Banyak plexer com organik sangat lemah sehingga tidak dapat dipisahkan dari solusi mereka sebagai senyawa yang pasti, dan seringkali sulit dikenali dengan cara kimiawi dan fisik. Energi tarik antara substrat ini mungkin kurang dari 5 kcal / mol untuk kebanyakan kompleks organik. Karena jarak ikatan antara komponen kompleks lebih tinggi dari 3 Å, maka hubungan kovalen tidak dilibatkan. Sebagai gantinya, satu molekul polariz di sisi lain, menghasilkan sejenis interaksi ionik atau transfer muatan, dan kompleks mol ecular ini sering disebut sebagai kompleks transfer muatan. Sebagai contoh, kelompok nitro p dari enzim trinitrob menginduksi dipol dalam molekul benzen yang mudah polarizabel, dan interelasi elektrostatik yang
menyebabkan pembentukan kompleks.
X-ray difraksi udies dari komplex com yang terbentuk antara turunan trinitrobenzena dan anilin telah terjadi dimana salah satu kelompok nitro trinitrobenzena terletak di atas cincin benzena molekul anilin, jarak antar antarmolekul antara dua molekul sekitar 3,3 Å. Hasil ini sangat menunjukkan bahwa interaksi antara ikatan π antara elektron rons cincin benzena dan elektron yang menerima gugus nitro.
Faktor yang penting dalam pembentukan kompleks molekuler adalah kebutuhan sterik. Jika pendekatan dan asosiasi cloe tentang molekul donor dan akseptor terhambat oleh faktor sterik, kompleksnya tidak akan terbentuk. Ikatan Hyrogen dan efek lainnya harus dipertimbangkan, dan ini dibahas sehubungan dengan kompleks spesifik yang dipertimbangkan pada halaman berikut. Resonansi di kompleks penerima donor obituin trinit (akseptor, t p) dan hexamethy lbenzene (onor, botto m). (Dari F. Y. Bullock, di M. Florkin dan E. H. totz (Eds.), Biokimia Komprehensif, Elsevier, New York, 1967, hlm.
Dengan izin.)
Perbedaannya adalah jika akseptor donor dan muatannya berbeda, maka pada tipe yang terakhir, resonansi membuat kontribusi utama pada kompleksasi, seperti pada dispersi London
Di sisi kiri gambar, dispersi lemah dan dipolar berkontribusi terhadap interaksi A dan D; di sisi kanan gambar, kalimat Hasil dari transisi sig ificant trans charge, aking akseptor elit ctron trinitrobenzene negativel
dibebankan (A-) dan meninggalkan donor, hexamet hylbenzene, dengan muatan positif (D +). Keseluruhan kompleks ptoro donor ditunjukkan oleh tanda panah ganda-dia menyarankan agar beresonansi dengan D yang tidak disengaja ... A dan yang disalahgunakan D + ... A-moieties. Jika, seperti pada hexamethylbenzene-trinitrobenzen e, resona ce adalah
Cukup lemah, memiliki energi pengikat intermolekul ΔG sekitar -4700 kalori, kompleks ini disebut kompleks adonor-acc eptor. Jika, pada tangan yang lain, reso nance antara struktur transfer muatan (D + A-) dan spesies tidak bermuwa (D ... A) berkontribusi secara reatly terhadap pengikatan donor dan molekul peptce acce, komplek ini disebut ch arge transfer complex. Akhirnya, morfeks yang terikat bersama oleh van d er Waals forc s, interaksi dipol-dipol, dan ikatan hidro en tapi kurang sfer trannya diketahui hanya sebagai leksion molekul. Dalam kedua transfer muatan dan kompleks akseptor donor, larangan penyerapan baru ds terjadi dalam spektrum e, seperti yang ditunjukkan pada Gambar 10-1 3. Dalam buku ini, kami tidak mencoba memisahkan dua kelas pertama, namun mengacu pada semua interaksi yang
menghasilkan
pita abso rption sebagai transfer muatan atau sebagai kompleks akseptor donor ele ctron tanpa perbedaan. Kompleks selang yang tidak menunjukkan band baru adalah kompleks molekul alled. Mengisi transfer kompleks sangat penting di apotek. Yodium membentuk 1: 1 transfer muatan yang sesuai dengan obat-obatan yang digunakan ulfiram, chlomethiazole, d tolnaftate. Obat ini telah mengenali aktivasi farmakologis ow n mereka
Disulfiram digunakan untuk melawan kecanduan alkohol, clomethiazole adalah obat penenang - tiroid dan antikonvulsan, dan tolnaftate adalah agen antijamur. Masing-masing obat ini
mengandung moi etil nitrogen-karbon-belerang (lihat struktur tolnaftate yang menyertainya), dan lex com dapat dihasilkan dari transfer muatan dari sepasang elektron fr pada atom nitrogen dan / atau sulfur dari se obat ke orbital anti ikatan dari atom yodium. Jadi dengan mengikatkan diri saya, molekul yang mengandung N-C == S memberantas aksi thyr id di tubuh kanan.9
Kompleks obat
dengan gaya dipol-dipol atau ikatan hidrogen antara gugus karbonil polarisasi dari kafein dan atom hidrogen asam. Interaksi sekunder mungkin terjadi antara bagian molekul nonpolar, dan kompleks yang dihasilkan adalah "diperas keluar" dari fase berair karena tekanan internal air yang besar. Kedua efek ini menghasilkan tingkat interaksi yang tinggi.
Kompleksasi ester sangat memprihatinkan apoteker karena banyak obat penting termasuk golongan ini. Kompleks yang terbentuk antara ester dan amina, fenol, eter, dan keton telah dikaitkan dengan ikatan hidrogen antara oksigen karbonil nukleofilik dan hidrogen aktif. Ini, bagaimanapun, tidak menjelaskan kompleksasi ester seperti benzokain, procaine, dan tetrakain dengan kafein, seperti yang dilaporkan oleh Higuchi dkk.11 Tidak ada hidrogen aktif pada kafein; hidrogen pada posisi nomor 8 (rumus I) sangat lemah (Ka = 1 × 10-14) dan tidak mungkin masuk ke dalam kompleksasi. Mungkin disarankan bahwa, di dalam molekul kafein, ada pusat yang relatif positif yang berfungsi sebagai tempat kompleksitas yang mungkin terjadi. Molekul kafein diberi nomor dalam formula I untuk kenyamanan dalam diskusi. Seperti yang diamati dalam formula II, nitrogen pada posisi 2 mungkin bisa menjadi sangat elektrofilik atau asam seperti pada imida, karena penarikan elektron oleh okso pada posisi 1 dan 3. Suatu ester seperti benzokain juga menjadi polarisasi. (formula III) sedemikian rupa sehingga oksigen karboksil bersifat nukleofilik atau dasar. Kompleksasinya dapat terjadi sebagai akibat interaksi dipol-dipol antara oksigen karboksil nukleofilik benzokain dan nitrogen elektrofilik dari kafein. Kafein membentuk kompleks dengan asam organik yang lebih larut dari pada xanthine murni, dan kompleksnya dengan asam organik, seperti gentisic aci d, kurang larut daripada kafein saja. Kompleks yang tidak larut semacam itu menyediakan kafein untuk kulit yang menutupi rasa pahitnya dan harus berfungsi sebagai keadaan yang cocok untuk tablet kunyah. Higuchi dan Pitman12 mensintesis 1: 1 dan 1: 2 kompleks asam kafein-gentisi dan mengukur kelarutan ekuilibrium dan tingkat pembubarannya. Baik kompleks 1: 1 dan 1: 2 kurang larut dalam air daripada kafein, dan tingkat disolusi juga kurang dari ha kafein. Tablet kunyah yang
diformulasikan dari kompleks ini harus memberikan bentuk obat yang diakhiri dengan meningkatkan aste.York dan Saleh13 mempelajari efek sodiu m salisilat pada pelepasan benzokain dari klausa veix topikal, yang dikenalkan pada salisilat f orm kompleks molekul dengan benzokain. Kompleksasi antara obat dan obat pengompleks dapat meningkatkan atau meningkatkan absorpsi dan ketersediaan hayati; penulis menemukan bahwa natrium sa licylate secara signifikan mempengaruhi pelepasan benzokain, mengurangi jenis kendaraan yang terlibat. Peningkatan penyerapan terbesar diamati pada basis polietilena glikol yang dapat larut dalam air. Tabel 10-3 Beberapa Kompleks Organik Molekuler untuk Minat Farmasi
Kompleks Polimer
polieter tertentu, seperti Carbowaxes, Pluronics, dan Tweens dengan asam tanat, asam salisilat, dan fenol, dapat dikaitkan dengan interaksi ini. Marcus14 mengulas beberapa interaksi yang mungkin terjadi pada suspensi, emulsi, salep, dan supositoria. Ketidakcocokan dapat
dimanifestasikan sebagai endapan, flokulasi, penyerapan biologis tertunda, hilangnya tindakan pengawet, atau efek fisik, kimia, dan farmakologis lainnya yang tidak diinginkan.
Plaizier-Vercammen dan De Nève15 mempelajari interaksi povidone (PVP) dengan senyawa aromatik ionik dan netral. Beberapa faktor mempengaruhi pengikatan terhadap PVT asam benzoat tersubstitusi dan turunan nikotin. Meskipun kekuatan ion tidak berpengaruh, peningkatan pengikatan pada larutan buffer fosfat meningkat dan suhu meningkat
Crosspovidone, PVP yang tidak terkait silang, mampu mengikat obat-obatan karena karakter dipolar dan struktur berpori. Frömming dkk.16 mempelajari interaksi crosspovidone dengan acetaminophen, benzocaine, benzoic acid, kafein, asam tanat, dan papaverine hydrochloride, di antara obat-obatan lainnya. Interaksi ini terutama disebabkan oleh kelompok fenolik apapun pada obat tersebut. Hexylresorcinol menunjukkan ikatan yang sangat kuat, namun interaksinya kurang dari 5% untuk kebanyakan obat yang diteliti (32 obat). Crosspovidone adalah disintesa dalam butiran dan tablet farmasi. Ini tidak mengganggu penyerapan gastrointestinal karena pengikatan obat bersifat reversibel.
Larutan dalam formulasi parenteral dapat bermigrasi dari larutan dan berinteraksi dengan dinding wadah polimer. Hayward dkk.17 menunjukkan bahwa kemampuan wadah poliolefin untuk berinteraksi dengan obat-obatan bergantung secara linear pada koefisien partisi oktanol air obat. Untuk paraben dan obat-obatan yang menunjukkan sifat donor ikatan hidrogen cukup signifikan, istilah koreksi yang terkait dengan pembentukan ikatan hidrogen diperlukan. Interaksi wadah polimer-polimer dapat menyebabkan hilangnya komponen aktif dalam bentuk sediaan cair.
Kompleks obat polimer digunakan untuk memodifikasi parameter biofarmasi obat; tingkat disolusi ajmaline ditingkatkan dengan kompleksasi dengan PVT. Interaksi ini disebabkan oleh cincin aromatik ajmina dan kelompok amida PVP untuk menghasilkan kompleks dipol-dipol-dipol.18
Beberapa kompleks organik molekul yang menarik bagi apoteker diberikan pada Tabel 10-3. (Kompleks yang melibatkan kafein tercantum dalam Tabel 10-6).
Senyawa inklusi
terjebak dalam kisi terbuka atau struktur kristal mirip cagelike yang lain untuk menghasilkan susunan yang stabil.
Jenis Kisi Saluran
Asam khlor (asam empedu) dapat membentuk sekelompok kompleks yang pada dasarnya melibatkan asam deoksikolat dalam kombinasi dengan parafin, asam organik, ester, keton, dan senyawa aromatik dan dengan pelarut seperti eter, alkohol, dan dioksan. Kristal asam deoksikolat disusun untuk membentuk saluran dimana molekul kompleks bisa muat (Gambar 10-3).
Gambar 10-3. (a) kompleks saluran untuk med dengan molekul urea sebagai h ost. (b) ini molekul dikemas dengan cara tertib dan teratur dengan ikatan gen hydrogen antara nitrogen dan oksigen atom. Saluran heksag nal, kira-kira 5 Å masuk dia meter, prov de room untuk molekul tamu seperti arbon hidrokarbon rantai panjang, seperti shown di sini (Dari J. F. Brown, Jr., S) Am. 20 7, 82, 1962 Hak Cipta © 1962 olehScintific American, Inc. Semua hak dilayani.) (C) Kompleks saluran heksagonal (ad duct) metil α-lipoat dan 15 g urea dalam metanol p epared dengan lembut. Kristal yang dibutuhkan untuk aduk terpisah pada suhu kamar senyawa inklusi atau adduct mulai terurai pada suhu 63 ° C dan meleleh pada suhu 163 ° C. Thi ourea juga bisa digunakan untuk membentuk kompleks saluran. (Dari H. Min a dan M.Nis hikawa, J. harm. Sci. 53, 931, 19 64. Dengan izin.) (D) ekstrem Cyclod(cy loamylose Schardinger dextrin). (Lihat Indeks Merc k, Ed ke 11, Mer ck, Rahway, N.J, 1989, hal.4 25.)
Urea dan tiourea juga mengkristal dalam struktur el-like yang memungkinkan kandang u bercabang.
parafin, alkohol, keton, org asam anat, dan nd lain, seperti yang ditunjukkan pada Gambar 10-3a dan b. Solusi pati-iodin yang terkenal adalah komplemen el tipe trans yang terdiri dari sosis mol yodium yang masuk dalam spiral residu glukosa.
Jenis lapisan
Senyawa e, seperti tanah liat montmor illonite, konstipula incipal pr dari bentonit, dapat
menjebak hidrokarbon, alkohol, dan gly cols di antara lapisan kisi-kisi mereka. Grafit juga dapat mencampur senyawa akhir antara lapisannya.
Clathrates2 1
Klatrat mengkristal dalam bentuk kisi-kisi yang mirip cegelike dimana koordinat co mpound diserap. Ikatan kimia tidak dilibatkan dalam hubungan lexes ini, dan pada tingkat molekul dari enca ged compon ent sangat penting. Ketelaar22 mengamati d analogi antara stabilitas tingkat clath dan kurungan tahanan. Kestabilan sebuah klatatanya disebabkan oleh kekuatan struktur, yaitu, pada enema tinggi yang harus dibuang ke dekomposisi, seperti halnya priso ner dibatasi oleh jeruji yang mencegah pelarian.
Powell dan Palin23 membuat studi terperinci tentang kadar lemak klatim dan menunjukkan bahwa usia yang sangat beracun t hydroquino ne (quinol) menangis terhambat dalam struktur ikatan hidrat yang mirip cagelike, seperti yang terlihat pada Gambar
10-4. Lubang memiliki diameter o 4,2 Å dan pe rmit jebakan satu molekul kecil ke sekitar setiap dua molekul kuinol. Molekul kecil seperti metil alkil, CO2, HCl dapat terjebak dalam sangkar, tapi molekul smalle r seperti H2 dan molekul yang lebih besar seperti etanol tidak dapat
Struktur Cagelike terbentuk melalui ikatan hidrogen molekul hydroquinone. Es molekul kecil seperti metanol terjebak dalam kandang untuk membentuk klatrat. (Mod ified dari J. F. Brown, Jr., Sci. A m. 207, 82, 1962. Cop yright © 1 962 oleh Scientific American, In c. All rights reserve Satu obat resmi, warfarin sodiu m, United Sta tes Pharmacopeia, adalah klatrat wate r, isopropil alco hol, dan sodiu m warfarin dalam bentuk bubuk kristal putih.
Monomoleular Incusion Compoun ds: Cycldextrins
Inklusi juga disatukan oleh Frank.24a Sebagai tambahan pada senyawa saluran dan kerucut (klatrat), Fran k menambahkan kelas-kelas senyawa monokromat mikroskopik n s. Inklusi monomolekuler terlibat dalam jebakan molekul gu est tunggal di rongga satu host.
mole cule Struktur host monomolekuler diwakili oleh ekstrem siklod (CD). Senyawa ini adalah chiller oligosak siklik yang membentuk ibu mungil dari enam unit D - (+) - glukopiranosa yang digantikan oleh α-1,4 linka g yang dihasilkan oleh tindakan pada pati ransamilase Bacillus mace. Α-, β-, dan γ-cycl odextrins (α-CD, β-CD, dan γ-CD, masing-masing) terdiri dari enam, tujuh, dan delapan unit glukosa.
pada Gambar 10-5a; Ini dapat mengakomodasi molekul-molekul seperti mitomisin C untuk membentuk senyawa inklusi (Gambar 10-5b). Interi atau kavitas relatif bersifat hidrofobik karena kelompok CH2, sedangkan lubang kavitasi memasuki hidrofilik kembali karena adanya gugus hidroksil primer dan sekunder.25,26α-CD memiliki rongga terkecil (diameter internal hampir 5 Å). β-CD dan γ-CD adalah yang paling berguna untuk teknologi ceutical farmasi karena ukurannya lebih besar dari rongga (internal diamete r hampir 6 Å dan 8 Å, secara spektroskopi). Pada rongga di dalam rongga cenderung menempel keluar dan digantikan oleh spesies yang lebih hidrofobik. Dengan demikian, molekul ukuran ropriate app dan stereoch mistry dapat dimasukkan ke dalam rongga odpttrin siklik oleh tindakan antar hidrofobik. Comp lexation biasanya tidak melibatkan ikatan co valent. Obat som mungkin terlalu besar untuk dikonsumsi sama sekali di rongga. Seperti ditunjukkan pada Gambar 10-5b, mitomycin C berinteraksi dengan γ-CD di satu sisi torus. Dengan demikian, ring azirid ine
Konsep kunci Siklodekstrin
Menurut Davis dan Bre ster, 24b "Clodextrin Cy adalah oligomer siklik dari glu cose yang membentuk kompleks inklusi sol-air dengan molekul kecil dan sebagian besar. senyawa. Wahana oligosaklik non-kompatibel ini tidak menimbulkan respons imun dan memiliki tingkat kesamaan pada hewan dan manusia. Cyclodextrins digunakan dalam aplikasi farmasi untuk banyak hal, termasuk meningkatkan ketersediaan bioa obat. Dari kepentingan khusus adalah penggunaan polimer penghasil siklodekstrin untuk memberikan kemampuan yang tidak sesuai untuk pengiriman nukleat ac ds. "Davis dan Brewster 24b membahas tentang siklodekstrin terapi merupakan aplikasi masa depan yang mungkin, dan tinjau kembali penggunaan cyclodextrin-containing polimer dalam pemberian obat
Gambar 10-5. (a) epresentation of cyclo dextrin sebagai kerucut terpotong. (b) M itomisin sebagian tertutup siklodekstrin untuk kompleks inklusi. (Dari O. Beckers, Int J. Pharm 52, 240, 247, 1989. Dengan p ermission.
dari mitomycin C dilindungi dari degradasi dalam larutan asam.27Bakensfield dkk.28
mempelajari inklusi indometasin dengan β -CD menggunakan teknologi iH 1H-NMR. Bagian p-chlorobenzoyl dari indometasin (bagian sh ded dari Gambar 10-6) mengandung rekombinasi β-CD, sedangkan indole moiet yang tersubstitusi (ada gen utama dari molekul) terlalu besar untuk inc lusion dan bersandar pada pintu masuk rongga CD.
asam retinoat berair (0,5 mg / liter), dru g menggunakan topica lly di treasuran jerawat, 30 meningkat menjadi 160 mg / liter oleh c omplexation w ith β-CD. Tingkat disolusi memainkan peran penting dalam ketersediaan hayati obat-obatan, pelarutan cepat biasanya menguntungkan penyerapan. Dengan demikian, tingkat penggunaan obat bius, 31 obat kuat dalam pengobatan lambung dan duoden al ulcer, dan tolbutamida, obat antidiabetes oral, diperkuat oleh
kompleksasi dengan β-siklodekstrin.32
Cyclodextrins ma meningkatkan atau menurunkan reaktivitas ulat ulin tamu tergantung pada sifat reaksi dan orientasi molekul dalam rongga CD. Th kita, α-siklodekstrin cenderung disukai
pH dependen drolysis dari indometasin dalam ion solu berair, sedangkan β-cyclodextri n menghambat
itu.28 Sayangnya, air sehingga kelarutan β-CD (1,8 g / 100 mL pada suhu 25 ° C) seringkali saya tidak menggunakan obat stabili pada dosis terapeutik dan juga terkait dengan nefrotoksisitas saat CD dimasukkan dalam jalur parenteral. 33 Senyawa yang relatif rendah untuk kita kelarutan dari cyclode xtrins mungkin disebabkan oleh pembentukan ikatan hidran okular intra olekular antara gugus hidroksil (lihat Gambar 10-3d), yang mencegah terjadinya inter aksi dengan molekul teren.
Deri vatives dari CD kristal alami telah dikembangkan untuk meningkatkan kelarutan dalam air dan toksisitas avoi. Metilasi parsial (alkilasi) dari beberapa gugus OH dalam CD mengurangi ikatan intermolekuler hinogenik, sehingga membuat gugus OH bebas untuk berinteraksi dengan air, sehingga meningkatkan kemampuan rangsangan CD.34Menurut Müller dan Br auns, 35 substitusi alkil rendah adalah
lebih baik. Derivat dengan tingkat substitusi yang tinggi mengurangi tegangan permukaan air, dan ini berkorelasi dengan aktivitas hemolitik yang diamati pada derivatif e CD. Derivat amorf dari β-C D dan γ-CD lebih efektif sebagai agen pelarut untuk hormon seks seks daripada p arent cycl odextrins Co mplexes dari tes tosterone dengan amorf hidroksipropil β-CD memungkinkan efisiensi
Rute ini menghindari metabolisme obat di usus dan dekomposisi lintang cepat yang cepat pada r live (lihat Bab 15), sehingga meningkatkan ketersediaan hayati.
pelepasan diltiazem antagonis kalsium larut dalam air secara signifikan menurun dengan leksasi com dengan etilated β-CD. Tingkat pelepasan dikoordinasikan dengan mencampur turunan hidrofobik dan hidrofilik dari siklodekstrin pada beberapa rasio .37 CD-CD etilated memiliki o Cyclodextrins dipelajari sebagai agen pelarut dan stabilisasi dalam bentuk dosis farmasi. Lach dan associates29 menggunakan siklodekstrin untuk menjebak, menstabilkan, dan melarutkan sulfonamida, tetrasiklin, fine, aspirin, benzokain, efedrin, reserpin, dan testosteron. Kelarutan asam retinoat berair (0,5 mg / liter), obat yang digunakan topica lly di treasuran jerawat, 30 meningkat menjadi 160 mg / liter oleh c omplexation w ith β-CD. Tingkat disolusi memainkan peran penting dalam bioavailabilitas obat, pembubaran cepat biasanya menguntungkan
penyerapan. Dengan demikian, tingkat penggunaan obat bius, 31 obat kuat dalam pengobatan lambung dan duoden al ulcer, dan tolbutamida, obat antidiabetes oral, diperkuat oleh
kompleksasi dengan β-siklodekstrin.32
Cyclodextrins ma meningkatkan atau menurunkan reaktivitas ulat ulin tamu tergantung pada sifat reaksi dan orientasi molekul dalam rongga CD. Th kita, α-siklodekstrin cenderung disukai
pH dependen drolysis dari indometasin dalam ion solu berair, sedangkan β-cyclodextri n menghambat
itu.28 Sayangnya, air sehingga kelarutan β-CD (1,8 g / 100 mL pada suhu 25 ° C) seringkali saya tidak menggunakan obat stabili pada dosis terapeutik dan juga terkait dengan nefrotoksisitas saat CD dimasukkan dalam jalur parenteral. 33 Senyawa yang relatif rendah untuk kita kelarutan dari cyclode xtrins mungkin disebabkan oleh pembentukan ikatan hidran okular intra olekular antara gugus hidroksil (lihat Gambar 10-3d), yang mencegah terjadinya inter aksi dengan molekul teren.
Deri vatives dari CD kristal alami telah dikembangkan untuk meningkatkan kelarutan dalam air dan toksisitas avoi. Metilasi parsial (alkilasi) dari beberapa gugus OH dalam CD mengurangi ikatan intermolekuler hinogenik, sehingga membuat gugus OH bebas untuk berinteraksi dengan air, sehingga meningkatkan kemampuan rangsangan CD.34Menurut Müller dan Br auns, 35 substitusi alkil rendah adalah
pengangkutan hormon ke dalam sirkulasi saat diberikan secara sublingual.36 Rute ini
menghindari metabolisme obat di usus dan dekomposisi lintang cepat di r live (lihat Bab 15), sehingga meningkatkan ketersediaan hayati.
Dalam sinyal ke himpunan derivat hidrofilik, bentuk hidrofobik dari β-CD telah ditemukan penggunaannya sebagai pelacak pembawa yang bertahan lama. Dengan demikian, tingkat pelepasan diltiazem antagonis kalsium larut dalam air secara signifikan menurun dengan leksasi com dengan etilated β-CD. Tingkat pelepasan dikoordinasikan dengan mencampur turunan hidrofobik dan hidrofilik siklodekstrin pada beberapa rasio .37 Etilated β-CD telah digunakan untuk menghambat pengiriman isosorbid dinitrat, vasodilator.38
Cyclodextrins ma memperbaiki karakteristik organoleptik formulasi cairan oral. Rasa pahit dari tanda-tanda suspensi fe moxetine, antidepresan t, sangat dipengaruhi oleh kompleksasi obat dengan β-siklodekstrin.39
penyaringan molekuler
Senyawa klorin makromolekul, atau saringan molekuler seperti yang biasa disebut, meliputi zeolit, dekstrin, gel silika, dan zat terkait. Atom disusun dalam dimensi awal untuk menghasilkan sangkar dan saluran. Zeolit sintetis dapat dibuat dengan ukuran pori yang pasti sehingga bisa memisahkan kelopak mol dengan dimensi yang berbeda, dan juga merupakan pertukaran ion. Lihat artikel review oleh Fran k24a untuk pembahasan rinci tentang senyawa inklusi
Metode Analisis
Sebuah penghentian rasio eto stoichio ligan untuk memenuhi l atau donor terhadap akseptor dan ekspresi kuantitatif dari konstanta kestabilan untuk melengkapi ex formasi penting dalam penelitian dan penerapan komisi koordinasi. Sejumlah metode im yang lebih penting untuk memperoleh jumlah ini disajikan di sini
Metode Variasi Kontinyu
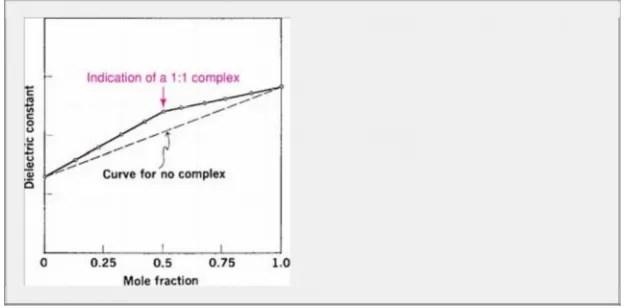
Job4 1 menyarankan penggunaan alat tambahan aditif seperti t he spectrophotometric extin ction coefficie nt (konstanta dielektrik t atau kuadrat indeks refra ctive ma y juga digunakan) untuk pengukuran kompleksasi. Jika properti untuk dua spesies cukup berbeda dan jika tidak ada interaksi terjadi bila komponennya m, maka nilai properti adalah rata-rata tertimbang dari nilai-nilai
Spesies sepa jenis dalam campuran. Ini berarti bahwa jika properti aditif, katakanlah konstanta dielektrik, diplotkan terhadap fraksi mol dari 0 sampai 1 untuk salah satu komponen campuran di sini, tidak terjadi kompleksasi, lasiasi linier diamati, seperti yang ditunjukkan oleh garis putus-putus pada Gambar 10-7. Jika pelarut dari dua sitas A dan B ion konsentrat molar yang sama (dan konsentrasi konsentrasi tetap terhadap talas) akan dicampur dan jika bentuk kompleks antara dua spesi, nilai sifat aditif akan melewati maksimum (atau mi nimum), seperti yang dimiliki oleh kurva u pper pada Gambar 10-7. F atau kontra total konsentrasi A dan B, komplek berada pada konsentrasi terbesarnya pada titik dimana spec A dan B digabungkan kembali dalam rasio di mana terjadi pada koekslomerasi. Oleh karena itu, lin menunjukkan sebuah br eak atau chan ge di lereng pada pecahan mol correspo yang menempel pada mmlex c. Perubahan pada slope occu rs pada fraksi mol 0,5 pada Gambar 10-7, menunjukkan kompleks tipe 1: 1.
Bila absorbansi spektrofotometri digunakan sebagai sifat fisik, nilai yang diamati diperoleh pada variasi fraksi mol ketika terjadi morfomasi koaksial terjadi dimana usua lly dikurangkan dari nilai yang sesuai yang diharapkan tidak menghasilkan kompleks. Perbedaan ini, D, kemudian diplot terhadap fraksi mol, seperti yang ditunjukkan pada Gambar 10-8. Rasio molar kompleks ini mudah diperoleh dari kurva tersebut Dengan cara menghitung invol ving entrasi conc dan properti yang diukur d, stabilisasi formasi dapat ditentukan dengan metode yang dijelaskan oleh Martell dan C alvin.42 Anoth er bertemu, disarankan oleh Bent dan French, 43 diberikan di sini Jika magnitudo dari ukuran d properti, seperti as ace, prop hanya proporsional terhadap
konsentrasi kompleks M n, rasio molar ligan A terhadap logam M dan konstanta stabilitas c dapat ditentukan dengan mudah. Persamaan untuk c mplexation dapat ditulis sebagai
dan stabilitas konstan sebagai atau, bentuk logaritmik
Dimana [MAn] adalah konsentrasi kompleks, [M] adalah
konsentrasi logam yang tidak dikomplekskan, [A] adalah rangsangan ringkas dari ligan
ncomplexed, n adalah jumlah mol ligan yang dikelompokkan dengan 1 m ole ion logam, dan K adalah kesetimbangan konstanta bolak-balik untuk l . Entitas entrasi ion logam adalah konstanta medan sedangkan entrasi rapat ligan bervariasi, dan konsentrasi pelengkap yang sesuai, [MAn], comp lex yang terbentuk diperoleh dari analisis spektrofotometri.41 Sekarang, menurut
persamaan (10- 5), jika log [MAn] diplot terhadap log [A], slop e dari garis menghasilkan rasio hiometrik stoic atau numb er n dari ligan molekul mol yang terkandung pada ion logam, dan mencegat pada sumbu vertikal memungkinkan untuk mendapatkan konstanta stabilitas, K, karena [] adalah kuantitas yang diketahui. Ayub membatasi metodenya untuk pembentukan lex tunggal; Namun, Vosburgh dkk.44 memodifikasinya sehingga bisa mengobati mation kompleks yang lebih tinggi dalam larutan. Osman dan Abu-Eittah45 menggunakan teknik spektrofotometri untuk menyelidiki kompleks logam-ligan 1: 2 dari tembaga dan barbiturat. Sebuah omplex hijau kehijauan diwarnai dengan mencampur solutio n biru tembaga (II) dengan thiobar biturat
(colo rless). Dengan menggunakan metode Job m ethod, konstanta kestabilan yang nyata seperti yang terjadi pada kompleksitas th e 1: 2 diperoleh.
Metode Titrasi pH
Ini adalah salah satu metode yang paling andal dan dapat digunakan bilamana kompleksasi dihadiri oleh chan ge dalam pH. Klasifikasi ion cupric oleh glisin, misalnya, dapat
direpresentasikan sebagai
coppe dan plot pada pH ag ainst persamaan valensi ba se ditambahkan. Hasil titrasi
ototensiometrik p ditunjukkan pada Gambar 10-9. C rve untuk campuran mixer m etal-glisin jauh di bawah bahwa untuk glisin saja, dan kelengkungan pada pH s yang morfeksasi terjadi di sebagian besar kisaran neutralizatio n. Hasil percobaan diperoleh dengan ion zwitte lainnya dan asam lemah (basa), seperti asam diasetat N, N'-diac etylethylenediamine, yang telah dipelajari untuk tindakan kompleksnya dengan ion copper dan kalsium.
Hasilnya dapat diolah secara quan dengan cara berikut untuk mendapatkan kestabilan konstanta untuk kompleks. Dua elektron berurutan atau stepwise eq uilibria antara ion tembaga atau logam, M, dan glisin, atau ligan, A, dapat ditulis secara umum sebagai Bjer um46 disebut K1 dan K2 konstanta formasi, dan konstanta kesetimbangan t e, β, untuk keseluruhan reaksi dikenal sebagai konstanta kekestalan. Sebuah kuantitas n sekarang akan diremehkan. Ini adalah jumlah kelelawar nd liga yang terikat pada ion logam. Jumlah rata-rata li dan kelompok yang terikat per ion logam ada sebelum disain (n bar) dan ditulis sebagai Belum ada yang pasti untuk setiap speci complex (1 atau 2 dalam kasus ini), mungkin ada hubungan antara molekul ligan yang ada, 2 dalam kasus ini. Pengambilan nihil dari eqution (10-11) ial konsentrasi total ikatan ligan terikat. Istilah kedua dalam pembilang dikalikan dengan 2 dapat digunakan dua molekul ligan yang terkandung dalam setiap m olecule spesies, MA2. Penyebutnya beri nilai total logam mulia untuk milid, baik yang tidak terikat maupun yang bebas. Untuk kasus khusus i n yang ñ = 1, persamaan (10 -11) menjadi Mempekerjakan hasil dalam equati ns (10-9) dan (10-12), kita mendapatkan relasi berikut ini: Dan akhirnya
dimana p [A] ditulis untuk -log [A]. Bjerrum juga menunjukkan, pada roximation aplikasi pertama,
Sekarang seharusnya dimungkinkan untuk mendapatkan konstanta formasi kompleks individu, K1 dan K2, dan konstanta stabilitas keseluruhan, β, jika Anda mengetahui dua nilai: [n dengan bar di atas] nd p [A].
Persamaan (10-10) menunjukkan bahwa konsentrasi ligan terikat harus ditentukan sebelum dapat dievaluasi Sudut horizontal yang ditunjukkan oleh lin es pada Gambar 10-9 antara kurva titrasi untuk glisin saja (kurva I) dan f atau glisin dalam kehadiran Cu2 + (kurva II) memberikan sebidang alkal yang digunakan dalam reaksi berikut.
Kuantitas alkali ini sama persis dengan c oncentration of ligand bou d pada pH apapun, dan, menurut persamaan (10-10), bila dibagi dengan konsentrasi total ion logam, g ves nilai [n dengan bar atas]. Konsentrasi glisin bebas [A] sebagai "dasar" NH2CH COO- pada pH apa pun
konsentrasi [NH3 + CH2C OO-], atau [HA], dari spesies asam pada setiap p H diambil sebagai selisih antara konsentrasi awal, [HA] init, glisin dan konsentrasinya, [NaOH], dari alkali ditambahkan. Kemudian
dimana [A] adalah konsentrasi glisin ligan. Contoh 10-1
Hitung Rata-rata Jumlah Ligan
Jika sampel 75-mL mengandung 3,34 × 10-2 mol / liter glikin hidroklorida saja dan dalam binaan gabungan dengan 9,45 x 10-3mole / liter ion cupric yang dititrasi n 0,2959 N NaOH, keduanya kurva I dan II, masing-masing, pada Gambar 10-9 diperoleh. Hitung - dan p [A] pada pH 3,50 dan pH 8.00. PK a dari glycine s 9.69 pada 30 ° C.
sebuah. Dari Gambar 10-9, jarak horisontal pada pH 3,50 untuk berat 75 mL adalah 1,6 0 mL NaOH atau 2,59 × 10-4 mol / mL × 1,60 = 4,15 x 10-4 mol. Untuk sampel 1 liter, nilainya adalah 5,54 × 10-3 mol. Konsentrasi total ion per detik adalah 9,45 × 10-3mole, a nd dari persamaan (10-10), [n dengan ba di atas] diberikan oleh
Dari persamaan (10-2 1),
Pada pH 8.00, jarak horiz ontal antara dua kurva I dan II pada Gambar 10-9 adalah equivale nt sampai 5,50 mL NaOH dalam sampel 75 mL, atau .59 × 10-4 × 5.50 × 100/75 = 19.0 × 10-3 mol / liter. Kita punya
Nilai [n dengan bar di atas] dan p [A] pada nilai pH bervariasi kemudian digambarkan sebagai sho wn pada Gambar 10-10. Kurva yang dia dapatkan saya kenal sebagai kurva formasi. Hal ini terlihat mencapai batas pada [n dengan bar di atas] = 2, menunjukkan bahwa jumlah mol molekul glycine yang dapat digabungkan dengan satu atom tembaga adalah 2. Dari kurva ini pada [n dengan bar di atas] = 0,5, pada [n dengan bar di atas] = 3/2, dan pada [n dengan bar abov e] = 1.0, perkiraan nilai v untuk log K1, log K2, sebuah log β β, masing-masing diperoleh
Satu kumpulan data untuk kompleksisasi glisin oleh tembaga ditunjukkan pada Tabel 10-4. Nilai log K1, log 2, dan log β untuk beberapa kompleks logam terjadi pada Tabel 10-5.
bahwa lithium membentuk kompleks dengan spesies zwitterionic f katekolamin pada pH 9 t o 10 dan dengan bentuk deprotonasi pada nilai pH di atas 10. T ia berinteraksi dengan lithium epends pada disosiasi
oxyg en henolik dari amina catecho. Pada pH yiologis, spesies yang terprotonasi tidak menunjukkan adanya kompleksitas semut. Jadi saya lithium sal s, seperti lith ium carbonate, litium chlo ride, dan lithi um citrate, yang digunakan dalam psikiatri
ubungan linier antara obat pKa dan e log konstanta kestabilan komplemen logam pelengkapnya menunjukkan bahwa ligan yang lebih mendasar (obat terlarang) memberi nilai lebih stabil. chelate dengan cerium (IV), pallaium (II), dan tembaga (II). Metode potentiometri dijelaskan secara rinci oleh C onnors dkk.5 untuk komplemen com inklusi tipe yang terbentuk antara α-yclodextrin dan asam benz oic tersubstitus
Metode Distribusi
Metode penyaluran zat terlarut antara pelarut tanpa minyak dapat digunakan untuk menentukan konstanta kestabilan untuk beberapa plekson tertentu. Keragaman yodium oleh potassium iodi de dapat digunakan sebagai contoh untuk mengetahui metode ini. Reaksi ekuilibrium dalam
bentuknya yang paling sederhana adalah Langkah tambahan juga terjadi pada bentuk polyiodida; Sebagai contoh, 2I- + 2I2 [tangkapan tepat pada tangkai tangkai kiri] I2-6 dapat terjadi pada konsentrasitas tinggi, namun tidak dipertimbangkan lagi di sini.
Gratis dan Jumlah Yodium Contoh 10-2
Bila yodium dikalsinasi b etween air (w) pada 25 ° C dan disulfida karbon sebagai fasa organik (o), seperti yang digambarkan pada butiran 10-11, konstanta distribusi K (o / w) = Co / C w ditemukan menjadi
625. Bila disalurkan melalui larutan potas ium iodida 0,150 M dan disulfida karbon, koefisien gabungan yodium pada olahan organik adalah 0,18 96 mol / liter. Untuk analisis yang kita dapatkan, analisis konsentrat dari i odine adalah sebesar 0,02832 mol e / liter.
Dalam s ummary, hasilnya adalah sebagai berikut:
Konsentrasi total I2 di lapisan rawan (fr ee + yodium kompleks): 0,02832, mo le / liter Total konsentrasi KI dalam a queo
Koefisien distribusi, (o / w) = [I2] o [I2] w = 625
Comon spesies ke kedua fase adalah yodium bebas atau tidak terkompresi; hukum distribusi Higuchi dan rekan-rekannya menyelidiki tindakan kompleks kafein, polivinilpirolidon, dan poli etilen glikol pada sejumlah obat asam, dengan menggunakan partisi ini atau menambahkannya. Menurut Higuchi dan Zuck, 51 reaktan antara asam ffeine dan benzoat untuk membentuk kompleks asam benzoat-kafein adalah hanya mengekspresikan konsentrasi yodium bebas, dan hasil analisis kimiawi konsentrasi total yodium dalam fase aq ueous. Konsentrasi yodium bebas dalam fasa air diperoleh s berikut
Hasilnya agak bervariasi, nilai t 37,5 menjadi stabilitas usia rata-rata c onstant. Guttman dan Higuchi52 kemudian menunjukkan bahwa kafein ada di dalam larutan encer terutama sebagai monomer, dimer, dan tetramer, yang akan menjelaskan bagian untuk variasi pada K seperti yang diamati oleh Higuchi dan Zuck
Metode Kelarutan
Dengan metode kelarutan, kelebihan qu antitas obat dioleskan ke dalam wadah yang baik, bersamaan dengan solusi dari usia mplexing t di berbagai kontraksi c, dan botol-botol tersebut diaduk dalam suhu konstan-suhu u ntil equilibriu m tercapai. Aliquot portio ns cairan supe rnatant dilepas dan dianalisis. Higuchi dan Lach 53 menggunakan olahannya yang perlu dilakukan dalam menentukan xasi p-a minobenzoic a cid (PA BA) oleh kafein. Hasilnya diplot pada Gambar 10-12. Titik A di mana garis yang melintasi sumbu vertikal adalah kelarutannya permadani di air Dengan penambahan kafein, kelarutan PABA meningkat secara linear karena kompleksasinya. Pada titik B, lusi itu jenuh dengan respect ke co mplex dan obat itu sendiri. Kompleks ini terus terbentuk dan diendapkan dari sistem jenuh karena semakin banyak kafein ditambahkan. Pada titik C, semua bekas PA BA telah masuk ke solutio dan telah diubah menjadi kompleks. Alth ough obat padat exha usted dan solusinya tidak lagi jenuh, beberapa PABA rem ains unco mplexed dalam ol ol ol, dan menggabungkannya lebih jauh dengan caffe ine untuk membentuk kompleks yang lebih tinggi seperti (PABA-2 caffeine) seperti yang ditunjukkan oleh kurva di sebelah kanan diagram
Contoh 10-3
Rasio Kompleks Stoikiometrik
dihitung dengan mengurangkan asam dalam larutan pada titik atur B dari sekup inisiat ditambahkan ke campuran karena ini adalah amo unt namun tidak terlarut yang kompleks.
2 m le / liter P ABA bebas dan tidak terlarut bebas sama dengan larutan asam tota minus pada titik B, yaitu 7,3 × 10-2 - 5,5 × 10-2, atau 1,8 × 10-2 mol / liter, dan
stoi chiometric ra tio ini
Formasi kompleksnya adalah sebelum terjadinya dan konstanta kestabilan untuk perbandingan 1: 1 ini adalah total asam bisa membentuk menjadi 1,8 × 10-asam diPerhitungan berikut dibuat untuk mendapatkan rasio stoikiometri dari c omplex. Sentinasi kafein, sesuai dengan lempeng au BC, sama dengan konsentrasi kafein masuk ke dalam kompleks di atas r ange ini, dan jumlah asam p-aminobe nzoic ente ring the com plex diperoleh dari pasta yang tidak larut. di titik t B. itu K dapat dipahami sebagai berikut. Konsentrasi conel [PABA-Caffeine] sama dengan saturasi asam total b jenuh kurang asam (PABA] asam dalam air. Sentimentasi [C affeine] dalam larutan pada kesetimbangan sama dengan kafein yang ditambahkan ke sistem sehingga kurang
konsentrasi yang telah diubah menjadi co mplex. Konsentrasi asam lemak jenuh I 4,58 × 10-2mole / liter tanpa kafein ditambahkan (kelarutan PAB A) dan 5,312 x 10-2 m ole / liter whe n 1,00 x 10-2 mol / liter kafein ditambahkan Kita punya Konstanta stabilitas untuk nu mber kompleks caffei ne diperoleh terutama oleh distribusi dan metode olrasilitasnya diberikan pada Tabel 10-6. Stabilitas konstanta untuk beberapa kompleks obat lain dikompilasi oleh Higuchi dan Connors.54 K enley et al.55 mempelajari kompleks com larut air dari variasi ligan ds dengan obat ntiviral siklovir dengan menggunakan metode kelarutan. Spektroskopi dan Kompleks Transfer Perubahan
Spektrum oscromulan absorpsi di daerah spektrum ultraviolet yang terlihat dan ul jarang digunakan untuk mengisolasi elektroda donor atau plexation transfer muatan .6 Ketika iodi ne dianalisis dengan larutan nonc sehingga lender seperti CCl4 , sebuah kurva diperoleh dengan puncak tunggal sekitar 520 nm. Solusinya adalah ungu. Solusi saya makan di benze ne
menunjukkan perpindahan maksimum menjadi 475 nm, dan puncak baru kontra intensitas tinggi untuk pita muatan-bergeser menjadi ppears pada 300 nm. Larutan yodium dalam diet eter
Semakin banyak easil y donor yang menghasilkan benzena atau dietil et er melepaskan elektronnya, yang diukur dengan potensi ionisasinya, stro nger itu sebagai donor. Potensi ion Ionizat dari serangkaian donor menghasilkan garis lurus yang diplot terhadap energi maksimum atau muatan tr nsfer frekuensi (1 nm = 18,63 kal / mol) untuk pelarut yodium dalam pelarut donor.56,5 7
Konstanta kompleksasi, K, dapat diperoleh dengan menggunakan v isible dan spektroskopi ultraviolet. Persamaan antara donor D dan menerima atau A adalah representasi sebagai dimana K = k1 / k-1 adalah konstanta kesetimbangan untuk kompleksitas r n (konstanta kestabilan) dan k1 dan k-1 adalah konstanta laju interaksi. Ketika dua molekul berasosiasi sesuai dengan skema ini dan selanjutny Salah satu gugus muatan nsfer diukur pada elu wav yang pasti, K mudah memperoleh d dari persamaan Benesi- ildebrand A0 dan D0 adalah konsentrasi awal dari acceptor dan tidak atau spesies, secara khusus, dalam mol / liter, ε adalah absorptivitas mola r dari kompleks transfer muatan pada panjang gelombangnya, dan K, stabilitas konstan, diberikan dalam liter / mol atau M-1. Sebuah plot A0 / A versus 1 / D0 menghasilkan garis lurus dengan kemiringan 1 / (K ε) dan intersep 1 / ε, seperti yang diamati pada Gambar 10-14. Bora zan et al.59 menyelidiki evolusi dasar asam nukleat (akseptor elektron) dengan catecho l, epinefrin, dan isoproterenol (don elektron). Catechols memiliki potensi io nisasi yang rendah dan
kecenderungan untuk menyumbangkan elektron. C memanfaatkan kompleksitas transfe n terbukti seperti yang ditunjukkan oleh pengukuran ultraviolet abso rption. Dengan asumsi 1: 1 com plexes, equilibrium con stant, K, untuk transfer muatan dalam eraction diperoleh dari plot Benesi-Hild ebrand pada suhu tiga atau fou r, dan ΔH ° diperoleh pada suhu yang sama dari th e kemiringan garis sebagai plotte d pada Gambar 1-15. Nilai-nilai K dan parameter termodinamika ΔG °, ΔH °, dan ΔS ° diberikan dalam T mampu 10-7.
Contoh 10-4
Hitung Molar Absorptivity
Bila A0 / A diplotkan terhadap 1 / D0 untuk larutan katekol (donor elektron) yang mengandung urasil (akseptor elektron) pada 0,1 N HCI pada suhu 6 ° C, 18 ° C, 25 ° C, dan 37 ° C, keempat garis tersebut diamati untuk memotong sumbu vertikal di 0,01041. Konsentrasi total, A0, untuk urasil adalah 2 × 10-2 M, dan D0 untuk katekol berkisar antara 0,3 sampai 0,8 M. Lereng garis yang ditentukan oleh metode kuadrat-terkecil adalah sebagai berikut:
Tenangkan absorptivitas molar dan kestabilan konstan, K. Sayap Kno K pada keempat suhu ini, apakah kita akan melanjutkan untuk memperoleh ΔH °, ΔG °, dan Δ °?
ple ini diberikan pada Tabel 10-7.Web b dan Thompson60 mempelajari kemungkinan peran kompleks nukleotida penerima nd dalam ikatan obat-reseptor menggunakan derivat quinoline dan naphtha lene sebagai model donor lectron dan
trinitrofluoren de rivatif sebagai akseptor elektron. Pengaturan yang paling menguntungkan f atau donor 8-amin oquinolin (garis berat) dan d-1, yang dicoba suksinat dengan metode kimia qu antum, ditunjukkan di bawah ini.
Persilangan antara Bene si-Hildebra nd, adalah timbal balik molar
abs orptivity, atau 1 /0.01041 = 96.1. The m olar absorptivity, ε, adalah konstanta untuk senyawa atau kompleks com, indep ndent of temperature atau concentratio n. K diperoleh dari kemiringan dari empat kurva
Metode lainnya
Sejumlah metode lain tersedia untuk mempelajari c omplexation kompleks molekul logam dan olegan. Mereka termasuk NMR dan spektroskopi inframerah, polarografi beredar dichroism, kinetik, x-ray iffraction, sebuah d difraksi elektron. Beberapa di antaranya akan dibahas secara singkat di bagian ini. Kompresi kafein dengan L-tryptophan dalam larutan sol encer disingkat oleh Nishijo et al.61 menggunakan spektroskopi 1H-NMR. Kafein saya nteract dengan L-tryptophan t rasio molar o 1: 1 secara parallel raja stac Komposisi adalah hasil interaksi polarisasi dan π - actions pada cincin aromati c. Modus penumpukan paralel yang mungkin ditunjukkan pada Gambar 10-16. Penelitian ini menunjukkan bahwa triptofan, yang diduga merupakan situs pengikat dalam serum albumin untuk obat tertentu, dapat berinteraksi dengan kafein bahkan sebagai asam amino bebas. Namun, Kafein tidak berinteraksi dengan asam amino aromatik seperti L-valine atau L-leucine.
Bora zan dan Kou mriqian62 stu meninggal dalam transisi coil-helix asam polyadenylic yang diinduksi oleh ikatan pengikat
dari katekolamin norepinephrine dan oproterenol, menggunakan ichroism lingkaran. Mo st mRNA
sule mol mengandung daerah asam lyadenyat, yang dipikirkan untuk memudahkan tumbuhnya mRNA dan stab
diinterpretasikan sebagai akibat pengikatan kripto katekolamin antar sisipan antara adeni ne dasar s. Para peneliti ini menyarankan bahwa katekolamin dapat menggunakan mekanisme kontrol melalui induksi trans tran co-to-helix dari asam adenilik poli, yang mempengaruhi terjemahan genetika. De T aee dan Ze egers-Huyskens63 menggunakan spektroskopi inframerah untuk mengimbangi kompleks ikatan hidrogen yang melibatkan basis polifungsional su ch sebagai atron proton d. Ini adalah teknik yang sangat tepat untuk menentukan atau menentukan parameter termodinamika yang terlibat dalam pembentukan ikatan drogen dan untuk
karakterisasi interaksi pada saat m olecule memiliki beberapa kelompok yang tersedia untuk membentuk hidrogen. Kafein membentuk ikatan hidrogen dengan beberapa donor proton: o fenol, turunan fenol, aliphati c alco hols, dan wat er. Dari teknik i nfrared, prefe rred hydroge n-bonding site s adalah fungsi onyl mobil caffei ne. Tujuh puluh persen kompleks terbentuk pada C == O grou p pada posisi 6 dan 30% dari exes compl pada kelompok C = O pada posisi 2 dari affine c. El-Said et al.64 metode edom etom dan infomasi ed untuk mengkarakterisasi 1: 1 komplex com antara en uranyl acetate dan tetrasiklin. Struktur yang disarankan untuk kompleks ura yl-tetrasiklin ditunjukkan di bawah ini
Konsep kunci
Obat-Protein Binding
Pengikatan obat-obatan untuk melindungi konteiner dalam tubuh dapat mempengaruhi tindakan mereka dengan berbagai cara. Protein dapat (a) memfasilitasi distribusi obat-obatan tanpa tubuh, (b) secara tidak sengaja memberi obat dengan tidak memungkinkan sentimen obat bebas yang bebas untuk dikembangkan di lokasi reseptor, atau () menghambat ekskresi obat. Interaksi protein obat dengan penyebab (a) perpindahan hormon tubuh atau agen koagulan, (b) perubahan konfigurasi n protein, bentuk yang diubah secara struktural yang dapat digunakan untuk bin ding agen coadministered, atau (c) pembentukan kompleks obat-prot ein yang secara biologis aktif. Ini topi cs discu ssed di nu mber revi ews.65,66 A mong protein pla sma, albumin i mos t penting karena konsentrasi tinggi relatif terhadap protein r lain yang juga ada untuk nya
kemampuan untuk mengikat asam dan obat dasar. Protein p asma lain, glikoprotein asam-a11, telah ditunjukkan untuk memberi kita obat-obatan; Protein th Ap untuk mendapatkan afinitas lebih besar untuk bahan dasar daripada molekul obat asam
dimana K adalah konstanta asosiasi, [P] adalah konsentrasi prote n dalam hal situs pengikatan bebas,
lebih baik represented sebagai K (T); [PD], ymbol untuk bo und drug, adalah s ometimes ditulis sebagai [Db], sebuah nd [D], gratis , seperti [Df]. Jika konsentrasi total protein ditentukan sebagai [Pt], kita dapat menulis Mengganti ekspresi untuk P] dari persamaan (10-32) ke dalam Rasio r juga dapat diekspresikan di unit lain, seperti m illigrams obat terlarang, x, per gram protein, m. Persamaan (10-36) adalah salah satu bentuk dari adsorpsi Langmuir isot herm. Meskipun sangat penting untuk mengekspresikan data pengikat protein, namun harus ditentukan kesimpulan bahwa formula ini harus mensyaratkan bahwa protein dalam pengikatan menjadi fenomena adsorpsi n. Ekspresi (10-36) dapat diubah menjadi bentuk linea r, mudah digunakan untuk merencanakan, dengan membalikkannya:
Jika ada situs pengikat independen, ungkapan untuk r, persamaan (10-36), berarti menyiratkan v kali untuk satu situs tunggal, atau dan persamaan (10-37) menjadi Persamaan (10-39)
menghasilkan apa yang disebut plot komersil Klotz.67
Data yang disajikan menurut persamaan (10-41) dikenal sebagai plot AScatchard.67,68
Pengikatan bish ydroxycouma rin ke manusia erum albumi n ditunjukkan sebagai lot Scatchard pada Gambar 10-17.
Perlakuan Grahical terhadap data persamaan (10-39) berat bobot percobaan yang ditunjukkan pada konsentrasi rendah dari minuman bebas, D, dan oleh karena itu menyebabkan salah tafsir mengatur perilaku pr otein-binding yang tinggi. trasi obat fre e. Equa ion (10-41) tidak memiliki kelemahan ini dan merupakan metode pilihan untuk merencanakan data. Kelengkungan pada plot hese biasanya mengindikasikan keberadaan mor e daripada satu typ e of binding site.
Persamaan (10-39) dan (10-41) digunakan untuk analisis data jika sifat dan jumlah prot pada sistem ereksinya tidak serentak. Untuk situasi ini, Sandberg dkk.69 merekomendasikan
persamaan yang sedikit dimodifikasi Cara penulisan persamaan alternatif (10-38) adalah menata ulangnya terlebih dahulu
dimana [Db] adalah c oncentration of bound drug. Persamaan (10-42) diplotkan sebagai rasio [Db] / [Df] versus [Db], dan dengan cara ini K ditentukan dari kemiringan dan vK [Pt] ditentukan dari pencegatan
sebelah kanan adalah kecil, menunjukkan sangat lemah suatu kekurangan obat untuk situsnya, namun kelasnya mungkin memiliki jumlah duduk yang banyak dan karenanya dianggap tidak dapat terjual
Equilibrium Dialysi (ED) and Ultrafiltration (UF)
Sejumlah metode digunakan untuk menentukan jumlah obat yang terikat pada protein. Dialisis ekuilibrium, ultrafiltrasi, dan elektroforesis adalah teknik klas ssik yang digunakan, dan beberapa tahun terakhir metode lain, seperti gel filtrati dan resonansi magnetik nuklir, telah digunakan dengan hasil yang memuaskan. Kita akan membahas quilibrium dia lysis, ultrafiltration, dan metode kinetik.Prosedur pemeriksaan dialisis ekuilibrium disempurnakan oleh Klotz dkk.71 untuk mempelajari kompleksasi antara ion-ion metam atau molekul kecil dan kelopak makromol yang tidak dapat melewati semip ermeable mem brane. Menurut metode dialisis quilibrium, serum al umin (atau investigasi protein yang lain) ditempatkan di membrane Viskin g selulosa (Visking Corporation, C hicago) atau membran dialyzing si milar. Tabung diikat dengan aman dan tersuspensi dalam sel yang mengandung obat dalam berbagai entrasi. Ion ic stregth dan kadang-kadang hidrogen ion conce ntration adalah nilai justed to definition, dan mengendalikan d kosong dijalankan untuk memperhitungkan adsorpsi obat dan protein membrane Jika bin ding terjadi, konsentrasi obat dalam kantung yang mengandung protei n lebih besar pada ekuilibrium t anion obat pada bejana di luar kantung. Sa mples di rem dan digali untuk mendapatkan c
oncentration obat bebas dan kompleks. Dialisis ekuilibrium adalah teknik klasik f atau protein mengikat ing dan tetap menjadi metho d yang paling populer. Salah satu kesalahan potensial berhubungan dengan teh te ini adalah mungkin obat bius untuk membr ane, mengurangi jumlah obat di bawah substrat dari plasma ke buffer sid e dari mem brane, dan osmotic volu me shifts of mengalir ke sisi plasma. Toz er dkk.72 merajut persamaan matematika matematis untuk
menghitung dan memperbaiki besarnya pergeseran cairan. B riggs et al.73 mengusulkan teknik dialisis kesetimbangan yang diirukan untuk meminimalkan kesalahan kadaluarsa untuk
penentuan tingkat ligan atau kosa mol kecil yang rendah.Saringan filtrasi ultra perhambaan lebih mudah dilakukan karena tidak perlu waktu lama untuk menggunakannya. Metode ultrafiltrasi mirip dengan dialisis ekuilibrium di makromolekul seperti albumin s erum dipisahkan dari molekul rg kecil. Tekanan hidrolik atau ce ntrifugasi digunakan pada trafiltrasi ul untuk memaksa pelarut dan molekul mal, obat tak terikat, melalui membran yang mencegahnya melepaskan obat yang terikat pada protein. Ultrafiltrate ini kemudian dianalisis dengan spec trophotometr y atau teknik lain yang sesuai. Konsentrasi obat t at bebas dan tidak terikat, Df, diperoleh dengan menggunakan metode hukum B eer:
Binding to Human Serum Albumin
Pengikatan albumin serum sulfamethoxypyridazine t o dipelajari pada suhu 25 ° C, pH 7,4, dengan teknik trafik ultrafil. Persentasenya dari penelitian ini, [Dt], adalah 3,24 × 10-5 m le / liter dan konsentrasi serum albumin manusia, [Pt], adalah 1 .0 × 10-4 mo le / liter. Setelah equilibrasi, ultrafiltrate memiliki kemiringan yang sangat tinggi, A, o f 0,559 pada 540 nm dalam lensa yang panjang jalur optiknya, b, adalah 1 cm. Tingkat absorbansi molar, ε, dari obatnya adalah 5,6 × 104 liter / mol cm.Berikan nilai rujukan atrard dan persentase obat yang terikat. Konsentrasi pada bebas (u nbound) dru g, [Df], diberikan oleh Sebuah teknik kesalahan ultrafiltrasi terjadi akibat pengikatan obat pada embhem m. Pilihan antara ultrafiltrasi dan metode dialisis kesetimbangan bergantung pada c haracteristics obat. Dua teknologi ini telah dibandingkan dengan beberapa penelitian yang mengikat protein.74,75,76
Konsep kunci Protein Binding
Protein binding PB) berperan penting dalam ph armacokinetics dan pharmacodyna ics of a drug. Tingkat PB di plasma atau jaringan c ontrols v olume distribusi dan mempengaruhi baik hati dan ginjal clearance. Dalam banyak kasus, konsentrasi obat bebas, daripada konsentrasi total dalam plasma, berkorelasi dengan efeknya. Perpindahan obat dari dru -protein co mplex dapat
dilakukan melalui kompetisi dua obat untuk tempat pengikatan yang sama dan penting dengan obat-obatan yang terikat tinggi (> 95%), dimana perpindahan kecil obat terikat dapat sangat Kenaikan konsentrasi obat bebas di plasma. Dalam rangka mea yakin falsafah bebas atau PB obat, trafiltrasi ul (UF), ultracen trifugation, equilibrium dial ysis (ED), chromatograp hy, spectrophotometry, electrophore, dan lain-lain telah digunakan.
adalah b merasa kurang rentan terhadap fakta seni yang rileks. Namun, ini memakan waktu dan tidak sesuai untuk senyawa yang tidak stabil karena memerlukan waktu keseimbangan anterior substansial (3-24 jam) bergantung pada obat-obatan, saya, matrik mbrane, dan eversi d. Peneliti pria telah menggunakan alat cif rifugal UF untuk pengukuran PB. UF adalah metode sederhana dan cepat di mana sentrifugasi memaksa buffer yang mengandung obat bebas melalui membran eksklusi ukuran dan mencapai pemisahan cepat dari obat bebas protein tanpa protein.
mencakup pemilihan prosedur pengujian, perangkat, dan perawatan. Metode yang paling sering digunakan hanya untuk pengukuran PB adalah ED, yang mana Dialisis Dinamis
Meyer dan Guttm an77 mengembangkan metode kinetik untuk menentukan konsentrasi obat terikat dalam larutan protein. Metode ini banyak mendapat dukungan dalam beberapa tahun terakhir karena relatif ra pid, ekonomis dalam hal kebutuhan protein yang dibutuhkan, dan mudah menyesuaikan studi tentang hambatan pengikatan protein. Hal ini dibahas di sini secara rinci. The m thod, yang dikenal sebagai dialisis dinamis, didasarkan pada tingkat penolakan pemberian obat dari sel yisis yang sebanding dengan traktat unbound
obat. Aparatus terdiri dari gelas bejana dengan kadar 400 mL jac keted (suhu-terkontrol) dimana 200 mL larutan lebih banyak ditempatkan. Suatu kantong dialisis c llophane yang mengandung 7 mL obat atau obat -protein solut pada susp berakhir pada buffer solutio. Kedua solutio ns diaduk terus menerus. Sampel s olution exter al ke kantung ialisis dilepaskan secara riodically dan dianalisis secara mikronometri, dan jumlah pelarut buffer yang setara dikembalikan ke larutan xternal. Proses dialisis mengikuti laju Yaitu konsentrasi obat t hitung, [Df], adalah konsentrasi obat bebas atau tidak terikat di kantung alisis, -d [Dt] / dt adalah tingkat kehilangan obat dari kantung, dan k adalah semut const tingkat pertama atau er (lihat Bab 13) yang mewakili proses diffusi. Faktor k juga bisa disebut sebagai Nampak tingkat permeabilitas onstant untuk pelarian obat dari kantung. Konsentrasi obat tak terikat, [Df], dalam kantung (kompartemen protein) pada konsentrat alkohol total pada [Dt] dihitung dengan menggunakan persamaan (10-5), kno wing k dan laju-d [Dt] / d pada nampan obat nampan, [Dt]. Dia menilai semut const, k, diperoleh dari kemiringan plot semilogaritik [Dt] versus waktu ketika eksperimen tersebut ditemukan dalam abse nce dari protein.Gambar 10-18 mengilustrasikan jenis plot kinetik yang dapat diperoleh dengan sistem ini. N ote bahwa dalam kehadiran protein, kurva II, tingkat kehilangan obat dari kantung dialisis diperlambat co mpared dengan laju tanpa protein, kurva I. Untuk menyelesaikan persamaan (0-47) untuk obat bebas ransum konsentrasi, [Df], sangat berbeda untuk menentukan kurva kurva II pada berbagai sudut pada waktunya. Ini tidak dilakukan secara grafis, karena pada akhirnya dilakukan dengan benar menyesuaikan data waktu-waktu dengan persamaan e mpir yang sesuai, seperti berikut ini, dengan menggunakan komputer.
Kemampuan komputer memberikan dorongan dari C1 sampai C6. dia nilai untuk d [Dt] / dt kemudian dapat dihitung dari persamaan (10-49), yang mewakili turunan persamaan
Akhirnya, setelah kita memiliki serangkaian nilai [Df] yang dihitung dari persamaan (0-49) dan (1 0-47) yang sesuai dengan nilai eksperimen menentukan nilai ed [Dt] pada masing-masing t saya, kita dapat kembali ke Kami menggunakan vario kami untuk plot Scatchard
Contoh 10-6 *
Asumsikan bahwa data kinetik yang diilustrasikan pada Gambar 10-18 adalah obta yang berada di bawah kondisi berikut: konsentrasi obat awal, [Dt0], adalah 1 x 10-3 mol ko-protein ko ntrinasi adalah 1 × 10-3 mol / liter . Juga berasumsi bahwa konstanta laju orde pertama, k, untuk kontrol (kurva I) adalah ditentukan menjadi 1,0 jam-1 d yang sesuai dengan kurva II terhadap persamaan (10-48) menghasilkan d dalam konstanta empiri al berikut: C1 = 5 × 1 0-4 mol / liter, C2 = 0,6 hr 1, C3 = 3 x 10-4 m le / liter, C4 = 0,4 hr-1, C5 = 2 × 10-4 mol / liter, dan C6 = 0,2 jam-1.
Hitung nilai Scatchard (plot Scatchard seperti yang dibahas pada bagian sebelumnya) untuk r dan r [Df] jika, selama d alisis hadir protein, nilai sekutu eksperimen yang menentukan nilai untuk [Dt] adalah 4,2 × 10- 4 mol / liter pada 2 jam. Di sini, r = [Db] / Pt, w ere [Db] adalah d rug terikat dan Pt adalah total protein conce tration. Kami menggunakan persamaan 10-49)
Poin tambahan untuk plot Scatchard akan didapat dalam mode si milar, menggunakan d ata obta yang ada di titik kita sepanjang dialisis. Dengan demikian, ada serangkaian perhitungan per mits satu untuk menyiapkan plot atrard Sc (lihat Bab 10-17).
judi s78 menyelidiki pengikatan turunan fenol dan fenol oleh serum manusia secara keseluruhan dengan menggunakan teknik dialisis dinamis dan mempresentasikan hasilnya dalam bentuk plot Scatchard
Interaksi Hidrofobik
Hidrolik "ikatan," yang pertama kali diajukan oleh Kau zmann, 79 sebenarnya bukan formasi sama sekali melainkan kecenderungan tetes mukosa tetes mekar atau tetes molekul hidrofobik untuk menghindari hal ini karena mereka tidak mudah larut dalam struktur n-ikatan hidroge dari wat er. Spesies hidrofobik besarseperti protein menghilangkan molekul air dalam larutan berair sepanjang mungkin oleh asosiasi ke dalam struktur micellelike (Bab 15) dengan bagian nonpolar yang bersentuhan di daerah dalam
"Misel," ujung polar menghadap ke air m olecules. Daya tarik spesies hidrofobik ini, yang dihasilkan dari penerimaan saya di air, dikenal sebagai ikatan hidrofobik, atau lebih baik, hidrofobik.
interaksi. Ini melibatkan gaya pasukan Waals, hidrogen bon ding molekul air dalam struktur tiga dimensi, dan interaksi lainnya. Interaksi hidrofobik disukai thermdynamicall Karena penggunaan kelainan atau entropi air m olecules yang meningkat yang menyertai asosiasi molekul onpolar, yang memeras airnya. Glo protein buler dianggap menjaga struktur bola seperti bola di air karena efek hidrofobik. Interaksi Hydrophobik digambarkan pada Gambar 10-19.Nag wekar dan
pelarut organik dalam mengurangi bentuk kompleks asi antara molekul organi kecil dalam larutan berair. Keterkaitan antara spesies organik dengan kontribusi yang signifikan dari bicboning hidropho dan efek unik dari struktur air. Metode yang disarankan pada beberapa mekanisme "donor-akseptor" klasik mungkin beroperasi pada stabilitas ke kompleks yang terbentuk Feldman dan Gibaldi82 mempelajari efek urea, methylurea, dan 1,3-dimethylurea tentang kelarutan asam benzoat dan salisilat dalam larutan berair. Mereka menyimpulkan bahwa peningkatan kelarutan oleh urea dan turunannya merupakan hasil ikatan hidrofobik dan bukan kompleksasi. Urea memecah gugus air berikat hidrogen yang mengelilingi molekul terlarut nonpolar, meningkatkan entropi sistem dan menghasilkan kekuatan pendorong untuk pelarutan asam benzoat dan salisilat. Mungkin saja urea membentuk kompleks saluran dengan asam aromatik seperti ditunjukkan pada Gambar 10-3 a, b, dan c. Interaksi obat-obatan dengan protein dalam tubuh mungkin melibatkan ikatan hidrofobik setidaknya sebagian, dan gaya ini pada gilirannya dapat mempengaruhi metabolisme, ekskresi, dan aktivitas biologis obat Asosiasi Mandiri
Beberapa molekul obat dapat berasosiasi sendiri untuk membentuk dimer, trimer, atau agregat dengan ukuran lebih besar. Tingkat asosiasi yang tinggi dapat menyebabkan pembentukan misel, tergantung pada sifat molekulnya (Bab 16). Doxorubicin membentuk dimer, prosesnya
dipengaruhi oleh komposisi buffer dan kekuatan ion. Pembentukan tetramer disukai oleh agregat susun hidrofobik.83 Keterkaitan diri dapat mempengaruhi kelarutan, difusi, pengangkutan melalui membran, dan tindakan terapeutik. Insulin menunjukkan keterikatan bergantung pada konsentrasi, yang menyebabkan komplikasi dalam pengobatan diabetes. Agregasi sangat penting dalam perangkat insulin jangka panjang, di mana kristal insulin telah diamati. Langkah awal dari asosiasi diri insulin adalah interaksi hidrofobik monomer untuk membentuk dimer, yang
selanjutnya dihubungkan ke agregat yang lebih besar. Prosesnya lebih disukai pada konsentrasi insulin yang lebih tinggi.84 Penambahan urea pada konsentrasi nontoksik (1,0-3 mg / mL) telah terbukti menghambat asosiasi mandiri insulin. Urea memecah "gunung es" di air cair dan berasosiasi dengan air terstruktur dengan ikatan hidrogen, mengambil bagian aktif dalam pembentukan struktur "kisi" yang lebih terbuka.85 Natrium salisilat meningkatkan penyerapan rektum sejumlah obat, semua mereka menunjukkan asosiasi sendiri. Touitou dan Fisher86chose methylene blue sebagai model untuk mempelajari efek natrium salisilat pada molekul yang diasosiasikan sendiri dengan proses susun. Metilena biru adalah pewarna aromatik planar yang membentuk dimer, trimer, dan agregat yang lebih tinggi dalam larutan berair. Para pekerja menemukan bahwa natrium salisilat mencegah asosiasi diri biru metilen. Penghambatan agregasi insulin porselin dengan natrium salisilat menghasilkan peningkatan kelarutan 7875 kali lipat.87 Sampel heparin komersial cenderung agregat dalam penyimpanan tergantung pada faktor-faktor seperti suhu dan waktu penyimpanan.88