5
BAB IITINJAUAN PUSTAKA
2.1 Protein
Protein berasal dari bahasa Yunani yaitu proteos, yang bearti yang utama atau yang di dahulukan. Kata ini diperkenalkan oleh ahli kimia Belanda, Geraldus Mulder (1802-1880). Ia berpendapat bahwa protein adalah zat yang paling penting dalam setiap organisme. Molekul protein mengandung unsur-unsur C, H, O, dan unsur khusus yang terdapat di dalam protein dan tidak terdapat di dalam molekul
karbohidrat dan lemak ialah nitrogen (N). Protein mempunyai molekul besar
dengan bobot molekul bervariasi antara 5000 sampai jutaan. Ada 20 jenis asam
amino yang terdapat dalam molekul protein. Asam-asam amino ini terikat satu
dengan lain oleh ikatan peptida. Protein mudah dipengaruhi oleh suhu tinggi, pH
dan pelarut organik (Sibagariang, 2010; Sediaoetama, 2008; Poedjiadi, 1994). Tumbuhan membentuk protein dari CO2, H2O dan senyawa nitrogen.
Hewan yang makan tumbuhan mengubah protein nabati menjadi protein hewani.
Di samping digunakan untuk pembentukan sel-sel tubuh, protein juga dapat
digunakan sebagai sumber energi apabila tubuh kita kekurangan karbohidrat dan
lemak. Komposisi rata-rata unsur kimia yang terdapat dalam protein ialah sebagai
berikut: karbon 50%, hidrogen 7%, oksigen 23%, nitrogen 16%, belerang 0-3%
dan fosfor 0-3% (Poedjiadi, 1994).
2.1.1 Asam Amino
6
20 jenis asam amino yang berbeda, masing-masing memiliki struktur dasar yang
sama, yang membedakan hanyalah gugus R pada salah satu sisinya (Almatsier, 2004). Struktur dasar asam amino dapat dilihat pada Gambar 2.1.
H
NH2 C COOH
R
Gambar 2.1 Struktur Dasar Asam Amino (Almatsier, 2004)
2.1.2 Sifat-sifat asam amino
Pada umumnya asam amino larut dalam air dan tidak larut dalam pelarut
organik non polar seperti eter, aseton, dan kloroform. Sifat asam amino berbeda
dengan asam karboksilat maupun dengan sifat amina. Perbedaan sifat antara asam
amino dengan asam karboksilat dan terlihat pula pada titik leburnya. Asam amino
mempunyai titik lebur yang lebih tinggi bila dibandingkan dengan asam
karboksilat atau amina. Apabila asam amino larut dalam air, gugus karboksilat
akan melepas ion H+, sedangkan gugus amino akan menerima ion H+. Oleh
adanya gugus tersebut maka asam amino dapat membentuk ion yang bermuatan
positif dan juga bermuatan negatif (zwitterion) atau ion amfoter (Poedjiadi, 1994).
2.1.3 Klasifikasi Asam Amino
Tubuh memerlukan 20 jenis asam amino yang terdiri dari 11 asam amino
non-esensial dan 9 asam amino esensial. Asam amino non-esensial adalah asam
amino yang dapat disintesis tubuh yang sehat dalam jumlah yang cukup,
sedangkan asam amino esensial adalah asam amino yang tidak dapat disintesis
oleh tubuh dalam jumlah yang cukup sehingga harus terdapat dalam diet. Asam
7
dari fenilalanin. Metionin dan fenilalanin merupakan asam amino esensial
sehingga sistin dan tirosin harus dibentuk melalui asam amino esensial atau
langsung diperoleh dalam makanan. Oleh karena itu, sistin dan tirosin disebut
sebagai asam amino semi-esensial (Wardlaw, dkk., 2004). Klasifikasi asam amino
dapat dilihat pada Tabel 2.1 berikut:
Tabel 2.1 Klasifikasi Asam Amino
Asam Amino Esensial Asam Amino Semi
Esensial
Sumber: Wardlaw, dkk. (2004).
2.1.4 Penggolongan Protein
Menurut Budiyanto (2004), berdasarkan keanekaragaman penyusun
struktur protein maka penggolongan protein dilakukan dengan berbagai kriteria
sebagai berikut:
a. Berdasarkan bentuknya protein digolongkan atas dua golongan yaitu:
i. Protein fibriler (skleroprotein) yaitu protein yang berbentuk serabut. Contoh
protein fibriler adalah kolagen yang terdapat pada tulang rawan, miosin pada otot,
keratin pada rambut, dan fibrin pada gumpalan darah.
ii. Protein globuler (steroprotein) yaitu protein yang berbentuk bola. Protein ini
banyak terdapat pada bahan pangan seperti susu, telur dan daging.
b. Berdasarkan kelarutannya dalam air atau pelarut lain, protein digolongkan atas
8
i. Albumin: larut dalam air dan terkoagulasi oleh panas. Contohnya adalah
albumin telur, albumin serum, laktalbumin dalam susu.
ii. Globulin: tidak larut dalam air, terkoagulasi oleh panas. Contohnya adalah
miosinogen dalam otot dan ovoglobulin dalam kuning telur.
iii. Glutelin: tidak larut dalam pelarut netral, tetapi larut dalam asam atau basa
encer. Contohnya adalah glutelin gandum, orizenin beras.
iv.Prolamin (gliadin): larut dalam alkohol 70-80% dan tidak larut dalam air
maupun alkohol absolut. Contohnya adalah prolamin dalam gandum.
v. Protamin: larut dalam air dan tidak terkoagulasi dalam panas.
vi. Histon: larut dalam air dan tidak larut dalam amonia encer. Contohnya adalah
histon dalam hemoglobin.
c. Berdasarkan senyawa pembentuknya dibagi atas dua golongan yaitu:
i. Protein sederhana (protein saja) contohnya adalah hemoglobin.
ii. Protein konyugasi dan senyawa non protein: protein yang mengandung
senyawa lain yang non protein disebut protein konyugasi sedangkan protein yang
tidak mengandung senyawa non protein disebut protein sederhana. Contohnya
glikoprotein terdapat pada hati, lipoprotein terdapat pada susu dan kasein terdapat
pada kuning telur.
d. Berdasarkan asam amino pembentuknya, protein digolongkan sebagai berikut:
i. Protein sempurna (mengandung semua asam amino esensial).
ii. Protein kurang sempurna (hanya sedikit mengandung asam amino esensial).
iii. Protein tidak sempurna (tidak atau sedikit sekali mengandung asam amino
9
Menurut Girindra (1993), berdasarkan strukturnya protein digolongkan
atas empat golongan yaitu:
i. Struktur primer, pada struktur ini ikatan antar asam amino hanya ikatan peptida.
ii. Struktur sekunder adalah struktur protein di mana asam amino bukan hanya
dihubungkan oleh ikatan peptida tetapi juga diperkuat oleh ikatan hidrogen.
iii. Struktur tersier adalah rantai polipeptida yang cenderung untuk membentuk
struktur yang kompleks.
iv. Struktur kuartener adalah struktur yang terbentuk dari beberapa bentuk tersier.
Menurut Sediaoetama (2008), berdasarkan sumbernya protein digolongkan
atas dua yaitu:
i. Protein hewani adalah protein dalam bahan makanan yang berasal dari hewan.
Contohnya protein dari daging, protein susu, dan sebagainya.
ii. Protein nabati adalah protein yang berasal dari tumbuh-tumbuhan. Contohnya
protein dari jagung, terigu, kacang kedelai dan sebagainya.
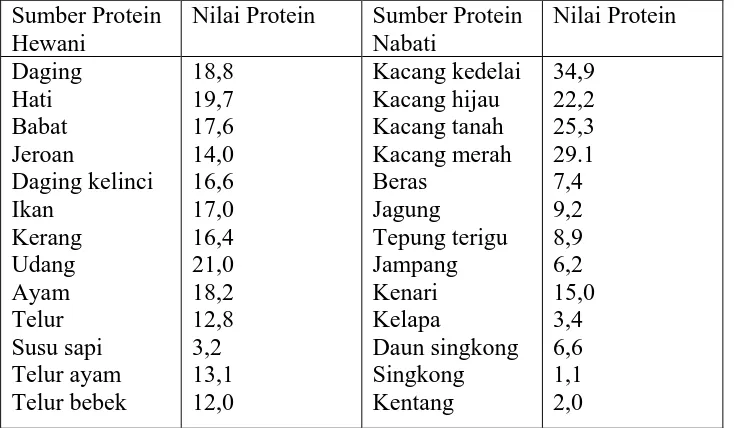
Nilai protein dalam berbagai bahan makanan dapat dilihat pada Tabel 2.2 berikut ini: Tabel 2.2 Nilai protein berbagai bahan makanan (gram/100 gram)
Sumber Protein Hewani
Nilai Protein Sumber Protein Nabati
10
2.1.5 Denaturasi ProteinDenaturasi protein terjadi akibat perubahan pada struktur sekunder, tersier,
dan kuaterner protein tanpa perubahan pada struktur primer. Denaturasi mengubah
sifat-sifat dari protein seperti hilangnya aktivitas enzim. Kebanyakan protein
makanan dikonsumsi dalam keadaan terdenaturasi. Denaturasi protein dapat
diinginkan maupun tidak tergantung pada keadaannya. Denaturasi meningkatkan
daya cerna dari suatu protein, terkadang pula membuat makanan menjadi lebih
lezat. Denaturasi dapat terjadi secara parsial atau sempurna, dapat pula bersifat
reversibel maupun irreversibel. Penyebab denaturasi protein adalah pemanasan,
perubahan pH yang drastis, deterjen, pelarut organik, perlakuan mekanis, urea dan
guanidin hidroklorida (Ustunol, 2015).
2.1.6 Fungsi Protein
Protein mempunyai fungsi bermacam-macam bagi tubuh, yaitu sebagai
enzim, zat pengatur pergerakan, pertahanan tubuh, dan alat pengangkut. Sebagai
zat-zat pengatur, protein mengatur proses-proses metabolisme dalam bentuk
enzim dan hormon. Proses metabolik (reaksi biokimiawi) diatur dan
dilangsungkan atas pengaturan enzim, sedangkan aktivitas enzim diatur lagi oleh
hormon, agar terjadi hubungan yang harmonis antara proses metabolisme yang
satu dengan yang lain (Sediaoetama, 2008).
Protein memegang peranan esensial dalam mengangkut zat-zat gizi dari
saluran cerna melalui dinding saluran cerna ke dalam darah, dari darah ke
jaringan-jaringan, dan melalui membran sel ke dalam sel-sel. Alat angkut protein
ini dapat bertindak secara khusus, misalnya, protein pengikat-retinol yang hanya
11
mangan dan zat besi, yaitu transferin, atau mengangkut lipida dan bahan sejenis
lipida yaitu lipoprotein. Bila kekurangan protein, menyebabkan gangguan pada
absorpsi dan transportasi zat-zat gizi (Almatsier, 2004).
Cairan tubuh terdapat di dalam tiga kompartemen: intraselular (di dalam
sel), ekstraselular/ interselular (di antara sel), dan intravaskular (di dalam
pembuluh darah). Kompartemen-kompartemen ini dipisahkan satu sama lain oleh
membran sel. Distribusi cairan di dalam kompartemen-kompartemen ini harus
dijaga dalam keadaan seimbang atau homeostatis. Keseimbangan ini diperoleh
melalui sistem kompleks yang melibatkan protein dan elektrolit. Penumpukan
cairan di dalam jaringan dinamakan edema dan merupakan tanda awal kekurangan
protein (Almatsier, 2004).
2.2 Non Protein Nitrogen
Dalam analisa bahan makanan dianggap bahwa semua nitrogen berasal
dari protein merupakan suatu hal yang tidak benar. Unsur nitrogen ini di dalam
makanan mungkin berasal pula dari ikatan organik lain yang bukan jenis protein,
misalnya urea dan berbagai ikatan amino yang terdapat dalam jaringan tumbuhan.
Nitrogen yang berasal dari ikatan yang bukan protein, disebut non protein
nitrogen (NPN), sebagai lawan dari protein nitrogen (PN) (Sediaoetama, 2008).
Pentingnya senyawa non protein nitrogen dalam makanan baru diperhatikan
beberapa tahun terakhir. Senyawa-senyawa ini termasuk asam amino, amin, amida,
senyawa nitrogen kuarterner, purin, pirimidin, dan N-nitrosoamida.
12
panggangan), dan sifat-sifat penting makanan lainnya (Pomeranz dan Meloan,
2000).
2.3 Penyakit Gizi yang Berhubungan dengan Protein
2.3.1 Akibat Kekurangan Protein
1. Kwashiorkor
Istilah Kwashioskor pertama kali diperkenalkan oleh Dr. Cecily Wiliams
pada tahun 1993 di Ghana, Afrika. Penyakit ini lebih banyak terdapat pada usia
dua hingga tiga tahun yang komposisi gizi makanannya tidak seimbang terutama
dalam hal protein (Yuniastuti, 2008).
Gejala penyakit Kwashioskor adalah pertumbuhan terhambat, otot-otot
berkurang dan lemah, bengkak (edema) terutama pada perut, kaki dan tangan,
muka bulat seperti bulan (moonface), gangguan psikimotor, nafsu makan kurang,
apatis (Widodo, 2009).
2. Marasmus
Marasmus umumnya merupakan penyakit pada bayi (12 bulan pertama),
karena terlambat diberi makanan tambahan. Hal ini dapat terjadi karena formula
pengganti ASI terlalu encer dan tidak higienis atau sering terkena infeksi.
Marasmus adalah penyakit kelaparan dan terdapat banyak diantara kelompok
sosial ekonomi rendah di sebagian besar negara sedang berkembang dan lebih
banyak dari kwashiorkor (Yuniastuti, 2008).
Gejala penyakit Marasmus adalah pertumbuhan yang terhambat, lemak
dibawah kulit berkurang, otot-otot berkurang dan melemah, muka seperti orang
13
2.3.2 Akibat Kelebihan ProteinProtein secara berlebihan tidak menguntungkan tubuh. Kelebihan asam
amino memberatkan ginjal dan hati yang harus memetabolisme dan mengeluarkan
kelebihan nitrogen. Kelebihan protein akan menimbulkan asidosis, dehidrasi,
diare, kenaikan amonia darah, kenaikan ureum darah, dan demam. Diet protein
tinggi yang sering dianjurkan untuk menurunkan berat badan kurang beralasan
(Almatsier, 2004).
2.4 Analisis Protein
Analisis protein dapat dilakukan dengan dua cara yaitu (i) secara langsung
menggunakan zat kimia yang spesifik terhadap protein dan (ii) secara tidak
langsung dengan menghitung jumlah nitrogen yang terkandung di dalam bahan
(Rhee, 2005).
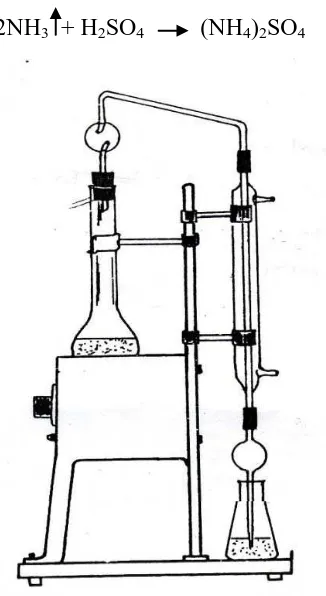
2.4.1 Metode Kjeldahl
Sejak abad ke-19, metode Kjeldahl telah dikenal dan diterima secara
universal sebagai metode untuk analisis protein dalam berbagai variasi produk
makanan dan produk jadi. Penetapan kadar protein dengan metode Kjeldahl
merupakan metode tidak langsung yaitu melalui penetapan kadar N dalam bahan
yang disebut protein kasar (Rhee, 2005; Estiasih, dkk., 2012).
Tahapan kerja pada metode Kjeldahl dibagi tiga yaitu:
a. Tahap Destruksi
Pada tahapan ini sampel dipanaskan dalam asam sulfat pekat sehingga
terjadi destruksi menjadi unsur-unsurnya. Elemen karbon, hidrogen teroksidasi
14
(NH4)SO4. Untuk mempercepat proses destruksi sering ditambahkan katalisator
berupa campuran Na2SO4 dan HgO (20:1). Ammonium sulfat yang terbentuk
dapat bereaksi dengan merkuri oksida membetuk senyawa kompleks, maka
sebelum proses destilasi Hg harus diendapkan lebih dahulu dengan K2S atau
dengan tiosulfat agar senyawa kompleks merkuri-ammonia pecah menjadi
ammonium sulfat. Gunning menganjurkan menggunakan K2SO4 atau CuSO4.
Dengan penambahan katalisator tersebut titik didih asam sulfat akan dipertinggi
sehingga dekstruksi berjalan lebih cepat. Tiap 1 gram K2SO4 dapat menaikkan
titik didih 3°C. Selain katalisator yang telah disebutkan tadi, kadang-kadang juga
diberikan selenium. Selenium dapat mempercepat proses oksidasi. Penggunaan
selenium lebih reaktif dibandingkan merkuri dan kupri sulfat tetapi selenium
mempunyai kelemahan yaitu karena sangat cepatnya oksidasi maka nitrogennya
justru mungkin ikut hilang (Sudarmadji, dkk., 1989).
Reaksi yang terjadi pada tahap dekstruksi adalah:
Protein + H2SO4 CO2 + H2O + (NH4)2SO4
15
b. Tahap DestilasiPada tahap destilasi, ammonium sulfat dipecah menjadi ammonia (NH3)
dengan penambahan NaOH sampai alkalis dan dipanaskan. Agar selama destilasi
tidak terjadi superheating ataupun pemercikan cairan atau timbulnya gelembung
gas yang besar maka dapat ditambahkan logam zink (Zn). Ammonia yang
dibebaskan selanjutnya akan ditangkap oleh larutan asam standar yang dipakai
dalam jumlah berlebihan. Agar kontak antara asam dan ammonia lebih baik maka
diusahakan ujung tabung destilasi tercelup sedalam mungkin dalam asam
(Sudarmadji, dkk., 1989).
Reaksi yang terjadi pada tahap destilasi adalah:
(NH4)2SO4 + 2NaOH 2NH3 + Na2SO4 + 2H2O
2NH3 + H2SO4 (NH4)2SO4
16
c. Tahap TitrasiLarutan asam pada penampung destilat yang dapat digunakan adalah
larutan standar asam kuat seperti asam sulfat atau larutan asam borat. Jika dipakai
larutan asam kuat standar maka titrasi yang dilakukan disebut titrasi kembali
sedangkan jika dipakai larutan asam borat maka disebut titrasi tidak langsung
(Kenkel, 2003).
Pada metode titrasi kembali, larutan asam standar yang berlebihan setelah
bereaksi dengan ammonia dititrasi dengan larutan standar NaOH. Titrasi ini
disebut titrasi kembali karena jumlah asam yang bereaksi dengan ammonia
tersedia dalam keadaan berlebih sehingga melewati titik ekuivalen reaksi. Oleh
karena itu, analis harus mengembalikan titik ekuivalen reaksi dengan titrasi
menggunakan NaOH (Kenkel, 2003).
Reaksi yang terjadi pada tahap titrasi adalah sebagai berikut:
H2SO4 + 2NaOH Na2SO4 + 2H2O
Menurut Sudarmadji, dkk. (1989), kadar nitrogen dalam sampel dapat
dihitung dengan rumus:
% N =ml NaOH (blanko – sampel)
berat sampel (g) x 1000 x N NaOH x 14,008 x 100%
Pada metode titrasi tidak langsung menggunakan asam borat, ammonia
bereaksi dengan asam borat menghasilkan garam asam borat yang bersifat netral
parsial. Garam tersebut dapat dititrasi dengan larutan asam standar. Jumlah larutan
asam yang diperlukan adalah proporsional dengan jumlah ammonia yang bereaksi
dengan asam borat. Titrasi ini disebut titrasi tidak langsung karena ammonia
ditentukan, bukan dititrasi. Ammonia ditentukan secara tidak langsung dengan
17
bereaksi dengan pentiter. Konsentrasi asam borat pada penampung destilat tidak
dimasukkan dalam perhitungan dan tidak perlu diketahui (Kenkel, 2003). Reaksi
yang terjadi adalah sebagai berikut:
NH3 + H3BO3 H2BO3- + NH4+
H2BO3- + H+ H3BO3
Menurut Sudarmadji, dkk. (1989), kadar nitrogen dalam sampel dapat
dihitung dengan rumus:
% N =ml HCl (sampel – blanko)
berat sampel (g) x 1000 x N NaOH x 14,008 x 100%
Setelah diperoleh %N, selanjutnya dihitung kadar protein dengan
mengalikan suatu faktor. Besarnya faktor perkalian N menjadi protein ini
tergantung pada persentase N yang menyusun protein dalam suatu bahan
(Sudarmadji, dkk., 1989).
Keuntungan menggunakan metode Kjeldahl ini adalah dapat diaplikasikan
untuk semua jenis bahan pangan, tidak memerlukan biaya yang mahal untuk
pengerjaannya, akurat dan merupakan metode umum untuk penentuan kandungan
protein kasar, dapat dimodifikasi sesuai kuantitas protein yang dianalisis. Adapun
kerugiannya adalah yang ditentukan adalah jumlah total nitrogen yang terdapat
didalamnya bukan hanya nitrogen dari protein, waktu yang diperlukan relatif lebih
lama (minimal 2 jam untuk menyelesaikannya), presisi yang lemah, pereaksi yang
digunakan korosif (Chang, 2003).
2.4.2 Metode Spektrofotometri
Penentuan kadar protein dengan menggunakan instrumen dibagi menjadi
18
280 nm dan ii) metode pembentukan warna dengan pereaksi tertentu (Simonian,
2005).
1. Metode pengukuran langsung pada panjang gelombang 205 nm dan 280 nm
Absorbansi pada panjang gelombang 205 nm dan 280 nm digunakan untuk
menghitung konsentrasi protein dengan terlebih dahulu distandarisasi dengan
protein standar. Metode ini dapat dengan mudah diaplikasikan dan sederhana,
cocok untuk larutan protein yang telah dimurnikan. Penetapannya berdasarkan
absorbansi sinar ultraviolet oleh asam amino triptopan, tirosin dan ikatan disulfida
sistein yang menyerap kuat pada panjang gelombang tersebut, terutama panjang
gelombang 280 nm (Simonian, 2005).
2. Metode pembentukan warna dengan pereaksi tertentu
a. Pereaksi Biuret
Prinsip penetapan protein metode Biuret adalah pada kondisi basa, Cu2+
membentuk kompleks dengan ikatan peptida (-CO-NH-) suatu protein
menghasilkan warna ungu, sehingga kadar protein sampel dapat ditetapkan
dengan spektrofotometer (Estiasih, dkk., 2012).
Keuntungan dari metode ini adalah prosedur yang sederhana, tidak
memerlukan biaya yang mahal, waktu yang digunakan relatif singkat, deviasi
warna sangat sedikit bila dibandingkan dengan Lowry, Bradford dan metode
turbidimetri sehingga absorpsi warnanya relatif stabil, sangat sedikit senyawa
yang berinteraksi dengan pereaksi Biuret, dan tidak mendeteksi nitrogen dari
sumber non-protein. Kerugiannya adalah kurang sensitif dibandingkan dengan
Lowry, konsentrasi garam ammonium yang sangat tinggi, adanya variasi warna
19
yang sangat tinggi dapat menyebabkan larutan menjadi buram sehingga tidak
dapat ditembus cahaya UV (Chang, 2003).
b. Pereaksi Lowry
Pada tahun 1951, Oliver H. Lowry memperkenalkan penggunaan pereaksi
ini yang merupakan perkembangan lebih lanjut dari Biuret. Metode ini diakui
cukup sensitif untuk menentukan konsentrasi total protein. Metode Lowry
menggabungkan reaksi biuret dengan reduksi reagen Folin-Ciocalteau fenol (asam
fosfomolibdat-fosfotungstat) oleh residu tirosin dan triptofan dalam protein.
Warna kebiruan yang terbentuk dibaca pada panjang gelombang 750 nm
(sensitivitas tinggi untuk konsentrasi protein tinggi) atau 500 nm (mempunyai
sensitivitas rendah untuk konsentrasi protein tinggi) (Krohn, 2005; Chang, 2003).
Keuntungan analisis dengan pereaksi ini adalah 50-100 kali lebih sensitif
daripada metode biuret, 10-20 kali lebih sensitif daripada metode absorpsi UV
pada 280 nm, kurang terganggu oleh turbiditas sampel, lebih spesifik daripada
metode lainnya, sederhana, dapat diselesaikan dalam 1 – 1,5 jam. Kerugian
analisis dengan pereaksi Lowry adalah variasi warnanya yang lebih banyak
dibanding dengan pereaksi Biuret, warna yang terbentuk tidak secara tepat
menggambarkan konsentrasi protein, reaksinya sangat dipengaruhi oleh
senyawa-senyawa pengganggu seperti glukosa dan lemak (Chang, 2003).
c. Pereaksi Bradford
Pada tahun 1976, Marion Bradford memperkenalkan penggunaan pereaksi
Coomassive Blue untuk penetapan secara kuantitatif konsentrasi total protein.
20
kemerahan menjadi kebiruan, dan absorpsi maksimum dari warna akan berubah
dari 465 nm menjadi 595 nm (Krohn, 2005; Chang, 2003).
Keuntungan analisis dengan pereaksi Bradford adalah cepat (reaksi hanya
berlangsung selama 2 menit), reprodusibel, sensitif, tidak mengalami gangguan
oleh ammonium sulfat, polifenol, karbohidrat atau kation-kation seperti K+, Na+,
dan Mg2+. Kerugiannya adalah analisis ini terganggu oleh adanya deterjen
nonionik dan ionik, kompleks warna-protein dapat bereaksi dengan kuvet kuarsa
(harus menggunakan kuvet kaca atau plastik), warna berbeda tergantung pada
jenis protein sehingga protein standar harus dipilih dengan hati-hati (Chang,
2003).
2.4.3 Metode Titrasi Formol
Larutan protein dinetralkan dengan basa (NaOH), kemudian ditambahkan
formalin akan membentuk dimethilol. Dengan terbentuknya dimethilol ini berarti
gugus aminonya sudah terikat dan tidak akan mempengaruhi reaksi antara asam
(gugus karboksil) dengan basa NaOH sehingga akhir titrasi dapat diakhiri dengan
tepat. Indikator yang digunakan adala fenolftalein, akhir titrasi bila tepat terjadi
perubahan warna menjadi merah muda yang tidak hilang dalam 30 detik. Titrasi
formol ini hanya tepat untuk menentukan suatu proses terjadinya pemecahan
protein dan kurang tepat untuk penentuan protein (Sudarmadji, dkk., 1989).
2.4.4 Metode Dumas
Pada metode ini sampel dioksidasi pada suhu sangat tinggi (700-900°C).
Hasil oksidasi menghasilkan gas O2, N2 dan CO2. Gas nitrogen yang dilepaskan
dikuantitasi menggunakan kromatografi gas dengan detektor konduktivitas termal
21
dikonversi. Jumlah nitrogen dalam sampel sebanding dengan kadar proteinnya
(Chang, 2003).
Keuntungan metode ini adalah tidak memerlukan zat kimia berbahaya,
analisis dapat diselesaikan dalam waktu 3 menit, instrumen otomatis terbaru dapat
menganalisis 150 sampel secara bersamaan. Adapun kekurangan metode ini
adalah membutuhkan instrumen analisis yang mahal, mengukur total nitrogen,
bukan hanya mengukur nitrogen yang berasal dari protein (Chang, 2003).
2.5 Pakkat (Calamus caesius Blume.)
Pakkat merupakan makanan unik berbuka puasa masyarakat di Mandailing
Natal dan di Medan yang diambil dari bagian dalam rotan muda. Pakkat ini dapat
dikonsumsi dengan cara dibakar dan direbus. Proses pembakaran biasanya
dilakukan dengan menggunakan kayu bakar dan dibakar di atas api secara
langsung. Pakkat ini sendiri sangat diminati selain karena dipercaya dapat
menyembuhkan berbagai penyakit diantaranya kencing manis dan malaria, juga
memiliki khasiat sebagai pembangkit nafsu makan disaat berbuka puasa ataupun
sahur (Harrist, 2014).
Menurut Herbarium Medanense (2015), klasifikasi pakkat adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Kelas : Monocotyledoneae
Ordo : Arecales
Famili : Arecaceae
Genus : Calamus
22
2.5.1 Deskripsi RotanRotan berasal dari bahasa melayu yang berarti tanaman yang tumbuh memanjat. Batang rotan memiliki ciri dan sifat berbeda-beda, tergantung pada jenis dan varietasnya. Ukuran ruas pada sebatang rotan berbeda-beda. Tanaman
rotan pada umumnya tumbuh berumpun dan mengelompok, maka umur dan
tingkat ketuaan rotan yang siap dipanen berbeda. Oleh karena itu, pemungutan
rotan dilakukan secara tebang pilih. Tanda-tanda rotan siap dipanen adalah daun
dan durinya sudah patah; warna durinya berubah menjadi hitam atau kuning
kehitam-hitaman dan sebagian batangnya sudah tidak dibalut oleh pelepah daun
(Sinambela, 2011).
2.5.2 Tempat Tumbuh dan Penyebaran Rotan
Tempat tumbuh rotan pada umumnya di daerah tanah berawa, tanah
kering, hingga tanah pegunungan. Semakin tinggi tempat tumbuh semakin jarang dijumpai jenis rotan. Tanaman yang tumbuh dan merambat pada suatu pohon akan memiliki tingkat pertumbuhan batang yang lebih panjang dan jumlah batang dalam satu rumpun lebih banyak dibandingkan dengan rotan yang menerima sedikit cahaya matahari akibat tertutup oleh cabang, ranting dan daun pohon (Sinambela, 2011). 2.5.3 Pemanfaatan Rotan
Batang rotan yang sudah tua banyak dimanfaatkan untuk bahan baku
kerajinan dan perabot rumah tangga. Batang yang muda digunakan untuk sayuran,
akar dan buahnya untuk bahan obat tradisional. Getah rotan dapat digunakan
untuk bahan baku pewarnaan pada industri farmasi. Rotan tidak hanya
dimanfaatkan sebagai bahan baku industri furniture tetapi juga sebagai makanan