UJI EFEKTIFITAS BAKTERI Pseudomonas fluorescens DARI BEBERAPA RIZOSFER TERHADAP PENYAKIT VIRUS PADA TANAMAN CABAI
(Capsicum annum L.) DI LAPANGAN
T E S I S
Oleh
N U R L I A N A
097001005/AET
SEKOLAH PASCASARJANA FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
UJI EFEKTIFITAS BAKTERI Pseudomonas fluorescens DARI BEBERAPA RIZOSFER TERHADAP PENYAKIT VIRUS PADA TANAMAN CABAI
(Capsicum annum L.) DI LAPANGAN
.
T E S I S
Untuk Memperoleh Gelar Magister Pertanian dalam Program Studi Agroekoteknologi pada Fakultas Pertanian Universitas Sumatera Utara
Oleh :
N U R L I A N A
097001005
SEKOLAH PASCASARJANA FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
Judul Tesis : UJI EFEKTIFITAS BAKTERI Pseudomonas fluorescens DARI BEBERAPA RIZOSFER TERHADAP PENYAKIT VIRUS PADA TANAMAN CABAI (Capsicum annum L.) DI LAPANGAN
Nama Mahasiswa : NURLIANA
Nomor Pokok : 097001005
Program Studi : Agroekoteknologi
Menyetujui
Komisi Pembimbing
( Dr. Ir. Hasanuddin, MS. )
Ketua
( Dr. Lisnawita, SP, M.Si.)
anggota
Ketua Program Studi
( Prof. Dr. Ir. Abdul Rauf, MP.)
Dekan
Telah diuji pada tanggal
: 30 Agustus 2012
PANITIA PENGUJI TESIS
Ketua
:
Dr. Ir. Hasanuddin, MS.
Anggota
:
Dr. Lisnawita, SP, M.Si.
Penguji
:
1.
Prof. Dr. Ir. Darma Bakti, MS.
ABSTRACT
Nurliana, 2012, Effectiveness Test of Pseudomonas fluorescens Bacterium of Several Rizosfers on the Virus–Contaminated Disease in Chili Plants (Capsicum annum L.) in the Field, under the supervision of Hasanuddin and Lisnawita.
Virus is the main disease for chili plants because, in terms of economy, this disease decreases chili production up to 100% that results in the decrease of the farmers’ income. Various control methods have been applied to reduce the virus infection and one of them is by using the resistance induction agents against P. fluorescence. Pseudomonas fluorescence can be isolated from various plant rizosfer. Thus, the purpose of this study conducted in the Plant Disease Laboratory, Faculty of Agriculture, the University of Sumatera Utara and in the Demonstration Plot, Faculty of Agriculture, The Islamic University of Sumatera Utara, Gedung Johor Subdistrict from January to October 2011 was to 1) find out the effectiveness of P. fluorescence bacterium from various rizosfers as the agents of resistance induction to control the virus –contaminated diseases in chili plants, 2) find out the most effective way to apply the P. fluorescence bacterium as the agents of resistance induction to control the virus –contaminated diseases in chili plants. This study consisted of 4 (four) stages such as 1. the Exploration of the P. fluorescence bacterium from various rizosfers (bamboo, Napier/elephant grass, reed), 2. Biofertilizer and bioprotecting tests, 3. the Application test through roots and leaves, and 4. Coating seed test by applying P. fluorescence bacterium. The result of this study showed that P. fluorescence bacterium was very effective as the agents of resistance induction on the virus–contaminated disease in chili plants in the field. This effectiveness was shown through a longer incubation period, low attack intensity of virus-contaminated virus, increasing germination rate of chili seed, and increasing growth, development and production of chili plants.
ABSTRAK
Nurliana, 2012. Uji Efektifitas Bakteri Pseudomonas fluorescens dari beberapa Rizosfer terhadap Penyakit Virus pada Tanaman Cabai (Capsicum annum L.) di Lapangan. di bawah bimbingan Hasanuddin dan Lisnawita.
Virus merupakan penyakit utama pada tanaman cabai karena dari segi ekonomi menurunkan produksi tanaman sampai 100%, yang berakibat pada penurunan pendapatan petani. Berbagai metode pengendalian telah dilakukan untuk mengurangi infeksi virus, salah satunya adalah dengan menggunakan agens induksi ketahanan P. fluorescens. Pseudomonas fluorescens dapat diisolasi dari berbagai rizosfer tanaman. Oleh karena itu tujuan penelitian ini adalah : 1). Mengetahui efektifitas bakteri P. fluorescens dari berbagai rizosfer sebagai agens induksi ketahanan untuk mengendalikan penyakit virus pada tanaman cabai. 2). Mengetahui cara aplikasi bakteri P. fluorescens yang paling efektif sebagai agens induksi ketahanan untuk mengendalikan penyakit virus pada cabai. Penelitian dilaksanakan pada dua tempat yaitu di Laboratorium Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara Medan, dan di lahan percobaan Fakultas Pertanian Universitas Islam Sumatera Utara Medan, Kecamatan Gedung Johor. Penelitian dilaksanakan pada bulan Januari 2011 sampai dengan Oktober 2011. Penelitian terdiri dari 4 tahap pengujian yaitu 1. Eksplorasi bakteri P.fluorescens dari berbagai rizosfer (bambu, rumput gajah dan gelagah). 2. Uji biofertilizer dan bioprotecting, 3. Uji Aplikasi melalui akar dan daun, 4. Uji seed coating dengan pemberian bakteri P.fluorescens. Hasil penelitian menunjukkan bakteri P.fluorescens sangat efektif sebagai agens induksi ketahanan terhadap penyakit virus pada tanaman cabai di lapangan. Bakteri P. fluorescens asal gelagah merupakan bakteri yang paling efektif sebagai agens induksi ketahanan terhadap penyakit virus pada tanaman cabai di lapangan. Hal ini ditunjukkan dengan periode inkubasi yang lebih lama, rendahnya intensitas serangan penyakit virus, meningkatnya daya kecambah benih cabai, meningkatnya pertumbuhan, perkembangan dan produksi tanaman cabai.
KATA PENGANTAR
Puji syukur kehadirat Allah SWT yang telah memberikan kesempatan dan
rahmat-Nya kepada penulis dalam menyelesaikan tesis yang berjudul Uji Efektifitas Bakteri Pseudomonas fluorescens dari beberapa Rizosfer terhadap Penyakit Virus pada Tanaman Cabai (Capsicum annum L.) di Lapangan. Tesis merupakan salah satu syarat untuk mendapatkan gelar Magister Pertanian pada
Program Studi Agroekoteknologi, Program Pascasarjana Fakultas Pertanian
Universitas Sumatera Utara.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Komisi
Pembimbing Dr. Ir. Hasanuddin, MS., selaku Ketua dan Dr. Lisnawita, SP, M.Si,
selaku Anggota.
Demi kesempurnaan penulisan ini penulis mengharapkan adanya kritik dan
saran yang bersifat membangun sehingga dapat bermanfaat untuk penulisan
selanjutnya.
Medan, Agustus 2012
UCAPAN TERIMA KASIH
Alhamdulillah, Puji syukur kehadirat Allah SWT yang telah memberikan
kesempatan dan rahmat-Nya kepada penulis dalam menyelesaikan tesis pada Program
Studi Magister Agroekoteknologi, Program Pascasarjana Fakultas Pertanian
Universitas Sumatera Utara.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Dr. Ir.
Hasanuddin, MS, selaku ketua komisi pembimbing dan Ibu Dr. Lisnawita, SP, M.Si,
Prof. Dr. Ir. Darma Bakti, MS., Dr. Ir. Lollie Agustina P.Putri, M.Si, dan Prof. Dr.
Dra. Maryani Cyccu Tobing, MS., selaku dosen penguji yang telah banyak
memberikan saran, masukan dan bimbingan yang sangat berguna bagi penulis dalam
menyelesaikan tesis ini.
Terima kasih penulis sampaikan kepada Prof. Dr. Ir. Darma Bakti, MS,
selaku Dekan Fakultas Pertanian Universitas Sumatera Utara, Prof. Dr. Ir. Abdul
Rauf, MS dan Dr. Ir. Lollie Agustina P.Putri, M.Si, selaku Ketua dan Sekretaris
Program Studi Pascasarjana Agroekoteknologi beserta staff Fakultas Pertanian.
Rektor Universitas Sumatera Utara Prof. Dr. dr. Syahril Pasaribu, DTM&H,
MSc(CTM). Sp.A(K), Direktur Pascasarjana Universitas Sumatera Utara Prof. Dr. Ir.
A. Rahim Matondang, MSIE.
Terima kasih yang sangat mendalam penulis ucapkan kepada keluarga yaitu
ayahanda Alm. Bagio dan ibunda Hj. Nurhaidah br. Simorangkir, suami tercinta
Rafiqatul Hasanah HD dan Nurul ‘Izzah HD, kakak dan adik yang telah memberikan
kasih sayang, materi dan dorongan semangat sehingga penulis berhasil menyelesaikan
studi ini.
Terimakasih kepada teman-teman angkatan 2009, teman-teman di
Laboratorium Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara
atas bantuan yang tak ternilai harganya. Semua pihak yang telah membantu penulis
dalam menyelesaikan tesis ini yang tidak dapat disebutkan satu persatu. Semoga budi
baik yang telah diberikan menjadi amal ibadah dan mendapat rahmat dari Allah SWT.
Amin.
Medan, Agustus 2012
RIWAYAT HIDUP
Nurliana, lahir sebagai anak kedua dari enam bersaudara pada tanggal 09 Pebruari 1973 di Marbau Selatan, Labuhan Batu Utara. Menempuh pendidikan formal mulai
dari sekolah dasar di SD Negeri 112315 Marbau Selatan selesai pada tahun 1985,
melanjutkan ke SMP PGRI Marbau selesai pada tahun 1988. Pendidikan Sekolah
Menengah Atas di tempuh di SMA Negeri 2 Rantauprapat yang diselesaikan pada
tahun 1991, dan lulus dari Fakultas Pertanian Universitas Islam Sumatera Utara
(UISU) Medan pada tahun 1995.
Tahun 1997-2011 penulis bekerja di salah satu Lembaga Swadaya Masyarakat
(LSM) di Medan, yang bergerak di bidang Advokasi Petani.
Pada tahun 2009, penulis melanjutkan kuliah di Sekolah Pascasarjana
DAFTAR ISI
Pengendalian Hayati dan Mekanisme Ketahanan Penyakit ... 10
BAHAN DAN METODE ... 13
Isolasi Pseudomonas kelompok fluorescens dari rizosfer bambu, rumput gajah dan gelagah ... 15
Penyediaan Larutan Bakteri P. fluorescens ... 16
DAFTAR TABEL
No J u d u l Halaman
1. Uji kemampuan menfiksasi nitrogen (N) bebas ... 25
2. Uji aktifitas selulosa ... 26
3. Persentase perkecambahan benih cabai ... 28
4. Periode inkubasi penyakit akibat virus pada tanaman cabai ... 30
5. Persentase kejadian penyakit ... 32
6. Rataan tinggi tanaman (cm) pengamatan I sampai dengan pengamatan XII ... 34
DAFTAR GAMBAR
No J u d u l Halaman
1 Pseudomonas yang diisolasi dari rizosfer bambu, rumput gajah, dan
gelagah …………...……… 23
2 Pewarnaan gram ketiga isolate bakteri P. fluorescens asal; a).
DAFTAR LAMPIRAN
No J u d u l Halaman
1 Denah penelitian ………. 48
2 Denah plot ……….. 49
3 Deskripsi tanaman cabai dari benih LADO F1 cap Panah Merah... 50
4 Tabel rataan perkecambahan benih 3 hari setelah semai sampai dengan 9 hari setelah semai dan Tabel Sidik Ragam …………... 51 5 Tabel rataan tinggi tanaman (cm) pengamatan I sampai dengan pengamatan XII dan Tabel Sidik Ragam…... 54 6 Tabel rataan produksi per tanaman (gram) pengamatan I sampai dengan pengamatan VI dan Tabel Sidik Ragam …………...………. 66 7 Tabel kejadian penyakit (hari) pengamatan I sampai dengan pengamatan VIII dan Tabel Sidik Ragam ………..… 72 8 Tabel rataan periode inkubasi (hari) dan Tabel Sidik Ragam ……… 80
9 Media pertumbuhan bakteri ………... 81
10 Bahan uji pewarnaan gram ………. 82
11 Bahan uji fiksasi-N bebas ………... 83
ABSTRACT
Nurliana, 2012, Effectiveness Test of Pseudomonas fluorescens Bacterium of Several Rizosfers on the Virus–Contaminated Disease in Chili Plants (Capsicum annum L.) in the Field, under the supervision of Hasanuddin and Lisnawita.
Virus is the main disease for chili plants because, in terms of economy, this disease decreases chili production up to 100% that results in the decrease of the farmers’ income. Various control methods have been applied to reduce the virus infection and one of them is by using the resistance induction agents against P. fluorescence. Pseudomonas fluorescence can be isolated from various plant rizosfer. Thus, the purpose of this study conducted in the Plant Disease Laboratory, Faculty of Agriculture, the University of Sumatera Utara and in the Demonstration Plot, Faculty of Agriculture, The Islamic University of Sumatera Utara, Gedung Johor Subdistrict from January to October 2011 was to 1) find out the effectiveness of P. fluorescence bacterium from various rizosfers as the agents of resistance induction to control the virus –contaminated diseases in chili plants, 2) find out the most effective way to apply the P. fluorescence bacterium as the agents of resistance induction to control the virus –contaminated diseases in chili plants. This study consisted of 4 (four) stages such as 1. the Exploration of the P. fluorescence bacterium from various rizosfers (bamboo, Napier/elephant grass, reed), 2. Biofertilizer and bioprotecting tests, 3. the Application test through roots and leaves, and 4. Coating seed test by applying P. fluorescence bacterium. The result of this study showed that P. fluorescence bacterium was very effective as the agents of resistance induction on the virus–contaminated disease in chili plants in the field. This effectiveness was shown through a longer incubation period, low attack intensity of virus-contaminated virus, increasing germination rate of chili seed, and increasing growth, development and production of chili plants.
ABSTRAK
Nurliana, 2012. Uji Efektifitas Bakteri Pseudomonas fluorescens dari beberapa Rizosfer terhadap Penyakit Virus pada Tanaman Cabai (Capsicum annum L.) di Lapangan. di bawah bimbingan Hasanuddin dan Lisnawita.
Virus merupakan penyakit utama pada tanaman cabai karena dari segi ekonomi menurunkan produksi tanaman sampai 100%, yang berakibat pada penurunan pendapatan petani. Berbagai metode pengendalian telah dilakukan untuk mengurangi infeksi virus, salah satunya adalah dengan menggunakan agens induksi ketahanan P. fluorescens. Pseudomonas fluorescens dapat diisolasi dari berbagai rizosfer tanaman. Oleh karena itu tujuan penelitian ini adalah : 1). Mengetahui efektifitas bakteri P. fluorescens dari berbagai rizosfer sebagai agens induksi ketahanan untuk mengendalikan penyakit virus pada tanaman cabai. 2). Mengetahui cara aplikasi bakteri P. fluorescens yang paling efektif sebagai agens induksi ketahanan untuk mengendalikan penyakit virus pada cabai. Penelitian dilaksanakan pada dua tempat yaitu di Laboratorium Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara Medan, dan di lahan percobaan Fakultas Pertanian Universitas Islam Sumatera Utara Medan, Kecamatan Gedung Johor. Penelitian dilaksanakan pada bulan Januari 2011 sampai dengan Oktober 2011. Penelitian terdiri dari 4 tahap pengujian yaitu 1. Eksplorasi bakteri P.fluorescens dari berbagai rizosfer (bambu, rumput gajah dan gelagah). 2. Uji biofertilizer dan bioprotecting, 3. Uji Aplikasi melalui akar dan daun, 4. Uji seed coating dengan pemberian bakteri P.fluorescens. Hasil penelitian menunjukkan bakteri P.fluorescens sangat efektif sebagai agens induksi ketahanan terhadap penyakit virus pada tanaman cabai di lapangan. Bakteri P. fluorescens asal gelagah merupakan bakteri yang paling efektif sebagai agens induksi ketahanan terhadap penyakit virus pada tanaman cabai di lapangan. Hal ini ditunjukkan dengan periode inkubasi yang lebih lama, rendahnya intensitas serangan penyakit virus, meningkatnya daya kecambah benih cabai, meningkatnya pertumbuhan, perkembangan dan produksi tanaman cabai.
PENDAHULUAN
Latar Belakang
Cabai (Capsicum annum L.) merupakan salah satu sayuran paling penting di dunia dan di Indonesia merupakan salah satu komoditas unggulan hortikultura.
Tanaman cabai ditanam di seluruh provinsi di Indonesia dan memiliki nilai yang baik
sehingga mendapat prioritas untuk dikembangkan. Luas pertanaman cabai pada tahun
2008 mencapai 103,837 ha, menempati urutan pertama terluas dibandingkan dengan
tanaman sayuran lainnya (Direktorat Jenderal Hortikultura 2008), namun produksi
masih belum mencukupi kebutuhan nasional. Produksi baru mencapai 6.51 ton per ha
sementara potensinya bisa mencapai 20-40 ton per ha. Rendahnya produktivitas cabai
tersebut dapat disebabkan banyak faktor, salah satunya gangguan organisme
pengganggu tanaman, seperti virus (Agustin2010).
Beberapa jenis virus yang dilaporkan dapat menginfeksi tanaman cabai di
Indonesia diantaranya adalah cucumber mosaic virus (CMV), chilli veinal mottle virus (ChiVMV), tobacco mosaic virus (TMV), tomato mosaic virus (ToMV),
tobacco etch virus (TEV), pepper mottle virus (PeMV), tomato spotted wilt virus
(TSWV), potato virus Y (PVY) (Semangun 1991), dan Pepper yellow leaf curl virus
(PepYLCV) yang menyebabkan penyakit daun keriting kuning cabai merah.
Pepper yellow leaf curl virus (PepYLCV) menjadi salah satu faktor pembatas produksi tanaman cabai saat ini. Kerusakan langsung pada tanaman disebabkan oleh
imago dan nimfa Bemisia tabaci (kutu kebul) yang merupakan vektor virus
bercak nekrotik pada daun akibat rusaknya sel-sel dan jaringan daun. Ekskresi kutu
kebul menghasilkan madu yang merupakan media yang baik untuk tempat tumbuhnya
embun jelaga yang berwarna hitam sehingga menyebabkan proses fotosintesis tidak
berlangsung normal (Sudiono dan Purnomo, 2007).
Pengendalian secara alami yang dilakukan oleh petani saat ini adalah terbatas
pada hama vektor virus. Pengendalian tersebut antara lain menggunakan tanaman
perangkap hama di sekeliling pertanaman cabai seperti jagung, kacang panjang,
mentimun, paria, bunga tembelekan dan bunga matahari. Disamping itu penggunaan
pestisida nabati dari bahan alami seperti daun nimba. Terlihat upaya pengendalian
terbatas pada hama vektor penyakit virus saja. Namun upaya pengendalian di atas
belum memberikan hasil yang maksimal. Oleh karena itu diperlukan pengendalian
alternatif yaitu pengendalian penyakit dengan menggunakan agens hayati menjadi
pilihan untuk mengurangi penggunaan pestisida kimia yang mahal, menyebabkan
kerusakan lingkungan dan kesehatan petani.
Menurut Peraturan Menteri Pertanian Nomor 411 tahun 1995 tentang
pengertian agens hayati maka, agens hayati adalah setiap organisme yang meliputi
spesies, subspesies, varietas, semua jenis serangga, nematoda, protozoa, cendawan (fungi), bakteri, virus, mikoplasma, serta organisme lainnya dalam semua tahap
perkembangannya yang dapat dipergunakan untuk keperluan pengendalian hama dan
penyakit atau organisme pengganggu, proses produksi, pengolahan hasil pertanian,
dan berbagai keperluan lainnya (Menteri Pertanian RI, 1995).
untuk menghancurkan dinding sel patogen. Selain itu bakteri juga menghasilkan
hidrogen sianida dan antibiotik seperti pycocyanine dan phenazine yang dapat
menghambat pertumbuhan organisme penyebab penyakit. Pseudomonas fluorescens
juga memproduksi siderofor yang dapat mengkhelat besi dalam tanah, dan membuat
patogen sulit masuk ke jaringan tanaman. Senyawa giberellin yang dihasilkan oleh
P. fluorescens dapat meningkatkan pertumbuhan tanaman. Bakteri ini juga tidak
memiliki fitotoksisitas dan dapat digunakan bersama dengan pupuk hayati, sehingga
bakteri ini sesuai untuk semua tanaman
Pseudomonas fluorescens merupakan salah satu plant growth promoting rhizobacteria (PGPR) yang pertama sekali dikenalkan oleh Kloepper dan Schroth pada tahun 1904. Bakteri ini ditemukan berkolonisasi pada akar tanaman setelah
diinokulasikan ke benih yang dapat meningkatkan pertumbuhan tanaman. Secara
implisit dijelaskan bahwa PGPR memiliki kemampuan berkolonisasi pada akar
setelah inokulasi ke benih yang berkembangbiak pada .
spermosphere (wilayah sekitar
benih) dengan merespon eksudat yang dikeluarkan oleh benih untuk melekat pada
permukaan akar (Nelson, 2004).
Tujuan Penelitian
1. Mengetahui efektifitas bakteri P. fluorescens dari berbagai rizosfer sebagai agens hayati untuk mengendalikan penyakit virus pada tanaman cabai.
Hipotesis
1. Bakteri P. fluorescens dari berbagai sumber rizosfer mempunyai efektifitas yang berbeda.
2. Aplikasi bakteri P. fluorescens dengan cara yang berbeda akan menunjukan efektifitas yang berbeda.
Rumusan Masalah
Tingginya serangan penyakit virus pada tanaman cabai seperti pada varietas
Lado F1 dapat menurunkan produksi hingga 100%. Penularan penyakit virus sangat
cepat, dapat secara mekanik dan lewat benih. Petani cabai kurang mengetahui
penyebab penyakit dikarenakan virus dapat ditularkan oleh banyak vektor dan
memiliki kisaran inang yang luas.
Penggunaan agens hayati bakteri P. fluorescens dengan cara seed coating atau penyiraman langsung ke tanah akan menjadi solusi untuk memberi ketahanan
tanaman cabai terhadap penyakit virus di lapangan.
Manfaat Penelitian
Hasil penelitian diharapkan dapat memberikan informasi ke petani tentang
TINJAUAN PUSTAKA
Penyakit Pada Tanaman Cabai
Tanaman cabai rentan dengan serangan berbagai penyakit, baik yang
disebabkan oleh bakteri, virus, jamur maupun nematoda. Penyakit-penyakit yang
menyerang tanaman cabai seperti ; tobacco mosaic virus (TMV), cucumber mosaic virus (CMV), layu bakteri (Ralstonia solanacearum), rebah kecambah atau dumping off, virus gemini, bercak bakteri (Xanthomonas campestris), antraksnosa (Patek),
bercak daun cercospora, busuk daun (Phytophthora capsici), layu fusarium, bengkak akar (Meloidogyne, spp.), busuk basah bakteri (Erwinia carotovora), dan bercak kering bakteri (Xanthomonas campestris) (Duriat et al., 2007).
Penyakit yang disebabkan oleh virus menjadi organisme pengganggu tanaman
(OPT) utama yang menyebabkan kerugian pada usaha tani cabai. Menurut Duriat dan
Muharam (2003) ahli virologi seperti Neinhaus (1981) dan Kalloo (1994) telah
mencatat antara 13-35 jenis virus yang menyerang tanaman cabai di daerah tropis dan
sub tropis. Prevalensi penyakit virus ini dari waktu ke waktu terjadi perubahan seperti
hasil deteksi virus cabai yang dilakukan Balai Penelitian Tanaman Sayuran (Balitsa)
Lembang antara 1986-1995 . Hasil survei tahun 1986 dan 1990 dilaporkan urutan tiga
Penyakit virus kuning yang disebabkan oleh virus gemini TYLCV (Tomato Yellow Leaf Curl Virus) genomnya berupa DNA utas tunggal, berbentuk bundar dan terselubung dalam virion ikosahedral kembar (germinate). Penyakit ini tidak ditularkan oleh biji, tetapi dapat menular melalui penyambungan dan serangga vektor
B. tabaci. Penyakit virus kerupuk yang disebabkan oleh CPSV (Chili Puckery Stunt Virus) yang ditularkan oleh golongan aphid (Aphis gossypii) sebagai vektor virus dan dapat pula ditularkan lewat penyambungan. Penyakit virus mosaik keriting yang
disebabkan oleh PVY atau TEV atau CMV atau CVMV secara tunggal atau gabungan
yang ditularkan oleh vektor dari golongan aphid (Myzus persicae dan A. gossypii). Penyakit virus kerdil, nekrosis, mosaik ringan disebabkan oleh tobacco mosaic virus
(TMV) dan tomato mosaic virus (ToMV) dapat ditularkan secara kontak. Kisaran inang dari penyakit virus pada cabai juga sangat luas seperti tomat, tembakau,
ketimun, gulma berdaun lebar, kubis, kacang panjang, kumis kucing, cabai rawit dan
gulma babadotan.
Plant Growth Promoting Rhizobacteria (PGPR)
Istilah rizosfer pertama sekali diperkenalkan oleh Hiltner pada tahun 1904,
yang didefenisikan tanah yang mengelilingi akar yang dapat mempengaruhi
pertumbuhan mikroorganisme. Interaksi ini ditandai dengan adanya pemanfaatan
eksudat akar yang dikeluarkan akar oleh mikroorganisme dan sebaliknya
metabolisme di perakaran dipengaruhi oleh kerja mikroorganisme. Eksudat akar
fisik diantara akar dan organisme perakaran. Modifikasi biologi dan fisika tanah dari
rizosfer memberi kontribusi bagi pertumbuhan akar tanaman agar tetap survive
(Kelly, 2005).
Bakteri-bakteri yang hidup di sekitar perakaran ada yang menguntungkan.
Bakteri ini sering disebut dengan rizobakteri pemacu tumbuh tanaman (RPTT) atau
popular disebut plant growth promoting rhizobacteria (PGPR). Aktivitas rizobakteria ini memberi keuntungan langsung maupun tidak langsung. Pengaruh langsung PGPR
ini didasarkan atas kemampuannya menyediakan dan memobilisasi atau memfasilitasi
penyerapan berbagai unsur hara dalam tanah serta mensintesis dan mengubah
konsentrasi berbagai fitohormon pemacu tumbuh (Husen et al., 2006).
Dalam Supriadi (2006) menurut Lelliot dan Stead (1987), jenis-jenis agens
hayati dari kelompok bakteri yang pernah diteliti telah dirangkum oleh Sadler (2005),
yang meliputi Bacillus spp., B. cereus, B. polymyxa, B. subtilis, Burkholderia glume, Corynebacterium sp., Escherichia sp., Pseudomonas aeruginosa, P. fluorescens, Streptomyces mutabilis, dan actinomycetes. Diantara spesies bakteri tersebut, B. polymyxa dan Curtobacterium (Corynebacterium) flaccumfaciens pv. flaccumfaciens
perlu diwaspadai karena berpotensi menjadi patogen pada tanaman.
Menurut Nivedhitha et al. (2008), tiga bakteri dan satu Actinomycetes yang diisolasi dari rizosfer bambu menunjukkan daya hambat terhadap pertumbuhan
Fusarium, meningkatkan pertumbuhan tanaman, dan bertambahnya jumlah daun. Selanjutnya menurut Minorsky (2008), bakteri P. fluorescens B16 yang diisolasi dari perakaran tanaman Graminae menunjukan adanya kolonisasi yang dapat
buah tomat. Kemampuan untuk menfiksasi nitrogen, melarutkan fosfat, memproduksi
senyawa siderofor dan hidrogen sianida (HCN), enzim kitinase, protease, dan selulosa merupakan karakteristik rizobakteri yang diinginkan (Zhang, 2004). Oleh
karena itu untuk memperoleh rizobakteri yang berpotensi perlu dievaluasi berbagai
karakter tersebut. Salah satu kemampuan rizobakteri dari kelompok Bacillus spp. dan
Pseudomonas spp. yang telah dilaporkan adalah mampu melarutkan fosfat (Faccini et al., 2004).Selain itu P. fluorescens merupakan salah satu mikroorganisme antagonis yang diteliti secara intensif dan berpotensi besar untuk pengendalian beberapa
penyakit (Hasanuddin, 2003).
Bakteri Pseudomonas fluorescens
Pseudomonas fluorescens berbentuk gram negatif yang bersumber dari tanah dan air. Suhu perkembangan dari P. fluorescens antara 25-30°C tetapi juga dapat bertahan dalam suhu rendah 0°C. Pseudomonas fluorescens merupakan bakteri obligat aerob dan oksidase positif. Dalam kondisi anaerobik bakteri ini tidak
berkembang. Bakteri P. fluorescens mempunyai kemampuan dalam menghasilkan siderofor yang berguna sebagai pengkhelat besi ketika konsentrasi besi rendah.
Sebaliknya apabila konsentrasi besi tinggi, pyoverdine tidak diperlukan sehingga koloni bakteri tidak akan berpendar di bawah sinar ultraviolet. Di samping itu P. fluorescens juga menghasilkan viscosin yang dapat meningkatkan antivirality.
Metabolit sekunder yang dihasilkan P. fluorescens memainkan peranan penting dalam menekan perkembangan penyakit tanaman seperti antibiotik
pertumbuhan phytopatogen. Pseudomonas fluorescens menghasilkan hidrogen sianida, pyocheline siderophores dan pyoverdine. Pseudomonas fluorescens menghasilkan exopolysaccharides yang digunakan untuk perlindungan terhadap bakteriofag atau dehidrasi serta untuk pertahanan terhadap sistem kekebalan tubuh
inang. Pseudomonas fluorescens memiliki flagella yang berguna dalam proses metabolisme. Secara khusus, isolat P. fluorescens tertentu menghasilkan dari metabolit sekunder 2,4-diacetylphloroglucinol (2,4-DAPG) dan biokontrol properti
antiphytopathegenic dalam strain nya.
Semua isolat P. fluorescens yang diuji bersifat gram negatif, membentuk enzim katalase dan oksidase positif. Memerlukan oksigen untuk tumbuh (aerob),
mampu menghidrolisa pati dan arginin, membentuk enzim gelatinase, melakukan
denitrifikasi dan tidak mengakumulasi poly-hydroxybutirate (Arwiyanto et al., 2007).
Yanti et al., (2008), melaporkan aplikasi P. fluorescens pada tanaman cabai menunjukkan pertumbuhan yang bagus. Hal ini dilihat dari peningkatan tinggi
tanaman, jumlah daun, berat basah, berat kering tanaman dan hasil. Di samping itu
aplikasi P. fluorescens juga dapat meningkatkan pengurangan serangan penyakit pada tanaman cabai.
Menurut Kloepper (1996), ketahanan sistemik terinduksi (induced systemic resistance) bergantung pada kolonisasi sistem perakaran oleh PGPR. Kolonisasi oleh PGPR dapat terjadi melalui penyelubungan benih atau penambahan suspensi PGPR
Pengendalian Hayati dan Mekanisme Ketahanan Penyakit
Kerugian yang disebabkan oleh serangan penyakit cukup tinggi dengan
menurunnya produksi tanaman cabai. Tindakan pengendalian yang dilakukan selama
ini dengan menggunakan pestisida kimia. Disamping harganya mahal dan susah
didapat, pestisida kimia dapat berakibat pada kerusakan lingkungan dan kesehatan
petani. Hal ini menjadi tantangan besar bagi kita untuk mencari teknik pengendalian
yang lebih bersahabat dengan lingkungan dan kesehatan petani dalam melindungi
tanaman terhadap serangan berbagai penyakit pada tanaman cabai.
Pengendalian hayati dilihat dari aspek ekologi adalah suatu fase dari
pengendalian alami. Definisi pengendalian hayati adalah perbuatan parasitoid,
predator dan patogen dalam memelihara kepadatan populasi organisme pada tingkat
rata-rata yang lebih rendah dari pada apabila perbuatan itu tidak ada.
Beberapa mekanisme pengendalian hayati, antara lain adalah sebagai berikut
(Istikorini, 2002):
1. Antagonisme
Antagonis adalah mikroorganisme yang mempunyai pengaruh yang merugikan
terhadap mikrooraganisme lain yang tumbuh dan berasosiasi dengannya.
Antagonisme meliputi (a) kompetisi nutrisi atau sesuatu yang lain dalam jumlah terbatas tetapi diperlukan oleh OPT, (b) antibiosis sebagai hasil dari pelepasan antibiotika atau senyawa kimia yang lain oleh mikroorganisme dan berbahaya
2. Ketahanan Terimbas.
Ketahanan terimbas adalah ketahanan yang berkembang setelah tanaman
diinokulasi lebih awal dengan elisitor biotik (mikroorganisme avirulen, non patogenik, saprofit) dan elisitor abiotik (asam salisilik, asam 2-kloroetil fosfonik). Kacang buncis yang diimbas dengan Colletotrichum lindemuthianum ras non patogenik menjadi tahan terhadap ras patogenik (Agrios, 1988).
3. Proteksi Silang.
Tanaman yang diinokulasi dengan strain virus yang lemah hanya sedikit
menderita kerusakan, tetapi akan terlindung dari infeksi strain yang kuat. Strain
yang dilemahkan antara lain dapat dibuat dengan pemanasan in vivo, pendinginan
in vivo dan dengan asam nitrit. Proteksi silang sudah banyak dilakukan di banyak negara antara lain Taiwan dan Jepang.
Ketahanan sistemik terinduksi (KST) pada berbagai tanaman terhadap
serangan patogen akibat aplikasi agens penginduksi tidak terlepas dari peran
senyawa-senyawa tertentu dan PR-protein (Patogenesis Related-protein) seperti
peroksidase, kitinase, β-1,3 glukanase, β-1,4glukosidase, dan asam salisilat
sebagaimana ditunjukkan oleh peningkatan aktivitas dan kadarnya (Wei et al.,
1996).
Kessman et al. (1994) menyatakan, asam salisilat (AS) memegang peranan penting dalam KST. Asam salisilat terbentuk pada tanaman sebagai
reaksi terhadap infeksi patogen.Beberapa produk dari gen KST mempunyai sifat
antimikrobia atau dapat dimasukkan ke dalam kelas protein anti mikrobia. Protein
BAHAN DAN METODE
Tempat dan waktu
Penelitian dilakukan di Laboratorium Penyakit Tumbuhan Fakultas Pertanian
Universitas Sumatera Utara dan di kebun percobaan Fakultas Pertanian Universitas
Islam Sumatera Utara (UISU) Jl. Ekawarni Gedung Johor, dari Januari sampai
dengan Oktober 2011.
Bahan dan Alat
Bahan-bahan yang digunakan antara lain, daun pisang kepok, rizosfer bambu,
rumput gajah, dan gelagah, bahan medium Kings’ B, Medium Nutrient Agar (NA), benih cabai Lado F-1, dan pupuk kandang sapi.
Alat-alat yang digunakan antara lain, cawan petri, erlenmeyer 250 dan
erlenmeyer 500 ml, mikropipet dan tip 1 ml, autoklaf, gembor, tali, timbangan, cangkul, meteran dan alat tulis.
Metode Penelitian
Metode Penelitian menggunakan Rancangan Acak Kelompok (RAK)
Faktorial dengan 2 faktor dan 3 kali ulangan, yaitu :
Faktor Pertama ; cara aplikasi (A) terdiri dari 2 metoda, yaitu :
A1
A
= Aplikasi melalui akar.
Faktor kedua ; Penyelubungan benih (seed coating) (C) terdiri dari 3 taraf, yaitu :
C1
C
= Penyelubungan + P. fluorescens asal bambu
2
C
= Penyelubungan + P. fluorescens asal rumput gajah
3
Sehingga didapat 2 x 3 = 6 kombinasi perlakuan yaitu : = Penyelubungan + P. fluorescens asal gelagah
A1C1 A2C1
A1C2 A2C2
A1C3 A2C3
Data dianalisis dengan uji kontras dengan kontrol/pembanding tanpa aplikasi P. fluorescens.
Model Linier Rancangan Penelitian :
Yijk = µ + αj=1,2+ βj=1,2,3 + (αβ)ij + Kk=1,2,3 + Єijk dimana :
Yijk = Hasil pengamatan untuk faktor A taraf ke-i, faktor C taraf ke-j pada kelompok ke-k.
µ = Nilai tengah umum
αj = Pengaruh faktor A pada taraf ke-i
β j = Pengaruh faktor C pada taraf ke-j
(αβ)ij = Pengaruh interaksi AC pada taraf ke-i (dari faktor A) dan taraf ke-j (dari taraf C).
Kk = Pengaruh kelompok ke-k
Pelaksanaan Penelitian Di Laboratorium
Isolasi Pseudomonas kelompok fluorescens dari rizosfer bambu, rumput gajah dan gelagah.
Sebanyak 10 g akar dan butiran tanah yang melekat di permukaan akar di
rizosfer bambu, rumput gajah dan gelagah, disuspensikan dalam 90 ml aquadest steril.
Setelah itu suspensi dikocok menggunakan rotary shaker selama 30 menit dengan kecepatan 100 rpm. Suspensi yang diperoleh diencerkan menjadi 10-1, 10-2, 10-3, 10-4,
10-5 dan dilakukan plating pada pengenceran 10-3, 10-4, 10-5 sebanyak 0,1 ml pada media King’s B (agar 15 gr, bacto peptone 20 gr, glycerol 10 ml, dipotassium phosphate 1,5 g, magnesium sulfate 7 H2O 1,5 gr) (Biokar Diagnostic, 2009).
Setelah itu biakan diinkubasikan pada suhu 37o
Uji Pewarnaan Gram
C selama 24 jam. Setiap koloni
rizobakteri yang tumbuh diisolasi kembali, dan dibuat biakan murni.
Untuk mengetahui apakah bakteri yang didapat gram positif atau negatif
dilakukan pengujian gram (gram staining) dari biakan murni setiap isolat. Pewarnaan gram terdiri dari larutan A: crystal violet 2,0 g, ethyl alkohol (95%) 20,0 ml, larutan B: ammonium oxalate 0,8 g, H2O 80,0 ml. Selanjutnya larutan A dan Larutan B
dicampur, kemudian dimasukan dan disimpan dalam inkubator dengan suhu 300
Iodine (I
C
selama 1 x 24 jam sebelum digunakan. Kemudian larutan tersebut disaring dengan
kertas saring, dimasukkan ke dalam botol penyimpanan.
2) 1,0 g, potasium iodida (KI) 2,0 g, H2O 300,0 ml. Larutan iodine
digerus halus di dalam mortar, kemudian tambahkan air perlahan. Selanjutnya
campuran disimpan di dalam botol gelap selama 1 malam.
Pewarna tandingan,
Larutan stock : Safranin O 2,5 g, Ethyl alkohol 100,0 ml, Larutan Kerja : Larutan stok 10,0 ml, H2
Pengujian dilakukan dengan mengoles tipis suspensi dari koloni murni
bakteri berumur 24 jam pada gelas objek yang bersih kemudian dikering-anginkan.
Setelah kering difiksasi dengan cara melewatkan bagian bawah gelas objek di atas api
bunsen dua kali. Olesan bakteri digenangi dengan larutan kristal violet selama 1
menit. Kemudian dibilas dengan air kran selama beberapa detik. Selanjutnya dikering
anginkan dan digenangi kembali dengan larutan iodine dan dibiarkan selama 1 menit. Setelah itu dibilas dengan air kran selama beberapa detik, dan dikering anginkan.
Selanjutnya dibilas dengan alkohol 95% selama 30 detik, kemudian dikering
anginkan dan dibilas kembali dengan air kran selama 2 detik. Setelah itu biakan
digenangi dengan safranin selama 10 detik dan dibilas kembali dengan air kran
dengan cepat, lalu dikering anginkan. Hasil pewarnaan diamati di bawah mikroskop
kompaun dengan pembesaran 10x100 kali dengan menggunakan minyak imersi
(immersion oil). Sel-sel bakteri gram positif akan berwarna ungu hingga biru gelap sedangkan bakteri gram negatif akan berwarna merah (Departemen Pertanian Badan
Karantina Pertanian, 2008).
Penyediaan Larutan Bakteri P. fluorescens
Isolat P. fluorescens yang disiapkan untuk perlakuan benih ditumbuhkan dalam media Kings’B agar selama 1 x 24 jam. Koloni yang terbentuk selanjutnya
disuspensikan dalam media Kings’B cair 125 ml per rizosfer dan diguncang dengan
rotary shaker selama 7x24 jam dengan kecepatan 100 rpm. Setiap aplikasi dilakukan pembuatan suspensi yang baru.
Uji Biofertilizer
Uji Kemampuan Menfiksasi Nitrogen (N) Bebas.
Fiksasi N dari udara yang berkisar 78-80% dapat dilakukan oleh beberapa
bakteri yang hidup bebas maupun bersimbiosis dengan akar tanaman, salah satunya
adalah bakteri P. fluorescens.Pengujian dilakukan menurut Hara et al. (2009), dengan
membuat media mineral minimum tanpa N dengan komposisi sebagai berikut:
MgSO4.7H2O 25 g, FeSO4.7H2O 0,01 g, Na2MoO4.2H2O 0,01 g, MnSO4.5H2O
0,01 g, CaCl2 0,1 g, K2HPO4 dalam buffer NaCl (1 kali ; stok K2HPO4 200 kali
dibuat dari 2 g K2HPO4 dicampur 1 g NaCl dilarutkan dalam 10 ml akuades.Tuang
media dalam cawan petri dan diamkan semalam. Tumbukan bakteri isolat uji dengan
cara menggoreskan pada permukaan media. Inkubasi hingga 4 hari. Isolat yang
tumbuh disubkultur pada media yang sama hingga 3 kali selama 7 hari. Bakteri yang
pertumbuhannya stabil pada media ini merupakan bakteri penfiksasi N dari udara
Uji Bioprotecting Uji Aktivitas Selulosa
Selulosa merupakan penyusun dinding sel tanaman yang sukar didegradasi,
karena monomer glukosanya dihubungkan dengan ikatan β(1.4). Untuk meningkatkan
pemecahan ikatan B-(1.4) diperlulan enzim selulase dengan aktivitas tinggi.
Menurut Andro et al. (1984), media yang digunakan terdiri atas 4 bagian yaitu
larutan A yaitu CMC yang dibuat dengan mencampurkan NaCl 0,25 g dan K2HPO4
1,5 g ke dalam akuades 400 ml lalu dikocok dengan kecepatan 100 rpm selama 24
jam pada suhu 50°C. Larutan B yaitu MgSO4 1,0 M. Larutan C yaitu: Na2HPO4
3,0 g, NH4Cl 0,5 g, gliserol 2,5 ml, yeast ekstrak 0,5 g, agar 6,5 g dan akuades 100
ml. Larutan D: 7,5% (w/v) CaCl2.
Penyediaan Formulasi Talk P. fluorescens
Semua bahan disterilisasi secara terpisah dengan
autoklaf selama 20 menit. Larutan A dan C dicampur secara perlahan-lahan, lalu 1,0
ml larutan B dan 1,0 ml larutan D hingga larutan homogen. Campuran media uji
tersebut selanjutnya dituangkan ke dalam cawan petri (ө 9 cm). Setelah media padat
digoreskan isolat rizobakteri lalu diinkubasi selama 3 hari pada suhu ruang. Setelah
diinkubasi, media diberi pewarna dengan 10 ml congo-red (0,1%), lalu diinkubasi selama 10 menit, dicuci dengan larutan NaCl 1,0 M selama 15 menit dan diamati terbentuknya halo di sekitar koloni bakteri.
(CMC), 1 kg bedak (talk), dan ditambahkan sedikit demi sedikit kalsium karbonat
(CaCO3) hingga mencapai pH 7,0. Setelah itu disterilkan dengan autoklaf temperatur
1 ATM (1210C) selama 30 menit selama dua hari berturut-turut. Pseudomonas fluorescens ditumbuhkan pada media King’s B cair dengan volume 400 ml dan diguncang selama 48 jam dengan kecepatan 150 rpm. Kemudian dibuat formulasi
tepung bakteri yang berisi 109
Penyelubungan benih (Seed Coating)
cfu ditambah dengan 1 kg talk steril. Formulasi ini dapat disimpan pada suhu 4°C dengan kadar air 35% selama 1 bulan.
Proses penyelubungan benih (seed coating) dilakukan secara manual. Benih ditimbang sebelum dan sesudah di-coating untuk mengetahui bobot bahan coating
yang melekat. Campurkan benih dengan formulasi tepung bakteri dan diaduk merata
menggunakan magnetic stirer. Lama pengadukan 20 menit. Benih yang telah
di-coating kemudian dikeringkan selama 10 jam di bawah sinar matahari. Sebagai kontrol tanpa pemberian P. fluorescens (Setiyowati et al., 2007).
Di Lapangan Penyemaian Benih
Benih cabai ditanam pada polibek yang telah diisi media steril (tanah + pupuk
kandang dengan perbanding 2:1), kemudian persemaian disungkup dengan
menggunakan kain kassa.
Pengolahan Tanah
Satu bulan sebelum tanam, lahan dibersihkan dari gulma-gulma yang tumbuh
dan sisa tanaman atau sampah. Pencangkulan dilakukan dengan kedalaman 30-40
dengan luas 1 m x 1,3 m dengan jarak antar sub plot 50 cm, jarak antar main plot 75
cm sedangkan jarak antar ulangan 100 cm.
Lima belas hari sebelum tanam dilakukan pemberian pupuk kandang yang
sebelumnya telah dikomposkan. Keesokan harinya dilakukan pencincangan lalu
dibiarkan selama 7 (tujuh) hari. Setelah itu dilakukan penyiraman bedengan sampai
basah dan diberi mulsa dari bahan organik jerami. Lubang tanam dibuat dengan jarak
60 x 70 cm. Setiap plot terdiri dari 8 tanaman yang terdiri dari 4 tanaman sampel.
Lubang tanam dibuat 1 minggu sebelum tanam dan diberi pupuk kandang 1 kg
/lubang tanam. Pemberian mulsa dilakukan 1 minggu sebelum tanam.
Penanaman ke Lapangan
Satu bulan di persemaian, bibit cabai dapat dipindahkan ke lapangan.
Perpindahan dilakukan pada sore hari saat intensitas matahari rendah dengan jarak
tanam 60 x 70 cm.
Aplikasi bakteri P. fluorescens
Aplikasi bakteri P. fluorescens menggunakan larutan yang sebelumnya telah dipersiapkan di Laboratorium. Dari larutan diambil 5 ml dan dicampur dalam 1 liter
air dan disiramkan di sekitar akar sebanyak 250 ml per tanaman. Sedangkan
penyemprotan pada daun hingga basah merata. Aplikasi dilakukan 1 hari setelah
tanaman cabai pindah ke lapangan dengan interval waktu 1 minggu sekali sampai
Pemupukan dan Pemeliharaan
Pemupukan dilakukan 1 hari setelah pindah tanam ke lapangan, yaitu
pemberian pupuk kandang sapi 100 gr/tanaman dan diulang 2 minggu sekali. Setelah
cabai berumur 2 minggu di lapangan, tanaman diberi kayu sebagai penopang
tanaman, agar batang tanaman cabai tidak rebah sehingga dapat memperkokoh
tanaman. Penyiraman dilakukan setiap hari yaitu pagi dan sore hari.
Pengendalian Hama
Untuk pengendalian hama, digunakan pestisida organik sesuai dengan
kebutuhan.
Parameter Pengamatan
Persentase Perkecambahan benih
Persentase perkecambahan benih dihitung pada umur 3, 6, 9 hari setelah semai
(hss). Persentase perkecambahan benih dihitung berdasarkan persentase jumlah benih
berkecambah (BK) pada pengamatan pertama (3 hss), kedua (6 hss) dan ketiga (9
hss), dengan rumus.
Keterangan :
BK : Benih berkecambah (Setiyowati et al., 2007).
ΣBK peng. 1 + BK peng.2 + BK peng. 3
% Perkecambahan = --- x 100 %
Periode Inkubasi
Periode inkubasi yaitu dimana gejala penyakit pertama sekali muncul.
Pengamatan dimulai dari sehari setelah tanaman dipindah ke lapangan untuk semua
perlakuan hingga ditemukan gejala penyakit tersebut. Pengamatan dihentikan
terhadap tanaman yang telah ditemukan gejala.
Persentase Kejadian Penyakit
Persentase kejadian penyakit dilakukan setiap 1 minggu sekali setelah pindah
tanam ke lapangan sampai pengamatan ke-7. Persentase kejadian penyakit
menggunakan rumus sbb:
Dimana :
KP = kejadian penyakit,
a = Jumlah tanaman terserang.
b = Total jumlah tanaman (Abbot, 1925).
Tinggi Tanaman
Pengukuran tinggi tanaman dilakukan dengan mengukur mulai dari pangkal
batang hingga puncak tertinggi tanaman. Pengukuran dilakukan pada tanaman sampel
mulai umur 1 minggu setelah di lapangan (minggu ke-5 setelah semai) dengan
interval waktu 1 minggu sekali sampai pengamatan ke-12.
a
Produksi cabai per tanaman
Produksi dihitung mulai panen pertama dengan ciri cabai telah berwarna
merah merata, sampai dengan panen ke-6. Pemanenan dilakukan dengan interval
waktu 4 hari sekali dengan menimbang berat cabai yang dipanen dari setiap plot
HASIL DAN PEMBAHASAN
Isolasi Pseudomonas kelompok fluorescens dari rizosfer bambu, rumput gajah dan gelagah.
Hasil isolasi P. fluorescens dari tiga rizosfer yaitu bambu, rumput gajah dan gelagah, sebelum dan sesudah menggunakan sinar ultraviolet dapat dilihat pada
Gambar 1 di bawah ini.
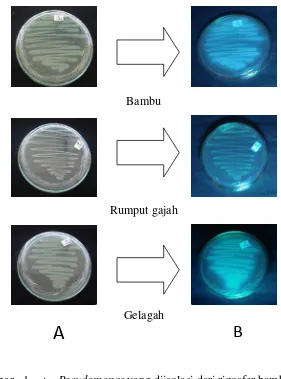
Gambar 1 : Pseudomonas yang diisolasi dari rizosfer bambu, rumput gajah, dan gelagah.
A = sebelum disinari dengan UV. B = setelah disinari dengan UV.
A
B
Bambu
Dari Gambar 1 terlihat bakteri kelompok pseudomonas yang diisolasi dari ketiga rizosfer tanaman bambu, rumput gajah dan gelagah masuk dalam golongan
fluorescens. Hal ini ditandai dengan ke-3 isolat mempunyai koloni bentuk bulat, tepi rata, fluidal dan berpendar di media King’s B setelah disinari UV 620 nm (Gambar 1
B). Pijaran yang dihasilkan P. fluorescens berasal dari pigmen pyoverdin dan atau
fenazin yang dihasilkan bakteri di dalam medium King’s B, sehingga terlihat berpijar bila terkena sinar UV.
Menurut Todar (2004), bakteri Pseudomonas paling dominan menghasilkan
pyocyanin yang merupakan pigmen biru-hijau, sedangkan non patogen saprofit P. fluorescens memproduksi pigmen fluorescent yang dapat larut dan kehijauan.
Uji Pewarnaan Gram
Gambar 2 Pewarnaan gram ketiga isolate P.fluorescens asal : a. bambu, b. rumput gajah, c. gelagah.
Hasil ini diperkuat dengan pengujian pewarnaan gram yang dilakukan. Pada
pengujian pewarnaan gram diperoleh ketiga isolat yang didapat masuk dalam
kelompok bakteri gram negatif. Hal ini dilihat ketiga isolat berwarna merah (Gambar
2). Bakteri ini berbentuk batang lurus atau lengkung, ukuran tiap sel bakteri 0.5-0.1
1μm x 1.5-4.0 μm, tidak membentuk spora dan bereaksi negatif terhadap pewarnaan
gram (Brock & Madigan 1988 dalam Hasanuddin, 2003). Begitu pula menurut Meera
dan Balabaskar (2012), dari hasil uji biokimia untuk identifikasi P. fluorescens
dengan pewarnaan gram menghasilkan gram negatif.
Uji Kemampuan Menfiksasi Nitrogen (N) Bebas.
Pengujian kemampuan menfiksasi N bebas dari ketiga isolat dapat dilihat
pada Tabel 1.
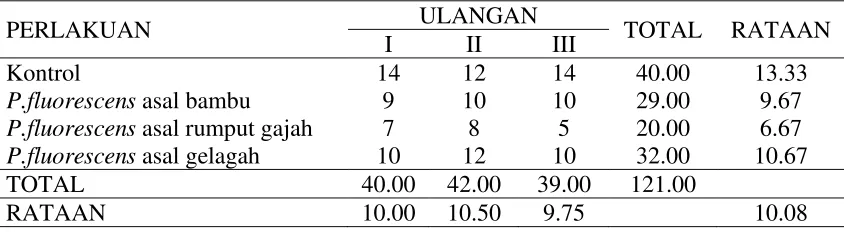
Tabel 1: Uji kemampuan menfiksasi nitrogen (N) bebas
Perlakuan Respon pada pengamatan
4 hsi 8 hsi 12 hsi
P.fluorescens asal bambu (+) (+) (-)
P.fluorescens asal rumput gajah (-) (-) (-)
P.fluorescens asal gelagah (-) (-) (-)
Keterangan :
+ = hidup.
- = mati
hsi = hari setelah inkubasi
Pengujian kemampuan menfiksasi N bebas dari ketiga isolat dapat dilihat pada
Tabel 1. Dari Tabel 1 dapat dilihat pada pengamatan 4 hsi dan 8 hsi P. fluorescens
asal bambu memiliki kemampuan menfiksasi N bebas. Hal ini ditandai dengan
terjadinya pertumbuhan bakteri (+). Sedangkan P. fluorescens asal rumput gajah dan gelagah mulai 4 hsi sampai 12 hsi tidak memiliki kemampuan menfiksasi N bebas
ditandai dengan tidak terjadinya pertumbuhan bakteri (-). Pseudomonas fluorescens
yang hidup di daerah perakaran tanaman dapat berperan sebagai jasad renik pelarut
fosfat, mengikat nitrogen dan menghasilkan zat pengatur tumbuh bagi tanaman
dapat dimanfaatkan sebagai pupuk biologis yang dapat menyediakan hara untuk
pertumbuhan tanaman.
Selanjutnya Susilowati et al. (2007) menyatakan tanaman membutuhkan hara N yang cukup besar, dan kebutuhan ini dapat dipenuhi dari aktivitas bakteri penambat
N2
Fiksasi nitrogen sangat penting untuk lingkungan dan pertanian
berkelanjutan. Sebagian besar tanaman mengasimilasi nitrogen hanya dari tanah
melalui penambahan pupuk. Sumber alternatif lain adalah rhizobia yang mampu menyebabkan pembentukan nodula pada akar dari tanaman legum sebagai tanaman
inang. Organ tanaman khusus diserang oleh bakteria yang menfiksasi nitrogen dalam
keadaan bakteroid endosimbiotik dalam sel tanaman. Proses ini melibatkan
pengenalan spesifik dan diferensiasi berkembang baik bakteri dan sel tanaman
inang. Rhizobia berhadapan dengan bermacam-macam kondisi lingkungan seperti bakteria yang hidup bebas dalam tanah, selama proses infeksi dan seperti diferensiasi
bakteroid dalam sel tanaman (Dewi, 2007).
, baik yang berada di sekitar perakaran dan bintil akar (rhizosfer) maupun di dalam jaringan tanaman (diazotrof endofit).
Uji Aktivitas Selulosa
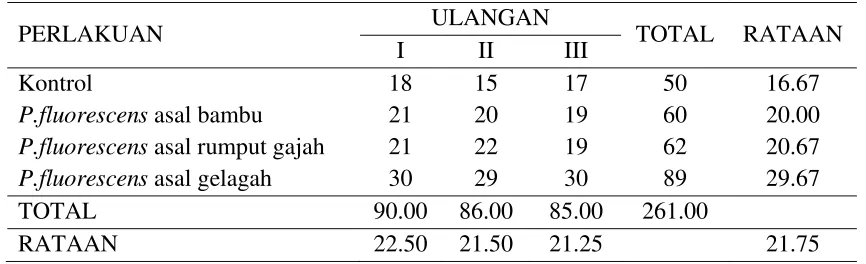
Hasil uji coba analisis aktivitas selulosa dapat dilihat pada Tabel 2 berikut :
Tabel 2 : Uji aktifitas selulosa
Perlakuan Pengamatan
3 hsi
P.fluorescens asal bambu (+)
P.fluorescens asal rumput gajah (-)
Keterangan :
+ = terbentuk halo
- = tidak terbentuk halo
Dari Tabel 2, didapat P. fluorescens asal bambu dan gelagah membentuk zona bening di sekitar daerah pertumbuhan bakteri pada 3 hsi, yang menunjukkan Selulosa
telah dihidrolisis oleh bakteri menjadi sakarida yang lebih sederhana. Sedangkan uji
P. fluorescens asal rumput gajah memberikan hasil yang sebaliknya yakni tidak terbentuk zona bening (-).
Menurut Yuliar (2008), zona bening (halo) yang terbentuk karena adanya
aktivitas selulosa yang mengandung surfaktin dapat berperan sebagai anti jamur dengan cara membentuk misel dengan komponen membran sel jamur.
Benhamou (1996) melaporkan enzim selulase dan pektinase yang dihasilkan
P. fluorescens dapat digunakan oleh bakteri tersebut untuk mengkolonisasi daerah interselluler jaringan korteks akar, sehingga terjadi penghambatan invasi patogen.
Kemampuan P.fluorescens memproduksi enzim selulosa menjadikan mikroorganisme tersebut mampu menghidrolisa selulosa menjadi glukosa atau gula-gula yang lain
yang larut dan dapat digunakan sebagai sumber carbon bagi pertumbuhannya.
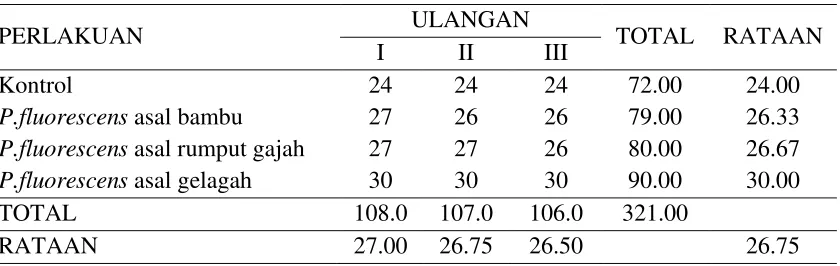
Persentase Perkecambahan Benih Cabai
Persentase perkecambahan benih dihitung pada umur 3, 6, 9 hari setelah semai
(hss) dalam polibek. Perhitungan berdasarkan persentase jumlah benih berkecambah
(BK) pada pengamatan pertama (3 hss), kedua (6 hss) dan ketiga (9 hss), per 100
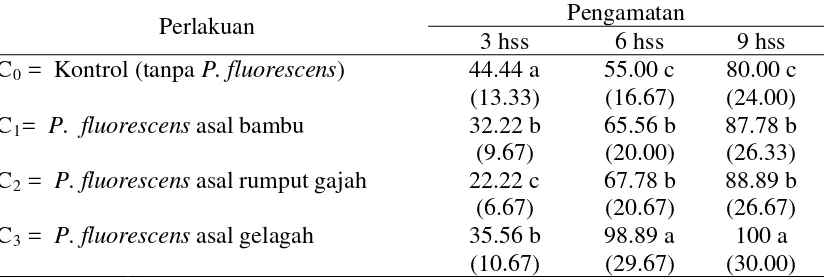
Tabel 3 : Persentase perkecambahan benih cabai Keterangan: angka-angka yang diikuti huruf yang berbeda menunjukkan berbeda nyata pada
taraf 5%.
Dari Tabel 3 di atas dapat dilihat persentase perkecambahan yang dimulai
pada 3 hari setelah semai, terlihat persentase tertinggi terlihat pada perlakuan C3
(seed coating + P. fluorescens asal gelagah) diikuti C0 (kontrol), C1 (seed coating + P. fluorescens asal bambu) dan C2 (seed coating + P. fluorescens asal rumput gajah).
Perlakuan dengan pemberian P.fluorescens dengan pertambahan umur, maka semakin meningkat daya kecambah cabai. Sedangkan pada kontrol (tanpa pemberian
P.fluorescens) sekalipun meningkat, tetapi masih di bawah daya kecambah dari pemberian P. fluorescens. Daya kecambah paling tinggi yaitu dengan pemberian P. fluorescens asal gelagah yang lebih efektif dari P. fluorescens asal bambu dan rumput gajah. Sejalan dengan hasil penelitian Taufik (2005), yang melaporkan terjadi
peningkatan pertumbuhan pada benih cabai Tit Segitiga yang diberi perlakuan PGPR
dibanding tanpa perlakuan. Sutariati et al. (2006), mengatakan perlakuan benih
Menurut Parjono (2008) kemampuan isolat Pseudomonas sp Crb97, Crb102 dan Crb106 untuk memacu pertumbuhan kecambah kemungkinan karena isolat
Pseudomonas sp. tersebut memproduksi hormon tumbuh yang dapat dimanfaatkan oleh kecambah. Keterlibatan hormon merupakan salah satu faktor penting dalam
pemacuan pertumbuhan.
Wuryandari (2003) menyebutkan memperlakukan biji menggunakan metode
penyelimutan biji dengan bakteri P. fluorescens akan memberikan kesempatan bakteri tersebut untuk berkembang menyelimuti biji. Kondisi ini akan meningkatkan
populasi P. fluorescens sebelum disemai dan bila biji berkecambah mengandung P. fluorescens yang selanjutnya berkembangbiak mengkoloni sistem akar atau rizosfer. Menurut Rao et al. (2004), pemberian P. chlamydosporia dan P. fluorescens
meningkatkan pertumbuhan bibit dari paprika, dimana terjadi kolonisasi oleh bio
agens dari kombinasi kedua bakteri tersebut dan mengkolonisasi akar saat pindah ke
lapangan. Selanjutnya Gholami et al. (2009) menyatakan, PGPR meningkatkan perkecambahan benih hingga 18,5%.
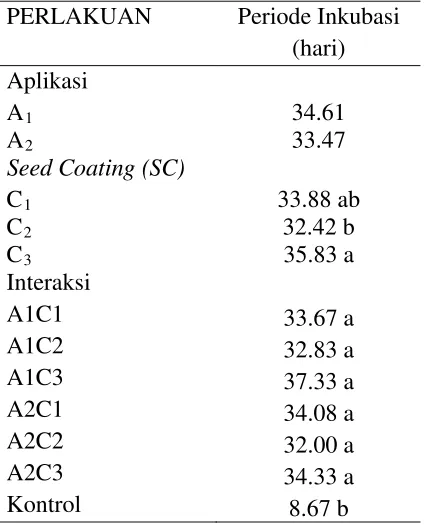
Periode Inkubasi
Pada Tabel 4 di bawah, terlihat terdapatnya perbedaan gejala virus pada
tanaman dari setiap perlakuan. Munculnya gejala dari yang paling cepat sampai
paling lambat dari setiap perlakuan berturut-turut adalah kontrol (8,67 hst), A2C2
(32,00 hst), A1C2 (32,83 hst), A1C1 (33,67 hst), A2C1 (34,08 hst), A2C3 (34,33 hst),
dan A1C3 (37,33 hst). Antar perlakuan tidak menunjukkan perbedaan yang nyata,
lebih lama dibanding dengan tanaman yang diberi P.fluorescens asal bambu dan asal rumput gajah. Artinya P. fluorescens asal gelagah lebih efektif dalam memperlambat perkembangan penyakit virus atau menunda pemunculan gejala awal sehingga
ekspresi gejala yang muncul lebih lama dari tanaman dengan pemberian bakteri P. fluorescens asal bambu dan rumput gajah.
Tabel 4. Periode inkubasi penyakit akibat virus pada tanaman cabai.
PERLAKUAN Periode Inkubasi
Keterangan: angka-angka yang diikuti huruf yang berbeda menunjukkan berbeda nyata pada taraf 5%.
Menurut Soesanto (2000) dan Rokhlani (2005) sistem ketahanan yang dimiliki
oleh tiap-tiap tanaman akan menunjukkan perbedaan masa inkubasi dan tingkat
virulensi virus yang menginfeksi. Cepatnya periode inkubasi diduga pada tanaman
dapat juga dikarenakan kesesuaian hidup patogen dengan cabai tanpa pemberian P. fluorescens. Sedangkan lebih lamanya periode inkubasi pada tanaman yang diberi P. fluorescens dikarenakan kemampuannya dalam menghambat patogen.
Metabolit sekunder yang dihasilkan bakteri P. fluorescens sangat berperan dalam periode inkubasi, seperti siderofor yang memiliki kemampuan menghambat
perkembangan patogen. Menurut Kanimozhi dan Perinbam (2011), P. fluorescens
LP1 menghasilkan metabolit sekunder siderofor sebagai agens phytophatogen. Hal yang sama juga diutarakan oleh Prashant et al. (2009), pemurnian siderofor dari
Acinetobacter calcoaceticus pada 500 ug / mL konsentrasi menghambat pertumbuhan
Aspergillus niger sampai dengan 30,00%, A. flavus hingga 10,71%, Colletotrichum
paprika hingga 21,57%, dan Fusarium oxysporum hingga 15,12%. Hal ini
menunjukkan bahwa kedua supernatan siderofor kaya metabolit yang memiliki
potensi penghambatan terhadap jamur pytopatogenik.
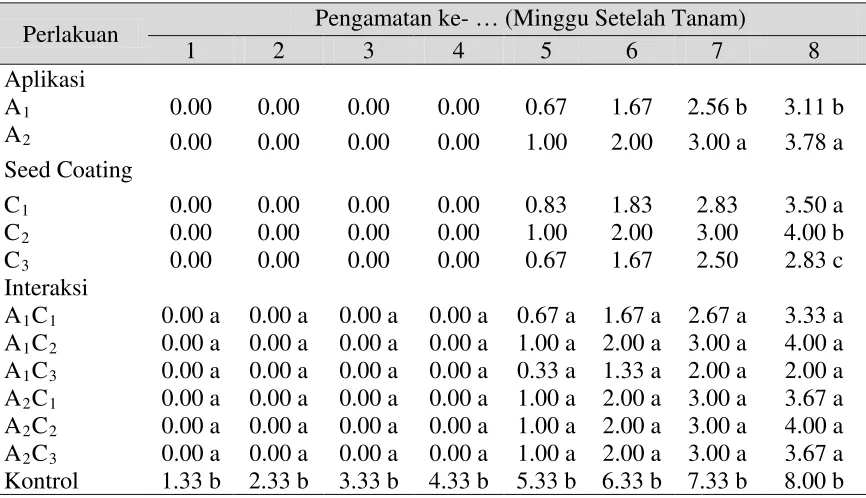
Persentase kejadian penyakit
Pengamatan persentase kejadian penyakit pada 1 mst sampai 8 mst dapat
dilihat pada Tabel 5 di bawah ini. Persentase kejadian penyakit virus pada
perlakuan pemberian P. fluorescens asal gelagah lebih rendah dibanding P. fluorescens asal bambu dan rumput gajah, berturut-turut A1C3 (2 mst), A1C3 (3,67
mst), A2C1 (3,67 mst), A1C1 (3.33 mst), A1C2 (4mst), A2C2 (4 mst). Pada kontrol
Persentase kejadian penyakit dapat dilihat pada Tabel 5 berikut :
Tabel 5. Persentase kejadian penyakit
Keterangan: angka-angka yang diikuti huruf yang berbeda menunjukkan berbeda nyata pada taraf 5%.
Pseudomonas fluorescens asal gelagah lebih efektif dibanding P. fluorescens
asal bambu dan rumput gajah. Hal ini menunjukkan P. fluorescens mempunyai kemampuan untuk menghambat infeksi patogen. Perbedaan kejadian penyakit ini
dapat disebabkan perbedaan ketahanan yang dimiliki oleh tanaman. Selain itu
kejadian penyakit dapat lebih tinggi akibat serangan ganda dari jenis virus dan sangat
berbeda bila tanaman mendapat serangan satu jenis virus saja.
Pada tanaman yang terinfeksi ganda terjadi interaksi antara kedua virus yang
bersifat meningkatkan kemampuan salah satu atau kedua virus dalam proses
perkembangan dan penyebarannya di dalam sel tanaman terinfeksi. Virus bergerak ke
Perlakuan Pengamatan ke- … (Minggu Setelah Tanam)
jaringan tanaman melalui pembuluh floem dan akan tersebar ke seluruh bagian
tanaman bersamaan dengan peredaran hasil fotosintat (Martin et al., 2004). Semakin
cepat proses perkembangan dan penyebaran virus di dalam sel tanaman, maka gejala
sistemik muncul semakin cepat dan tingkat keparahannya semakin tinggi.
Hasil yang sama disampaikan oleh Wardanah (2007), bahwa pemberian
campuran (P. fluorescens saja atau B. polymixa) keduanya menurunkan tingkat kejadian penyakit mosaik pada tanaman cabai yang disebabkan oleh TMV.
Anti mikrobia yang dihasilkan oleh kelompok P. fluorescens antara lain
pioluteorin, pirolnitrin, fenazines dan fusarisidin (Beatty dan Susan 2002). Menurut Ongena et al., (1999), siderophore berperan dalam mekanisme induced systemic resistance (ISR). Pada kondisi ini, siderophore menghasilkan senyawa pyoverdin,
pyocelin dan asam salisilat. Asam salisilat tersebut berperan sebagai transinduksi signal yang mengaktifkan gen-gen penginduksi pembentukan systemic acquered resistant (SAR) (Wahyuni, 2001), Ketahanan yang terbentuk tersebut efektif menekan perkembangan patogen termasuk cendawan, bakteri, dan virus (Chivasa et al., 1997). Banyak kajian menyatakan bahwa akumulasi asam salisilat berasosiasi dengan respon fisiologi tanaman terhadap serangan penyakit (Saikia et al., 2006).
Parjono (2008) menyatakan Pseudomonas sp Crb3 mampu menekan kejadian
penyakit sebesar 83.33%.
Tinggi Tanaman (cm)
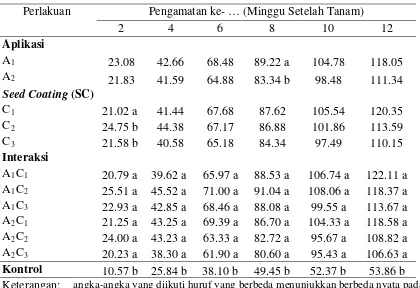
Hasil pengamatan terhadap tinggi tanaman dengan pemberian bakteri P. fluorescens dapat dilihat pada Tabel 6.
Tabel 6. Rataan tinggi tanaman (cm) pengamatan I sampai dengan pengamatan XII.
Perlakuan Pengamatan ke- … (Minggu Setelah Tanam)
2 4 6 8 10 12
Keterangan: angka-angka yang diikuti huruf yang berbeda menunjukkan berbeda nyata pada taraf 5%.
Hasil uji statistik aplikasi P.fluorescens tidak menunjukkan hasil yang nyata terhadap tinggi tanaman. Tetapi P. fluorescens asal bambu lebih efektif dibanding dengan P. fluorescens asal rumput gajah dan gelagah. Berturut-turut dapat dilihat A1C1 (122,11 cm), A2C1 (118,58 cm), A1C2 (118,37 cm), A1C2 (108,82 cm), A1C3
(113,67 cm), A2C2 (108,82 cm), A2C3
Ilyas (2003) menambahkan bahwa penggunaan seed coating dalam industri benih sangat efektif karena dapat memperbaiki penampilan benih, meningkatkan daya
simpan, mengurangi resiko tertular penyakit dari benih disekitarnya, dan dapat
digunakan sebagai pembawa zat aditif, misalnya antioksidan, anti mikroba, repellent, mikroba antagonis, zat pengatur tumbuh dan lain-lain. Menurut Sutariati et al. (2006), aplikasi P. fluorescens nyata meningkatkan tinggi tanaman cabai. Selanjutnya menurut Sutariati et al. (2006), perlakuan dengan isolat P. fluorescens PG01, PG22, dan PG07 secara nyata meningkatkan tinggi dan jumlah daun bibit cabai
dibandingkan dengan perlakuan standar. Ashrafuzzaman et al. (2009), juga mengatakan bahwa isolat PGPR berpengaruh signifikan terhadap tinggi tanaman padi
dibanding dengan perlakuan tanpa pemberian PGPR.
Tanaman yang terinfeksi virus akan terjadi penurunan zat pengatur tumbuh
(hormon) dan peningkatan kadar senyawa penghambat pertumbuhan (Agrios 1997).
Menurut Semangun (2000), TMV yang menginfeksi tanaman cabai dapat
menghambat pertumbuhan tinggi tanaman sampai mengakibatkan tanaman kerdil.
Pseudomonas sp. banyak dilaporkan sebagai penghasil fitohormon dalam jumlah besar khususnya IAA. IAA merupakan hormon pertumbuhan kelompok
auksin yang berguna untuk merangsang pertumbuhan tanaman. Auksin berfungsi
untuk meningkatkan pertumbuhan sel batang, menghambat proses pengguguran daun,
merangsang pembentukan buah, serta merangsang pertumbuhan kambium dan
menghambat pertumbuhan tunas ketiak (Tjondronegoro et al., 1989). Katiyar dan Goel (2003), P. fluorescens dengan kode CRPF2 bisa melarutkan P ke tingkat yang lebih tinggi ditandai dengan meningkatnya panjang tunas dan panjang akar. Hal ini
Produksi cabai per tanaman (gram)
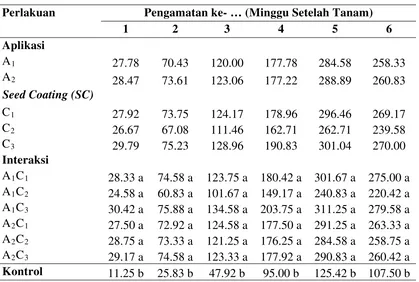
Tabel 7. Rataan produksi tanaman (gram) pengamatan I sampai dengan
pengamatan VI.
Perlakuan Pengamatan ke- … (Minggu Setelah Tanam)
1 2 3 4 5 6
Keterangan: angka-angka yang diikuti huruf yang berbeda menunjukkan berbeda nyata pada taraf 5%.
Dari Tabel 7 dapat dilihat produksi tanaman cabai pada tanaman yang
mendapat perlakuan pemberian P. fluorescens dan tidak berbeda nyata pada taraf 5%. Tetapi bila dilihat dari hasil analisis statistik, P. fluorescens asal gelagah lebih efektif dalam meningkatkan produksi tanaman dibanding dengan P. fluorescens asal bambu dan rumput gajah berturut-turut sebagai berikut A1C3 (279,58 gr), A2C3 (260,42 gr),
A1C1 (275.00 gr), A2C1 (263,33 gr), A2C2 (258,75 gr), A1C2
Wardanah (2007), menyatakan P. fluorescens, B. polymixa, dan campuran keduanya dapat berfungsi sebagai PGPR pada tanaman cabai karena dapat
meningkatkan pertumbuhan dan produksi tanaman. Kombinasi kedua bakteri dapat
mengkompensasi tanaman dari infeksi TMV sehingga tanaman cabai masih dapat
tumbuh dan memproduksi buah dengan baik.
Inokulasi P. fluorescens meningkatkan produksi hingga 100% dan juga bakteri pelarut Posfat yang diisolasi dari rizosfer padi dapat meningkatkan produksi
5,4-21,6% (Thakuria et al., 2004). Kemampuan isolat bakteri rizosfer sebagai pemacu pertumbuhan tanaman ditunjukkan dengan kemampuan dalam menyediakan dan
memobilisasi penyerapan berbagai unsur hara dalam tanah serta mensintesis dan
mengubah konsentrasi berbagai fitohormon pemacu pertumbuhan tanaman (Kloepper,
2003; Timmusk & Wagner, 2004). Menurut Sutariati (2006), P. fluorescens sebagai PGPR dapat meningkatkan ketersediaan nutrisi tanaman (biofertilizer). Hal ini sangat
berpengaruh pada peningkatan produksi tanaman.
Menurut Kusumadewi (1999) rizobakteri memungkinkan penyediaan unsur
hara tertentu dari lingkungannya yaitu menambat N2
Senyawa fosfat yang ada dalam lingkungan tumbuh tanaman tidak selalu
dapat mencukupi kebutuhan bagi tanaman sehingga keberadaan bakteri pelarut fosfat
di rizosfer tanaman membantu menyediakan senyawa fosfat bagi tanaman (Sutariati.
2006). Strain P. fluorescens melalui mutagenesesis dapat digunakan sebagai pupuk posfat untuk meningkatkan produksi tanaman pada suhu rendah (Katiyar et al., 2003).
dan mensuplai ketanaman.
Rizobakteri juga mampu menghasilkan siderofor yang dapat melarutkan dan
memisahkan besi dari tanah serta menyediakannya untuk tanaman. Genus yang
banyak diketahui sebagai pemacu pertumbuhan antara lain Pseudomonas sp., Bacillus
KESIMPULAN DAN SARAN
Kesimpulan
1. Hasil penelitian di lapangan menunjukkan bahwa bakteri P. fluorescens efektif untuk menginduksi ketahanan tanaman cabai terhadap penyakit virus di lapangan
yang ditandai dengan lamanya periode inkubasi dan kejadian penyakit di
lapangan. Bakteri P. fluorescens juga efektif dalam meningkatkan pertumbuhan dan produksi tanaman.
2. Perlakuan seed coating dengan P. fluorescens meningkatkan perkecambahan benih cabai dan memberi ketahanan terinduksi terhadap penyakit virus pada
tanaman cabai di lapangan.
3. Bakteri P. fluorescens sangat berperan sebagai biocontrol dan biofertilizer dari hasil metabolit sekunder yang dihasilkan seperti produksi N-bebas dan aktivitas
Selulosa.
4. Dari ketiga bakteri sebagai agens induksi ketahanan tanaman, P. fluorescens asal gelagah paling efektif terhadap parameter pengamatan daya kecambah, periode
inkubasi, kejadian penyakit, dan produksi tanaman.
Saran
1. Bakteri P. fluorescens dapat digunakan sebagai agens induksi ketahanan tanaman cabai terhadap penyakit virus di lapangan dengan cara seed coating.