BAB II
TINJAUAN PUSTAKA
2.1 Konsep Magnetik
Semua benda atau material terdiri dari dari atom-atom, setiap atom terdiri dari inti atom dan elektron, jumlah elektron berbeda setiap atom, elektron tersebut bergerak mengelilingi inti atom pada lintasannya masing masing yang disebut mengorbit sesuai dengan model Bohrdapat dilihat pada Gambar 2.1.
Gambar 2.1 Atom Model Bohr Elektron Mengorbit Inti (Karlsson and Soderstrom, 2012)
Karlsson and Soderstrom, (2012) menuliskan bahwa : elektron mengorbit inti atom dengan momentum sudut orbital L :
L = r × mev (1)
r, me dan v adalah radius orbital elektron, massa dan kecepatan elektron. Hal ini
dapat ditunjukkan bahwa magnet momen dipol m untuk loop arus kecil dapat
ditulis sebagai :
m = I AuN = I r2π uN (2)
A adalah luas dalam loop dan uN vektor satuan normal untuk A. Selanjutnya, saat
arus listrik I didefinisikan sebagai partikel bermuatan bergerak, dan ditulis sebagai
:
(3)
e adalah muatan elektron dan ω adalah frekuensi sudut elektron. Persamaan 1, 2
(4)
faktor -e/2me disebut rasio gyromagnetik. Hal ini diilustrasikan sesuai Gambar 2.2 dibawah ini.
Gambar 2.2 Ilustrasi Momen Dipol Magnetik m (Karlsson and Soderstrom,
2012)
maka bahan magnet dapat digolongkan menjadi lima yaitu : diamagnetik, paramagnetik, feromagnetik, antiferomagnetik dan ferimagnetik. Keterangan jenis magnet tersebut dijelaskan pada bagian berikut.
2.1.1 Diamagnetik.
Diamagnetik adalah bahan magnet yang tidak memiliki momen magnet atau medan magnet (kulit elektronnya lengkap dan terisi oleh spin elektron yang berpasangan), momen magnet hanya muncul saat diberikan medan magnet eksternal tetapi mengahsilkan arah momen magnetik yang berlawanan dengan arah kuat medan magnet eksternal sehingga akan menghasilkan resultan yang berarah negatif. Menurut Issa, B. et al (2013) diamagnetik tidak mempertahankan
momen magnetik saat medan magnet eksternal dihapus, contoh bahan diamagnetik seperti tembaga, perak, emas. Ilustrasi arah momen magnet diamagnetik pada saat ada dan tidak ada medan magnet eksternal dapat dilihat pada Gambar 2.3.
Gambar 2.3 Ilustrasi Dipol Magnetik Diamagnetik (Kolhatkar et al, 2013)
2.1.2 Paramagnetik
Paramagnetik adalah bahan magnet yang memiliki momen magnet (terdapat spin elektron tidak berpasangan) tetapi dalam keadaan acak, sifat magnet hanya muncul saat diberikan medan magnet eksternal. Ketika medan magnet ekternal diberikan pada material paramagnetik maka dipol magnetik akan mengikuti arah medan magnet eksternal. Paramagnetik merupakan jenis magnet nonpermanen. Menurut Issa, B. et al (2013) bahan paramagnetik tidak mempertahankan momen
magnetik saat medan magnet eksternal dihapus, contoh bahan paramagnetik seperti gadolinium, magnesium, lithium, dan tantalum. Ilustrasi arah momen magnet paramagnetik pada saat ada dan tidak ada medan magnet eksternal dapat dilihat pada Gambar 2.4.
Gambar 2.4 Ilustrasi Dipol Magnetik Paramagnetik (Kolhatkar et al, 2013)
2.1.3 Feromagnetik
Feromagnetik adalah bahan magnet yang memiliki momen magnet (terdapat spin elektron tidak berpasangan) momen magnet teratur dan searah, sama besar, saling menguatkan, sifat magnet tetap ada walaupun tidak diberikan medan magnet eksternal (permanen). Feromagnetik disebut juga magnet permanen. Menurut Issa, B. et al (2013) ketika bahan feromagnetik ditempatkan dalam
medan magnet, momen magnetik dari domain menyelaraskan sepanjang arah medan magnet yang membentuk momen magnetik besar, contoh bahan feromagnetik seperti besi, nikel, dan kobalt. Ilustrasi arah momen magnet feromagnetik dapat dilihat pada Gambar 2.5.
Paramagnetic
2.1.4 Antiferomagnetik
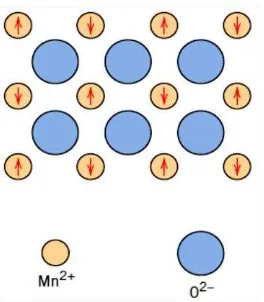
Antiferomagnetik merupakan jenis magnet permanen (kelompok feromagnetik), momen magnet saling berlawanan dan sama besar dengan demikian tidak memiliki margin momen magnet. Jenis magnet ini menjadi paramagnetik diatas suhu transisi, yang dikenal sebagai neel tempearture, TN (Cr: TN = 370C). Menurut Issa, B. et al (2013) contoh bahan antiferromagnetik seperti MnO, CoO, NiO, dan CuCl2 adalah senyawa dari dua atom yang berbeda yang menempati kisi yang berbeda posisi. Dua atom memiliki momen magnetik yang sama besarnya dan berlawanan arah yang menghasilkan momen magnetik nol. Ilustrasi arah momen magnet antiferomagnetik dapat dilihat pada Gambar 2.6 dan Gambar 2.7.
Gambar 2.6 Ilustrasi Dipol Magnetik Antiferomagnetik (Kolhatkar et al, 2013)
Gambar 2.7 Ilustrasi Anti Paralel Momen Magnetik Spin Antiferomagnetik MnO (Callister, 2007)
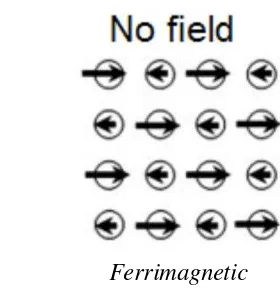
2.1.5 Ferimagnetik
Ferimagnetik merupakan bahan magnet permanen (kelompok feromagnetik), momen magnet saling berlawanan tetapi tidak sama besar dengan demikian memiliki margin momen magnet seperti magnetit Fe3O4 dan maghemite -Fe2O3. Ilustrasi arah momen magnet ferimagnetik dapat dilihat pada Gambar 2.8.
Gambar 2.8 Ilustrasi Dipol Magnetik Ferimagnetik (Kolhatkar et al, 2013)
Karlsson and Soderstrom (2012) memberikan contoh material berdasarkan bahan magnet pada Tabel 2.1
Tabel 2.1 Contoh Material Berdasarkan Bahan Magnet (Karlsson and Soderstrom, 2012)
Bahan Magnet Contoh material
Diamagentik Tembaga (Cu), Karbon (C), Hidrogen (H2), Natrium Klorida (NaCl) Paramagnetik Aluminium (Al), Oksigen (O2)
Feromagnetik Besi (Fe), Nikel (Ni), Feronikel (FeNi)
Antiferomagnetik Chromium (Cr), Besi oksida (FeO), Nikel oksida (NiO) Ferimagnetik Strontium ferit (SrFe12O19), Barium heksaferit (BaFe12O19)
2.2 Sifat Bahan Magnet
Sifat bahan magnet secara umum yang terdapat pada magnet logam dan magnet keramik adalah : temperatur curie, magnetik saturasi, magnetik remanensi dan koersivitas. Magnetik saturasi, magnetik remanensi dan koersivitas dibahas pada kurva histeresis.
2.2.1 Temperatur Curie
Temperatur Curie yaitu nilai temperatur yang mengakibatkan momen magnet dari suatu material akan hilang. Jika suatu material dipanaskan maka atom–atom material tersebut akan bervibrasi. Jika vibrasi atom semakin meningkat akibat temperatur terus semakin tinggi maka gaya kopel antar momen dipol menjadikan susunan dipol tidak teratur hal ini menyebabkan terjadinya penetralan yakni total medan magnet menjadi hilang. Dengan demikian jika temperatur ferimagnetik dan feromagnetik melebihi temperatur ini maka ia akan berubah sifat menjadi paramagnetik.
2.2.2 Kurva Histerisis
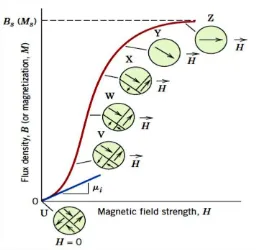
Kurva histerisis adalah hasil magnetisasi pada suatu bahan yang menunjukkan adanya pengaruh momen magnet terhadap pemberian variasi momen magnet ektrernal dengan arah yang berlawanan dalam bentuk kurva. Jika suatu bahan feromagnetik atau ferimagnetik di bawah temperatur Curie awalnya belum dimagnetisasi, maka momen magnet bahan (B) = 0 dan medan magnet eksternal (H) = 0 berarti dipol magnetik bahan tersebut arahnya acak seperti yang ditunjukkan pada kurva pada Gambar 2.9. Jika H terus ditingkatkan atau dimagnetisasi, maka bidang B mulai meningkat perlahan-lahan, kemudian lebih cepat akhirnya mencapai saturasi hal ini ditandai dengan semua jumlah dipol magnetik yang serah medan magnet ekternal tersebut atau keadaan jenuh sesuai dengan lintasan dari U ke Z pada Gambar 2.9.
Bila diberi nilai H negatif, dipol magnetik diarahkan kembali pada arah negatif sampai saturasi.
Gambar 2.9 Kurva Perubahan Nilai B (feromagnetik dan ferimagnetik) Terhadap Perubahan H pada Proses Magnetisasi (Callister, 2007)
Ilustrasi magnetisasi bahan feromagmetik dan ferimagnetik membentuk kurva histerisis dapat dilihat pada Gambar 2.10.
Sifat magnet suatu bahan dapat dilihat dari kurva histerisisnya, nilai Br atau momen magnet remanen menunjukkan tingkat kualitas magnet permanen. Semakin tinggi nilai Br suatu bahan magnet maka semakin tinggi momen magnetik suatu magnet permanen (tanpa medan eksternal). Hc merupakan koersivitas yakni indikator kekuatan suatu magnet untuk mempertahankan sifat magnetnya dari gangguan medan magnet eksternal atau kemampuan untuk menahan demagnetisasi. Semakin besar nilai koersivitas suatu bahan magnet maka semakin besar sifat magnet permanennya.
Menurut Kolhatkar et al (2013) magnetisasi saturasi (Ms) adalah
magnetisasi maksimum dari momen magnetik yang dapat dicapai pada medan magnetik ekatrenal, setelah medan ini tidak ada peningkatan magnetisasi lagi, magnetisasi Remanensi (Mr) adalah Induksi magnetisasi yang tersisa setelah medan magnet eksternal dihapus dan Koersivitas (Hc) intensitas medan koersif eksternal diperlukan untuk memaksa magnetisasi ke nol. Kurva histerisis berdasarkan jenis magnet dapat dilihat pada Gambar 2.11.
Gambar 2.11 Perbandingan Kurva Histerisis Berdasarkan Jenis Magnet. (Kolhatkar et al, 2013)
Penulisan satuan sifat magnet ada yang menggunakan sistem centimetre- gram-second (cgs) dan ada yang menggunakan sistem internasional (SI), untuk
Tabel 2.2 Konversi Satuan Sifat Magnet (Pullar, 2012)
No Satuan CGS Faktor konversi
ke satuan SI Satuan SI
1 Gauss (G) 10-4 Tesla (T)
2 Oersted (Oe) 103/4 A/m
3 Gauss (G) 103/4 A/m
4 emu/g 1 A m2 kg-1
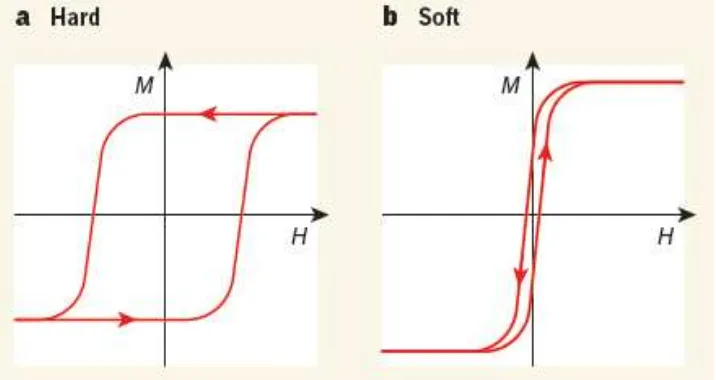
Ukuran kurva histerisis suatu bahan magnet dapat dijadikan sebagai dasar untuk menentukan bahan tersebut termasuk jenis hard magnet atau soft magnet.
Menurut James (2015) hard magnet adalah magnet yang memiliki kurva histerisis
tebal/ besar sedangkan soft magnet memiliki kurva histerisis tipis/ kecil. Hard magnet sulit untuk dimagnetisasi dan didemagnetisasi sedangkan soft magnet
mudah untuk dimagnetisasi dan didemagnetisasi. Berdasarkan kurva histerisis menurut Gutfleisch (2011) bahan yang termasuk jenis soft magnet adalah bahan
yang nilai Hc nya << 1kAm-1 (12,56 x 10-4 T), bahan yang termasuk jenis
semihard magnet adalah bahan yang nilai Hc diantar 1 s/d 31 kAm-1 (12,56 x 10-4
T s/d 389.36 x 10-4 T) dan bahan yang termasuk jenis hard magnet adalah bahan
yang nilai Hc > 31 kAm-1(0,039 T), ilustrasi hard magnet dan soft magnet
berdasarkan kurva histerisis dapat dilihat pada Gambar 2.12.
Gambar 2.12 Tipikal Kurva Histerisis pada a.HardMagnet dan b.Soft Magnet
Menurut Karlsson and Soderstrom (2012) material hard magnet dibagi
dalam tiga kelompok : magnet logam tanah jarang (seperti Nd-Fe-B and Sm-Co), magnet paduan logam (seperti agnet Al-Ni-Co) dan magnet ferit atau magnet keramik biasanya mengacu pada barium atau strontium ferit (Ba/ SrFe12O19). Menurut Gutfleisch (2011) contoh material soft magnet antara lain : soft Fe,
Fe49Co49V2, Ni50Fe50permalloy,Finemet, Ni78Fe17Mo5, supermalloy.
Selaian nilai Hc, pada magnet permanen perlu juga diketahui nilai rasio Mr/ Ms. Menurut An et al (2012) rasio Mr/Ms merupakan indeks penting dari tingkat
penyelarasan magnetik. Menurut Pullar (2012) sampel isotropik yang tidak selaras dengan suatu bahan magnet dikatakan berorientasi dengan baik jika Rasio Mr/Ms menunjukkan nilai setengah.
2.3 Barium Heksaferit
Barium heksaferit (BaFe12O19) merupakan jenis M-ferit heksagonal (BaM) yang telah banyak diteliti karena sifat yang sangat baik seperti temperatur Curie tinggi, stabilitas kimia yang baik, ketahanan korosi, dan koersivitas besar (An et al, 2014a; Kaynar et al 2015). Barium hexaferrite (BaFe12O19) dengan struktur
magnetoplumbite adalah magnet permanen keramik terkenal. Telah banyak
digunakan sebagai media perekaman magnetik high-density dan menyerap
gelombang mikro karena saturasi magnetisasi yang tinggi, koersivitas besar dan stabilitas kimia yang sangat baik (Huang et al, 2013).
BaFe12O19 merupakan magnet permanen (Yu, 2013; Ahmed et al, 2013; Choi et al, 2014; An at al, 2014a) berbasis ferit, dapat juga ditulis sebagai
Ba6.(Fe2O3). Martirosyan (2011) telah melakukan penelitian tentang barium heksaferit ia mengatakan studi terbaru difokuskan pada sintesis serbuk nanokristalin untuk meningkatkan sifat magnetik dengan meningkatkan luas permukaan dan sintering pada suhu rendah hal ini menghemat biaya, mendapatkan barium heksaferit dalam ukuran nano (kurang dari 100 nm) tetap merupakan sebuah tantangan. Kajian BaFe12O19 berstruktur nano memiliki sifat magnetik dan listrik yang berbeda jika dibandingkan dengan BaFe12O19 bulk
dipengaruhi oleh bentuk anisotropi dan ukuran nano partikel. Sementara itu menurut Mohapatra (2015) bahan ferit yang bermofologi nanorod memiliki
medan magnet yang lebih besar dari bahan ferit yang bermorfologi nanosphare
(volume bahan setara). Disamping itu partikel magnet bermorfologi nanorod
momen dipol nya cenderung tertata dengan baik (sejajar) hal ini akan mendukung wujudnya nilai remanensi yang tinggi setelah proses magnetisasi.
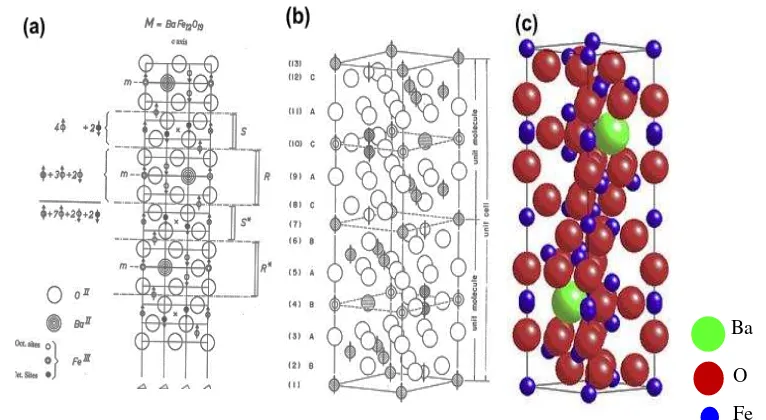
2.3.1 Struktur Barium Heksaferit
Molekul M-ferit mengandung array blok S dan blok R, dengan tumpang tindih bentuk segi enam dan bentuk kubik (Pullar,2012). Unit molekul Barium heksaferit terbuat dari satu blok S dan satu blok R, dengan tumpang tindih heksagonal dan dikemas lapisan cubically. Satu unit molekul Barium heksaferit
terdiri dari 2 x BaFe12O19 dengan rincian 2 atom Ba2+, 24 atom Fe3+ dan 38 atom O (Pullar,2012). Struktur kristal molekul BaFe12O19 dapat dilihat pada Gambar 2.13.
Gambar 2.13 Struktur Kristal BaFe12O19 (a) Susunan S blok dan R blok. (b) dan (c) Perspektif Dilihat Dari Sel Satuan Molekul. (Pullar, 2012)
2.3.2 Fasa Barium Heksaferit
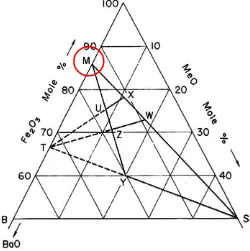
Fasa barium heksaferit adalah fasa terbentuknya kristal barium heksaferit yang berasal dari BaO dan Fe2O3, hal ini dapat dilihat pada diagram fasa
BaO-Ba
O
Fe2O3-MeO (Gambar 2.14) dan diagram fasa Fe2O3-BaO (Gambar 2.15). Lambang M, S, T, U,W, X, Y, Z pada Gambar 2.14 adalah lambang dari jenis ferit heksagonal. Pullar (2012) mengelompokkan jenis ferit heksagonal sebagai berikut : M adalah jenis ferit seperti : BaFe12O19 (BaM or barium ferrite), SrFe12O19 (SrM
or strontium ferrite), Cobalt–titanium substituted M ferrite, Sr- or BaFe 12-2xCoxTixO19 (CoTiM).U adalah jenis ferit (Ba4Me2Fe36O60), seperti Ba4Co2Fe36O60, atau Co2U. W adalah jenis ferit (BaMe2Fe16O27), seperti BaCo2Fe16O27, atau Co2W.X adalah jenis ferit (Ba2Me2Fe28O46), seperti Ba2Co2Fe28O46, atau Co2X.Y adalah jenis ferit (Ba2Me2Fe12O22), seperti Ba2Co2Fe12O22, atau Co2Y.Z adalah jenis ferit (Ba3Me2Fe24O41) seperti Ba3Co2Fe24O41, atau Co2Z. Sedangkan S merupakan Blok S (Me2Fe4O8) dan T merupakan Blok T (Ba2Fe8O14).
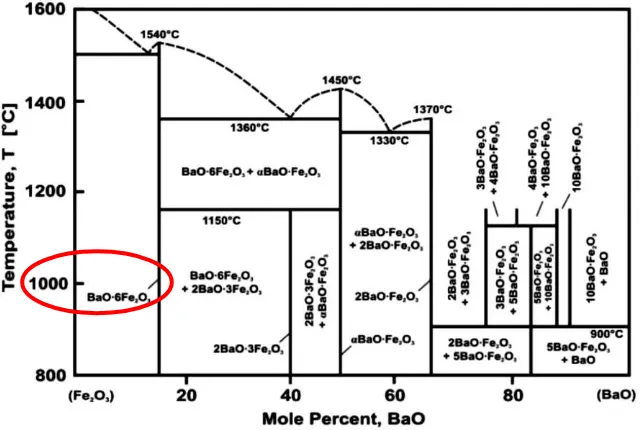
Menurut Pullar (2012) Lambang M pada Gambar 2.14 menandakan lambang ferit heksagonal jenis M-feritseperti BaFe12O19 (BaM atau barium ferit). Berdasarkan Gambar 2.14 fasa M terbentuk pada perbandingan BaO = 85 % mol dan Fe2O3 = 15% mol. Berdasarkan Gambar 2.15 terlihat fasa BaO.6(Fe2O3) atau BaFe12O19 terbentuk sekitar pada temperatur 10000C.
Gambar 2.15 Diagram Fasa Sistem Fe2O3-BaO (Chauhan, 2010)
Berdasarkan Gambar 2.15 fasa BaO.6Fe2O3 terbentuk pada temperatur 10000C. Menurut Chauhan (2010) kalsinasi memfasilitasi difusi solid state BaO dan Fe2O3 dan mengubah bahan baku ke tahap hexaferrite. Suhu kalsinasi juga memainkan peran penting dalam pembentukan fase heksaferit. Jika suhu kalsinasi rendah, maka kristal BaFe12O19 tidak terbentuk. Demikian pula jika suhu kalsinasi terlalu tinggi timbul fasa struktur kristal tambahan.
2.3.3 Sifat Magnetik Barium Heksaferit
Menurut Pullar (2012) sifat magnetik Barium heksaferit pada suhu kamar dapat diperoleh sebagai berikut :
a. M saturasi (Ms) = 72 Am2 kg-1
b. Koersivitas (Hc) = 594 kAm-1(teori) terendah 159-255 kAm-1 c. M remanensi (Mr)= 65Am2 kg-1
d. Temperatur Curie = 450 0C e. Bohr magnetons = 20 µB
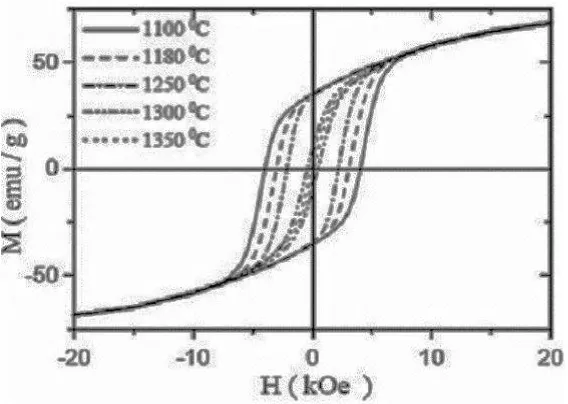
heksaferit dapat dilihat pada Gambar 2.16 berikut. Pada gambar terlihat perubahan nilai Hc terhadap perubahan suhu sintering.
Gambar 2.16 Kurva Histerisis Variasi Suhu Sintering Barium Heksaferit (Pullar,2012).
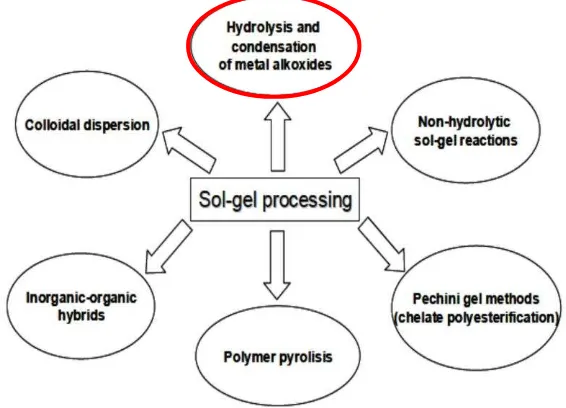
2.4 Pembuatan Barium Hekaferit
Menurut Kaynar et al (2015) beberapa metode yang paling umum untuk
mempersiapkan BaFe12O19 termasuk keramik adalah : sol-gel, sintesis
hydrothermal dan ball-milling. Dalam metode keramik, campuran oksida besi dan
barium karbonat dikalsinasi pada suhu (800 – 1150)0C untuk membentuk satu fasabarium heksaferit, penelitian ini menggunakan metode sol-gel untuk membuat
barium heksaferit.
2.4.1 Metode Sol-gel
Metode sol-gel adalah proses teknik kimia basah (kimia solusi deposisi),
yang terdiri dari dua proses Sol (solution) atau larutan dan gel (gelation) atau
pengentalan, suspensi koloid atau sol terbentuk dari hidrolisis dan polimerisasi
reaksi dari prekursor, garam logam biasanya anorganik atau logam senyawa organik seperti oksida logam (Khalaf et al, 2012). Proses sol-gel telah banyak
digunakan di bidang ilmu material (Tseng et al, 2010) sangat fleksibel untuk
lebih rendah (Darmawan et al, 2011). Proses sol-gel adalah proses dinamis,
berlangsung reaksi kondensasi (cross-linking) dari sebagian besar hidrofilik
molekul prekursor/ oligomer menghasilkan pemadatan dari jaringan (Feinle A. et al, 2015).
Gambar 2.17 Penerapan Proses Sol-gel
(Dimitriev et al, 2008)
Untuk mendapatkan oksida logam pada proses sol-gel melalui dua tahap
proses yaitu proses hidrolisis dan proses kondensasi seperti terlihat pada Gambar 2.17. Metode Sol-gel memiliki kelebihan antara lain : non-vakum, suhu rendah
mengontrol kemurnian, stoikiometri, doping dan homogen pada pencampuran pada tingkat molekuler, tapi terbatas materi penerapannya (Chilibon, 2012).
2.4.1.1 Hidrolisis
Hidrolisis adalah reaksi antara prekursor dengan air yang akan menghasilkan hidroksida logam dalam reaksi hidrolisis ion hidroksil menjadi terikat pada atom logam berarti hidrolisis menghasilkan larutan prekursor. Kristal keramik padat yang diperoleh tergantung dari kondisi hidrolisis awal, karena hidrolisis mengontrol struktur gel polimer, dan mempengaruhi proses densifikasi
harus dilakukan homogenisasi larutan yaitu proses pengadukan larutan menggunakan homogenizer (pengaduk berkecepatan tinggi) seperti Ultra Turrax Homogenizer, foto Ultra Turrax Homogenizer dapat dilihat pada Gambar 2.18
dibawah ini. Proses homogenisasi merupakan bagian akhir dari proses hidrolisis.
Gambar 2.18 Ultra Turrax Homogenizer
(IKA® WERKE, 2016)
2.4.1.2 Kondensasi
Kondensasi adalah proses pengentalan menjadi gel dengan cara
membebaskan molekul kecil, seperti air atau alkohol membentuk polimerisasi (Tseng et al, 2010). Salah satu faktor yang dapat mempengaruhi kondensasi
adalah pH dan temperatur. Pada proses sol-gel ketika pelarut dihilangkan dengan
penguapan, gel organik yang dihasilkan disebut xerogel (Esther G et al, 2013).
Proses kondensasi dilakukan hingga terbentuknya xerogel. Xerogel
diperoleh melalui tahapan pengeringan. Pengeringan adalah proses pemanasan larutan menggunakan oven dengan temperatur 1000C agar terjadi proses
kondensasi sekaligus proses penguapan untuk mengubah dari fasa cair menjadi fasa padat yang akhirnya terbentuk endapan (struktur gel) hal ini disebut dengan xerogel. Pada proses pembuatan barium heksaferit berdasarkan metod sol-gel
endapan kering (xerogel) yakni oksida logam, berupa Fe2O3 dan BaO. Gambar skema secara umum proses sol-gel dapat dilihat pada Gambar 2.19. dibawah ini.
Gambar 2.19 Skematik Proses Sol-Gel
(Elsalamony RA, 2016)
2.4.2 Kalsinasi
Kalsinasi merupakan salah satu istilah perlakuan panas yang sering digunakan pada temperatur tinggi tertentu tetapi masih dibawah titik lebur dan ditahan selama waktu tertentu agar sempurna terbentuk kristal yang diinginkan. Nilai temperatur kalsinasi yang diperlukan tergantung dari proses apa yang diinginkan sesuai dengan diagram fasanya. Kalsinasi dilakukan didalam oven/ furnace, jenis oven/ furnace yang digunakan tergantung dari bahan dan proses
yang diinginkan. Pembuatan barium heksaferit yang berawal dari oksida logam Fe2O3 dan BaO dapat dilakukan kalsinasi dengan temperatur sekitar 10000C sesuai dengan diagram fasa sistem BaO – Fe2O3 (Gambar 2.15) dan Menurut Pullar (2012) sisntesis BaFe12O19 dari perkursor sol-gel organik fase tunggal BaM
2.5 Prekursor
Prekursor merupakan istilah untuk bahan awal pembuatan material, pada pembuatan barium heksaferit pada penelitian ini digunakan prekursor yakni : Barium Nitrat (Ba(NO3)2) untuk mendapatkan molekul BaO, Ferric nitrate
nonahydrate (Fe(NO3)3.9H2O) untuk mendapatkan molekul Fe2O3 dan
Neodymium(III) Chloride Hexahydrate (NdCl3.6H2O) untuk mendapatkan atom Nd sebagai doping yang akhirnya untuk mendapatkan partikel Ba(Nd)xFe12O19.
2.5.1 Barium Nitrat (Ba(NO3)2)
Barium nitrat (Ba(NO3)2) berbentuk serbuk halus berwarna putih sifat beracun dengan kation Ba2+. Barium nitrat mudah terhidrolisis menjadi Ba(OH)2 digunakan dalam membuat barium oksida, barium dioksida, kaca optik, keramik dan glasir. Dari Ba(NO3)2 akan diperoleh atom Ba sebagai atom penyusun molekul Ba(Nd)xFe12O19. Gambar fisik dan struktur kimia Barium nitrat dapat dilihat pada Gambar 2.20, Gambar 2.21.
Gambar 2.20 Barium Nitrat
(Divjyot chemicals Private Limited, 2016)
Sifat fisika/ kimia Barium Nitrat dapat dilihat pada Tabel 2.3.
Tabel 2.3 Sifat Fisika dan Kimia Barium Nitrat (Cole-Parmer, 2016)
No Sifat Fisika dan Kmia Nilai 1 Kelarutan dalam air 90 g/l (20 0C)
2 Masa molar 261,34 g/mol
3 Titik lebur 592 °C
4 Densitas 3,24 g/cm3 (20 0C)
2.5.2 Ferric Nitrate Nonahydrate (Fe(NO3)3.9H2O)
Ferric nitrate nonahydrate atau Besi (III) Nitrat Nonahidrat berbentuk
garam lembab bewarna ungu pucat dengan kation Fe3+. Besar kemampuannya untuk menyerap molekul, mudah terhidrolisis menjadi Fe(OH)3, merupakan senyawa kimia logam besi atau besi oksida dengan asam nitrat, digunakan sebagai katalis, oksidan reagen analitis, zat penyerap radioaktif. Dari Fe(NO3)3.9H2O akan
diperoleh atom Fe sebagai atom penyusun molekul Ba(Nd)xFe12O19. Gambar fisik dan struktur kimia ferric nitrate nonahydrate dapat dilihat pada Gambar 2.22 dan
Gambar 2.23. Sifat fisika dan kimia ferric nitrate nonahydrate dapat dilihat pada
Tabel 2.4.
Gambar 2.22 Ferric Nitrate Nonahydrate
Gambar 2.23 Struktur Kimia Ferric Nitrate Nonahydrate
(Cole-Parmer, 2016)
Tabel 2.4 Sifat Fisika dan Kimia Ferric Nitrate Nonahydrate
(Cole-Parmer, 2016)
No Sifat Fisika/Kmia Nilai 1 Kelarutan dalam air (200C) larut
2 Masa molar 403,95 g/mol
3 Titik lebur 47 °C
4 Densitas 1,68 g/cm3(200C)
2.5.3 Neodymium (III) Chloride Hexahydrate (NdCl3.6H2O)
Neodymium(III) Chloride Hexahydrate berupa garam lembab bewarna
ungu, cepat menyerap air dan mudah mencair, digunakan untuk produksi logam neodymium dan senyawa, sebagai pewarna untuk gelas dan keramik, juga digunakan dalam katalis. Dianjurkan agar tetap bersegel dan disimpan di tempat kering dan sejuk. Dari NdCl3.6H2O akan diperoleh atom Nd sebagai atom penyusun molekul Ba(Nd)xFe12O19 (doping). Gambar fisik dan struktur kimia
Neodymium(III) Chloride Hexahydrate dapat dilihat pada Gambar 2.24 dan
Gambar 2.25.
Gambar 2.24 Neodymium(III) Chloride Hexahydrate
Gambar 2.25 Struktur Kimia Neodymium (III) Chloride Hexahydrate.
(LookChem, 2016)
Sifat fisika dan kimia Neodymium (III) Chloride Hexahydrate dapat dilihat pada
Tabel 2.5
Tabel 2.5 Sifat Fisika dan Kimia Neodymium (III) Chloride Hexahydrate
(LookChem, 2016)
No Sifat Fisika/Kmia Nilai 1 Kelarutan dalam air Larut
2 Masa molar 358,688 g/mol
3 Titik lebur 124 °C
4 Densitas 2,282 g/cm3
2.6 Kitosan
Kitosan adalah polisakarida kationik alami terdiri dari (a2-amino-2-deoksi--D-glukan) yang diperoleh dari deasetilasi basa kitin. Kitin ini berasal dari kulit serangga dan krustasea laut seperti udang dan kepiting (El-hefian et al, 2011).
Menurut Narimane et al (2014) krustasea laut adalah sumber terkaya kitin tersedia
Gambar 2.26 Proses Produksi Kitosan dari Limbah Udang (Narimane et al, 2014)
Gambar 2.27 Struktur Kimia Kitosan (Yogeshkumar, 2013)
Gugus amino dalam Kitosan memiliki nilai pKa ~ 6.5, yang mengarah ke protonasi yang mudah mengikat permukaan bermuatan negatif (Yogeshkumar et al, 2013). Kitosan dapat bertindak sebagai dispersant, karena secara struktural
kitosan mengandung amino dan hidroksil gugus fungsional yang mampu mengikat ion logam.
Dispersant adalah zat yang digunakan untuk mencegah pengendapan atau
penggumpalan partikel tersuspensi dalam cairan. Kitosan dapat digunakan sebagai
dispersant (Zhang, et al, 2010). Peran kitosan sebagai dispersant dengan cara
Gambar 2.28 Ilustrasi Kitosan Sebagai Dispersant (mengikat ion Fe3O4) (Zarnegar dan Safari,2014)
Menurut Hafdani dan Sadeghinia (2011) kitosan tidak larut dalam kebanyakan pelarut organik dan air pada pH netral, tetapi larut dalam larutan encer asam organik seperti asetat, format, tartarat, valerat, laktat, glikolat, dan asam sitrat dan juga larut dalam asam anorganik encer seperti klorida dan asam sulfat.
Kitosan merupakan polimer rantai panjang glukosamin dengan bobot molekul 2,5x10-5 Dalton dan memiliki rumus molekul [C
6H11NO4]n (Pebriani dkk, 2012).
2.7 Pati Tapioka
Pati Tapioka berasal dari ekstrak umbi singkong. Pati tapioka pada dasarnya karbohidrat, dikenal sebagai polisakarida dan mengandung beberapa molekul gula. Pati disusun dari dua macam karbohidrat yaitu amilosa dan amilopektin dalam komposisi yang berbeda-beda. Menurut Durejaa et al (2011),
Lin et al (2011) pati merupakan biopolimer terdiri dari unit glukosa dan memiliki
Gambar 2.29 Struktur Kimia Amilosa dan Amilopektin. (Polymeren, 2016)
2.8 Karakterisasi
Untuk mengetahui secara ilmiah suatu bahan magnet mengenai bentuk kristal, morfologi, komposisi atom dan sifat magnetnya maka bahan magnet tersebut harus diuji menggunakan peralatan ukur sebagai berikut :
1. X-R Diffractometer untuk mengetahui kristal yang terbentuk pada sampel.
2. Scanner Electron Microscope - EDS untuk mengetahui bentuk dan ukuran morfologi yang terbentuk pada sampel dan untuk mengetahui komposisi atom yang terkandung pada sampel.
3 Vibrarting Sample Magnetometer untuk mengatahui nilai sifat magnetik suatu
sampel.
2.8.1 X-Ray Diffractometer (XRD)
X-Ray Diffractometer (XRD) merupakan suatu teknik karakterisasi material
200 eV sampai 1 MeV. Menurut Budi (2011) sinar-x memiliki daya tembus yang cukup besar dan panjang gelombangnya berorde 10-10 m yang bersesuaian dengan ukuran kisi kristal. Dengan demikian itu sinar-x dapat digunakan untuk menganalisis struktur kristal bahan padatan melalui peristiwa difraksi. Gambar prinsip dasar hukum Bragg dapat diihat pada Gambar 2.30.
Gambar 2.30 Prinsip Dasar Hukum Bragg (Fultzand Howe, 2013)
Berdasarkan Gambar 2.30 menurut Fultz and Howe (2013) terlihat sudut datang dari dua sinar paralel θ., , d adalah jarak antara bidang atas dan bidang bawah, selisih panjang lintasan sinar datang dan sinar pantul adalah 2d sin θ. Konstruktif interferensi gelombang terjadi ketika perbedaan panjang lintasan kedua sinar adalah sama dengan satu panjang gelombang (λ) maka hukum Bragg dapat ditulis dengan persamaan berikut:
nλ =sin θ βd (5)
Menurut Budi (2011) peristiwa difraksi sinar-x pada kristal padatan dinyatakan dengan persamaan Bragg:
n λ=2dhklsin θ (6)
merupakan fungsi dari indeks Miller (hkl) dan tetapan kisi (a). Untuk struktur
kristal kubus dapat ditulis:
�
√ (7)Dari persamaan (6) dan (7) untuk n = 1 dapat diperoleh hubungan sbb:
struktur kristal sistem kubus nilai kumpulan s yang ditunjukan adalah sbb: Kubus sederhana : 1, β, γ, 4, 5, 6, 8, 9, 10 … , kubus pusat badan (bcc) : 2, 4, 6, 8, 10, 12, 14 …, kubus pusat muka (fcc) : γ, 4, 8, 11, 1β, 16 …(Budi, 2011). Untuk kristal heksagonal menurut Wang and Lu (2014) kisi Bravais kristal sistem heksagonal sumbu sel konvensional dan sudut adalah a = b ≠c, α = = 90o, = 120o, jarak
dhkl antar bidang hkl dapat dicari dari persamaan berikut
(9)
Kombinasi persamaan (6) dengan persamaan (9) diperoleh :
(10)
Persamaan (10) dapat ditulis menjadi :
� (11)
Dengan mengetahui nilai hkl, dan berdasarkan persamaan (11) dapat
adalah heksagonal atau bukan dengan ketentuan a = b ≠ c, selain itu dengan
bantuan perangkat lunak difraksi sinar-x kita langsung dapat mengetahui bentuk kristal berdasarkan pola difraksi sinar-x yang ada. Puncak-puncak yang terjadi pada pola difraksi sinar – x (yang disebut juga dengan kurva XRD) menujukkan intensitas yang tinggi. Intensitas menjadi tinggi karena adanya gabungan konstruktif dari pantulan sinar-x (diffracted wavefront) yang berfasa sama.
Atom yang berbeda pada struktur kristal dapat menyebabkan perbedaan fasa pada pantulan sinar-x. Untuk mendapatkan pola difaksi dari suatu sampel digunakan difraktometer sinar-x. Difraktometer sinar-x adalah perangkat untuk penerapan difraksi sinar-x. Difraktometer sinar-x terdiri dari tiga elemen dasar: sebuah tabung sinar-x, pemegang sampel dan detektor sinar-x (Banaciu, 2015). Gambar skematik beberapa komponen difraktometer yang khas dapat dilhat seperti pada Gambar 2.31.
Gambar 2.31 Diagram Skematik Beberapa Komponen Difraktometer yang Khas (Fultz and Howe, 2013).
Menurut Fultz dan Howe (2013) goniometer dapat menyediakan untuk rotasi spesimen di bidang permukaannya dengan sudut φ, dan di bidang goniometer oleh sudut ω. Sudut φ dan ω tidak mempengaruhi pola difraksi untuk
polikristal dengan orientasi acak, tetapi penting untuk sampel dengan kristalografi tekstur. Sedangkan menurut Banaciu (2015) geometri sebuah difraktometer sinar-x membuat sampel berputar di jalur collimated sinar-sinar-x pada sudut sedangkan detektor sinar-x dipasang pada lengan untuk mengumpulkan difraksi sinar-x dan berputar pada sudut 2. Alat yang digunakan untuk mempertahankan sudut dan memutar sampel disebut goniometer. Contoh pola difraksi sinar–x dari sampel BaFe12O19 dapat dilihat pada Gambar 2.32. Pola difraksi sinar-x pada Gambar 2.31 menggambarkan hubungan antara sudut (2 Theta) dengan Intensitas puncak yang terbentuk dengan satuan arbitrary unit (a.u.) yang artinya satuan sembarang sedangkan angka dalam kurung adalah informasi hkl setiap puncak yang terbentuk
dengan adanya puncak-puncak tersebut menandakan BaFe12O19 merupakan kristal.
Gambar 2.32 Contoh Pola Difraksi Sinar-X BaFe12O19 (Kanagesan et al, 2011)
2.8.2 Scanner Electron Microscope (SEM) dan Energy Dispersive X-ray Spectroscopy (EDS)
Scanner Electron Microscope (SEM) adalah suatu jenis mikroskop yang
sehingga spesimen berjarak dekat dapat diperbesar pada tingkat yang jauh lebih tinggi (10x hingga 180.000x). SEM dapat digunakan untuk melihat suatu morfologi material serbuk dalam ukuran nanometer, tampilan citra mirip citra 3 dimensi. Berkas elektron yang ditembakkan dari electron gun diteruskan menuju
sampel melaui anoda, lensa magnetik, scanning coil yang berada dalam ruang
hampa seperti terlihat pada Gambar 2.33. Setelah berkas mengenai sampel, berkas dipantulkan dan ditangkap oleh detektor. Detektor mengumpulkan X-Ray tersebut,
elektron backscattered, dan elektron sekunder dan mengubahnya menjadi sinyal
yang dikirim ke layar monitor menghasilkan citra akhir yang mirip tampilan foto 3 dimensi. Menurut Suga et al (2014) energi elektron sekunder 50 eV dan
energi inbackscattered electrons ≥ 50 eV. Gambar skema SEM dapat dilihat pada
Gambar 2.33 dan contoh hasil foto SEM dapat dilihat pada Gambar 2.34.
Gambar 2.33 (a) Skema Komponen SEM, (b) Hamburan Berkas Elektron Setelah Mengenai Sampel
(Purdue university, 2016)
Posisi objek dan pembesaran hingga ketajaman foto akhir dapat diatur dikomputer. Dengan menggunakan SEM maka peneliti mendapatkan gambar mikrostruktur sampel. Dari gambar mikrostruktur sampel tersebut akan didapatkan informasi lain seperti ukuran partikel, keseragaman partikel, bentuk partikel dan aspek rasio partikel.
Gambar 2.34 Contoh Foto Hasil SEMBarium Heksaferit (Sozeriet al, 2012)
Energy Dispersive x-ray Spectroscopy (EDS) merpakan perangkat yang
Gambar 2.35 Contoh Foto Hasil EDS Barium Heksaferit (Mandizadeh et al, 2014)
2.8.3 Vibration Sample Magnetometer (VSM)
Vibrating Sample Magnetometer (VSM) adalah alat untuk mengukur sifat
magnetik suatu bahan/ sampel dengan presisi yang sangat tinggi. Alat tersebut bekerja berdasarkan metode induksi yaitu mengukur magnetisasi dari sinyal yang ditimbulkan/ diinduksikan oleh bahan/ sampel yang bergetar dalam lingkungan medan magnet pada sepasang kumparan berdasarkan hukum Faraday.
Hasil pengujian sifat magnetik berupa kurva histerisis. Diagram skema VSM dapat dilihat pada Gambar 2.36 di bawah ini.
Gambar 2.36 Diagram Skematik VSM
Pada metode ini, bahan/ sampel yang akan diukur magnetisasinya dipasang pada ujung bawah batang (yang berhubungan dengan vibrator) bergetar secara vertikal dalam lingkungan medan magnet luar H, jika sampel/ bahan termagnetisasi, secara permanen ataupun sebagai respon dari adanya medan magnet luar, getaran ini akan mengakibatkan pembahan garis gaya magnetik dalam hal ini magnetisasi dilakukan hingga terjadi saturasi (dipol magnetik satu arah). Selanjutnya dalam proses pengukuran, medan magnet luar yang diberikan, suhu, sudut dan interval waktu pengukuran dapat divariasikan melalui kendali komputer. Komputer akan merekam data tegangan kumparan sebagai fungsi medan magnet luar, suhu, sudut ataupun waktu. Contoh kurva histerisis BaFe12O19 dapat dilihat pada Gambar 2.37
Gambar 2.37 Contoh Hasil VSMKurva Histerisis BaFe12O19 (Dursun et al, 2012)
2.9 Komputasi Material.
Komputasi material merupakan proses rancang bangun dan mengembangkan material baru agar mempunyai sifat-sifat dan fungsionalitas tertentu menggunakan pendekatan numerik dalam hal ini material dimodelkan sebagai suatu sistem partikel-partikel bermuatan yang saling berinteraksi. Pada umumnya partikel-partikel itu adalah inti atom dan elektron.
pada saat ini sangatlah bervariasi, dari yang amat sederhana, berbasis mekanika klasik hingga yang amat rumit berbasis mekanika kuantum karena melibatkan elektron, metodologi yang digunakan dalam rekayasa kuantum dan rancang bangun material adalah dinamika molekuler mengacu pada perhitungan mekanika kuantum melalui beberapa pendekatan matematis tanpa memasukkan data eksperimen. Salah satu perangkat lunak yang digunakan untuk merancang bangun material adalah Quantum Espresso.
2.9.1 Quantum Espresso.
Espersso merupakan singkatan dari opEn Source Package for Research inElectronic Structure, Simulation, and Optimization. QUANTUM ESPRESSO
adalah perangkat lunak open source berbasis linux berisi perhitungan
elektronik-struktur dan bahan pemodelan, berdasarkan teori kerapatan fungsional dan
pseudopotentials. Tampilan Situs Quantum Espresso seperti Gambar 2.38.
Gambar 2.38 Tampilan Situs Quantum Espresso
Program inti utama dalam Quantum Espresso adalah : PWSCF (Plane Wave Self Consistent Field) yang digunakan untuk melakukan perhitungan
File eksekusi bernama pw.x.CP (Car Parrinello) yang digunakan untuk
melaksanakan Car-Parrinello dinamika molekul simulasi.
QUANTUM ESPRESSO di jalankan menggunakan sistem operasi Linux
atau yang dikenal dengan nama Sistem operasi Ubuntu. Tampilan sistem Ubuntu 15.04 dapat dilihat pada Gambar 2.39 berikut.
Gambar 2.39 Tampilan Sistem Operasi Ubuntu 15.04
2.9.2 Density Functional Theory (DFT)
Menurut Sulistyani E.T., (2012). Teori fungsional densitas/ kerapatan (density functional theory) merupakan teori untuk mempelajari perilaku-perilaku
keadaan dasar sistem-sistem elektron melalui prinsip variasi. DFT dimungkinkan untuk mempelajari berbagai perilaku suatu sistem melalui besaran densitas (kerapatan) yang hanya bergantung pada titik dalam ruang. Dalam hal ini, energi total sistem merupakan fungsional dari kepadatan.
ini dalam mempelajari karakteristik struktur atom dipandang lebih mudah dan lebih praktis untuk mendapatkan hasil.
Teori fungsional densitas/ kerapatan :
a. Merupakan teori untuk mempelajari perilaku-perilaku keadaan dasar sistem-sistem elektron melalui prinsip variasi.
b. Merupakan suatu pendekatan pada struktur elektronik atom dan molekul. c. Menghitung total energi elektronik suatu molekul dan distribusi kerapatan
elektron secara keseluruhan.
d. Kerapatan elektron yang ditentukan dengan DFT mampu menunjukkan sifat dari molekul tersebut.
e. Hubungan elektron pada DFT didefinisikan sebagai perbedaan antara energi
Hartree-Fock dan solusi eksak dari persamaan Schrodinger.
f. Untuk mempelajari berbagai perilaku suatu sistem melalui besaran densitas (kerapatan) yang hanya bergantung pada titik dalam ruang. Dalam hal ini, energi total sistem merupakan fungsional dari kepadatan.
g. Merupakan salah satu gagasan eksak tentang masalah banyak partikel. Walaupun secara formal eksak, namun fungsional tersebut secara umum tidak diketahui.
h. Alternatif untuk mempelajari perilaku-perilaku keadaan dasar sistem-sistem elektron melalui prinsip variasi.
2.10 Penelitian Terdahulu dan Keterbaruan Penelitian
Barium heksaferit adalah magnet keramik merupakan bahan ferimagnetik dengan demikian magnet keramik tersebut tidak sekuat magnet logam, tetapi magnet tersebut termasuk magnet permanen dan tahan karat. Telah banyak dilakukan penelitan tentang barium heksaferit untuk mendapatkan magnet nano dengan variasi sifat magnetnya dan menurunkan biaya pembuatan yakni mempersingkat waktu proses pembutan dengan menerapkan berbagai macam metode pemrosesan, metode-metode pemrosesan tersebut pada umumnya terbagi kedalam dua cara yakni Top-down yakni memperkecil bahan baku yang awalnya
material nano secara sisntesis atau dengan kata lain melalui proses kimiawi salah satunya metode sol-gel. Berikut ini adalah sebagian penelitian yang terkait
dengan disertasi ini yaitu penelitian tentang barium heksaferit menggunakan metode sol-gel.
Gurbuz et al (2012) mensintesis barium heksaferit menggunakan metode sol-gel. Sebagai prekursor dugunakan : Barium nitrat (Ba(NO3)2, 99.999 %, Aldrich), ferric citrate mono hydrate (C6H5FeO7.H2O, 18–20 %, Fluka), manganese (II)nitrate tetrahydrate (Mn(NO3)2.4H2O,98.5 %, Merck), copper (II) nitrate trihydrate (Cu(NO3)2.3H2O, 99–104 %, Fluka), strontium nitrate
(Sr(NO3)2) dan nickel (II) nitrate hexahydrate (Ni(NO3)2.6H2O, 99.999 %, Aldrich), cobalt (II) chloride hexahydrate (CoCl2.6H2O, Sigma-Aldrich) sebagai
prekursor. Hasil sintesis dikeringkan pada temperatur 1800C selama 15 jam lalu disinter pada temperatur 10000C selama 5 jam menghasilkan partikel barium heksaferit bermorfologi bulat dengan diameter 460 nm. Sifat magnet yang diperoleh : momen magnet saturasi (Ms) = 55,64 emu/g dan koersivitas (Hc) = 214,598 kA/m= 0,27 T.
Murthy et al (2012) mensistesis barium heksaferit menggunakan metode sol-gel. Sebagai prekursor digunakan Ba(NO3)2.4H2O, Fe(NO3)2.9H2Odan asam sitrat dengan berbobot sesuai dengan rasio stoikiometri kemudian menambahkan NH3 untuk mendapatkan pH 12. Hasil sisntesis dipanaskan pada range temperatur 75–1500C, kemudian dikalsinasi pada temperatur 9500C selama 2 jam menghasilkan partikel barium heksaferit berformologi heksadesimal berkuran 90 nm dengan sifat magnet : Ms = 70 emu/g dan koersivitas Hc = 0,532 T.
Jazirehpour et al (2012) mensistesis barium heksaferit menggunakan
metode sol-gel. Sebagai prekursor digunakan barium carbonat (BaCO3), iron
nitrate (Fe(NO3)3.9H2O), magnesium nitrate (Mg(NO3)2.6H2O), titanium
tetra-isopropoxide dan menambahkan ethylene glycol (EG) sebagai templat. Hasil
Li et al (2012) mensistesis barium heksaferit menggunakan metode sol-gel. Sebagi prekursor digunakan barium nitrat (Ba(NO3)2), besi nitrat (Fe(NO3)3) dan asam citrat (C6H8O7·H2O), menambahkan amonia untuk mendapatkan pH 7-9. Hasil sintesis dikeringkan pada temperatur 1200C selama 10 jam kemudian dikalsinasi pada temperatur yang berbeda selama 4 jam pada tingkat 1200C/ jam sampai pada temperatur 9500C pada proses kalsinasi ditambah Bi
2O3. Diperoleh partikel barium heksaferit berformologi heksadesimal berukuran 0,5 – 2 m dengan sifat magnet : Ms = 57,9 emu/g dan Hc = 0,044 T.
Huang et al (2013) mensistesis barium heksaferit menggunakan metode sol-gel. Sebagi prekursor digunakan Barium nitrate (Ba(NO3)2), dan ferri nitrat
(Fe(NO3)3.9H2O) menambahkan polyethylene terephthalate/ asam citrat
(PET/CA) sebagai templat microfiber. Hasil sistesis dilakukan presintered pada
temperatur 4500C selama 2 jam dan dikalsinasi pada temperatur 11000C selama 2 jam menghasilkan partikel barium heksaferit bermorfologi nanofiber rata-rata
berukuran diameter 800 nm dengan sifat magnet : Ms= 68.47 Am2/kg (emu/g) . Chawla et al (2014) mensintesis barium heksaferit mnggunakan metode sol-gel menambahkan ethyleneglycol (50% volume/ larutan) sebagai templat.
Hasil sintesis dipanaskan pada temperatur 80-900C untuk mendapatkan gel selanjutnya dipanaskan pada temperatur 2500C selama 2 jam dan dilanjutkan dengan sintering pada temperatur 8500C ditahan selama 5 jam menghasilkan partikel barium heksaferit rata-rata bermorfologi heksagonal berukuran 41,62 nm dengan sifat magnet : Ms = 62,45 emu/g, Mr= 33,44 emu/g dan Hc= 0,543 T.
Berikut ini penelitian sebelumnya yang terkait dengan disertasi ini tentang barium heksaferit menghasilkan nanorod adalah sebagai berikut :
Cao et al (2010) mensintesis barium heksaferit menggunakan metode
reaksi precipitation-toptactic. Sebagai prekursor digunakan : FeSO4·7H2O, FeCl2·4H2O, BaCl2.2H2O ditambahkan NaOH sebagai pelarut dan α-FeOOH untuk oksidasi , -FeOOH untuk membentuk inti kristal serta NaCO3. Selanjutnya larutan prekursor dikalsinasi pada temperatur : 350, 600, 800, 900 dan 1000 0C. Kalsinasi pada temperatur 10000C menghasilkan partikel bermorfologi seperti
51.30 emu/g, Mr = 26.83 emu/g, Hc = 0,55β T (α) dan Ms= 49.99 emu/g, Mr = 24.33 emu/g, Hc= 0,330 T ().
Galvao et al (2014) mensistesis nano barium heksaferit menggunakan
metode pechini. Sebagi prekursor digunakan asam sitrat (Cargill, 98%), besi nitrat
(Vetec, 99%), barium carbonat (Vetec, 99%) danethylene glycol (Vetec, 98%).
Larutan perkursor diaduk menggunakan stirrer pada temperatur 700C. Kemudian larutan tersebut dipanaskan pada temperatur 900C untuk mendapatkan gel, dan dipanaskan lagi pada temperatur 3500C selama 2 jam untuk mendapatkan serbuk, setelah serbuk dihaluskan dikalsinasi pada temperatur 9000C selama 2, 4, 8 dan 16 jam. Kalsinasi pada temperatur 9000C selama 2 jam menghasilkan partikel barium heksaferit bermorfologi rod yang berukuran diameter = 70 nm dan panjang = 325
nm dengan sifat magnet : Ms dan Hc bervariasi tergantung lamanya kalsinasi sebagai berikut: 2 jam Ms = 41emu/g, Hc= 0,48 T.
Xu et al (2014) mensistesis barium heksaferit menggunakan metode reaksi topochemical. Sebagai prekursor digunakan : barium nitrat (Ba(NO3)2) dan ferri nitrat (Fe(NO3)2.9H2O) menambahkan α-FeOOH sebagai templat. Larutan disintesis didalam autoclave pada temperatur 2200C selama 24 jam. Prekursor
dikumpulkan dengan centrifugation, dicuci beberapa kali dengan air suling dan
ethanol. Setelah dikeringkan pada temperatur 600C, prekursor dipanaskan pada temperatur 4500C selama 3 jam di udara, kemudian serbuk yang dihasilkan dikalsinasi pada temperatur 800, 1000 dan 11000C selama 3 jam. Pada kalsinasi temperatur 10000C diperoleh partikel barium heksaferit bermorfologi rod berukuran diameter 250 nm dan panjang 1000 nm, dengan sifat magnet Ms = 62,5
emu/g; Hc= 0,38 Tesla.
Septiadi, A dan Purwasasmita, B.S. (2014) mensistesis barium heksaferit menggunakan metode sol-gel. Sebagai prekursor digunakan : barium nitrat
(Ba(NO3)2, purity ≥ 98%), besi (III) nitrat (Fe(NO3)3, purity ≥ 98%)
menambahkan 2% larutan kitosan sebagai dispersant dan 0,5% larutan tapioka
Sampel dengan rasio 1/2 dan sampel dengan rasio 1/1 mengandung partikel hanya berbentuk rod berdiameter 200 nm (untuk rasio 1/2) dan 200 nm – 500 nm
(untuk rasio 1/1), dengan sifat magnet : Mr = 23,2 emu/g (untuk rasio 1/2) dan 19,6 emu/g (untuk rasio 1/1), Hc = 0,14 T (untuk rasio 1/2) dan 0,12 T (untuk rasio 1/1).
Hasil penelitian sebelumnya yang meneliti pemberian atom doping pada BaFe12O19 adalah sebagai berikut :
Xie et al (2012) mensintesis Ba(La/Nd)xFe12−2xO19, menggunakan metode in situ chemical polymerization of pyrrole. Sebagai prekursor digunakan :
lanthanum nitrat (La(NO3)3.9H2O), neodymium nitrat (Nd(NO3)3.xH2O), barium nitrat (Ba(NO3)2), besi nitrat (Fe (NO3)3.9H2O), natrium dodesil benzena sulfonat (NaDBS), besi klorida (FeCl3·6H2O) dan menambahkan asam sitrat (C6H8O7.H2O). Larutan prekursor di aduk menggunakan stirrer pada temperatur 800C dan keringkan dalam kondisi fakum pada temperatur 600C selama 24 jam kemudian dilanjutkan dengan kalsinasi pada temperatur 8000C selama 3 jam. Hasil karakterisasi menunjukkan ukuran partikel berdiametr 200 – 300 nm dengan sifat magnet (Ms, Mr dan Hc) menurun sejalan dengan penambahan atom doping (La/Nd).
Kanagesan et al (2014) mensintesis BaFe1β−βxZnxNbxO19 menggunakan proses kimiawi. Sebagai prekursor digunakan : Ba(NO3)2 (99.5%), Fe(NO3)3·9H2O (99.9%), Zn(NO3)2·6H2O, NbCl5 dan menambahkan D-Fructose, x = (0,2 ; 0,4 ; 0,6 dan 0,8) mol. Larutan prekursor di aduk menggunakan stirrer pada temperatur 800C dan keringkan dalam kondisi fakum pada temperatur 1300C selama 2 hari kemudian dilanjutkan dengan kalsinasi pada temperatur 11500C selama 10 menit. Hasil karakterisasi menunjukkan bentuk partikel adalah hexagonal dengan sifat magnet (Ms, Mr dan Hc) menaik sejalan dengan penambahan atom doping (La/Nd).
Moitra et al (2014) mensintesis BaAlxFe12-xO19 menggunakan komputasi
dengan variasi x = 0,5 hingga x = 4 dengan interval 0,5. Total energi perhitungan dan geometri optimasi yang dilakukan menerapkan density-functional theory
yang menggunakan PERDEW-Burke-Ernzerhof (PBE). Hasil komputasi
menunjukkan sifat magnet menurun sejalan dengan penambahan nilai x.
Hasil penelitian sebelumnya atas pada umumnya menggunakan metode
sol-gel dan tanpa dispersant sedangkan yang menggunakan templat pada
umumnya menggunakan templat sintesis. Penelitian yang menghasilkan partikel barium heksaferit bermorfologi nanorod lebih sedikit dibandingkan yang
menghasilkan partikel barium heksaferit bermorfologi heksagonal dan bulat, Berdasarkan penelitian sebelumnya di atas maka keterbaruan penelitian ini adalah : penggunaan larutan kitosan 1% w/v sebanyak 10% v/v, penggunaan larutan tapioka 5% sebanyak (0, 5, 10 dan 15) % v/v, dan variasi jumlah atom Nd (sebagai doping) pada sintesis Ba(Nd)xFe12O19 berbasis metode sol-gel.
Keterbaruan ini juga dilengkapi dengan dilakukan simulasi struktur Ba(Nd)xFe12O19 dalam ukuran bulk. Penggunaan larutan kitosan 1% w/v untuk mencegah pengendapan atau penggumpalan partikel tersuspensi dalam cairan yang disebut dengan dispersant, penggunaan larutan tapioka 5% w/v berfarisai (0,
5, 10 dan 15) % v/v untuk mengetahui sebera jauh peningkatan koersifitas (ciri
hardmagnet) jika dibandingkan dengan tanpa larutan tapioka, sedangkan
penambahan atom Nd sebagai doping untuk mengetahui perubahan sifat magnet barium heksaferit yang didoping atom logam tanah jarang (Nd) dan membuat simulasi struktur Ba(Nd)xFe12O19 untuk membandingkan dengan teori.
2.11 Kerangka Konseptual
Berdasarkan hal di atas maka yang menjadi objek permasalahan pada penelitian ini adalah bagai mana cara meningkatkan sifat magnet serbuk Ba(Nd)xFe12O19 sekaligus dapat menghemat biaya dalam proses pembuatannya. Penelitian ini menekankan pada upaya peningkatkan sifat magnet serbuk Ba(Nd)xFe12O19 pada proses pembuatanya dengan cara membentuk morfologi
nanorod pada serbuk Ba(Nd)xFe12O19. Pembentukan nanorod dengan cara
penggunaan templat yang ada pada larutan tapioka. Penghematan biaya dilakukan dengan cara menggunakan metode sol-gel, penambahan dispersant dan templat
Variabel bebas dan variabel terikat pada penelitian ini dapat diuraikan sebagai berikut : variabel bebas adalah variasi jumlah larutan tapioka sebagai templat pada variasi jumlah atom Nd sebagai doping untuk BaFe12O19, sedangkan variabel terikatnya adalah sifat magnet yaitu : Ms, Mr dan Hc.
2.12 Hipotesa
Pada penelitian ini dapat dibuat hipotesa sebagai berikut :
1. Morfologi nanorod Ba(Nd)xFe12O19 dapat diperoleh dengan cara sintesis
menerapkan metode Sol-gel menggunakan kitosan sebagai dispersant dan pati
tapioka sebagai templat.
2. Penggunaan pati tapioka dapat meningkatkan sifat magnet.