i
PRODUKSI GAS HIDROGEN MENGGUNAKAN
ELEKTRODA STAINLESS STEEL/Fe-Co-Ni DENGAN MEDIA TEPUNG BIJI RAMBUTAN(Nephelium lappaceum l.)
SKRIPSI
Diajukan kepada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta
Untuk Memenuhi Sebagian Persyaratan Guna Memperoleh Gelar Sarjana Sains Kimia
Oleh:
ABDURROHMAN AFIEF NIM 13307141041
PROGRAM STUDI KIMIA JURUSAN PENDIDIKAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA
▸ Baca selengkapnya: diketahui kode elektroda exx2x. menurut aws, angka 2 menunjukkan elektroda dapat digunakan untuk
(2)(3)(4)(5)v MOTTO
“Katakanlah (Muhammad), “Sesungguhnya sholatku, ibadahku, hidupku, dan matiku hanyalah untuk Alloh, Tuhan seluruh alam,
Tidak ada sekutu bagi-Nya, dan demikianlah yang diperintahkan kepadaku dan aku adalah orang yang pertama berserah diri (muslim)”
vi
PERSEMBAHAN
Dengan menyebut nama Allah Yang Maha Pengasih lagi Maha Penyayang Naskah Tugas Akhir Skripsi ini saya persembahkan kepada:
1. Kedua Orang Tua saya yang tak pernah lelah mendukung dan memberi semangat hingga detik ini. Sayang kalian Abi, Umi
2. Keluarga Kelas Kimia E 2013 atas kebersamaan yang telah dilalui bersama (read hunger games bersama). Semoga kelak reuni semua sudah sukses
3. Bapak dan ibu dosen jurusan pendidikan Kimia FMIPA UNY atas ilmu, bimbingan, dan teladan yang telah diberikan.
4. Ibu Isana Supiah YL sebagai orang tua saya dalam pengerjaan skripsi yang tak pernah lelah membantu, membimbing, dan mengingatkan tentang tugas ini
5. Ibu Sri Handayani sebagai ibu PA selama saya kuliah di UNY. Maaf banyak merepotkan bu
6. Keluarga HIMAKI 2014 dan HIMAKI 2015 yang telah banyak memberi pembelajaran dan pendewasaan ... Sukses selalu
7. Keluarga DPM FMIPA UNY 2016 yang memberi banyak sekali ilmu serta pengalaman mengesankan. #Viva legislativa
vii
PRODUKSI GAS HIDROGEN MENGGUNAKAN ELEKTRODA
STAINLESS STEEL/Fe-Co-Ni DENGAN MEDIA TEPUNG
BIJI RAMBUTAN(Nephelium lappaceum l.)
Oleh : Abdurrohman Afief NIM. 13307141041
Pembimbing : Dr. Isana Supiah Yosephine Louise, M.Si ABSTRAK
Penelitian ini dilakukan untuk mengetahui aktivitas elektroda stainless
steel dan elektroda stainless steel/Fe-Co-Ni sebagai elektroda kerja pada
elektrolisis air dalam produksi gas hidrogen, dan mengetahui produksi maksimal gas hidrogen dengan modifikasi media elektrolisis menggunakan tepung biji rambutan.
Subjek penelitian adalah elektroda stainless steel/Fe-Co-Ni, objeknya adalah aktivitas elektroda stainless steel dan stainless steel/Fe-Co-Ni, dan efisiensi produksi gas hidrogen. Produksi gas hidrogen dilakukan secara elektrolisis air dengan elektrolit pendukung NaHCO3 dan modifikasi media
tepung biji rambutan sebanyak: 0 hingga10 gram. Karakterisasi permukaan elektroda stainless steel/Fe-Co-Ni menggunakan SEM dan XRD. Data kuantitatif diperoleh dari voltameter eDAQ Echem dan EDX.
Penggunaan elektroda stainless steel dan stainless steel/Fe-Co-Ni dengan media tepung biji rambutan memberikan hasil yang kurang baik dibandingkan pada elektrolisis tanpa penambahan tepung biji rambutan. Penggunaan elektroda
stainless steel/Fe-Co-Ni memberikan hasil yang lebih baik daripada elektroda stainless steel berdasarkan efisiensi jumlah produksi gas hidrogen dan energi yang
dibutuhkan untuk produksi gas hidrogen.
Kata Kunci : elektroda stainless steel/Fe-Co-Ni, elektrolisis, produksi gas hidrogen, tepung biji rambutan, voltametri siklik
viii
HYDROGEN GAS PRODUCTION USING STAINLESS STEEL/Fe-Co-Ni ELECTRODE WITH RAMBUTAN(Nephelium lappaceum l.)
SEED FLOUR MEDIA
By :
Abdurrohman Afief
Number of Student: 13307141041
Supervisor : Dr. Isana Supiah Yosephine Louise, M.Si ABSTRACT
The objective of this reserch is to know the activity of stainless steel electrode and stainless steel / Fe-Co-Ni electrode as working electrode on water electrolysis in hydrogen gas production, and to know the maximum production of hydrogen gas with modification of electrolysis media using rambutan seed flour.
Research subjects are stainless steel / Fe-Co-Ni electrodes, the object is the activity of stainless steel and stainless steel / Fe-Co-Ni electrodes, and the efficiency of hydrogen gas production. Production of hydrogen gas was carried out by electrolysis of water with electrolytes supporting NaHCO3 and
modification of rambutan seed flour medium: 0 to 10 gram. Surface characterization of stainless steel /Fe-Co-Ni electrode was performed by SEM and XRD. Quantitative data were performed by eDAQ Echem voltameter and EDX.
The use of stainless steel and stainless steel/ Fe-Co-Ni electrodes with rambutan seed flour medium yield poor results compared to electrolysis without the addition of rambutan seed flour. The use of stainless steel / Fe-Co-Ni electrodes provides better results than stainless steel electrodes based on the efficiency of the amount of hydrogen gas production and the energy required for the production of hydrogen gas.
Keywords:stainless steel/ Fe-Co-Ni electrode, electrolysis, hydrogen gas production, rambutan flour, cyclic voltammetry
ix
KATA PENGANTAR
Assalamualaikum Warahmatullahi Wabarakatuh
Puji syukur saya panjatkan kehadirat Alloh SWT atas limpahan rahmat, dan hidayah-Nya sehingga laporan tugas akhir ini mampu penulis selesaikan. Sholawat serta salam selalu terlimpah kepada Nabi Muhammad SAW serta keluarga, sahabat, dan para pengikutnya yang setia pada ajarannya sampai hari kiamat.
Penelitian berjudul “Produksi Gas Hidrogen Menggunakan Elektroda
Stainless steel/Fe-Co-Ni dengan Media Tepung Biji Rambutan(Nephelium lappaceum l.)” telah dapat saya selesaikan dengan baik sebagai salah satu
persyaratan memperoleh gelar sarjana sains yang telah ditetapkan oleh Jurusan pendidikan Kimia di Universitas Negeri Yogyakarta. Banyak pembelajaran yang saya dapat selama mengerjakan rangkaian proses pengerjaan skripsi ini semenjak penelitian hingga pengerjaan laporan tugas akhir ini selesai. Pada kesempatan ini perkenankanlah saya sebagai penulis mengucapkan terima kasih kepada:
1. Bapak Dr.Hartono selaku Dekan FMIPA Universitas Negeri Yogyakarta yang telah memberikan izin dalam penulisan tugas akhir ini.
2. Bapak Drs. Jaslin Ikhsan, M.App.Sc., Ph.D selaku Ketua dan Koordinator Tugas Akhir Skripsi Program Studi Kimia, Jurusan Pendidikan Kimia, Universitas Negeri Yogyakarta yang telah memberikan kelancaran pelayanan dan urusan akademik selama pengerjaan tugas akhir ini.
3. Ibu Dr. Sri Handayani, M.Si selaku Dosen Penasehat Akademik yang telah memberikan dorongan dan motivasi untuk mengerjakan penulisan tugas akhir skripsi ini.
4. Ibu Dr. Isana Supiah Yosephine Louise, M.Si selaku dosen pembimbing penelitian yang telah banyak memberikan masukan, saran, bimbingan, dan bantuan dalam proses penelitian sehingga proses penelitian ini dapat diselesaikan.
x
5. Kedua orang tua saya yang telah banyak memberikan dorongan, motivasi, dan bantuan materiil serta non materiil selama pelaksanaan penelitian sehingga penelitian ini dapat diselesaikan dengan tepat waktu..
6. Seluruh pihak yang telah membantu terselesaikannya penelitian dan penulisan tugas akhir ini yang tidak bisa saya sebutkan satu persatu.
Penulis menyadari bahwa dalam penulisan tugas akhir ini masih jauh dari kesempurnaan, maka penulis mengharapkan kritik dan saran yang membangun dari berbagai pihak demi perbaikan laporan ini. Semoga laporan ini dapat bermanfaat bagi pembaca laporan tugas akhir ini.
Wassalamualaikum Warrahmatullohi Wabarokatuh
Yogyakarta, 31 Juli 2017
xi DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN ... ii
HALAMAN PERNYATAAN ... iii
HALAMAN PENGESAHAN ... iv MOTTO ... v PERSEMBAHAN ... vi ABSTRAK ...vii ABSTRACT...viii KATA PENGANTAR ... ix DAFTAR ISI ... xi
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN A. Latar Belakang Masalah... 1
B. Identifikasi Masalah ... 4
C. Pembatasan Masalah ... 4
D. Rumusan Masalah ... 5
E. Tujuan Penelitian ... 5
F. Manfaat Penelitian ... 6
BAB II KAJIAN TEORI A. KAJIAN PUSTAKA ... 7
1. Gas Hidrogen ... 7
2. Reaksi Elektrolisis Air ... 8
3. Elektroda Stainless steel ... 11
4. Elektroda Stainless steel/Fe-Co-Ni ... 12
5. Metode Elektrodeposisi ... 13
6. Biji Rambutan ... 15
7. eDAQ EChems ... 18 Halaman
xii
8. SEM-EDX ... 21
9. XRD ... 22
B. PENELITIAN RELEVAN ... 24
C. KERANGKA BERPIKIR ... 26
BAB III METODE PENELITIAN A. Subjek dan Objek Penelitian ... 28
1. Subjek Penelitian ... 28 2. Objek Penelitian ... 28 B. Variabel Penelitian ... 28 1. Variabel bebas... 28 2. Variabel Terikat ... 28 3. Variabel Kontrol ... 29
C. Alat dan Bahan Penelitian ... 29
1. Alat Penelitian... 29
2. Bahan-bahan Penelitian ... 29
D. Prosedur Penelitian ... 30
1. Preparasi Elektroda Stainless steel/Fe-Co-Ni ... 30
2. Elektrolisis H2O ... 30
E. Teknik Pengambilan Data ... 31
BAB IV HASIL PENELITIAN DAN PEMBAHASAN A. Preparasi Tepung Biji Rambutan(Nephelium lappaceum l.) ... 33
B. Preparasi Sampel Elektrolisis... 34
C. Elektrodeposisi Logam Fe-Co-Ni pada Elektroda Stainless steel ...35
D. Karakterisasi Elektroda SS dan Elektroda SS/Fe-Co-Ni ... ...37
1. Karakterisasi SEM-EDX... 37
2. Karakterisasi XRD ... 40
E. Elektrolisis Air ... 41
BAB V SIMPULAN DAN SARAN A. Simpulan ... 49
B. Saran ... 50
DAFTAR PUSTAKA ... 51
xiii
DAFTAR TABEL
Tabel 1. Data energi kalor yang dihasilkan dari beberapa hidrokarbon ... 8
Tabel 2. Data kandungan stainless steel S-430 ... 11
Tabel 3. Data nama sampel berdasarkan massa tepung yang ditambahkan ... 31
Tabel 4. Kandungan logam pada stainless steel/Fe-Co-Ni ... 39
Tabel 5. Data efisiensi energi dan arus katodik hasil elektrolisis menggunakan elektroda Stainless steel dan stainless steel/Fe-Co-Ni ... 42
Tabel 6. Nilai efisiensi produk dan overpotential pada proses elektrolisis... 45
Tabel 7. Data kondisi optimum menggunakan elektroda stainless steel dan stainless steel/Fe-Co-Ni ... 47
xiv
DAFTAR GAMBAR
Gambar 1. Skema elektrolisis air dalam suasana basa ... 10
Gambar 2. Skema perangkat elektrodeposisi ... 14
Gambar 3. Biji rambutan (Nephelium lappaceum l.) ... 16
Gambar 4. Voltamogram Linear ... 19
Gambar 5. Voltamogram siklik ... 20
Gambar 6. Contoh hasil karakterisasi SEM-EDX... 22
Gambar 7. Skema cara kerja XRD ... 23
Gambar 8. Grafik voltamogram linear elektrodeposisi ion Fe2+ , Co2+, Ni2+ ... 36
Gambar 9. (a) Hasil karakterisasi SEM elektroda stainless steel, (b) Hasil karakterisasi SEM elektroda stainless steel/Fe-Co-Ni ... 38
Gambar 10. Karakterisasi XRD terhadap SS dan SS/Fe-Co-Ni ... 40
Gambar 11. Arus katodik elektroda Stainless steel dan Stainless steel/Fe-Co-Ni 43 Gambar 12.Energi yang dibutuhkanuntukelektrolisispadaelektrodastainless steel danstainless steel/Fe-Co-Ni……….……..… 44
xv
DAFTAR LAMPIRAN
Lampiran 1. Perhitungan Data Kuantitatif Hasil Penelitian ... 56 Lampiran 2. Diagram Alir Proses ... 58 Lampiran 3. Kurva Voltamogram pada Penambahan Tepung Biji Rambutan .... 61 Lampiran 4. Karakterisasi Kualitatif dengan XRD dan SEM-EDX ... 65 Halaman
1 BAB I PENDAHULUAN
A. Latar Belakang Masalah
Energi yang sangat diperlukan oleh seluruh makhluk hidup. Energi menjadi syarat dapat berlangsungnya kehidupan karena energi menjadi penopang segala aktivitas makhluk hidup. Energi bahan bakar merupakan salah satu jenis energi yang sangat diperlukan bagi kehidupan manusia.. Energi bahan bakar dapat diperoleh dari berbagai sumber, diantaranya berasal dari batu bara dan minyak bumi. Minyak bumi menopang mayoritaskebutuhan energi bahan bakar karena hasil pengolahannya yang beragam dapat dimanfaatkan bagi kebutuhan manusia khususnya transportasi. Besarnya peran minyak bumi menjadikan minyak bumi sering disebut sebagai ‘emas hitam’ karena warnanya gelap namun memiliki nilai jual yang tinggi.
Produksi minyak bumi di Indonesia dari tahun 1965 hingga 1977 terus meningkat karena pada saat tersebut merupakan masa pembukaan kilang minyak di Indonesia. Produksi minyak bumi di Indonesia mengalami fluktuasi yang stabil dan dapat memenuhi kebutuhan konsumsi minyak bumi hingga tahun 2004. Di sisi lain konsumsi dan kebutuhan minyak bumi terus meningkat karena semakin banyaknya jumlah kendaraan bermotor, dan kebutuhan hidup lain seperti listrik dan industri. Mulai tahun 2004 produksi minyak bumi di Indonesia tidak mampu mencukupi kebutuhan konsumsi minyak bumi di Indonesia. Dengan kata lain pemenuhan kebutuhan minyak bumi diperoleh secara impor dari luar negeri.
2
Besarnya ketergantungan manusia terhadap ketersediaan minyak bumi perlu dikurangi. Mazloomi (2012), telah melakukan berbagai penelitian untuk memperoleh solusi pada permasalahan ini dengan menawarkan penggunaan bahan bakar terbarukan. Penelitian mengenai energi terbarukan yang kini dikembangkan adalah pemanfaatan bahan bakar hidrogen (Hydrogen Fuel Cell). Gas hidrogen (H2) merupakan gas yang memiliki kelimpahan paling besar yaitu 75% penyusun
alam semesta dan hampir 90% membentuk unsur di alam. Gas hidrogen sedikit ditemukan di atmosfer bumi karena apabila memasuki atmosfer dalam bentuk gas maka akan berbenturan dengan unsur lain dan akan terlempar kembali keluar atmosfer bumi. Di bumi hidrogen bersenyawa dengan unsur oksigen membentuk senyawa H2O yang sering disebut dengan air. Pembakaran gas hidrogen
menghasilkan energi yang cukup besar.
Menurut Vanags (2012), hidrogen tidak tersedia di bumi dalam keadaan bebas melainkan diproduksi secara industri sehingga harga akhir dari gas hidrogen ditentukan melalui proses produksi yang digunakan. Inilah alasan penelitian tentang ekektrolisis air menjadi sangat penting. Gas hidrogen (H2) dapat diperoleh
salah satunya dengan metode elektrolisis air. Gas hidrogen (H2) dapat dipisahkan
dari molekul air dengan cara memasukkan arus listrik dengan besaran yang sesuai sehingga gas oksigen dan hidrogen akan dapat dipisahkan.
3
Elektroda yang digunakan pada proses elektrolisis seharusnya memiliki sifat tidak mudah korosi agar tidak mudah rusak ketika digunakan. Logam yang tidak mudah korosi dapat digunakan logam mulia seperti platinum (Pt) atau emas (Au). Kendala yang dihadapi apabila menggunakan logam mulia tersebut adalah harga yang relatif mahal. Alternatif yang dapat dilakukan adalah menggunakan logam non-mulia yang memiliki sifat mirip dengan logam mulia tersebut. Logam non-mulia yang dapat menjadi alternatif adalah stainless steel.
Logam stainless steel memiliki daya tahan terhadap korosi yang cukup baik karena adanya kandungan kromium yang dapat menghambat interaksi dengan oksigen membentuk kromium oksida (CrO) sehingga menghambat korosi. Kelemahan ketika menggunakan logam stainless steel adalah rendahnya aktifitas sebagai katalis terhadap adsorpsi atau desorpsi ion H+. Modifikasi pada elektroda berupa penambahan logam-logam yang bersifat katalitik seperti Fe, Co, dan Ni. Penggunaan logam Fe, Co, dan Ni sebagai tambahan pada elektroda stainless steel karena adanya kemiripan sifat, ukuran, dan mudah ditemui. Penempelan logam Fe, Co, dan Ni tersebut dilakukan dengan metode elektrodeposisi.Modifikasi pada media elektrolisis air yaitu dengan menambahkan tepung biji rambutan
(Nephelium lappaceum l.). Penggunaan tepung biji rambutan(Nephelium
lappaceum l.) sebagai media elektrolisis air bertujuan untuk mengetahui aktivitas
katalitik elektroda stainless steel/Fe-Co-Ni dalam media tepung biji rambutan(Nephelium lappaceum l.).
4 B. Identifikasi Masalah
Berdasarkan latar belakang masalah maka dapat diidentifikasi permasalahan yang ada yaitu:
1. Perlunya pengembangan sumber energi terbarukan sebagai pengganti minyak bumi.
2. Energi hidrogen potensial untuk dikembangkan karena bahan baku yang melimpah, ramah lingkungan, dan energi yang dihasilkan cukup besar.
3. Perlunya modifikasi proses produksi gas hidrogen secara elektrolisis air.
4. Jenis dan kondisi modifikasi proses elektrolisis air untuk produksi gas hidrogen.
C. Pembatasan Masalah
Berikut batasan masalah yang didasarkan pada identifikasi masalah diatas supaya penelitian yang dilakukan efektif:
1. Jenis paduan logam yang digunakan sebagai substrat adalah stainless steel tipe S-430, ketebalan 1,2 mm; lebar 3 mm; dan panjang 110 mm
2. Metode yang digunakan untuk pembuatan elektroda stainless steel/Fe-Co-Ni adalah elektrodeposisi.
3. Modifikasi media elektrolisis airmenggunakan tepung biji rambutan
(Nephelium lappaceum l.).
4. Efisiensi produksi gas hidrogen ditentukan berdasarkan efisiensi jumlah produk dan efisiensi energi.
5 D. Rumusan Masalah
Berdasarkan identifikasi masalah dan batasan masalah, maka dapat dirumuskan masalah sebagi berikut:
1. Bagaimana karakter elektroda stainless steel/Fe-Co-Ni?
2. Bagaimana jumlah produk gas hidrogen, energi yang dibutuhkan, dan kondisi optimum pada penggunaan elektrodastainless steel danstainless steel/Fe-Co-Ni pada elektrolisis air menggunakan media tepung biji rambutan(Nephelium
lappaceum l.) pada elektrogenerasi hidrogen?
E. Tujuan Penelitian
Berdasarkan latar belakang dan rumusan masalah di atas, penelitian ini bertujuan:
1. Mengkarakterisasi elektroda stainless steel/Fe-Co-Ni.
2. Menentukan jumlah produk gas hidrogen, energi yang dibutuhkan, dan kondisi optimum pada penggunaan elektroda stainless steel dan stainless steel/Fe-Co-Ni pada elektrolisis air menggunakan media tepung biji rambutan(Nephelium
6
F.
Manfaat PenelitianManfaat yang diperoleh dari penelitian ini adalah sebagai berikut: 1. Memberi informasi mengenai karakter elektroda stainless steel/Fe-Co-Ni. 2. Memberi informasi mengenai jumlah produk gas hidrogen, energi yang
dibutuhkan, dan kondisi optimum pada penggunaan elektroda stainless steel dan stainless steel/Fe-Co-Ni pada elektrolisis air menggunakan media tepung biji rambutan (Nephelium lappaceum l.)pada elektrogenerasi hidrogen.
7 BAB II KAJIAN TEORI
A. KAJIAN PUSTAKA 1. Gas Hidrogen
Hidrogen merupakan unsur kimia pada Tabel periodik unsur dengan simbol H dan nomor atom 1. Pada suhu dan tekanan standar hidrogen tidak berwarna, tidak berbau, bersifat non logam, bervalensi tunggal, dan merupakan gas diatomik yang mudah terbakar. Hidrogen adalah gas ringan (lebih ringan dari udara) yang apabila terbakar tidak menunjukkan adanya nyala dan akan menghasilkan panas yang sangat tinggi. Persamaan reaksi pembakaran hidrogen dinyatakan sebagai berikut:
2H2(g)+ O2(g)2H2O(l)ΔH=+572kJ (286kJ/mol) ... (1)
Wardani(2010) menyebutkan hidrogen adalah unsur paling melimpah dengan presentase 75% dari total massa unsur alam semesta. Kebanyakan bintang dibentuk hidrogen dalam keadaan plasma. Senyawa hidrogen relatif langka ditemukan secara alami di muka bumi. Kelimpahan hidrogen di bumi nomor 3 setelah silikon dan oksigen. Produksi hidrogen banyak dihasilkan secara industri dari senyawa hidrokarbon seperti metana. (Dewi, 2011: 3-5) menyatakan produksi hidrogen dapat diperoleh dari hidrolisis biomassa, elektrolisis metanol, dan elektrolisis air. Hidrogen memiliki kandungan kalor yang relatif tinggi dibandingkan beberapa bahan bakar lain per satuan berat. Data energi tersebut ditampilkan pada Tabel 1:
8
Tabel1. Data energi kalor yang dihasilkan dari beberapa hidrokarbon Bahan Bakar Kalor yang Dihasilkan
(kJ/gram) Angka Oktan Hidrogen 141,86 130 Metana 55,53 125 Propana 50,36 105 Oktana 48 100 Bensin 47,5 87 Diesel 44,8 31 Metanol 19,96 (Sumber : Wardhani, 2010)
Hidrogen merupakan unsur kimia yang sangat reaktif sehingga jarang ditemukan dalam keadaan bebas. Rufiati(2011) menyebutkan hidrogen dalam keadaan bebas berupa molekul diatomik, H2. Di alam, hidrogen tersebar dalam
keadaan bereaksi dengan unsur lain seperti oksigen dan karbon. Reaksi hidrogen dengan oksigen ditemukan dalam senyawa air yang jumlahnya sangat melimpah di bumi. Sebelum dapat dimanfaatkan sebagai bahan bakar diperlukan pemisahan gas hidrogen dari senyawa asal. Metode yang dapat digunakan untuk memisahkan gas hidrogen dari air salah satunya dengan cara elektrolisis air.
2. Reaksi Elektrolisis Air
Elektrolisis air merupakan peristiwa penguraian air (H2O) menjadi oksigen
(O2) dan hidrogen (H2) menggunakan arus listrik. Elektrolisis satu mol air
menghasilkan 1 mol gas hidrogen dan ½ mol gas oksigen dalam bentuk diatomik. Persamaan reaksi elektrolisis air ditunjukkan persamaan (2):
9
Beda potensial yang dihasilkan arus listrik pada anoda dan katoda mengionisasi molekul air menjadi ion positif dan ion negatif. Pada katoda terdapat ion positif yang menyerap elektron dan menghasilkan molekul H2, dan ion negatif
akan bergerak menuju anoda untuk melepaskan elektron dan menghasilkan molekul O2. Reaksi setengah sel pada reaksi elektrolisis air dibedakan
berdasarkan elektrolit yang digunakan dalam proses elektrolisis. Perbedaan reaksi setengah sel ditampilkan sebagai berikut:
Elektrolit asam:
Anoda : H2O(l) ½ O2(g) + 2H+(aq) + 2e- ... (3)
Katoda : 2H+(aq) + 2e- H2(g) ... (4)
Total : H2O(l) H2(g) + ½ O2(g) ... (5) Elektrolit Basa :
Anoda : 2OH-(aq) ½ O2(g) + H2O(l) + 2e- ... (6)
Katoda : 2H2O(l) + 2e- H2(g) + 2OH-(aq) ... (7)
Total : H2O(l) H2(g) + ½ O2(g) ... (8)
Dalam penelitian ini elektrolisis air dilakukan untuk mengetahui pengaruh penggunaan elektroda stainless steel/Fe-Co-Ni dan modifikasi media tepung biji rambutan terhadap produk gas hidrogen yang dihasilkan. Menurut Mazloomi (2012), perlu digunakan larutan air tanpa ion (aqua demineralisasi) sebagai air yang dielektrolisis karena air yang terkontaminasi mengakibatkan reaksi samping dalam cell.Adanya ion dengan konsentrasi terlalu tinggi juga mengakibatkan penurunan nilai impedansi.
10
Elektrolit yang digunakan adalah NaHCO3yang memiliki sifat basa.
Elektrolisis dalam suasana basa lebih sering dilakukan. Farid (2012) menyimpulkan penggunaan katalis KOH memberikan hasil lebih baik dibandingkan H2SO4. Dharmaraj(2016), menyimpulkan produksi H2 meningkat
sebanding peningkatan NaOH dalam larutan.Elektrolisis air yang dilakukan dalam suasana basa sehingga persamaan reaksi setengah sel yang terjadi pada anoda mengacu persamaan (6) dan reaksi pada katoda mengacu pada persamaan (7). Skema elektrolisis air yang dilakukan dalam penelitian ini ditunjukkan pada Gambar 1:
(Sumber: Fahrudin, 2015: 2)
Gambar 1. Skema elektrolisis air dalam suasana basa
Menurut Alimah (2008), metode produksi gas hidrogen ada 3 yaitu: elektrolisis, steam reforming, dan termokimia siklus sulfur-iodine. Diantara metode tersebut dalam hal efisiensi, biaya produksi, biaya modal, dan biaya energi, metode elektrolisis adalah metode yang paling buruk dibandingkan 2 metode yang lain. Pengembangan metode elektrolisis masih sangat dibutuhkan guna meningkatkan produksi gas hidrogen.
11 3. Elektroda Stainless steel
Logam stainless steel merupakan campuran logam besi yang mengandung ≥ 10,5% kromium dan ≤ 1,2% karbon. Berdasarkan (Handbook of Stainless steel, 2013),kromium dalam logam bereaksi dengan oksigen menjadi kromium oksida yang pada akhirnya berperan sebagai pelindung kromium dari korosi. Sifat kromium diantaranya adalah tahan korosi, tahan panas, dan dapat didaur ulang.
Logam stainless steel yang digunakan dalam penelitian ini adalah stainless
steel tipe S-430. Stainless steel tipe ini mengombinasikan antara sifat tahan korosi
dan tahan panas, serta tahan reaksi oksidasi pada temperatur diatas 1500oF. Selain itu, logam ini tahan terhadap pengaruh asam seperti: Asan nitrat, gas sulfur, dan makanan dengan sifat asam. Wahyono (2015), menyatakan logam stainless steel S-430 memiliki struktur kristal BCC (Body Center Cubic) dan laju korosi 0,1142m/tahun. Berdasarkan data (AK Steel, 2007), menginformasikan kandungan stainless steel S-430 berdasarkan Tabel 2:
Tabel2. Data kandungan stainless steel S-430
Kandungan % Karbon 0.12 Mangan 1.00 Pospor 0,040 Sulfur 0.030 Silikon 1.00 Kromium 16.0-18.0 Nikel 0.50 Besi 76
12
Adanya logam-logam yang bersifat katalis membuat logam stainless steel sering digunakan sebagai elektroda pada kegiatan elektrokimia. Salah satunya yang dilakukan oleh Andewi (2014), yang menggunakan logam stainless steel sebagai katoda pada produksi gas hidrogen dengan variasi tegangan dan salinitas. Isana (2010) menunjukkan penggunaan stainless steel dapat digunakan sebagai elektroda pada produksi gas hidrogen secara elektrolisis air.
4. Elektroda Stainless steel/Fe-Co-Ni
Elektroda yang sering digunakan sebagai anoda maupun katoda dalam fuel
cell adalah platinum (Pt). Penggunaan Pt didasari sifatnya sebagai logam yang
aktif diantara logam mulia yang lain, stabil dalam kondisi asam tinggi, dan aktifitasnya tinggi. Kelemahan platinum adalah harganya yang mahal dan mudah terdeaktivasi oleh CO. Menurut Mahreni (2011), katalis non Platinum dapat menyamai aktivitas dan stabilitas Platinum dengan cara mensubtitusi unsur N ke dalam komponen aktif katalis (M/C) dengan (M=Pd, Ru, Fe, Co, Ni, atau logam transisi lain).
Romdhane(2013) menyebutkan elektroda dengan material homogen alumunium memiliki kekurangan dengan masa pakai yang pendek. Tembaga yang digunakan menunjukkan arus hidrogen yang sangat rendah. Material lain seperti: stainless, baja, dan grafit memiliki arus hidrogen rendah, dan efisiensi energi yang buruk. Penggunaan elektroda heterogen dengan mengombinasikan material yang ada seperti alumunium/tembaga memberikan hasil yang lebih baik dalam hal efisiensi arus dan konsumsi energi. Penggunaan elektroda heterogen lebih
13
disarankan karena mengandung manfaat material penyusun.Trisunaryanti (2015) menyebutkan contoh katalis homogen berupa katalis logam dan oksidanya diantaranya berupa: Fe (Fe2O3), Zn (ZnO), Co (CoO), Cr (Cr2O3), Pt, Ni (NiO),
dan lain-lain. Katalis heterogen diantaranya Fe2O3/alumina-silika,
Pd/alumina-silika, NiO/alumina-Pd/alumina-silika, Fe2O3/clay .
Elektroda stainless steel/Fe-Co-Ni yang digunakan dalam penelitian ini diperoleh dari elektroda stainless steel S-430 dengan ketebalan 1,2 mm mengacu penelitian yang dilakukan Sopandi (2015). Modifikasi pada penelitian ini adalah dilakukan elektrodeposisi menggunakan logam yang bersifat katalis yaitu: Fe, Co, dan Ni. Pelapisan ini bertujuan untuk meningkatkan aktivitas dan efektivitas logam stainless steel sebagai elektroda kerja. Pemilihan kombinasi logam Fe, Co, dan Ni didasari kemiripan sifat, kemiripan ukuran, dan mudah diperoleh di pasaran. Kemiripan sifat kimiawi logam katalitik tersebut mengakibatkan akan adanya kompetisi antar logam untuk menempel (tercoating) pada logam stainless
steel.
5. Metode Elektrodeposisi
Elektrodeposisi merupakan metode pelapisan suatu logam terhadap suatu objek menggunakan prinsip reduksi ion logam yang akan ditempelkan dengan bantuan energi listrik dari luar. Ion logam akan mengalami reduksi (pengendapan) ketika arus yang diberikan dari luar telah mencapai batas minimal (Eored) yang
diperlukan untuk reduksi. Dalam proses elektrodeposisi, reaksi kimia yang terjadi di sekitar daerah elektroda melalui beberapa tahap. Tahap pertama logam dengan pemberian potensial logam mengalami penyusunan di permukaan elektroda
14
membentuk lapisan ganda helmholtz, diikuti dengan pembentukan difusi larutan. Kedua lapisan tersebut disebut sebagai lapisan Guoy-Chapman.
Menurut Riyanto (2010), proses terbentuknya lapisan adalah dimulai ion dari logam akan mendekati bahan/logam yang akan dilapisi dan terdeposisi membentuk lapisan tipis. Ion menumbuk bahan sehingga kehilangan kecepatan tegak lurus dan kehilangan sebagian energinya.Ion-ion akan terserap dan bergerak pada permukaan bahan. Ion berinteraksi satu sama lain dengan membentuk
cluster. Setelah mencapai ukuran kritis tertentu, kelompok tersebut menjadi stabil
dan mencapai ukuran inti tertentu. Kemudian setelah ukuran kritis tumbuh dalam jumlah dan ukuran tertentu, sehingga keadaan jenuh tercapai. Inti yang berlubang
(porous)disebut dengan pulau-pulau. Suatu lapisan kontinyu akhirnya terbentuk
secara sempurna dengan mengisi lubang-lubang pasca permukaan substrat.Kemudian pembentukan lapisan tipis secara penggabungan (coalescence
stage). Tahap terakhir pulau yang terputus-putus menjadi jenis jaringan yang
berlubang (porous).
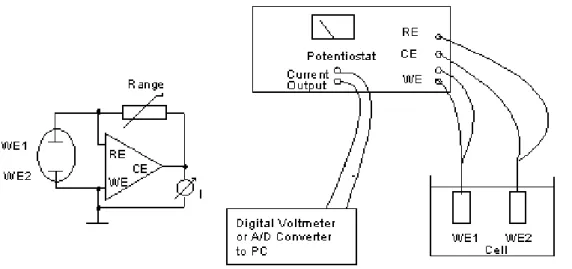
15
Berdasarkan Gambar 2, diperoleh informasi susunan perangkat elektrodeposisi yang terdiri dari elektroda kerja, elektroda referensi, dan elektroda kontra. Elektroda kontra sering digunakan untuk mengetahui berjalannya reaksi elektrokimia. Biasanya elektroda kontra terbuat dari bahan inert seperti (Pt, Ag). Elektroda kontra tidak turut serta dalam reaksi. Elektroda referensi adalah elektroda yang stabil dan diketahui potensial elektrodanya sebagai titik referensidan kontrol dalam pengukuran. Tingginya stabilitas berfungsi untuk mengamati sistem redoks dalam reaksi. Elektroda kerja (working electrode) adalah tempat berlangsungnya reaksi elektrokimia. Bentuk dan sifat elektroda kerja disesuaikan dengan aplikasi dan tujuan pembuatannya.
6. Biji Rambutan
Rambutan (Nephelium lappaceum l.)termasuk tanaman tropis yang berasal dari Indonesia dan telah menyebar ke daerah tropis lainnya seperti Filipina, Malaysia, dan negara-negara Amerika Latin. Pertumbuhan rambutan(Nephelium lappaceum l.) sangat dipengaruhi oleh iklim, terutama ketersediaan air dan suhu. Intensitas curah hujan yang diperlukan untuk pertumbuhan maksimal yaitu 1.500-2.500 mm/tahun dan merata sepanjang tahun. Suhu optimal pertumbuhan rambutan(Nephelium lappaceum l.) adalah 25oC pada siang hari.
16
(Sumber : Seno, 2010)
Gambar 3. Biji rambutan(Nephelium lappaceum l.)
Menurut Tjandra(2011), biji rambutan (Nephelium lappaceum
l.)mengandung senyawa fenolik dari golongan flavanoid yang bersifat sebagai
antioksidan dan aktivitas antimikroba. Fatisa (2013) dalam penelitian yang dilakukanmemperoleh 542,2 mg/g senyawa fenol dari ekstrak kering metanol kulit dan biji rambutan (Nephelium lappaceum l.)yang mempunyai aktivitas antimikroba melawan bakteri patogen dengan strain paling sensitif adalah
Staphylococcus epidermis. Ibrahim (2013) mengemukakan ekstrak etanol biji
rambutan efektif dalam menghambat pertumbuhan bakteri patogen pada ikan antara lain: A. dydropilla, A. salmonicida, dan Streptococcus sp. Hawarima(2016) melakukan penelitian tentang pemanfaatan kandungan rambutan (Nephelium
lappaceum l.)sebagai agen antibakteri penyebab diare. Rahayu(2013) menyatakan
penggunaan air seduhan biji rambutan (Nephelium lappaceum l.)sebagai penurun kadar gula darah pada mencit, dan diperoleh hasil bahwa khasiat air seduhan biji rambutan (Nephelium lappaceum l.)dosis 3,12 gram/kg setara dengan glibenklamida 0,65 mg/kg bb.
17
Fessenden (1986) menyatakan radikal bebas merupakan atom yang memiliki satu atau lebih elektron tidak berpasangan sehingga senyawa ini bersifat sangat reaktif. Senyawa radikal bebas menimbulkan berbagai penyakit dalam tubuh. Senyawa radikal penyebab penyakit dapat dicegah dengan adanya senyawa antioksidan. Antioksidan merupakan senyawa yang menghambat proses oksidasi dengan menstabilkan senyawa radikal bebas dengan cara melengkapi kekurangan elektron sehingga menghambat terjadinya reaksi berantai. Fenol-fenol, senyawa yang terikat pada karbon cincin aromatik, merupakan antioksidan yang efektif.
Menurut Kadapi (2015), aktifitas antioksidan biji rambutan(Nephelium
lappaceum l.) dipengaruhi suhu pengolahan biji rambutan. Semakin tinggi suhu
perlakuan maka aktivitas antioksidan biji rambutan menjadi semakin rendah. Hal tersebut diperoleh dari penelitian mengenai aktifitas antioksidan pada kopi biji rambutan yang mengalami penurunan pada penyangraian dengan suhu tinggi. Berdasarkan pendapat tersebut maka dalam penelitian ini dilakukan penghilangan air dalam biji rambutan(Nephelium lappaceum l.) dengan sinar matahari untuk menghindari berkurangnya aktifitas antioksidan biji rambutan(Nephelium
lappaceum l.).
Antioksidan dapat dikatakan sebagai suatu aktivitas yang menghambat adanya reaksi oksidasi. Secara definisi oksidasi dapat diartikan reaksi suatu senyawa dengan oksigen, pelepasan elektron, dan pelepasan hidrogen. Dengan kata lain, antioksidan dapat diartikan suatu aktifitas zat yang menghambat pelepasan hidrogen. Penggunaan biji rambutan (Nephelium lappaceum
18
l.)dalampenelitian ini adalah untuk mengetahui aktifitas pemecahan molekul H2O
menjadi oksigen (O2) dan hidrogen (H2) pada media yang mengandung senyawa
antioksidan.
7. eDAQ EChems
Pada penggunaannya, EChem dihubungkan dengan suatu potensiostat sehingga arus yang dihasilkan pada setiap potensial yang diberikan direkam oleh komputer secara langsung. eDAQ EChem merupakan salah satu software yang digunakan untuk mengukur voltametri elektroda. Secara umum, EChem merupakan program yang disediakan khusus untuk metode voltametri dan amperometri. (EChem User’s Guide 1.5)
Aplikasi penggunaan instrumentasi eDAQ EChem pada penelitian ini adalah pada hasil pelapisan logam stainless steel dengan logam Fe, Co, dan Ni, dianalisis tegangan (volt) yang memungkinkan terjadinya reaksi elektrodeposisi. Harga tegangan dari reaksi elektrodeposisi menunjukkan spontan tidaknya reaksi tersebut berlangsung. Karakterisasi penempelan logam katalis pada elektroda
stainless steel diamati menggunakan metode voltametri linear. Sedangkan
pengamatan proses produksi hidrogen secara elektrolisis air dilakukan secara voltametri siklik.
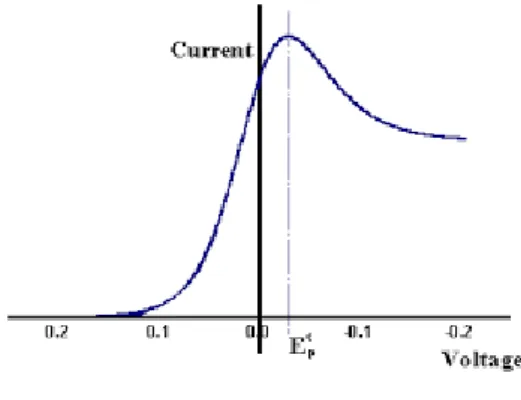
Voltametri linear dimulai dari potensial rendah dan arus katoda disebabkan migrasi ion dalam larutan. Pada saat potensial mendekati potensial reduksi dari zat terlarut yang direduksikan, arus katodanya makin besar. Segera
19
setelah potensial melebihi potensi reduksi, arus berkurang disebabkan polarisasi elektroda. Bentuk voltamogram linear ditunjukkan pada Gambar 4:
Gambar 4. Voltamogram Linear
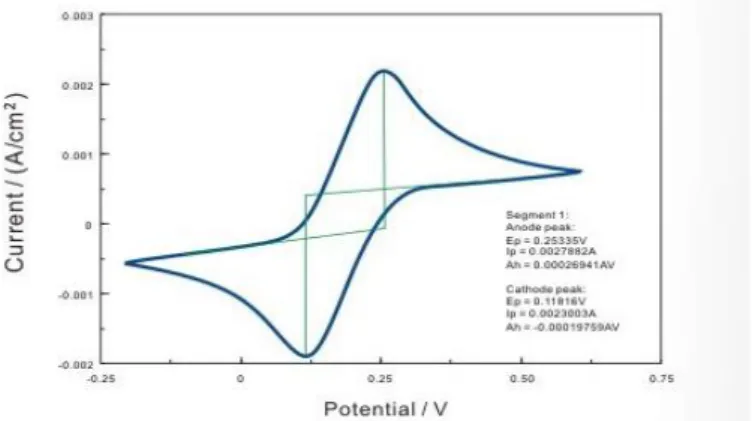
Menurut Atkins (1996), modifikasi metode ini adalah voltametri siklik. Bentuk kurva voltametri siklik pada awalnya menyerupai kurva voltamografi linear, tetapi setelah potensial mulai turun, terdapat perubahan arus yang cepat karena konsentrasi spesies teroksidasi yang tinggi didekat elektroda. Ketika potensialnya mendekati potensial yang diperlukan untuk mengoksidasi spesies tereduksi, terdapat arus anoda yang besar sampai oksidasinya sempurna sehingga arus kembali ke nol. Bentuk keseluruhan kurva teresebut memberikan perincian informasi kinetika proses elektroda.
Menurut Puranto (2010), metode voltametrik merupakan metode aktif karena penukurannya berdasarkan potensial yang terkontrol. Pengukuran dilakukan dengan menerapkan suatu potensial ke dalam sel elektrokimia, kemudian respon arus yang dihasilkan dari proses reaksi redoks diukur. Respon arus diukur pada daerah potensial yang telah ditentukan, selanjutnya dibuat plot
20
arus fungsi potensial yang disebut voltamogram siklik. Contoh kurva voltamogram siklik ditunjukkan pada Gambar 5:
Gambar 5. Voltamogram siklik
Menurut Riyanto (2010), voltemetri siklik merupakan teknik yang banyak digunakan untuk memperoleh informasi tentang reaksi elektrokimia. Voltametri siklik diperoleh dari scan potensial melawan densitas arus dengan berbagai kecepatan scan. Berdasarkan voltamogram siklik didapatkan beberapa nilai parameter penting seperti potensial puncak anoda (Epa), potensial puncak katoda
(Epc), puncak arus anoda (ipa), puncak arus katoda (ipc), potensial setengah katoda
(Ep/2) dan potensial setengah gelombang (E1/2). Voltamogram siklik dapat
digunakan untuk mengetahui perilaku senyawa di permukaan elektroda. Kajian potensiometri dilakukan dengan tidak ada arus yang mengalir dalam sel elektrokimia dan keseimbangan terjadi antara muka (interface) elektroda-larutan. Potensial elektroda hanya bergantung pada konsentrasi spesies elektroaktif dalam larutan
21 8. SEM-EDX
SEM (Scanning Electron Mocroscope) adalah alat yang digunakan untuk mempelajari morfologi permukaan/ ukuran butiran. Pengamatan morfologi permukaan dalam 3 dimensi, resolusi tinggi dan analisis kimia. Aptika (2009) menyebutkan gambar pada SEM dibuat berdasarkan deteksi elektron sekunder atau elektron pantul yang muncul dari permukaan sampel ketika permukaan tersebut dilakukan penyapuan dengan sinar elektron. Sujatno (2015), menyebutkan ketika elektron discan pada permukaan sampel, terjadi interaksi elektron dengan atom pada permukaan maupun bawah permukaan sampel. Akibat interaksi tersebut sebagian besar elektron dapat keluar kembali dan disebut backscattered electrons. Sebagian kecil elektron masuk kedalam bahan kemudian memindahkan sebagian besar energi pada elektron atom sehingga terpental keluar permukaan bahan yang disebut secondary elektron. Pembentukan elektron sekunder diikuti munculnya x-ray yang karakteristik untuk tiap elemen, sehingga dapat digunakan untuk mengukur kandungan elemen pada bahan yang diteliti.
SEM yang dikombinasikan dengan EDX (Energy Dispersive X-Ray
spectroscopy) dapat diperoleh informasi mengenai komposisi internal dari
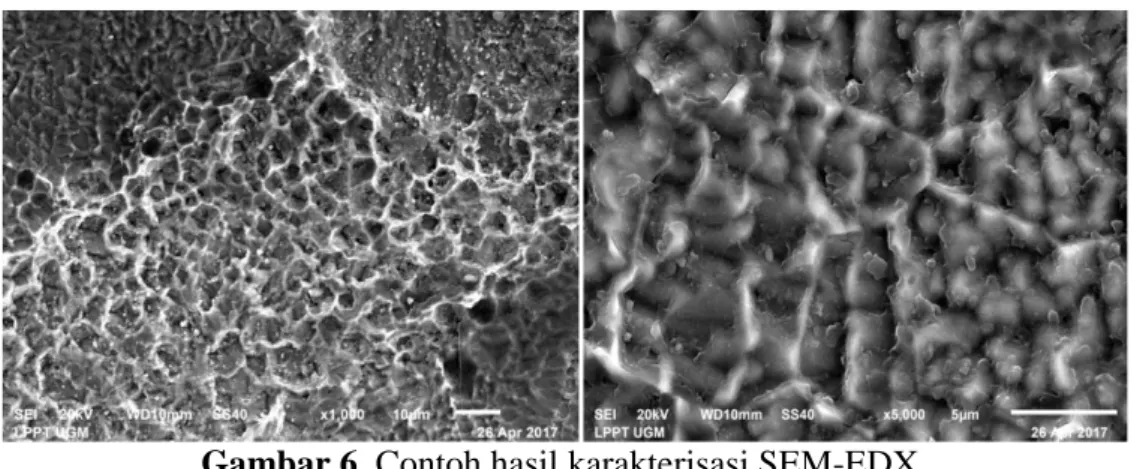
partikel. Instrumen ini memungkinkan untuk menganalisis struktur benang-benang (fibers) pada kayu dan kertas, permukaan logam, dan kerusakan pada karet dan plastik. SEM sering digunakan untuk menganalisis logam. Beberapa hal yang sering dianalisis adalah permukaan pelapisan, pemisahan, dan kerusakan cetakan. Hasil pengukuran menggunakan SEM-EDX ditunjukkan pada Gambar 6:
22
Gambar 6. Contoh hasil karakterisasi SEM-EDX
Berdasarkan Gambar 6, diketahui hasil karakterisasi SEM-EDX memiliki kelebihan untuk mengetahui struktur permukaan suatu sampel dengan jelas pada berbagai perbesaran yang sangat kecil. Hal tersebut memungkinkan bagi pengguna untuk mengetahui perbedaan suatu sampel sebelum dan setelah dilakukan perlakuan yang berhubungan dengan permukaannya. Kelebihan tersebut sangat bermanfaat pada penelitian kali ini karena dibutuhkan karakterisasi yang dapat memfasilitasi karakterisasi permukaan elektroda hasil elektrodeposisi.
9. XRD
Menurut (Mukti, 2012: 6), metode Difraksi Sinar-X (X-Ray Diffraction) berguna untuk analisis padatan kristalin, yaitu untuk meneliti ciri utama struktur (parameter kisi dan tipe struktur), dan untuk mengetahui rincian lain misalnya susunan berbagai jenis atom dalam kristal, keberadaan cacat, ukuran butiran, orientasi, ukuran dan kerapatan presipitat. Prinsip pembentukan pola difraksi ditunjukkan Gambar 7:
23
Gambar 7. Skema cara kerja XRD
Menurut Wega (2015), pendekatan Bragg pada difraksi adalah untuk memandang kristal sebagai pembangun dalam lapisan atau bidang datar yang berperan sebagai cermin semitembus cahaya (semi-transparan). Sinar-X direfleksikan keluar bidang datar dengan sudut refleksi yang sama dengan sudut keluarnya, tetapi sisanya diteruskan yang kemudian direfleksikan oleh bidang datar berikutnya. Ukuran kristal dari material dapat ditentukan dengan perluasan puncak difraksi sinar-X. Perluasan garis berbanding terbalik dengan ukuran kristal dan dapat digunakan untuk memberikan ukuran mikroskopis dalam rentang 3-10nm.
Pola difraksi untuk tiap unsur bersifat spesifik sehingga sangat akurat untuk menentukan komposisi unsur dan senyawa yang terkandung dalam suatu sampel, karena pola yang terbentuk seperti fingerprint dari suatu materi. Dari hasil difraksi dapat diperoleh nilai FWHM (Full Width at Half Maximum), maka dengan menggunakan persamaan Scharer dapat dituliskan persamaan (9) :
L = Kλ
B(2θ) Cosθ… … … (9)
K = 0,94, dianggap bentuk kristal mendekati bentuk bola L = ukuran kristal
24 B. PENELITIAN RELEVAN
Pada penelitian yang dilakukan oleh Isana (2010) menunjukkan penggunaan stainless steel dapat digunakan sebagai elektroda pada produksi gas hidrogen. Dalam penelitian tersebut logam stainless steel menunjukkan memiliki kriteria yang memenuhi sebagai elektroda kerja dalam proses elektrolisis air.Rohendi (2010), menyarankan upaya peningkatan aktifitas katalitik elektroda secara elektrodeposisi karena memungkinkan penempatan katalis berukuran nanometer dan terdistribusi merata di permukaan elektroda.
Isana (2014) melakukan variasi kombinasi campuran logam yaitu logam tunggal Fe, Co, Ni, komposit logam biner dengan mengkombinasikan 2 dari 3 logam tersebut; Fe-Co, Co-Ni, dan Fe-Ni, dan komposit logam terner Fe-Co-Ni. Pada penelitian tersebut disimpulkan aktivitas katalitik elektroda kerja dengan pelapisan terner memberikan efisiensi lebih baik daripada logam tunggal dan komposit biner. Perlakuan coating logam katalis terhadap elektroda juga dilakukan Rohendi (2010) dan diperoleh peningkatan konduktivitas permukaan elektroda.
Paryono (2001), melakukan perbandingan penggunaan logam Ni dan
stainless steel 316 sebagai elektroda kerja produksi gas hidrogen secara
elektrolisis air. Hasil yang diperoleh Ni memberikan hasil yang lebih baik dari segi konsumsi energi dan efektifitas. Namun untuk skala industri logam stainless
steel 316 lebih disarankan karena harganya lebih murah dengan aktifitas hampir
25
steel dan stainless steel/Fe-Co-Ni sebagai elektroda kerja dalam proses
elektrogenerasi hidrogen secara elektrolisis air menggunakan media tepung jagung (maizena) sebagai bahan tambahan dalam media elektrolisis. Hasil dari penelitian tersebut menunjukkan aktivitas elektroda stainless steel/Fe-Co-Ni memberikan hasil yang lebih baik daripada elektroda stainless steel. Elektroda
stainless steel/Fe-Co-Ni juga meningkatkan jumlah produksi gas hidrogen dan
memberikan harga over potential paling kecil, sehingga energi yang dibutuhkan juga lebih kecil. Dalam penelitian kali ini dilakukan pengembangan modifikasi yaitu menggunakan tepung biji rambutan(Nephelium lappaceum l.) sebagai media elektrolisis air. Diharapkan dengan dilakukan penelitian ini dapat diperoleh pengetahuan baru terkait penggunaan elektroda stainless steel/Fe-Co-Ni sebagai elektroda pada produksi gas hidrogen secara elektrolisis air.
Isana (2012), menunjukkan penggunaan senyawa elektrolit dalam proses elektrokimia dapat menyebabkan peningkatan konduktivitas listrik sehingga energi mengalami kenaikan yang membuat laju pemecahan molekul air menjadi lebih cepat. Senyawa elektrolit yang disarankan yaitu NaHCO3. Isana (2014)
melakukan pengujian variasi penambahan NaHCO3 sebanyak 1-5 gram dalam 1
liter air. Hasil yang diperoleh kondisi optimum yang menghasilkan produk paling banyak adalah penambahan 5 gram NaHCO3. Marlina (2013) melakukan variasi
2,5; 5; 7,5; 10; 12,5; dan 15% NaHCO3. Hasil yang diperloeh menunjukkan
penambahan 10% NaHCO3 memberikan hasil yang terbaik.Bimantara (2017),
mengusulkan penggunaan NaHCO3untuk produksi gas hidrogen Pada penelitian
26 C. KERANGKA BERPIKIR
Penggunaan bahan bakar fosil sebagai sumber energi berbagai kendaraan dan alat industri terus mengalami kenaikan seiring perkembangan teknologi dan peningkatan jumlah kendaraan. Bahan bakar fosil merupakan sumberdaya tak terbarukan, yang berarti ada masanya bahan bakar fosil akan habis. Sebelum saat tersebut terjadi sangat diperlukan persiapan mancari sumber energi alternatif yang bersifat terbarukan sehingga dapat menunjang kebutuhan manusia secara berkelanjutan. Salah satu energi alternatif adalah gas hidrogen.
Hidrogen merupakan gas yang ringan dan mudah terbakar. Gas hidrogen melepas energi dalam jumlah besar sehingga dapat dimanfaatkan sebagai sumber energi alternatif masa depan. Penelitian produksi gas hidrogen telah banyak dilakukan, diantaranya menggunakan metode elektrolisis air. Penggunaan elektrolisis air sangat memungkinkan karena jumlah air dibumi (kelimpahan) cukup besar dan jumlah atom hidrogen yang dominan dalam air. Elektrolisis merupakan pemecahan molekul air menjadi gas hidrogen dan oksigen dengan memberikan arus listrik terhadap air. Metode elektrolisis air adalah metode produksi gas hidrogen yang terus dikembangkan hingga saat ini.
Permasalahan utama metode elektrolisis air adalah efisiensi produk dan efisiensi energi yang belum memberikan hasil yang memuaskan. Berbagai variasi metode meliputi pengembangan alat, kondisi, dan media dilakukan untuk memperoleh hasil yang maksimal. Pada penelitian ini dilakukan pengembangan elektroda yaitu menggunakan elektroda kerja stainless steel/Fe-Co-Ni dalam
27
media tepung biji rambutan(Nephelium lappaceum l.) yang dilakukan secara voltametri siklik. Penggunaan tepung biji rambutan (Nephelium lappaceum
l.)bertujuan untuk mengetahui aktifitas katalitik elektroda stainless steel/Fe-Co-Ni
dalam media tepung biji rambutan(Nephelium lappaceum l.). Hasil voltametri siklik akan diperoleh data berupa voltamogram siklik yang digunakan sebagai dasar analisis efisiensi produk gas hidrogen dan efisiensi energi yang dibutuhkan dalam produksi hidrogen.
28 BAB III
METODE PENELITIAN
A. Subjek dan Objek Penelitian 1. Subjek Penelitian
Subjek dalam penelitian ini adalah elektroda stainless steel/Fe-Co-Ni
2. Objek Penelitian
Objek dalam penelitian ini adalah aktivitas elektrode stainless steel dan
stainless steel/Fe-Co-Ni serta efisiensi produksi gas H2 dari elektrolisis air
dengan media tepung biji rambutan (Nephelium lappaceum l.). B. Variabel Penelitian
Variabel yang digunakan dalam penelitian ini terdiri dari variabel bebas, variabel terikat, dan variabel kontrol. Penguraian masing-masing variabel akan dijelaskan sebagai berikut:
1. Variabel bebas
Variabel bebas dalam penelitian ini adalah variasi massa tepung biji rambutan (Nephelium lappaceum l.)dalam media elektolisis air dan elektroda kerja yang digunakan pada elektrolisis air.
2. Variabel Terikat
Variabel terikat dalam penelitian ini terdiri dari efisiensi produksi gas hidrogen dan efisiensi energi yang dihasilkan dari elektrolisis air.
29 3. Variabel Kontrol
Variabel kontrol dalam penelitian ini adalah scan rate pada proses elektrolisis yaitu sebesar 50mV/s
C. Alat dan Bahan Penelitian 1. Alat Penelitian
a. Alat-alat gelas dan ukur, b. Tabung elektrolisis, c. eDAQ Echem.
2. Bahan-bahan Penelitian
a. Elektroda stainless steel tipe S-430, b. Tepung biji rambutan,
c. Asam nitrat, d. Aseton, e. NaHCO3, f. Aquades, g. Aquabides, h. FeSO4.7H2O p.a, i. Co(NO3)2.6H2O p.a, j. NiSO4.6H2O p.a, k. H3BO3, l. Sakarin, m. NaCl, n. Elektroda Pt,
30 o. Elektroda Ag/AgCl,
p. NH4Cl.
D. Prosedur Penelitian
1. Preparasi Elektroda Stainless steel/Fe-Co-Ni
a. Menyiapkan elektroda stainless steel S-430 dengan dimensi ketebalan 1,2 mm; lebar 3 mm; panjang 110 mm.
b. Menyiapkan larutan FeSO4(aq), Co(NO3)2(aq), dan NiSO4(aq) sebagai
sumber Fe-Co-Ni dengan perbandingan mol 1:1:1 yang akan di coating terhadap elektroda stainless steel.
c. Menyiapkan katalis elektrodeposisi yaitu H3BO3, Sakarin, NaCl dan NH4Cl.
d. Melakukan elektrodeposisi dengan alat eDAQ Echem dengan elektroda kontra Pt, elektroda referensi Ag/AgCl, dan elektroda kerja stainless steel dengan laju scan rate 50mV/s selama 600 s.
2. Elektrolisis H2O
Elektrolisis H2O dilakukan untuk memecah molekul H2O menjadi gas
oksigen (O2) dan gas hidrogen (H2). Elektrolisis dilakukan dengan menggunakan
instrumen eDAQ EChems dengan elektroda kontra Pt, elektroda referensi Ag/AgCl, serta elektroda kerja stainless steel dan stainless steel/Fe-Co-Ni. Elektrolisis dilakukan dalam suasana basa dengan media tepung biji rambutan(Nephelium lappaceum l.). Elektrolit pendukung menggunakan NaHCO3
sebanyak 5 gram dilarutkan dalam 1 liter air. Variasi masa tepung biji rambutan
(Nephelium lappaceum l.)yang diterapkan dalam penelitian ini ditampilkan dalam
31
Tabel3. Data nama sampel berdasarkan massa tepung yang ditambahkan
E. Teknik Pengambilan Data 1. Data kualitatif
Data kualitatif diperoleh dari analisis data hasil karakterisasi menggunakan SEM-EDX dan XRD. Data hasil karakterisasi menggunakan XRD dan SEM-EDX adalah untuk menentukan keberhasilan proses elektrodeposisi elektroda stainless
steel/Fe-Co-Ni berdasarkan karakterisasi pada permukaan elektroda.
2. Data kuantitatif
Data kuantitatif didapatkan dari analisis data hasil karakterisasi menggunakan eDAQ EChem dan SEM-EDX. Efisiensi produk diperoleh dengan membandingkan produk pada elektroda stainless steel/Fe-Co-Ni dan stainless
steel. Efisiensi produk gas hidrogen ditentukan dengan menggunakan persamaan
(10).
𝜀 = 𝑖𝑐 𝑆𝑆 /𝐹𝑒−𝐶𝑜−𝑁𝑖
𝑖𝑐 𝑆𝑆 𝑥 100% ...(10)
Nomor NaHCO3 Massa Tepung Biji Rambutan Kode Sampel
1 5 gram 0 gram Sampel 1 2 1 gram Sampel 2 3 2 gram Sampel 3 4 3 gram Sampel 4 5 4 gram Sampel 5 6 5 gram Sampel 6 7 6 gram Sampel 7 8 7 gram Sampel 8 9 8 gram Sampel 9 10 9 gram Sampel 10 11 10 gram Sampel 11
32
dengan 𝜀 dan ic masing-masing adalah efisiensi produk hidrogen dan puncak arus
katoda. 𝜀 dan ic diperoleh dari kurva voltamogram siklik menggunakan instrumen
eDAQ EChem. 𝜀 ditentukan untuk tiap sampel.
Selain efisiensi produk, ditinjau juga efisiensi energi, dengan menggunakan persamaan (11).
∆V = (Veksperimen – Vteori) ...(11)
Veksperimen diperoleh berdasarkan energi yang dibutuhkan untuk elektrolisis
dan diketahui melalui puncak arus katodik. Vteori produksi gas hidrogen secara
elektrolisis air adalah (Eo H2O/H2 = -0,828 Volt). Hasil perhitungan menggunakan
33 BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. Preparasi Tepung Biji Rambutan(Nephelium lappaceum l.)
Dalam penelitian ini menggunakan tepung biji rambutan (Nephelium
lappaceum l.)sebagai media elektrolisis untuk mengetahui aktifitas elektroda
stainless steel/Fe-Co-Ni. Biji rambutan yang diperoleh dicuci menggunakan air
bersih lalu dijemur hingga kering. Pengeringan biji rambutan menggunakan sinar matahari karena berdasarkan penelitian (Kadapi, 2015: 5), semakin tinggi suhu perlakuan terhadap biji rambutan (Nephelium lappaceum l.)maka akan mengurangi aktivitas antioksidan biji rambutan. Berkurangnya aktivitas antioksidan biji rambutan(Nephelium lappaceum l.) dapat mengakibatkan tujuan penelitian untuk mengetahui aktivitas elektroda stainless steel dan stainless
steel/Fe-Co-Ni dalam media tepung biji rambutan(Nephelium lappaceum l.) tidak
tercapai.
Untuk dapat digunakan sebagai modifikasi media, biji rambutan
(Nephelium lappaceum l.)yang telah dikeringkan perlu dihaluskan agar dapat
dilarutkan dalam aquades. Proses penghalusan dilakukan dengan cara dilumat. Proses pelumatan dilakukan hingga tekstur biji rambutan(Nephelium lappaceum
l.) benar-benar lembut. Proses terakhir yang dilakukan adalah pengayakan dengan
tujuan menyaring biji rambutan (Nephelium lappaceum l.)yang memiliki ukuran besar agar tidak ikut terlarut dalam aquades yang akan digunakan pada saat elektrolisis..
34 B. Preparasi Sampel untuk Elektrolisis
Objek dalam penelitian ini adalah aktifitas stainless steel/Fe-Co-Ni dan
stainless steeldalam media tepung biji rambutan(Nephelium lappaceum l.),
sehingga sampel yang dibuat dalam penelitian ini yaitu tepung biji rambutanyang telah disiapkan dilarutkan kedalam aquades pada konsentrasi yang telah ditentukan. Sampel yang diteliti terdiri dari larutan aquades demineralisasi, serbuk NaHCO3, dan tepung biji rambutan (Nephelium lappaceum l.)dengan variasi
massa. Massa tepung biji rambutan(Nephelium lappaceum l.) yang digunakan dan kode sampel pada masing-masing variasi massa ditunjukkan pada Tabel 3.
Elektrolit yang digunakan dalam penelitian ini adalah NaHCO3. Penentuan
penggunaan NaHCO3 ini didasari oleh penelitian yang dilakukan oleh Isana
(2012), yang menunjukkan NaHCO3 mampu mengkatalisis reaksi pemecahan
molekul H2O pada proses elektrokimia. Adanya senyawa elektrolit dalam larutan
mengakibatkan peningkatan koduktivitas listrik yang mengakibatkan kenaikan energi sehingga laju pemecahan molekul H2O menjadi lebih cepat. NaHCO3
dalam air akan mengalami ionisasi berdasarkan reaksi :
NaHCO3(s) Na+(aq) + HCO3-(aq)...(12)
Adanya ion positif (anion) dan ion negatif (kation) pada larutan sebagai hasil ionisasi senyawa elektrolit tersebut meningkatkan arus yang dialirkan sehingga meningkatkan H2O yang terelektrolisis. Meskipun NaHCO3 dapat
digunakan sebagai katalis, bukan berarti semakin banyak NaHCO3 yang
ditambahkan akan membuat laju elektrolisis semakin cepat. Kondisi tertentu ketika penambahan NaHCO3 telah mencapai batas maksimal maka penambahan
35
NaHCO3 yang berikutnya akan mengakibatkan larutan menjadi jenuh dan justru
mengurangi produk gas hidrogen karena larutan telah penuh dengan ion NaHCO3.
Dalam penelitian kali ini digunakan senyawa elektrolit NaHCO3 sebanyak 5 gram
untuk tiap 1 liter aqua demineralisasi.
C. Elektrodeposisi Logam Fe-Co-Ni pada Elektroda Stainless steel
Elektrodeposisi secara voltametri linear dilakukan dengan elektroda kerja
stainless steel, elektroda kontra Pt, dan elektroda referensi Ag/AgCl. Sumber
logam Fe, Co, dan Ni masing-masing diperoleh dari larutan FeSO4.7H2O p.a,
Co(NO3)2.6H2O p.a, dan NiSO4.6H2O p.a. Untuk memudahkan penempelan
logam Fe-Co-Ni digunakan katalis H3BO3, sakarin, NH4Cl, dan NaCl.
Elektrodeposisi dilakukan menggunakan instrumentasi eDAQ EChems dengan
scan rate 50mV/s selama 600s.
Elektrodeposisi merupakan metode pelapisan logam terhadap suatu objek menggunakan prinsip reduksi ion logam yang akan ditempelkan dengan bantuan energi listrik dari luar. Ion logam akan mengalami reduksi (pengendapan) ketika arus yang diberikan dari luar telah mencapai batas minimal (Eored) yang
diperlukan untuk reduksi. Secara teoritis potensial reduksi standar dari logam-logam tersebut yaitu:
Fe2+(aq)+ 2e- Fe(s) Eored = -0,44Volt ... (13)
Co2+(aq)+ 2e- Co(s) Eored = -0,28Volt ... (14)
36
Berdasarkan harga energi potensial elektrode, semakin positif nilai Eored
maka logam tersebut akan semakin sukar melepas elektron sehingga bersifat oksidator kuat dan mudah mengalami reduksi. Potensial reduksi Ni memiliki nilai paling besar sehingga Ni akan mengalami reduksi (mengendap) lebih dulu, kemudian diikuti Co dan Fe.
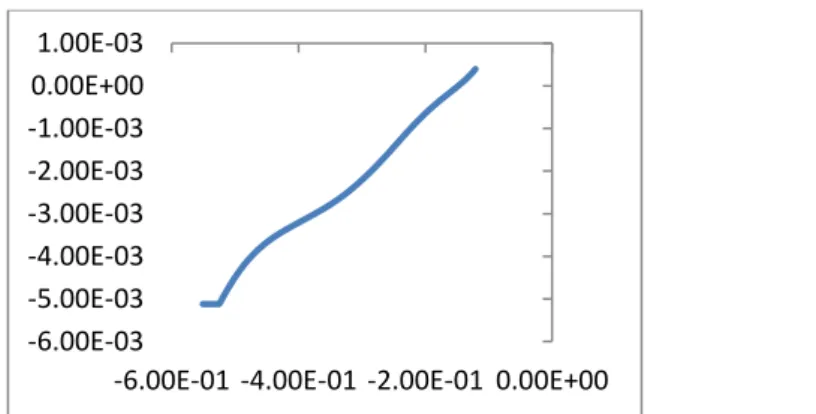
Gambar 8. Grafik voltamogram linear elektrodeposisi ion Fe2+ , Co2+, Ni2+ Gambar 9 merupakan kurva voltamogram linear dari proses elektrodeposisi logam Fe, Co, dan Ni terhadap elektroda stainless steel. Pengendapan logam tersebut ditandai dengan puncak-puncak kurva voltamogram yang menunjukkan terjadinya reduksi ion logam menjadi padatan logam yang menempel pada stainless steel. Keberadaan puncak arus katodik pada voltamogram tersebut menunjukkan adanya reduksi logam Fe, Co, Ni pada permukaan logam stainless steel, sehingga elektroda stanless steel/Fe-Co-Ni telah berhasil dibuat.
Proses pelapisan logam Fe, Co, Ni pada permukaan stainless steel dimulai dengan dikelilinginya substrat oleh ion Fe2+, Co2+, dan Ni2+ setelah larutan mengalami polarisasi. Polarisasi diakibatkan adanya arus listrik dari luar sehingga mengakibatkan stainless steel sebagai substrat menjadi bermuatan. Stainless
-6.00E-03 -5.00E-03 -4.00E-03 -3.00E-03 -2.00E-03 -1.00E-03 0.00E+00 1.00E-03
37
steelyang dalam sistem elektrodeposisi sebagai katoda dikelilingi oleh ion logam
dengan muatan yang berlawanan dengan muatan katoda sehingga membentuk lapisan rangkap listrik atau lapisan Helmholtz. Beda potensial listrik membantu pergerakan ion logam menuju permukaan katoda dan kemudian menangkap elektron dari katoda, untuk kemudian mendeposisikan diri di permukaan katoda. Ketika keadaan kesetimbangan, ion-ion berubah menjadi atom-atom yang kemudian menempel pada permukaan katoda (stainless steel).
D. Karakterisasi Elektroda Stainless steel dan Elektroda Stainless steel/Fe-Co-Ni
1. Karakterisasi SEM-EDX
Scanning Elekron Microscope dan Energy Dispersive X-Ray Spectroscopy
(SEM-EDX) merupakan alat yang memiliki kemampuan memberikan informasi secara langsung tentang topografi (tekstur permukaan sampel), morfologi (bentuk dan ukuran), komposisi (unsur penyusun sampel), serta informasi kristalografi (susunan atom penyusunan sampel). Penggunaan karakterisasi SEM-EDX dalam penelitian ini adalah untuk mengetahui tekstur permukaan elektroda stainless
steel/Fe-Co-Ni dan untuk mengetahui komposisi logam Fe, Co, Ni yang
38
(a) (b)
Gambar 9.(a) Hasil karakterisasi SEM elektroda stainless steel, (b) Hasil karakterisasi SEM elektroda stainless steel/Fe-Co-Ni
Berdasarkan penelitian yang dilakukan oleh Isana (2012) dalam karakterisasi SEM-EDX terhadap logam stainless steel diperoleh data kandungan logam Fe-Co-Ni sebelum dilakukan coating adalah 80,11% Fe; 0,05% Co; dan 0,00% Ni. Data hasil tersebut digunakan sebagai indikator keberhasilan coating karena dapat dijadikan pembanding komposisi penyusun elektroda sebelum dan setelah dilakukan elektrodeposisi. Secara kuantitatif keberhasilan elektrodeposisi ditandai dengan meningkatnya komposisi Fe; Co; dan Ni dalam elektroda.
Gambar 9(b) menunjukkan tekstur permukaan elektroda stainless steel/Fe-Co-Ni menggunakan instrumentasi SEM dengan perbesaran 5000 kali. Pada gambar tersebut dapat dilihat adanya bercak-bercak yang menempel pada logam. Bercak yang terdapat pada logam tersebut menunjukkan logam Fe, Co, Ni yang telah berhasil di coating secara elektrodeposisi terhadap logam stainless steel. Berdasarkan hasil karakterisasi SEM-EDX diketahui komposisi logam Fe; Co; Ni yang tedapat dalam elektroda adalah 50,34 % Fe; 0,14% Co; dan 0,17% Ni.
39
Hasil karakterisasi SEM-EDX pada penelitian ini sesuai dengan penelitian yang dilakukan oleh Isana (2012) yaitu terjadi peningkatan jumlah logam Co dan Ni pada elektroda stainless steel/Fe-Co-Ni.Kandungan logam Fe-Co-Ni pada elektroda setelah dilakukan coating dan dibandingkan dengan penelitian Isana (2012) ditunjukkan pada Tabel 4:
Tabel4. Kandungan logam pada stainless steel/Fe-Co-Ni
Stainless steel/Fe-Co-Ni Stainless steel/Fe-Co-Ni (Isana, 2012) Fe 50,34 % 57,09% Co 0,14 % 0,22% Ni 0,17% 0,74%
Berdasarkan data Tabel 4, dapat disimpulkan proses elektrodeposisi berhasil karena terjadi peningkatan kadar logam Co dan Ni dalam elektroda
stainless steel/Fe-Co-Ni. Adapun penurunan kadar Fe yang terdeteksi oleh EDX
dikarenakan penempelan logam Co dan Ni dalam elektroda mengakibatkan permukaan Fe yang terdeteksi oleh SEM-EDX menjadi lebih kecil sehingga data kadar logam Fe yang ditunjukkan menjadi lebih kecil.
40 2. Karakterisasi XRD
Karakterisasi XRD digunakan untuk analisis komposisi fasa atau senyawa pada material dan juga karakterisasi kristal. Ketika berkas sinar-X berinteraksi dengan suatu material, maka sebagian berkas akan diabsorbsi, ditransmisikan, dan sebagian lagi dihamburkan terdifraksi. Hamburan terdifraksi inilah yang dideteksi oleh XRD.Karakterisasi XRD dilakukan terhadap elektroda stainless steel dan
stainless steel/Fe-Co-Ni. Karakterisasi pada kadua jenis elektroda tersebut
bertujuan untuk membandingkan perbedaan antara grafik XRD pada stainless
steel dan stainless steel/Fe-Co-Ni. Karakterisasi elektroda stainless steeldan
stainless steel/Fe-Co-Ni ditunjukkan pada Gambar 12:
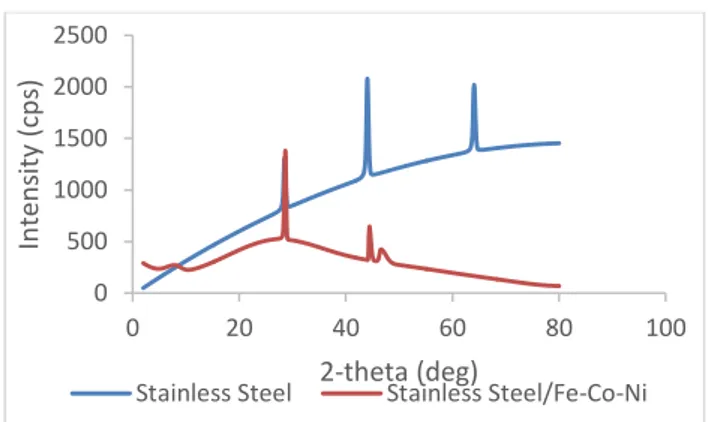
Gambar 10. Karakterisasi XRD terhadap SS dan SS/Fe-Co-Ni
Karakterisasi terhadap elektroda stainless steel/Fe-Co-Ni dilakukan setelah
coating terhadap elektroda stainless steel dengan logam Fe, Co, dan Ni.
Karakterisasi terhadap stainless steel/Fe-Co-Ni diharapkan memiliki grafik yang berbeda dibandingkan grafik pada elektroda stainless steel sehingga dapat diketahui berhasil atau tidaknya coatingyang dilakukan. Berdasarkan Gambar 10, terlihat perbedaan jumlah puncak dan posisi puncak yang terbentuk pada grafik
0 500 1000 1500 2000 2500 0 20 40 60 80 100 In ten sity (cp s) 2-theta (deg)
41
hasil karakterisasi.Hal tersebut mengindikasikan adanya perbedaan kristalinitas pada elektroda stainless steel dan stainless steel/Fe-Co-Ni.
E. Elektrolisis Air
Elektrogenerasi hidrogen pada penelitian ini dilakukan secara elektrolisis air. Elektrolisis pada penelitian ini menggunakan elektroda kerja stainless steel dan stainless steel/Fe-Co-Ni. Penggunaan 2 elektroda tersebut bertujuan untuk membandingkan aktivitas elektroda stainless steel dengan elektroda stainless
steel/Fe-Co-Ni. Elektroda referensi menggunakan Ag/AgCl dan elektroda kontra
Pt.
Elektrolisis dilakukan pada modifikasi media dengan ditambahkan tepung biji rambutan. Dengan demikian dapat diketahui aktifitas elektroda stainless steel dan stainless steel/Fe-Co-Ni sebagai elektroda kerja untuk produksi gas hidrogen secara elektrolisis air dalam media tepung biji rambutan. Tepung biji rambutan(Nephelium lappaceum l.) yang ditambahkan bervariasi yaitu: 0 gram, 1 gram, 2 gram, 3 gram, 4 gram, 5 gram, 6 gram, 7 gram, 8 gram, 9 gram, dan 10 gram.
Hasil elektrolisis secara voltametri siklik berupa kurva voltamogram. Pada kurva voltamogram terdapat puncak-puncak sehingga berdasarkan puncak tersebut dapat diketahui jumlah hidrogen yang dihasilkan dan energi yang diperlukan untuk menghasilkan gas hidrogen dengan jumlah paling banyak. Jumlah hidrogen yang dihasilkan ditunjukkan oleh puncak arus katodik (ic). Hasil
elektrolisis air menggunakan elektroda stainless steel dan stainless steel/Fe-Co-Ni ditunjukkan dalam Tabel6:
42
Tabel5. Data efisiensi energi dan arus katodik hasil elektrolisis menggunakan elektroda Stainless steeldan stainless steel/Fe-Co-Ni
Nama Sampel Elektroda Stainless steel Elektroda Stainless steel/Fe-Co-Ni Energi (Volt) ic (mA) Energi (Volt) ic (mA) Sampel 1 -0,8280 -0,2455 -0,7820 -0,4048 Sampel 2 -0,9750 -0,1825 -0,7500 -0,1182 Sampel 3 -0,9960 -0,1710 -0,6370 -0,1056 Sampel 4 -0,9900 -0,1218 -0,5770 -0,0940 Sampel 5 -0,9980 -0,1470 -0,7550 -0,1360 Sampel 6 -0,9980 -0,1784 -0,6930 -0,1156 Sampel 7 -0,9810 -0,1655 -0,7350 -0,0854 Sampel 8 -0,9890 -0,1687 -0,6860 -0,1577 Sampel 9 -0,9970 -0,1310 -0,8130 -0,1408 Sampel 10 -0,9900 -0,1000 -0,7940 -0,1398 Sampel 11 -0,9950 -0,1000 -0,8180 -0,1545
Prinsip elektrolisis secara voltametri adalah proses adsorpsi dan desorpsi. Puncak anodik pada kurva voltamogram menunjukkan puncak reaksi oksidasi (produksi gas oksigen). Puncak katodik pada kurva voltamogram menunjukkan reaksi reduksi (produksi gas hidrogen). Efektivitas produksi hidrogen yang dihasilkan ditinjau berdasarkan puncak arus katodik yang terdapat pada kurva voltamogram. Semakin besar nilai puncak arus katodik, menunjukkan makin besar pula hidrogen yang dihasilkan. Untuk mengetahui pengaruh penggunaan elektroda stainless steel/Fe-Co-Ni dilakukan pembandingan dalam bentuk grafik yang ditunjukkan pada Gambar 11: