PRODUKSI HIDROGEN DARI PEMECAHAN MOLEKUL H2O DALAM MEDIA Aloe vera DENGAN ELEKTRODA
STAINLESS STEEL/Fe-Co-Ni
SKRIPSI
Diajukan kepada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta Untuk Memenuhi Sebagian Persyaratan Guna
Memperoleh Gelar Sarjana Sains
Oleh : Ratih Widyandari NIM 13307141018
PROGRAM STUDI KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA
PRODUKSI HIDROGEN DARI PEMECAHAN MOLEKUL H2O DALAM MEDIA Aloe vera DENGAN ELEKTRODA
STAINLESS STEEL/Fe-Co-Ni
Oleh : Ratih Widyandari NIM. 13307141018
ABSTRAK
Penelitian ini bertujuan untuk mengetahui pengaruh penambahan media Aloe vera pada proses elektrolisis serta mengetahui efektivitas penggunaan elektroda stainless steel dan stainless steel/Fe-Co-Ni untuk produksi pembentukan gas hidrogen.
Pemecahan molekul air dapat dipelajari dengan menggunakan voltametri siklik dengan laju penyapuan 50 mV/s yang menghasilkan dua puncak yaitu puncak katoda dan puncak anoda. Pada saat elektrolisis digunakan larutan elektrolit NaHCO3 dengan konsentrasisebanyak 5 gram per 1 liter air dan penambahan media Aloe vera sebanyak 0-10 gram yang dilarutkan dalam akuabides.
Hasil penelitian menunjukkan bahwa: aktivitas katalitik elektroda stainless steel/Fe-Co-Ni memberikan hasil 12,04% lebih baik apabila dibandingkan dengan penggunaan elektroda stainless steel. Kondisi optimum penggunaan elektroda stainless steel/Fe-Co-Ni terjadi pada pada saat tanpa penambahan Aloe vera dengan energi yang dibutuhkan relatif kecil yakni sebesar 0.083 Volt, sedangkan kondisi optimum penggunaan elektroda stainless steel terjadi pada saat tanpa penambahan Aloe vera dengan energi yang dibutuhkan lebih besar yakni 0.093 Volt. Penambahan media Aloe vera pada proses elektrolisis dapat menyebabkan covering, sehingga laju produksi gas hidrogen menjadi lebih lambat.
PRODUCTION OF HYDROGEN FROM SPLITTING H2O MOLECUL IN Aloe vera MEDIA WITH STAINLESS STEEL/Fe-Co-Ni ELECTRODE
By : Ratih Widyandari NIM. 13307141018
ABSTRACT
This research aimed to determine the effect of Aloe vera media addition on the electrolysis process and to determine the effectiveness of the use of stainless steel and stainless steel/Fe-Co-Ni electrodes for the production of hydrogen gas formation.
The splitting of water molecules can be studied using cyclic voltammetry methode at sweeping rate of 50 mV/s. Production process of hydrogen gas was done by using electrolysis of NaHCO3 5 gram per liter of solution with addition of 0-10 gram Aloe vera per liter of water.
The results showed that: the catalytic activity of stainless steel/Fe-Co-Ni electrodes gives 12.04% better results when compared with the use of stainless steel electrodes. The optimum condition of the used of stainless steel/Fe-Co-Ni electrode occurred at without addition of Aloe vera media with the required energy was relatively small at 0.083 Volt, while the optimum condition of the use of stainless steel electrodes occurs at without addition of Aloe vera media with the required energy was greater at 0.093 Volt. The addition of Aloe vera media to the electrolysis process causes the surface covering, the production rate of hydrogen gas becomes slower.
HALAMAN PERNYATAAN
Yang bertanda tangan di bawah ini, saya:
Nama : Ratih Widyandari
NIM : 13307141018
Prodi : Kimia
Fakultas : MIPA
Judul : Produksi Hidrogen dari Pemecahan Molekul H2O dalam Media
Aloe vera dengan Elektroda Stainless Steel/Fe-Co-Ni
menyatakan bahwa penelitian kimia ini adalah hasil dari pekerjaan saya sendiri.
Sepanjang pengetahuan saya tidak terdapat karya atau pendapat yang ditulis atau
diterbitkan orang lain, kecuali sebagai acuan atau kutipan dengan mengikuti tata
penulisan karya ilmiah yang lazim. Tanda tangan dosen penguji yang tertera dalam
halaman pengesahan adalah asli. Jika tidak asli, saya siap menerima sanksi ditunda
pada yudisium periode berikutnya.
Yogyakarta, Juni 2017 Yang menyatakan,
Ratih Widyandari
MOTTO
ااناعام ا ال َنإ نازحات اَ
Don't be sad, indeed Allah is with us.
(QS. At-Taubah: 40)
Jika tidak ada bahu untuk bersandar, masih ada sajadah untuk
bersujud ❤
Jangan takut melangkah, sebab tak ada langkah kedua tanpa langkah pertama
HALAMAN PERSEMBAHAN
Alhamdulillahirabil’alamin, segala puji bagi Allah SWT yang telah memberikan
limpahan berkah, rahmat, dan anugerah, sehingga saya dapat menyelesaikan Tugas
Akhir Skripsi ini.
Tugas Akhir Skripsi ini saya persembahkan untuk:
1. Orang tuaku tercinta, Bapak Rochmadi dan Ibu Sri Wahyuni yang telah
memberikan kasih sayang, nasehat, dukungan, serta doa sedari kecil hingga
kini.
2. Kakakku terkasih, Rani Ristiyanti yang selalu membantu dan
memotivasiku.
3. Lathifa Hidayati, Nur Azizah Rahmawati, Abdurrahman Affief dan Wisnu
Sutopo mitra kerja satu penelitian.
4. Sahabat terbaikku, Dewa Jati Enggartiasto yang telah menjadi pendonor
semangat selama ini.
5. Sahabat-sahabat setiaku, Tifa, Mera, Diska, Ivon, dan Agit yang sudah
bertahun-tahun menjadi teman curhat, dan penyemangatku.
6. Sahabat-sahabatku tercinta, Lathifa, Enny, Karlin, Yenni, dan Mei yang
selama 4 tahun telah menemani dan memberikan semangat yang tiada henti.
7. Semua teman-teman Kimia B 2013
8. Teman-teman seperjuangan KKN UNY 16ND.
KATA PENGANTAR
Puji syukur kehadirat Allah SWT atas berkat dan karunia-Nya, Tugas Akhir
Skripsi dalam rangka untuk memenuhi sebagian persyaratan untuk mendapatkan
gelar Sarjana Sains dengan judul “Produksi Hidrogen dari Pemecahan Molekul
H2O dalam Media Aloe vera dengan Elektroda Stainless Steel/Fe-Co-Ni” dapat
disusun sesuai dengan harapan. Tugas Akhir Skripsi ini dapat diselesaikan tidak
lepas dari bantuan dan kerjasama dengan pihak lain. Berkenaan dengan hal
terssebut, penulis menyampaikan ucapan terimakasih kepada yang terhormat:
1. Dr. Hartono selaku Dekan FMIPA Universitas Negeri Yogyakarta yang
memberikan persetujuan pelaksanaan Tugas Akhir Skripsi.
2. Drs. Jaslin Ikhsan, M. App. Sc., Ph.D Drs. selaku Ketua Jurusan dan Ketua
Program Sudi Kimia beserta dosen dan staf yang telah memberikan bantuan
dan fasilitas selama proses penyusunan pra proposal sampai dengan
terselesainya Tugas Akhir Skripsi ini.
3. Drs. Heru Pratomo Aloysius, M.Si. selaku Dosen Pembimbing Utama yang
telah banyak memberikan kritikan dan bimbingan selama penyusunan Tugas
Akhir Skripsi.
4. Prof. Dr. Endang Widjajanti FLX selaku Penguji Utama yang telah
memberikan saran dan koreksi perbaikan secara komprehensif terhadap
Tugas Akhir Skripsi.
5. Dr. Isana Supiah Yosephine Louise, M.Si. selaku Penguji Pendamping yang
telah memberikan saran, kritikan dan perbaikan terhadap Tugas Akhir
6. Keluarga dan sahabat yang senantiasa mendoakan dan memberikan semangat
dalam menyelesaikan Tugas Akhir Skripsi.
7. Seluruh pihak yang tidak dapat penulis sebutkan satu per satu yang telah
membantu penulis dalam menyelesaikan Tugas Akhir Skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, oleh karena
itu penulis mengharapkan kritik dan saran yang membangun dari berbagai pihak
demi kesempurnaan skripsi ini. Semoga skripsi ini dapat bermanfaat bagi kita
semua. Amiiin.
Yogyakarta, 8 Juni 2017
DAFTAR ISI
Table of Contents
HALAMAN SAMPUL...i
ABSTRAK ... ii
ABSTRACT ... iii
HALAMAN PERSETUJUAN ... Error! Bookmark not defined. HALAMAN PERNYATAAN ... vi
MOTTO ... vii
HALAMAN PERSEMBAHAN ... viii
KATA PENGANTAR ... ix
B. Identifikasi Masalah ... 4
C. Pembatasan Masalah... 4
D. Perumusan Masalah ... 5
3. Elektroda Stainless Steel dan Stainless Steel/Fe-Co-Ni ... 11
4. Metode elektrodeposisi ... 14
5. Voltameter eDAQ EChem ... 17
6. Difraksi Sinar-X (XRD) ... 19
7. SEM-EDX ... 20
8. Lidah Buaya (Aloe vera) ... 22
B. Penelitian Yang Relevan ... 24
C. Kerangka Berfikir ... 26
BAB III METODE PENELITIAN ... 29
1. Subjek ... 29
2. Objek ... 29
B. Variabel Penelitian ... 29
C. Alat dan Bahan Penelitian ... 30
D. Prosedur Penelitian ... 31
1. Preparasi media Aloe vera ... 31
2. Elektrodeposisi Stainless Steel/Fe-Co-Ni ... 31
3. Elektrolisis H2O ... 31
E. Teknik Pengambilan Data ... 33
BAB IV HASIL PENELITIAN DAN PEMBAHASAN ... 34
A. Elektrodeposisi Logam Fe-Co-Ni pada Substrat Stainless Steel ... 34
B. Karakteristik Elektroda Stainless Steel dan Stainless Steel/Fe-Co-Ni.. 37
1. Karakterisasi Voltametri Linear ... 37
2. Karakterisasi XRD ... 38
3. Karakterisasi SEM-EDX ... 40
C. Elektrolisis H2O dengan Elektroda Stainless Steel ... 42
D. Elektrolisis H2O dengan Elektroda Stainless Steel/Fe-Co-Ni ... 48
E. Kondisi Optimum Elektrolisis H2O dengan Elektroda Stainless Steel dan Stainless Steel/Fe-Co-Ni ... 52
BAB VKESIMPULAN DAN SARAN ... 55
A. Kesimpulan ... 55
B. Saran ... 55
DAFTAR PUSTAKA ... 57
DAFTAR TABEL
Tabel 1. Perbandingan Kalor... 8
Tabel 2. Potensial Lebih dari Beberapa Jenis Zat ... 10
Tabel 3. Kandungan Logam Stainless Steel Tipe S-430 ... 13
Tabel 4. Komponen Aloe vera ... 23
Tabel 5. Karakteristik Tanaman Aloe barbadensis Miller ... 24
Tabel 6. Variasi Konsentrasi Aloe vera... 32
Tabel 7. Data Kadar Logam Fe, Co, dan Ni Hasil Karakterisasi SEM-EDX ... 42
Tabel 8. Kondisi Optimum Proses Elektrolisis dengan Elektroda Stainless Steel dan Elektroda Stainless Steel/Fe-Co-Ni ... 54
Tabel 9. Hasil Pengujian Voltametri Siklik dengan Elektroda Stainless Steel ... 68
DAFTAR GAMBAR
Gambar 1. Pembentukan Gas Oksigen dan Hidrogen dalam Elektrolisis ... 9
Gambar 2. Rangkaian Alat Elektrodeposisi ... 15
Gambar 3. Kurva Voltamogram Siklik yang Menunjukkan Puncak Arus Katoda dan Puncak Arus Anoda. ... 18
Gambar 4. Kurva Fungsi Potensial dengan Waktu dan Voltamogram Linear ... 19
Gambar 5. Hamburan Sinar-X pada Kristal ... 20
Gambar 6. Interaksi Elektron dan Sampel ... 21
Gambar 7. Tanaman Aloe barbadensis Miller ... 24
Gambar 8. Voltamogram Linear Metode Elektrodeposisi ... 36
Gambar 9. Karakterisasi Voltamogram Linear (a) Elektroda Stainless Steel dan (b) Elektroda Stainless Steel/Fe-Co-Ni ... 37
Gambar 10. Hasil Karakterisasi XRD Elektroda Stainless Steel dan Elektroda Stainless Steel/Fe-Co-Ni ... 39
Gambar 11. Hasil Karakterisasi SEM-EDX Elektroda Stainless Steel ... 41
Gambar 12. Hasil Karakterisasi SEM-EDX Elektroda Stainless Steel/Fe-Co-Ni . 41 Gambar 13. Voltamogram Siklis Elektrolisis Air Menggunakan Elektroda Stainless Steel dengan Media Serbuk Aloe vera Sebanyak (a) 0 gram, (b) 1 gram, (c) 2 gram, (d) 3 gram, (e) 4 gram, (f) 5 gram, (g) 6 gram, (h) 7 gram, (i) 8 gram, (j) 9 gram, dan (k) 10 gram per liter air ... 45
Gambar 14. Grafik Perbandingan Efisiensi Produksi Gas Hidrogen dan Overpotential Menggunakan Elektroda Stainless Steel ... 46
Gambar 15. Voltamogram Siklis Elektrolisis Air Menggunakan Elektroda Stainless Steel/Fe-Co-Ni dengan Media Serbuk Aloe vera Sebanyak (a) 0 gram, (b) 1 gram, (c) 2 gram, (d) 3 gram, (e) 4 gram, (f) 5 gram, (g) 6 gram, (h) 7 gram, (i) 8 gram, (j) 9 gram, dan (k) 10 gram prel liter air ... 50
Gambar 16. Grafik Perbandingan Efisiensi Produksi Gas Hidrogen dan Overpotential Menggunakan Elektroda Stainless Steel/Fe-Co-Ni .... 51
DAFTAR LAMPIRAN
Lampiran 1. Diagram Alir Proses ... 61 Lampiran 2. Hasil Karakterisasi Difraksi X-Ray (XRD) ... 65 Lampiran 3. Hasil Karakterisasi Elektroda Stainless Steel/Fe-Co-Ni
Menggunakan SEM-EDX ... 67 Lampiran 4. Hasil Uji Voltametri Siklik dengan Elektroda Stainless Steel dan
BAB I PENDAHULUAN A. Latar Belakang Masalah
Energi merupakan salah satu komponen yang paling penting bagi makhluk
hidup. Kebutuhan energi akan terus meningkat seiring dengan pertumbuhan zaman,
karena energi merupakan salah satu kebutuhan dasar untuk memenuhi
kelangsungan hidup manusia. Sebagian besar pemenuhan kebutuhan energi masih
tergantung pada energi fosil seperti minyak bumi, sedangkan cadangan energi di
dalam bumi semakin lama akan berkurang dan semakin habis. Penggunaan energi
fosil atau minyak bumi sebenarnya sudah menjadi andalan untuk memenuhi
kebutuhan energi di seluruh sektor kegiatan. Hal tersebut berdampak pada cadangan
energi yang tentu saja akan semakin habis baik jumlah maupun cadangannya.
Ketersediaan minyak bumi sangat terbatas serta membutuhkan waktu yang cukup
lama dalam pengolahannya. Oleh karena itu minyak bumi merupakan salah satu
sumber energi yang tidak dapat diperbaharui atau bersifat tak terbarukan (non
renewable energy sources).
Ketersediaan energi minyak bumi setiap tahunnya akan mengalami
penurunan seiring meningkatnya pertumbuhan penduduk di Indonesia. Menurut
Ariyanti (2014) konsumsi minyak bumi di Indonesia terus mengalami peningkatan
sekitar 3,5% setiap tahunnya. Oleh karena itu pemanfaatan sumber energi
terbarukan perlu dikembangkan untuk penyedia energi yang berkelanjutan. Sampai
saat ini sumber energi terbarukan belum sepenuhnya dimanfaatkan untuk
memenuhi kebutuhan energi bagi kelangsungan hidup manusia. Pemanfaatan
Indonesia mempunyai sumber energi bahan bakar alternatif yang melimpah.
Salah satu bahan bakar alternatif yang dapat diperbaharui adalah hidrogen.
Hidrogen tergolong bahan bakar alternatif karena hasil pembakaran gas hidrogen
menghasilkan energi yang cukup besar. Oleh karena itu hidrogen sangat potensial
sebagai energi yang mendukung penciptaaan lingkungan karena dapat
menghasilkan pembakaran yang efisien dan bersih sehingga merupakan bahan
bakar yang ramah lingkungan.
Hidrogen bukan merupakan sumber energi (energy source) melainkan
pembawa energi (energy carrier), artinya hidrogen harus diproduksi dan tidak
tersedia bebas di alam. Salah satu metode yang sederhana untuk memproduksi gas
hidrogen adalah metode elektrolisis. Metode elektrolisis ini sangat mungkin
dilakukan karena selain aman, metode ini juga mudah untuk dilakukan. Elektrolisis
merupakan proses penguraian air untuk menghasilkan oksigen dan hidrogen dengan
cara pengaliran arus listrik melalui katoda dan anoda yang tercelup di dalam air.
Gas hidrogen akan terkumpul di katoda yaitu elektroda yang terhubung arus negatif
sedangkan gas oksigen akan terkumpul di anoda, yaitu elektroda yang terhubung
arus positif.
Elektroda merupakan salah satu komponen penting dalam proses elektrolisis.
Elektroda yang digunakan harus memiliki ketahanan anti korosi sehingga tidak
mudah rusak apabila digunakan saat elektrolisis. Salah satu jenis elektroda yang
dapat digunakan dalam proses elektrolisis adalah stainless steel. Jenis logam
stainless steel yang digunakan sebagai elektroda dalam penelitian ini yaitu stainless
elektroda stainless steel dapat ditingkatkan efektifitasnya agar lebih maksimal
melalui teknik pelapisan logam Fe, Co, dan Ni.
Modifikasi elektrolisis air dapat meliputi penambahan zat terlarut yang
bersifat elektrolit, dapat berupa asam, basa atau garam (Isana, 2010). Elektrolit yang
digunakan dalam penelitian ini adalah garam NaHCO3 yang dilarutkan dalam
akuabides. Adanya elektrolit akan meningkatkan konduktifitas listrik karena pada
saat proses elektrolisis dapat menurunkan energi yang dibutuhkan, sehingga laju
reaksi pemecahan molekul air menjadi lebih cepat (Marlina et. al., 2013: 54).
Penelitian ini juga memanfaatkan tanaman lidah buaya (Aloe vera) sebagai media
dalam proses elektrolisis. Aloe vera yang digunakan dalam penelitian ini yaitu
berjenis Aloe barbadensis Miller.Pemilihan Aloe barbadensis Miller sebagai media
dalam proses eletrolisis karena merupakan salah satu jenis tanaman lidah buaya
yang banyak tumbuh di Indonesia serta merupakan tanaman hias yang sangat
mudah ditemukan, baik di lingkungan rumah atau di luar lingkungan. Selain itu di
dalam Aloe vera terdapat kandungan zat aktif yaitu senyawa alkaloid (Willer, et.
al., 1978 :71), terpenoid, dan flavonoid (Cowman, 1999: 564). Senyawa alkaloid
merupakan senyawa yang bersifat basa (Lenny, 2006: 23). Menurut (Rashid, et. al.,
(2015: 81), sifat asam atau basa dapat meningkatkan konduktivitas pada saat
pemecahan molekul air. Berdasarkan uraian tersebut, maka dilakukan penelitian
elektrolisis dengan penambahan media Aloe vera yang bertujuan untuk mengetahui
pengaruh penambahan mediator terhadap produksi gas hidrogen dan diharapkan
B. Identifikasi Masalah
Berdasarkan latar belakang masalah di atas, dapat diidentifikasi permasalahan
sebagai berikut:
1. Penggunaan bahan bakar yang ramah lingkungan belum sepenuhnya
dimanfaatkan untuk memenuhi kebutuhan energi.
2. Jenis logam untuk melapisi elektroda stainless steel.
3. Metode yang digunakan untuk pembuatan elektroda stainless steel/Fe-Co-Ni.
4. Jenis dan variasi konsentrasi media yang digunakan dalam proses elektrolisis.
5. Elektrolit yang digunakan dalam proses elektrolisis
6. Efisiensi evolusi gas hidrogen.
C. Pembatasan Masalah
Berikut batasan masalah yang didasarkan pada identifikasi masalah di atas
agar penelitian yang dilakukan efektif:
1. Gas hidrogen merupakan salah satu bahan bakar yang ramah lingkungan.
2. Jenis logam untuk melapisi elektroda stainless steel yaitu logam terner Fe,Co,
dan Ni
3. Metode yang digunakan untuk pembuatan elektroda stainless steel/Fe-Co-Ni
adalah metode elektrodeposisi.
4. Media yang digunakan yaitu serbuk Aloe vera dengan variasi konsentrasi 0,
1, 2, 3, 4, 5, 6, 7, 8, 9, dan 10 gram per liter.
5. Elektrolit yang digunakan yaitu larutan NaHCO3 dengan konsentrasi 5 gram
6. Efisiensi produksi gas hidrogen adalah kuantitas gas hidrogen yang
dihasilkan dalam media dan tanpa media Aloe vera dibandingkan dengan
elektroda stainless steel dan stainless steel/Fe-Co-Ni yang dihasilkan.
D. Perumusan Masalah
Berdasarkan identifikasi masalah dan batasan masalah di atas, maka dapat
dirumuskan masalah sebagai berikut:
1. Bagaimana pengaruh media Aloe vera pada proses elektrolisis menggunakan
elektroda stainless steel?
2. Bagaimana pengaruh media Aloe vera pada proses elektrolisis menggunakan
elektroda stainless steel/Fe-Co-Ni?
3. Bagaimana efektivitas penggunaan elektroda stainless steel dan stainless
steel/Fe-Co-Ni untuk produksi gas hidrogen saat proses elektrolisis?
E. Tujuan Penelitian
Berdasarkan latar belakang dan rumusan masalah di atas, penelitian ini
bertujuan:
1. Mengetahui pengaruh media Aloe vera pada proses elektrolisis menggunakan
elektroda stainless steel.
2. Mengetahui pengaruh media Aloe vera pada proses elektrolisis menggunakan
elektroda stainless steel/Fe-Co-Ni
3. Mengetahui efektivitas penggunaan elektroda stainless steel dan stainless
F. Manfaat Penelitian
Manfaat yang diperoleh dari penelitian ini adalah sebagai berikut:
1. Memberi informasi mengenai prosedur pembuatan elektroda stainless
steel/Fe-Co-Ni secara elektrodeposisi.
2. Memberi informasi mengenai karakterisasi elektroda stainless steel
/Fe-Co-Ni.
BAB II
KAJIAN PUSTAKA
A. Deskripsi Teori 1. Gas Hidrogen
Hidrogen merupakan salah satu unsur yang paling sederhana karena hanya
memiliki memiliki nomor atom 1 serta Ar= 1,00797 dengan konfigurasi elektron 1s1
dalam tabel periodik. memiliki satu proton dan satu elektron. Menurut Batubara
(2012: 4), hidrogen berasal dari bahasa Yunani yaitu hydro yang berarti air dan
genes yang berarti pembentukan, sehingga hidrogen dapat disebut sebagai unsur
pembentuk air. Pada suhu dan tekanan standar, hidrogen merupakan gas yang tidak
berwarna, tidak berbau dan sangat mudah terbakar.
Gas hidrogen dapat digunakan sebagai bahan bakar yang lebih efektif karena
pembakarannya akan menghasilkan energi yang lebih besar dibandingkan dengan
bahan bakar lain. Pembakaran hidrogen tidak menghasilkan produk sampingan
yang berbahaya, hanya energi ramah lingkungan yang dihasilkan (Dewi, 2011: 5).
Menurut Putra (2010: 146), terdapat beberapa keuntungan apabila hidrogen
digunakan sebagai bahan bakar, diantaranya yaitu:
a. Pembakaran hidrogen akan membentuk air dan menghasilkan energi.
b. Pembakaran hidrogen menghasilkan polusi yang tidak berbahaya.
c. Penggunaan hidrogen dalam mesin kendaraan bermotor akan terbakar lebih
efisien dibandingkan dengan bahan bakar lain.
Pembakaran hidrogen dapat menghasilkan kalor sebanyak 187 kJ/mol
hidrogen. Hidrogen terbakar menurut persamaan reaksi:
Hasil pembakaran gas hidrogen menghasilkan kalor yang cukup besar.
Seperti pada Tabel 1 berikut dapat dibandingkan kalor yang dihasilkan oleh
hidrogen dengan bahan bakar lain.
Tabel 1. Perbandingan Kalor
Bahan Bakar Kalor yang di hasilkan (kJ/gram)
Gas hidrogen 143
Hidrogen cair 142
Gas metan 55
LPG 50
Oktana cair 48
Sumber: Putra, 2010: 145
2. Elektrolisis
Elektrolisis merupakan suatu metode yang sederhana dengan memanfaatkan
energi listrik untuk menjalankan suatu reaksi kimia. Elektrolisis adalah peristiwa
penguraian elektrolit dalam sel elektrolisis oleh arus listrik yang akan diubah
menjadi suatu energi kimia (Isana, 2010). Menurut Sebastian & Sitorus (2013:20),
elektrolisis air merupakan proses penguraian senyawa air menjadi gas-gas oksigen
dan hidrogen dengan menggunakan arus listrik. Hidrogen akan terkumpul di katoda
yaitu elektroda negatif dan oksigen akan terkumpul pada anoda yaitu elektroda
positif.
Proses ionisasi dan pembentukan gas hidrogen dan oksigen pada proses
Gambar 1. Pembentukan Gas Oksigen dan Gas Hidrogen dalam Elektrolisis Sumber: Zeng & Zhang, 2010: 310
Gambar 1 menunjukkan bahwa terjadi proses elektrolisis yang berlangsung
ketika dua buah elektroda ditempatkan dalam elektrolit dan arus searah (power DC)
dialirkan diantara kedua elektroda tersebut. Molekul H2O akan terpisah menjadi
ion-ionnya yaitu ion H+ dan ion OH-. Ion H+ akan tertarik ke kutub katoda yang
bermuatan negatif sehingga ion H+ menyatu pada katoda. Atom-atom hidrogen
akan membentuk gas hidrogen dalam bentuk gelembung gas pada katoda yang
melayang ke permukaan. Hal serupa terjadi pada ion OH- yang menyatu pada anoda
kemudian membentuk gas oksigen dalam bentuk gelembung gas katoda (Zeng &
Zhang, 2010: 310). Reaksi elektrolisis yang terjadi yaitu:
Katoda (reduksi) : 2 H2O (l) + 2 e-→ H2 (g) +2 OH- (aq)
Anoda (oksidasi) : 2 OH- (aq)→ ½ O2 (g) + H2O (l) + 2 e
-Reaksi Sel : H2O (l)→ H2 (g) + ½ O2 (g)
Proses elektrolisis juga bergantung pada elektroda yang digunakan. Elektroda
berperan sebagai tempat berlangsungnya reaksi. Reaksi reduksi berlangsung di
katoda, sedangkan reaksi oksidasi berlangsung di anoda. Katoda akan menarik
kation yang tereduksi menjadi endapan logam, sedangkan anoda akan menarik
elektrolisis adalah untuk mendapatkan suatu lapisan atau endapan logam di katoda
dan gas di anoda. Menurut Putra (2010: 142-143), terdapat dua prinsip dari
elektrolisis yaitu beda potensial yang digunakan dan arus yang mengalir melalui sel
elektrolisis. Dalam proses elektrolisis diperlukan potensial minimum karena:
a. Adanya beda potensial antara elektroda menyebabkan ion-ion dalam sistem
bergerak ke elektroda baik anoda maupun katoda.
b. Diperlukan potensial tambahan untuk discas ion pada elektrolisis yang
disebut potensial lebih (overpotential)
Reaksi pada elektroda yang menghasilkan gas memerlukan potensial lebih
yang besar. Menurut Bird (1987: 234), potensial lebih pada elektrogenerasi
hidrogen adalah selisih antara beda potensial sebenarnya dan potensial teoritis.
Persamaan reaksi dari elektrogenerasi hidrogen pada keadaan standar adalah
sebagai berikut (Riyanto, 2013: 18):
2 H2O (l) + 2e-⇄ H2 (g)+ 2 OH- (aq) E°= -0,828 V (2)
Potensial lebih dapat dipengaruhi oleh permukaan elektroda maupun
konsentrasi elektrolit yang digunakan dalam proses elektrolisis. Potensial lebih
pada beberapa jenis gas disajikan pada tabel berikut.
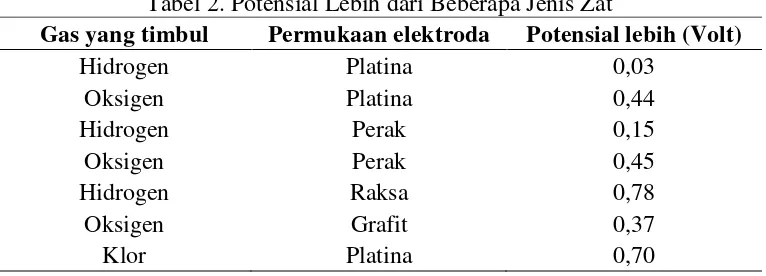
Tabel 2. Potensial Lebih dari Beberapa Jenis Zat
Gas yang timbul Permukaan elektroda Potensial lebih (Volt)
Hidrogen Platina 0,03
Hidrogen merupakan molekular berupa gas tidak berwarna, tidak berbau dan
paling mudah dibuat melalui reaksi elektrolisis air (Cotton, 1989: 241). Melalui
proses elektrolisis air hidrogen dapat dihasilkan, sehingga disebut proses evolusi
hidrogen. Reaksi evolusi hidrogen terjadi secara terbatas dan didasarkan atas
desorpsi molekul pada permukaan katoda (Astuti, 2016: 8).
Pemecahan molekul air melibatkan reaksi adsorpsi dan desorpsi H+.
Mekanisme yang terjadi adalah sebagai berikut:
Pembentukan hidrogen teradsorpsi
H+ + e-→ Hads (3)
Selanjutnya diikuti dengan desorpsi kimia
2 Hads → H2 (4)
Atau desorpsi elektrokimia
H+ + e- + Hads→ H2 (5)
Reaksi (3) merupakan tahap adsorpsi hidrogen. Penggunaan elektroda yang
berlubang-lubang atau berpori akan membuat lebih banyak hidrogen yang teradsorp
pada saat proses elektrolisis. Pada reaksi (4) dan (5) merupakan tahap desorpsi
hidrogen. Penggunaan elektroda dengan permukaan yang kasar akan meningkatkan
reaksi kimia dan mengurangi gelembung sehingga akan meningkatkan laju
elektrolisis. Pembentukan hidrogen juga dipengaruhi oleh jenis elektroda,
konsentrasi elektrolit serta suhu reaksi (Zeng & Zhang, 2010: 314).
3. Elektroda Stainless Steel dan Stainless Steel/Fe-Co-Ni
Elektroda sangat berperan penting dalam proses elektrolisis. Terdapat dua
elektroda yang digunakan, yaitu katoda dan anoda. Katoda merupakan elektroda
negatif. Elektroda merupakan konduktor yang digunakan untuk bersentuhan dengan
bagian atau media non-logam dari sebuah sirkuit. Menururt Marlina et. al., (2013:
54), elektroda merupakan salah satu komponen yang sangat penting pada proses
elektrolisis air yaitu sebagai penghantar arus listrik dari sumber tegangan ke air
yang akan dielektrolisis.
Pada proses elektrolisis, elektroda yang sering digunakan yaitu terbuat dari
logam golongan mulia karena bersifat tahan korosi. Akan tetapi penggunaan
elektroda logam mulia ini kurang menguntungkan karena memakan biaya yang
cukup mahal. Sehingga dipilih elektroda yang mudah didapatkan dan harganya
lebih ekonomis serta sifat dan fungsinya tidak memiliki perbedaan yang cukup jauh.
Salah satu elektroda yang dapat digunakan sebagai pengganti elektroda logam
mulia yaitu logam stainles steel.
Stainless steel merupakan paduan beberapa unsur logam yang mempunyai
sifat tahan korosi yang cukup tinggi dan tahan terhadap oksidasi. Menurut AK Steel
(2007), sifat tahan korosi stainless steel diperoleh karena adanya kandungan unsur
kromium yang tinggi yaitu berkisar antara 16% - 18% sehingga memiliki ketahanan
korosi yang relatif tinggi. Logam stainless steel yang digunakan dalam penelitian
ini adalah stainless steel tipe S-430. Stainless steel tipe S-430 ini menggabungkan
sifat antara tahan korosi dan panas, serta tahan reaksi oksidasi di atas temperatur
1500°F (816°C). Kandungan logam stainless steel tipe S-430 dapat dilihat pada
Tabel 3. Kandungan Logam Stainless Steel Tipe S-430
Menurut Ceper (2016), logam stainless steel mempunyai beberapa
karakteristik sebagai berikut:
a. Kandungan kromium tinggi
Stainless steel memiliki kandungan kromium minimal 10.5%.
Kandungan unsur chromium yang menyebabkan stainless steel tahan
terhadap korosi dan oksidasi.
b. Tahan korosi
Stainless steel memiliki sifat tahan korosi secara alami yang diperoleh
dari adanya kandungan kromium yang tinggi. Stainless steel memiliki lapisan
oksida yang stabil pada permukaannya sehingga tahan terhadap pengaruh
oksigen. Lapisan oksida ini bersifat self-healing atau penyembuhan diri,
dalam artian akan tetap utuh meskipun permukaan benda dipotong atau
dirusak.
c. Tampilan menarik
Karakteristik dari stainless steel yaitu memiliki warna perak mengkilap
yang tampak lebih menarik sehingga sering digunakan untuk peralatan pada
Logam stainless steel dapat digunakan sebagai elektroda dalam proses
elektrolisis, akan tetapi aktivitas katalitiknya perlu dioptimalkan. Oleh sebab itu
perlu adanya peningkatan efektifitas katalitiknya dengan cara teknik pelapisan.
Teknik pelapisan dapat dilakukan dengan logam yang bersifat katalitik, seperti
logam Fe, Co, dan Ni yang masing-masing memiliki nomor atom 26, 27, dan 28
yang terletak pada golongan 8, 9, dan 10 dalam tabel periodik unsur (Isana et. al.
(2012). Menurut Isana (2014), logam Fe, Co, dan Ni memiliki ukuran dan harga
potensial yang tidak berbeda jauh sehingga memungkinkan terjadinya kompetisi
ketat antara ketiga logam untuk menempel pada substrat stainless steel. Hasil
penelitian tersebut menyatakan bahwa elektoda stainless steel/Fe-Co-Ni
menunjukkan aktivitas katalitik yang lebih baik sebagai elektroda dalam proses
elektrolisis.
4. Metode elektrodeposisi
Metode elektrodeposisi merupakan proses pengendapan logam pada
elektroda dengan memanfaatkan reaksi elektrokimia. Arus listrik dialirkan ke anoda
inert melalui elektrolit yang mengandung ion logam, sehingga logam tersebut
mengendap dalam bentuk murninya di katoda (Ariyanti & Rohmatika, 2013: 8).
Metode elektrodeposisi pada dasarnya merupakan elektroplating yaitu proses
pengendapan secara elektrokimia. Menurut Ahmad (2011: 12), elektroplating
merupakan suatu proses pengendapan zat atau ion-ion logam pada katoda melalui
proses elektrolisis. Terjadinya proses pengendapan pada katoda disebabkan oleh
adanya pemindahan ion-ion bermuatan listrik dari anoda dengan perantara larutan
permukaan benda logam. Berikut ini rangkaian alat elektrodeposisi ditunjukkan
pada Gambar 2.
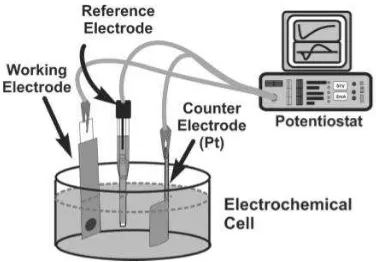
Gambar 2. Rangkaian Alat Elektrodeposisi Sumber: Pasa & Munford, 2006: 823
Prinsip dasar dari proses elektrodeposisi yaitu pembentukan lapisan atau
endapan logam pada katoda dengan menggunakan bantuan energi listrik melalui
suatu elektrolit (Yanlinastuti et. al., 2009: 175). Proses elektrodeposisi melibatkan
transfer elektron ke katoda, dengan mengukur arus dalam sel elektrokimia.
Menururt Pasa & Munford (2006: 824), pada reaksi, ion logam M+ mereduksi logam
M dengan cara melepaskan elektron n. Reaksi yang terjadi pada elektroda kerja
dalam larutann elektrolit adalah reaksi reduksi dari logam (M).
Mn+ + ne- → M (6)
Menurut Manurung (2010: 3-5), terdapat unsur-unsur pokok dalam proses
elektrodeposisi diantaranya:
a. Rectifier
Arus listrik yang digunakan pada proses elektroeposisi maupun
elektroplating adalah arus searah atau DC (direct current). Arus listrik
berfungsi sebagai sumber daya penghantar untuk menarik ion-ion positif dari
arus yang dikeluarkan bersifat arus searah, tegangannya konstan dan besar
arus yang mengalir dapat divariasikan.
b. Larutan elektrolit
Elektrolit merupakan suatu zat yang akan terurai menjadi ion-ion positif
atau negatif bila dilarutkan di dalam air dan bersifat penghantar listrik. Ion
positif akan tertarik menuju elektroda negatif yaitu katoda, sedangkan ion
negatif akan menuju elektroda positif yaitu anoda.
c. Anoda
Anoda adalah suatu elektroda yang bermuatan positif dalam larutan
elektrolit. Fungsi dari anoda adalah sebagai sumber bahan baku yang akan
dibawa melalui elektrolit kepada permukaan katoda. Anoda biasanya dipilih
dari logam murni yaitu untuk menjamin kebersihan elektrolit pada saat proses
elektrodeposisi. Adanya arus listrik menyebabkan pelepasan ion-ion logam
dan oksigen (reduksi) di anoda, selanjutnya ion-ion logam tersebut
diendapkan pada katoda.
d. Katoda
Katoda adalah elektroda negatif dalam larutan elektrolit dimana pada
katoda ini terjadi penempelan ion-ion yang tereduksi dari anoda. Katoda
bertindak sebagai logam yang akan dilapisi atau produk yang bersifat
menerima ion.
Menurut Yanlinastuti et. al. (2009: 175) terdapat beberapa faktor yang perlu
diperhatikan dalam metode elektrodeposisi yaitu:
c. Faktor-faktor fisik seperti arus, waktu dan konsentrasi.
Metode elektrodeposisi yang dilakukan dalam penelitian ini yaitu pelapisan
pada substrat stainless steel menggunakan tiga jenis logam yaitu Fe, Co, dan Ni.
Pemilihan logam Fe, Co, dan Ni bertujuan untuk meningkatkan aktivitas katalitik
sehingga mampu memecah molekul air dan menghasilkan gas hidrogen lebih
efektif.
5. Voltameter eDAQ EChem
Voltameter eDAQ EChem merupakan salah satu software yang digunakan
untuk mengukur voltametri elektroda. Secara umum EChem merupakan program
yang disediakan khusus untuk metode voltametrik dan amperometrik. Pada
penggunaannya, Echem dihubungkan dengan potensiostat sehingga arus yang
dihasilkan akan direkam oleh komputer secara langsung (eDAQ Pty Ltd, 2017).
Aplikasi voltametri ini mendukung beberapa teknik elektrokimia diantaranya
adalah sebagai berikut (Andriani, 2007: 17):
a. Linear Sweep Voltammetry (LSV)
b. Normal Pulse Voltammetry (NPV)
c. Square Wave Voltammetry (SWV)
d. Differential Pulse Voltammetry (DPV)
e. Cyclic Voltammetry (CV)
Voltametri adalah metode elektrokimia dimana arus dan potensial yang
diamati. Voltametri berasal dari kata Volt-Amperro-Metry. Kata Volt merujuk pada
potensial, Amperro merujuk pada arus, dan Metry merujuk pada pengukuran.
Sehingga dapat diartikan bahwa voltametri adalah pemberian potensial pada
disebabkan karena terjadinya reaksi oksidasi-reduksi pada permukaan elektroda
(Apriliani, 2009: 9).
Metode voltametri merupakan salah satu metode elektrokimia yang
didasarkan pada prinsip pengukuran arus dan ptensial yang diberikan sehingga akan
memberikan suatu bentuk kurva voltamogram (Kasidi, 2007). Metode ini
merupakan metode elektroanalisis dimana informasi tentang analit diperoleh dari
pengukuran arus fungsi potensial. Teknik pengukuran metode ini dilakukan dengan
menerapkan suatu potensial ke dalam sel elektrokimia, kemudian mengukur respon
arus yang dihasilkan dari proses reaksi redoks. Respon arus diukur pada daerah
potensial yang telah ditentukan dan kemudian dibuat plot arus fungsi potensial yang
disebut voltamogram siklik (Puranto & Imawan, 2010: 21).
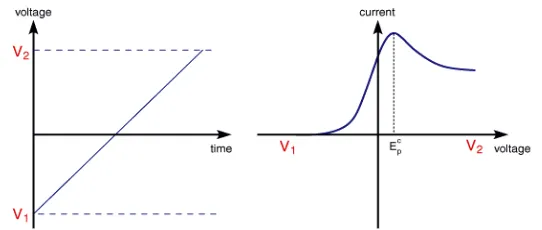
Gambar 3. Kurva Voltamogram Siklik yang Menunjukkan Puncak Arus Katoda dan Puncak Arus Anoda.
Berdasarkan voltamogram siklik didapatkan beberapa nilai parameter penting
seperti potensial puncak anoda (Epa), potensial puncak katoda (Epc), puncak arus
anoda (ipa) serta puncak arus katoda (ipc) (Riyanto, 2013: 94). Selain voltamogram
siklik, terdapat juga voltamogram linear atau Linear Sweep Voltametry. Menurut
diperoleh arus yang dihasilkan oleh elektroda kerja berupa garis linier antara
potensial dan arus, seperti yang ditunjukkan pada Gambar 4.
Gambar 4. Kurva Fungsi Potensial dengan Waktu dan Voltamogram Linear
6. Difraksi Sinar-X (XRD)
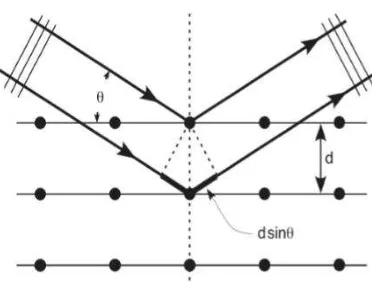
X-ray diffraction (XRD) atau difraksi sinar X merupakan alat untuk
mengetahui indeks bidang ataupun karakteristik struktur kristal yang terdapat dari
berbagai macam bahan dengan memanfaatkan hamburan sinar-X (Rahman &
Toifur, 2016: 5). Selain itu juga digunakan untuk mengidentifikasi fasa kristalin
dalam material (Nelson, 2014). XRD juga dapat memberikan data kualitatif dan
semi kuantitatif pada padatan atau sampel (Rylan, 1958: 80).
Seberkas sinar monokromatik ditembakkan pada permukaan material, maka
atom-atom dalam kristal akan menyerap energi danmenghamburkan kembali sinar
ke segala arah. Berkas sinar yang dihamburkan oleh atom yang sefasa akan terjadi
interferensi saling menguatkan, tetapi apabila tidak sefasa maka akan saling
menghilangkan. Pemantulan dan interferensi bergabung menjadi difraksi. Difraksi
akan saling menguatkan jika terpenuhi persamaan Bragg 2d sin θ = nλ (Rahman &
Gambar 5. Hamburan Sinar-X pada Kristal Sumber: Rahman & Toifur, 2016: 6
Difraksi sinar-X terjadi apabila suatu berkas elektron bebas berenergi kinetik
tinggi menumbuk logam yang merupakan sumber sinar dengan daya tembus yang
besar. Kemudian elektron-elektron inilah akan menimbulkan pancaran sinar-X,
sehingga puncak-puncak akan muncul atau terlihat dari suatu bahan yang
ditembakkan (Rahman & Toifur, 2016: 6).
Difraksi sinar-X merupakan salah satu metode yang sangat penting untuk
mengkarakterisasi struktur kristal material. Selain itu, difraksi sinar-X juga dapat
digunakan untuk beberapa hal, diantaranya adalah sebagai berikut (Nelson, 2014):
a. Pengukuran jarak rata-rata antara lapisan atau baris atom
b. Penentuan kristal tunggal
c. Penentuan struktur kristal dari material yang tidak diketahui
d. Mengukur bentuk, ukuran, dan tegangan dalam dari kristal kecil
7. SEM-EDX
SEM (Scanning Electron Microscope) merupakan instrumen yang digunakan
untuk mengetahui struktur atau sifat permukaan material. Prinsip dasar dari
mikrostruktur, termasuk porositas dan bentuk retakan suatu material (Gunawan dan
Azhari, 2011: 7-9).
Berikut ini gambaran umum interaksi antara elektron dengan sampel dapat
dilihat pada Gambar 6.
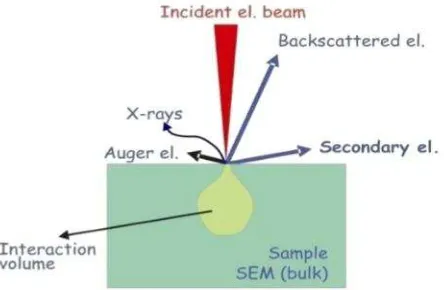
Gambar 6. Interaksi Elektron dan Sampel Sumber: Sujatno et. al., 2015: 46
Gambar 6 menunjukkan bahwa ketika berkas elektron ditembakkan pada
permukaan sampel, terjadi interaksi elektron dengan atom-atom di permukaan
maupun di bawah permukaan sampel. Akibat interaksi tersebut sebagian besar
berkas elektron berhasil keluar kembali, elektron-elektron tersebut disebut sebagai
Backscattered Electrons (BSE). Sebagian kecil elektron masuk ke dalam bahan
kemudian memindahkan sebagian besar energi pada elektron atom sehingga
terpental ke luar permukaan bahan, elektron tersebut disebut Secondary Electrons
(SE) (Sujatno et. al., 2015: 46-47). Radiasi yang dipancarkan selama interaksi
meliputi elektron sekunder, backscattered electron dan komponen tambahan seperti
cahaya tampak, elektron auger, dan sinar-X (Sutton et. al., 2007: 776).
Pembentukan elektron-elektron sekunder selalu diikuti proses munculnya
dalam bahan yang diteliti untuk mengetahui morfologi permukaan sampel (Sujatno
et. al., 2015: 46-47).
8. Lidah Buaya (Aloe vera)
Aloe vera atau biasa disebut dengan lidah buaya ini merupakan sejenis
tanaman yang sudah ada sejak ribuan tahun silam dan sering digunakan untuk
penyembuh luka, perawatan kulit dan digunakan sebagai obat. Menurut
Furnawanthi (2007: 5), lidah buaya termasuk dalam kelompok tanaman CAM
(Crassulacean Acid Metabolism) dengan sifat tahan kekeringan. Dalam kondisi
gelap terutama malam hari, stomata atau mulut daun membuka sehingga uap air
dapat masuk. Pada malam hari udaranya dingin dan uap air tersebut berbentuk
embun. Stomata yang membuka pada malam hari memberi keuntungan, yakni tidak
akan terjadi penguapan air daru tubuh tanaman sehingga air yang berada di dalam
tubuh daun dapat dipertahankan. Sehingga tanaman lidah buaya mampu bertahan
dalam kondisi apapun, termasuk kondisi kering.
Semua tanaman kaya akan berbagai metabolit sekunder, seperti tanin,
terpenoid, alkaloid, dan flavonoid (Cowman, 199: 564). Tanaman lidah buaya juga
termasuk tanaman yang mengandung senyawa alkaloid (Willer, 1978: 73). Alkaloid
merupakan senyawa tidak berwarna, akan tetapi beberapa senyawa kompleks
spesies aromatik berwarna. Alkaloid merupakan senyawa organik yang bersifat
basa yang disebabkan oleh adanya atom nitrogen (N) dalam molekul senyawa
tersebut. Semua alkaloid mengandung paling sedikit satu atom N yang bersifat basa
dan sebagian besar atom nitrogen ini merupakan bagian dari cicin heterosiklik. Pada
Komposisi terbesar yang terdapat dalam gel lidah buaya adalah air, yaitu 99%, asam
amino, protein dan karbohidrat (Bhuvana et. al., 2014 :678). Beberapa komponen
lain dari Aloe vera dapat dilihat pada Tabel 4.
Tabel 4. Komponen Aloe vera
Vitamin Senyawa
Kolin Mangan (Mn) Asam Glutamat Leusin
Asam Folat Seng (Zn) Hidroksiprolin Isoleusin
Asam Asorbat Kromium (Cr) Prolin Fenilalanin
Tembaga (Cu) Glisin Methionin
Magnesium (Mg) Alanin Besi (Fe)
Sumber: Bhuvana et. al., 2014: 679
Jenis Aloe vera yang digunakan dalam penelitian ini yaitu Aloe barbadensis
Miller. Berikut klasifikasi ilmiah dari tanaman Aloe barbadensis Miller menurut
Furnawanthi (2007: 10):
Gambar 7. Tanaman Aloe barbadensis Miller
Karakteristik dari Aloe barabadensis Miller meliputi batang, bentuk daun,
lebar daun, lapisan lilin pada daun, duri, tinggi bunga dan warna bunga dapat dilihat
pada Tabel 5.
Tabel 5. Karakteristik Tanaman Aloe barbadensis Miller
Karakteristik Aloe barbadensis Miller
Batang Tidak terlihat jelas
Bentuk daun Lebar dibagian bawah, dengan pelepah
bagian atas cembung, terdapat bercak putih
Lebar daun 6-13 cm
Lapisan lilin pada daun Tebal
Duri di bagian pinggir daun
Tinggi bunga (mm) 25-30 (tinggi tangkai bunga 60-100 cm)
Warna bunga Kuning
Sumber: Furnawanthi, 2007: 9
B. Penelitian Yang Relevan
Penelitian mengenai produksi gas hidrogen melalui pemecahan molekul air
menggunakan elektroda stainless steel telah dilakukan oleh Isana (2010) yang
berjudul Perilaku Sel Elektrolisis Air dengan Elektroda Stainless Steel. Pada
penelitian ini dilakukan elektrolisis akuades, air sumur dan larutan soda dengan
dan pH dalam selang waktu tertentu, yang selanjutnya digunakan untuk
mempelajari perilaku sel elektrolisis. Hasil penelitian menunjukkan bahwa
masing-masing sel elektrolisis memiliki perilaku yang berbeda-beda.
Elektroda stainless steel dapat ditingkatkan efisiensi gas hidrogennya dengan
teknik pelapisan (coating) menggunakan logam Fe, Co, dan Ni. Hasil penelitian
yang ini dilakukan oleh Isana et. al., (2012) yang berjudul Studies on the Hydrogen
Evolution Reaction on the Fe-Co-Ni/Stainless Steel Electrode,memberikan hasil
bahwa adanya pelapisan logam Fe, Co, dan Ni mampu meningkatkan aktivitas
katalitik elektroda. Paduan logam terner yang digunakan menghasilkan 32,2 kali
lebih baik pada produksi gas hidrogen dan 11 kali lebih baik pada produksi gas
oksigen dibandingkan dengan menggunakan elektroda stainless steel.
Proses elektrolisis H2O dilakukan dengan menggunakan elektrolit NaHCO3.
Adanya elektrolit meningkatkan konduktifitas listrik karena pada saat proses
elektrolisis dapat menurunkan energi yang dibutuhkan, sehingga laju reaksi
pemecahan molekul air menjadi lebih cepat. Jabar & Ibrahim (2013: 68) melakukan
penelitian berjudul The Effect of NaHCO3 as Catalys via Electrolysis tentang
penggunaan elektrolit NaHCO3 dan NaOH. Hasil yang diperoleh pada penelitian
tersebut adalah elektrolit NaHCO3 memiliki kemampuan lebih baik untuk
menghasilkan gas hidrogen dibandingkan dengan NaOH. Selain itu dalam
penelitian yang telah dilakukan Marlina et. al. (2013: 53-57) yang berjudul Produksi
Brown’s Gas Hasil Elektrolisis H2O dengan Katalis NaHCO3, dilakukan variasi
penambahan NaHCO3 dalam proses elektrolisis sebesar 5%; 7,5%; 10%; 12,5; dan
15%. Penambahan 12,5% NaHCO3 memberikan hasil prosentase efisiensi yang
Penelitian ini juga menggunakan penambahan media berupa serbuk Aloe vera
yang berjenis Aloe barbadensis Miller. Pemilihan Aloe vera sebagai media dalam
proses elektrolisis karena di dalam Aloe vera terdapat kandungan senyawa alkaloid
(Willer, 1978: 73) yang memiliki sifat basa (Lenny, 2006: 23). Menurut (Rashid,
et. al., (2015: 81), sifat asam atau basa dapat meningkatkan konduktivitas pada saat
pemecahan molekul air.
Astuti (2016) dalam penelitiannya yang berjudul Reaksi Evolusi Hidrogen
Menggunakan Media Tepung Mocaf dengan Elektroda Stainless Steel/Fe-Co-Ni,
menyebutkan bahwa pada penggunaan elektroda stainless steel aktivitas
katalitiknya menurun dengan adanya tepung mocaf dan pada penggunaan elektroda
stainless steel/Fe-Co-Ni mengalami peningkatan dengan adanya tepung mocaf.
Selain itu Mayssaroh & Isana (2016) melakukan penelitian yang berjudul
Elektrolisis H2O Menggunakan Elektrode Stainless Steel dalam Suasana Basa
dengan Media Tepung Maizena, menyebutkan bahwa penggunaan elektrode
stainless steel pada proses elektrolisis dengan media tepung maizena secara
voltametri siklik memberikan hasil kurang baik bila dibandingkan dengan
elektrolisis tanpa media tepung maizena. Kondisi optimal proses elektrolisis
menggunakan elektrode stainless steel terjadi pada penambahan 1 gram tepung
maizena.
C. Kerangka Berfikir
Energi merupakan salah satu kebutuhan dasar untuk memenuhi kelangsungan
hidup manusia. Sebagian besar kebutuhan energi masih tergantung dengan energi
energi terbarukan perlu dikembangkan untuk penyedia energi yang berkelanjutan.
Salah satu sumber energi yang dapat diperbaharui adalah hidrogen.
Salah satu cara untuk menghasilkan gas hidrogen adalah dengan metode
elektrolisis. Metode elektrolisis yang dilakukan dalam peneletian ini dilengkapi
dengan elektroda stainless steel dan stainles steel/Fe-Co-Ni. Elektroda stainles
steel/Fe-Co-Ni dibuat dengan teknik pelapisan logam Fe, Co, Ni dengan
perbandingan 1:1:1 menggunakan metode elektrodeposisi. Proses elektrodeposisi
dilakukan dengan instrument Voltameter eDAQ EChem dengan laju penyapuan 50
mV/s selama 10 menit. Kemudian elektroda stainless steel dan stainless steel
/Fe-Co-Ni dilakukan karakterisasi menggunakan Voltameter eDAQ EChem secara
liniaer, XRD dan SEM-EDX. Pada penelitian ini digunakan larutan elektrolit
NaHCO3 dengan konsentrasi 5 gram dalam 1 liter larutan. Selain itu digunakan juga
mediator berupa serbuk lidah buaya (Aloe vera) dengan variasi konsentrasi 0, 1, 2,
3, 4, 5, 6, 7, 8, 9, dan 10 gram per liter. Aloe vera yang digunakan dalam penelitian
ini adalah Aloe barbadensis Miller. Jenis Aloe barbadensis Miller dipilih karena
memiliki kandungan zat aktif yaitu alkaloid (Willer, et. al., 1978 :71). Senyawa
alkaloid merupakan senyawa yang bersifat basa (Lenny, 2006: 23). Menurut
(Rashid, et. al., (2015: 81), sifat asam atau basa dapat meningkatkan konduktivitas
pada saat pemecahan molekul air. Konduktivitas larutan bergantung pada jumlah
ion dalam larutan elektrolit. Jumlah ion ini akan mempercepat hantaran listrik yang
dilaluinya, maka pergerakan ion akan semakin mudah sehingga dapat
memepercepat perpindahan elektron. Setiap ion hanya dapat membawa muatan
terdapat dalam elektrolit, maka akan semakin tinggi sifat hantaran listrik yang
dialirkan.
Pada proses elektrolisis dilakukan dengan metode voltametri siklik dengan
laju penyapuan 50 mV/s. Kemudian dianalisis untuk mengetahui efisiensi produk
dan efisiensi energi gas hidrogen berdasarkan puncak katoda yang dihasilkan dari
BAB III
METODE PENELITIAN A. Subjek dan Objek Penelitian
1. Subjek
Subjek dalam penelitian ini adalah elektroda stainless steel/Fe-Co-Ni.
2. Objek
Objek dari penelitian ini adalah aktivitas elektroda stainless steel dan
stainless steel/Fe-Co-Ni dan efisiensi gas hidrogen dalam pemecahan molekul air.
B. Variabel Penelitian
Variabel dalam penelitian ini meliputi variabel bebas, terikat, dan kontrol
adalah sebagai berikut:
1. Variabel bebas
Variabel bebas dalam penelitian ini adalah variasi komposisi Aloe vera
sebagai media.
2. Variabel terikat
Variabel terikat dalam penelitian ini adalah aktivitas stainless steel dan
stainless steel/Fe-Co-Ni serta efisiensi gas hidrogen yang dihasilkan.
3. Variabel Kontrol
Variabel kontrol dalam penelitian ini adalah laju penyapuan voltameter
C. Alat dan Bahan Penelitian
1. Alat yang digunakan dalam penelitian meliputi:
a. Alat-alat gelas dan ukur,
b. Tabung elektrolisis,
c. eDAQ EChem,
2. Bahan yang digunakan dalam penelitian meliputi:
a. Elektroda stainless steel tipe 430 dengan ketebalan = 1,2 mm; lebar = 3 mm;
dan panjang = 110 mm,
b. Elektroda stainless steel/Fe-Co-Ni dengan ketebalan = 1,2 mm; lebar = 3 mm
dan panjang = 110 mm,
c. Lidah buaya,
d. Asam nitrat,
e. Aseton,
f. NaHCO3 p.a,
g. FeSO4.7H2O p.a,
h. Co(NO3)2.6H2O p.a,
i. NiSO4.6H2O p.a,
j. Sakarin,
k. NaCl,
l. NH4Cl,
m. Akuabides,
D. Prosedur Penelitian 1. Preparasi media Aloe vera
a. Tanaman Aloe vera dicuci terlebih dahulu menggunakan air bersih.
b. Kemudian Aloe vera dipotong menjadi ukuran yang lebih kecil
c. Aloe vera yang sudah dipotong selanjutnya dijemur di bawah terik matahari
dengan tujuan menghilangkan kandungan air.
d. Setelah Aloe vera kering, selanjutnya dihaluskan menggunakan blender dan
kemudian diayak.
2. Elektrodeposisi Stainless Steel/Fe-Co-Ni
Elektroda stainless steel/Fe-Co-Ni dibuat secara voltametri linear dengan
staninless steel sebagai elektroda kerja, platinum sebagai elektroda kontra, dan
Ag/AgCl sebagai elektroda pembanding.
a. Membuat larutan Fe2+, Co2+, dan Ni2+ dengan perbandingan mol sebesar
1:1:1.
b. Larutan Fe2+, Co2+, dan Ni2+ dibuat dengan menyiapkan larutan FeSO4 dari
padatan kristal FeSO4.7H2O, larutan Co(NO3)2 dari padatan kristal
Co(NO3)2.6H2O, dan larutan NiSO4 dari padatan kristal NiSO4.6H2O dengan
konsentrasi masing-masing larutan sebesar 0,01 M.
c. Dilakukan elektrodeposisi menggunakan eDAQ EChem dengan laju
penyapuan sebesar 50 mV/s selama 10 menit.
3. Elektrolisis H2O
Elektroda stainless steel dan stainless steel/Fe-Co-Ni digunakan sebagai
a. Larutan elektrolit disiapkan dengan menggunakan NaHCO3 sebanyak 5 gram
per 1 liter air.
b. Dilakukan penambahan variasi konsentrasi Aloe vera sebagai mediator
sebanyak 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, dan 10 gram yang dilarutkan dalam
akuabides
c. Masing-masing sampel di elektrolisis secara voltametri siklis menggunakan
voltameter eDAQ EChem dengan laju 50 mV/s. Variasi konsentrasi Aloe vera
dapat dilihat dalam Tabel 6.
Tabel 6. Variasi Konsentrasi Aloe vera
No Sampel Variasi konsentrasi
1 1 0 gram/L
2 2 1 gram/L
3 3 2 gram/L
4 4 3 gram/L
5 5 4 gram/L
6 6 5 gram/L
7 7 6 gram/L
8 8 7 gram/L
9 9 8 gram/L
10 10 9 gram/L
E. Teknik Pengambilan Data
Data yang diperoleh dari penelitian ini adalah data kualitatif dan data
kuantitatif.
1. Data kualitatif
Data kualitatif didapatkan dari analisis data hasil pengukuran menggunakan
SEM-EDX dan XRD.
2. Data kuantitatif
Data kuantitatif didapatkan dari analisis data hasil pengukuran menggunakan
voltameter eDAQ EChem. Efisiensi gas hidrogen dapat ditentukan dengan
menggunakan persamaan:
dengan � adalah efisiensi gas hidrogen dan ic adalah puncak arus katoda.
Selain efisiensi gas hidrogen, ditinjau pula efisiensi energi berupa potensial
lebih (over potential) dengan menggunakan persamaan:
∆E = (Eeksperimen–Eteori) (8)
dengan ∆E adalah potensial lebih dari elektrogenerasi hidrogen, Eteori adalah
potensial setengah reaksi hidrogen pada keadaan standar, dan Eeksperimen adalah
potensial yang terukur pada saat reaksi berlangsung.
�= � ��
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
Penelitian ini berjudul “Produksi Hidrogen dari Pemecahan Molekul H2O
dalam Media Aloe vera dengan Elektroda Stainless Steel/Fe-Co-Ni” yang bertujuan
untuk mengetahui aktivitas elektroda stainless steel dan stainless steel/Fe-Co-Ni
dalam media Aloe vera serta mengetahui kondisi optimum laju pembentukan gas
hidrogen pada proses elektrolisis. Pada saat elektrolisis digunakan larutan elektrolit
yang bersifat basa yaitu larutan NaHCO3 dengan konsentrasisebanyak 5 gram per
1 liter air dan penambahan media Aloe vera sebanyak 0 gram sampai dengan 10
gram yang dilarutkan dalam akuabides.
A. Elektrodeposisi Logam Fe-Co-Ni pada Substrat Stainless Steel
Metode elektrodeposisi adalah metode pengendapan secara elektrokimia
dengan cara mengalirkan arus listrik melalui elektroda ke dalam larutan elektrolit.
Metode elektrodeposisi ini merupakan proses yang dilakukan dalam suatu bak atau
bejana sel dan berisi larutan elektrolit, serta dilengkapi dengan elektroda. Elektroda
yang digunakan dalam proses elektrodeposisi ada tiga yaitu logam stainless steel
sebagai elektroda kerja, platinum sebagai elektroda kontra (auxiliary electrode) dan
Ag/AgCl sebagai elektroda pembanding (reference electrode).
Pelapisan logam stainless steel ini menggunakan paduan logam Fe, Co dan
Ni dengan perbandingan 1:1:1. Pemilihan logam Fe, Co, dan Ni karena
logam-logam tersebut memiliki sifat dan ukuranya relatif sama, mudah didapatkan dan
harganya lebih ekonomis. Pada proses elektrodeposisi digunakan beberapa bahan
kimia tambahan yang mampu membantu proses pelapisan logam Fe, Co, dan Ni
Proses elektrodeposisi ini dikarakterisasi dengan voltametri linear menggunakan
instrumen eDAQ Echem dengan laju penyapuan 50mV selama 10 menit.
Pelapisan logam Fe, Co, dan Ni pada substrat stainless steel dapat terjadi
karena adanya arus listrik yang dihubungkan pada elektroda, sehingga menyebaban
aliran elektron bergerak dari anoda menuju katoda melalui larutan elektrolit.
Larutan elektrolit yang digunakan yaitu larutan NaHCO3 mengandung ion Na+ dan
HCO3-, ion-ion tersebut yang berfungsi sebagai penghantar arus listrik. Penggunaan
NaHCO3 sebagai larutan elektrolit karena menururt Jabar dan Ibrahin (203: 68),
elektrolit NaHCO3 memiliki kemampuan lebih baik untuk menghasilkan gas
hidrogen dibandingkan dengan NaOH. Proses pelapisan dimulai dengan adanya
arus listrik searah yang dialirkan pada kedua elektroda, yaitu anoda dan katoda
dalam larutan elektrolit. Ion-ion positif yang terbentuk karena adanya potensial
akan ditarik oleh elektroda katoda yaitu elektroda yang bermuatan negatif.
Sedangkan ion yang bermuatan negatif akan berpindah ke arah elektroda bermuatan
positif yaitu anoda. Ion-ion tersebut akan dinetralisir oleh kedua elektroda dan
larutan elektrolit kemudian akan diendapkan pada elektroda katoda. Di dekat
permukaan katoda, terbentuk daerah Electrical Double Layer (EDL) yaitu lapisan
dielektrik. Hasil yang terbentuk merupakan lapisan logam dan gas hidrogen.
Adanya lapisan EDL menjadikan ion-ion logam akan lebih mudah menuju ke
permukaan katoda dan menangkap elektron dari katoda. Ion logam tersebut akan
tereduksi menjadi logam dan mengendap di katoda membentuk lapisan logam.
Gambar 8. Voltamogram Linear Metode Elektrodeposisi
Elektrodeposisi merupakan merupakan suatu proses pengendapan ion-ion
logam pada suatu logam dasar (katoda) melalui proses elektrolisis. Terjadi proses
pengendapan pada katoda disebabkan oleh adanya pemindahan ion-ion bermuatan
listrik dari anoda dengan perantara larutan elektrolit, yang terjadi secara terus
menerus pada tegangan konstan hingga akhirnya mengendap dan menempel kuat
membentuk lapisan permukaan benda logam.
Gambar 8 menunjukkan voltamogram elektrodeposisi logam Fe, Co, dan Ni
pada substrat stainless steel menggunakan voltametri linear. Pada potensial -0,8
Volt mulai terlihat kenaikan arus yang menunjukkan terjadinya puncak
voltamogram. Pada potensial -0,75 Volt puncak maksimam sudah ditunjukksn pada
voltamogram tersebut. Terdapatnya puncak tersebut mengindikasikan bahwa
terjadi penempelan dan pengendapan logam Fe, Co, dan Ni pada katoda yaitu
substrat stainless steel. Sehingga proses elektrodeposisi logam terner: Fe, Co dan
Ni telah berhasil dilakukan. Reaksi reduksi untuk mengendapkan logam Fe, Co, dan
Ni pada proses elektrodeposisi adalah sebagai berikut:
Ni2+ (aq) + 2e-→ Ni (s) (11)
B. Karakteristik Elektroda Stainless Steel dan Stainless Steel/Fe-Co-Ni
Karakterisasi ini bertujuan untuk mengetahui hasil pada penggunaan
elektroda stainless steel dan stainless steel/Fe-Co-Ni, sehingga dapat ditentukan
perbedaan dan perbandingan diantara kedua elektroda. Karakterisasi elektroda
stainless steel dan stainless steel/Fe-Co-Ni pada penelitian ini dilakukan dengan
menggunakan Voltameter eDAQ Echem secara voltametri linear (Linear Sweep
Voltametry), difraksi sinar-X (XRD) serta SEM-EDX.
1. Karakterisasi Voltametri Linear
Karakterisasi Voltametri Linear dilakukan dengan menggunakan instrument
Voltameter eDAQ Echem dengan laju penyapuan 50 mV/s. Berikut ini hasil uji
karakterisasi voltametri secara linear dapat dilihat pada gambar berikut.
Gambar 9. Karakterisasi Voltamogram Linear (a) Elektroda Stainless Steel dan (b) Elektroda Stainless Steel/Fe-Co-Ni
Gambar 9 menunjukkan hasil karakterisasi voltametri elektroda stainless
steel dan elektroda stainless steel/Fe-Co-Ni secara linear dengan nilai arus (I) dan
pada rentang potensial (E) tertentu. Penentuan secara voltametri linear ini
voltamogram tersebut, terlihat adanya perbedaan bentuk voltamogram yang
dihasilkan. Perbedaan yang mendasar yaitu terlihat pada voltamogram (b) pada
penggunaan elektroda stainless steel/Fe-Co-Ni, mulai muncul kenaikan puncak
pada nilai potensial -0,6 Volt dan pada potensial -0,5 Volt terjadi puncak
maksimum dengan nilai arus sekitar 0,3 mA. Sedangkan pada voltamogram (a)
pada penggunaan elektroda stainless steel tidak terlihat kemunculan puncak pada
gelombang voltamogram, hanya terjadi kenaikan voltamogram pada potensial -0,5
Volt tanpa adanya kemunculan puncak.
Berdasarkan hasil uraian tersebut, dapat disimpulkan bahwa terjadi
perbedaan yang signifikan pada penggunaan elektroda stainless steel dan stainless
steel/Fe-Co-Ni, yakni kemunculan puncak voltamogram. Kemunculan puncak
tersebut mengindikasikan bahwa terdapat perubahan struktur lapisan pada
permukaan elektroda stainless steel/Fe-Co-Ni. Perubahan yang terjadi dapat
disebabkan oleh substrat stainless steel yang telah terlapisi oleh logam Fe, Co, dan
Ni pada saat proses elektrodeposisi. Pada proses elektrodeposisi ini menyebabkan
ion-ion dari logam Fe, Co, dan Ni akan bergerak menuju ke permukaan katoda dan
menangkap elektron dari katoda yaitu substrat stainlesss steel. Ion logam tersebut
akan tereduksi menjadi logam dan mengendap di katoda, sehingga substrat stainless
steel telah terdeposisi oleh logam Fe, Co, dan Ni serta membentuk suatu lapisan
logam. Hal ini dapat terlihat pada perbedaan puncak kedua voltamogram yang
disajikan pada Gambar 9.
2. Karakterisasi XRD
kerja XRD (X-Ray Diffraction) dengan memanfaatkan radiasi gelombang
elektromagnetik yaitu sinar-X dan diperoleh data karakterisasi berupa
difraktogram. Pola difraktogram yang dihasilkan berupa deretan puncak-puncak
difraksi dengan intensitas dan pada rentang sudut 2θ tertentu. Besarnya intensitas
tergantung pada jumlah atom yang berada dalam material tersebut. Pola difraksi
sinar-X elektroda stainless steel dan stainless steel/Fe-Co-Ni hasil penelitian dapat
dilihat pada Gambar 10.
Gambar 10. Hasil Karakterisasi XRD Elektroda Stainless Steel dan Elektroda Stainless Steel/Fe-Co-Ni
Gambar 10 menunjukkan hasil elektroda stainless steel dan elektroda
stainless steel/Fe-Co-Ni pada rentang 2θ yaitu 0° sampai dengan 80°. Grafik
tersebut menunjukkan hubungan antara intensitas (I) puncak difraksi dan sudut
difraksi (2θ). Hasil karakterisasi XRD yang disajikan pada Gambar 9 dilakukan
analisa secara kualitatif dengan membandingkan kedua gambar tersebut. Hasil
grafik dari keduanya memiliki karakteristik yang berbeda. Hal tersebut ditandai
dengan adanya perbedaan puncak-puncak difraktogram. Pada grafik elektroda
stainless steel muncul puncak-puncak dengan intensitas ketajaman puncak yang
tinggi, diantaranya pada sudut 2θ: 28,43º; 43,97º; dan 63,97º. Sedangkan pada
elektroda stainless steel/Fe-Co-Ni muncul lebih banyak puncak-puncak pada sudut
2θ: 7,81º; 28,64º; 44,34º; dan 46,51º. Perbedaan puncak yang terlihat dari kedua
grafik tersebut mengindikasikan bahwa logam Fe, Co, dan Ni sudah terdeposisi
pada substrat stainless steel dengan kata lain sudah terjadi proses pengendapan pada
katoda melalui metode elektrodeposisi dengan melihat hasil perbedaan puncak
difraktogram stainless steel dan stainless steel/Fe-Co-Ni yang disajikan pada
Gambar 10. Terjadinya proses pengendapan pada katoda yaitu substrat stainless
steel disebabkan oleh adanya pemindahan ion-ion bermuatan listrik dari anoda
dengan perantara larutan elektrolit. Proses tersebut terjadi secara terus menerus
pada tegangan konstan hingga akhirnya logam mengendap dan menempel kuat
membentuk lapisan permukaan katoda.
3. Karakterisasi SEM-EDX
Karakterisasi SEM-EDX ini digunakan untuk mengetahui ukuran
partikel-partikel hasil sintesis berupa gambar serta komposisi dan kadar yang terkandung
pada sampel yang diujikan.Elektroda stainless steel yang digunakan dalam
penelitian ini adalah tipe S-430 dengan ketebalan 1,2 mm. Data penelitian
karakterisasi stainless steel menggunakan SEM-EDX diperoleh dari penelitian
Isana et. al., 2015: 175. Hasil karakterisasi ini diuji komposisinya dan kadar Fe, Co,
dan Ni yang terkandung dalam stainless steel masing-masing sebesar 80,11 %b,
0,05 %b dan untuk logam Ni tidak terdeteksi. Berikut ini hasil karakterisasi
Gambar 11. Hasil Karakterisasi SEM-EDX Elektroda Stainless Steel Sumber: Isana dkk., 2015: 175
Karakterisasi elektroda stainless steel/Fe-Co-Ni diperoleh dari hasil
penelitian dan dilakukan karakterisasi menggunakan SEM-EDX. Hasil
karakterisasi SEM-EDX dari elektroda stainless steel/Fe-Co-Ni dapat dilihat pada
Gambar 12
Gambar 12. Hasil Karakterisasi SEM-EDX Elektroda Stainless Steel/Fe-Co-Ni
Gambar 11 dan Gambar 12 merupakan hasil karakterisasi menggunakan
SEM yang memperlihatkan struktur morfologi sebelum dan sesudah pelapisan
logam Fe, Co, dan Ni dengan perbesaran 5000 kali. Pada Gambar 11, struktur
morfologi stainless steel sebelum pelapisan terlihat memanjang dan kasar,
sedangkan struktur morfologi stainless steel yang telah dilapisi oleh logam Fe, Co,
dan Ni terlihat lebih rapat serta terdapat bercak-bercak yang lebih merata.
Permukaan yang lebih rata ini memberikan pengaruh baik terhadap aktivitas
katalitik elektroda stainless steel/Fe-Co-Ni. Kadar logam yang terkandung dalam
Fe