i
PRODUKSI HIDROGEN DARI PEMECAHAN MOLEKUL H2O DALAM MEDIA PARE DENGAN ELEKTRODA STAINLESS STEEL/Fe-Co-Ni
SKRIPSI
Diajukan kepada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta untuk Memenuhi Sebagian
Persyaratan Guna Memperoleh Gelar Sarjana Sains
Oleh: Lathifa Hidayati NIM 13307141007
PROGRAM STUDI KIMIA JURUSAN PENDIDIKAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA
ii
PRODUKSI HDROGEN DARI PEMECAHAN MOLEKUL H2O DALAM
MEDIA PARE DENGAN ELEKTODA STAINLESS STEAL/Fe-Co-Ni Oleh:
Lathifa Hdayati NIM. 13307141007
ABSTRAK
Penelitian ini bertujuan untuk mengetahui efisiensi produksi gas H2 pada
media pare dengan elektroda stainless steel dan stainless steel/Fe-Co-Ni pada proses elektrolisis air serta mengetahui hasil optimum produksi gas H2 dalam
media pare.
Subjek penelitian ini adalah elektroda stainless steel dan stainless steel/Fe-Co-Ni. Objek penilitian ini adalah efisiensi produksi gas hidrogen hasil elektrolisis dalam media pare dengan elektroda stainless steel dan stainless steel/Fe-Co-Ni. Stainless steel/Fe-Co-Ni dibuat dari logam stainless steel dengan metode elektrodeposisi yang dilakukan dengan menggunakan eDAQ EChem dengan laju 50 mV/s selama 10 menit. Logam sebelum dan sesudah elektrodeposisi dikarakterisasi menggunakan Voltametri Liniear, SEM-EDX (Scanning Electron Microscope) dan XRD (X-Ray Diffraction). Elektroda stainless steel dan stainless steel /Fe-Co-Ni digunakan sebagai elektroda kerja dalam elektrolisis air. Proses elektrolisis air menggunakan elektrolit NaHCO3
sebanyak 0,5% dan penambahan media pare dengan variasi 0,1% - 1%. Elektrolisis dari setiap semple secara voltametri siklik menggunakan eDAQ EChem dengan laju 50 mV/s.
Hasil penelitian menunjukkan bahwa produksi hidrogen optimum pada elektrolisis air dengan elektroda stainless steel yaitu pada sampel tanpa penambahan media pare dan dengan elektroda stainless steel/Fe-Co-Ni yaitu pada penambahan 0,7% media pare. Adanya media pare mengakibat covering pada permukaan elektroda. Covering optimum pada elektrolisis air dengan elektroda stainless steel terjadi pada penambahan 0,8% media pare dan dengan elektroda stainless steel/Fe-Co-Ni terjadi pada penambahan 0,2% media pare. Produksi hidrogen dengan elektroda stainless steel/Fe-Co-Ni pada elektrolisis air dengan penambahan media pare lebih efisien daripada elektroda stainless steel.
iii
HYDROGEN PRODUCTION FROM ELECTROLYSIS OF H2O USE MEDIA OF BITTER MELON WITH STAINLESS STEAL/Fe-Co-Ni
ELECTRODE Bitter Melon using stainless steel and stainless steel/Fe-Co-Ni electrodes on water electrolysis process and also to obtain the optimum condition of H2 production on
water electrolysis process.
The subjects of this study are Stainless Steel and Stainless Steel/Fe-Co-Ni electrodes. The object of this study is the efficiency of production hydrogen gas on media of Bitter Melon using stainless steel and stainless steel/Fe-Co-Ni electrodes. Stainless steel/Fe-Co-Ni is made of stainless steel which uses electrodeposition method by using eDAQ Echem instrument at a rate of 50 mV/s for 10 minutes. The metals on before and after electrodeposition is characterized using Liniear Voltametry, SEM-EDX (Scanning Electron Microscope) and XRD (X-Ray Diffraction). Stainless steel and stainless steel/Fe-Co-Ni electrodes used as working electrodes on water electrolysis. The process of water electrolysis used electrolyte NaHCO3 for 0.5% and additional amount of Bitter Melon added in
variation 0.1% - 1%. Each of the sample is electrolyzed in a cyclic voltammetric by using eDAQ Echem instrument at a rate of 50 mV / s.
The study results showed that optimum hydrogen production on water electrolysis using stainless steel electrode was without of Bitter Melon added, while using stainless steel/Fe-Co-Ni electrode was optimum when 0.7% of Bitter Melon was add. The Bitter Melon creates a covering on the surface of electrode. The optimum covering of water electrolysis using stainless steel electrodes formed when 0.8% of Bitter Melon was added while using stainless steel/Fe-Co-Ni electrodes it formed when 0.2% of Bitter Melon was added. Production of hydrogen using stainless steel/Fe-Co-Ni electrodes on water electrolysis when additional Bitter Melon was more efficient than using stainless steel electrodes. Keywords: electrodeposition, water electrolysis, stainless steel, bitter melon,
vi
HALAMAN PERNYATAAN
Yang bertanda tangan di bawah ini, saya: Nama : Lathifa Hidayati
NIM : 13307141007 Prodi : Kimia
Fakultas : MIPA
Judul : Produksi Hidrogen dari Pemecahan Molekul H2O dalam Media
Pare dengan Elektroda Stainless Steel/Fe-Co-Ni
menyatakan bahwa penelitian kimia ini adalah hasil dari pekerjaan saya sendiri. Sepanjang pengetahuan saya tidak terdapat karya atau pendapat yang ditulis atau diterbitkan orang lain, kecuali sebagai acuan atau kutipan dengan mengikuti tata penulisan karya ilmiah yang lazim. Tanda tangan dosen penguji yang tertera dalam halaman pengesahan adalah asli. Jika tidak asli, saya siap menerima sanksi ditunda pada yudisium periode berikutnya.
Yogyakarta, 13 Juni 2017 Yang menyatakan,
vii MOTTO
Boleh Jadi Kamu Membenci Sesuatu, Padahal Ia Amat Baik
Bagi Kamu. Dan Boleh Jadi Kamu Mencintai Sesuatu,
Padahal Ia Amat Buruk Bagi Kamu. Allah Maha
Mengetahui Sedangkan Kamu Tidak Mengetahui”
(Al-Baqarah: 216)
Keep Thinking The Out Of The Box And Keep Executing The
Indside Of The Box
Jadi Diri Sendiri, Cari Jati Diri, dan Dapatkan Hidup Yang
Mandiri
The Greatest Secret Of Success Is There Is No Big Secret,
Whoever You Are, You Will Be Success If You Endeavor In
viii
HALAMAN PERSEMBAHAN
Ku persembahkan skripsi kepada :
1. Allah SWT yang telah memberikan limpahan berkah dan nikmat yang luar biasa.
2. Keluarga tercinta Bapak Sunaryo, Ibu Poniyem, Kakak Ikhsan Ari Fauzi dan Adik Nina Alfiani Nur Hikmah yang telah memberikan kasih sayang, dukungan, semangat, nasehat dan doa yang tiada henti-hentinya.
3. Ratih Widyandari, Nur Azizah Rahmawati, Abdurrahman Affief dan Wisnu Sutopo rekan satu penelitian yang selalu semangat dan kompak. 4. Teman-teman Kimia B 2013 khususnya Ratih, Enny, Karlin, Yenni, dan
Mei yang telah memberikan semangat dan dukungan tiada henti.
5. Sahabat-sahabat tercinta yang senantiasa mendengarkan keluh kesah, memberikan saran, masukan, semangat dan dukungan.
6. Teman-teman yang tidak lupa selalu memberikan semangat, dukungan serta doa.
ix
KATA PENGANTAR
Segala puji bagi Allah Yang Maha Pengasih lagi Maha Penyayang yang telah melimpahkan rahmat dan hidayah-Nya, sehingga penulis dapat menyelesaikan Tugas Akhir Skripsi (TAS) dengan judul “Produksi Hidrogen dari Pemecahan Molekul H2O dalam Media Pare dengan Elektroda Stainless
Steel/Fe-Co-Ni,” salawat serta salam tak lupa tercurahkan kepada Nabi Muhammad yang
kita nantikan sya’atnya di yaumil akhir kelak.
Penulis menyadari dalam menyelesaikan skripsi ini tidak terlepas dari bantuan, bimbingan, arahan, motivasi dari berbagai pihak. Oleh sebab itu, melalui kesempatan ini penulis mengucapkan terima kasih kepada:
1. Dr. Hartono selaku Dekan FMIPA Universitas Negeri Yogyakarta yang telah memberikan ijin penelitian.
2. Drs. Jaslin Ikhsan, M. App. Sc., Ph.D selaku Ketua Jurusan Pendidikan Kimia UNY dan Ketua Program Studi Kimia UNY.
3. Drs. Heru Pratomo AL, M.Si dan Dr. Isana Supiah YL, M.Si selaku pembimbing skripsi yang telah memberikan bimbingan, ilmu, saran dan masukannya bagi penulis dalam menyelesaikan tugas akhir skripsi.
4. Sekertaris, penguji utama dan penguji pendamping yang telah memberikan saran, masukan dan nasehat bagi penulis dalam menyelesaikan tugas akhir skripsi.
x
6. Keluarga dan sahabat yang selalu mendoakan, mendukung, memberikan semangat dan motivasi dalam melaksanakan penelitian serta menyelesaikan Tugas Akhir Skripsi.
7. Seluruh pihak yang tidak dapat penulis sebutkan satu per satu yang telah membantu penulis dalam menyelesaikan Tugas Akhir Skripsi ini.
Penulis mengharapkan kritik dan saran yang membangun demi kesempurnaan Tugas Akhir Skripsi ini. Semoga Tugas Akhir Skripsi ini dapat digunakan sebagaimana mestinya dan bermanfaat bagi pembaca sekalian.
Yogyakarta, 13 Juni 2017
xi DAFTAR ISI
ntents
ABSTRAK ... ii
ABSTRACT ... iii
HALAMAN PERSETUJUAN ... Error! Bookmark not defined. HALAMAN PENGESAHAN ... Error! Bookmark not defined. HALAMAN PERNYATAAN ... vi
BAB II KAJIAN PUSTAKA ... 9
A. Deskripsi Teori ... 9
6. Pare (Momordica charantia L.) ... 20
7. SEM EDX ... 22
8. XRD (Difraksi Sinar X) ... 24
B. Penelitian Yang Relevan ... 25
C. Kerangka Berpikir ... 27
BAB III METODE PENELITIAN ... 29
A. Subjek dan Objek Penelitian ... 29
B. Variabel penelitian ... 29
C. Alat dan Bahan Penelitian ... 29
D. Prosedur Penelitian ... 30
E. Teknik Pengambilan Data ... 33
BAB IV HASIL DAN PEMBAHASAN ... 34
A. Elektrodeposisi Elektroda Stainless Steel/Fe-Co-Ni ... 34
B. Karakterisasi ... 37
xii
1. Elektrolisis H2O dengan Elektroda Stainless Steel ... 42
2. Elektrolisis H2O dengan Elektroda Stainless Steel/Fe-Co-Ni ... 45
3. Perbandingan Kondisi Optimum ... 47
BAB IV KESIMPULAN DAN SARAN... 50
A. Kesimpulan ... 50
B. Saran ... 50
DAFTAR PUSTAKA ... 52
xiii
DAFTAR TABEL
Tabel 1. Sifat Hidrogen ... 9 Tabel 2. Gizi yang Terkandung dalam 100 gram Buah Pare ... 21 Tabel 3. Konsentrasi Media Pare dalam Larutan NaHCO3 0,5%... 32
Tabel 4. Kadar Logam (%) dalam Stainless Steel dan Stainless Steel/Fe-Co-Ni.. 40 Tabel 5. Kondisi Optimum Proses Elektrolisis dengan Elektroda Stainless Steel
dan Stainless Steel/Fe-Co-Ni ... 47 Tabel 6. Hasil Elektrolisis Air dengan Elektroda Stainless Steel dalam Media
Pare ... 62 Tabel 7. Hasil Elektrolisis Air dengan Elektroda Stainless Steel/Fe-Co-Ni dalam
xiv
DAFTAR GAMBAR
Gambar 1. Sel Elektrolisis Pembentukan Gas Hidrogen dan Gas Oksigen ... 12
Gambar 2. Pare Putih ... 20
Gambar 3. Votamogram Linier Metode Elektrodeposisi ... 35
Gambar 4. Voltamogram Liniear Sebelum Pelapisan (Stainless Steel) ... 37
Gambar 5. Voltamogram Liniear Sesudah Pelapisan (Stainless Steel /Fe-Co-Ni) 37 Gambar 6. Grafik Hubungan 2θ dengan Intesitas dari Karakterisasi XRD ... 38
Gambar 7. Hasil Karakterisasi Stainless Steel dengan SEM EDX ... 39
Gambar 8. Hasil Karakterisasi Stainless Steel/Fe-Co-Ni dengan SEM EDX ... 39
Gambar 9. Grafik Efisiensi Produksi dan Overpotensial Hasil Elektrolisis dengan Elektroda Stainless Steel ... 43
Gambar 10. Grafik Efisiensi Produksi dan Overpotensial Hasil Elektrolisis dengan Elektroda Stainless Steel/Fe-Co-Ni ... 45
Gambar 11. Voltamogram Siklik Hasil Elektrolisis Air dengan Elektroda Stainless Steel dalam Media Pare Sebanyak (a) 0%; (b) 0,1%; (c) 0,2%; (d) 0,3%; (e) 0,4%; (f) 0,5%; (g) 0,6%; (h) 0,7%; (i) 0,8%; (j) 0,9% dan (k) 1%. ... 59
xv
DAFTAR LAMPIRAN
Lampiran 1. Voltamogram Hasil Elektrolisis dengan Elektroda Stainless Steel
dalam Media Pare ... 58
Lampiran 2. Voltamogram Hasil Elektrolisis dengan Elektroda Stainless Steel/ Fe-Co-Ni dalam Media Pare ... 60
Lampiran 3. Hasil Potensial Puncak di Katoda, Arus Puncak di Katoda, Efisiensi dan Overpotensial dari Elektrolisis Air dalam Media Pare ... 62
Lampiran 4. Karakterisasi Hasil XRD ... 63
Lampiran 5. Karakterisasi Hasil SEM-EDX ... 65
Lampiran 6. Diagram Alir Prosedur Penelitian... 67
Lampiran 7. Diagram Alir Proses Elektrodeposis... 68
1
BAB I
PENDAHULUAN
A. Latar Belakang
Di jaman modern saat ini, penggunaan energi sangat diandalkan untuk melakukan aktivitas sehari-hari. Segala aktivitas dapat dilakukan dengan lebih mudah dengan adanya energi, seperti energi untuk bahan bakar motor sehingga kita dapat mencapai tujuan dengan lebih cepat. Energi dapat berasal dari batubara, gas alam ataupun minyak bumi yang disebut sebagai energi primer. Energi tersebut merupakan energi yang tak terbarukan atau tidak dapat diperbarui.
Di Indonesia penggunaan energi yang berasal dari gas alam ataupun minyak bumi semakin meningkat setiap tahunnya. Peningkatan penggunaan energi dipengaruhi oleh meningkatnya jumlah penduduk serta pertumbuhan ekonomi. Penduduk di Indonesia mencapai 206 juta jiwa pada tahun 2000 dan menjadi lebih dari 238 juta jiwa pada tahun 2010. Pertumbuhan penduduk dalam kurun waktu tahun 2000-2010 tersebut rata-rata sebesar 1,5% per tahun. Tahun 2010-2015 penduduk Indonesia diproyeksikan tumbuh 1,19% dan mencapai 252 juta jiwa ditahun 2014 Boedoyo, et al, 2016: 11. Pertumbuhan ekonomi juga mempunyai peran serta dalam peningkatan penggunaan energi. Semakin banyaknya industri di Indonesia menyebabkan makin banyaknya permintaan akan kebutuhan energi.
2
diperkirakan akan habis dalam 37 tahun untuk gas bumi dan 70 tahun untuk batubara Boedoyo, et al, 2016: 17.
Tahun 2014 produksi minyak bumi mencapai 288 juta barel dan diperkirakan terus menurun menjadi 52 juta barel tahun 2050. Kebutuhan minyak bumi akan terus meningkat sejalan dengan peningkatan kebutuhan bahan bakar minyak (BBM). Kebutuhan minyak bumi diperkirakan akan meningkat 3 kali lipat dari 300 juta barel pada tahun 2014 menjadi 967 juta barel pada tahun 2050 Boedoyo, et al, 2016: 44. Hal inilah yang menyebabkan subsidi energi di
Indonesia makin meningkat. Kebutuhan energi makin meningkat sedangkan persediaan minyak bumi semakin menurun menyebabkan pemerintah harus melakukan impor minyak bumi dari negara lain.
3
bakar yang ramah lingkungan. Selain itu, diharapkan dapat berfungsi sebagai energi pengganti sehingga gas alam dan minyak bumi tidak habis.
Gas hidrogen dapat diproduksi secara biologi maupun kimia tergantung dari sumber atau bahan baku untuk menghasilkan gas hidrogen. Gas hidrogen dapat diproduksi secara kimia maupun biologi, secara kimia dapat melalui elektrolisis maupun Steam Reforrming sedangkan secara biologi dengan memanfaatkan mikroorganisme ataupun enzim (Siregar, 2010). Secara biologi produksi hidrogen dapat dilakukan dari biomassa, namun mempunyai kelemahan yaitu hasil samping berupa tar (karbon cair), char (arang), N2, CO, CO2 ataupun CH4. Kelemahan lain
produksi gas hidrogen secara biologi adalah ketergantungan terhadap organisme atau enzim dalam proses metabolisme untuk menghasilkan gas. Secara kimia produksi gas hidrogen dapat dilakukan dengan metode Steam Reforrming dari metana, namun terdapat hasil samping seperti CO atau CO2. Gas hidrogen juga
dapat diproduksi secara kimia dengan metode elektrolisis dari air (Mahreni & Adi Ilcham, 2011). Molekul air terdiri dari dua atom hidrogen dan satu atom oksigen. Karena ketersediaan air di bumi sangat melimpah, sehingga sangat efektif memproduksi hidrogen dari molekul air. Salah satu metode yang dapat digunakan untuk memperoleh hidrogen dari molekul air adalah metode elektrolisis. Menurut Chang (2005: 219), elektrolisis merupakan proses menggunakan energi listrik agar reaksi kimia nonspontan dapat terjadi.
4
didalam air agar tidak mudah rusak. Logam yang mengalami korosi dapat menurunkan hasil elektrolisis jika terus digunakan. Logam stainless steel merupakan salah satu paduan logam yang tidak mudah mengalami korosi. Akan tetapi logam stainless steel kurang efektif digunakan dalam elektrolisis jika dibandingkan logam platina yang merupakan logam mulia. Oleh karena itu, diperlukan perlakuan tambahan agar dapat meningkatkan keefektifan logam stainless steel dalam proses elektrolisis air. Berdasarkan hasil penelitian yang telah dilakukan oleh Isana SYL, et al, pada tahun 2012, logam stainless steel yang dicoating dengan logam yang lebih bersifat katalitik yaitu Fe, Co, dan Ni dapat meningkatkan produksi gas hidrogen pada proses elektrolisis air.
Laju reaksi dalam proses elektrolisis dapat dipercepat dengan adanya larutan elektrolit. Larutan elektrolit berfungsi menghantarkan aliran listrik sehingga ion-ion dapat bergerak menuju elektroda. Larutan elektrolit merupakan gabungan antara air dan elektrolit. Elektrolit merupakan suatu zat yang dapat teruai menjadi ion-ionnya dalam pelarut. Elektrolit berfungsi sebagai katalis yang dapat mempercepat produksi gas hidrogen dalam metode elektrolisis air. Adanya elektrolit akan meningkatkan konduktivitas, ion-ion dalam larutan elektrolit akan bergerak menuju elektroda sehingga laju reaksi akan makin cepat. Salah satu elektrolit yang dapat digunakan untuk menghasilkan hidrogen pada elektrolisis air adalah elektrolit NaHCO3. Penggunaan elektrolit NaHCO3 dalam proses
5
Besarnya konsumsi energi dalam proses elektrolisis mengakibatkan produksi hidrogen menjadi tidak ekonomis. Oleh karena itu, diperlukan perlakuan tambahan untuk meningkatkan produksi gas hidrogen ataupun menurunkan energi yang diperlukan agar proses produksi hidrogen menjadi lebih efisien. Selain dilakukan proses coating pada logam stainless steel yang digunakan sebagai elektroda, dapat pula dilakukan penambahan media pada larutan elektrolit agar dapat meningkatkan produksi gas hidrogen dalam proses elektrolisis air. Media yang digunakan dalam penilitian ini adalah media Pare. Pare merupakan buah yang sangat mudah didapatkan dan harganya sangat murah. Senyawa-senyawa organik dapat mengalami reaksi melalui mekanisme transfer muatan di permukaan elektroda. Menurut Conway & Monzata dalam Riyanto (2013: 70), bahwa senyawa organik banyak mengalami reaksi di permukaan elektroda bahan padat. Logam dan oksidanya mempunyai sifat alami sebagai katalis aktif. Menurut jurnal penelitian oleh Maysaroh dan Isana SYL pada tahun 2016, menyatakan bahwa penambahan 1 gram tepung maizena dapat memberikan efisiensi energi pada elektrolisis air dengan elektroda stainless steel. Seperti halnya tepung meizena, penggunaan media pare pada larutan elektrolit diharapkan dapat meningkatkan efisiensi produksi gas hidrogen maupun efisisnsi energi pada proses elektrolisis air.
B. Identifikasi Masalah
6
1. Menipisnya sumber energi dikhawatikan tidak mencukupi kebutuhan di masa mendatang.
2. Pengembangan produksi energi alternatif yang ramah lingkungan sebagai pengganti energi dari sumber daya alam.
3. Metode produksi gas hidrogen yang beragam.
4. Metode elektrolisis untuk produksi hidrogen memerlukan energi yang cukup besar.
5. Beragamnya elektroda yang digunakan dalam metode elektrolisis. 6. Pemilihan media yang digunakan dalam metode elektrolisis. 7. Efisiensi produksi gas hidrogen.
C. Pembatasan Masalah
Berdasarkan identifikasi masalah di atas, maka diberikan pembatasan masalah guna keefektifan penilitian sebagai berikut:
1. Produksi gas hidrogen sebagai energi alternatif yang ramah lingkungan.
2. Jenis metode yang digunakan dalam produksi gas hidrogen adalah metode elektrolisis.
3. Jenis elektroda yang digunakan dalam metode elektrolisis adalah elektroda stainless steel/Fe-Co-Ni dan stainless steel.
4. Elektrolit yang digunakan dalam proses elektrolisis yaitu NaHCO3 sebanyak
0,5% dalam 1 liter larutan.
7
6. Efisiensi produksi gas hidrogen ditinjau dari efisiensi produk dan efisiensi energi yang diperoleh dari perbandingan elektrolisis tanpa media dengan elektrolisis menggunakan media pare.
D. Rumusan Masalah
Berdasarkan masalah di atas, maka dapat dirumuskan permasalahan yang akan ditelieti yaitu sebagai berikut:
1. Bagaimanakah efisiensi produksi gas hidrogen (H2) pada media pare dengan
elektroda Stainless Steel?
2. Bagaimanakah efisiensi produksi gas hidrogen (H2) pada media pare dengan
elektroda Stainless Steel/ Fe-Co-Ni?
3. Bagaimanakah kondisi optimum produksi gas hidrogen (H2) dalam media pare
dengan elektroda Stainless Steel dan elektroda Stainless Steel/ Fe-Co-Ni?
E. Tujuan Penelitian
1. Untuk mengetahui efisiensi produksi gas hidrogen (H2) pada media pare
dengan elektroda Stainless Steel.
2. Untuk mengetahui efisiensi produksi gas hidrogen (H2) pada media pare
dengan elektroda Stainless Steel/ Fe-Co-Ni.
3. Untuk mengetahui hasil optimum produksi gas hidrogen (H2) dalam media
pare dengan elektroda Stainless Steel dan elektroda Stainless Steel/ Fe-Co-Ni.
F. Manfaat Penelitian
8
2. Memberikan informasi mengenai produksi gas hidrogen (H2) dengan metode
elektrolisis dalam media pare.
3. Memberikan informasi mengenai kondisi optimum produksi gas hidrogen (H2)
9 satu. Ini berarti di dalam pusat atom hidrogen terdapat satu partikel yang disebut proton. Proton memiliki muatan positif, sedangkan partikel yang bermuatan negatif disebut elektron. Massa atom hidrogen yaitu 1,00794 amu. Inti atom hidrogen dikelilingi satu elektron. Inti atom hidrogen membutuhkan dua elektron yang mengelilinginya agar stabil (Fardon, 2000: 4-5). Pada suhu dan tekanan standart, hidrogen tidak berbau, tidak berasa dan tidak berwarna. Hidrogen memiliki titik didih pada -252,760C (20,39 K) dan memiliki titik leleh pada -259,190C (13,96 K) (Holleman, 1995: 240). Sifat lain dari hidrogen dapat dilihat pada Tabel 1.
Energi ionisasi 1310 kJ/mol
Titik kritis 33 K
Kerapatan 0,00009 g/cm3
Jari-jari atom 0,037 nm
(Sumber: Putra, 2010)
10
hidrogen 14 kali lebih ringan daripada udara, massa 1 hidrogen adalah 0,09 gram sedangkan massa udara adalah 1,2 gram.
Gas hidrogen dapat digunakan sebagai sumber energi seperti energi dari minyak bumi atau gas alam. Kelebihan energi dari gas hidrogen yaitu dapat diperbarui dan ramah lingkungan. Hasil samping dari pembakaran gas hidrogen berupa upa air sehingga tidak menimbulkan polusi, efek rumah kaca dan hujan asam (Dewi, 2011). Gas hidrogen dapat diubah menjadi bahan bakar dengan sistem fuel cell dengan hasil berupa panas dan air. Fuel cell merupakan suatu sistem elektrokimia yang mengubah energi kimia dari hidrogen dan oksigen langsung menjadi energi listrik (Hasan, 2007). Gas hidrogen hasil dari generator tipe dry cell dapat diterapkan pada mesin sepeda motor. Pemanfaatan gas hidrogen hasil elektrolisis H2O dari generator tipe dry cell sebagai suplemen
BBM. Penambahan gas hidrogen dapat menurunkan konsumsi bahan bakar utama dan menurunkan emisi CO dan hidrokarbon (Rahadi, et al., 2014).
2. Elektrolisis
Reaksi redoks dalam sel volta atau sel galvani berlangsung seraca spontan,
energi kimia diubah menjadi energi listrik. Elektrolisis merupakan reaksi yang
tidak dapat berlangsung secara spontan, diperlukan tegangan luar agar reaksi
11
arus listrik ke dalam suatu larutan elektrolit, sehingga akan terjadi reaksi redoks
dalam sel elektrolisis. Menurut Isana SYL, et al (2015) proses elektrolisis sangat bergantung pada jenis elektrolit, jenis elektroda, arus, voltase dan waktu yang digunakan. Variasi arus dan penambahan katalis dapat mempengaruhi produksi gas hidrogen pada proses elektrolisis air. Makin besar arus yang diberikan maka produksi gas hidrogen akan makin besar pula. Menurut Hukum Faraday pertama bahwa massa zat yang terbentuk pada masing-masing elektroda sebanding dengan
kuat arus/arus listrik yang mengalir pada suatu elektrolisis (Riyanto, 2013: 31). Arus listrik yang digunakan dalam elektrolisis bersumber dari luar yang berfungsi untuk menggerakkan reaksi kimia nonspontan. Arus listrik tersebut dilewatkan pada dua elektroda dalam suatu larutan elektrolit. Elektroda yang bermuatan positif disebut anoda dan elektroda yang bermuatan negarif disebut katoda. Kedua elektroda akan saling berhubungan sehingga dapat menguraikan molekul air menjadi unsur-unsur pembentuknya yaitu H2 dan O2. Pada elektroda,
gas hidrogen berkumpul di kutub negatif atau katoda dan gas oksigen berkumpul di kutub positif atau anoda. Elektroda seperti platina yang hanya mentransfer elektron dari larutan, disebut elektron inert. Elektroda reaktif adalah elektroda yang secara kimia mengalami reaksi elektroda selama elektrolisis (Dogra, 1998 : 492).
Proses elektrolisis untuk menghasilkan gas H2 dan O2 murni dengan
memanfaatkan energi listrik pada sistem disebut sebagai elektrolisis air. Gas yang dihasilkan dari proses elektrolisis air disebut gas HHO atau oxyhydrogen atau
12
adalah pemecahan unsur air (H2O) dengan mengalirkan arus listrik DC untuk penguraikan air menjadi gas HHO (Brown’s gas). Karena atom dari air kehilangan elektronnya sedangkan atom oksigen mendapatkan elektron, dengan demikian atom-atom oksigen bermuatan negatif (O-) dan atom hidrogen menjadi positif (H+). Atom-atom hidrogen ini bergabung menjadi H2 melalui katoda membentuk
gelembung-gelembung gas. Hal tersebut juga terjadi pada ion O- yang kemudian berkumpul menjadi gas O2.
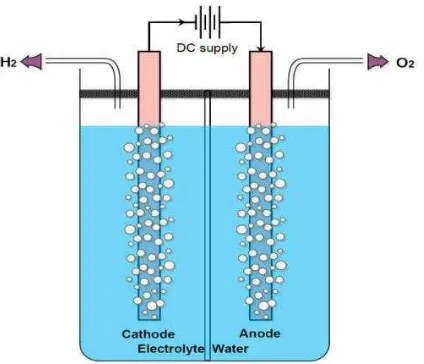
Gambar 1. Sel Elektrolisis Pembentukan Gas Hidrogen dan Gas Oksigen (Rashid, et al, 2015)
Reaksi yang terjadi pada elektroda dalam proses elektrolisis air adalah: Katoda : 2 H2O (l) + 2e- 2OH- (aq) + H2 (g) (1)
Anoda : 4OH- (aq) O2 (g) + 2 H2O (l) + 4e- (2)
(Wiryawan, et al, 2015)
Dua molekul air bereaksi dengan menangkap dua elektron di katoda, kemudian tereduksi menjadi gas hidrogen (H2) dan ion hidroksida (OH-). Ion
13
H+ serta mengalirkan electron ke katoda. Ion H+ dan ion OH- mengalami netralisasi sehingga terbentuk kembali beberapa molekul air. (Spiegel, Coollen dalam Sebastian & Sitorus, 2013). Elektrolisis air secara teoritis akan diuraikan menjadi gas H2 dan O2, menghasilkan 2 mol hidrogen dan 1 mol oksigen
(Sopandi, et al, 2015).Gas hidrogen (H2) tidak terbentuk begitu saja di katoda.
Molekul air yang berada di dekat katoda akan menerima elektron dari katoda dan terurai menjadi ion hidrogen (H+) dan ion hidroksida (OH-). Ion hidrogen (H+) bebas akan menangkan electron dari katoda dan membentuk atom hidrogen netral. Atom-atom hidrogen yang terbentuk akan berkumpul dan berikatan membentuk gas hidrogen (H2) berupa gelembung dan naik ke permukaan (Tjatur, et al,
2009). Reaksi yang terjadi sebagai berikut:
H2O OH- + H+ (3)
H+ + e H (4)
H + H H2 (5)
14
2015). Elektrolit akan terion dalam larutan dan dapat menghantarkan arus listrik dengan mudah sehingga hambatan dalam larutan relatif lebih rendah jadi daya yang dibutuhkan juga rendah (Sopandi, et al, 2015). Menurut Marlina (2016), ketika elektrolit NaHCO3 bereaksi dengan air maka senyawa tersebut akan
terionisasi:
NaHCO3(s) + H2O(l)→ Na+ (aq) + H2O (l) + HCO3- (aq) (6)
Penambahan katalis berupa larutan elektrolit dapat menghantarkan arus listrik karena elektrolit akan terion dalam larutan, namun terlalu banyak penambahan katalis dapat menyebabkan larutan menjadi jenuh sehingga ion-ion sulit untuk bergerak. Daya hantar akan semakin rendah karena ion-ion sulit bergerak. Menurut Andono & Gamayel dalam Sopandi, et al (2015), kejenuhan larutan akan menimbulkan efek yaitu gerakan kation dan anion menjadi terhambat. Sehingga anion dan kation dalam larutan elektrolit juga semakin sulit untuk bergerak ketika menghantarkan arus listrik. Karena jarak antara partikel terlalu dekat, maka daya hantarnya akan menjadi rendah dan reaksi elektrolisis yang terjadi tidak akan optimal dan laju produksi gas HHO cenderung menurun. 3. Elektroda
15
bermatan positif, ion-ion bermuatan negatif mengalir ke elektroda ini untuk dioksidasi. Katoda merupakan tempat berlangsungnya reaksi reduksi dan anoda merupakan tempat berlangsungnya reaksi oksidasi. Pada sel elektrolisis, elektron mengalir dari aki/baterai eksternal, masuk melalui katoda dan keluar lewat anoda. Apabila arus listrik diberikan ke larutan elektrolit maka ion yang tereduksi akan menuju ke katoda dan ion yang teroksidasi akan menuju ke anoda. Pada elektrolisi air, molekul air akan mengikat elektron dan terpecah menjadi gas hidrogen (H2)
dan anion OH-. Anion OH- akan menuju anoda dan terpecah menjadi gas oksigen. Reaksi reduksi terjadi di katoda, ion H+ yang tereduksi pada katoda akan membentuk gas hidrogen dan ion OH- akan menuju anoda dan teroksidasi. Jika elektrolit yang digunakan adalah elektrolit basa maka akan terjadi reaksi basa.
Elektroda, seperti platinum yang hanya mentranfer elektron ke dan dari larutan disebut elektroda inert. Elektroda reaktif adalah elektroda yang secara kimia mengalami reaksi elektroda. Selama elektrolisis, terjadi reduksi pada katoda dan oksidasi pada anoda. Ada banyak tipe reaksi elektroda, tetapi gambaran umumnya diringkas sebagai berikut
a. Arus listrik yang membawa ion akan dibebaskan pada elektroda
b. Ion negatif yang sulit untuk dibebaskan pada anoda menyebabkan penguraian H2O dan pembentukan O2, H+ dan elektron
c. Ion positif yang sulit dibebaskan pada katoda menyebabkan penguraian H2O
dan pembentukan H2, OH- dan adsorpsi elektron. Dogra, 1990 492
16
meningkatkan aktivitas katalitik dari stainless steel tersebut. Stainless steel merupakan baja paduan yang mengandung sedikitnya 11,5% krom berdasar beratnya. Stainless steel memiliki sifat tidak mudah terkorosi sebagaimana logam baja yang lain. Stainless steel berbeda dari baja biasa dari kandungan kromnya. Stainless steel memiliki persentase jumlah krom yang memadahi sehingga akan membentuk suatu lapisan pasif kromium oksida yang akan mencegah terjadinya korosi lebih lanjut. Stainless steel tidak memerlukan suatu perlindungan logam yang khusus karena lapisan pasif tipis ini akan cepat terbentuk kembali katika mengalami suatu goresan. Peristiwa ini biasa disebut dengan pasivasi, yang dapat dijumpai pula pada logam lain misalnya aluminium dan titanium (Sumarji 2011).
Logam stainless steel yang digunakan sebagai elektroda dilapisi dengan logam Fe, Co dan Ni untuk meningkatkan keefektifitasannya. Menurut Isana SYL, et al (2012), logam stainless steel yang telah dilapisi dengan logam Fe, Co dan Ni memiliki keefektifitasan yang lebih besar dari pada logam stainless steel yang tidak dilapisi dengan logam lain.
4. Elektrodeposisi
17
Elektrodeposisi merupakan proses pengendepan logam pada logam lain (elektroda) melalui proses elektrolisis dengan menggunakan prinsip elektrokimia yaitu dengan menerapkan arus listrik. Menurut Sudagar dalam Budi (2016), proses elektrodeposisi dibagi menjadi dua yaitu elektroplating dan elektrolisis. Proses elektroplating menggunakan elektroda sebagai bahan pelapis, sedangkan proses elektrolisis menggunakan elektrolit sebagai bahan pelapis.
Sistem elektroplating terdiri atas sirkuit luar, elektroda negatif (katoda) yang akan dilapisi, larutan elektrolit, elektroda positif (anoda). Logam M yang akan terdeposisikan akan mengalami reaksi:
M(s) Mn+ (aq) + ne- (7) Logam akan teroksidasi menjadi ion logam dan melepaskan sejumlah elektron. Ion positif dalam larutan elektrolit akan bergerak menuju katoda dan ion bermuatan negatif ke arah anoda. Ion positif yang sampai di katoda yang bermuatan negatif, elektron di katoda akan mereduksi ion positif untuk membentuk logam sehingga atom logam akan tersimpan di katoda tersebut (Riyanto, 2013: 27-29). Persamaan reaksi reduksi yang terjadi:
Mn+ (aq) + ne- M(s) (8)
(Yanlinastuti, et al, 2016)
18
dan akan meningkatkan jumlah ion hidroksil. Keseluruhan reaksinya sebagai berikut:
2H2O + 2e- H2 + 2OH- (9)
M2+ + OH- M(OH)+ (10)
M(OH)+ M(OH)+ads (11)
M(OH)+ads + 2e- M + OH- (12)
19
Menurut Maysarrah (2016), logam mengendap berdasarkan harga potensial yang dimiliki, semakin positif harga potensial suatu logam maka logam tersebut semakin tidak reaktif. Logam yang kurang reaktif artinya sulit melepas elektron sehingga akan memiliki sifat oksidator kuat dan mengalami reaksi reduksi. Hal serupa juga diungkapkan oleh Isana YSL, et al (2012) bahwa logam yang memiliki potensial standart lebih tinggi akan lebih mudah terdeposit. Terdapat dua kompetisi ion logam dalam proses elektrodeposisi untuk membentuk logam biner, logam dengan potensial standart yang lebih positif akan terdeposisi terlebih dahulu. Contonya pada proses elektrodeposisi paduan logam biner Sn-Zn, Sn memiliki potensial reduksi yang lebih positif jika dibandingkan Zn yaitu -0,137 V sedangkan Zn memiliki potensial reduksi -0,763 V. Makan logam Sn akan terdeposisi terlebih dahulu kemudian diikuti logam Zn (Beattie & Dahn, 2005). 5. Voltametri Siklik
Elektroanalitik merupakan teknik yang berhubungan dengan arus listrik dan rekasi kimia. Voltametri siklik merupakan teknik elektroanalitik dengan prinsip dasar elektrolisis. Voltametri siklik adalah teknik yang digunakan untuk mendapatkan informasi tentang reaksi kimia (G.B, Balazs, et al, dalam Mulyani, et al. 2012). Hasil dari teknik voltametri siklik berupa voltamogram hubungan antara arus dengan potensial. Voltamogram memberikan informasi tentang potensial puncak anoda (Epa), potensial puncak katoda (Epc), puncak arus anoda
(ipa), dan puncak arus katoda (ipc) yang ditunjukkan dari teknik voltametri siklik
20
di permukaan elektroda. Menurut Barroso dalam Riyanto, et al, (2007), kelebihan dari teknik voltametri siklik yaitu biaya yang murah, proses yang tidak lama dan merupakan teknik yang sederhana. Keunggulan lain dari voltametri siklik yaitu sensitivitas dan kepekaan yang tinggi (Riyanto, 2015).
6. Pare (Momordica charantia L.)
Tanaman Pare (Momordica charantia L.) adalah sejenis tanaman menjalar dengan buah yang panjang bergerigi dan ujungnya runcing. Pare tumbuh baik di dataran rendah dan tumbuh subur di tempat-tempat yang agak terlindung karena tidak memerlukan banyak sinar matahari. Tanaman pare merupakan tanaman herbal berumur satu tahun atau lebih yang tumbuh menjalar dan merambat.
Gambar 2. Pare Putih (Sumber: Anonim 2016).
Menurut Subahar & Tim Lentera (2004: 5), tanaman pare diklasifikasikan dalam:
21
Jenis (spesies) : Momordica charantia
Tanaman pare memiliki akar tunggang dengan warna putih dan struktur batang tidak berkayu dengan berwarna hijau. Daun tanaman pare berbentuk bulat, berbulu, dan berlekuk dengan susunan tulang daun menjari. Warna bunga pare adalah kuning menyala dan tumbuh dari ketiak daun. Sedangkan buah pare berbentuk bulat memanjang yang memiliki rasa pahit. Buah pare juga memiliki banyak biji yang dibalut oleh daging buah pare yang tebal (Subahar& Tim Lentera, 2004: 3-4).
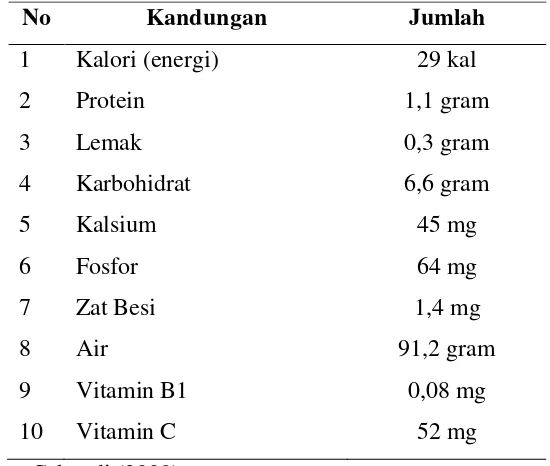
Tabel 2 . Gizi yang Terkandung dalam 100 gram Buah Pare
No Kandungan Jumlah
22
glikosid, alkanoid, momorcharin alpha dan momorcharin beta. Daun pare mengandung momordisina, momordina, karantina, asam trikosanik, resin, asam resinat, saponin, vitamin (A dan C), dan lemak (asam oleat, asamlinoleat, asam stearat, dan L. oleostearat) (Indrawati, et al., 2016: 76). Dalam 100 gram buah pare segar (mentah) gizi yang terkandung tertera pada Tabel 1.
Pare memiliki beberapa macam jenis yaitu pare putih, pare hijau dan pare ular. Pare yang digunakan dalam penelitian ini merupaka pare dengan jenis pare putih. Pare putih berwarna hijau putih kekuningan dengan ukuran buah 30-50 cm, diameter 3-7 cm dan berat rata-rata antara 200-500 gram/buah (Anonim, 2016). Menurut Subahar & Tim Lentera (2004: 6), pare putih dikenal dengan nama pare gajih atau pare mentega. Rasa buah pare putih tidak terlalu pahit. Tanaman pare dapat mulai dipanen pada umur 2 bulan dengan masa panen sampai umur 3-3,5 bulan. Ciri-ciri buah yang layak panen adalah terdapat bintil-bintil dan keriputnya masih rapat dengan alur belum melebar (Setyaningrum & Cahyo Saparinto, 2011: 176-177).
7. SEM EDX
23
tidak bermuatan maka sampel harus dilapisi (coating) terlebih dahulu dengan emas (Amrina, 2008). Syarat agar SEM dapat menghasilkan gambar yang yang baik dan tajam apabila permukaan sampel bersifat sebagai pemantul elektron atau dapat melepaskan elektron sekunder ketika ditembak dengan berkas elektron. Logam merupakan material yang dapat memantulkan elektron atau melepaskan elektron sekunder ketika ditembak berkas elektron. Sampel yang tidak dapat memantulkan elektron atau melepaskan elektron sekunder maka permukaan sampel tersebut harus dilapisi dengan logam. Metode pelapisan yang umumnya dilakukan adalah evaporasi dan sputtering.
24
elemen, sehingga dapat digunakan untuk mengukur kandungan elemen yang ada di dalam sampel. Dengan bantuan detektor khusus elektron sekunder dapat dimanfaatkan untuk membentuk gambar morfologi permukaan sampel dengan baik (Sujatno, et al, 2015).
Setiap mikroskop elektron memiliki senapan elektron (electron gun) yaitu pemercepat elektron menghasilkan pancaran elektron dan batas arus, pada celah lensa berfungsi untuk mengurangi pembelokan sudut. Interaksi pancaran elektron dengan sampel dan elektron yang dipantulkan akan diterima oleh detector. SEM dapat menghasilkan gambar dengan kontras yang rendah karena sampel yang mengandung komponen non konduktif seperti lapisan pasivasi oksida pada permukaan. Oleh karena itu SEM harus dioperasikan dengan pengaturan parameter elektron seperti high viltage, spot size, bias dan bean current juga parameter optik seperti kontras, fokus dan astigmatismus yang tepat sehingga diperoleh hasil gambar yang optimal secara ilmiah (Sujatno, et al, 2015).
8. XRD (Difraksi Sinar X)
25
struktur kristal berdasarkan pola yang dihasilkan oleh atom-atom penyususn kristal.
Sinar-X berinteraksi dengan elektron dalam atom, foton sinar-X akan menumbuk elektron dan beberapa foton akan diadsorpsi, ditransmisikan dan dihamburkan dengan arah yang berbeda dari arah datangnya. Hamburan difraksi iniliah yang akan terdeteksi oleh detektor. Gelombang difaksi dapat saling berinteraksi, apabila fasanya sama akan saling menguatkan namun jika fasanya berbeda akan saling menghilangkan (Nurwati, 2007).
Metode X-ray Diffraction (XRD) berdasarkan sifat difraksi sinar-X yakni
hamburan cahaya dengan panjang gelombang λ saat melewati kisi kristal dengan
sudut datang θ dan jarak antar bidang kristal d. Data yang diperoleh dari metode
karakterisasi XRD adalah sudut hamburan (sudut Bragg) versus intensitas. Berdasarkan teori difraksi, sudut difraksi tergantung pada lebar celah kisi sehingga mempengaruhi pola difraksi, sedangkan intensitas cahaya difraksi bergantung pada berapa banyak kisi kristal yang memiliki orientasi yang sama (Prabakara dalam Amrina, 2008).
B. Penelitian Yang Relevan
26
Ena Marlina, Slamet Wahyudi dan Lilis Yuliati dalam penelitiannya pada tahun 2013 yang judul Produksi Brown’s Gas Hasil Elektrolisis H2O dengan Katalis NaHCO3, menyebutkan bahwa jumlah energi yang diperlukan untuk proses elektrolisis dan laju produksi gas HHO meningkat seiring dengan bertambahnya prosentase NaHCO3 dan mencapai nilai maksimum pada
prosentase NaHCO3 sebesar 12,5%.
Hasil penelitian yang dilakukan Isana SYL, Wega Trisunaryanti, Agus Kuncaka dan Triyono pada tahun 2012 dengan judul Studies on the Hydrogen Evolution Reaction on the Fe-Co-Ni/Stainless Steel Electrode, menyebutkan bahwa coating logam Fe, Co, dan Ni pada Stainless Steel dapat meningkatkan laju reaksi evolusi hidrogen. Penggunaan elektroda Fe-Co-Ni/Stainless Steel dalam elektrolisis air 32x lebih baik pada produksi hidrogen dan 11x lebih baik pada produksi oksigen daripada penggunaan elektroda Stainless Steel tanpa coating.
Penelitian yang dilakukan oleh Isana SYL, Dewi Yuanita dan Heru Pratomo AL (2015) dengan judul Pemecahan Molekul Air dengan Menggunakan Media Tepung Umbu Dahlia (Dahlia Pinnata), menyebutkan bahwa proses elektrolisis air menjadi terhambat dengan adanya tepung umbi dahlia. Hal ini disebabkan terjadinya covering di sekitar permukaan elektroda sehingga proses pemecahan molekul air menjadi terhambat. Covering optimum ditunjukkan pada penambahan 9 gram penambahan tepung umbi dahlia dalam 1 liter air.
Maysaroh D dan Isana SYL (2016) dalam penelitiannya yang berjudul Elektrolisis H2O Menggunakan Elektrode Stainless Steel dalam Suasana Basa
27
elektroda stainless steel paling baik terjadi pada penambahan 1 gram tepung maizena.
Yulia Ari Atuti (2016) dalam penelitannya yang berjudul Reaksi Evolusi Hidrogen Menggunakan Media Tepung Mocaf dengan Elektroda Stainless Steel/Fe-Co-Ni, benyebutkan bahwa aktivitas elektroda stainless steel mengalami penurunan dengan adanya tepung mocaf dan aktivitas elektroda stainless steel/Fe-Co-Ni mengalami peningkatan dengan adanya tepung mocaf. Kondisi optimum elektrogenerasi gas hidrogen pada elektrolisis air dengan elektroda stainless steel/Fe-Co-Ni dalam media tepung mocaf terjadi pada konsentrasi tepung mocaf 3 gram/Liter.
C. Kerangka Berpikir
Ketersediaan sumber energi berupa minyak bumi dan gas alam dapat habis karena sifatnya yang tidak bisa diperbaruhi. Diperlukan waktu berjuta-juta tahun untuk dapat menghasilkan minyak bumi dan gas alam dari fosil. Oleh karena itu, diperlukan suatu energi terbarukan yang dapat menggantikan peran minyak bumi dan gas alam sebagai sumber energi. Salah satunya adalah hidrogen. Hidrogen sangat efektif sebagai bahan bakar karena tidak menghasilkan emisi sehingga lebih ramah lingkungan. Walaupun demikian, harga gas hidrogen saat ini sangat mahal karena proses produksinya membutuhkan banyak biaya.
Adanya penelitian ini diharapkan dapat memproduksi hidrogen dengan biaya yang lebih ringan, yakni produksi hidrogen dari pemecahan H2O.
Ketersediaan H2O yang melimpah di alam diharapkan produksi hidrogen menjadi
28
pemecahan H2O dilakukan dengan proses elektrolisis. Dilakukan penambahan
29
BAB III
METODE PENELITIAN
A. Subyek dan Obyek Penelitian
1. Subjek Penelitian
Elektroda stainless steel dan stainless steel/ Fe-Co-Ni 2. Objek Penelitian
Efisiensi produksi gas hidrogen pada elektrolisis dalam media pare dengan elektroda stainless steel dan stainless steel/ Fe-Co-Ni
B. Variabel penelitian
1. Variabel bebas:
Variasi berat media pare yang ditambahkan pada proses elektrolisis air dan elektoda yang digunakan yaitu elektroda stainless steel dan stainless steel/Fe-Co-Ni.
2. Variael control:
Laju penyapuan voltameter sebesar 50 mV/s. 3. Varibel terikat:
Efisiensi produksi gas hidrogen.
C. Alat dan Bahan Penelitian
Alat utama penelitian 1. Alat-alat gelas dan ukur, 2. eDAQ EChem,
30 Bahan utama penelitian
1. Logam stainless steel S-430, ketebalan 1,2 mm; lebar 3 mm; dan panjang 110 mm,
2. Asam nitrat, 3. Aseton, 4. NaHCO3 p.a,
5. FeSO4.7H2O p.a,
6. Co(NO3)2.6H2O p.a,
7. NiSO4.6H2O p.a,
8. Media pare, 9. H3BO3,
10. Sakarin, 11. NaCl, 12. NH4Cl,
13. Akuades.
D. Prosedur Penelitian
1. Media Pare
31 2. Elektrodeposisi Fe-Co-Ni
Pembuatan elektroda stainless steel/Fe-Co-Ni dengan menggunakan staninless steel sebagai elektroda kerja, platinum sebagai elektroda kontra, dan Ag/AgCl sebagai elektroda referensi secara voltametri linear. Proses pembuatan elektroda stainless steel/Fe-Co-Ni dimulai dengan memotong logam stainless steel tipe Ferritic Grades S-430 dengan ketebalan 1,2 mm; lebar 3 mm; dan panjang 110 mm. Kemudia membuat larutan Fe-Co-Ni dengan perbandingan mol Fe:Co:Ni sebesar 1:1:1. Larutan Fe-Co-Ni dibuat dengan mencampurkan larutan FeSO4 dari padatan kristal FeSO4.7H2O dengan konsentrasi 0,01 M, larutan
Co(NO3)2 dari padatan kristal Co(NO3)2.6H2O dengan konsentrasi 0,01 M, dan
larutan NiSO4 dari padatan kristal NiSO4.6H2O dengan konsentrasi 0,01 M.
Selanjutnya menambahkan bahan-bahan yang digunakan untuk membantu penempelan logam pada substrat, yakni: 1,5 gram H3BO3, 0,1 gram sakarin, 2
gram NaCl, dan 2 gram NH4Cl per liter larutan. Elektrodeposisi dilakukan dengan
menggunakan eDAQ EChem dengan laju 50 mV/s selama 10 menit. 3. Karakteristik logam stainless steel dan stainless steel/Fe-Co-Ni
32 4. Elektrolisis H2O
Elektoda stainless steel/Fe-Co-Ni hasil sintesis pada tahap sebelumnya dan elektroda stainless steel digunakan dalam elektrolisis air sebaga elektroda kerja, platinum sebagai elektroda kontra, dan Ag/AgCl sebagai elektroda referensi secara voltametri siklik.
Pada proses elektrolisis larutan elektrolit disiapkan dengan menggunakan variasi konsentrasi media pare dan elektrolit NaHCO3 sebanyak 0,5%. Variasi
media pare dapat dilihat pada Tabel 3.
Tabel 3. Konsentrasi Media Pare dalam Larutan NaHCO3 0,5%
Konsentrasi media pare
Nama Sampel Konsentrasi media pare
Nama Sampel
0 % Sampel 1 0,6 % Sampel 7
0,1 % Sampel 2 0,7 % Sampel 8
0,2 % Sampel 3 0,8 % Sampel 9
0,3 % Sampel 4 0,9 % Sampel 10
0,4 % Sampel 5 1 % Sampel 11
0,5 % Sampel 6
33
E. Teknik Pengambilan Data
Data yang diperoleh dari penelitian ini adalah data kualitatif dan data kuantitatif. 1. Data kualitatif
Data kualitatif didapatkan dari analisis data hasil pengukuran menggunakan Voltametri, SEM-EDX dan XRD.
2. Data kuantitatif
Data kuantitatif didapatkan dari analisis data hasil pengukuran menggunakan eDAQ EChem. Efisiensi produksi gas hidrogen ditentukan dengan menggunakan persamaan (13).
(13)
dengan dan ic masing-masing adalah efisiensi produksi gas hidrogen dan
puncak arus katodik.
Selain efisiensi produksi gas hidrogen, ditinjau juga kebutuhan energi, dengan menggunakan persamaan (14).
34
BAB IV
HASIL DAN PEMBAHASAN
Penelitian ini berjudul “Produksi Hidrogen dari Pmecahan Molekul H2O
dalam Media Pare dengan Elektroda Stainless Steel/Fe-Co-Ni” yang bertujuan untuk mengetahui efisiensi produksi gas H2 pada media pare dengan elektroda
stainless steel dan stainless steel/Fe-Co-Ni dan untuk mengetahui kondisi optimum produksi gas H2 dalam media pare. Berdasarkan hasil penelitian yang
telah dilakukan, pada bab ini akan dibahas mengenai elektrodeposisi elektroda stainless steel/Fe-Co-Ni, karakteristik logam stainless steel dan elektroda stainless steel/Fe-Co-Ni serta elektrolisis H2O.
A. Elektrodeposisi Elektroda Stainless Steel/Fe-Co-Ni
35
stainless steel memiliki aktivitas yang lebih efektif dalam elektrolisis jika terlebih dahulu dilakukan coating dengan logam terner pada logam stainless steel. Larutan elektrolit yang digunakan dibuat dari larutan Fe-Co-Ni yang ditambahkan 1,5 gram H3BO3, 0,1 gram sakarin, 2 gram NaCl, dan 2 gram NH4Cl per liter larutan.
Penambahan H3BO3, NaCl dan NH4Cl berfungsi untuk membantu penempelan
logam pada substrat. Menurut Huriyati, dkk. (2008), dari hasil penelitian yang telah dilakukan, penambahan asam borat dapat meningkatkan kualitas dan morfologi endapan logam kobal pada elektroda.
Selama proses elektrodeposisi, kation-kation logam akan tertarik menuju kutub negatif yaitu katoda, sehingga kation akan berubah menjadi atom-atom yang akan terdeposisi pada katoda. Mula-mula logam akan teroksidasi membentuk logam bermuatan positif dan melepaskan elektron. Logam bermuatan positif akan tertarik ke elektroda negatif yaitu katoda. Logam bermuatan positif akan terdeposisi di katoda karena elektron di katoda akan mereduksi logam bermuatan positif, sehingga logam akan bermuatan netral dan akan menempel pada permukaan katoda.
36
Elektrodeposisi dilakukan menggunakan instrumen eDAQ Echem secara voltametri linier dengan laju 50 mV/s selama 10 menit. Hasil elektrodeposisi dapat dilihat pada Gambar 3. Puncak pada voltamogram menunjukkan telah terjadi peningkatan arus yang mengindikasikan telah terjadi reaksi oksidasi dari logam. Logam yang teroksidasi akan bermuatan positif dan akan tertarik oleh katoda karena perbedaan muatan dan akan terdeposisi di katoda. Pengendapan logam yang berbeda didasarkan pada potensial reduksi standar yang dimiliki masing-masing logam tersebut. Hal ini dikarenakan logam yang memiliki potensial reduksi standart yang lebih positif akan memiliki sifat oksidator yang lebih kuat. Logam yang berperan sebagai oksidator merupakan logam yang mengalami reaksi reduksi. Oleh karena itu, logam yang memiliki potensial reduksi standart yang lebih positif akan mengalami reaksi reduksi terlebih dahulu sehingga akan terlebih dahulu terdeposisikan pada permukaan katoda. Berdasarkan teori, maka logam Ni akan terdeposisi terlebih dahulu, kemudian diikuti oleh logam Co dan Fe. Ion Ni2+ memiliki potensial standard yang lebih possitif jika dibandingkan dengan logam Co2+ dan Fe2+, sehingga ion Ni2+ akan mengalami reaksi reduksi terlebih dahulu membentuk logam Ni kemudian akan terdeposit di permukaan katoda. Reaksi yang terjadi di kataoda sebagai berikut:
37
B. Karakterisasi
Logam stainless steel sebelum dan sesudah dilakukan pelapisan dengan logam Fe, Co dan Ni dikarakterisasi dengan voltametri linear, XRD dan SEM-EDX. Karakterisasi dengan voltametri liniear bertujuan untuk mengetahui variasi arus dan potensial elektroda stainless steel sebelum dan sesudah dilakukan pelapisan. Hasil karakterisasi dengan voltametri linear berupa voltamogram yang ditunjukkan pada Gambar 4 dan Gambar 5 di bawah ini:
Gambar 4. Voltamogram Liniear Sebelum Pelapisan (Stainless Steel)
Gambar 5. Voltamogram Liniear Sesudah Pelapisan (Stainless Steel/Fe-Co-Ni) Kedua gambar diatas menunjukkan perbedaan puncak dari elektroda stainless steel sebelum dan sesudah dilakukan pelapisan (stainless steel/Fe-Co-Ni). Pebedaan puncak pada voltamogram menunjukkan terdapat perbedan
38
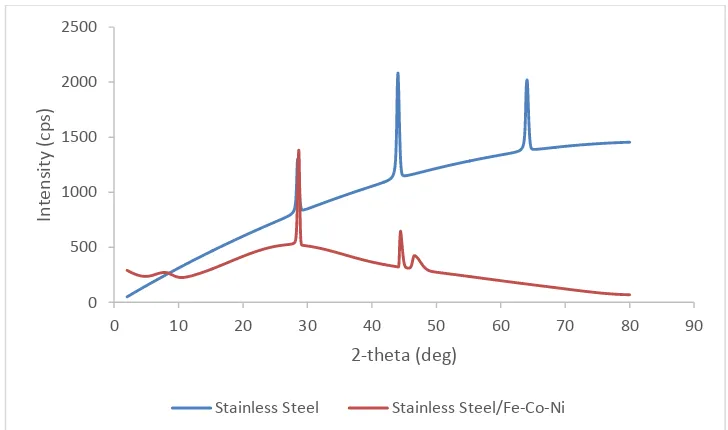
kenaikan arus yang dihasilkan. Arus yang dihasilkan merupakan gambaran dari aktvitas elektroda. Elektroda dengan komponen yang berbeda akan memberikan arus yang berbeda pula. Perbedaan tersebut menunjukkan pelapisan logam stainless steel dengan logam Fe, Co, dan Ni telah berhasil dilakukan. Karena elektroda stainless steel sebelum dan sesudah dilakukan pelapisan (stainlesssSteel/Fe-Co-Ni) memiliki aktfitas yang berbeda. Karakterisasi logam stainless steel dan stainless steelFe-Co-Ni dengan XRD dilakukan di Laboratorium Kimia UNY. Karakterisasi dengan XRD juga menunjukkan telah terdapat logam Fe, Co, dan Ni yang telah menempel yang ditunjukkan dengan perbedaan puncak yang dihasilkan. Karakterisasi dengan XRD dari stainless steel menghasilkan 3 puncak pada difraktogram, sedangkan karakterisasi dengan XRD dari stainless steelFe-Co-Ni menghasilkan 4 puncak pada difraktogram. Perbedaan puncak-puncak pada difraktogram stainless steel dan stainless steelFe-Co-Ni dapat dilihat pada Gambar 6.
39
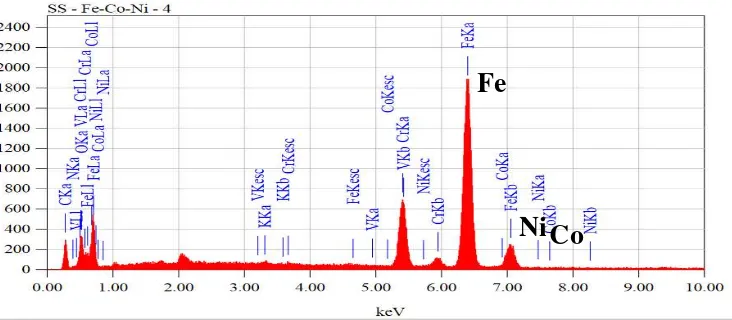
Karakterisasi yang selanjutnya yaitu karakterisasi dengan SEM-EDX. Data kaakterisasi SEM-EDX stainless steel diperoleh dari penelitian yang dilakukan oleh Isana SYL, dkk (2015) yang dtunjukkan pada Gambar 7. dan karakterisasi SEM-EDX stainless steel /Fe-Co-Ni ditunjukkan pada Gambar 8. Karakterisasi SEM-EDX stainless steel /Fe-Co-Ni dilakukan di LPPT UGM. Keberhasilan dari pelapisan logam stainless steel diperkuat dengan hasil karakterisasi SEM-EDX yang ditunjukkan oleh kadar logam Fe, Co, dan Ni. Kadar logam Fe, Co, dan Ni dari hasil karakterisasi dapat dilihat pada tabel 4.
Gambar 7. Hasil Karakterisasi Stainless Steel dengan SEM EDX
Gambar 8. Hasil Karakterisasi Stainless Steel/Fe-Co-Ni dengan SEM EDX
Fe
40
Tabel 4. Kadar Logam (%) dalam Stainless Steel dan Stainless Steel/Fe-Co-Ni
Stainless Steel Stainless Steel/Fe-Co-Ni
Fe 80.11 % 50,34 %
Co 0,05 % 0,14 %
Ni 0 % 0,17 %
Kadar logam Fe pada Tabel 4 mengalami penurunan setelah dilakukan pelapisan pada logam stainless steel dan kadar logam Co dan Ni mengalami peningkatan setelah dilakukan pelapisan. Penurunan kadar logam Fe dan peningkatan kadar logam Co dan Ni menunjukkan bahwa jumlah logam Co dan Ni pada logam stainless steel/Fe-Co-Ni (stainless steel yang telah dilakukan pelapisan) lebih banyak banyak daripada logam stainless steel. Hal ini mengindikasikan bahwa telah terjadi pelapisan logam Fe, Co Ni pada logam stainless steel.
C. Elektrolisis H2O
Elektrolisis merupakan reaksi yang tidak dapat berlangsung secara spontan, diperlukan tegangan luar agar reaksi elektrolisis dapat berlangsung. Proses
elektrolisis untuk menghasilkan gas hidrogen (H2) dan gas oksigen (O2) murni
dengan memanfaatkan energi listrik pada sistem disebut sebagai elektrolisis air. Reaksi dalam proses elektrolisis air pada katoda seperti pada persamaan reaksi (1) dan pada anoda seperti pada reaksi persamaan (2). Proses reduksi terjadi pada katoda yang menghasilkan gas hidrogen (H2) dan ion hidroksida (OH-), sedangkan
41
hidrogen (H+). Ion hidroksida (OH-) dan ion hidrogen (H+) akan mengalami netralisasi dan membentuk molekul H2O.
Gas hidrogen yang dihasilkan sangat bermanfaat sebagai energi terbarukan. Oleh karena itu inovasi dalam proses produksi hidrogen sangat diperlukan untuk menghasilkan gas hidrogen dengan biaya yang relatif murah. Energi yang dihasilkan dari gas hidrogen tidak menghasilkan emisi karena hasil samping konversi energi adalah air. Gas hidrogen dapat dikonversi menjadi energi bahan bakar jika direaksikan dengan gas oksigen dalam sel bahan bakar. Reaksi yang terjadi merupakan reaksi spontan dengan reaksi kimia sebagai berikut:
2H2(g)+ O2(g) 2H2O(l)+ energi (18)
(Riyanto, 2013: 23)
Elektroda yang digunakan dalam penelitian ini adalah logam stainless steel dan logam stainless steel yang telah dicoating dengan logam Fe-Co-Ni. Logam stainless steel yang digunakan adalah tipe stainless steel S-430 dengan ketebalan 1,2 mm; lebar 3 mm; dan panjang 110 mm. Proses elektrolisis air dalam penelitian ini menggunakan larutan elektrolit NaHCO3 yang ditambahkan media pare ke
dalam larutan elektrolit tersebut. Media pare dibuat dengan cara memotong buah pare yang telah dihilangkan isinya terlebih dahulu dan dicuci dengan air bersih. Kemudian buah pare tersebut dikeringkan di bawah sinar matahari sampai kering. Buah pare yang telah kering dihaluskan dengan blender dan diayak. Media pare ditambahkan dalam 10 mL larutan elektrolit NaHCO3 yang digunakan dalam
42
secara voltametri siklik. Mennurut Evans et al (1993) dan Lund & Hummerich (2001) dalam Riyanto (2013: 94), voltametri siklik merupakan teknik yang banyak digunakan untuk mendapatkan informasi tentang reaksi elektrokimia.
1. Elektrolisis H2O dengan Elektroda Stainless Steel
Proses elektrolisis pertama yang diakukan yaitu elektrolisis air dengan elektroda stainless steel pada media pare. Voltamogram hasil elektrolisis air dengan elektroda stainless steel ditunjukkan oleh Gambar 9 pada lampiran, dari voltamogram tersebut diperoleh besar potensial dan arus di puncak katodik hasil pengujian yang dapat dilihat pada Tabel 6 di lampiran.
43
Gambar 9. Grafik Efisiensi Produksi dan Overpotensial Hasil Elektrolisis dengan
Elektroda Stainless Steel
Berdasarkan grafik pada Gambar 9, efisiensi produksi gas hidrogen pada proses elektrolisis air dalam media bubuk pare dengan elektroda stainless steel yang paling baik ditunjukkan pada sampel 1 yaitu elektrolisis tanpa penambahan media pare. Sampel 1 menunjukkan produksi gas hidrogen paling besar yaitu 100% dengan arus sebesar -0,2243 mA. Besarnya arus yang dihasilkan dari proses elektrolisis air sebanding dengan besarnya gas hidrogen yang dihasilkan. Sesuai dengan Hukum Faraday pertama yang menyatakan bahwa massa zat yang terbentuk pada masing-masing elektroda sebanding dengan kuat arus/arus listrik
yang mengalir pada suatu elektrolisis. Akan tetapi, proses elektrolisis air tanpa penambahan media pada sampel 1 tersebut membutuhkan energi yang cukup besar karena overpotensial yang dihasilkan yaitu 0,099 Volt. Overpotensial berbanding lurus dengan energi yang dibutuhkan. Oleh karena itu, besarnya overpotensial dari hasil perhitungan menunjukkan besarnya energi yang dibutuhkan. Overpotensial diperoleh dari selisih potensial hasil percobaan dengan
44
potensial teori (E0 H2O/H2 = - 0,828 V). Semakin kecil nilai overpotensial yang
dihasilkan pada proses produksi gas hidrogen, maka semakin kecil pula energi yang dibutuhkan dalam proses produksi gas hidrogen tersebut.
45
2. Elektrolisis H2O dengan Elektroda Stainless Steel/Fe-Co-Ni
Proses elektrolisis kedua yang diakukan yaitu elektrolisis air dengan elektroda stainless steel/Fe-Co-Ni pada media pare. Voltamogram hasil elektrolisis air dengan elektroda stainless steel/Fe-Co-Ni ditunjukkan oleh Gambar 10 pada lampiran, dari voltamogram tersebut diperoleh besar potensial dan arus di puncak katodik hasil pengujian yang ditunjukkan pada Tabel 7 di lampiran. Berdasarkan data hasil pada Tabel 7, maka efesiensi produksi gas hidrogen dan over potensial pada elektrolisis air dalam media pare dengan elektroda stainless steel/Fe-Co-Ni dapat ditentukan. Nilai efisiensi produksi gas hidrogen dapat ditentukan dengan persamaan (13) dan nilai overpotensial dapat ditentukan dengan persamaan (14). Setelah dilakukan perhitungan dengan persamaan tersebut, maka nilai efisiensi produksi gas hidrogen dan overpotensial dari hasil perhitungan dapat dialurkan dalam grafik dibawah ini:
46
Berdasarkan grafik pada Gambar 10 di atas, efisiensi produksi gas hidrogen pada proses elektrolisis air dalam media pare dengan elektroda stainless steel/Fe-Co-Ni yang paling baik ditunjukkan pada sampel yang tidak ditambahkan media pare yaitu sebesar 100%. Proses elektrolisis air pada ampel yang tidak ditambahkan media pare tersebut membutuhkan energi yang cukup besar yaitu 0,08 Volt. Apabila ditinjau dari energi yang dibutuhkan, penambahan 0,7% media pare membutuhkan energi yang paling kecil yaitu 0,001 Volt dengan efisiensi produksi gas hidrogen pada penambahan 0,7% media pare yaitu 51,06%. Kondisi optimum elektrolisis air ditunjukkan pada penambahan 0,7% media pare karena memiliki overpotensial yang paling kecil dengan efisiensi produksi gas hidrogen yang tidak terlalu kecil. Penambahan media pare mengakibatkan proses elektrolisis air dengan elektroda stainless steel/Fe-Co-Ni menjadi terhambat. Hal ini ditunkukkan oleh besarnya energi yang dibutuhkan dengan efisiensi produksi gas hidrogen yang lebih kecil jika dibandingkan dengan proses elektrolisis air tanpa penambahan media pare.
47
struktur lapisan permukaan elektroda. Beberapa kasus proses penyerapan dapat menyebabkan kerusakan molekul. Covering di permukaan elektroda mengakibatkan permukaan aktif elektroda semakin berkurang sehingga produksi gas hidrogen menjadi berkurang. Produksi gas hidrogen palng sedikit yaitu 38,32 % atau sebesar -0,1525 mA yang ditunjukkan oleh sampel 3 dengan penambahan 0,2% media pare. Sampel 2 menunjukkan kondisi optimum terjadinya covering.
3. Perbandingan Kondisi Optimum
Penggunaan elektroda stainless steel/Fe-Co-Ni dalam elektrolisis air pada media pare memberikan efisiensi energi yang lebih baik. Hal ini ditunjukkan pada nilai overpotesial pada proses elektrolisis air pada media pare. Proses elektrolisis air pada media pare dengan elektroda stainless steel/Fe-Co-Ni memiliki nilai overpotensial yang lebih kecil jika dibandingkan elektrolisis air pada media pare dengan elektroda stainless steel.
Tabel 5. Kondisi Optimum Proses Elektrolisis dengan Elektroda Stainless Steel dan Stainless Steel/Fe-Co-Ni
Kondisi Optimum
Stainless Steel Stainless Steel/Fe-Co-Ni
Konsentrasi media pare 0 % 0,7 %
Efisiensi Produksi H2 100% 51,06%
Overpotensial 0,099 Volt 0,001 V
48
stainless steel/Fe-Co-Ni dapat dilihat dari Tabel 5. Ditinjau dari efisiensi produksi gas hidrogen, kondisi optimum produksi gas hidrogen menggunakan elektroda stainless steel pada proses elektrolisis dalam media pare lebih besar jika dibandingkan elektroda stainless steel/Fe-Co-Ni. Namun selisih gas hidrogen yang diproduksi tidak terlalu besar yang ditunjukkan oleh arus katodik pada proses elektrolisis dengan elektroda stainless steel yaitu -0,2243 mA, sedangakan arus katodik pada proses elektrolisis dengan elektroda stainless steel/Fe-Co-Ni yaitu -0,2032 mA. Semakin besar nilai dari puncak arus katodik menunjukkan bahawa semakin banyak gas hidrogen yang terbentuk. Besarnya arus pada puncak katodik yang dihasilkan dari proses elektrolisis air sebanding dengan besarnya gas hidrogen yang dihasilkan sesuai dengan Hukum Faraday pertama.
49
50
BAB IV
KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil penelitian dan pembahasan yang telah dilakuan, dapat disimpulkan bahwa:
1. Produksi gas hidrogen pada media pare dengan elektroda stainless steel kurang efisien dan terjadi covering pada permukaan elektroda.
2. Produksi gas hidrogen pada media pare dengan elektroda stainless steel/Fe-Co-Ni juga terjadi covering pada permukaan elektroda namun lebih efisien jika dibandingkan dengan elektroda stainless steel.
3. Kondisi optimum produksi gas hidrogen pada media pare dengan elektroda stainless steel terjadi pada penambahan 0% media pare dan kondisi optimum produksi gas hidrogen pada media pare dengan elektroda stainless steel/Fe-Co-Ni terjadi pada penambahan 0,7% media pare.
B. Saran
Berdasarkan penelitian tentang produksi gas hidrogen dengan elektroda stainless steel dan stainless steel/Fe-Co-Ni saran yang dapat diberikan antara lain: 1. Air yang mengandung atau ditambahkan pare sebaiknya tidak digunakan pada proses elektrolisis air dengan elektroda stainless steel dan stainless steel/Fe-Co-Ni karena dapat menurunkan efisiensi produksi gas hidrogen.
2. Perlu dilakukan penelitian lebih lanjut mengenai variasi konsentrasi NaHCO3
51
52
DAFTAR PUSTAKA
Amrina, Q.H. (2008). Sintesa Hidroksiapatit dengan Memanfaatkan Limbah Cangkang Telur: Karakterisasi Difraksi Sinar-X dan Sanning Electron Microscopy (SEM). Skripsi. Fakultas Matematika dan Ilmu Pengetahuan Alam IPB.
Andewi, Ni Made A.Y. & Hadi, W. (2012). Produksi Gas Hidrogen Melalui Proses Elektrolisis Air Sebagai Sumber Energi. Jurnal Teknik. FTSP-ITS. Anonim. (2016). 20+ Manfaat Pare, Turunkan Gula Darah & Asi Booster.
Diakses pada tanggal 4 Juni 2017 dari http://www.herbalogi.com/manfaat-pare/.
Astuti, Y.A. (2016). Reaksi Evolusi Hidrogen dengan Menggunakan Tepung Mocaf dengan Elektroda Stainless Steel/Fe-Co-Ni Secara Elektrolisis Air. Skripsi. Fakultas Matematika dan Ilmu Pengetahuan Alam UNY.
Beattie, S.D & Dahn, J.R. ( 2005). Combinatorial Electrodeposition of Ternary Cu-Sn-Zn Alloys. Journal of The Electrochemical Society. 152 (8). Hlm. 542-548.
Boedoyo, M.S. (2016). Outlook Energi Indonesia 2016. Jakarta: Pusat Teknologi Pengembangan Sumber Daya Energi BPPT.
Budi, E. (2016). Potensi Pembentukan Lapisan Super dan Ultra Keras Senyawa Komposit Nitrida Menggunakan Kaidah Elektrodeposisi. Jurnal Fisika dan Aplikasinya. Vol. 1. No. 2. Hlm. 69-74.
Cahyadi, R. (2009). Uji Toksisitas Akut Ekstrak Buah Pare (Momordica charantia L.) terhadap Larva Artemia Salina Leach dengan Metode Brine Shrimp Lethality Test (BST). Skripsi. Fakultas Kedokteran-Universitas Diponegoro.
Chang, R. (2005). Kimia Dasar Konsep –Konsep Inti Edisi ke Tiga Jilid 2. Jakarta: Erlangga.
Das, D. & Veziroglu, T.N. (2001). Hydrogen Production by Biological Processes: a Survey of Literature. International Journal of Hydrogen Energy. 26. Hlm. 13-28.
Dewi, E. L. (2011). Potensi Hidrogen sebagai Bahan Bakar untuk Kelistrikan Nasional. Prosiding Seminar Nasional Teknik Kimia. BPPT-Jakarta.
Dogra. (1998). Kimia Fisika. Jakarta: Universitas Indonesia.