KEMAMPUAN JAMUR PELAPUK KAYU ISOLAT JPA DAN
TRICHODERMA SP. S2-2 DALAM MENDEGRADASI
TANDAN KOSONG KELAPA SAWIT
UNTUK MENGHASILKAN
SELULOSA
ALHIDAYATULLAH
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR
2014
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis berjudul Kemampuan Jamur Pelapuk Kayu Isolat JPA dan Trichoderma sp. S2-2 dalam Mendegradasi Tandan Kosong Kelapa Sawit untuk Menghasilkan Selulosa adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dan karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2014
Alhidayatullah
SUMMARY
ALHIDAYATULLAH. The capability of Wood Rot Fungus JPA Isolate and
Trichoderma sp. S2-2 in Degradation of Oil Palm Empty Fruit Bunches to Produce Cellulose. Supervised by LISDAR IDWAN SUDIRMAN and OKKY SETYAWATI DHARMAPUTRA
Oil palm empty fruit bunches (OPEFB) are a lignocellulosic waste which commonly found in oil palm refining process. OPEFB abundant waste can be used to get the biorefinary products that have added value. The objectives of this study was to determine the capability of wood-rot fungus JPA isolate and
Trichoderma in degradation of OPEFB and to determine the growth of the two fungal isolates on OPEFB that has been composted.
The experiment consisted of two topics. The first topic consisted of four treatments of inoculations, i.e. the substrate was inoculated with JPA isolate (JPA); with Trichoderma sp. S2-2 (T); and with both isolates (JPA + T). On the 4th treatment, the substrate was inoculated with JPA isolate. After 4 weeks of incubation, the substrate was inoculated with Trichoderma sp. S2-2 [(JPA) + T]. As control, OPEFB was not inoculated with either JPA isolate or Trichoderma sp. S2-2.
On second topic, 4 piles of OPEFB (40 kg/pile) were inoculated with commercial decomposer. They were then composted for 4, 6, 8, and 10 weeks, respectively, under natural conditions. As control, OPEFB was not composted. The degraded OPEFB was inoculated with either JPA isolate or Trichoderma sp. S2-2, it was then incubated for 35 days.
The results of the first topic showed, that the substrate inoculated with JPA+T produce the highest decrease of dry weight (20.54%). After degradation, from the lowest to the highest of lignin contents were the smooth part of JPA+T (20.83%); JPA (21.85%); rough part of JPA+T (23.93%); T (24.93%); (JPA)+T (29.15%); and control (30.89%) respectively, while from the lowest up to the highest of cellulose contents were T (31.90%), followed by the rough part of JPA+T (33.77%); smooth part of JPA+T (40.4%); JPA (43.33%); (JPA)+T (45.51%); and control (
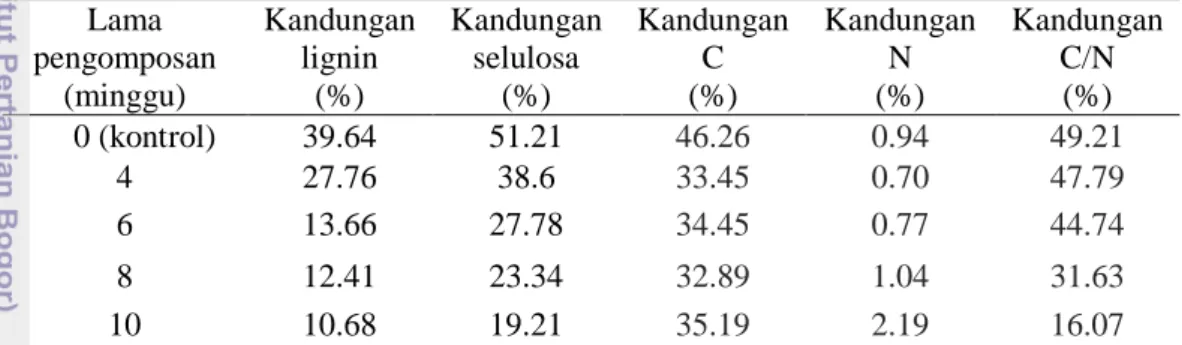
The results of the second topic showed, that after degradation using commercial decomposer for control, 4, 6, 8, and 10 weeks of composting, the lignin contents of OPEFB were 39.64, 27.76, 13.66, 12.41 and 10.68%, respectively, while the cellulose contents were 51.21, 38.60, 27.78, 23.34 and 23.34%, respectively.
51.21%). The lowest to the highest of C/N ratio were smooth part of JPA+T (28.24%); JPA (30.44%); rough part of JPA+T (30.46%); (JPA)+T (30.67%); T (34.76%) and control (49.21%) respectively.
JPA isolate colonized OPEFB for 6 weeks of composting and 25 days after incubation, whereas Trichoderma sp. S2-2 colonized OPEFB for 8 weeks of composting and 20 days after incubation.
Wood rot fungus JPA isolate and Trichoderma sp. S2-2 have a capability in degradation of oil palm empty fruit bunches to obtain cellulose as a raw material to produce value-added products.
Key word : degradation, oil palm empty fruit bunches, Trichoderma sp. S2-2 wood rot fungus
RINGKASAN ALHIDAYATULLAH.
Tandan kosong kelapa sawit (TKKS) merupakan limbah lignoselulosa yang pada umumnya ditemukan pada proses pengolahan minyak kelapa sawit. Limbah TKKS yang berlimpah dapat dimanfaatkan untuk mendapatkan produk
biorefinary yang mempunyai nilai tambah. Tujuan penelitian ini yaitu untuk menganalisis kemampuan jamur pelapuk kayu isolat JPA dan Trichoderma sp. S2-2 dalam mendegradasi TKKS. Selain itu juga untuk mengamati pertumbuhan jamur pelapuk kayu isolat JPA dan Trichoderma sp. S2-2 pada TKKS yang telah dikomposkan. Percobaan terdiri dari dua topik. Topik I terdiri atas empat perlakuan yaitu TKKS diinokulasi dengan isolat JPA (JPA); TKKS diinokulasi dengan Trichoderma sp. S2-2 (T); TKKS diinokulasikan dengan dua isolat secara bersamaan (JPA+T); dan TKKS diinokulasi dengan isolat JPA kemudian setelah masa inkubasi 4 minggu, diinokulasi dengan Trichoderma sp. S2-2 [(JPA)+T]. Sebagai kontrol (K) yaitu TKKS yang tidak diinokulasi dengan isolat JPA dan
Trichoderma S2-2. Pada topik ke-II, empat tumpukan TKKS (40 kg/tumpukan) masing diinokulasi dengan dekomposer komersial, kemudian masing-masing diinkubasi selama 4, 6, 8, dan 10 minggu pada lingkungan alam. Sebagai kontrol (K) yaitu TKKS yang tidak dikomposkan. TKKS hasil pengomposan masing-masing diinokulasi dengan isolat JPA atau Trichoderma sp. S2-2, kemudian diinkubasi selama 35 hari.
Kemampuan Jamur Pelapuk Kayu Isolat JPA dan
Trichoderma sp. S2-2 dalam Mendegradasi Tandan Kosong Kelapa Sawit untuk Menghasilkan Selulosa. Dibimbing oleh LISDAR IDWAN SUDIRMAN dan OKKY SETYAWATI DHARMAPUTRA.
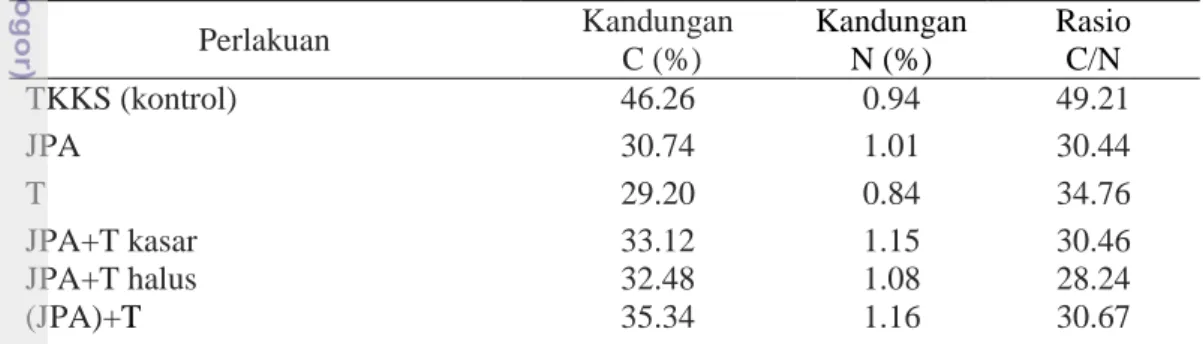
Hasil percobaan topik I menunjukkan, bahwa perlakuan JPA+T mengalami penurunan berat substrat tertinggi (20.54%). Kandungan lignin terendah hingga tertinggi setelah degradasi berturut-turut adalah JPA+T bagian halus (20,83%); JPA (21.85%); JPA+T bagian kasar (23.93%); T (24.93%); (JPA)+T (29.15%); dan kontrol (30.89%), sedangkan kandungan selulosa terendah hingga tertinggi berturut-turut adalah perlakuan T (31.90%) diikuti oleh JPA+T bagian kasar (33.77%); JPA+T bagian halus (40.4); JPA (43.33%); (JPA)+T (45.51%) dan kontrol (51.21%). Rasio C/N terendah hingga tertinggi setelah degradasi berturut-turut adalah JPA+T bagian halus (28.24%); JPA (30.44%); JPA+T bagian kasar (30.46%); (JPA)+T (30.67%); T (34.76%) dan kontrol (49.21%).
Hasil percobaan topik II menunjukkan, bahwa kandungan lignin TKKS setelah degradasi dengan menggunakan dekomposer komersial tanpa pengomposan (kontrol), pengomposan 4, 6, 8, dan 10 minggu masing-masing adalah 39.64%, 27.76%, 13.66%, 12.41%, dan 10.68%, sedangkan kandungan selulosa tanpa pengomposan (kontrol), pengomposan 4, 6, 8, dan 10 minggu masing-masing adalah 51.21, 38.60, 27.78, 23.34, dan 23.34%. Isolat JPA memenuhi substrat TKKS yang dikomposkan selama 6 minggu setelah inkubasi 25 hari, sedangkan Trichoderma sp. S2-2 memenuhi substrat TKKS yang dikomposkan selama 8 minggu setelah inkubasi 20 hari.
Hasil penelitian memberikan informasi, bahwa jamur pelapuk kayu isolat JPA dan Trichoderma sp. S2-2 berpotensi dalam mendegradasi tandan kosong
kelapa sawit untuk menghasilkan selulosa sebagai bahan baku untuk menghasilkan produk bernilai tambah.
Kata kunci : degradasi, jamur pelapuk kayu, tandan kosong kelapa sawit,
©
Hak Cipta milik IPB, tahun 2013
Hak Cipta dilindungi undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB.
KEMAMPUAN JAMUR PELAPUK KAYU ISOLAT JPA
DAN TRICHODERMA SP. S2-2 DALAM MENDEGRADASI
TANDAN KOSONG KELAPA SAWIT
UNTUK MENGHASILKAN SELULOSA
ALHIDAYATULLAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2014
KEMAMPUAN JAMUR PELAPUK KAYU ISOLAT JPA
DAN
TRICHODERMA
SP. S2-2 DALAM MENDEGRADASI
TANDAN KOSONG KELAPA SAWIT
UNTUK MENGHASILKAN SELULOSA
ALHIDAYATULLAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2014
Judul Tesis : Kemampuan Jamur Pelapuk Kayu Isolat JPA dan Trichoderma sp. S2-2 dalam Mendegradasi Tandan Kosong Kelapa Sawit untuk Menghasilkan Selulosa
Nama : Alhidayatullah
NIM : G35110071
Disetujui oleh Komisi Pembimbing
Dr Ir Lisdar I Sudirman Prof Dr Okky Setyawati Dharmaputra Ketua Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana Mikrobiologi
Prof Dr Anja Meryandini Dr Ir Dahrul Syah, MScAgr
Judul Tesis : Kemampuan Jamur Pelapuk Kayu Isolat JPA dan Trichoderma sp. S2-2 dalam Mendegradasi Tandan Kosong Kelapa Sawit untuk Menghasilkan Selulosa Nama Alhidayatullah NIM G35110071 Disetujui oleh Komisi Pembimbing
(}if
Dr IrZSUdinnan Prof Dr Okky Setyawati Dharmaputra
Ketua Anggota
Diketahui oleh Ketua Program Studi
Mikrobiologi
Prof Dr Anja Meryandini
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah subhanahu Wata’ala, atas izin dan perkenan-Nya, penulis akhirnya dapat menyelesaikan rangkaian penelitian dan penulisan tesis yang berjudul “Kemampuan Jamur Pelapuk Kayu Isolat JPA dan Trichoderma sp. S2-2 dalam Mendegradasi Tandan Kosong Kelapa Sawit untuk Menghasilkan Selulosa”
Penulis memberikan penghargaan tertinggi dan terima kasih yang sebesar-besarnya kepada Dr. Ir. Lisdar I Sudirman dan Prof. Dr. Okky Setyawati Dharmaputra selaku komisi pembimbing atas segala perhatian dan bimbingannya selama penelitian dan penulisan naskah tesis ini. Penulis juga mengucapkan terima kasih kepada Dr. Laksmi Ambarsari, MS atas kritik dan sarannya terhadap tesis ini.
. Penelitian ini dilaksanakan di rumah jamur dan di Laboratorium Biokimia, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB), Insititut Pertanian Bogor.
Ucapan terima kasih penulis sampaikan kepada staf tenaga pengajar Program Studi Mikrobiologi Sekolah Pascasarjana IPB atas ilmu yang diberikan selama penulis kuliah di IPB. Penulis mengucapkan terima kasih kepada laboran Laboratoium Biokimia PPSHB dan rekan-rekan mahasiswa Program Studi Mikrobiologi Sekolah Pascasarjana IPB angkatan 2010, atas segala bantuan dan dukungannya kepada penulis selama penelitian dan penyusunan tesis ini.
Ucapan terima kasih yang sebesar-besarnya penulis sampaikan kepada keluarga tercinta, Ayahanda Mahmud Tahir, Ibunda Nursiah, adik Syamsul Alam Nur, dan Sri Purnama Lestari atas doa, dukungan, dan kasih sayangnya setiap saat kepada penulis. Semoga Allah senantiasa melimpahkan rahmat kepada mereka.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2014
DAFTAR ISI DAFTAR TABEL ix DAFTAR GAMBAR ix DAFTAR LAMPIRAN ix PENDAHULUAN Latar Belakang 1 Tujuan Penelitian 2 TINJAUAN PUSTAKA 3
Tandan Kosong Kelapa sawit 3
Lignoselulosa 4
Biodegradasi Lignin 5
Jamur Pelapuk Kayu 6
Biologi Trichoderma 7
METODE PENELITIAN 10
Lokasi dan Waktu Penelitian 10
Bahan Penelitian 10
Prosedur Percobaan 10
Pembuatan Kultur Jamur Pelapuk Kayu Isolat JPA dan
Trichoderma sp. S2-2
10 Uji Lignolitik dan Selulolitik Jamur Pelapuk Kayu Isolat JPA
dan Trichoderma sp. S2-2
10 Pembuatan Bibit Jamur Pelapuk Kayu Isolat JPA dan
Trichoderma sp. S2-2
10
Penyiapan Media Perlakuan 11
Degradasi TKKS oleh Jamur Pelapuk Kayu Isolat JPA dan
Trichoderma sp. S2-2 11
Pertumbuhan Jamur Pelapuk Kayu Isolat JPA dan Trichoderma
sp. S2-2 pada TKKS yang Telah Dikomposkan 11
HASIL DAN PEMBAHASAN 13
Pembuatan Kultur Jamur Pelapuk Kayu Isolat JPA dan
Trichoderma sp. S2-2
13 Uji Lignolitik dan Selulolitik Jamur Pelapuk Kayu Isolat JPA dan
Trichoderma sp. S2-2
13 Degradasi TKKS oleh Jamur Pelapuk Kayu Isolat JPA dan
Trichoderma sp. S2-2 14
Pertumbuhan Jamur Pelapuk Kayu Isolat JPA dan
Trichoderma sp. S2-2 pada TKKS yang Telah Dikomposkan 18
SIMPULAN 21
DAFTAR PUSTAKA 22
DAFTAR TABEL
1 Persentase dan lama kolonisasi jamur pelapuk kayu isolat JPA dan
Trichoderma sp. S2-2 pada substrat TKKS
14
2 Kandungan lignin dan selulosa TKKS yang telah didegradasi selama
delapan minggu
16
3 Kandungan C, N, dan rasio C/N TKKS setelah degradasi selama delapan
minggu 17
4 Kandungan lignin, selulosa, C, N, dan rasio C/N pada TKKS yang telah
dikomposkan dengan dekomposer Promi selama0, 4, 6, 8, dan 10 minggu 18
5 Kolonisasi isolat JPA pada TKKS yang dikomposkan selama 4, 6, 8, dan
10 19
6 Kolonisasi isolat Trichoderma sp. S2-2 pada TKKS yang dikomposkan
selama 4, 6, 8, dan 10 19
DAFTAR GAMBAR
1 Limbah tandan kosong kelapa sawit dalam pengolahan minyak
kelapa sawit 3
2 Konfigurasi dinding sel tanaman 4
3 Satuan penyusun lignin 5
4 Kultur isolat JPA dan Trichoderma sp. S2-2 pada media ASK dan
pada media jagung 13
5 Aktivitas lignolitik isolat JPA dan Trichoderma sp. S2-2 pada media agar-agar air yang mengandung asam tanat setelah inkubasi 10x24 jam pada suhu ruang (±28oC)
13 6 Aktivitas selulolitik isolat JPA (a) dan Trichoderma sp. S2-2 (b)
pada media agar-agar air yang mengandung karboksimetil selulosa (CMC) setelah inkubasi 5x24 jam pada suhu ruang
(±28 oC) 14
7 Penurunan berat substrat TKKS setelah diinokulasi dengan isolat JPA dan Trichoderma sp. S2-2 dengan waktu inkubasi delapan
minggu 15
8 Kolonisasi isolat JPA (a) dan Trichoderma sp. S2-2 (b) pada perlakuan JPA+T setelah inkubasi 30 hari (1), 45 hari (2), dan 60
hari (3) 15
9 Kolonisasi isolat JPA dan Trichoderma sp. S2-2 setelah inkubasi 20 hari pada TKKS yang tidak dikomposkan (kontrol) dan yang
telah dikomposkan selama 4, 6, 8, dan 10 minggu 20
DAFTAR LAMPIRAN
1 TKKS hasil degradasi pada masing-masing perlakuan pada topik penelitian I
28 2 Tumpukan TKKS pada periode pengomposan 4, 6, 8, dan 10
minggu pada topik penelitian II 29
PENDAHULUAN Latar Belakang
Salah satu sumber daya yang memiliki potensi pengembangan yang sangat besar dan terpesat di Indonesia adalah di bidang perkebunan. Saat ini di Indonesia, kelapa sawit merupakan salah satu komoditas yang mengalami perkembangan terpesat. Produksi minyak kelapa sawit Indonesia pada tahun 2008 sebanyak 15 306 953 ton dari lahan seluas 3 496 700 ha. Jumlah ini meningkat 48.02% dibandingkan tahun 2004 yaitu sebesar 10.341.227 ton untuk luas lahan yang sama (BPS 2009).
Pabrik minyak kelapa sawit menghasilkan limbah padat tandan kosong kelapa sawit (TKKS) dalam jumlah besar sepanjang tahun. Menurut Away et al.
(1998) di Indonesia pada tahun 1997, ketersediaan TKKS sekitar 2.2 juta ton berat kering atau setara dengan 4 juta ton berat basah dan jumlah ini meningkat terus seiring dengan semakin meningkatnya produksi. Di seluruh Indonesia pada tahun 2010, luas areal penanaman kelapa sawit meningkat sebesar 27.31% dan setiap tahun areal tanaman kelapa sawit serta produksi minyaknya juga selalu meningkat (Sentana et al. 2010). Pabrik minyak kelapa sawit dengan kapasitas olah 30 ton/jam TBS dan rata-rata beroperasi selama 20 jam/hari, akan menghasilkan limbah padat TKKS sebanyak 120 ton. Setiap pengolahan 1 ton TBS akan dihasilkan TKKS sebanyak 22–23% TKKS atau sebanyak 220 – 230 kg TKKS. Limbah ini belum dimanfaatkan secara baik oleh sebagian besar pabrik kelapa sawit (PKS) di Indonesia (Ningtyas dan Astuti 2009). Menurut Darnoko et al. (1993) karakteristik TKKS adalah mempunyai ukuran besar, didominasi oleh bahan-bahan yang sulit melapuk yaitu 45.95% selulosa, 22.84% hemiselulosa, 16.45% lignin dan mempunyai nisbah C/N yang tinggi. Komposisi dari bahan-bahan penyusun ini dapat bervariasi tergantung pada jenis persilangan, umur tanaman kelapa sawit dan kondisi lingkungan pertumbuhan tanaman kelapa sawit tersebut.
Selulosa merupakan bagian yang dapat digunakan untuk menghasilkan berbagai jenis produk seperti bioetanol, pakan ternak, dan membran selulosa (Lindu et al. 2008). Namun demikian, perolehan selulosa pada beberapa tanaman dapat dilakukan apabila lapisan lignin dihilangkan atau didegradasi terlebih dahulu (Bayer et al. 1994). Degradasi lignin dapat dilakukan melalui proses kimiawi, fisika, dan biologi. Silverstein et al. (2007) menyatakan bahwa NaOH, H2SO4, H3O, dan O3 dapat digunakan untuk mendegradasi lignin. Dalam
penelitiannya, penggunaan NaOH % dapat menurunkan kandungan lignin hingga 65%. .
Perolehan selulosa dengan menggunakan mikrob merupakan salah satu alternatif yang dapat ditempuh sebab selain biaya yang rendah juga merupakan cara yang dianggap lebih ramah lingkungan. Selain itu TKKS hasil degradasi yang diperoleh dapat dijadikan sebagai bahan kompos yang mampu meningkatkan unsur hara dalam tanah. Jamur pelapuk kayu merupakan jamur yang dapat mendegradasi kayu dengan bantuan enzim lignolitik yang terdiri dari lignin peroksidase (LiP), mangan peroksidase (MnPs) dan lakase (Srinivasan et al. 1995). Jamur pelapuk kayu dapat digunakan dalam bioteknologi seperti pada
Namun demikian, penggunaan bahan kimia tersebut dapat mencemari lingkungan. Selain itu bahan kimia dari golongan asam dapat menyebabkan korosif
2
proses biopulping dan biobleaching, desulfurisasi minyak bumi dan batu bara serta delignifikasi limbah pertanian (Dosoretz et al. 1993). Proses degradasi lignin oleh jamur pelapuk kayu juga berguna untuk bioremediasi (Hasibuan 2007).
Trichoderma merupakan cendawan yang memiliki aktivitas selulolitik cukup tinggi, karena berperan dalam menghidrolisis selobiosa dan selooligosakarida yang terdapat di dalam selulosa menjadi glukosa melalui aktivitas enzim selulase yang terdiri dari enzim eksoglukonase 1,4 glikanhidrolase), dan selubiose (β-glukosidase) (Goksyor dan Ericsen 1980).
Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Menganalisis kemampuan jamur pelapuk kayu isolat JPA dan Trichoderma sp. S2-2 dalam mendegradasi TKKS untuk menghasilkan selulosa.
2. Mengamati pertumbuhan jamur pelapuk kayu isolat JPA dan Trichoderma
3
TINJAUAN PUSTAKA Tandan Kosong Kelapa sawit
Dalam proses pengolahan minyak kelapa dari kelapa sawit (Crude Palm Oil), dihasilkan juga tandan kosong kelapa sawit (TKKS) yang limbahnya cukup berlimpah (Gambar 1). Dengan perkiraan bahwa 24-35 % dari tandan buah segar (TBS) kelapa sawit adalah TKKS, maka berat limbah TKKS yang dihasilkan pada tahun 1991 adalah sebesar 953 000 ton (Sa’id. 1996). Away et al (1998), mengemukakan bahwa TKKS memiliki rata-rata panjang dan lebar masing-masing 50 dan 35 cm, dengan bobot basah mulai beberapa kilogram hingga 100 kg.
Gambar 1 Limbah tandan kosong kelapa sawit dalam pengolahan minyak kelapa sawit (Ghaida 2012)
Sebagai limbah hasil pertanian yang mengandung bahan lignoselulosa sangat tinggi, TKKS sampai sekarang belum didayagunakan secara optimal. Selama ini TKKS dibakar dan abunya dimanfaatkan sebagai pupuk. Selain nilai ekonominya yang relatif rendah, aktivitas pembakaran TKKS juga menimbulkan pencemaran udara (Sa’id 1996).
Ketersedian TKKS cukup besar sejalan dengan peningkatan jumlah dan kapasitas pabrik kelapa sawit (PKS) untuk menyerap TBS yang dihasilkan (Darnoko et al. 2002). Salah satu potensi TKKS yang cukup besar adalah sebagai bahan pembenah tanah dan sumber hara bagi tanaman. Potensi ini didasarkan pada materi TKKS yang merupakan bahan organik dengan kandungan hara yang cukup tinggi. Tandan kosong kelapa sawit mengandung 42.8 % C, 2.90 % K2O, 0.80 % N, 0.22 % P2O5, 0.30 % MgO dan unsur-unsur mikro antara lain 10 ppm B, 23 ppm Cu, dan 51 ppm Zn (Singh et al. 1990). Cangkang buah kelapa sawit merupakan hasil pecahan tempurung biji kelapa sawit. Limbah berupa cangkang sebesar 5 % dari TBS. Limbah ini biasanya digunakan sebagai bahan bakar ketel. Pada umumnya cangkang digunakan sebagai tambahan pada bahan bakar serabut sampai 15 %. Cangkang mempunyai kelebihan, karena dapat digunakan sebagai bahan pelapis dan pengeras permukaan badan jalan di kebun. Cangkang juga
4
dapat digunakan sebagai bahan baku pembuatan arang yang selanjutnya digunakan untuk pembuatan karbon aktif. Serat (serabut) kelapa sawit merupakan salah satu limbah padat PKS. Limbah serat pada PKS sebanyak 15% dari TBS. Serat sawit diperoleh setelah pemisahanq AQ biji dari serabut. Bentuknya halus dan memiliki kadar air yang cukup rendah. Banyaknya serat sawit adalah 15 % dari TBS dengan kadar zat kering 62% (Mangoensoekardjo dan Semangun 2005).
Lignoselulosa
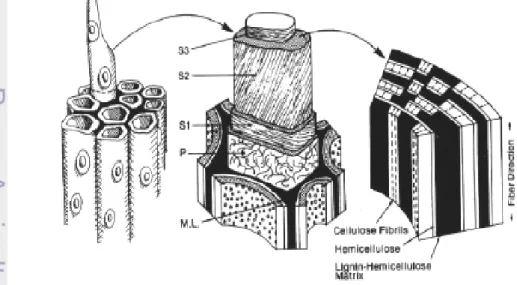
Lignoselulosa merupakan komponen utama tanaman yang menggambarkan jumlah sumber bahan organik yang dapat diperbaharui. Lignoselulosa terdiri dari selulosa, hemiselulosa, lignin dan beberapa bahan ekstraktif lain. Semua komponen lignoselulosa terdapat pada dinding sel tanaman. Susunan dinding sel tanaman (Gambar 2) terdiri dari lamela tengah (M), dinding primer (P) dan dinding sekunder (S) yang terbentuk selama pertumbuhan dan pendewasaan sel, terdiri dari lamela transisi (S1), dinding sekunder utama (S2) dan dinding sekunder bagian dalam (S3) (Perez et al. 2002). Dinding primer mempunyai ketebalan 0.1-0.2 μm dan mengandung jaringan mikrofibril selulosa yang mengelilingi dinding sekunder dan relatif lebih tebal (Chahal dan Chahal 1998). Pada setiap lapisan dinding sekunder selulosa terbentuk sebagai lembaran tipis yang tersusun oleh rantai panjang residu β-D-glukopiranosa yang berikatan melalui ikatan β-1,4 glukosida yang disebut serat dasar (elementary fiber). Sejumlah serat dasar jika terjalin secara lateral akan membentuk mikrofibril. Mikrofibril mempunyai struktur dan orientasi yang berbeda pada setiap lapisan dinding sel (Perez et al. 2002). Lapisan dinding sekunder terluar (S1) mempunyai struktur serat menyilang, lapisan S2 mempunyai mikrofibril yang paralel terhadap poros lumen, lapisan S3 mempunyai mikrofibril yang berbentuk heliks. Mikrofibril dikelilingi oleh hemiselulosa dan lignin. Bagian antara dua dinding sel disebut lamela tengah (M) dan diisi dengan hemiselulosa dan lignin. Hemiselulosa dihubungkan oleh ikatan kovalen dengan lignin. Selulosa secara alami terproteksi dari degradasi dengan adanya hemiselulosa dan lignin.
5
Lignin merupakan polimer dengan struktur aromatik (Gambar 3) yang berat molekulnya tinggi (Stevenson 1982), terbentuk melalui unit-unit penilpropan (Sjorberg 2003), konifenil alkohol, dan sinafil alkohol (Stevenson 1982) yang berhubungan secara bersama oleh beberapa jenis ikatan yang berbeda (Perez et al. 2002). Keberadaan unit-unit tersebut tergantung pada sifat dan jenis tanaman (Stevenson 1982). Lignin sulit didegradasi karena strukturnya yang kompleks dan heterogen, berikatan dengan selulosa dan hemiselulosa dalam jaringan tanaman. Lebih dari 30% tanaman tersusun atas lignin, sehingga memberikan bentuk yang kokoh terhadap tanaman dan memberikan proteksi terhadap serangan serangga dan patogen (Orth et al. 1993).
Para Kumaril Alkohol Koniferil Alkohol Sinapil Alkohol Model Kerangka C
Gambar 3 Satuan penyusun lignin (Steffen 2003)
Disamping memberikan bentuk yang kokoh terhadap tanaman, lignin juga membentuk ikatan yang kuat dengan polisakarida, melindungi polisakarida dari degradasi mikroorganisme, dan membentuk struktur lignoselulosa. Lignin terutama terkonsentrasi pada lamela tengah dan lapisan S2 dinding sel yang terbentuk selama proses lignifikasi jaringan tanaman (Chahal dan Chalal 1998). Lignin tidak hanya mengeraskan mikrofibril selulosa, tetapi juga berikatan secara fisik dan kimia dengan hemiselulosa.
Selulosa merupakan komponen utama penyusun dinding sel tanaman. Kandungan selulosa pada dinding sel tanaman tingkat tinggi sekitar 35-50% dari berat kering tanaman (Lynd et al. 2002). Selulosa merupakan polimer glukosa dengan ikatan β-1,4 glukosida dalam rantai lurus. Bangun dasar selulosa berupa suatu selobiosa yaitu dimer dari glukosa. Rantai panjang selulosa terhubung secara bersama melalui ikatan hidrogen yang berikatan silang (Bequin dan Aubert 1994) dan gaya van der Waals (Perez et al. 2002). Selulosa mengandung sekitar 50-90% bagian berkristal dan sisanya bagian amorf (Aziz et al. 2002). Ikatan β-1,4 glukosida pada serat selulosa dapat dipecah menjadi monomer glukosa dengan cara hidrolisis asam atau enzimatis.
Biodegradasi Lignin
Ligninolitik adalah keadaan jamur mengeluarkan enzim yang dapat mendegradasi lignin. Pada jamur pelapuk putih, enzim yang dikeluarkan adalah
6
peroksidase. Phanerochaete chrysosporium mengeluarkan enzim hemeperoksidase, yaitu lignin peroksidase (LiP) dan mangan peroksidase (MnP). Jamur ini telah dipertimbangkan dalam produksi enzim untuk degradasi lignin dalam penerapan proses biokonversi lignoselulosa. (Johjima et al. 1999).
Dalam kerjanya, enzim peroksidase terlebih dahulu dioksidasi oleh H2O2,
yang juga dihasilkan oleh jamur, untuk membentuk suatu zat antara. Zat ini selanjutnya direduksi oleh sebuah elektron dan membentuk zat kedua yng bersifat radikal. Selanjutnya zat kedua mengoksidasi substrat berikutnya dengan satu elektron sehingga siklus katalitis tersebut lengkap. Senyawa veratril alkohol merupakan metabolit sekunder yang juga dihasilkan oleh jamur. Beberapa substrat tertentu yang tidak dapat dioksidasi oleh lignin peroksidase akan teroksidasi jika di dalam campuran terdapat veratril alkohol. H2O2 dan veratril alkohol
merupakan mediator dalam proses biodelgnifikasi ini (Koduri dan Tien 1994).
Jamur Pelapuk Kayu
Jamur pelapuk kayu merupakan cendawan yang dapat menguraikan komponen kayu (lignoselulosa) dan tergolong kelompok basidiomiset. Basidiomiset pendegradasi lignoselulosa terdiri dari dua grup utama yaitu jamur pelapuk coklat (brown-rot fungi) dan jamur pekapuk putih (white-rot fungi). jamur pelapuk coklat melepaskan selulosa dari substrat tapi masih meninggalkan polimer lignin, sedangkan jamur pekapuk putih melepaskan selulosa dari substrat dan mendegradasi lignin melalui aktivitas enzimatik. Jamur pelapuk kayu dapat digunakan dalam bioteknologi seperti dalam proses biopulping dan biobleaching. Jenis jamur ini mendegradasi substrat kayu menjadi bahan-bahan organik yang lebih sederhana melalui proses hidrolisis enzimatis (Widyastuti et al. 2007), sehingga dapat digunakan oleh mikroorganisme lainnya termasuk oleh tanaman (Santi 2006). Menurut Supardjo (2008) jamur yang mampu mendegradasi lignin berasal dari kelompok jamur pekapuk putih, jamur pelapuk coklat, dan jamur pelapuk lunak (soft-rotfungi).
Jamur pelapuk putih tergolong kelompok basidiomiset dan askomiset. Jamur ini dapat mendegradasi lignin secara lebih cepat dan ekstensif dibanding dengan mikroorganisme lain. Substrat bagi pertumbuhan jamur ini adalah selulosa dan hemiselulosa dan degradasi lignin terjadi pada akhir pertumbuhan primer melalui metabolisme sekunder dalam kondisi defisiensi nutrien seperti nitrogen, karbon atau sulfur (Hatakka 2001). Aktivitas enzimatik jamur merupakan proses oksidatif dan tidak spesifik, dengan mengurangi kandungan metoksi, fenolik dan alifatik lignin, memecah cincin aromatik dan membentuk grup karbonil baru (Kirk dan Farrell 1987; Hatakka 2001). Perubahan molekul lignin ini mengakibatkan depolimerasi dan produksi karbon dioksida. Tingkat dan laju pengurangan polisakarida dan lignin dari substrat dapat berbeda diantara spesies jamur pelapuk putih (Adaskaveg et al. 1995). Jamur ini ada yang mampu mendegradasi lignin secara selektif, tetapi ada juga yang non-selektif (Hatakka 2001). Jamur pelapuk putih selektif (Ceriporiopsis subvermispora, Dichomitus squalens, Phanerochaete chrysosporium, Phlebia radiata), mendegradasi lignin dan hemiselulosa lebih banyak dibandingkan selulosa, sedangkan jamur pelapuk putih non-selektif (Trametes versicolor dan Fomes fomentarius), mendegradasi semua komponen lignoselulosa dalam jumlah yang sama (Hatakka 2001).
7
Jamur pelapuk coklat terutama terglong kelompok basidiomiset. Jamur ini mendegradasi selulosa dan hemiselulosa sangat efisien dengan mekanisme yang berbeda dari organisme lain yang melibatkan reaksi non enzimatik dan tanpa enzim eksoglukonase (Blanchette 1995). Keberadaan lignin memacu degradasi selulosa oleh jamur pelapuk coklat meskipun lignin didegradasi dalam tingkat yang lebih rendah terutama pada lamela tengah dinding sel yang kaya lignin (Hatakka 2001). Polyporus ostreiformis mampu menghasilkan enzim MnP and LiP, tetapi kemampuannya dalam mendegradasi lignin lebih rendah dibanding P. chrysosporium (Dey et al. 1994).
Jamur pelapuk lunak terutama hanya terdapat pada daerah dengan lingkungan yang ekstrim bagi jamur pelapuk yang tergolong kelompok basidiomiset, misalnya lingkungan yang terlalu basah atau terlalu kering (Blanchette et al. 1991, Blanchette 1995). Jamur ini juga mempunyai tingkat toleransi yang lebih baik terhadap temperatur, pH dan keterbatasan oksigen dibandingkan dengan jamur pelapuk lain (Daniel dan Nilsson 1998). Jamur pelapuk lunak dapat berkembang pada tanah, kompos, kayu, jerami dan daerah perairan (Tuomela 2002). Penambahan nitrogen dalam substrat mampu meningkatkan laju perombakan lignin, berlawanan dengan sifat jamur pelapuk putih dan coklat (Daniel dan Nilsson 1998).
Mekanisme awal dimulai dengan dihasilkannya enzim untuk mendegradasi lignin pada substrat kayu, sehingga bagian kayu menjadi lunak dan pecah seperti dinding yang tercerai berai. Kemudian enzim akan menyerang dinding sel yang berdifusi melalui lumen sel (Sachs et al. 1990). Jamur pelapuk kayu menghasilkan enzim ekstraseluler LiP, MnP, dan lakase yang berperan dalam pelapukan kayu, pendegradasi sampah, dan lignin (Bajpai 1999).
Biologi Trichoderma
Trichoderma merupakan cendawan yang memiliki pertumbuhan cepat, mampu memanfaatkan substrat dan resisten terhadap bahan kimia berbahaya yang berbahaya (Klein 1998). Trichoderma sering ditemukan sebagai microflora tanah yang dominan pada berbagai ekosistem seperti pertanian, padang rumput, rawa, dan gurun, disemua zona iklim (Danielson dan Davey 1973;
Pertumbuhan Trichoderma pada media Potato Sucrose Agar (PSA) sangat cepat yaitu setelah 3-4 hari inkubasi pada suhu kamar (27
Roiger et al. 1991; Wardle et al. 1993; Smith 1995).
o
C) mampu memenuhi cawan Petri berdiameter 7-9 cm, pertumbuhan hifa datar dan membentuk daerah melingkar yang berwarna hijau terang sampai gelap, kemudian koloni menjadi seperti beludru sampai menjadi tepung dan membentuk cincin konsentris.
Trichoderma memiliki aktivitas. Di alam, Trichoderma banyak ditemukan baik di tana maupun tanah pertanian atau pada substrat
berkayu. Trichoderma berbeda-beda
tergantung pada spesiesnya (Danielson dan Davey 2002).
Reproduksi aseksual Trichoderma menggunakan terdapat pada akan membent Pada ujung cabang terdapat dapat sama dengan cabang utama ataupun lebih kecil. Fialid dapat terletak pada ujung cabang konidiofor ataupun pada cabang utama. Konidium secara umum
8
bening atau kuning. Bentuknya secara umum adalah elips, jarang ditemukan bentuk
Trichoderma memproduksi klamidospora. Bentuknya secara umum
Trichoderma dalam memproduksi
merupakan aspek penting dalam proseset al. 1996). Beberapa spesies Trichoderma dapat tumbuh baik pada maupun pada temperatur cukup tinggi. Biakan murni Trichoderma dapat tumbuh cepat pada suhu 25-30 °C, namun pada suhu 35 °C cendawan ini tidak dapat tumbuh. Perbedaan suhu mempengaruhi produksi seperti
Kemampuan Trichoderma merespon 2 juga
bervariasi. Namun secara umum apabila kandungan CO2 meningkat, maka pH
untuk pertumbuhan akan berubah menjadi semakin basa. Di udara, pH optimum bagi Trichoderma berkisar antara 3-7. Faktor lain yang mempengaruhi
pertumbuhan Trichoderma adal
terlalu berpengaruh. Penambahan senyawa triterpenoid seperti azadirakhtin diketahui dapat menghambat pertumbuhan Trichoderma (Azarkan et al. 1997). Melalui uj merupakan sumberTrichoderma, sedangkan pada beberapa spesies sumber nitrogennya berasal dari ekstrak dan Davey 2002).
Trichoderma merupakan cendawan yang memiliki aktivitas selulolitik cukup tinggi, karena memproduksi enzim selulase yang terdiri dari enzim eksoglukonase (β-1,4 glikanhidrolase), dan selubiose (β-glukosidase) (Goksyor 1980) yang berperan dalam hidrolisis selubiosa menjadi glukosa (Smith et al. 1983; Wirahadikusumah et al. 1995). Soepardi (1983) menyatakan bahwa
Trichoderma dapat menghancurkan atau mendegradasi selulosa, gum, pati, dan senyawa-senyawa organik yang mudah larut seperti protein dan gula.
Pada beberapa penelitian diperoleh hasil bahwa Trichoderma berperan sebagai agens pengendali hayati dan dalam proses pengomposan. Beberapa spesies dari genus ini memiliki kemampuan dalam menghasilkan enzim dan antibiotik (Rossman 1996). Trichoderma juga menghasilkan sejumlah bioaktif seperti glioviridin, seskuiterpenoid, trichothecenes, peptida siklik, isosianida yang mengandung metabolit (trikoviridin). Disamping mampu menghambat mikrob lain, metabolit tersebut berperan dalam menghambat mikrob selulolitik pada rumen domba (Brewer et al. 1982). Interaksi antara Trichoderma dan mikrob lainnya adalah kompleks, mencakup kompetisi dalam perolehan nutrisi, proses litik dari enzim, disamping antibiosis/simbiosis dan fungistatik (Wardle et al. 1993). Dalam proses pengomposan, Trichoderma mampu menurunkan rasio C/N. Suhartatik (1999) menyatakan bahwa Trichoderma dapat menurunkan nisbah C/N menjadi lebih rendah dari 20 pada minggu ke-4 setelah inokulasi. Selanjutnya Mala (1994) melaporkan bahwa pengomposan dengan menggunakan galur
Trichoderma 53.3 mampu menurunkan nisbah C/N menjadi 20 kurang dari 20 hari pengomposan.
Hasil percobaan yang dilakukan oleh Hersanti (2009) menunjukkan bahwa 100% kompos sampah yang dikombinasikan dengan Trichoderma menyebabkan
9
peningkatan populasi Trichoderma. Campuran kompos sampah dan Trichoderma
pada perlakuan yang diuji mampu menekan penyakit rebah kecambah pada persemaian padi organik.
Menurut Purwantisari et al. (2004) pada kondisi rumah kaca, Trichoderma lignosum pada media tanah tanaman kentang dapat menekan serangan patogen
Phytopthora infestans yang ditandai dengan menurunnya indeks kelayuan daun selama 3 bulan umur pertumbuhan tanaman.
Trichoderma mempunyai sifat mudah didapat, penyebarannya luas, toleran terhadap zat penghambat pertumbuhan, tumbuh cepat, kompetitif dan menghasilkan konidium yang berlimpah, sehingga mempermudah penyediaan cendawan tersebut sebagai agens pengendali hayati (Alfian 1990).
10
METODE PENELITIAN
Lokasi dan Waktu Penelitian
Penelitian telah dilakukan di Kampus Darmaga Institut Pertanian Bogor dari Januari 2012 sampai dengan Desember 2013. Penentuan kandungan C-organik dan N-total dilaksanakan di Laboratorium Departemen Ilmu Tanah dan Sumber Daya Lahan IPB, sedangkan penentuan kandungan lignin dan selulosa dilaksanakan di Laboratorium Ilmu dan Teknologi Pakan, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan IPB.
Bahan Penelitian
Bahan yang digunakan adalah tandan kosong kelapa sawit (TKKS) yang diperoleh dari PT. Perkebunan Nusantara VIII, karboksimetil selulosa (CMC), asam tanat 1%, dekomposer Promi yang mengandung isolat T. harzianum DT 38,
T. pseudokoningii DT 39, Aspergillus sp., cendawan pelapuk putih, isolat
Trichoderma sp.S2-2, jamur pelapuk kayu isolat JPA (Koleksi Dr. Ir. Lisdar I. Sudirman, Bagian Mikologi, Departemen Biologi, Fakultas MIPA, IPB).
Prosedur Percobaan
Pembuatan kultur jamur pelapuk kayu isolat JPA dan Trichoderma sp. S2-2
Semua isolat disimpan dalam bentuk biakan murni pada media agar-agar miring sukrosa kentang (ASK) dengan komposisi terdiri dari 1 L akuades, 200 g kentang, 20 g gula pasir, 500 mg antibiotik kloramfenikol, dan 20 g bacto agar. Media tersebut juga digunakan sebagai media untuk meremajakan atau perbanyakan biakan murni di media agar-agar cawan.
Uji lignolitik dan selulolitik jamur pelapuk kayu isolat JPA dan
Trichoderma sp. S2-2
Uji lignolitik menggunakan media agar cawan yang terdiri atas agar-agar air (20 g/L) yang mengandung asam tanat 1%, sedangkan uji selulolitik menggunakan media agar-agar cawan yang terdiri dari agar-agar air (20 g/L) yang mengandung karboksimetil selulosa (CMC) 1%. Kedua isolat tersebut masing-masing diinokulasikan pada kedua media agar-agar cawan dan diinkubasi selama 10 hari. Pengamatan aktivitas lignolitik dilakukan dengan melihat keberadaan zona berwarna coklat di sekitar koloni (Amrullah et al. 2011), sedangkan aktivitas selulolitik dilihat kemampuan kedua isolat tumbuh pada media (Lamid et al. 2011).
Pembuatan bibit jamur pelapuk kayu isolat JPA dan Trichoderma sp. S2-2
Media bibit induk dibuat dari biji jagung kering simpan yang digiling dengan ukuran sekitar 0.5 cm kemudian direbus hingga merekah dengan air ledeng sebanyak 450 mL/kg biji jagung atau air menutupi permukaan jagung, dan ditempatkan didalam botol (volume 250 mL) sebanyak 185 g. Selanjutnya, media jagung tersebut disterilkan di dalam autoklaf pada suhu 121 oC, tekanan 15-20 psi selama 15 menit, kemudian didinginkan selama satu malam. Inokulasi dilakukan dengan menggunakan satu koloni jamur berukuran 4 x 1 cm dari media agar-agar cawan ASK yang berumur 10 hari. Botol dan substrat yang sudah diinokulasi diinkubasi pada suhu sekitar 26-28 oC sampai seluruh substratnya ditumbuhi miselium (12-14 hari).
11
Penyiapan media perlakuan
Media perlakuan berupa TKKS yang terlebih dahulu dicacah hingga berbentuk serabut, kemudian direndam dalam air ledeng selama 1x24 jam dan ditiriskan dalam karung plastik (polipropilena) pada kondisi tertutup dan dasar karung tidak menyentuh lantai selama 6 jam. Selanjutya dibuat substrat pertumbuhan kedua isolat dengan berat 500 g yang terdiri dari 81% TKKS, 15% dedak, 1.5% gipsum, dan 1.5% kapur. Kadar air substrat diatur hingga 70% (Winarni dan Rahayu 2002). Penentuan kadar air dilakukan dengan menggunakan metode kering oven. Selanjutnya substrat dimasukkan kedalam kantong plastik polietilena (35x20 cm), tebal 1 mm, dan pada bagian ujung kantong diberi cincin berupa bambu (diameter 4.5 cm). Kantong yang telah berisi substrat ditutup dengan kapas, kemudian ditutup kembali dengan kertas HVS lalu disterilisasi di dalam autoklaf pada suhu 121 oC, tekanan 15-20 psi selama 2 jam. Substrat kemudian didinginkan selama ±12 jam.
Topik I: Degradasi TKKS oleh jamur pelapuk kayu isolat JPA dan
Trichoderma sp. S2-2
Rancangan percobaan yang digunakan yaitu Rancangan Acak Lengkap (RAL) dengan satu faktor yaitu jenis isolat dan terdiri dari empat perlakuan inokulasi yaitu: isolat JPA (JPA); Trichoderma sp. S2-2 (T); isolat JPA dan
Trichoderma sp. S2-2 bersama-sama (JPA+T). Pada perlakuan ke-4 isolat JPA
diinkubasi selama 4 minggu, kemudian disterilisasi di dalam autoklaf, suhu 121 oC, tekanan 15-20 psi selama 2 jam, didinginkan pada suhu ruang selama ±12 jam, dan diinokulasi dengan Trichoderma sp. S2-2 [(JPA)+T]. Sebagai kontrol (K), yaitu substrat tidak diinokulasi dengan isolat cendawan. Semua substrat yang telah diinokulasi selanjutnya diinkubasi selama delapan minggu pada suhu ruang (±28 oC). Pada akhir inkubasi, substrat dikeringkan di dalam oven pada suhu 105 o
Penurunan kandungan lignin =
C selama 12 jam dan substrat dibalik setiap 3 jam. Penurunan berat substrat ditentukan dengan menghitung selisih antara berat kering sebelum degradasi dan berat kering setelah degradasi. Kandungan lignin, sellulosa, C, N, dan C/N pada substrat ditentukan pada akhir inkubasi (Kasli 2008). Penurunan kandungan lignin dan tingkat degradasi ditentukan dengan rumus berikut :
LSB – LST Tingkat degradasi = LK- LST
Keterangan:
LSB : Kandungan lignin sebelum degradasi LST : Kandungan lignin setelah degradasi LK : kandungan lignin substrat kontrol
Topik II: Pertumbuhan jamur pelapuk kayu isolat JPA dan Trichoderma sp. S2-2 pada TKKS yang telah dikomposkan
x 100% LK
Rancangan percobaan yang digunakan adalah RAL dengan satu faktor yaitu lama pengomposan yang terdiri dari empat perlakuan, yaitu 4 , 6, 8, dan 10
12
minggu. Data dianalisis dengan ANOVA dengan nilai alpha 5% dan uji lanjut dengan Tukey.
Pada percobaan ini, setiap tumpukan TKKS yang telah dicacah direndam selama 1x24 jam dan ditiriskan dalam karung dengan keadaan tertutup dan tergantung selama 6 jam. TKKS kemudian dibagi menjadi empat tumpukan dengan panjang, lebar, dan tinggi tumpukan masing-masing berukuran 0.75 x 0.75 x 1 m. Setiap tumpukan terdiri dari lima lapis dan diberi 5 L dekomposer promi (1 L setiap lapisan) dengan konsentrasi 5%. Semua tumpukan ditutup dengan terpal dan masing-masing dikomposkan selama 4, 6, 8, dan 10 minggu dan dilakukan pembalikan tumpukan dua minggu sekali. Sebagai kontrol, tumpukan TKKS yang tidak dikomposkan. Pada akhir masa pengomposan, TKKS dikeringkan dengan bantuan sinar matahari selama 2x24 jam, kemudian direndam kembali selama 1x24 jam dan ditiriskan dalam karung dengan keadaan tertutup dan tergantung selama 5 jam. Selanjutnya dibuat substrat yang terdiri atas 81% TKKS, 15% dedak, 1.5% gipsum, dan 1.5% kapur dengan kadar air 70%. Sebanyak 500 g substrat tersebut dimasukkan kedalam kantong dengan 20 ulangan (20x500 g). Sebanyak 10 ulangan diinokulasi dengan isolat JPA, sedangkan 10 ulangan lainnya diinokulasi dengan Trichoderma sp. S2-2. Pengamatan pertumbuhan kedua isolat pada substrat dilakukan setiap 5 hari dengan mengukur panjang koloni (cm) dan persentase kolonisasi substrat dengan menggunakan rumus berikut:
Panjang koloni (cm) =
4
Sisi A+Sisi B+Sisi C+Sisi D
Kolonisasi (%) = Panjang koloni x 100
Panjang kantong Keterangan:
Sisi A = Panjang koloni pada sisi depan kantong Sisi B = Panjang koloni pada sisi belakang kantong Sisi C = Panjang koloni pada sisi kanan kantong Sisi D = Panjang koloni pada sisi kiri kantong
13
HASIL DAN PEMBAHASAN
Pembuatan Kultur Jamur Pelapuk Kayu Isolat JPA dan
Trichoderma sp. S2-2
Pada media ASK, isolat JPA tumbuh lebih lambat dari pada Trichoderma
sp. S2-2. Isolat JPA tumbuh memenuhi cawan Petri (diameter 9 cm) setelah inkubasi 8 hari, sedangkan Trichoderma sp. S2-2 memenuhi cawan setelah inkubasi 5 hari. Pada media jagung, isolat JPA juga tumbuh lebih lambat daripada
Trichoderma sp. S2-2, yaitu isolat JPA selama 14 hari, sedangkan Trichoderma
sp. S2-2 selama 10 hari (Gambar 4). Hal ini membuktikan bahwa pertumbuhan
Trichoderma sp. lebih cepat daripada isolat JPA.
(1) (2) (1) (2)
(a) (b)
Gambar 4 Kultur jamur pelapuk kayu isolat JPA (1) dan Trichoderma sp. S2-2 (2)
pada media ASK (a) dan pada media jagung (b)
Uji Lignolitik dan Selulolitik Jamur Pelapuk Kayu Isolat JPA dan
Trichoderma sp. S2-2
Hasil uji lignolitik isolat JPA dan Trichoderma sp. S2-2 menunjukkan bahwa kedua isolat tersebut memiliki aktivitas lignolitik yang ditandai dengan zona berwarna cokelat pada media (Gambar 5).
a b
Gambar 5 Aktivitas lignolitik jamur pelapuk kayu JPA (a) dan Trichoderma sp. S2-2 (b)
pada media agar-agar air yang mengandung asam tanat setelah inkubasi 10x24
jam pada suhu ruang (±28 o
Diameter zona berwarna cokelat yang terbentuk pada media asam tanat yang ditumbuhi oleh isolat JPA dan Trichoderma sp. S2-2 setelah 5x24 jam inkubasi masing-masing adalah 6 dan 2.2 cm. Setelah 10x24 jam inkubasi, media
C)
14
yang ditumbuhi oleh isolat JPA dan seluruhnya telah berwarna cokelat dengan diameter 8.5 cm sedangkan diameter zona berwarna cokelat pada media yang ditumbuhi oleh Trichoderma sp. S2-2 adalah 3.5 cm atau belum memenuhi media. Hal ini menunjukkan bahwa aktivitas lignolitik isolat JPA lebih tinggi daripada
Trichoderma sp. S2-2. Asam tanat digunakan sebagai pendekatan dalam proses degradasi lignin, karena asam tanat memiliki struktur molekul yang hampir sama dengan struktur molekul lignin (Amrullah et al. 2013).
Hasil uji selulolitik (Gambar 6) menunjukkan bahwa setelah inkubasi 5x24 jam, isolat JPA dan Trichoderma sp. S2-2 mampu tumbuh pada media agar-agar air yang mengandung CMC masing-masing dengan panjang koloni 4 dan 9 cm. Hal ini menunjukkan bahwa aktivitas selulolitik Trichoderma sp. S2-2 lebih baik daripada isolat JPA. Lamid et al. (2011) mengatakan bahwa kemampuan selulolitik dapat dilihat dari kemampuan tumbuh pada media CMC.
a b
Gambar 6 Aktivitas selulolitik jamur pelapuk kayu isolat JPA (a) dan Trichoderma sp.
S2-2 (b) pada media agar-agar air yang mengandung karboksimetil selulosa
(CMC) setelah inkubasi 5x24 jam pada suhu ruang (±28 o
Perlakuan
C)
Topik I: Degradasi TKKS oleh jamur pelapuk kayu isolat JPA dan
Trichoderma sp. S2-2
Pertumbuhan kedua isolat pada TKKS pada masing-masing perlakuan memiliki perbedaan dalam waktu tumbuh memenuhi substrat TKKS (Tabel 1). Selain itu, berat kering substrat (Gambar 7), kandungan lignin dan selulosa (Tabel 2), C, N, dan rasio C/N (Tabel 3) juga menunjukkan hasil yang berbeda dari keempat perlakuan.
Tabel 1 Persentase dan lama kolonisasi jamur pelapuk kayu isolat JPA dan
Trichoderma sp. S2-2 pada substrat TKKS
Kolonisasi dan lama kolonisasi (hari ke-)
Kontrol -
JPA 100% (35 hari)
T 100% (26 hari)
JPA+T*
25% JPA+75% Trichoderma sp.S2-2 (30 hari) 50% JPA+50% Trichoderma sp.S2-2 (45 hari) 75% JPA+25% Trichoderma sp.S2-2 (60 hari)
(JPA)+T** 100% JPA (35 hari)
100% Trichoderma sp. S2-2 (22 hari) *)
Jamur pelapuk kayu Isolat JPA dan Trichoderma sp. S2-2 diinokulasikan bersama-sama
**)
Jamur pelapuk kayu Isolat JPA diinkubasi selama 4 minggu kemudian disterilisasi dan diinokulasi dengan Trichoderma sp. S2-2
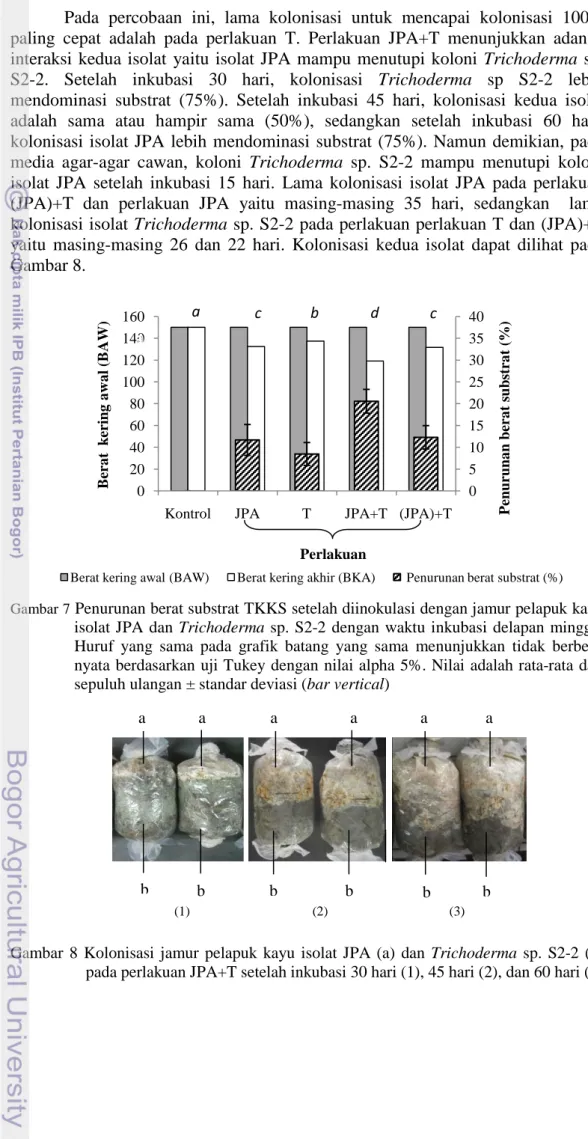
15
Pada percobaan ini, lama kolonisasi untuk mencapai kolonisasi 100% paling cepat adalah pada perlakuan T. Perlakuan JPA+T menunjukkan adanya interaksi kedua isolat yaitu isolat JPA mampu menutupi koloni Trichoderma sp. S2-2. Setelah inkubasi 30 hari, kolonisasi Trichoderma sp S2-2 lebih mendominasi substrat (75%). Setelah inkubasi 45 hari, kolonisasi kedua isolat adalah sama atau hampir sama (50%), sedangkan setelah inkubasi 60 hari, kolonisasi isolat JPA lebih mendominasi substrat (75%). Namun demikian, pada media agar-agar cawan, koloni Trichoderma sp. S2-2 mampu menutupi koloni isolat JPA setelah inkubasi 15 hari. Lama kolonisasi isolat JPA pada perlakuan (JPA)+T dan perlakuan JPA yaitu masing-masing 35 hari, sedangkan lama kolonisasi isolat Trichoderma sp. S2-2 pada perlakuan perlakuan T dan (JPA)+T yaitu masing-masing 26 dan 22 hari. Kolonisasi kedua isolat dapat dilihat pada Gambar 8.
Gambar 7 Penurunan berat substrat TKKS setelah diinokulasi dengan jamur pelapuk kayu
isolat JPA dan Trichoderma sp. S2-2 dengan waktu inkubasi delapan minggu.
Huruf yang sama pada grafik batang yang sama menunjukkan tidak berbeda nyata berdasarkan uji Tukey dengan nilai alpha 5%. Nilai adalah rata-rata dari
sepuluh ulangan ± standar deviasi (bar vertical)
(1) (2) (3)
Gambar 8 Kolonisasi jamur pelapuk kayu isolat JPA (a) dan Trichoderma sp. S2-2 (b)
pada perlakuan JPA+T setelah inkubasi 30 hari (1), 45 hari (2), dan 60 hari (3) 0 5 10 15 20 25 30 35 40 0 20 40 60 80 100 120 140 160
Kontrol JPA T JPA+T (JPA)+T Penur
una n be ra t s ubs tr a t ( %) B era t k eri n g a w a l ( B A W) Perlakuan
Berat kering awal (BAW) Berat kering akhir (BKA) Penurunan berat substrat (%)
a c b d c
a a a a a a
16
Penurunan berat kering substrat paling tinggi terjadi pada perlakuan JPA+T (20.54%), diikuti oleh perlakuan (JPA)+T (12.27%), JPA (11.67%), dan T (8.44%). Proses degradasi substrat mengakibatkan terjadinya reduksi berat karena sebagian besar unsur karbon berubah menjadi CO2
Perlakuan
(Wahyono dan Sahwan 2008). Hasil analisis kandungan lignin dan selulosa setelah inkubasi 8 minggu (Tabel 2) menunjukkan adanya penurunan kandungan lignin dan selulosa pada substrat TKKS yang dikomposkan.
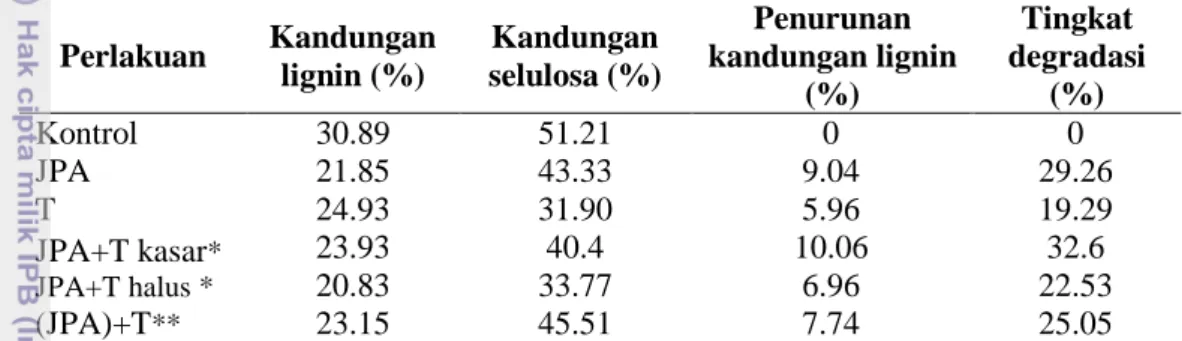
Tabel 2 Kandungan lignin dan selulosa TKKS yang telah didegradasi selama delapan minggu Kandungan lignin (%) Kandungan selulosa (%) Penurunan kandungan lignin (%) Tingkat degradasi (%) Kontrol 30.89 51.21 0 0 JPA 21.85 43.33 9.04 29.26 T 24.93 31.90 5.96 19.29 JPA+T kasar* JPA+T halus * 23.93 20.83 40.4 33.77 10.06 6.96 32.6 22.53 (JPA)+T** 23.15 45.51 7.74 25.05 *)
Isolat JPA dan Trichoderma sp. S2-2 diinokulasikan bersama-sama **)
Penurunan kandungan lignin dan selulosa pada substrat TKKS membuktikan bahwa isolat yang digunakan dalam perlakuan memiliki kemampuan dalam mendegradasi lignin dan selulosa. Kondisi aerobik diduga berperan dalam mempercepat atau mendukung proses degradasi lignin. Enzim yang mendegradasi lignin juga merupakan enzim kompleks, yang terdiri dari lignin peroksidase (LiP), mangan peroksidase (MnP), dan lakase. Enzim-enzim tersebut diproduksi aktif pada keadaan oksigen yang cukup (Fukushima dan Kirk 1995; Rothschild et al. 1995). Penurunan kandungan lignin terendah terdapat pada perlakuan JPA+T dengan kisaran 20.83-23.93%. Nilai kisaran ini dapat terjadi karena pada perlakuan JPA+T terdapat dua bagian substrat, yaitu bagian substrat yang kasar dengan kandungan lignin 23.93% dan bagian substrat yang halus dengan kandungan lignin 20.83%. Bagian substrat yang halus merupakan substrat yang ditumbuhi oleh isolat JPA dan Trichoderma sp. S2-2 sehingga diduga terjadi proses degradasi lignin dan selulosa pada substrat TKKS. Akibatnya, substrat tersebut lebih halus. Bagian substrat yang kasar merupakan substrat yang ditumbuhi oleh Trichoderma sp. S2-2, tetapi tidak ditumbuhi oleh isolat JPA, sehingga proses degradasi lignin diduga tidak sebaik pada bagian substrat yang ditumbuhi oleh isolat JPA. Kandungan selulosa tertinggi terdapat pada perlakuan (JPA)+T dan JPA, sedangkan kandungan selulosa terendah pada perlakuan T. Hal ini mungkin disebabkan oleh degradasi selulosa oleh Trichoderma sp. S2-2 pada perlakuan (JPA)+T hanya berlangsung selama empat minggu, sedangkan pada perlakuan T degradasi selulosa berlangsung selama delapan minggu. Tingginya kandungan selulosa pada perlakuan tersebut diduga karena periode degradasi selulosa pada perlakuan (JPA)+T dan JPA tidak sama dengan periode degradasi selulosa pada perlakuan T. Diketahui bahwa Trichoderma memiliki kemampuan selulolitik yang baik, didukung oleh hasil percobaan Ratnakomala (2010). Hal ini didukung pula oleh kemampuan tumbuh Trichoderma sp. S2-2 pada media
agar-Isolat JPA diinkubasi selama empat minggu kemudian disterilisasi dan diinokulasi dengan
17
agar air yang mengandung CMC yang dilakukan dalam penelitian ini. Menurut Istikowati dan Marsoem (2009), isolat Phanerochaete chrysosporium yang digunakan untuk mendegradasi kayu randu (Ceiba pentandra Gaertn) dengan persentase penurunan kandungan lignin sebesar 3.5% atau dengan tingkat degradasi lignin setelah 40 hari inkubasi sebesar 12.28%. Samsuri et al. (2007) melaporkan Lentinus edodes yang digunakan untuk mendegradasi lignin pada bagas, persentase penurunan kandungan lignin setelah 4 minggu inkubasi adalah sebesar 2.4% atau dengan tingkat degradasi lignin sebesar 9.91%. Pada percobaan ini, hasil degradasi lignin pada perlakuan JPA+T juga lebih besar daripada hasil yang diperoleh Noferdiman et al. (2008) yang menggunakan Phanerochaete chrysosporium pada proses biodegradasi lumpur sawit dengan beberapa perlakuan, yaitu tanpa penambahan urea, dengan penambahan 0.5 g urea, dan dengan penambahan 1.0 g urea. Hal ini menunjukkan bahwa kedua isolat dan metode yang digunakan dalam percobaan ini berpotensi dalam memperoleh selulosa. Selain dengan menggunakan mikrob, degradasi lignin dapat pula dilakukan secara fisik dan kimia (Anindyawati 2010). Silverstein et al. (2007) mempelajari keefektifan delignifikasi menggunakan H2SO4, NaOH, H3O, dan O3.
Hasil penelitiannya menunjukkan delignifikasi dengan 2% NaOH, 90 menit, 121o
Perlakuan
C meningkatkan delignifikasi hingga 65%. Selain natrium hidroksida, pereaksi kimia yang dapat digunakan untuk delignifikasi lignoselulosa adalah natrium hipoklorit (Richana et al. 2011). Secara fisik, delignifikasi dapat dilakukan dengan menggunakan microwave, metode pirolisis, dan iradiasi gamma
(Mtui 2009).
Tabel 3 Kandungan C, N, dan rasio C/N TKKS setelah degradasi selama delapan minggu Kandungan C (%) Kandungan N (%) Rasio C/N TKKS (kontrol) 46.26 0.94 49.21 JPA 30.74 1.01 30.44 T 29.20 0.84 34.76 JPA+T kasar JPA+T halus 33.12 32.48 1.15 1.08 30.46 28.24 (JPA)+T 35.34 1.16 30.67
Dari hasil analisis diketahui bahwa kandungan C mengalami penurunan pada semua perlakuan (Tabel 3) sesuai yang dilaporkan oleh Atkinson et al. (1996) dan Goyal et al. (2005) bahwa selama pengomposan bahan organik terjadi perubahan total kandungan C-organik dan hilangnya karbon sebagai karbon dioksida yang merupakan indikator terjadinya dekomposisi. Selain itu, rasio C/N pada akhir degradasi juga mengalami penurunan. Rasio C/N terendah terdapat pada perlakuan JPA+T bagian halus dengan nilai 28.24. Namun demikian, nilai rasio C/N pada perlakuan JPA dan JPA+T bagian kasar tidak berbeda jauh dengan nilai C/N rasio pada perlakuan (JPA)+T. Tingginya rasio C/N pada substrat dapat disebabkan karena bahan tersebut banyak mengandung lignin dan selulosa. Rasio C/N yang lebih rendah pada perlakuan JPA+T bagian halus mungkin disebabkan oleh meningkatnya kandungan N dan penurunan kandungan C. Menurut Goenadi (2006) pada proses pengomposan terjadi pelepasan C, sehingga kandungan C dalam substrat menurun. Selain itu disebabkan pula oleh peningkatan unsur N
18
dalam substrat. Rasio C/N TKKS setelah degradasi pada percobaan ini dengan perlakuan JPA+T hampir sama dengan rasio C/N TKKS pada percobaan yang dilakukan oleh Yelianti et al (2009) dengan perlakuan TKKS+EM4 (rasio C/N=27.50) dan TKKS+Trichoderma harzianum (rasio C/N=27.34). Penentuan rasio C/N ini penting dilakukan apabila bahan yang telah didegradasi akan dijadikan parameter kematangan kompos (Wahyuni 2010).
Topik II: Pertumbuhan jamur pelapuk kayu isolat JPA dan Trichoderma sp. S2-2 pada TKKS yang telah dikomposkan
Percobaan ini dilakukan untuk melihat kemampuan isolat JPA dan
Trichoderma sp. S2-2 untuk tumbuh pada TKKS yang telah dikomposkan sebab pada penelitian sebelumnya (Sudirman 2010, data tidak dipublikasi), isolat JPA tidak dapat tumbuh pada TKKS yang telah dikomposkan. TKKS yang dikomposkan selama 4, 6, 8, dan 10 minggu di lapangan terbuka menunjukkan adanya pertumbuhan cendawan pada tumpukan TKKS (Lampiran 1). TKKS yang dikomposkan pada masing-masing periode pengomposan menunjukkan perbedaan kandungan lignin dan selulosa pada akhir masa pengomposan (Tabel 4).
Tabel 4 Kandungan lignin, selulosa, C, N, dan rasio C/N pada TKKS yang telah dikomposkan dengan dekomposer Promi selama 0, 4, 6, 8, dan 10 minggu Lama pengomposan (minggu) Kandungan lignin (%) Kandungan selulosa (%) Kandungan C (%) Kandungan N (%) Kandungan C/N (%) 0 (kontrol) 39.64 51.21 46.26 0.94 49.21 4 27.76 38.6 33.45 0.70 47.79 6 13.66 27.78 34.45 0.77 44.74 8 12.41 23.34 32.89 1.04 31.63 10 10.68 19.21 35.19 2.19 16.07
Dari hasil analisis diketahui, bahwa kandungan lignin, selulosa, dan rasio C/N tertinggi terdapat pada TKKS yang dikomposkan selama 4 minggu, sedangkan kandungan terendah terdapat pada TKKS yang dikomposkan selama 10 minggu. Diduga lama pengomposan berpengaruh terhadap kandungan lignin, selulosa, dan rasio C/N TKKS. Artiningsih (2006) melaporkan beberapa spesies
Ganoderma (G. applanatum SA1-24, G. australe SA3-60, G. tropicum SA2-26, G. lucidum KT2-52, G. ochrolaccatum SA2-14, dan G. mastoporum KT1-64) yang ditumbuhkan pada media Glenn dan Gold menunjukkan aktivitas lignolitik yang semakin tinggi hingga akhir inkubasi (21 hari). Hasil penelitian Herliyana (2007) menunjukkan kandungan polimer serbuk kayu sengon baik lignin, maupun selulosa cenderung menurun setelah diinokulasi dengan masing-masing isolat kelompok Pleurotus (Pleurotus EB6, Pleurotus EB7, Pleurotus EB14-2,
Pleurotus EA4, dan Pleurotus EB9) baik pada pada fase vegetatif, maupun pada fase generatif (panen ke-1 hingga panen ke-4). Kasli (2008) melaporkan, bahwa bahan organik berupa TKKS, jerami padi, sampah perkotaan, dan ampas tahu yang didegradasi oleh T. harzianum mengalami penurunan rasio C/N hingga akhir inkubasi (hari ke-7). Hasil pengomposan pada kondisi alam dengan menggunakan dekomposer Promi lebih baik dalam menurunkan kandungan lignin TKKS daripada kedua isolat, JPA dan Trichoderma sp. S2-2. Namun demikian kedua
19
isolat mampu tumbuh pada TKKS yang telah dikomposkan (Tabel 5 dan Tabel 6).
Tabel 5 Kolonisasi jamur pelapuk kayu isolat JPA pada TKKS yang dikomposkan selama 4, 6, 8, dan 10 minggu Lama pengomposan (minggu) Pengamatan (hari) 5 10 15 20 25 30 35 0 (Kontrol) 3.4 5.9 c (17.2%) 8.8 c (29.8) 11.8 b (44.4%) 13.9 c (59.3%) 16.8 c (69.6%) 19.8 b (84.2%) a (100%) 4 3.3bc 7.4 (16.6%) 10.3 ab (37.1%) 13.4 ab (51.8%) bc 16.6 (67.2%) 19.9 b (83.3%) 19.9 a (100%) 6 a (100%) 3.7a 7.2 (18.5%) 11.4 bc (36.2%) 15.0 a (57.3%) 19.9 ab (75%) 19.9 a (100%) a 19.9 (100%) 8 a (100%) 4.7a 8.2 (73.7%) 12.2 ab (41.2%) 16.3 a (61%) 20.1 ab (81.5%) 20.1 a (100%) 20.1 a (100%) 10 a (100%) 3.4b 5.5 (17.3%) 8.1 a (27.7%) 14.6 a (40.7%) 16.1 a (73%) 20.1 b (80.9%) 20.1 a (100%) a (100%) Keterangan: Angka merupakan kolonisasi isolat dalam cm dan %. Angka-angka yang diikuti huruf
yang sama pada kolom yang sama menunjukkan tidak ada perbedaan dari perlakuan yang diberikan menurut uji Tukey pada taraf nyata 5%.
Tabel 6 Kolonisasi isolat Trichoderma sp. S2-2 pada TKKS yang dikomposkan selama 4,
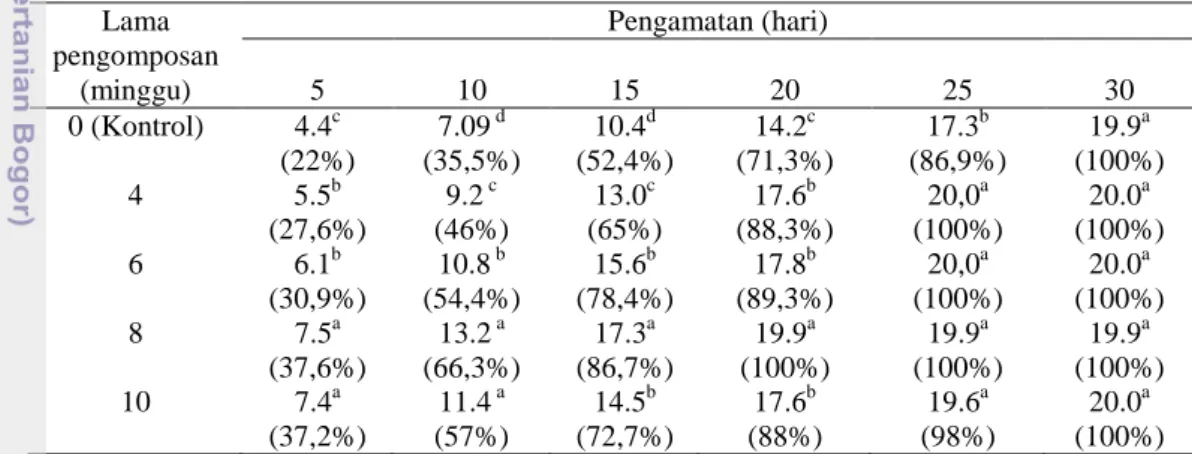
6, 8, dan 10 minggu Lama pengomposan (minggu) Pengamatan (hari) 5 10 15 20 25 30 0 (Kontrol) 4.4c 7.09 (22%) 10.4 d (35,5%) 14.2 d (52,4%) 17.3 c (71,3%) 19.9 b (86,9%) a (100%) 4 5.5b 9.2 (27,6%) 13.0 c (46%) c (65%) 17.6b 20,0 (88,3%) 20.0 a (100%) 6 a (100%) 6.1b 10.8 (30,9%) 15.6 b (54,4%) 17.8 b (78,4%) 20,0 b (89,3%) 20.0 a (100%) 8 a (100%) 7.5a 13.2 (37,6%) 17.3 a (66,3%) 19.9 a (86,7%) 19.9 a (100%) 19.9 a (100%) 10 a (100%) 7.4a 11.4 (37,2%) 14.5 a (57%) 17.6 b (72,7%) 19.6 b (88%) 20.0 a (98%) a (100%) Keterangan: Angka merupakan kolonisasi isolat dalam cm dan %. Angka-angka yang diikuti huruf
yang sama pada kolom yang sama menunjukkan tidak ada perbedaan dari perlakuan yang diberikan menurut uji Tukey pada taraf nyata 5%.
Isolat JPA menunjukkan pertumbuhan koloni terbaik pada TKKS yang dikomposkan selama 6 minggu pada hari ke-25 dengan kolonisasi mencapai 99.8% Sedangkan Trichoderma sp. S2-2 menunjukkan pertumbuhan terbaik pada TKKS yang dikomposkan selama 8 minggu dengan kolonisasi mencapai 100% pada hari ke-20. Pada TKKS yang dikomposkan selama 4 minggu, isolat JPA dan
Trichoderma sp. S2-2 mengkolonisasi substrat dengan kolonisasi mencapai 100% masing-masing setelah inkubasi 30 dan 25 hari. Jika kolonisasi kedua isolat pada TKKS yang dikomposkan selama 6 dan 8 minggu dibandingkan dengan kolonisasi kedua isolat pada TKKS yang dikomposkan selama 4 minggu, maka lama kolonisasinya hanya berbeda 5 hari. Dengan demikian, penggunaan TKKS yang dikomposkan selama 4 minggu lebih efektif dari segi waktu daripada TKKS yang dikomposkan selama 6, 8, dan 10 minggu.
20
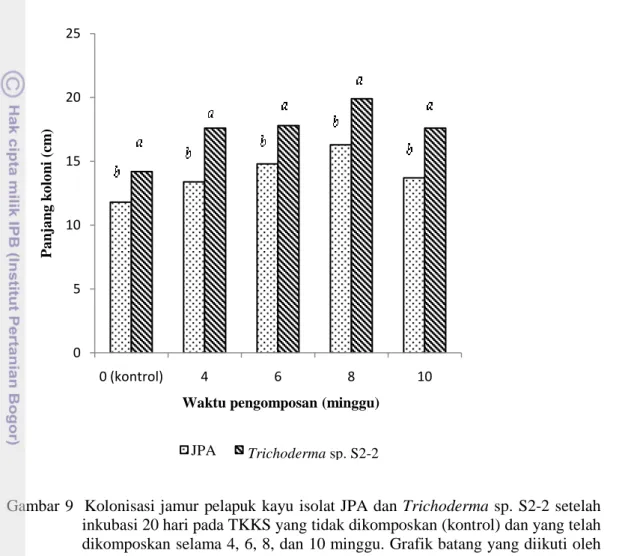
TKKS yang dikolonisasi oleh masing-masing isolat memiliki tekstur yang lebih hancur pada akhir inkubasi. Dengan demikian Trichoderma sp. S2-2 lebih baik daripada isolat JPA dalam mengkolonisasi TKKS yang dikomposkan selama 4, 6, 8, dan 10 minggu (Gambar 9).
Gambar 9 Kolonisasi jamur pelapuk kayu isolat JPA dan Trichoderma sp. S2-2 setelah
inkubasi 20 hari pada TKKS yang tidak dikomposkan (kontrol) dan yang telah dikomposkan selama 4, 6, 8, dan 10 minggu. Grafik batang yang diikuti oleh huruf yang sama pada waktu pengomposan yang sama menunjukkan tidak ada perbedaan dari perlakuan isolat berdasarkan uji Tukey dengan nilai alpha 5%
Diduga cepatnya pertumbuhan kedua isolat disebabkan oleh kandungan lignin yang mulai menurun akibat degradasi oleh dekomposer (Promi). Andayanie (2013) menyatakan bahwa miselium cendawan tumbuh dengan baik pada media yang telah dikomposkan. Namun demikian belum dapat disimpulkan hasil degradasi pada minggu keberapa yang paling baik, sebab tidak dilakukan analisa kandungan lignin, selulosa, C, dan N pada TKKS yang telah ditumbuhi oleh isolat JPA dan Trichoderma sp. S2-2.
0 5 10 15 20 25 0 (kontrol) 4 6 8 10 P an jan g k ol on i (c m )
Waktu pengomposan (minggu)
21
SIMPULAN
Jamur pelapuk kayu isolat JPA dan Trichoderma sp. S2-2 masing-masing mampu mendegradasi lignin dan selulosa. Isolat JPA dan Trichoderma sp. S2-2 mampu mendegradasi TKKS dengan hasil degradasi terbaik pada penggunaan kedua isolat tersebut secara simultan (JPA+T). Isolat JPA mengkolonisasi dengan baik TKKS yang telah dikomposkan selama 6 minggu dan hari ke-25 setelah inokulasi, sedangkan Trichoderma sp. S2-2 mengkolonisasi dengan baik TKKS yang telah dikomposkan selama 8 minggu dan hari ke-20 setelah inokulasi. Kedua isolat berperan dalam memperoleh selulosa sebagai bahan baku untuk menghasilkan produk bernilai tambah.
22
DAFTAR PUSTAKA
Adaskaveg JE, Gilbertson RL, Dunlap MR. 1995. Effects of incubation time and temperature on in vitro selective delignification of silver leaf oak by
Ganoderma colossum. Appl Environ Microbiol. 61:138-144.
Alexopoulos CJ, Mims CW, Blackwell M. 1996. Introductory Mycology. 4th Ed. New York (US): John Wiley & Sons..
Alfian C. 1990. Telaah Trichoderma Sebagai Agen Pengendali Hayati. Jakarta (ID): PDIT BPP. Teknologi. hlm 288 – 295.
Amrullah M, Nawir NH, Abdullah A, Tambaru E. 2013. Isolasi jamur mikroskopik pendegradasi lignin dari beberapa substrat alami. J Alam Lingk. 4(7):19-25
Artiningsih T. 2006. Aktivitas ligninolitik jenis Ganoderma pada berbagai sumber karbon. Biodiversitas. 7(4):307-311.
Atkinson CF, Jones DD, Gauthier JJ. 1996. Biodegradability and microbial activities during composting of poultry litter. Poult Sci. 75:608-617
Away Y, Didik H, Goenadi, Ridwan A, Pasaribu, Gatot JS. 1998. Biopulping TKKS. Pemberdayaan Bioteknologi Untuk Penigkatan Efisiensi Usaha Perkebunan. Bogor (ID): Unit Penelitian Bioteknologi Perkebunan. hlm 10-19.
Azarkan M, Amrani A, Nus M, Vandermes A, Zerhouni S, Smolders, Looze Y. 1997. Carica papaya lateks is a rich source of a class II chitinase. Phytochemistry. Elsevier Science Ltd. 46(8):119-125.
Aziz AA, Husin M, Mokhtar A. 2002. Preparation Of Cellulose From Oil Palm Empty Fruit Bunches Via Ethanol Digestion: Effect Of Acid And Alkali Catalysts. J Oil Palm Res. 14(1):9-14.
[BPS] Badan Pusat Statistik. 2009. Areal dan Produksi Perkebunan Besar Indonesia Tahun 1995-2009. Jakarta (ID): BPS.
Bajpai P. 1999. Aplication of enzyme in the pulp and paper industry. Biotechnol Prog. 15:147-157.
Bayer EA, Morag E, Lamed R. 1994. The cellulosome- a treasure-trove for biotechnology. TIBTECH. 12:379-386.
Blanchette RA, Cease KR, Abad AR. 1991. An evaluation of different forms of deterioration found in archaeological wood. Int Biodeter. 28:3-22.
Brewer D, Feicht A, Taylor A, Kfeping JW, Taha AA, Thaller V. 1982 Ovine ill-thrift in Nova Scotia. 9. Production of experimental quantities of isocyanide metabolites of Trichoderma hamatum. Can J Microbiol. 28:1252-1260.
23
Blanchette RA. 1995. Degradation of lignocellulose complex in wood. Can J Bot. 73 (Suppl. 1):S999-S1010.
Chahal PS, Chahal DS. 1998. Lignocellulosic waste: Biological conversion. Di dalam: Martin AM, editor. Bioconversion of waste materials to industrial products. Ed ke-2. London (GB): Blackie Academic & Professional. hlm 376-422.
Daniel G, Nilsson T. 1998. Developments in the study of soft rot and bacterial decay. Di dalam: Bruce A, Palfreyman JW, editor. Forest Products Biotechnology. Great Britain (GB): Taylor & Francis. hlm 37-62.
Danielson RM, Davey CB. 1973. The abundance of Trichoderma propagules and the distribution of species in forest soils. Soil Biol Biochem. 5:486–494. Danielson RM, Davey CB. 2002. Non nutritional factors affecting the growth of
Trichoderma in culture. Soil Biol Chem. 5:495-504.
Darnoko, Poeloengan Z, Anas I. 1993. Pembuatan pupuk organik dari tandan kosong kelapa sawit. Bul PPKS. 1:89-99.
Darnoko D, Siahaan E, Nuryanto J, Elisabet L, Erningpraja L, Tobing PL, Naibaho PM, Haryati T. 2002. Teknologi Pengolahan Kelapa Sawit dan Produk Turunannya. Medan (ID): Pusat Penelitian Kelapa Sawit Indonesia. hlm 5-18.
Dey S, Maiti TK, Bhattacharyya BC. 1994. Production of some extracellular enzymes by a lignin peroxidase-producing brown-rot fungus, Polyporus ostreiformis, and its comparative abilities for lignin degradation and dye decolorization. Appl Environ Microbiol. 60:4216-4218.
Dozoretz CG, Rothschild N, Hadar Y. 1993. Overproduction of lignin peroxidase by Phanerochaete chrysosporium BKM-F1767. Appl Environ Microbiol.
59(6):1919-1926.
Fukushima Y, Kirk TK. 1995. Laccase component of the ceriporiopsis subvermispora lignin-degradating system. Appl Environ Microbiol. 61(3): 872- 876.
Ghaida M. 2012. Pemanfaatan tandan kosong kelapa sawit (TKKS) untuk pupuk organik (kompos) dengan bioaktivator Trichoderma sp. di kebun sawit [Internet]. [diunduh 2013 Jan 10]. Tersedia pada: http://dr-
plant.blogspot.com/2012/07/pemanfaatan-tandan-kosong-kelapa-.sawit.html.
Goenadi DH, Santi LP. 2006. Aplikasi bioaktivator SuperDec dalam pengomposan limbah padat organik tebu. Bul Agron. 34(3):173 – 180.
Goksyor J, Ericsen J. 1980. Celluloses. Di dalam: Rose AH, editor. Microbial enzymes and bioconverssion. New York (US): Academic Press. hlm 8-12.