LAPO�
AKHIR PENELITIAN
Potensi Genistein dalam Meningkatkan Kemampuan
Diferensiasi dan Proliferasi Mesenchymal Stem Cells
(MSCs) melalui Penghambatan Jalur Apoptosis (Studi
pada Kultur MSCs Kondisi Hipoksia)
Nama
Penyusun Laporan:
Candra Bumi
Heni
Fatmawati
Nindya
ShintaFakultas Kedokteran Universitas Jember
Jl. Kalimantan 37 Jember
2012
•
la: .\lENT LR lA '\ l'.l·:S E H ATA "\'
B \1.> \ ·< l'l "-! j IT, \:-. ll \ '\. t '1"1..\tl \1(). \ Sc ·.'\:'-. Ki:'<iFI L<\1.-\!\-• • j [A," .' If. ! �. r 1. , 1 ,_ 'I' I. I I' '. � t-. • ' � 'f;. ' !• t •);. • � i • . '\ '.i.l \ ' 1n·--.r:· • t \�1��---. · . • �.� I' PI \• I ''I, l � ·•.:.,. ),'.I:,! ... --.�. ,t, ,P,( tll,.�\J,�_::: , .. 11 t l,,!�I'IRioh
to(;�f';.JJTllo'��tl fi�Oi,;, .\-e.a.�'lh.!l<a l.,tV-�o.,.N:'� KIF'�F-.A-.:.., '� ·�o!i.tef.l .� ... _o'J •\�. • _:<-l.,.. �c:.�·-JUllll. ,� ISE l ·.•·.;-._ •.:·· , <!'" J< " : I " � ... _,._ '00 4 ' '..-('<Mo.� I-·.•·.� ol :· ••� o ,.,, l '· • ·.t��-.-.,,_�' . .1' ., •:••\:.ol' --��-· ...;. ... -.,-� .. --. �:. .. ; " ... �..;. ; � .''1 .• r. 16o ·, , -....,_ • ·-:r ;y�: :.._.. �-"\ �·-.��" • '!>.-. • .:-·e,�"'·.ii...,.- !>�_. ,,. __ .w.�- �! •. �.· ·:1'1"-1-- t_t'(·.':::oi:.-�, ... ..;(,., ··�-���-·-� "·-·� .• �- .... ._l�ll.',-,..� t1..,;l. I''•'' ;I(,; �o'/ (?'-'' \� �· :l· ·,. ,jO ,• 1
1.,1�::.:·�--.;:·�_ . ..:; .• ,.·vt- :.. ... -... floi., •-·r;\· ,.- . ·., ... �
� 't! • �"V'."'
. .. �·· . '
LEMBAR PENGESAHAN PENELITIAN RISBIN IPTEKDOK
1. Judul
: Potensi Genistein dalam Meningkatkan Kemampuan Diferensiasi dan Proliferasi Mesenchymal Stem Cells (MSCs) melalui Penghambatan Jalur Apoptosis (Studi pada Kultur MSCs Kondisi Hipoksia).2. Ketua Peneliti
2.1 Data Pribadi
a. Nama Lengkap
b. Jenis Kelamin
c. NIP/Golongan
d. Srata/Jab. Fungsional
e. Jabatan Struktural
f.
Fakultas/J
urusang. Bidang Ilmu
h.Alamat Kantor
i. Telepon/Faks!E-mail
J.Alamat Rumah
3. Jumlah Anggota Peneliti
a. Nama Anggota I
b. Nama Anggota ll
c. Nama Anggota III
: dr. Candra Bumi, MSi
: Pria
: 197406082008011012/IIlb
: Kesehatan Masyarakat
: Imunologi
danEpidemiologi
: Jl. Kalimantan 1193
:0331 7891500/[email protected]
: Perum. Taman Gading LL-20 Jember
: dr. Heni Fatmawati, Mkes
: dr. Nindya Shinta, MKed
4. Lokasi Penelitian
: Laboratorium liD Universitas Unair
5. Jangka Waktu Penelitian : 6 Bulan
Jember, 8 Februari 2012
Ketua Peneliti,
dr.
CandraBumi, MSi
NIP.197406082008011012
•
I<EMENTERIAN PEN DIDIKAN NASIONAL
UNIVERSIT A S JEMBE R
FAI(ULTAS KEDOKTERAN
Jl. Kalimantan 37 Kampus Tegalboto Telp. (0331) 337877 Jember 68121 E-Mail: [email protected]
Surat Pernyataan
Saya yang bertanda tangan di bawah ini: Nama Lengkap
Nomor lnduk Pegawai Asal lnstansi
Judul Penelitian
: Candra Bumi
:197406082008011012
: Fakultas Kesehatan Masyarakat Universitas Jember : Potensi Genistein dalam Meningkatkan Kemampuan
Diferensiasi dan Proliferasi Mesenchymal Stem Cefls
(MSCs) pada lnfark Miokard melalui Penghambatan Jalur Apoptosis (Studi pada Kultur MSCs Kondisi Hipoksia)
'
Dengan ini menyatakan kesanggupan untuk menyelesaikan penelitian Riset Pembinaan llmu Pengetahuan dan Teknologi Kedokteran yang telah dilakukan pada tahun 2011, sesuai dengan Surat Perjanjian Kerjasama yang ditandatangani pada tahun 2011 (penPiitian tahun ke-1)
Apabila dikemudian hari, Saya tidak dapat menyelesaikan penelitian seperti ketentuan tersebut di atas, maka segala akibat yang timbul dari penelitian tersebut menjadi tanggung jawab Saya sepenuhnya dan seluruh biaya penelitian yang telah diterima akan saya kembalikan kepada Badan Penelitian dan Pengembangan Kesehatan.
Demikian Surat Pernyataan ini Saya buat tanpa ada paksaan dan untuk dapat dipergunakan sebagaimana semestinya.
I I
ti, M.Kes
0
14199903.7()0Jember, 16 Januari 2012 Yang membuat pernyataan,
'\
\
E
.
·
rr
�\J
(-
'A
.-
'.
'�
r L
'
'*r
tj(J
�
�
}
�
.
�>
.
\.
·;;;· '·':.
�_(
----06DOEAAF9�2
2
7
3&
?--f�.\ ....
\ l'tiJ.!J Ktrn•�H '((G(OfiD
dr. Candra Bumi, MSi NIP. 197406082008011012
KA TA PENGANTAR
Dengan memanjatkan segala puji syukur kepada Allah
SWT,
atas limpahan rahmat dan hidayah-Nya tim peneliti dapat menyelesaikan penelitian dan laporan hasil penelitian tahap II yang be�udul : Potensi Genistein dalam Meningkatkan Kemampuan Diferensiasi dan Proliferasi Mesenchymal Stem Cells (MSCs) melalui Penghambatan Jalur Apoptosis (Studi pada Kultur MSCs Kondisi Hipoksia).Kami atas nama tim peneliti bemarap mudah - mudahan hasil penelitian berguna dan bermanfaat baik untuk pengembangan ilmu dan teknologi pada umumnya dan khususnya ilmu dan teknologi dalam bidang kedokteran.
Kami sadar bahwa penelitian kami masih terdapat kekurangan. Oleh karena itu peneliti mengharapkan melalui laporan penelitian ini, para pembaca dapat memberikan saran yang membangun demi perbaikan penulisan hasil penelitian tersebut.
IV
Jember,
F ebruari 2012
Ketua Penelitf, dr. Candra Bumi, MSi
DAFTAR
lSI
hal am an
SA
M
PUL DALAM ... . . . .. . . ... ... · ..i
SK PENELITI ... : ... II LEMBAR PENGESAHAN ... . . . . ... . . . ... . . ... . . . ... . . . .
.
. . . ... iiiKAT A PENGANT AR
.
... . ....
. ...
... . . ....
..
... ....
. ivDAFTAR 151 . . . ... . .
.
... . . . ... . ..
. . . ... , ... . . .. . . ... vRINGKASAN ... . ...
.
... . . . ....
. . ... . ... viiABSTRAK ... . . . ... . .. .. . . .
.
..
... . . . ... . . . ...
...viii
DAFTAR ANGGOTA TIM PENELITI . . . ... . . . ...
ix
DAFTAR T ABEL ..
.
... . . . ..
. . ... . . . ... . . .x
DAFTAR GAMBAR . ... . . .
.
... . . . . ... . . . ... . . ..
... . . . ... . . ... . . ...xi
DAFTAR LAMPIRAN . . . . ... . . ... ...
.
. . . . ... . . ... . . . ..
... . . . ... xii
I. PENDAHULUAN ... . . 1
1.1
Latar Belakang . . . ..
... . . . ... . . ...
. ..
. . . ..
. . ..
... . .1
1 .2
Rumusan Masalah . . . . ..
... . . . ..
... . . ... . ... . . . ... . . . ....
3
II. TUJUAN PENELITIAN . .... . . ... . . ... · ....
.
. . . ... . . . ... .. .4
2.1
Tujuan Umum... ... . 4
2.2
Tujuan Khusus . . ..
. . . .... . . ... . . . ... . ..
... . . . ... . 42.3 Manfaat Riset. ... ... . 4
2.4 Hipotesis Riset ... , ... . 4
III.BAHAN DAN METODE PENEUTIAN . . . ..
.
.. . . ... . .....
... · ... .5
3.1 Bahan
. . . ... . . . ... . . . ... . . .5
3.2 Varia
be
l Penelitian... 5
3.3
Metode Penelitian ... . 73.4 Diagram Allr Penelltlan . . . ... ... . . . ... . ...
.
... . . .9
IV.HASIL DAN PEMBAHASAN ...
.
.. . . .. . . ... .. .. . . . ... . ..
..
. . . ... .10
4.1
Hasil Penelitian . . . . ... . ... . . . .... . . ...
....
. . .10
4.1.1
Morfologi Kultur MSCs . . . ... . . . ..
. . . ..
.... . . ... . . ... . . . ... _. .... .10
4.1.2
Pembuatan Model Hipoksia . . . ... . . . ... . . ... . . ... . ...12
4.1.3
/dentifikasi Sel MSCs . . . ... . . ... . . . ... . . ..
...13
4.1.4
Viabilitas
MSCs pada kondisi hipoksia setelah pemberian
genistein dengan mengguna�an MTI assay ... 13
4.1.5 Efek pemberian genistein terhadap aktivitas p38 MAPK,
Caspase-3, dan Caspase-9 pada kultur MSCs hipoksia . . ... . . . ... . . .15
v
•
4.1.6 Efek pemberlan genistein terhadap apoptosis sel
pad a kultur MSCs hipoksia ... 16
4.2. Pembahasan . ... . . ... . . . ... . . ... . ... ... . ... . . . .. 18
V
KESIMPULAN DAN SARAN . . . ... . . . ... . . .... . . ... . . ... . 21UCAPAN TERIMA KASIH . . . ... . . : ... 22
DAFTAR PUSTAKA
. . . .. . . ... . . .. . . ... . . . .. . . ... . . 23.LAMPIRAN
. . . .. . . .. . . .. . . .. . . .. . . ... . . . ... . . . 25•
RINGKASAN
Candra Bumi, Heni Fatmawati, Nindya Shinta, Potensi Genistein dalam Meningkatkan Kemampuan Diferensiasi dan Proliferasi Mesenchymal Stem Cells (MSCs) melalui Penghambatan Jalur Apoptosis (Studi pada Kultur MSCs Kondisi Hipoksia).
Penyebab utama gagal jantung adalah infark miokard akut. Pada infark otot jantung mengalami iskhemia (hipoksia), peningkatan sekresi sitokin, dan terjadi inflamasi. Terapi sel menggunakan mesenchymal stem cells (MSCs) dari bone marrow untuk mengatasi infark mlokard akut telah menunjukkan hasii yang sangat menjanjikan akan tetapi minimnya viabilitas dari terapi ini menjadi terbatas. Hal ini disebabkan kondiksi hipoksia pada saat terapi mampu meningkatkan ROS sehingga MSCs menjadi apoptosis. Genistein merupakan isoflavon yang bersifat antioksidan dan pada dosis rendah mampu sebagai antiapoptosis. Sehingga penelitian ini bertujuan untuk mempelajari peranan genistein terhadap viabilitas dan derajat apoptosis kultur MSCs dengan kondisi hipoksia dan efektivitas genistein terhadap aktivitas p38MAPK, caspase-3 dan caspase-9 pada kultur MSCs dengan kondisi hipoksia.
Hasil pene
l
itian menuhjukkan terdapat peningkatan viabilitas MSCs kondisi hipoksia dan penurunan derajat apoptosis MSCs seiring dengan peningkatan dosis genistein (p<O,OS). Hasil pemeriksaan terhadap kadar p38MAPK cenderung menurun begitupula untuk kadar caspase-3 dan kadar caepaee-9 hasllnya juga cenderung menurun dengan p>0,05. Hal lnl menunjukkan bahwa genistein dapat meningkatkan vlabllltas MSCs kondlslhipoksia dan menurunkan derajat apoptosls MSCs kondlsl hlpoksla. Penurunan
derajad apoptosis mungkin merupakan akumulasi hambatan jalur apoptosis yang
lain seperti caspase-8, caspase-7 yang pada penelitian kali ini belum dilakukandan juga mungkin melalui hambatan ROS. Penurunan kadar p38MAPK, caspase-3, dan caspase-9 yang tidak signifikan mungkin diakibatkan oleh dosis genistein yang kurang besar. Genistein merupakan salah satu isoflavon yang terdapat pada kedelai. Genistein mempunyai ban yak efek diantaranya . adalah efek hormonal karena bersifat sebagai fitoestrogen, anti inflamasi, anti oksidan, dan mempengaruhi proliferasi dari sel. Studi pada sel MCF-7
(
H
uman breast cancer cells) menunjukkan efek bifasik dari genistein yaitu pada konsentrasi rendah memicu pertumbuhan sedangkan pada konsentrasi tinggi menghambat pertumbuhan. Mekanisme yang te�adi untuk menjelaskan peristiwa bifasik tersebut belum sepenuhnya jelas. Penelitian pada sel otot genioglossus didapatkan hasil genistein pada konsentrasi rendah (< 10 nM) tidak menunjukkan efek, pada konsentrasi sedang (10 nM- 1 JJM) mampu melindungi sal terhadapapoptosis karena hlpoksia, sedangkan pada konsentrasi tlnggl (> 1 JJM) memlcu
terjadlnya apoptosis. Proteksi genistein pada hlpoksla dlduga melalul
peningkatan Akt dan ERK, juga efek antioksidannya mampu menghambat ROS, disamping itu genistein juga mempengaruhi rasio Bax/BCI2 menjadi turun
Hasil dari penelitian ini diharapkan dapat mengungkap leblh jelas mekanisme genistein dalam memperbaiki penurunan jumlah dan fungsi MSCs pada kondisi hipoksia pada saat dilakukan terapi sel punca menggunakan MSCs. Disamping itu genistein sebagai antioksidan dapat gunakan sebagai pilihan terapi untuk membantu keberhasilan terapi sel punca.
VII
ABSTRAK
Terapi dengan MSCs telah menunjukkan hasil yang menjanjikan akan tetapi tidak
sesuainya lingkungan mikro (hipoksia) mengakibatkan MSCs apoptosis.
Genistein sebagai antioksidan dan pada dosis rendah dapat sebagai
antiapoptosis diharapkan mampu meningkatkan efektivitas terapi sel punca.
Tujuan dari penelitian ini untuk mengkaji efektivitas genistein terhadap viabilitas
mesenchymal stem cells (MSCs) khususnya dalam kemampuannya regenerasi
melalui penghambatan apoptosis (p38MAPK, caspase-9, caspase-3) pada
kondisi hipoksia. Metode yang digunakan pada penelitian ini menggunakan
MSCs dari sumsum tulang kelinci New Zealand. Kultur hipoksia dengan
menggunakan Anaeropack-anaero (MGC). Viabilitas MSCs, diukur dengan
MTT
assay,
derajat apoptosis dengan
fluorescence
dye Hoechst
33342, sedangkan
p38MAPK dengan ELISA, caspase-9 dan caspase-3 dengan
colorimetric.
Analisis
datadengan menggunakan one way anova. Hasilnya didapatkan
vi
abll
i
tas MSCs pada kondisih
ip
ok
s
ia meningkat secara signifikan
(p,O,OS)
pada setlap kelompok begltupula dengan derajad apoptosls yangmenurun
(p,0,05)selrlng dengan menlngkatnya dosls genistein sedan
gkan
kadar p38MAPK,caspase-9, dan caspase-3 menurun tldak signifikan (p>0,05). Keslmpulannya
genistein dapat meningkatkan viabilitas dan menurunkan derajad apoptosis tetapi
tidak untuk menurunkan p38MAPK, caspase-9, dan caspase-3.
DAFTARANGGOTA TIM PENELITI
1.
dr. Candra Bumi, MSi (Ketua)
2.
dr. Heni Fatmawati, MKes (Anggota)
3.
dr. Nindya Shinta, MKed (Anggota)
IX • .. t • �
DAFTAR TABEL
No
Judul
1. Tabel 4.1. Hasil analisis statistik pengukuran viabilitas MSCs pada
kultur MSCs hipoksia yang dipapar beberapa dosis
Hal a man
genistein
. . . ... . . . ... ... 142.
Tabel
4.2.Hasil analisis statistik pengukuran aktivitas p38 MAPK
pada kultur MSCs hipoksia yang dipapar beberapa
dosis genistein
. . . ... . . . ... ... . ... . . ... 153.
Tabel
4.3.Hasil analisis statistik pengukuran aktivitas caspase 9
pada kultur MSCs hipoksia yang dipapar beberapa
dosis genistein
. . . ... . . . ....
... 164.
Tabel 4.4.
Hasil analisis statistik pengukuran aktivitas caspase 3
pada kultur MSCs hipoksia yang dipapar beberapa
dosis genistein
. . . ... : ... 16 5.Tabel4.5. Hasil analisis statistik persentase jumlah apoptosis pada
kultur MSCs hipoksia yang dipapar beberapa dosis genistein
... 17
•
DAFTAR GAMBAR
No
Judul
1.
Gambar
4.1.Gambaran sel MSCs pada hari pertama
Halaman
setelah k
u
l
tur
... 11 2.Gam bar
4.2.Gamba ran sel MSCs setelah dilakukan pencucian
... 113. Gam bar 4.3.
Gambaran sel MSCs masih 30% dengan bentuk
spindel
. . . .. . . ... 124.
Gam bar
4.4.Gamba ran sel MSCs yang sudah konfluen 80%
. . . ... 125.
Gam bar
4.5.Gamba ran hasil identifikasi sel MSCs
... . ... . ...13
6.
Gam bar 4.6. Diagram batang hasil pengukuran viabilitas MSCs
dengan menggunakan MTT assay pada kultur MSCs hipoksia
yang dipapar beberapa dosis genistein
. . . ... ... ... . . ... 14 7.Gam bar
4. 7.Diagram batang hasil pengukuran aktivitas p38 MAPK
pada kultur MSCs hipoksia yang dipapar beberapa dosis genistein
... 15 8.Gambar 4.8. Diagram �atang hasil peng
uk
uran
kadar caspase 9pada kultur MSCs hlpoksla
yang
dlpapar
beberapa dosls g
en
is
tein... 15
9.
Gambar
4.9.Diagram batang hasil pengukuran kadar caspase 3
pada kultur MSCs hipo
k
s
i
a yang dipapar beberapa dosis
genistein
... 1610
Ga
m
ba
r 4.10.Gambaran apoptosis kultur MSCs menggunakan
pewamaan
fluorescence dye Hoechst 33342 ... 17xi
DAFTAR LAMPIRAN
No
Judul
Halaman
1. Anal
isis Statistik
One Way A nova
. . . .-... ... 24
•
I. PENDAHULUAN
1.1
Latar Belakang
Penyebab
utamagagal jantung adalah infark miokard yang mengarah pada
kerusakan permanen dari kardiomiosit dan diikuti oleh
remodelling
patologis dari
ventrikel
kiri 1•2. Me
ski
punpada
penelitianterdahulu disebutkan terdapat pembelahan
•dari
kardiomiosit setelah infark pada otot jantung,
tetapi kemampuan mit()sis tersebut
menjadi
sangat terl:iatas untuk menggantikansel-sel
yanghilang
setelahinfark
miokard1. Terapi sel menggunakan
mesenchymal
stemcells (MSCs) dari
bonemarrow
telah menunjukkan basil yang sangat menjanjikan dalam hal meregenerasi dan
mengembalikan miokardium yang iskemia, mengembalikan fungsinya serta merupakan
strategi efektif yang aman untuk terapi gaga! jantung iskemia 3•4•5•6. Namun demikian
minimnya
viabilitasdari t
ransplan
ta
si MSCspada jantung yang mengalami infark
menyebabkan efikasidari terapi
ini menjadi terbatas7•8. Penelitian oleh Geng, th
2003,menunjukkan
99%MSCs
yangdiinjeksikan
ke ventrikelkiri dari CB17SCID/tikus
dewasa
beige
mengalami
kematiansetelah
4hari injeksi,
halini membuk:tikan bahwa
lingkungan mikro
iskemi/microenvironment
yang iskemipada miokardium yang infark
tidak kondusif untuk
ketahananMSCs. Dugaan mekanisme yang mendasari
menurunnya fungsi MSCs adalah sel-sel MSC banyak yang mengalami apoptosis dan
kapasitas untuk melekat serta diferensiasi menjadi MSCs
turun.Dengan demikian
meningkatkan ketahanan dari MSCs yang berimplantasi menjadi hal pen�ing untuk
peningkatan efikasi dari terapi
stem cells.
Tujuan
cardiomyop/asty
seluler adalah untuk mengganti kardomiosit yang
hilang setelah
iskemia, menginduksi revaskularisasi padadaerah trauma, dan mencegah
remodelling
patologis setelah infark 10•11.
Saatini
cardiomyoplasty
selulermenggunakan
MSCs tel
ahmenjadi altematif utama sebagai terapi
untukmeningkatkan
fungsi pada penyakit otot jantung10. Kandidat yang
ideal untuk
cardiomyoplasty
seluler
adalah
sel yang mempunyai kemampuan berdiferensiasi penuh sebagai otot jantung 10•
12. Populasi
sel
tersebut dapat ditemukan pada sumsum tulang dewasa. Saat ini telah
diketahui bahwa populasi sel adheren 'yang diisolasi dari sumsum tulang dan di
ekspansikan
secarain vitro, merupakan sumber yang potensial dari
undifferentiated
•
mesenchymal
stem
cells (MSCs) yangakan
menjadi tipe seljaringan penyambung11.
Pengeluaran MSCs dari
bone marrow
sebagai
res pon terhadap
stimulus untuk
mobilisasi
merupakan interaksi yang komplek dalam
microenvironment
pada
marrow
1
t
setempat. Beberapa faktor yang mungkin berperan sebagai penyebab kematian awal dari sel MSC dipengaruhi oleh saat isolasi dan injeksi sel, hipoksia, atau ketidakberadaan
survival factor.
Adanya kondisi hipoksia pada miokardium yang infark, akan menstimulus respon imun untuk bereaksi dan mengakibatkan terjadinya proses potensi redoks yang menghasilkan peningkatan stress oksidatif pada sel ototj
a
ntung
14.P
eni
ngk
at
an
ROS
me
nye
b
abk
an
modulasi dari molekul proinflamatori
seperti molekul
TNF-a
yang pada akhirnya mengaktifkan jalur aktivasi mitogen
activated protein kinase (MAPK)15'16. Aktivasi MAPK selanjutnya menyebabkan
kondisi patologis yang mengaktifkan kaskade apoptosis melalui caspase-3
9•16.Mengingat proses apoptosis menjadi faktor utama dari patogenesis kegagalar) MSCs berimplantasi pada daerah jantung yang infark, maka, penghambatan beberapa molekul yang terlibat pada apoptosis merupakan hal yang tepat untuk meningkatkan efektifitas terapi menggunakan
mesenchymal stem cells (MSCs).
Indonesia sebagai negara tropis mempunyai keragaman flora yang mempunyai p
ot
ensi besar untuk dikembangkan dalam dunia pengobatan. Akan tetapip
ene
lit
ian
tentang hal tersebut masih sangat sedikit, padahal berbagai kandungan zat yang
mempunyai khasiat sebagai obat banyak terdapat pada tumbuhan-tumbuhan tersebut.
Isoflavon darik
ed
ela
itelah diterima
secara luasdan menjadi perhatian selama beberapa
tahun karena potensinya dalam mencegah penyakit kronis. Genistein merupakan isoflavon utama yang berasal dari kedelai, bersifat sebagai fitoestrogen dan mempunyai berbagai aktivitas biologi. Sejauh ini genistein diketahui mempunyai beberapa efek antara lain menurunkanstress oxidative
17
dan meningkatkan sintesa NO 18• Meskipun beberapa data menujukkan genistein mempunyai peran proteksi pada penyakit jantung, namun mekanisme yang mendasarinya masih belum diketahui, dan penelitian tentang efek genistein pada penyakit jantung masih sangat terbatas.Genistein diketahui mempunyai efek menurunkan kolesterol serum dan
menurunkan insiden penyakit ko'roner. Yang lebih menarik, genistein juga mampu
menghambat aktivitas sitokin proinflamasi, menurunkan apoptosis kardiomiosit,
memperbaiki fungsi endotel dan meningkatkan imunotoleransi setelah transplantasi
18•19. Bebcrapa penelitian lain juga membuktikan genistein berperan scbagai
antiapoptosis pada berbagai sel, diantaranya genistein mampu memperbaiki fungsi jantung pada tikus dan babi dengan stenosis aorta dengan menghambat apoptosis pada kardiomiosit 19.2°. Meskipun terdapat beberapa bukti bahwa genistein sebagai antiapoptosis, namun peranan genistein dalam melindungi MSCs pada kondisi hipoksia
masih belum diketahui. Untuk itu pada penelitian ini akan diungkap mekanisme kerja genistein pada MSCs khususnya kemampuannya pada regenerasi sel kardiomiosit melalui penghambatan apoptosis pada kondisi hipoksia
in vitro.
Berdasarkankemungkinan keterkaitan kemampuan regenerasi MSCs tersebut dengan potensi
genistein sebagai antiapoptosis dan antioksidan serta kemudahan untuk didapatkan dan
keamanan yang lebih tinggi, maka penelitian ini perlu dilakukan.
1.2
Rumusan Masalah
•
Apakah peranan genistein pada viabilitas dan derajat apoptosis pada
ku1tur
MSCs dengan
kon
disi
h
i
poks
ia?•
Bagaimana efektivitas
genistein terhadap eks
pres
i p38MAPK, caspase-3 dan .ll.
TUJUAN PENELITIAN
2.1
Tujuan Umum:
Mengkaji
efektifitas
genistein
terhadap
ketahanan
mesenchymal stem cells
(MSCs)
khususnya dalam kemampuannya pada regenerasi melaJui penghambatan
apoptosis pada kondisi hipoksia in vitro.2.2
Tujuan Khusus:
•
Mempelajari peranan genistein terhadap viabilitas dan derajat apoptosis kultur
MSCs dengan
kondisi hipoksia.
•
Mempelajari efektivitas genistein terhadap aktivitas p38MAPK, caspase-3 dan
caspase-9
pada kultur MSCs
de
ngan
kondisi hipoksia.
2.3
Manfaat Riset
Dari penelitian ini diharapkan dapat memberikan pengetahuan bahwa proses apoptosis pada kultur
mesenchymal stem
cells (MSCs) pada kondisi hipoksia melalui mekanisme yang melibatkanjalur p38 MAPK, caspase-3 dan caspase-9.2.4
Hipotesis Riset
:Pemberian genistein
mampu
meningkatkan viabilitas dan
proliferasi MSC menghambat pro
ses apo
pt
o
s
i
s
pada kultur Mesenchymal stem cells
kondisi hipoksia melalui hambatan jalur p38 MAPK, caspase-3, dan caspase-9.
m. BAHAN DAN METODOLOGI PENELITIAN
3.1. Bahan
Medium Dulbecco's
(IMDM),
fet!ll bovine serum (FBS), rabbit polyclonal antibodies,anti
TNFa,
anti MAPK (Cell Signal Technology, Beverly, MA), mouse monoclonal
antibodies, anti-�-actin (SantaCruz). Horse-radish peroxidase-conjugated secondary
antibodies (SantaCruz Biotechnology), Caspase-3 colorimetric assay kit (Biovision
Research, CA), Caspase-9
colorimetricassay kit
(BiovisionResearch, CA).
3.2 Variabel Penelitian
3.2.1 Klasifikasi Variabel Penelitian
Dalam penelitian ini melibatkan 3 varia bel:
1. V ariabel bebas: Genistein
2.
Variabel kendali: Kondisihip
oksia kultur MSCs
3.Varia
bel Moderator:Kultur MSCs
4.
Variabel tergantung: jumlah apoptosis, prol
iferasi sel, kadar p38MAPK, kadar
caspase-9, kadar caspase-3.
3.2.2 Definisi Operasional Variabel Penelitian a. Variabel Bebas:
Genistein: Genistein adalah sediaan fitoestrogen yang dipakai sebagai terapi harmon (Sigma Chemical, St. Louis,MO). Diberikan dalam berbagai dosis yaitu 1 �mol/L,
5
�mol/L, 10 �mol/Lb. Variabel Ke
n
dal
i:Kondisi hipoksia: kultur MSCs dikondisikan hipoksia dengan konsentrasi
02
0.5%.
Kondisi hipoksia dilakukan dengan memberikan Anaeropack Anaero dari
MGCA
yang mengandung asam askorbat sehingga dapat mengubah
02
menjadi
C02
selama
1
jam.c. Variabel Moderator:
Kultur MSCs: MSCs diambil dari sumsum tulang kelinci New Zealand jantan,
usianya 6 bulan dan berat badan 900 gr. Usia 6 bulan merupakan usia remaja
bagi kelinci sehingga diharapkan mendapat BMSCs yang bagus. Sebelum
5
t
diambil kelinci dilakukan pembiusan kemudian dengan menggunakan spuit
10
ml yang sudah ada heparinnya stimsum tulang diambil secara aseptis. Setelahdidapat aspirat dari sumsum tulang kemudian aspirat di biakkan dalam medium k:ultur BMSCs.
d.
V
ariabel tergantung.I. Jumlah Apoptosis: banyaknya BMSCs yang mengalami apoptosis diwarnai dengan fluorescent dye
H
oechst dan propidium iodide. Analisis morfologi dilihat dengan mikroskop fase kontras dan mikroskop fluoresens (Olympus).Inti set yang berpendar biru menunjukkan apoptosis sedangkan nukleus yang berwarna pink menunjukkan nekrosis. Junilah sel dihitung dalam 10 lapang pandang tiap 400 sel yang kemudian hasilnya di rata-rata.
2.
Proliferasi sel: banyaknya sel mengalami mitosis yang diukur menggunakan MTT assay berdasarkan aktivitas dehidrogenase. Bila aktivitas meningkat maka wama pada well akan semakin ungu. Besamya intensitas warna diuk:ur dengan menggunakan spektrofotometer.3. Kadar p38MAPK: kadar p38 MAPK yang terfosforilasi pada kultur set MSCs yang diukur dengan ELISA
(p38 immunoassay kit assay design).
Nilai disajikan dalam satuan pg/mL.4. Kadar caspase-3: banyak:nya caspase-3 di dalam sel MSCs yang dideteksi dengan Colorimetric assay. Caspase-3 dideteksi berdasarkan hidrolisis dari peptida asetil-Asp-Glu-Val-Asp p-nitroanilid� (pNA) sehingga melepaskan
pNA. pNA mempunyai absorbansi tinggi pada
405
nm. Tingginya kadarpNA dapat diukur dengan menggunakan ELISA reader. Nilai satuan
disajikan dalam �glml.
5. Kadar caspase-9: banyaknya caspase-9 di dalam sel MSCs yang dideteksi
dengan Colorimetric assay. Caspase-9 dideteksi berdasarkan hidrolisis dari
peptlda asetii-Asp-Giu-Vai-Asp p-nltroanlllde (pNA) sehlngga melepaskan pNA. pNA mempunyai absorbansi tinggi pada
405
nm. Tlngglnya kadar pNA dapat diukur dengan menggunakan ELISA reader. Nilai satuan•
3.3.
Metode Penelitian
• llolall dan
Kultur Kultur MSCs
Isolaai MSCs dilakukan dengan mensambil
bone marrow
(sumsum tulana) kelinci sehatsecara aseptis. Sel-sel dari
marrow
yang diperoleh kemudian diletakkan pada kultur disk dengan densitas lxl06 sel/cm2 pada 6 well dengan medium IMDM yang berisi 15% FBS, suplemen stimulator MSC, dan antibiotik (100U
pen
i
cil
l
in/1
00 J.Lg/mL
streptomycin) pada suhu 37°C, 5% C02 ·dan udara 95%. Sel-sel yangtidak.
melekat digant
idengan medium yang
baru setelah 72j
am dan
sel
an
j
u
tnya set
iap4
hari sekali.Identifikasi sel-sel MSC dilakukan menggunakan flowcytometry (CD 105 dan CD 45).
Induksi apoptosis pada MSCs dilakukan dengan kondisi hipoksia yaitu dengan
mem
asukkan
flask kulturk
edalam inkubator khusus
yang didalamnya diberikan anaeropack dari MGCA 13.• Perlakuan Genistein.
Setelah konfluen, sel diinkubasi dengan genistein. Konsentrasi genistein (Sigma) yang digunakan dalam penelitian ini adalah 1, 5, dan 1 OJ.Lmol/L. MSCs diinkubasi dengan beberapa konsentrasi genistein selama 24
jam.
•
Uji
MTT Assay
Viabilitas sel untuk pengujian proliferasi sel menggunakan metode uji MTT (Cell
proliferation kit
1, KPL Diagnostic)dimana garam
tetrazolium berwarnakuning
dimetabolisme oleh sel viabel menjadi kristal formazan yang berwana ungu. MSCs diinkubasi selama 3 jam dengan larutan MTT (5 mg/ml). Kristal formazan dilarutkan dalam bufer SDS (100/o SDS dalamO.OIN HCI)
semalam dan produk diukur secara spektrofotometri pada A. 570 run.• Kadar p38 MAPK dengan ELISA.
Kadar
TNF-n
dan MAPK intraseluler pada set MSC dengan beberapa k
on
d
isi
hipoksia diuku r dengan metode ELISA, prosedur pengukuran dilakukan sesuai
dengan petunjuk yang tertera pada label Anti Rat ELISA Kit (Assaydesign).
7
• Detekll Sel Apoptosis dan
Nekrosis.
Untuk mengidentifikasi set apoptosis dan nekrosis, kondensasi kromosom diwamai d
e
nga
nfluorescent dye
Hoechst 33342 (Sigma) dan propidium iodide (Sigma)(
Jank
ows
ka et a/, 1997).
Sel-sel difiksasi pada suhu ruang
selama 30 me
ni
t dalamPBS yang mengandung
1%
glutar
al
de
hy
de
, dicuci 2kali
denganPBS selanjutnya
dipaparkan pada
5
�g/ml
Hoechst
33342 dal
am
PBS
s
el
ama
30menit suhu
ruang.
Analisis morfologi dilihat dengan mikroskop fase k.ontras dan mikrosk.op fluoresens
(Olympus). Inti sel yang berpendar biru menunjukkan apoptosis sedangkan nukleus
yang berwama pink menunjukkan nekrosis.
• Kadar caspase-9 den gao
Colorimetric
Assay.Kadar
Caspase·3 dan caspase·9 pada MSCs yang sudah dipapar dengan beberapa konsentrasi Genistein diukur dengan
Colorimetric Assay.
• Analisis Data
Data hasil p
e
ngu
kur
a
nditampilkan dalam mean± SD. Data
dianal
is
i
s dengan
menggunakan
one-way ANOVA(
a
n
al
is
i
s
ragam) dilanjutk.an dengan uji Tukey untuk
melihat perbedaan masing-masing variabel. Analisis data dilakukan dengan
komputerisasi menggunakan metode
SPSS
versi
11.
3.4 Diagram Alir Penelitian
ldentifikasi CD 105
Meta de
Pl
+ Genistein
lj.tmoi/L
Plr:
...
;+.
aenlstelh
t.:·
·=:
:.s���ll:�: .
9
t
IV.
BASIL DAN PEMBAHASAN
4.1 Basil Penelitian
4.1.1 Morfologi Kultur MSCs
Penelitian ini
m
enggunakan
sa.mpel dari sumsum tulang kelinci, Penelitian initelah
diajukan pada komisi etik Lembaga Penelitian Universitas Airlangga. Kriteriadonortikus
adalah de
ngan
berat 150 gram dengan usi� 1,5 bulan.Isolasi MNCs dilakukan dengan mengambil sumsum tulang kelinci sehat secara
aseptis dan diaspirasi ke dalam spuit yang telah diberi heparin 1000 unit. Pengambilan
aspirat sumsum tulang tikus dari daerah krista iliaka. Sebelumnya tikus dibius dengan
injeksi ketamin (untuk induksi) 20 mg!kgBB dan Xylasin (untuk sedasi)
3mglkgBB.
Pada daerah pengambilan didisinfeksi
yangkemudian ditutup doek
steril.
Pada pengambilan pertama didapatkan kurang dari 1 mlsumsum tulang.
KemudianMNCs
dipisahk:an dengan menggunakan Ficoll-paque (1077;Sigma). Setelah disentrifus 1600 rpm selama15
menit maka Buffy coat yang terbentuk diambil dengan menggunakan pipet pasteur secara perlahan.Kemudian sel MNCs
dibilas dengan PBSlx
dan disentrifus 1600rpm selama
10menit. Pelet yang terbentuk diresuspensi dengan medium kultur yang komplit yang
berisi o.-MEM, FBS
20%,1-Glutamin 2mM, dan antibiotik (100
U
penicillin/100 j.lg/mL
streptomycin). Hasil resuspensi diletakkan ke beberapa plate dengan volume masing
masing plate
5mi. Kemudian sel diamati pertumbuhannya setiap
hari
dan setiap tiga
hari medium
dig
anti.
Pada pengambilan yang pertama
terjadi kegagalan pertumbubanMSCs.
Pertumbuhan sel sangat lambat sehingga sel akhirnya mati. Hal ini diakibatkan karena kontak antar sel (cell signaling) terhambat sehingga tidak segera terbentuk koloni sel. Ketika diulang isolasi yang ke dua pada saat pengambilan aspirat terdapat kesulitan danhasil aspirat kurang
dari 1ml.
Set
el
ah selMNCs ditanam ke plate maka setelah diamati
pertumbuhannya lambat dan terjadi kontaminasi.
Keberhasilan isolasi MSC dari sumsum tulang sangat bergantung dari cara
pengambilan dan jumlah aspirat yang djdapat. Jika jumlah sel yang didapat sedikit
maka komunikasi antar sel juga terganggu. Cara pengambilan yang sulit mengakibatkan
kemungkinan terjadinya kontaminasi juga tinggi.
•
Dengan pertimbangan di atas maka diambil keputusan untuk mencoba donor sumsum tulang berasal dari kelinci. Berat badan kelinci yang digunakan adalah
900
grdengan usia 6 bulan.
Setelah aspirat didapatkan dan set
MNCs
dipisahkan dengan Ficoll-hipaquemaka sel tersebut dibiakkan kedalam plate dan ditambahkan medium
kultur
yang
komplit. Pada hari pertama tampak sel masih berbentuk bulat dan b
el
ummenempel ke
dasar plate.
Gambar
4.1.
Gambaran sel MSCs pada hari pertama setelah kultur. Tampak sel yang masih berbentuk bulat-bulat.Pada
3 x24 jam
sel harus dicuciuntuk
memisahkan antara MSCdengan
sel
hemopoeitik. MSC akan melekat pada dasar plate sedangkan set hemopoeitik tidak: melekat pada dasar plate.Gambar 4.2. Gambaran sel MSCs setelah dilakukan pencucian. Sel dengan
bentuk poligonal yarig telah adheren.
I
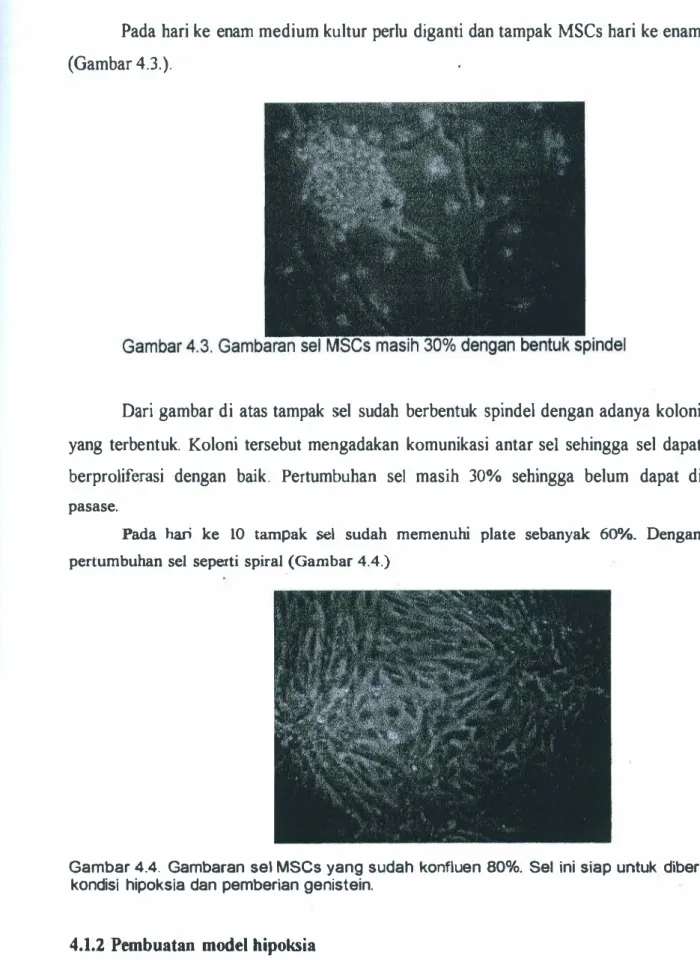
Pada hari ke enam medium kultur perlu diganti dan tampak MSCs hari ke enam
(Gambar
4.3.).
Dari gambar di atas tampak sel sudah berbentuk �pindel dengan adanya koloni
yang terbentuk. Koloni tersebut mengadakan komunikasi antar sel sehingga sel dapat
berproliferasi dengan baik. Pertumbuhan sel masih
30%
sehingga belum dapat di
pasase.
Pada hari
ke
10 tampak selsudah memenuhi plate sebanyak
60%.
Dengan
pertumbuhan sel seperti spiral
(Gambar 4.4.)Gambar 4.4. Gambaran sel MSCs yang sudah konflue·n
80%.
Sel ini siap untuk diberikondisi hipoksia dan pemberian genistein.
4.1.2
Pembuatan model hipoksia
Pembuatan model hipoksia dengan menggunakan anaeropack Anaero. Alat ini
mengandung asam askorbat yang dapat menyerap Oksigen dan mengubahnya menjadi
•
C02. Bila telah terjadi kondisi hipoksia maka bahan ini akan berubah warna menjadi
ungu. Hipoksia yang dihasilkan oleh alat ini
bisamencapai kadar 02 0,5% dalam
1
jam.
Pada
kultur MSCno
rmalmenunjukk:an gambaran sel yang normal, yang
mempunyai ciri-ciri bentuk sel poligonal dengan jarak antar sel yang teratur dan rapat, permukaan sel rata ditandai dengan penampakan inti, membran plasma, sitoplasmaserta
matriks ekstraseluler). Sedangkan pada MSC hipoksia menunjukkan ga.mbaran sel yang mengalami apoptosis. Hal ini ditandai dengan MSC yang mengalami selshrinkage,
membran menggelembung
(blebbing),
inti
sel fragmentasi.4.1.3.
ldentifikasi Sel MSC
Dari hasil identifikasi dengan menggunakan CD
1
05/endoglin didapatkan bahwa
sel
yang di cat dengan FITC
mampu berpendarhijau. Hal ini menunjukkan sel tersebut
mengekspresikan CD 105. Seperti diketahui CD 1 05+merupakan
marker bagi sel MSCs.Gambar 4.5. Gambaran hasil identifikasi sel MSCs. A. Merupakan
selMSCs yang
belum diidentifikasi.
B.Sel MSCs yang yang telah diidentifikasi dengan
menggunakan CD1 05/endoglin dengan pengecatan FITC. Dengan
menggunakan mikroskop elektron tampak sel berpendar hijau.
4.1.4 Viabilitas MSCs pada kondisi bipoksia setelab pemberian genistein dengan menggunakan MTT assay.
Setelah terbentuk
MNC,
sel kemudian diinkubasi dengan genistein padakonsentrasi
1,
5,
10
J.UllOl/L
selama
1
jam dengan kondisi hipoksia.
Pada
pengamatan
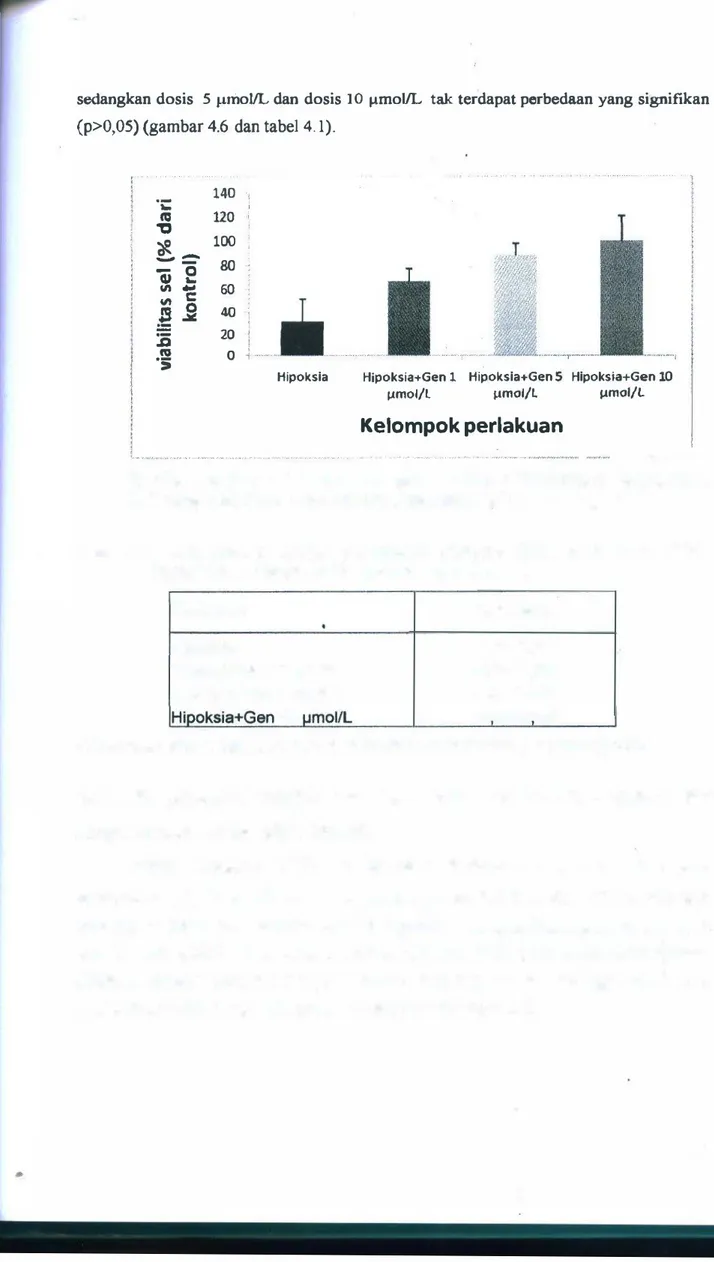
terhadap viabilitas kondisi hipoksia terjadi peningkatan viabilitas MSCs seiring dengan
peningkatan dosis genistein. Terdapat perbedaan yang signifikan (p<O,OS) antara dosis
0
J.UllOIIL
dengan do sis
1
�-tmol/L dan dosis
1
�-tmol/L dengan dosis
10
llffiOI!L
13
Isedangkan dosis
5 J.unoVL dan dosis 10 J.Lmoi/L
takterdapat perbedaan yang signif"'tkan
(p>0,05) (gambar 4.6 dan tabel 4. 1).
\ 140 ·.: co 120 --1 ,
*'
100 --0
80 "Qi
� .... ... 60 � c�
j
40 .,:s
20 j I IV 0 i· ·s ' �--� , __ .,_..,,..,,..,, ... � ... ·-·� ··---� ... -� ., ... ,. Hipoksia ... . . ... . . . ... '''')Hlpoksia+Gen 1 Hipoksia+Gen 5 Hipoksia+Gen 10
�o�mol/l j..lmoi/L j..lmoi/L
Kelompok perlakuan
!
' ,, ,, ''" -� o '' ' • � O O ··�••M••<-' .. ,,,.,,,,�, "��"�"'"' """ ... v..• ... ... -.. -... � ... -.,. •• ..,... .... , ·-�_..,.,..,..,,,....,,_tGambar
4.6. Diagram batang hasil pengukuran viabilitas MSCs dengan menggunakan MTI assay pada kultur MSCs hipoksia yang dipapar beberapa dos
is geni
stei
n.Tabel
4.1.Hasil analisis statistik pengukuran viabilitas MSCs pada kultur MSCs
hipoksia yang dipapar beberapa dosis genistein
Per1akuan
Mean±SD
•
Hlpoksla
32,0::1:19,788
Hipoksia+Gen
1 !Jmoi/L 66,9::t:10,63bHipoksia+Gen
5!JmOIIL
88,7::t:9,01bo
Hipoksia+Gen
10j.Jmoi/L
99 8:1:20 86°Keterangan : notasi yang sama menunjukkan tidak ada perbedaan yang nyata
(p>0,05)
4.1.5
Efek pemberiao genistein terhadap aktivitas p38
MAPK,
Caspase-3, dan
Caspase-9 pada kultur MSCs hipoksia
Setelah terbentuk
MNC,
sel kemudian diinkubasi dengan genistein pada
konsentrasi 1,
5,10 )llllOIIL selama
1
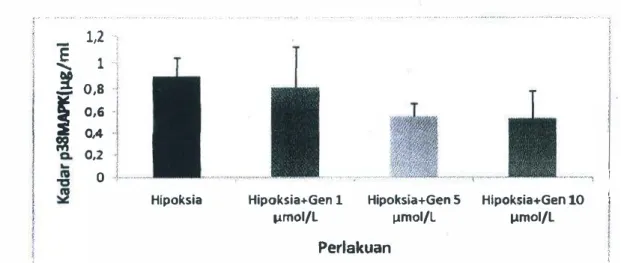
jam dengan kondisi hipoksia. Pada pengamatan
terhadap aktivitas p38
MAPK,kondisi hipoksia menyebabkan peningkatan pada
aktivitas p38
MAPK.Pemberian genistein beberapa
dosis
pada kultur menunjukkan
t
e
lj
a
di penurunan
pada
aktivitas p38
MAPKd
e
ngan
penurunan tertinggi terjadi p·ada
pemberian genistein dosis 10
!lmoi/L (gambar 4.7
dan tabel 4.2).
14
" ... �·--· ... � ... .... .. ••··-··; ·--·�---� .. ---.��--·--···"'' r· .. ... .. �---··�--··--·· . . . ·---· · ... -· -- . . . . < ! 1,2
e
...!
I
�
Q. 1 0,8 0,6 . 0,4 0,2 0 Hipoksia I Hipoksia+Gen 1 Hipoksia+Gen 5 Hipoksia+Gen lol
.
·
!
v.moi/L �-tmoi/L llmoi/L
,
Perlakuan
·.
I
!
. ... . . " . . .. JGambar 4.7. Diagram batang hasil pengukuran aktivitas p38 MAPK pada kultur MSCs hipoksia yang d
ipapar beberapa dosis genistein.
Perlakuan
Hlpoksla
0,9:t0, 14•
Hipoksia+Gen
1 �moi/L0,8:t0,3111
Hipoksia+Gen 5
�moi/L0,6:t0,12•
Hi oksia+Gen
10
moi/L0,5±0,2411
Keterangan : notasi yang sama menunjukkan tidak ada perbedaan yang nyata
(p>O,OS)
Hal yang serupa ditunjukkan pada aktivitas caspase-9 dan caspase 3 yaitu teljadi
penurunan tetapi tidak signifikan pada kelompok yang diberi genistein dibandingkan
dengan kelompok hipoksia, penurunan paling nyata pada kelompok genistein
konsentrasi
5
�ol/L.
- 140'l
�
120 -1 c 100·1
.z.J
01 80 �!
a. 60
"!
., I rJ 40 ·1
� 0 i , 2 1�
' 0 .. ; . Hipoksia . ... . ... ! I < ' iHipoksia+Gen 1 Hipoksia+Gen 5 Hipoksia+Gen 10 i
( �mol/l 1Jmoi/L �oi/L
!
;
Perlakuan !
< !
L--·----···---· ... . ... .. ... ... _, .. . ----···-·-· ...
--·-
----·----J
Gambar 4.8. Diagram batang hasil pengukuran kadar caspase 9 pada kultur MSCs hipoksia yang dipapar beberapa dosis genistein.
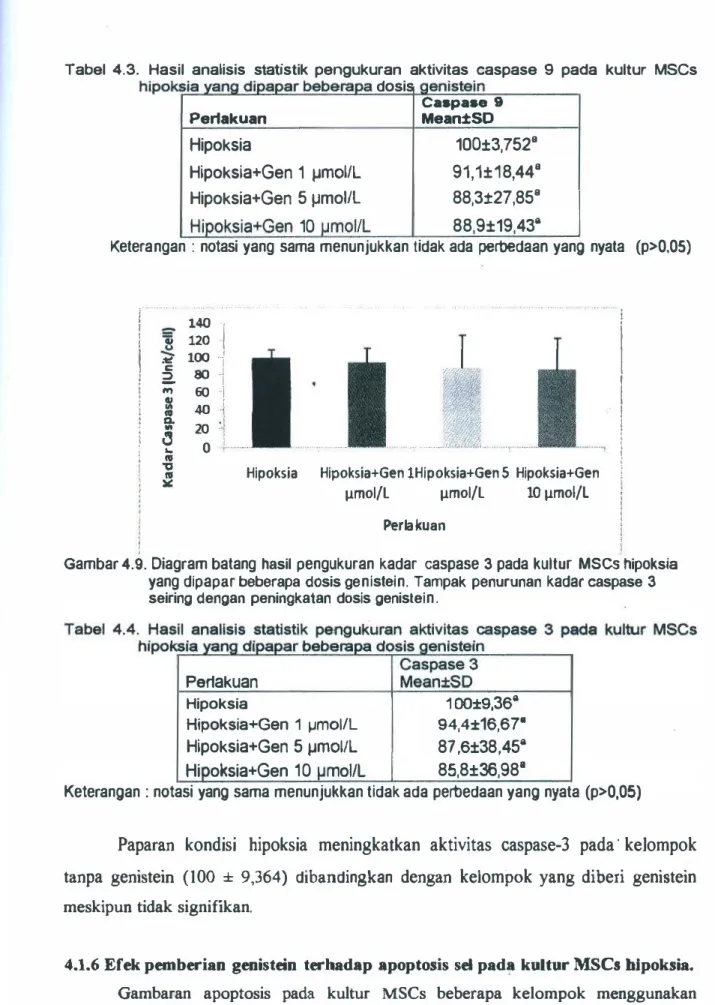
Tabel 4.3. Hasil analisis statistik pengukuran aktivitas caspase
9pada kultur MSCs
hipok
sia vane dipapar beberaoa dosis aenistein
Caspase 9 Perlakuan Mean±SD
Hipoksia
100±3,7528Hipoksia+Gen
1�moi/L
91,1±18,448Hipoksia+Gen
5�moi/L
88,3±27,858Hipoksia+Gen
10�moi/L
88,9±19,438Keterangan : notasi yang sama menunJukkan tldak ada perbedaan yang nyata (p>0,05)
I
l
-I!
!
� c: 2.I
"" � : ftl : Q. i "' la
i .. i ftl ' "tJ tV :111:: 140.1
120-1:
-
-1
60 ·-1 40 I.1
20 'l 0 '-Hipoksia
I
!
l It
Hipoksia+Gen lHipoksia+Gen
5Hipoksia+Gen
•�moi/L
�moi/L
10�moi/L
P
er
l
a
kuan
Gambar 4.9. Diagram batang
hasil
pengukuran kadar caspase 3 pada kultur MSCshipoksia
yang dipaparbeberapa dosis ge
ni
stei
n.Tampak penurunan
kadarcaspase
3seiring dengan peningkatan dosis geniste
i
n.Perlakuan
Hipoksia
1 00±9,368Hipoksia+Gen 1
tJmoi/L
94,4±16,678Hipoksia+Gen
5�moi/L
87 ,6±38,458Hi oksia+Gen
10moi/L
85,8±36,988Keterangan : notasi yang sama menunjukkan tidak ada perbedaan yang nyata (p>0,05)
Paparan kondisi hipoksia meningkatkan aktivitas caspase-3 pada
·kelompok
tanpa genistein
(100
±
9,364)
dibandingkandengan kelomj:>Ok yang diberi genistein
meskipun tidak signifikan.
4.1.6 Efek pemberian genistein terbadap apoptosis sel pada kultur
MSCs
hipoksia.Gambaran apoptosis pada kultur MSCs beberapa kelompok menggunakan pewarnaan
fluorescence dye Hoechst
33342
(
Sig
ma)
danpropidium iodide
(Sigma),•
menunjukkan adanya gambaran apop
tos
i
s
pada sel yang berwarna biru. Gambaran sel
apoptosis, ditandai dengan MSCs yang mengalami sel
shrinkage,
membran
menggelembung (b/ebbing),
dan inti set fragmentasi (gambar 4.8).
Hasil
a
nal
is
i
s s
tat
ist
i
k
pe
rs
e
n
ta
se
j
um
l
a
h ap
o
p
t
osi
s
MSCs pada kultur MSCs
kondisi hipoksia yang dipapar beberapa dosis genistein
me
n
u
n
j
ukk
an terdapat
persentase jumlah sel apoptosis yang lebih tinggi pada kelompok tanpa diberi genistein
(45,6±4,560)
secaranyata (p<0.05). Pemberian genistein menurunkan jumlah sel
apoptosis pada dosis
1
�mol/L tetapi tidak. berbeda nyata dengan hipoksia. Penurunan
yang signifikan terjadi pada dosis 5 Jlmol/L (1 8,4±6,066)
dan10 J.UnOIIL (22,4±3,578)
dibandingkan dengan tanpa pemberian genistein., namun pada dosislO J.UnOl!L terjadi
kenaikan kembali jumlah set apoptosis walaupun tidak berbeda nyata dengan kelompok
dosis
5
f.UllOVL.
Tabel
4.5.
Hasil analisis statistik persentase jumlah apoptosis pada kultur MSCs
k
d
hipo sia yang
ipapar beberapa dosis genistein
Persentase apoptosis
Pertakuan
Mean±SD
H
ip
o
ksia
45,6±4,568
Hipo
ksia+G
en 1 �moi/L37,6±7,278
Hipoksia+Gen 5
1Jmoi/L
18,4±6,07b'
Hipoksia+Gen
1 0 IJmOVL22,4±3,58b
Keterangan : notas1 yang sama menunJukkan tldak ada perbedaan yang nyata (p>0,05)
Gambar
4.10.
Gambaran apoptosis kultur MSCs mengguna
kan pewamaan nuorescence dye Hoechst 33342. Oengan menggunakan mikroskopfluoresent
tampak inti sel yang berpendar biru seperti yang ditunjukkanpanah.
17
I4.1
Pembahasan
Hasil penelitian menunjukkan kondisi hipoksia,
menghambat kemampuan
MSCs dalam membentuk koloni dan menurunkan aktivitas proliferasi. Kemungkinan
hipoksia menginduksi terjadinya ROS yang akan menginduksi tetjadinya apoptosis
pada
kultursel MSCs.
Genistein merupakan salah satu isoflavon yang terdapat pada kedelai. Genistein
•mempunyai banyak efek diantaranya
adalah
efek hormonal karena bersifat sebagai
fitoestrogen, anti inflamasi, anti oksidan, dan mempengaruhi proliferasi dari sel. Studi
pada sel MCF-7 (Human breast cancer cells) menunjukkan efek bifasik dari genistein
yaitu pada konsentrasi rendah memicu pertumbuhan sedangkan pada konsentrasi tinggi
menghambat pertumbuhan
21.Mekanisme yang terjadi untuk menjelaskan peristiwa
bifasik tersebut belum sepenuhnya jelas. Penelitian pada
setotot genioglossus
didapatkan basil genistein pada konsentrasi rendah (
<10 nM) tidak menunjuk:kan efek,
pada konse
ntras
i sedang ( 10
nM - 1f.1M)
mampu melindungi sel terhadap
·apoptosis
karena hipoksia, sedangkan pada konse
ntras
i tinggi (>
1f.1M) memicu terjadinya
apoptosis. Proteksi genistein pada hipoksia
d
i
du
ga
me
l
al
u
i
pe
ni
n
g
ka
t
an
Akt
dan
ERK,
juga efek antioksidannya mampu menghambat
ROS,
disamping itu genistein juga
mempengaruhi rasio Bax/BCI2 menjadi turon
22.Hasil pengukuran kadar p38
MAPK
menunjukkan pada kondisi hipoksia
menyebabkan
peningkatan aktivitas p38 MAPK. Pemberian
genistein beberapa
dosis
pada kultur menunjukkan terjadi penurunan pada aktivitas p38
MARKdengan
penurunan terti
nggi terjadi pad a
pem
b
e
ri
a
n
genistein dosis
10
�ol/L.
Hal
ini
menunjukkan bahwa hipoksia pada sel
kuturMSCs merupakan
halyang potensial untuk
terbentuk
radikalbebas yang akan menginduksi kematian sel apoptosis melalui induksi
jalur p38 MAPK. Peningkatan aktivitas p38 MAPK pada
selakan
menginduksi
apoptosis melalui fosforilasi faktor transkripsi p5328. Pengakiifan p53 selanjutnya
akan
mengaktifkan bax sebagai proapoptosis yang akan menginduksi pengeluaran
cytochrome
cdari mitokondria
29•30.Pemberian genistein menurunkan aktivitas p38
MAPK
secara nyata pada dosislO
�,
menunjukkan genistein sebagai antioksidan
berperan menghambat pada jalur sinyal apoptosis ini.
Hasil pengamatan terhadap aktivitas caspase-3 pada penelitian ini menunjukkan
hipoksia meningkatkan aktivitas caspase-3 pada kelompok
kontrol
(0,9±0,
139)
(p>0.05). Pemberian genistein bebetapa dosis mampu menurunkan
kadarcaspase-3
tetapi tidak berbeda nyata dibandingk:an kontrol. Hal serupa juga terjadi pada aktivitas
18
•
oatpate-9. Hi
p
ok
tia merupakan kondisi yangpo
tensial dalammonalndukli terjadinya
stress oksidasi melalui peningkatan produk
reactive
oxygen species(ROS) dan
perubahan fungsi sel MSCs.1.s ROS berperan penting pada proses apoptosis yang
diinduksi oleh hipoksia, hal ini juga menunjukkan bahwa hipoksia, melalui
peningkatan
aktivitas caspase-9 dan caspase-3 dapat menginduksi terjadinya apoptosis sel MSCs.
Antioksidan genistein berperan pada penghambatan apoptosis sel, diduga genistein
mencegah caspase-9 dan caspase-3 memecah sitoskeleton maupun protein lain.
Pengamatan sel apoptosis menggunakan pewarnaan
fluorescence dye Hoechst
33342 menunjukkan terdapat
p
eni
ng
k
at
an
persentase jumlah
sel
apoptosis pada
kelompok kontrol (45,6±4,560) dan perlakuan genistein dosis
1
�mol/L s
ecaranyata
(p<O.OS). Pada
kulturMSCs hipoksia menunjukkan terjadi perubahan morfologi EPC
yang abnormal, ditandai dengan sel yang mengalami shrinkage,
danpembe
saranmembran
(membrane blebbing).
Inti sel tampak mengalami fragmentasi atau
kondensasi nukleus (Gambar 4.5B). Berdasarkan basil pengamatan morfologi tersebut
diatas, dapat disimpulkan bahwa terjadi apoptosis pada MSCs. Menurut Robbins,
et a/.
(1996),
terdapat dua b
entuk kematian sel
yang masing-masing mempunyai
c
i
ri
-
ciri
morfologi yang berbeda, yaitu apoptosis dan nekrosis32. Pada apoptosis terjadi kematian
sel yang terprogram, yakni fragmentasi kromatin, inti sel menjadi padat, ukuran sel
mengecil dan badan
sel
mengkerut. Sedangkan pada nekrosis, sel
nampak
men
gg
ele
m
bu
n
g
(swelling),
kromatin menggumpal, hilangnya integritas organel set dan
membran plasma, yang pada akhimya sel menjadi pecah
(membran
damage) .
.
Perubahan morfologis dasar pada apoptosis dan nekrosis disebabkan teijadinya
dena
turasi protein
danpen
cemaanenzimatik organel dan sitosol.
Halini menunjukkan
adanya proses stress oksidatif akibat kondisi hipoksia yang menyebabkan gangguan
proses replik.asi sel sekaligus menginduksi terjadinya apoptosis. Patomekanisme
terjadinya kematian sel disebabkan oleh jejas pada sel, salah satunya akibat jejas
kimiawi, yang menyebabkan meningkatnya produksi radikal bebas ataupun senyawa
oksigen reaktif (ROS) di dalam sel yang berasal dari reaksi oksidatif metabolik yang
berlebihan di dalam sel
27•33•34.Pemberian genistein menurunkan jumlah sel apoptosis pada dosis
1
�mol/L
tetapi tidak berbeda nyata dengan kontrol. Penurunan yang signiflkan terjadi pada dosis
5 �moi!L (18,4±6,066)
dan10 !J.ffiOI!L (22,4±3,578) dibandingkan dengar1 kontrol.
Penurunan gambaran apoptosis
selsetelah pemberian genistein m
enggunakan
pengecatan Hoechst 33342 ini sejalan dengan basil yang diperoleh pada pengukuran
aktivitas p38, caspase-9, dan caspase-3, me
n
u
n
j u
kk
anbahwa
proses apoptosis terjadi melaluij
a
l
u
ryang
melibatkan p38, caspase-9, dan caspase-3. Diduga genistein
menurunkan apoptosis melalui penurunan aktivitas
p38atau ketiganya,
p38 cas
pas
e-
9,dan
c
as
pase
-3.
Peningkatan
aktivitas
p38akan memicu sinyal
apoptosis melalui p
eni
n
gka
tanfosforilasi faktor transkripsi p53
sehingga akan
meningkatkan aktivitas bax sebagaiproapotosis yang akan meningkatkan pengeluaran cytochrome c dari mitoko
n
dria
.
Cytochrome c akan berikatan dengan protein Apaf 1 sehingga akan menarik caspase-9
untuk membentuk apoptosome 30•36. Apoptosome selanjutnya akan mengaktifka.n caspase-3 sehingga akan memecah protein lain dan terjadi apoptosis (Gambar
4.
9).
Penurunan persentase gambaran sei apoptosis setelah pemberian genistein menunjukkan
te
rd
a
pat
peran antioksidan dalam menekan
a
poptos
is
melalui jalur
p38dan
caspase-3.Dengan demikian p
a
da
penel
iti
a
n
ini dapat
disimpulkan
bahw
ati
n
gg
in
ya proses stress
oksidasi
pa
da kondisi hipoksia menyebabkan meningkatnya apoptosis
s
el
.P
eni
ngkat
anapoptosis
set terjadi melalui jaluryang melibatkan
p38 MAPK, caspase-9, dancaspase-3.
Genistein sebagai antioksidan mampu menghambat peningkatan apoptosis dengandosis optimum 10
•
V. KES�PULAN DAN SARAN
V.l. KesimpulanDari basil penelitian dapat disimpulkan
bahwa
genistein dapat meningkatkan
viabilitas MSCs secara signiflkan dan menurunkan derajad apoptosis MSCs
secarasigniflkan pada kondisi hipoksia seiring dengan meningkatnya dosis genistein. Terjadi
penurunan kadar p38MAPK, caspase-3" dan caspase-9 tetapi tidak signifikan. Hal
tersebut menun
j
ukkan bahwa genistein sampai dengan do sis
10
�mol/L bel urn efektif
menghambat p38MAPK, caspase-3 dan caspase-9.
V.2. Saran
Pcrlu
dilakukan penelitian yang lebih lanjut dengan menambah atau memperluas
variasi dosis genistein dan jalur lain yang menyebabkan apoptosis pada
MSCskondisi
hipokasia. Disamping perlu juga diketahui
efekpenggunaan genistein pada terapi sel
punca MSCs secara invivo.
21
UCAPAN TERIMA KASm
Peneliti mengucapkan terima kasih yang sebesar-besarnya kepada :
.1.
Kepala beserta Staf Badan Penelitian dan Pengembangan Kesehatan
Kementrian ·Kesehatan Republik Indonesia melalui program Risbin Iptekdok
yang telah menyediakan
dana penelitian.
2.
Dekan Fakultas Kedokteran Universitas Jember
yang telahmemberikan ijin
dan kemudahan dalam pelaksanaan penelitian.3.
Prof Dr. Fedik Abdul Rantam,
drh., yang telahmemberikan saran
untuk
perbaikan penelitian.
4.
Direktur
lTDUnair atas fasilitasnya sehingga penelitian
1m dapat
dilaksanakan.
5.
Tim panel gizi atas berbagai saran dan masukan demi perbaikan penelitian.
6.
Semua pihak yang telah membantu terselesaikannya penelitian ini, yang tidak
dapat kami sebutkan satu persatu.
DAFT AR PUSTAKA
1.
Beltrami
AP,Urbanek K, Kajstura
J, Yan
SM,
Finato
N,
Bussani
R,
Nadal-Ginard
B, Silvestri F, Leri A. Beltrami CA.
Anversa
P. 2001.
Evidence that
humancardiac
myocytes divide after myocardial infarction. N Engl J Med 344:1750-1757.
2.
Bra
u
n
w
al
d
E,
B
ri
stow M.2000. Congestive heart failure: fifty years
of
pr
o
gress. Circulation;102:
IV 14-IV23.3. Stamm C, Westphal B, Kleine HD, Petzsch M., Kittner C, Klinge
H,
Schumichen C,Nienaber CA. Freund
M.,
Steinhoff G. 2003. Autologous bone-marrow stem-celltr
anspla
nt
atio
nformyocardial regeneration. Lancet 361: 45-46.
4.
Katritsis DG, Sotiropoulou PA, Karvouni E, Ka�abinos
I,
Korovesis S, Perez SA,
Voridis EM, apamichailM. 2005. Transcoronary transplantation of autologous
mesenchymal stem cells and endothelial progenitors into
infracted
human
myocardium. Catheter Cardiovasc Interv. 65:32 1-329.
5.
Mark
FB, Adam
JE, Woo
YJ,
Timothy
JP, LawrenceTB, Vasant
J,Kevin
JM,
Timothy JG, Dennis ED, Sweeney
HL.2006. Mesenchymal
stem cell
injection
after myocardial infarction improves myocardial compliance.
AmJ Physiol Heart
Circ Physiol 290:H2196-H2203.
6. Miyahara Y, Nagaya N, Kataoka M, Yanagawa
B,
Tanaka K, Hao H, Ishino K, Ishida H., Shimizu T, Kangawa K, Sano S, Okano T, Kitamura S, Mori H. 2006.Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction. Nat Med
12:459-465.
7.
K
e
n
ic
h
i
r
o
H,
Noritoshi
N,
Takashi
I,Itoh
T,Murakami S, Shimizu
Y, Taki W,Miyatake
K,
Kangawa
K.
2005.
Adrenomedullin
enhances therapeutic potency of
mesenchymal stem cells
after e
xp
e
ri
me
n
tal
stroke in rats. Stroke 36:853-858.
8.
Tang
YL,
Zhang
YC,
Qian,
Shen LP,
Ph
il
l
i
p
s
MI.
2005.
Improved graft
mesenchymal stem
cell
survival in ischemic
heart
with a hypoxia-regulated
hemeoxygenase-1 vector. J Am Coli Cardiol 46: 1339-1350.
9.
Geng
YJ
.
2003. Molecular mechanisms for cardiovascular
stem cell
apoptosis and
growth
in
the hearts with atherosclerotic coronary diseaseand
ischemic heartfailure. Science, Ann NY Acad
1010:687-697.
10. Hamano K,
Li
TS, Kobayashi T, Hirata K, YanoM.,
Kohno M, Matsuzaki M.2002.
Therapeutic angiogenesis induced by local autologous bone marrow
cellimplantation. Ann Thorac
Surg 73:1210-1215.
1 1 .
Toma C, Pittenger MF, Cahill KS, Byrne BJ, KesslerPD. 2002. Human
mesenchymal stem cells differentiate to
a
cardiomyocyte phenotype in the adult
murine heart. Circulation 105: 93-98.
12. Wang J
-S
,
Shum-Tim
D,
Galipeau
J,
et al. Marrow stromal cells for cellular
cardiomyoplasty: feasibility and potential clinical advantages.
J
Thorac Cardiovasc
Surg.
2000; 120:999-1006.
13. Keira SM, Ferreira
LM,
Gragnani A, Campaner
AB.
2004. Experimental model
for
establishment of hypoxia in 75 cm2 culture flasks. Acta Cir Bras,
Vol
19 Special
Edition,
http://wvvw.scielo.br/acb.23
t
14.
Zhu WQ, Chen
JH,
Cong
XF,
Hu
SS,
Chen
X.
2006. Hypoxia and serum
deprivation-induced apoptosis in mesenchymal stem cells. Stem Cells 24:416-425.
15. Maack C,
K
artesT,
Kilter
H,Scha .. fers
HJ, Nicken
ig
G,
Bo"hm M,
Lau
f
s U.2003. Oxygen free radical release in human failing myocardium la aaaociated with increased activity of racl-GTPase and represents a target for statin treatment. Circulation 108:1 567-1574.
16. Xie J, Qian J, Yang J, Wang S, Freeman ME, lli, Yi Q. 2005. Critical roles of
Raf7MEK/ERK and
PI3K/AKT
signaling and inactivation of p38 MAP kinase inthe differentiation and
survival of monocyte-derived immature dendritic
cells. ExpHematol 33:564-572.
17. Wei H, Bowen R, Cai Q, et
al,
19
9
5
.Antioxidant and antipromotional effects of the
soybean isoflavone genistein.
Proc Soc Exp Bioi Med.
1995; 208:124-130.
18. Liu D, Homan L, Dillon
J.
2004. Genistein Acutely Stimulates Nitric Oxide
Synthesis in Vascular Endothelial Cells by a Cyclic Adenosine 5'-Monophosphate
Dependent Mechanism . Endocrinology Vol. 145, No. 12 5532-5539.
19.
Min
JY,L
ia
o H, Wang JF,Sullivan
MF, ItoT,
and Morgan
JP. 2002. Geni
stein
Attenuates Postischemic Depressed Myocardial Function by Increasing
Myofilament Ca2+ Sensitivity in Rat Myocardium. Exp Bioi Med Vol. 227{8):632-638.
20. Si H and Liu D. 2008. Genistein, Upregulates the Expression of Human
Endothelial Nitric Oxide Synthase and Lowers Blood Pressure in Spontaneously
Hypertensive Rats.J. Nutrition. 138: 297-304.
21.