SEBARAN SPASIAL DAN POTENSI REPRODUKSI POPULASI SIPUT GONGGONG (Strombus turturela) DI TELUK KLABAT
BANGKA – BELITUNG
JUDISTIRA SIDDIK C651050061
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
SURAT PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Saya menyatakan dengan sebenar-benarnya bahwa segala pernyataan dalam tesis saya yang berjudul “Sebaran Spasial Dan Potensi Reproduksi Siput Gonggong (Strombus turturella) Di Teluk Klabat” merupakan karya saya dengan arahan Komisi Pembimbing, dan belum pernah diajukan untuk program sejenis diperguruan tinggi manapun. Sumber informasi yang berasal atau dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar pustaka.
Bogor, Juli 2011
ABSTRACT
Dog conch (Strombus turturella) as a popular food source has undergone a rapid decreasing in population because of habitat destruction. A research has been done in Klabat bay, Bangka Belitung in 3 months to assess habitat characteristics and individual spatial distribution using PCA and CA. Based on environmental biophysical and chemical parameter, spatial distribution consists of cluster formed by temperatur, pH, DO, and sand; cluster formed by depth and turbidity; and cluster formed by salinity, TOM, and clay. Spatial distribution based on shell-size consists of small cluster (20,39 mm - 38,53 mm); medium cluster (38,54mm - 56,68 mm); and big cluster (56,69 mm - 78,34 mm). Length-weight analysis result shows a negative allometric growth pattern (b= 2,787). Furthermore, spatial distribution based on gonad maturity index consists of GMI 0 formed by DO, turbidity, depth, temperatur, pH, and sand; GMI I formed by temperatur, DO, pH, sand, salinity, TOM, clay and mud; and GMI III formed by salinity, TOM, clay and mud, depth and turbidity. Spawning pattern analysis shows that conch spawning season reach its peak during May and June annually.
SEBARAN SPASIAL DAN POTENSI REPRODUKSI POPULASI SIPUT GONGGONG (Strombus turturela) DI TELUK KLABAT
BANGKA – BELITUNG
JUDISTIRA SIDDIK
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister pada
Program Studi Ilmu Kelautan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
SEBARAN SPASIAL DAN POTENSI REPRODUKSI POPULASI
SIPUT GONGGONG (
Strombus turturella
) DI TELUK KLABAT
BANGKA-BELITUNG
JUDISTIRA SIDDIK
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Penelitian : Sebaran Spasial dan Potensi Reproduksi Populasi Siput Gonggong (Strombus turturella) di Teluk Klabat Bangka-Belitung
Nama : Judistira Siddik NRP : C651050061 Program Studi : Ilmu Kelautan
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Dietriech G. Bengen, DEA
Ketua Anggota
Dr. Ir. Safar Dody, M.Si
Mengetahui
Ketua Program Studi Ilmu Kelautan Dekan Sekolah scasarjana
Dr. Neviaty P. Zamani Msc Dr. Ir. Dahrul Syah, M.Sc. Agr.
i PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala karunia Nya sehingga tesis ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Mei 2008 ini adalah “Sebaran Spasial dan Potensi Reproduksi Siput Gonggong Di Teluk Klabat Bangka-Belitung”. Penelitian ini terfokus pada penggalian informasi yang bertujuan untuk pengembangan dan perlindungan habitat serta kehidupan siput gonggong (Strombus turturella) di Teluk Klabat pada khususnya.
Pada kesempatan ini penulis perlu menyampaikan ucapan terimakasih dan penghargaan yang setinggi-tingginya kepada :
1. Prof. Dr. Ir. Dietriech G. Bengen DEA, selaku ketua komisi pembimbing yang telah memberikan arahan, nasehat dan motivasi secara terus menerus dengan penuh dedikasi dari awal perencanaan penelitian sampai selesainya tesis ini.
2. Dr. Ir. Safar Dody M.Si, selaku anggota pembimbing yang telah banyak memberikan bimbingan, arahan, saran dan koreksian-koreksiannya, sehingga menambah kualitas tesis ini.
3. Rektor Universitas Nasional dan Dekan Fakultas Biologi UNAS, yang telah memberikan kesempatan kepada penulis untuk mengikuti pendidikan program Magister di Institut Pertanian Bogor.
4. Isteriku Prihastini,Dra dan putra-putri tersayang yang dengan penuh kesabaran dan kasih sayang selalu mendoakan dan memberikan semangat untuk menyelesaikan tesis ini.
5. Saudara-saudaraku di ilmu kelautan (IKL) angkatan 05 dan di “Kosan Gugah Sari”(KGS) yang selalu memberikan motivasi dan saran-saran dengan “canda-canda nya”, sehingga menambah semangat dalam menyelesaikan tesis ini.
6. Abang, Mas, Kakak2 Ku yang dengan penuh sabar dan pengertiannya selalu memberikan dukungan moril dan materil hingga selesainya tesis ini. 7. Sahabat, saudara2ku di Fakultas Biologi Unas yang selalu mengingatkan
saat-saat rasa “malas” menyelimuti perasaan ini.
8. Pa Danu, mba Denti, mba Yanti dan seluruh staf di ilmu kelautan (FPIK) IPB yang banyak membantu serta memotivasi agar terselesaikannya tesis ini.
Penulis menyadari bahwa tesis ini masih jauh dari kata “sempurna”, namun demikian penulis berharap semoga tesis ini bermanfaat.
Bogor, Juli 2011
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 6 maret 1958, merupakan putra
ke sebelas dari dua belas bersaudara dari ayah Ahmad Siddik dan ibu Yohana.
Pendidikan sarjana di tempuh di Fakultas Biologi UNAS Jakarta, lulus pada tahun
1988. Kesempatan untuk melanjutkan ke program magister pada program studi
Ilmu Kelautan di Institut pertanian Bogor, baru terlaksana pada tahun 2005,
dengan biaya sendiri (mandiri).
Penulis bekerja sebagai staf pengajar di Fakultas Biologi Universitas
Nasional Jakarta, sejak tahun 1998 sampai saat ini. Sebuah makalah dengan judul
“ Sebaran Spasial Siput Gonggong (Strombus turturella) di Teluk Klabat
Bangka-Belitung” segera diterbitkan di Jurnal Ilmu Dan Budaya, Vol.33, No. 26-27, ISSN
No. 01262602. UNAS Press. Karya ilmiah tersebut merupakan bagian dari
ii
DAFTAR ISI
KATA PENGANTAR ... i
DAFTAR ISI ... ii
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
DAFTAR LAMPIRAN ... vi
I. PENDAHULUAN 1.1. Latar Belakang ... 1
1.2. Perumusan Masalah ... 3
1.3. Tujuan Penelitian ... 4
1.4. Manfaat Penelitian ... 4
1.5. Kerangka Pemikiran Penelitian ... 6
II. TINJAUAN PUSTAKA 2.1. Klasifikasi Siput Gonggong (Strombus turturella) ... 7
2.2. Morfologi dan Anatomi ... 7
2.3. Habitat dan Adaptasi ... 9
2.4. Reproduksi dan Siklus Hidup ... 11
III. METODOLOGI PENELITIAN 3.1. Waktu dan Lokasi Penelitian ... 13
3.2. Alat dan Bahan ... 15
3.3. Prosedur Penelitian ... 16
3.3.1. Penentuan Stasiun Pengamatan ... 16
3.3.2. Pengambilan Sampel ... 17
3.4. Analisis Data ... 20
3.4.1. Karakteristik Habitat Siput Gonggong ... 20
3.4.2. Kepadatan dan Pola Distribusi Populasi ... 22
3.4.3. Pengelompokan Stasiun Penelitian Berdasarkan Karakteristik Habitat ... 23
3.4.4. Morfometrik ... 23
3.4.5. Hubungan Panjang – Bobot ... 23
3.4.6. Potensi Reproduksi ... 24
III. METODOLOGI PENELITIAN 4.1. Karakteristik Habitat Siput Gonggong ... 27
4.2. Karakteristik Fisik dan Kimia Perairan ... 27
iii
4.2.2. Salinitas... 28
4.2.3. Derajat keasaman (pH) ... 29
4.2.4. Komposisi Butiran dan Total Organik Mater (TOM)... 30
4.3. Sebaran Karakteristik Fisika-Kimia Air dan Sedimen ... 33
4.4. Kepadatan dan Pola Penyebaran Populasi Siput Gonggong ... 36
4.4.1. Kepadatan Populasi ... 36
4.4.2. Pola Penyebaran Populasi Siput Gonggong ... 37
4.5. Morfometrik ... 40
4.5.1. Sebaran Ukuran Siput Gonggong ... 40
4.5.2. Sebaran Populasi Siput Gonggong Berdasarkan kelas Ukuran ... 41
4.5.3. Hubungan Panjang – Berat ... 42
4.6. Potensi Reproduksi ... 46
4.6.1. Nisbah kelamin ... 46
4.6.2. Fekunditas ... 48
4.6.3. Tingkat kematangan Gonad ... 51
4.6.4. Indeks kematangan Gonad ... 53
V. KESIMPULAN DAN SARAN 5.1. Kesimpulan ... 54
5.2. Saran ... 54
DAFTAR PUSTAKA ... 55
iv
DAFTAR TABEL
Halaman
1. Parameter, alat dan bahan penelitian ... 15
2. Rataan Komposisi dan TOM Sedimen di Teluk Klabat... 30
v
DAFTAR GAMBAR
Halaman
1. Kerangka Pemikiran Penelitian ... 6
2. Bentuk cangkang gonggong (Strombus turturella) ... 8
3. Bentuk operkulum ... 8
4. Siput gonggong di habitatnya ... 10
5. Alat kelamin jantan dan betina pada siput gonggong dewasa ... 11
6. Siklus Hidup Gonggong ... 12
7. Peta lokasi penelitian di Teluk Klabat, Provinsi Bangka-Belitung ... 14
8. Posisi Stasiun pengamatan di Teluk Klabat, Provinsi Bangka-Belitung 17 9. Contoh penempatan transek kwadrat dilokasi penelitian... 18
10. Diagram reprentasi sebaran stasiun penelitian berdasarkan parameter fisik kimia lingkungan pada sumbu 1 dan 2, serta sumbu 1 dan 3... 33
11. Diagram analisis koresponden keterkaitan stasiun pengamatan dengan modalitas ukuran dan jenis kelamin siput gonggong pada sumbu 1 dan2... 34
12. Diagram analisis koresponden keterkaitan stasiun pengamatan dengan tingkat kematangan gonad pada sumbu 1 dan 2... 36
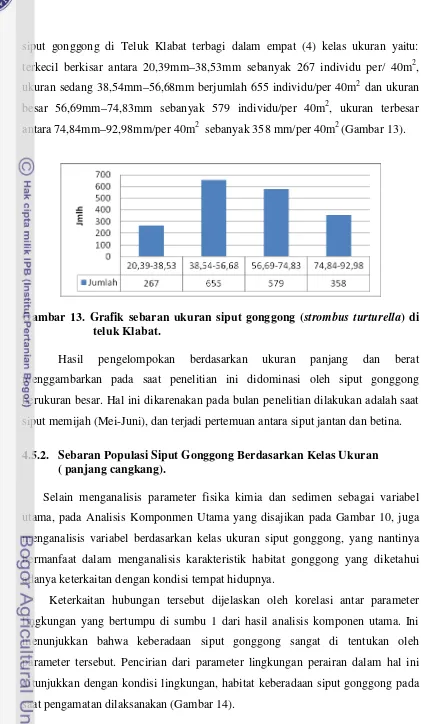
13. Kepadatan siput gonggong (Strombus turturella) di Teluk Klabat... 39
14. Grafik sebaran ukuran siput gonggong (Strombus turturella) di Teluk Klabat... 41
14. Pengelompokan stasiun berdasarkan sebaran kelas ukuran individu siput gonggong (Strombus turturella) ... 42
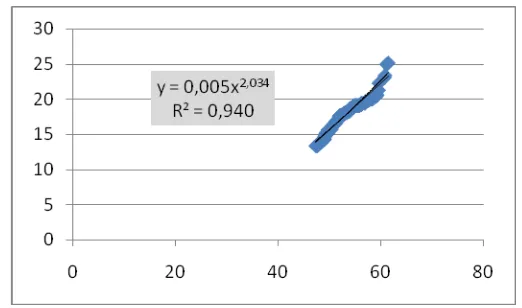
15. Kurva hubungan morfometrik panjang-berat siput gonggong (Strombus turturella) di Teluk Klabat ... 43
16. Kurva hubungan panjang-berat siput jantan di teluk Klabat ... 44
17. Kurva hubungan panjang-berat siput betina di Teluk Klabat ... 45
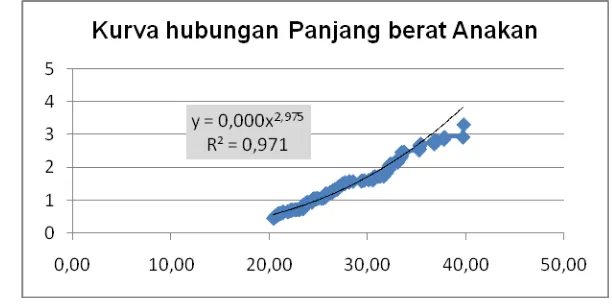
18. Kurva hubungan panjang-berat anakan siput di teluk Klabat ... 46
19. Organ reproduksi luar pada siput gonggong (Strombus turturella) ... 46
20. Jumlah dan persentase siput gonggong (Strombus turturella) jantan dan betina di teluk Klabat... 47
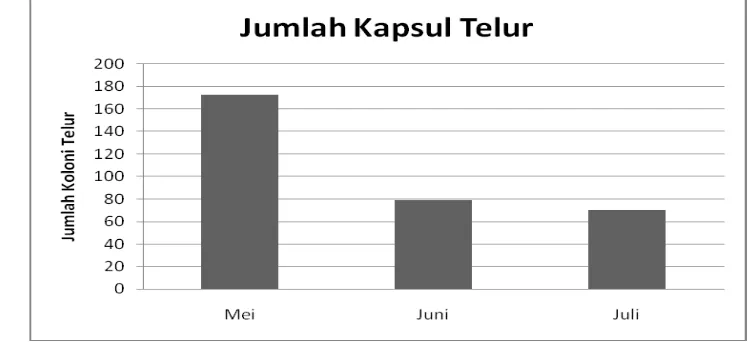
21. Jumlah koloni telur siput gonggong (Strombus turturella) yang dilepas ke alam ... 49
22. jumlah koloni telur siput gonggong (Strombus turturella) di Ds. Romodong, Teluk Klabat... ... 49
23. Koloni telur siput gonggong hasil pemijahan di alam ... 49
vi
25. Butira-butiran telur siput gonggong yang terlindungi di dalam kapsul .. 50
26. Puncakpemijahansiputgonggong(Strombusturturella)
vii
DAFTAR LAMPIRAN
Tabel Halaman
1. Karakteristik fisik-kimia perairan Teluk Klabat ... 58
2. Analisis Karakteristik fisik-kimia perairan Teluk Klabat... . 58
3. Sebaran ukuran siput gonggong (Strombus turturella)... 60
4. Analisis koresponden stasiun dengan tingkat kematangan gonad... 63
1 I PENDAHULUAN
1.1. Latar Belakang
Sumberdaya alam pesisir merupakan suatu himpunan integral dari
komponen hayati (biotik) dan komponen nir-hayati (abiotik) yang dibutuhkan
oleh manusia untuk hidup dan meningkatkan mutu kehidupan. Komponen hayati
dan nir-hayati secara fungsional berhubungan satu sama lain dan saling
berinetraksi membentuk suatu sistem (Bengen, 2004).
Teluk Klabat yang terletak di bagian utara pulau Bangka termasuk
didalam Kabupaten Bangka Induk, memiliki bentuk yang cukup unik seolah-olah
terdiri dari dua bagian yaitu bagian luar melebar yang berhadapan langsung
dengan laut lepas (laut Natuna), dimana karakteristik perairannya masih
dipengaruhi oleh krakteristik lautan. Di bagian tengahnya menyempit dimana
terdapat pelabuhan Blinyu dan bagian dalam teluk Klabat melebar lagi, tempat
bermuaranya dua sungai yang cukup besar yaitu Sungai Layar dan Sungai Antan.
Kedua sungai tersebut ditumbuhi hutan mangrove yang cukup lebat.
Dilihat dari segi bahari, hutan mangrove mempunyai arti yang sangat
penting, berbagai jenis hewan laut hidup dikawasan ini atau sangat bergantung
pada ekosistem hutan mangrove. Perairan mangrove dikenal berfungsi sebagai
tempat asuhan (nursery ground) bagi berbagai jenis hewan aquatik yang
mempunyai nilai ekonomi penting, seperti ikan, udang, kerang-kerangan (Macnae,
1974). Sumbangan terpenting hutan mangrove terhadap ekosistem pesisir adalah
lewat daun yang gugur. Luruhan daun mangrove merupakan sumber bahan
organik penting dalam rantai makanan dilingkungan perairan yang mencapai 7-8
ton/tahun. Daun yang gugur kedalam air segera menjadi bahan makanan bagi
berbagai biota laut, atau dihancurkan lebih dahulu oleh kegiatan bakteri dan fungi
(jamur). Hancuran bahan organik kemudian menjadi bahan makanan penting bagi
cacing, krustase dan hewan-hewan inipun menjadi makanan bagi hewan-hewan
2 Pemanfaatan sumberdaya di daerah pesisir cukup intensif mengingat
lokasi ini sangat mudah di akses oleh masyarakat. Masyarakat yang mendiami
daerah pesisir sangat bergantung pada sumberdaya yang ada disekitarnya sebagai
alternatif pemenuhan kebutuhan protein hewani dari laut yang juga dapat
dijadikan sebagai salah satu komoditi yang bernilai ekonomis. Salah satu
komponen hayati pesisir yang memiliki potensi protein hewani yang tinggi adalah
Siput Gonggong (Strombus turturella), yang termasuk dalam kelas Gastropoda,
merupakan kelas terbesar dalam filum Moluska. Organisme ini berperan baik
dalam proses mineralisasi, pendaur ulangan bahan organic, maupun sebagai salah
satu sumber makanan bagi organisme konsumen yang lebih tinggi. Menurut
Barnes (1994), anakan Strombidae merupakan makanan bagi anak-anak ikan yang
bersifat karnivor. Dan terutama sifat organisme ini yang cukup sensitip terhadap
perubahan lingkungan.
Selanjutnya menurut Amini dkk (1987), Siput Gonggong (Strombidae)
merupakan salah satu biota pesisir yang memiliki daya rekruitmen yang relatif
terbatas dan rentan terhadap degradasi habitat, dimana lambat laun akan
mengalami penurunan populasi akibat dari eksploitasi yang kontinyu, serta
pengrusakan habitat yang terus berlangsung. Pertimbangan lainnya, Gastropoda
(siput gonggong) merupakan organisme yang menetap dikawasan pasang-surut,
keberadaannya dapat memberikan gambaran kondisi lingkungan kawasan tempat
hidupnya (habitat). Jumlah dan jenisnya dikendalikan oleh faktor-faktor
lingkungan kawasan pasang-surut.
Indikasi terhadap penurunan jumlah populasi siput Gonggong mulai
dirasakan oleh nelayan setempat dengan semakin berkurangnya hasil tangkapan
mereka serta ukuran siput yang semakin mengecil. Jika hal ini dibiarkan terus
berlangsung akan berakibat punahnya biota tersebut dan berimplikasi terhadap
kegiatan perekonomian setempat. Kearifan tradisional yang diterapkan selama ini
terhadap penyelamatan sumberdaya laut tanpa didasari dengan hasil kajian ilmiah,
tidak akan banyak membantu. Mengingat tingkat eksploitasi yang terjadi telah
melebihi daya dukung lingkungan yang ada, untuk itu diperlukan daerah
3 dipertahankan secara lestari. Upaya pengaturan pemanfaatan siput gonggong
yang baik memerlukan informasi dasar mengenai Tingkat Kematangan Gonad
(TKG) dan preferensi habitatnya di alam. Dengan demikian, penelitian Bioekologi
siput gonggong terutama yang berkaitan dengan sebaran ukuran, populasi dan
kematangan gonad perlu dilakukan agar dapat memberikan masukan dalam
penataan dan pengaturan pemanfaatan siput gonggong.
1.2. Perumusan masalah
Ancaman kepunahan organisme laut terutama moluska di berbagai
ekosistem akibat eksploitasi yang berlebihan, berubahnya ekosistem oleh sebab-
bencana alam, konversi ekosistem, pencemaran, maupun kerusakan fisik oleh
sebab-sebab lain seperti penambangan di darat maupun di perairan pesisir,
menyebabkan habitat dari moluska dan biota lainnya di perairan semakin
terancam. Hal yang sama juga terjadi di perairan pulau Bangka, khususnya
daerah utara pulau Bangka (Teluk Klabat) yang merupakan salah satu habitat siput
gonggong yang potensial di perairan Kabupaten Bangka Induk, Propinsi
Bangka-Belitung.
Kerusakan habitat dan populasi biota laut akibat aktifitas manusia maupun
sebab-sebab lain, akan memberikan dampak yang cukup serius. Dampak
kerusakan ini akan berpengaruh pada siput gonggong (Strombus turturella) yang
merupakan salah satu jenis moluska dari kelas Gastropoda dan berpotensi sebagai
sumber daya alami yang memiliki nilai gizi tinggi serta disukai masyarakat
sebagai bahan makanan olahan, juga mempunyai nilai tambah yang cukup tinggi
bagi perekonomian masyarakat di sekitar pantai. Di pulau Batam dan Riau, siput
gonggong (Strombus turturella) dijual dalam bentuk olahan maupun segar.
Beberapa restoran “Sea Food” menjual dengan harga yang cukup tinggi per
porsinya (berisikan 10-15 ekor), sedangkan yang sudah dalam bentuk olahan
(kerupuk) dijual dengan harga Rp 100.000,- - Rp 150.000,- per Kg. Hal ini
menyebabkan meningkatnya permintaan, sehingga mengakibatkan tingginya
tingkat eksploitasi pada musim-musim tertentu terhadap siput tersebut. Tekanan
yang diterima mengakibatkan berkurangnya populasi di alam serta penurunan
4 Bila kondisi tersebut berlangsung terus-menerus dalam kurun waktu
tertentu maka akan mengakibatkan kepunahan. Di lain pihak penurunan kualitas
lingkungan yang di indikasikan dengan laju sedimentasi yang cukup tinggi
sebagai akibat penambangan timah di daratan maupun perairan pantai yang
semakin banyak dilakukan oleh masyarakat penambang timah inkonvensional (TI)
memberikan andil dalam proses degradasi lingkungan. Akibat dari faktor-faktor
diatas, maka ukuran maksimum, jumlah dan frekwensi penemuan siput di alam
juga berkurang.
Sebagai salah satu sumber penopang ekonomi masyarakat, penelitian
terhadap sumber daya siput Gonggong diarahkan kepada pemulihan habitat dan
populasi biota tersebut agar rekruitmen secara alamiah serta pasokan bibit lewat
kegiatan budidaya perairan dapat berlangsung secara berkesinambungan.
Dalam rangka usaha menjamin kelestarian siput gonggong di daerah
Teluk Klabat diperlukan informasi mengenai biologi dan ekologi dasar dengan
pendekatan terhadap analisa populasi dan habitat siput di alam yang mengkaji
beberapa elemen seperti ukuran, sebaran populasi, kepadatan populasi,
kematangan gonad dan kandungan gizi siput, terhadap faktor-faktor lingkungan
yang meliputi parameter fisika, kimia perairan yang berpengaruh di Teluk
Klabat. Secara umum kerangka pemikiran dari penelitian ini disajikan pada
Gambar 1.
1.3. Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Menelaah sebaran populasi berdasarkan karakteristik habitat siput
gonggong (Strombus turturella).
2. Mengkaji potensi reproduksi siput gonggong (Strombus turturella).
1.4. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang status
siput gonggong (Strombus turturella) di Teluk Klabat, yang dapat digunakan
5 keberadaannya dapat terus berlangsung dan akan menambah pendapatan
6 Gambar 1. Kerangka Pemikiran Penelitian
Ekosistem Pantai
Komponen Abiotik
Komponen Biotik
Potensi Reproduksi Karakteristikm
morfometrik
Sebaran Kepadatan dan Kelimpahan
Degradasi Lingkungan
Kualitas Perairan Kualitas Sedimen
Populasi Siput Gonggong
Berat
Tubuh Morfologi dan Anatomi
Reproduksi
TKG
Ukuran Kematangan
7 BAB II. TINJAUAN PUSTAKA
2.1. Klasifikasi Siput Gonggong (Strombus turturella)
Klasifikasi Siput Gonggong (Strombus turturella) menurut Ruppert dan
Barnes (1994); adalah sebagai berikut:
Kingdom :
Filum :
Kelas : Gastropoda Subkelas : Prosobranchia
Ordo :
Famili : Strombidae Genus : Strombus
Spesies : Strombus turturella
Menurut Morton (1979); , siput gonggong termasuk dalam Genus
Strombus, Famili Strombidae, Super Famili Strombacea dan Ordo Megagastropoda.
2.2. Morfologi dan Anatomi
Siput gonggong memiliki satu cangkang yang memperlihatkan perputaran
spiral dengan sudut 180º, disebut torsion (pilinan/putaran ), umumnya putaran
cangkang bersifat dekstral (kekanan), yaitu putaran yang terjadi saat pertumbuhan
berlawanan dengan arah jarum jam seperti pada Gambar 2 (Barnes, 1967;
Dharma, 1988). Linder (1975), mencatat ciri-ciri gonggong lainnya ialah
memiliki cangkang berbentuk seperti kerucut, terdiri dari tiga lapisan
periostrakum, lapisan prismatik yang terdiri dari kristal kalsium karbonat dan
lapisan nacre (lapisan mutiara). Bentuk kepala jelas, mempunyai tentakel, mata
dan radula serta probosis yang besar yang berguna untuk menyapu dan menyedot
makanan yang bercampur dengan lumpur yang berada di dasar perairan (Barnes,
8
Gambar 2. Bentuk cangkang Gonggong ( Strombus turturella ) (Dody, 2006)
Sebagian besar jenis-jenis siput mempunyai tutup cangkang yang disebut
operkulum yang menempel pada kakinya. Pada saat sedang tidak sedang berjalan,
operkulum ini menutupi bagian bukaan cangkang (Kozloff, 1990). Operkulum
berbentuk pipih memanjang dan bergerigi (Gambar 2), yang berfungsi ganda
untuk melindungi tubuh yang berada dalam cangkang, dan sebagai alat bantu
berpindah tempat (Ruppert et al, 1994).
Cangkang Kaki
Operkulum
Gambar 3. Bentuk Operkulum Strombus turturella (Ruppert et al, 1994)
Menurut Ruppert dan Barnes (1994), siput gonggong memiliki cangkang
yang tepinya menebal dan berwarna serta memiliki tutup memipih panjang
dengan siphon. Cangkang siput gonggong terdiri atas 4 lapisan, lapisan terluar
adalah Periostrakum yang merupakan lapisan tipis terdiri dari bahan protein
9 endapan pigmen berwarna. Periostrakum berfungsi untuk melindungi lapisan
dibawahnya yang terdiri dari kalsium karbonat terhadap erosi.
Lapisan kalsium karbonat terdiri atas 3 lapisan atau lebih, yang terkuat
adalah prismatik atau palisade, lapisan tengah atau lamella dan paling dalam
adalah lapisan nacre atau hypostrakum. Lapisan prismatik terdiri atas kristal
kalsite yang tersusun vertikal, masing-masing diseliputi matrik protein yang tipis,
Lapisan tengah dan lapisan nakre terdiri atas lembaran-lembaran aragonite dalam
matrik organik tipis (Suwignyo dkk, 2005). Sebagian besar jenis-jenis siput
mempunyai tutup cangkang yang disebut operkulum yang menempel pada
kakinya. Pada saat sedang tidak sedang berjalan, operkulum ini menutupi bagian
bukaan cangkang (Kozloff, 1990)
2.3. Habitat dan Adaptasi
Di alam siput gonggong menyukai habitat pasir berlumpur. Menurut
Amini (1986), siput gonggong banyak terdapat hidup di perairan pantai dengan
dasar pasir berlumpur dan kondisi perairan dimana banyak ditemukan rumput
laut. Sedangkan menurut Dharma (1988), Strombus hidupnya diatas pasir, jika
berjalan seperti melompat-lompat dengan menggunakan operkulum atau penutup
cangkangnya yang berbentuk seperti pisau berduri. Salinitasnya berkisar antara
26 – 32 %o, pH antara 7,1 – 8,0, oksigen terlarut 4,5 – 6,5 ppt, kecerahan air 0,5 –
3,0 meter serta suhu berkisar antara 26 – 300
Asosiasi antara rumput laut dengan Gastropoda, famili Strombidae
khususnya, banyak ditemukan oleh para peneliti. Menurut Amini (1986),
Strombus canarium banyak ditemukan pada substrat pasir berlumpur yang di tumbuhi rumput laut samo-samo (Enhalus accoroides) dan Thalassia spp. Dari C (Amini, 1986). Sedangkan Latama
dan Nessa (1994), melakukan penelitian komposisi dan densitas Gastropoda di
Pulau Kodingareng Keke, Sulawesi Selatan, yang berdasarkan kisaran kedalaman.
Diperoleh hasil, pada kedalaman 1-5 meter kepadatan tertinggi didominasi oleh
marga Strombus dengan substrat terdiri dari pasir dan karang mati. Menurut Litaay (1994), Strombidae dan Cypraeidae mendominasi keberadaanya di rataan
10 hasil penelitian Aswandy dan Hutomo (1988) di Teluk Banten, menemukan 10
jenis moluska yang berasosiasi dengan padang Lamun. Famili Strombidae
merupakan famili yang dominan keberadaannya di Teluk Kotania Seram Barat
(Cappenberg,1996); Patterson J K (1995).
Sedangkan Peristiwady (1994) dari hasil penelitiannya di pantai Selatan
Lombok mendapatkan sedikitnya terdapat 4,99% dari seluruh jenis makrofauna
yang berasosiasi dengan padang Lamun adalah moluska. Dari tiga teluk yang ada
di pantai Selatan Lombok ditemukan sebanyak 70 spesies moluska yang
berasosiasi dengan padang Lamun dan yang kelimpahannya tertinggi adalah
Strombus labiatus, S. Luhuanus, kondisi perairan dengan salinitas berkisar antara 33,20 – 33,50 %o, suhu antara 26,50 – 26,590 C dan kandungan oksigen 2,79 –
4,12 mg/l serta pH berkisar antara 8,30 – 8,35. Menurut Stoner et al (1996),
anakan siput dari marga Strombus biasanya selalu berasosiasi dengan tumbuhan
lamun jenis Thalassia testudinum dan Syringodium filiforme (Gambar 4).
11 2.4. Reproduksi dan Siklus Hidup
Menurut Barker (2001), banyak gastropoda alat kelaminnya terpisah,
sehingga tiap individu adalah dioseus dengan satu gonad yang terletak dekat apex.
Secara umum Gastropoda memiliki alat kelamin yang terpisah, begitu pula halnya
dengan siput gonggong (Strombus turturella).
Penelitian tentang reproduksi siput gonggong (Strombus turturella) belum
banyak dilakukan baik di daerah tropis maupun sub-tropis. Musim penangkapan
siput gonggong di perairan P. Bintan – Riau mencapai puncaknya pada bulan Mei
hingga Oktober (Amini, 1986). Menurut Barnes (1994), kebanyakan gastropoda
bersifat dioseus dengan sebuah gonad (ovari atau testis) terletak dekat saluran
pencernaan dalam massa viseral (Gambar 5).
Gambar 5. Siput Gonggong jantan dan betina dewasa (Dody, 2009).
Ketika terjadi perkawinan, pembuahan terjadi di dalam, kemudian telur
dibungkus semacam agar dan dikeluarkan dalam bentuk rangkaian kalung, pita
atau berkelompok, telur siput gonggong berbentuk seperti rangkaian kalung
(Gambar 6).
♂ ♀
12 Gambar 6. Siklus Hidup Gonggong ( Dody, 2009 )
Stadium trochophore berlangsung didalam pembungkus telur dan menetas
sebagai larva veliger yang berenang bebas. Ciri khas larva veliger adalah
mempunyai velum yang bersilia, kaki, mata dan tentakel. Velum berfungsi
sebagai alat untuk berenang dan mengalirkan makanan ke mulut karena veliger
merupakan pemakan suspensi (Appeldorn, R.S., 1988). Pada akhir stadium
veliger kaki sudah cukup besar untuk merayap, maka larva turun ke substrat
dan melakukan metamorfosa. Velum hilang dan bentuk tubuh berubah seperti
dewasa. Saat metamorfosa merupakan saat yang paling kritis dalam daur hidup
gastropoda (Barnes, 1994); (Anonim, 1990). Menurut Barker (2001); Cob Z C,
(2007) :
1) Fertilisasi telur (telur berdiameter 0,23 mm dan kuning telur berdiameter
0,18 mm).
2) Fase trokofor yang mulai aktif berenang (19 jam setelah pemijahan).
3) Fase veliger muda (umur 29 jam dengan panjang 0,26 mm).
4) Fase veliger yang mulai aktif berenang dan sudah memiliki organ stigmas dan
cephalic tentakel (umur 2,5 hari dengan panjang 0,29 mm).
5) Fase veliger sempurna dalam tingkat pertumbuhan awal (umur 5 hari dengan
13 6) Fase pertumbuhan memasuki stadia larva dan mulai membentuk cangkang
peristomal (umur 13 hari).
7) Fase dewasa yang telah memiliki organ respirasi (140 hari dengan panjang
tubuh 3,0 mm).
8) Fase selanjutnya membentuk cangkang muda (160 hari dengan panjang tubuh
3,7 mm).
9) Fase dewasa
Menurut Sugiarti dkk (2005), siput gonggong hidup sebagai deposit feeder,
mempunyai probosis yang besar untuk menyapu dan menyedot endapan di dasar
14 III. METODOLOGI PENELITIAN
3.1. Waktu dan Lokasi Penelitian
Penelitian dilakukan selama 3 (tiga) bulan, yaitu bulan Mei sampai Juli.
Dua bulan dilakukan pengambilan sampel di lapangan dan satu bulan untuk
analisa laboratorium. Lokasi penelitian terletak di Perairan Teluk Klabat Bangka
Belitung (Gambar 7). Analisa kualitas air dan sedimen dilakukan di laboratorium
P2O-Lembaga Ilmu Pengetahuan Indonesia, Jakarta
Teluk Klabat termasuk dalam Kabupaten Bangka Induk, Pulau Bangka.
Perairan sekitar Teluk Klabat memiliki ekosistem muara sungai (estuaria),
ekosistem mangrove dan ekosistem karang. Bentuk Teluk Klabat cukup unik,
seolah-olah terdiri dari dua bagian yaitu bagian luar melebar di tengah menyempit
dimana terletak pelabuhan Blinyu dan bagian dalamnya melebar lagi. Dalam
penelitian ini lokasi pengambilan sampel hanya dilakukan pada lokasi bagian luar,
sedangkan teluk bagian tengah dan dalam tidak dilakukan pengamatan.
Aktifitas utama di Teluk Klabat bagian luar adalah kegiatan pelayaran dan
aktivitas penangkapan ikan, selain itu khusus di sisi barat teluk bagian luar juga
15
Sumber:
BAKOSURTANA 2006
Teluk Klabat
Kabupaten
Provinsi
16 3.2. Alat dan Bahan
Alat dan bahan yang digunakan pada penelitian serta parameter yang diukur
[image:30.595.82.562.111.818.2]disajikan pada Tabel 1 sebagai berikut :
Tabel 1. Parameter, Alat dan Bahan Penelitian
Parameter Metode analisis/alat
FISIKA-KIMIA AIR:
1. Suhu (0 2. pH
C)
3. DO (mg/l)
4. Organik Total/TOM (mg/l) 5. Salinitas (%o)
6. Turbiditas (NTU)
Horiba Type U-10 Horiba Type U-10 Horiba Type U-10 Horiba Type U-10 Turbidimeter
FISIKA-KIMIA SEDIMEN :
1. Fraksi sediment (%) 2. pH
3. Redoks potensial (mV) 4. TOM (mg/l)
Saringan bertingkat
pH-meter
Redoks potensiometer
Timbangan O Hauss
BIOLOGI DAN REPRODUKSI SIPUT GONGGONG:
1. Morfometri 2. Bobot tubuh
Kaliper
17 3.3. Prosedur Penelitian
3.3.1. Penentuan Stasiun Pengamatan
Stasiun pengamatan berada pada Teluk Klabat bagian luar dengan
dua lokasi utama, yakni:
a. Lokasi 1 : Teluk bagian luar sisi timur dengan aktivitas utama
merupakan alur pelayaran, dan aktivitas penangkapan ikan. Sedangkan
aktivitas penambangan timah tidak dijumpai di areal ini. Penentuan titik
sampel di mulai pada sisi timur teluk yang berdekatan dengan Tanjung
Penyusuk menyusuri perairan pantai desa Romodong hingga ke Tanjung
Gudang. Di lokasi sisi timur ini terdapat enam stasiun penelitian, yakni
stasiun 1,2,3,4,5 dan 6.
b. Lokasi 2 : Teluk bagian luar sisi barat dengan aktivitas utama aktivitas
penangkapan ikan dan penambangan timah. Penentuan titik sampling
dengan menyusuri pantai sebelah barat Teluk Klabat. Areal ini
diperkirakan merupakan habitat siput gonggong yang potensial, dengan
kondisi substrat terdiri dari pasir dan pasir berlumpur. Nelayan pencari
siput gonggong memfokuskan aktivitasnya di daerah ini. Vegetasi yang
tumbuh di daerah pantai umumnya cemara. Selain itu dijumpai pula
beberapa pulau kecil yang bervegetasi serta beberapa pulau berupa
tonjolan batu dan gosong pasir yang muncul ke permukaan saat air
surut.
Di areal ini juga beroperasi puluhan tambang timah rakyat (TI) yang
mengeruk substrat untuk mendapatkan pasir timah. Kegiatan
mengaduk-aduk ini yang menyebabkan rusaknya habitat siput gonggong
di areal tersebut. Di lokasi sisi barat ini terdapat delapan stasiun
penelitian, yakni stasiun 7,8,9,10, 11, 12, 13 dan 14 ) Posisi stasiun
18 Gambar 8. Posisi Stasiun Pengamatan di Teluk Klabat, Provinsi
Bangka-Belitung (Bakosurtanal, 1997)
3.3.2. Pengambilan Sampel
a. Pengambilan Sampel Siput Gonggong
Pengambilan sampel siput pada tiap stasiun di lakukan pada saat
surut terendah (kedalaman air mencapai 0,5 m – 1 m) dengan cara
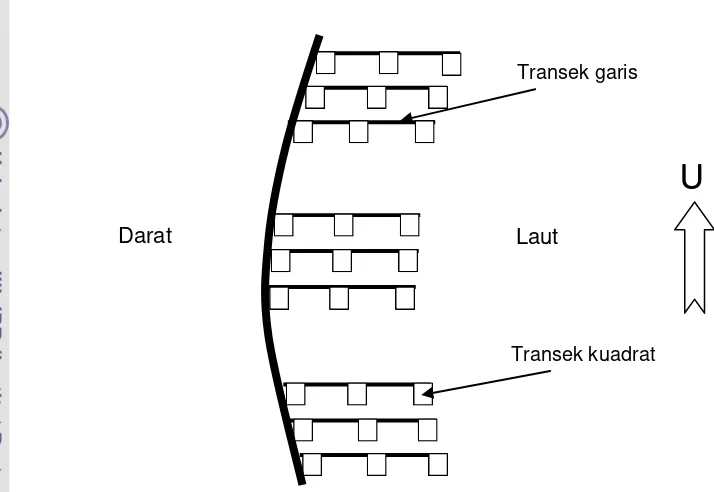
meletakan transek kwadrat berukuran 1 x 1 meter yang terbuat dari besi dan
pada salah satu sudutnya diikatkan pelampung berupa gabus sterofoam .
Siput gonggong yang berada di dalam transek kwadrat di ambil dengan
tangan secara snorkeling. Dari setiap kwadran sampel dimasukan kedalam
kantong waring dan diberi label menandai stasiun pengambilan.
Setiap stasiun terdiri dari 4 transek garis berjarak 50 meter setiap
garis dan tiap transek garis terdiri dari 10 transek kuadrat. Transek garis
1
2
3
4 5
6 13
11 10 9
8
7 12
14
19 ditentukan dari arah darat ke laut. Penempatan transek kwadrat di lapangan
[image:33.595.121.478.151.397.2]disajikan pada Gambar 9.
Gambar 9. Contoh penempatan transek kwadrat di lokasi penelitian b. Kualitas air
Pengukuran kualitas air dilakukan dengan dua cara yaitu secara
insitu dan pengukuran di laboratorium. Pengukuran secara insitu dilakukan dengan cara mengambil contoh air pada masing-masing stasiun pengamatan.
Parameter kualitas air yang diukur di lapangan meliputi suhu, oksigen
terlarut (DO), pH, salinitas, dan turbiditas, sedangkan kandungan bahan
organik total diukur di laboratorium dengan mengambil contoh air yang
selanjutnya dianalisis di P2O-LIPI (Lembaga Ilmu Pengetahuan Indonesia),
Jakarta.
c. Kualitas sedimen dan fraksi sedimen
Contoh sedimen diambil pada stasiun yang sama dengan
pengambilan contoh air. Sedimen diambil kurang lebih 500 gram dengan
menggunakan Ekman Grab dan dimasukkan ke dalam plastik serta disimpan
dalam cool box. Sampel sedimen selanjutnya dianalisis di P2O-LIPI (Lembaga Ilmu Pengetahuan Indonesia), Jakarta.
Darat
U
Transek kuadrat Transek garis
20 d. Pengukuran Morfometri Cangkang dan Bobot Tubuh
Pengukuran morfometrik siput dilakukan memakai caliper dengan
ketelitian 1,00 mm, mengikuti metode Bailey dan Green (1988), terhadap
karakter-karakter: (1) panjang cangkang (Pc), Panjang cangkang diukur dari
ujung anterior ke ujung posterior cangkang Sedangkan pengukuran
terhadap bobot tubuh dilakukan dengan menggunakan timbangan OHAUS
Precision Plus, dengan ketelitian 0,001 gr. Penimbangan dilakukan meliputi berat total siput, cangkang dan daging baik basah maupun kering.
Selanjutnya bobot cangkang tanpa daging ditimbang begitu juga dengan
bobot daging tanpa cangkang (bobot tegumen) ditimbang.
e. Potensi Reproduksi • Nisbah Kelamin
• Tingkat Kematangan Gonad • Indeks Kematangan Gonad • Fekunditas
Untuk mengamati jumlah koloni telur yang dihasilkan di alam
dilakukan pengamatan secara berkala setiap bulannya dengan menggunakan
pengembangan metode manta tow yang diadopsi dari English et al (1994),
dengan bantuan long boat bermesin tempel 15 PK. Garis transek sebanyak
dua buah dipasang sejajar dengan garis pantai pada kedalaman 1,5 m dan 2
m. Pada salah satu sisi perahu diletakan sebilah kayu dengan posisi
melintang sebagai tempat berpegangan bagi pengamat. Pencacahan koloni
telur yang menggunakan hand counter dilakukan saat perahu bermotor
mulai bergerak dengan kecepatan konstan (3-5 km/jam) menyusuri
sepanjang garis transek. Luas areal daerah sapuan + 1.000 m2. Pencacahan
koloni telur dilakukan dengan cara menyelusuri garis transek yang sejajar
21 dihasilkan oleh seekor induk betina dalam satu koloni, maka dilakukan
koleksi beberapa koloni telur untuk dihitung jumlahnya menggunakan
metode gravimetri (Effendie, 1979).
3.4. Analisa Data
3.4.1. Karakteristik Habitat Siput Gonggong
Untuk melihat karakteristik habitat siput gonggong digunakan
pendekatan analisis statistik multi variable dengan Analisis Komponen
Utama (AKU = Principal Component Analysis, PCA) (Bengen, 2000).
Analisis ini memungkinkan adanya suatu reduksi terhadap dimensi dari
ruang-ruang agar dapat lebih mudah dibaca dengan kehilangan informasi
sesedikit mungkin. Metode ini bertujuan mendeterminasi sumbu-sumbu
optimum tempat diproyeksikannya individu-individu dan / atau
variabel-variabel.
Data variabel fisika-kimia perairan yang diperoleh tidak memiliki
pengukuran yang sama, maka sebelum dilakukan Analisis Komponen
Utama, data tersebut perlu dinormalisasikan terlebih dahulu melalui
pemusatan dan pereduksian
Nilai sesudah pemusatan diperoleh dari selisih antara nilai variabel
dengan nilai rata-rata, yakni:
_
x N C = i −
dengan: C = Nilai pemusatan Ni = Nilai asli variabel
_
x = Nilai rata-rata variabel
Sementara pereduksian merupakan hasil bagi antara variabel yang
telah dipusatkan dengan nilai simpangan baku variabel, yang dirumuskan
sebagai berikut: S C R=
dengan: R = Nilai pereduksian C = Nilai pemusatan
22 Untuk menentukan hubungan antara dua variabel digunakan
pendekatan matriks korelasi yang dihitung dari indeks sintetik (Ludwig dan
Reynolds, 1988), yaitu: Rs x s = As x n At
dengan:
n x s
Rs x s = Matriks korelasi r
A
ij s x n = Matriks indeks sintetis r
A
ij t
n x s
Korelasi linear antara dua variabel yang dihitung dari indeks
sintetiknya merupakan peragam dari dua variabel yang telah dinormalkan.
Tahapan ini sebenarnya merupakan suatu usaha untuk mentransformasikan
p variabel kuantitatif awal (inisial), yang kurang lebih saling berkorelasi, ke
dalam p variabel kuantitatif baru yang disebut komponen utama. Dengan
demikian hasil dari analisis ini tidak berasal dari variable-variabel awal
(inisial) tetapi dari indeks sintetik yang diperoleh dari kombinasi linier
variabel-variabel asal.
= Matriks transpose (pertukaran baris dan kolom) dari matriks A
Diantara semua indeks sintetik yang mungkin, analisis ini mencari
terlebih dahulu indeks yang menunjukkan ragam individu yang maksimum.
Indeks ini disebut komponen utama pertama atau sumbu ke-1 (F1), yaitu
suatu proporsi tertentu dari ragam total stasiun yang dijelaskan oleh
komponen utama ini. Selanjutnya dicari komponen utama kedua (F2) yang
memiliki korelasi nihil dengan F1 dan memiliki ragam individu terbesar.
Komponen utama kedua memberikan informasi terbesar sebagai pelengkap
komponen utama pertama. Proses ini berlanjut terus sehingga diperoleh
komponen utama ke-p, di mana bagian informasi yang dapat dijelaskan
semakin kecil.
Prinsip Analisis Komponen Utama menggunakan pengukuran jarak
Euclidean (jumlah kuadrat perbedaan antara individu untuk variabel yang
berkoresponden) pada data. Jarak Euclidean dirumuskan sebagai berikut:
∑
= − = p j j i ij X X i i d 1 2 ' 22( , ) ( )
dengan: i,i’ = dua baris
23 Semakin kecil jarak Euclidean antara dua stasiun, maka semakin
mirip karakteristik fisika kimia air dan substrat antar kedua stasiun tersebut
dan sebaliknya semakin besar jarak Eclidean antara dua stasiun, maka
semakin berbeda karakteristik karaktersitik fisika kimia air dan substrat
kedua stasiun tersebut.
3.4.2. Kepadatan dan Pola Distribusi Populasi
a. Kepadatan Populasi
Kepadatan populasi menunjukkan rataan individu suatu jenis siput
perpetak dari seluruh contoh yang diamati, yaitu menggunakan rumus:
D = ∑Xi / n
dengan: ∑Xi = jumlah total individu siput n = luas seluruh petak contoh
b. Pola Sebaran
Pola penyebaran siput gonggong dalam penelitian ini ditentukan
dengan menggunakan Indeks Morisita (Id). Indeks ini tidak dipengaruhi
oleh luas petak pengamatan dan sangat baik untuk membandingkan pola
pemencaran populasi (Brower et al, 1990). Rumus yang dipergunakan
adalah: ) 1 ( ) ( 2 − − ∑ = N N N x n Id
dengan: Id = indeks distribusi Morisita N = jumlah total seluruh individu n = jumlah seluruh petak pengamatan ∑x2
Nilai indeks morisita yang diperoleh diinterpretasikan sebagai berikut: = jumlah individu jenis i per petak.
Id < 1, distribusi individu cenderung acak Id = 1, distribusi individu bersifat merata
Id > 1, distribusi individu cenderung berkelompok.
24 Sebaran jenis, ukuran siput gonggong berdasarkan karakteristik
biofisik dianalisa menggunakan metode Corespondence Analysis (CA)
(Legendre & Legendre, 1983; Foucart, 1985; Bengen, 1998). Analisis ini
didasarkan pada matriks data yang terdiri atas I baris (stasiun pengamatan)
dan J kolom (jenis siput gonggong dengan kelas ukuran tertentu) dimana
pada perpotongan baris I dan kolom J ditemukan kelimpahan siput
gonggong. Matriks ini merupakan tabel kontingensi stasiun pengamatan dan
modalitas jenis siput gonggong berdasarkan kelas ukuran. Pada tabel
kontingensi, I dan J mempunyai peranan yang simetris, membandingkan
unsur-unsur I (untuk tiap J) sama dengan membandingkan hukum
probabilitas bersyarat yang diestimasi dari nij/ni. Untuk masing-masing
nij/nj, dengan
ni = ∑ nij (jumlah subjek I yang memiliki semua karakter j) dan nj = ∑ nij (jumlah jawaban karakter j).
Pengukuran kemiripan antar dua unsur I1 dan I2
d
dari I dilakukan
melalui pengukuran jarak khikuadrat dengan rumus:
2 ( i,i’) = ∑( Xij/Xi – Xi’j/ Xi’ )2
dengan: Xi = Jumlah baris I untuk semua kolom J Xj
Xj = Jumlah kolom J untuk semua baris I
3.4.4. Morfometrik
Analisis hubungan morfometrik antara panjang cangkang dengan
lebar dan tinggi cangkang siput gonggong adalah:
P = a + bL P = a + T L = a + T
b b
3.4.5. Hubungan panjang –Berat
Pola pertumbuhan siput dapat diketahui melalui hubungan panjang
cangkang dengan bobot tubuh siput (berat basah) yang dianalisis melalui
hubungan persamaan regresi kuasa (power regresion) sebagai berikut
25 jumlah siput betina / jantan
Jumlah seluruh sampel dimana : W = berat basah (gr)
L = panjang cangkang (mm) a dan b = konstanta
Untuk menguji apakah konstanta b sama dengan 3 atau tidak
(isometrik atau allometrik) dilakukan uji t. Persamaan diatas juga dilakukan
terhadap jenis kelamin.
3.4.6. Potensi Reproduksi 3.4.6.1. Nisbah Kelamin
Nisbah kelamin dianalisa dengan cara membandingkan jenis siput
betina dan jantan secara keseluruhan dikalikan dengan 100 %.
Nisbah kelamin = x 100 %
Untuk membandingkan apakah siput jantan dan betina seimbang
atau tidak maka dilakukan dengan menggunakan uji Chi-Kuadrat (Sugiono,
2001). Dimana : X2 F = Chi-Kuadrat o F
= Frekuensi yang diobservasi
h = Frekuensi harapan
3.4.6.2. Fekunditas
Fekunditas didapat dengan metode gabungan (Effendie, 2002) sebagai
berikut :
Dimana :
∑
− − = k i h h f f f X 1 02 ( )
26
) (
2 X pi
X X
M = k + − ∑
[
]
−
−
∑
±
1
96
,
1
2ni
qi
pi
X
m
F = Jumlah total telur (butir) G = Berat gonad total (gram) V = Volume pengenceran (cc) X = Jumlah telur sebagian (butir) Q = Berat gonad sebagian (gr)
Pengamatan fekunditas bertujuan untuk mengetahui potensi reproduksi siput
gonggong yang dilakukan hanya pada individu betina dan waktu yang
diamati hanya bulan Mei, Juni dan bulan Juli. Pengamatan dilapangan
dilakukan dengan cara menyelusuri garis transek yang sejajar dengan garis
pantai dan pengambilan sampel telur dilakukan hanya tiga (3) transek
disetiap stasiunnya. Untuk mengetahui rata-rata jumlah telur yang
dihasilkan oleh seekor induk betina dalam satu koloni, maka dilakukan
koleksi beberapa koloni telur untuk dihitung jumlahnya menggunakan
metode gravimetri (Effendie, 1979).
3.4.6.3. Tingkat Kematangan Gonad
Penentuan TKG secara morfologi dari ikan sampel dilakukan
berdasarkan petunjuk Cassie dalam Effendie (1979). Untuk menentukan
pertama kali matang gonad pada ikan dapat diduga dengan menggunakan
metode Spearman – Karber (Udupa, 1986) dalam Omar, 2004) sebagai
berikut :
Jika ά = 0,05 maka batas-batas kepercayaan 95 % dari m adalah :
Antilog
Dimana :
M = Logaritma panjang ikan pada saat pertama kali matang gonad Xk
X = Selisih logaritma nilai tengah
27
%
100
x
w
wg
GSI
=
Pi = Proporsi ikan matang gonad pada kelas ke – i (pi = ri/ni) Ri = Jumlah ikan matang gonad pada kelas ke – i
Ni = Jumlah ikan pada kelas ke – i
qi = 1 – pi, panjang ikan pada waktu mencapai kematangan gonad
yang pertama adalah M = antilog m. Untuk mengetahui rata-rata jumlah
telur yang dihasilkan oleh seekor induk betina dalam satu koloni, maka
dilakukan koleksi beberapa koloni telur untuk dihitung jumlahnya
menggunakan metode gravimetri (Effendie, 1979).
3.4.6.4. Indeks Kematangan Gonad
Indeks kematangan gonad sering disebut juga “koefisien
kematangan” atau index of maturity. Namun yang banyak dipakai adalah Gonado Somatics Indeks (GSI) yang gunakan untuk mengukur aktivitas
gonad (Effendie, 2002) dengan rumus sebagai berikut:
Dimana :
GSI = Gonado somatics indeks/indeks kematangan gonad (%) Wg = berat gonad (gram)
W = Berat tubuh ikan (gram)
28 IV. HASIL DAN PEMBAHASAN
4.1. Karakteristik Habitat Siput Gonggong
Teluk Klabat memiliki bentuk yang cukup unik, seolah-olah terdiri dari dua
bagian yaitu bagian luar melebar di tengah menyempit, dimana terletak
pelabuhan Blinyu dan bagian dalamnya melebar lagi (Gambar 7). Lokasi
penelitian berada di teluk bagian luar yang dibagi menjadi dua bagian (sisi),
bagian Barat dan bagian Timur. Kondisi perairan pada saat pengambilan sampel
dalam kondisi surut terendah, Lokasi Timur (stasiun 1– 6), memiliki hamparan
pantai pasir yang relatif pendek dengan substrat dasar perairan, berpasir. Lokasi
Barat (stasiun 7- 14) hamparan pantai pasir yang sangat panjang (luas) dengan
substrat dasar perairan, pasir berlumpur.
4.2. Karakteristik Fisik dan Kimia Perairan
Hasil pengukuran parameter fisik kimia perairan selama penelitian di
Teluk Klabat dapat dilihat pada Lampiran 1
4.2.1. Suhu
Berdasarkan pengukuran suhu air diseluruh stasiun pengamatan, ada pada
kisaran nilai 29,0 – 29,7°C (Tabel 2). Suhu terendah ditemukan pada stasiun 6 (
ST.6 ), sedangkan yang tertinggi ditemukan pada stasiun 3,4,13 dan 14 ( ST
3,4,13 dan St 14 ). Menurut Nontji (1993) kisaran suhu permukaan Perairan
Indonesia adalah 28-30° C, kisaran suhu ini masih memungkinkan untuk
metabolisme berbagai jenis organisme yang berada di perairan tersebut, termasuk
juga untuk makrozoobentos. Kisaran suhu tersebut merupakan kisaran suhu
normal untuk perairan daerah tropis seperti Indonesia. Menurut Romimohtarto
dan Juwana (2001), suhu alami air laut berkisar antara 30-33°C. Suhu di
permukaan relatif sama dengan suhu di dasar perairan, hal ini karena pada lokasi
sampling berada di perairan dangkal. Dari nilai-nilai tersebut terlihat bahwa suhu
perairan di semua lokasi pengamatan relatif sama dan berada dalam kisaran
normal untuk daerah tropis. Melihat dari kisaran suhu tersebut maka bisa
dikatakan bahwa di lokasi penelitian masih memiliki kisaran suhu yang normal
29 Suhu tertinggi 29,7°C dijumpai pada Stasiun 3,4,13 dan 14 (Lampiran 1).
Hal ini disebabkan oleh berbagai faktor lingkungan disekitarnya antara lain
kedalaman dan intensitas cahaya matahari serta musim. Suhu terendah di
dapatkan pada stasiun 6, hal ini disebabkan kondisi perairannya berada di mulut
Teluk Klabat yang mendapat pengaruh langsung dari massa air laut teluk bagian
dalam yang mendapat tambahan massa air dari sungai yang masuk ke Teluk
Klabat dibanding stasiun lainnya, kondisi ini mengakibatkan kolom air lebih
stabil.
4.2.2. Salinitas
Kadar salinitas di Teluk Klabat berkisar antara 31,6 ‰ – 33 ‰. Daerah
pesisir seperti Pantai Teluk Klabat dimana daerah tersebut dapat terendam pada
saat pasang tertinggi dan muncul ke permukaan pada saat surut terendah, sangat
memungkinkan memiliki kadar salinitas yang tinggi sebagai akibat dari
penguapan.
Di perairan Teluk Klabat bagian dalam terdapat dua buah sungai yaitu
Sungai Antan dan Sungai Layang mengalirkan airnya ke arah mulut pantai, dan
sampling dilakukan pada saat air laut pasang naik sehingga pengaruh air tawar
yang masuk ke pantai tidak sampai mempengaruhi salinitas perairan Teluk Klabat
bagian luar, lokasi dimana pengamatan dan pengambilan sampel data dilakukan.
Hal ini disebabkan pengaruh massa air laut Natuna yang cukup besar, sehingga
salinitas menjadi relatif stabil dibanding Pantai Teluk Klabat bagian dalam.
Variasi salinitas pada masing-masing lokasi terjadi karena adanya gerak pasang
surut yang menyebabkan terjadinya pengadukan pada kolom air hingga terjadi
pertukaran air secara vertikal. Di permukaan, air cenderung mengalir keluar
sedangkan air laut merayap masuk dari bawah. Akibatnya antara ke duanya terjadi
percampuran. Menurut Nontji (1993), sebaran salinitas di laut dipengaruhi oleh
berbagai faktor seperti, pola sirkulasi air, penguapan, curah hujan, dan aliran
30 4.2.3. Derajat Keasaman (pH)
Hasil pengukuran pH di lokasi penelitian cenderung bersifat basa. Dimana
kisaran pH pada Teluk Klabat 7,6 – 7,7. Nilai tersebut memperlihat bahwa pH
perairan cenderung bersifat basa dan termasuk normal bagi pH air laut di
Indonesia yang pada umumnya bervariasi antara 6.0 - 8.5. Hutasoit (1991)
menyatakan perairan yang mempunyai pH dengan kisaran 6.50 – 7.50
dikategorikan perairan cukup baik sedang perairan yang mempunyai pH dengan
kisaran 7.50 – 8.50 dikategorikan perairan sangat baik. jika dibandingkan dengan
hasil penelitian Muchtar, 1993 di Lombok Selatan yang mendapatkan nilai pH
antara 8.3-8.35, maka nilai pH perairan yang diperoleh pada penelitian ini reltif
lebih rendah. Hal ini mungkin saja terjadi melihat kondisi perairan yang berbeda.
Menurut EPA (1996), biota laut memiliki kisaran pH ideal 6,5 sampai 8,5. Ini
artinya kadar pH yang terdapat di Pantai Teluk Klabat masih bisa dikatakan
berada dalam keadaan normal yang dibutuhkan bagi biota perairan di daerah
tersebut. Nilai pH menunjukkan derajat keasaman atau kebasaan suatu perairan.
Derajat Keasaman (pH) air laut cenderung berada dalam keseimbangan karena
ekosistem air laut mempunyai kapasitas penyangga yang mampu
mempertahankan nilai pH. Menurut Odum (1971), air laut merupakan sistem
penyangga yang sangat luas dengan pH relatif stabil sebesar 7 hingga 8,5.
Derajat keasaman merupakan faktor yang penting karena perubahan pH
dapat mempengaruhi fungsi fisiologis khususnya yang berhubungan dengan
respirasi (Arfiati dkk, 1999). Toleransi organisme air terhadap pH bervariasi, hal
ini tergantung pada suhu air, oksigen terlarut, dan adanya berbagai anion dan
kation serta jenis dan stadium organisme. Batas toleransi organisme terhadap pH
sangat bervariasi dan pada umumnya sebagian besar dari biota akuatik sensitif
terhadap perubahan pH dan menyukai pH sekitar 7 - 8.50. Nilai pH sangat
mempengaruhi proses biokimia dalam perairan dan juga akan memberi pengaruh
terhadap keanekaragaman komunitas biologi perairan, pH 6 - 6.50 menyebabkan
keanekaragaman bentos akan sedikit menurun (Novotny dan Olem 1994 dalam
Effendi 2003). Menurut Odum (1993), ). Nilai pH pada suatu perairan akan
31 sebaran organisme yang metabolismenya tergantung pada sebaran faktor-faktor
kimia tersebut.
4.2.4. Komposisi butiran dan Total Organic Matter (TOM) sedimen
Hasil analisis laboratorium dari ukuran partikel substrat yang merupakan
habitat siput gonggong diklasifikasikan menurut skala Wenworth yang
menggolongkan partikel dari lempung (clay) sampai batu besar (boulder) dengan
diameter 1/4096 mm sampai 2048 mm, setelah terklasifikasi kemudian didapatkan
persentase rataan ukuran partikel berdasarkan stasiun. Jenis substrat sangat
berkaitan dengan kandungan oksigen, sirkulasi air dan ketersediaan nutrien dalam
sedimen. Komposisi butiran sedimen di sisi Timur dan Barat Pantai Teluk Klabat
bagian luar memiliki dua jenis yang tidak terlalu berbeda dan didominasi oleh
pasir, oleh karena itu bisa dikatakan secara keseluruhan substrat di Pantai Teluk
Klabat pasir berlumpur (Tabel 2).
Tabel 2. Rataan Komposisi Sedimen dan TOM di Pantai Teluk Klabat.
Komposisi substrat, perairan Teluk Klabat secara umum adalah pasir
berlumpur. Penyebaran partikel dasar ini disusun dan dikelompokan menurut
Skala Wenworth (Tabel 2). Komposisi pasir bisa terbentuk dari patahan karang
dan sisa-sisa biota yang telah mati. Sedimen berpasir memiliki kandungan oksigen
relatif lebih besar dibandingkan sedimen yang halus, karena pada sedimen
berpasir terdapat pori udara yang memungkinkan terjadinya pencampuran yang
lebih intensif dengan air di atasnya, tetapi kendalanya pada sedimen berpasir tidak
terlalu banyak terdapat bahan organik (Wood, 1987). Komposisi sedimen (%)
Kelas Tekstur
TOM
Pasir Debu Liat (mg/l)
(8-0,25mm) (0,125mm) (<0,063 mm)
88,61 3,55 7,84 Pasir 0,51-5,89
85,75 3,99 10,25
Pasir
32 TOM pada suatu perairan dipengaruhi oleh kandungan bahan organik di
sedimen melalui proses pengendapan ke dasar perairan. Laju pengendapan
tersebut sangat dipengaruhi oleh kecepatan arus. Partikel yang halus akan terbawa
oleh aliran air yang deras. Kisaran TOM pada perairan ini tidak terlalu tinggi yaitu
berkisar antara 0,51 – 12,3 mg/l. Kandungan bahan organik terlarut pada
masing-masing stasiun menunjukkan nilai yang bervariasi. TOM tertinggi dijumpai pada
stasiun 8 dan 14 dengan rata-rata sebesar 12,33 dan 6,64 mg/l yang terendah
dengan rata-rata 0.51 dan 0,98 mg/l terdapat pada stasiun 2 dan stasiun 11.
Kandungan TOM dalam perairan sangat dipengaruhi oleh pemasukan zat-zat dari
daratan dan adanya erosi dari hulu sungai yang banyak mengandung bahan
organik (Susetiono, 1999).
Secara keseluruhan nilai TOM lebih tinggi ke arah muara sungai, hal ini
sangat berhubungan dengan adanya partikel-partikel lumpur yang terbawa arus
dari dua sungai yang bermuara di Teluk Klabat bagian dalam, kecepatan arus yang
semakin kecil ke arah Teluk Klabat bagian luar ( lokasi penelitian ), stasiun 1 dan
stasiun 11 serta stasiun 8 dan stasiun 14 dan juga nilai salinitas yang semakin
tinggi, dimana tingginya salinitas sangat berhubungan dengan kandungan
bahan-bahan mineral yang ada dalam perairan tersebut. Tekstur sedimen sangat erat
kaitannya dengan fraksi butiran sedimen.
Tingginya bahan organik di Teluk Klabat disebabkan karena banyaknya
sisa-sisa biota seperti hewan, serasah dari lamun dan alga yang telah mati
kemudian terendapkan. Menurut Wood (1987), Pada sedimen yang halus,
walaupun oksigen sangat terbatas tetapi kandungan bahan organik tersedia dalam
jumlah yang banyak. Sedangkan menurut Susetiono (1999), dari hasil
penelitiannya di Teluk Kuta, Lombok, NTB, banyaknya partikel halus dan TOM
di Teluk Kuta menunjukkan bahwa lingkungan Teluk Kuta mempunyai tingkat
turbulensi yang rendah.
Rendahnya turbulensi bisa dikarenakan daerah tersebut cenderung
terlindungi atau juga karena terdapatnya hamparan lamun yang sangat lebat di
daerah tersebut. Kandungan TOM dalam perairan sangat dipengaruhi oleh
33 sekitarnya dan kecepatan arus. Kandungan bahan organik terlarut pada
masing-masing stasiun menunjukkan nilai yang bervariasi.
4.3. Sebaran Karakteristik Fisika-Kimia Air dan Sedimen
Sebaran Karakteristik Fisika-Kimia Air terhadap stasiun pengamatan
dianalisis dengan menggunakan Analisis Komponen Utama. Menurut Legendre
dan Legendre (1983), untuk mendeterminasi distribusi karakteristik fisik kimia
perairan antar stasiun pengamatan, digunakan Analisis Komponen Utama
(Principal Component Analisis, PCA ). Analisis Komponen Utama digunakan
karena parameter lingkungan perairan lebih tepat dalam menerangkan ordinasi.
Data parameter lingkungan yang dianalisis mempunyai unit pengukuran yang
berbeda, maka sebelum dilakukan Analisis Komponen Utama terlebih dahulu
dilakukan pemusatan dan pereduksian terhadap data. Hasil dari analisis matriks
korelasi data fisika kimia perairan menunjukkan bahwa kontribusi dua komponen
utama terhadap ragam total mencapai 68,606 % dari ragam total, sedangkan
kontribusi tiga komponen utama terhadap ragam total mencapai 80,499 % dari
ragam total. Sebagian besar informasi terpusat pada sumbu 1 dan 2 dimana
masing-masing sumbu menjelaskan 39,851% dan 28,756% dari ragam total,
sedangkan sumbu 3 memberikan kontribusi 11,893 % dari ragam total. Nilai akar
ciri (eigenvalue) dari ketiga komponen secara berurutan adalah 3,895; 2,876; dan
1,189. Hasi analisis pada Lampiran 2.
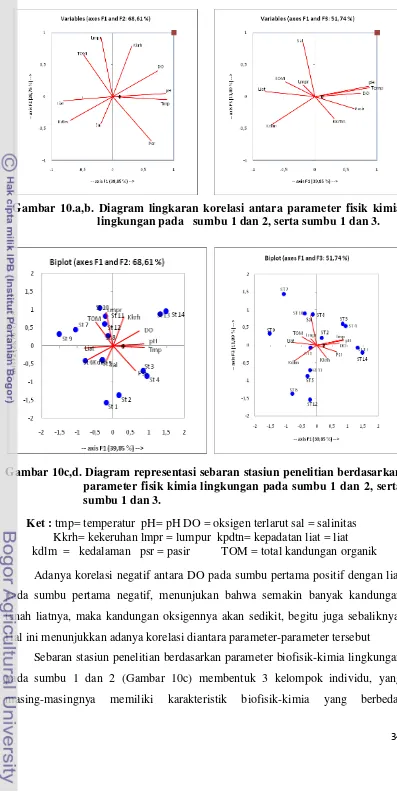
Diagram lingkaran korelasi parameter biofisik kimia lingkungan, pada
sumbu 1 dan 2 (Gambar 1a), sumbu 1 menunjukkan parameter pH berkorelasi
positif terhadap, DO dan temperatur, tetapi berkorelasi negatif dengan kedalaman
dan tanah liat (liat). Pada sumbu 2, salinitas berkorelasi posistif dengan lumpur
dan TOM, tetapi berkorelasi negatif dengan salinitas dan substrat pasir. Pada
sumbu 1 dan sumbu 3 (Gambar 10 a,b), sumbu 1 menunjukkan parameter DO
berkorelasi positif terhadap temperatur, pH dan substrat pasir. Dan berkorelasi
negatif dengan TOM, liat dan kedalaman, sedangkan pada sumbu 3 variabel
34 Gambar 10.a,b. Diagram lingkaran korelasi antara parameter fisik kimia
lingkungan pada sumbu 1 dan 2, serta sumbu 1 dan 3.
[image:48.595.108.505.50.842.2]
Gambar 10c,d. Diagram representasi sebaran stasiun penelitian berdasarkan parameter fisik kimia lingkungan pada sumbu 1 dan 2, serta sumbu 1 dan 3.
Ket : tmp= temperatur pH= pH DO = oksigen terlarut sal = salinitas
Kkrh= kekeruhan lmpr = lumpur kpdtn= kepadatan liat = liat kdlm = kedalaman psr = pasir TOM = total kandungan organik
Adanya korelasi negatif antara DO pada sumbu pertama positif dengan liat
pada sumbu pertama negatif, menunjukan bahwa semakin banyak kandungan
tanah liatnya, maka kandungan oksigennya akan sedikit, begitu juga sebaliknya.
Hal ini menunjukkan adanya korelasi diantara parameter-parameter tersebut
Sebaran stasiun penelitian berdasarkan parameter biofisik-kimia lingkungan
pada sumbu 1 dan 2 (Gambar 10c) membentuk 3 kelompok individu, yang
35 Kelompok I terdiri atas stasiun 3 dan 4 serta stasiun13 dan stasiun 14 yang
dicirikan dengan temperatur, pH dan substrat pasir serta DO. Kelompok II terdiri
atas stasiun 8,10 dan stasiun 11 dan 12 yang dicirikan dengan kekeruhan, TOM
dan lumpur yang tinggi. Dan kelompok III yang terdiri atas stasiun 1,2 stasiun
5,6,7 dan stasiun 9 yang dicirikan dengan kedalaman, salinitas dan liat yang
tinggi.
Pada sumbu 1 dan 3, sebaran stasiun membentuk 3 kelompok individu, yang
masing-masing memiliki karakteristik biofisik kimia berbeda. Kelompok I terdiri
atas stasiun 2,3, dan stasiun 4, serta stasiun 13 dan stasiun 14 yang dicirikan oleh
kandungan oksigen terlarut, temperatur, pH dan substrat pasir yang tinggi.
Kelompok II terdiri atas stasiun 2, 7 dan stasiun 9 serta stasiun 10 dicirikan oleh
salinitas, TOM, liat dan lumpur, sedangkan kelompok III terdiri atas stasiun 1, 5
dan 6 serta stasiun 11 dan stasiun 12 dicirikan oleh kedalaman dan kekeruhan.
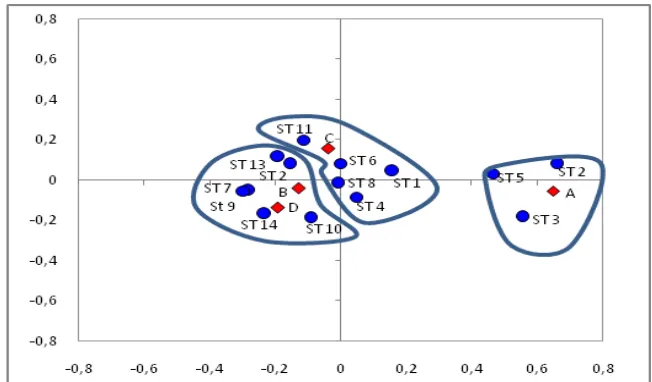
4.3.1. Distribusi Spasial Siput Gonggong Berdasarkan Kelas Ukuran dan Jenis Kelamin
Pengelompokan titik-titik pengamatan dari hasil analisis berdasarkan kelas
ukuran terdiri atas tiga kelompok yang mempunyai keterkaitan yang erat antara
siput gonggong dengan stasiun pengamatan (Gambar 11)(Lampiran 3).
[image:49.595.95.513.29.816.2]36
Hasil analisis memperlihatkan siput gonggong kelompok A (ukuran
20,39 mm-38,53 mm) banyak terdapat di stasiun 2 dan stasiun 3 yang dicirikan
temperatur, DO, pH dan kandungan substrat pasir yang tinggi, diduga pasir
dijadikan areal perlindungan bagi anakan gongong, yang pada fase veliger
mempunyai velum yang bersilia, kaki, mata dan tentakel. Stasiun 5 yang
dicirikan dengan kedalaman dan kekeruhan yang tinggi diperkirakan merupakan
lokasi yang disenangi siput gonggong dikarenakan kondisi perairan yang
demikian dapat melindungi larva-larva veliger dari serangan musuh. Menurut
Barnes (1994), sesaat setelah menetas larva veliger berenang bebas merupakan
saat-saat paling kritis dan stadium veliger disenangi ikan sebagai makannya.
Kelompok B (ukuran 38,54 mm-56,68 mm) banyak terdapat di stasiun 4, 6 dan
stasiun 13 serta stasiun 14, sedangkan kelompok C (ukuran 56,69 mm-74,83 mm)
dan kelompok D (ukuran 74,89 mm-92,98 mm) banyak terdapat di stasiun 1,2,7
dan stasiun 8,9 serta stasiun 10 dan stasiun 11.
Kelompok C dan kelompok D merupakan kelompok yang berukuran besar
dan jenis kelaminnya sudah terlihat jelas, dengan kondisi lingkungan di stasiun
ini sesuai dengan persyaratan hidup dari siput gonggong selain itu pada
stasiun-stasiun ini diperkirakan banyak terdapat makanan hasil limpahan dari teluk bagian
dalam yang merupakan muara dari dua sungai yang cukup besar. Amini (1986)
menyatakan, siput gonggong banyak terdapat di perairan pantai dengan dasar
pasir berlumpur dan kondisi perairan dimana banyak ditemukan rumput laut,
sedangkan Dody (2009), menyatakan siput gonggong yang hidup diperairan pulau
37 4.3.2. Distribusi Spasial Siput Gonggong Berdasarkan Tingkat Kematangan
Gonad
Gambar 12. Diagram analisis koresponden keterkaitan stasiun pengamatan dengan tingkat kematangan gonad pada sumbu 1 dan 2.
Hasil pengukuran (Gambar 12) memperlihatkan distribusi spasial siput
gonggong dengan tingkat kematangan gonad pada TKG 0, banyak dijumpai di
stasiun 1,2 dan stasiun 3 serta di stasiun 5 yang dicirikan dengan kandungan
oksigen tinggi, kekeruhan, kedalaman dan temperatur, pH dan substrat pasir.
Kondisi lingkungan yang stabil sangat diperlukan oleh gonggong berukuran kecil,
gonggong termasuk organisme yang sensitif terhadap perubahan lingkungan.
Menurut Menurut Basmi (2000) suhu berperan penting dalam proses metabolisme
dan laju fotosintesis organisme fitoplankton yang merupakan salah satu makanan
bagi hewan bentos
Tingkat kematangan gonad (TKG I) banyak dijumpai pada stasiun 4,6 dan
stasiun 8, Stasiun 11 serta stasiun 13 dan stasiun 14 yang dicirikan oleh
temperatur, DO, pH dan pasir juga salinitas, TOM, lumpur dan liat serta
kedalaman dan kekeruhan, melimpahnya siput gonggong yang masih memiliki
tingkat kematangan gonad I (TKG I) menunjukkan bahwa siput gonggong yang
[image:51.595.134.433.124.386.2]38 antara lain temperatur yang stabil, DO yang tinggi, lumpur tempat berkamuflase
menghindar dari predator. Lingkungan juga merupakan tempat tumbuh dan
berkembang baik individu maupun populasinya. Pada stasiun 7,9 dan 10 serta
stasiun 12 yang karakteristik lingkungannya mencirikan salinitas, TOM, lumpur
dan liat serta kedalaman dan tingkat kekeruhan yang tinggi banyak ditemukan
siput gonggong yang memasuki tingkat kematangan gonad empat (TKG IV).
Lokasi ini diperkirakan sebagai lokasi untuk mendapatkan makanan dan sekaligus
lokasi pertemuan gonggong dewasa untuk melakukan pemijahan.
Pengelompokan stasiun penelitian berdasarkan karakteristik habitat,
stasiun penelitian tersebar di sepanjang pantai Timur dan Barat Teluk Klabat
dengan masing-masing terdiri atas 6 stasiun berada di Timur dicirikan oleh nilai
temperatur, pasir, salinitas dan pH hal ini sesuai dengan pengamatan dilapangan,
tekstur sedimen memang menjadi faktor pembatas utama bagi penyebaran siput
gonggong pada habitatnya. Siput gonggong jarang ditemukan pada substrat yang
didominasi oleh pasir. Di pantai bagian Barat terdapat 8 stasiun, merupakan
stasiun-stasiun yang berada di rataan pantai yang sangat lebar yang dicirikan
dengan tingginya lumpur, TOM dan nilai kekeruhan.
Tingginya nilai-nilai variabel ini diduga dipengaruhi oleh aliran dari sungai
dan laut yang membawa material bahan organik serta adanya proses pengadukan
dari kedua massa air tersebut serta terjadinya pengendapan dirataan sangat luas
yang merupakan ciri topografi di daerah tersebut.
4.4. Kepadatan dan Pola Penyebaran Populasi Siput Gonggong 4.4.1. Kepadatan Populasi
Jumlah dan kepadatan siput gonggong yang ditemukan selama penelitian
diseluruh stasiun, seluruhnya ada 1859 individu (lampiran 3), yang tertinggi pada
stasiun 7, stasiun 8 dan stasiun 11 masing-masing 5 indv/m2 , sedangkan yang
terendah ditemukan pada stasiun 2, stasiun 3 dan stasiun 13 serta stasiun 14
masing-masing 2 indv/m2 ( Gambar 12 ). Tingginya jumlah siput gonggong pada
stasiun 7 dan 8 diperkirakan masih banyaknya makanan akibat terbawa arus dari
Teluk bagian dalam yang banyak menerima endapan lumpur dari sungai-sungai
39 terdiri dari pasir berlumpur merupakan tempat hidup yang disenangi oleh siput
gonggong (Amini,1986; Cappenberg,1996). Jumlah siput gonggong yang
ditemukan pada stasiun 2, 3 dan stasiun 13 serta stasiun 14 adalah jumlah yang
terkecil ( 2 indv/m2 ), diperkirakan lokasi stasiun – stasiun ini terletak di mulut
teluk yang kondisi substratnya pasir miskin bahan organik yang berasal dari hasil
penguraian bangkai dan sisa-sisa organisme oleh bakteri pengurai (Odum, 1993).
Akibat erosi dibagian hulun sungai Antan dan sungai Layar dan kecepatan arus
yang berasal dari laut Natuna masih sangat berpengaruh.
Gambar 12. Kepadatan Siput Gonggong ( Strombus turturella ) di Teluk
Klabat.
Hal ini sesuai dengan pendapat Sudara dkk (1992) yang menyatakan
bahwa moluska dari kelas gastropoda banyak ditemukan di daerah padang lamun
yang kurang rapat. Sedangkan Hadijah (2000), mendapatkan banyak gastropoda
yang berukuran kecil di pengaruhi oleh kerapatan dan jenis lamun.
4.4.2. Pola Penyebaran Populasi Siput Gonggong
Setiap populasi memiliki struktur sebaran individu yang disebut
dengan pola sebaran populasi. Pola sebaran populasi ini terbagi menjadi 3 pola
yaitu merata, acak, dan mengelompok. Untuk mengetahui pola apa yang dimiliki
siput gonggong (Strombus turturella) maka dilakukan perhitungan dengan
menggunakan indeks morisita. Hasil analisis pola penyebaran siput gonggong
40
Tabel 13. Pola Penyebaran Spasial Siput Gonggong (Strombus turturella).
Kelompok Sebaran Ukuran (mm)
Nilai Indeks Morisita (Id)
A (20,39 – 38,53) 1,2
B (38,54 – 56,68) 1,0
C (56,69 – 74,83) 1,2
D (74,84 – 92,98) 1,3
Kelompok ukuran yang dianalisis hanya kelompok B yang mempunyai
sebaran merata ( Id=1 ), sedangkan kelompok A, kelompok C dan kelompok D
pola penyebarannya mengelompok ( Id > 1). Pada kelompok B merupakan