I.
TINJAUAN PUSTAKA
A.
Keracunan Pangan
Secara umum bahaya yang timbul dari pangan disebut foodborne disease atau sering disebut keracunan pangan. Menurut World Health Organization (WHO), kejadian luar biasa (KLB) keracunan pangan (foodborne disease outbreak) didefinisikan sebagai suatu kejadian dimana terdapat dua orang atau lebih yang menderita sakit setelah mengkonsumsi pangan yang secara epidemiologi terbukti sebagai sumber penularan (Sparringa 2002). Foodborne disease adalah penyakit yang disebabkan infeksi atau intoksikasi akibat mengkonsumsi makanan, minuman atau air yang telah terkontaminasi (Sharp dan Reilly 2000).
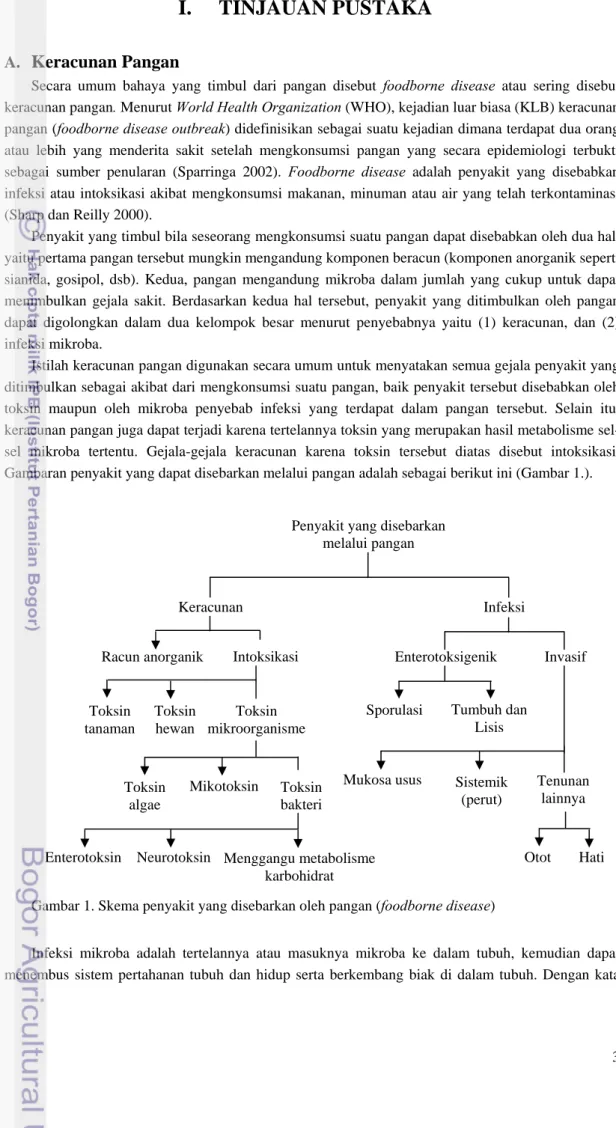
Penyakit yang timbul bila seseorang mengkonsumsi suatu pangan dapat disebabkan oleh dua hal, yaitu pertama pangan tersebut mungkin mengandung komponen beracun (komponen anorganik seperti sianida, gosipol, dsb). Kedua, pangan mengandung mikroba dalam jumlah yang cukup untuk dapat menimbulkan gejala sakit. Berdasarkan kedua hal tersebut, penyakit yang ditimbulkan oleh pangan dapat digolongkan dalam dua kelompok besar menurut penyebabnya yaitu (1) keracunan, dan (2) infeksi mikroba.
Istilah keracunan pangan digunakan secara umum untuk menyatakan semua gejala penyakit yang ditimbulkan sebagai akibat dari mengkonsumsi suatu pangan, baik penyakit tersebut disebabkan oleh toksin maupun oleh mikroba penyebab infeksi yang terdapat dalam pangan tersebut. Selain itu, keracunan pangan juga dapat terjadi karena tertelannya toksin yang merupakan hasil metabolisme sel-sel mikroba tertentu. Gejala-gejala keracunan karena toksin tersebut diatas disebut intoksikasi. Gambaran penyakit yang dapat disebarkan melalui pangan adalah sebagai berikut ini (Gambar 1.).
Gambar 1. Skema penyakit yang disebarkan oleh pangan (foodborne disease)
Infeksi mikroba adalah tertelannya atau masuknya mikroba ke dalam tubuh, kemudian dapat menembus sistem pertahanan tubuh dan hidup serta berkembang biak di dalam tubuh. Dengan kata
Infeksi
Enterotoksigenik Invasif
Tumbuh dan Lisis Sporulasi
Mukosa usus Sistemik (perut) Tenunan lainnya Hati Otot Menggangu metabolisme karbohidrat Neurotoksin Toksin bakteri Mikotoksin Keracunan
Racun anorganik Intoksikasi
Toksin tanaman Toksin hewan Toksin mikroorganisme Toksin algae Enterotoksin
Penyakit yang disebarkan melalui pangan
lain infeksi merupakan proses ketika mikroba yang patogen memasuki tubuh inangnya, mengadakan invasi, berkembang biak di dalam tubuh inang, dan menimbulkan penyakit. Dalam menghadapi adanya infeksi mikroba dan hasil-hasil metabolitnya, tubuh mengadakan suatu reaksi perlawanan, yang ditandai oleh adanya gejala-gejala demam yang dialami oleh penderita penyakit. Hal ini merupakan salah satu gejala penyakit yang membedakan antara intoksikasi dengan infeksi mikroba, dimana penderita intoksikasi biasanya tidak mengalami gejala demam.
Kemampuan suatu mikroba dalam menimbulkan penyakit biasanya dinyatakan dengan istilah virulen. Mikroba yang terdapat dalam jumlah yang sedikit tetapi sudah dapat menimbulkan gejala infeksi atau penyakit, dikatakan mempunyai daya virulensi yang tinggi. Sedangkan mikroba yang menyebabkan gejala penyakit yang ringan, atau yang harus terdapat dalam jumlah yang banyak untuk dapat memulai infeksi atau menimbulkan penyakit, dikatakan mempunyai daya virulensi yang rendah. Sifat virulensi juga dapat diartikan sebagai keseluruhan sifat patogenik suatu mikroba yang merupakan perpaduan dari tiga sifat kemampuan mikroba yaitu: (1) daya infeksi atau kemampuannya untuk memulai suatu infeksi di dalam tubuh inangnya, (2) daya invasif atau kemampuan suatu mikroba untuk menembus ke jaringan-jaringan yang lebih dalam, (3) daya patogenik atau kemampuan suatu mikroba untuk merusak sel-sel jaringan tubuh (Supardi dan Sukamto 1999).
Mikroba penyebab infeksi yang tumbuh pada pangan dapat dibedakan menjadi dua kelompok yaitu: (1) mikroba patogen yang pertumbuhannya tidak distimulir oleh pangan tempat mikroba tersebut hidup, dalam hal ini pangan hanya sebagai perantara (pembawa). Misalnya mikroba patogen yang menyebabkan hepatitis. (2) Mikroba patogen yang pertumbuhannya distimulir oleh pangan tempat tumbuhnya sehingga jumlahnya akan bertambah banyak. Misalnya Salmonella sp., EPEC, dan
Vibrio parahaemolyticus.
Mikroba lain yang menyebabkan infeksi antara lain: Clostridium perfringens, Bacillus cereus,
Shigella sp., Yersinia enterocolica dan sebagainya. Clostridium perfringens dan Bacillus cereus
adalah mikroba yang juga dapat memproduksi enterotoksin (bersifat enterotoksigenik), sehingga kadang-kadang digolongkan ke dalam kelompok mikroba penyebab intoksikasi. Clostridium
perfringens tipe A menghasilkan enterotoksin yang akan dilepaskan ke luar sel sewaktu terjadi
sporulasi di dalam saluran pencernaan atau di dalam pangan. Bacillus cereus juga menghasilkan enterotoksin, tetapi toksin tersebut akan dilepaskan ke luar sel sewaktu mengalami lisis atau pecah di dalam saluran pencernaan atau di dalam pangan.
Jika toksin dan kedua mikroba itu dilepaskan oleh sel di dalam pangan dan pangan tersebut tertelan masuk ke dalam tubuh, gejala yang ditimbulkannya disebut sebagai gejala intoksikasi. Meskipun demikian, menunjukkan bahwa penyakit yang disebabkan oleh kedua mikroba tersebut baru timbul jika mikroba yang masih hidup tertelan dalam jumlah cukup tinggi. Hal ini menunjukkan bahwa kondisi yang terbaik bagi kedua mikroba tersebut untuk melepaskan toksinnya adalah di dalam saluran pencernaan. Oleh karena itu, kedua mikroba tersebut dapat digolongkan ke dalam kelompok mikroba penyebab infeksi.
Toksin mikroba dapat dibedakan menjadi dua kelompok diantaranya (1) eksotoksin yaitu toksin yang disintesis di dalam sel mikroba, kemudian dikeluarkan ke substrat di sekelilingnya, dan (2) endotoksin yaitu toksin yang disintesis di dalam sel mikroba, dan baru bersifat toksik bila sel mengalami lisis. Eksotoksin yang dihasilkan oleh mikroba biasanya bekerja secara spesifik terhadap tenunan-tenunan atau sel-sel tertentu. Misalnya sel-sel saraf, otot, sel-sel pada saluran pencernaan, dan sebagainya.
Tidak semua mikroba yang masuk ke dalam tubuh dapat menimbulkan penyakit. Untuk dapat menimbulkan penyakit, suatu mikroba harus dapat melalui beberapa tahap penting yaitu: masuk ke dalam tubuh (jalan masuk untuk setiap mikroba tidak sama), harus dapat berkembang biak, tahan
terhadap sistem pertahanan tubuh, dan melakukan invasi ke dalam tubuh inangnya, serta harus ada jalan keluar penyebab penyakit.
Mikroba yang dapat menginfeksi dan dapat menimbulkan penyakit adalah mikroba yang mempunyai daya patogenisitas yang tinggi, daya virulensi yang kuat, dan daya invasi yang tinggi, sehingga dapat berkembang biak dan menyebar ke dalam tubuh inang yang peka, serta mempunyai daya pertahanan dan daya hinder yang baik terhadap serangan sel-sel fagosit di dalam tubuh inang. Proses yang terjadi di setiap tahap sangat kompleks dan biasanya dipengaruhi oleh beberapa faktor. Suatu mikroba dapat kehilangan sifat patogeniknya jika salah satu dari faktor tersebut hilang. Substrat dan lingkungan tempat pertumbuhan mikroba mempengaruhi hilangnya atau terbentuknya faktor patogenik tersebut.
Mikroba patogen yang terdapat di dalam pangan biasanya masuk ke dalam tubuh melalui saluran pencernaan. Infeksi oleh mikroba tersebut dapat dimulai dari membran mukosa pada dinding saluran pencernaan, terutama usus halus. Meskipun demikian, tidak semua mikroba patogen masuk melalui saluran pencernaan dapat menyebabkan infeksi pada membran mukosa tersebut, karena sesungguhnya dinding saluran pencernaan dilindungi oleh lapisan lendir saluran mukus, pergerakan isi saluran pencernaan, dan mikroba komensal yang hidup berkembang biak tanpa merugikan di saluran pencernaan.
Berdasarkan cara penyebarannya dan daya penetrasinya di dalam tubuh, mikroba patogen yang dapat menyebabkan infeksi melalui saluran pencernaan dapat dibedakan atas tiga golongan yaitu: (1) mikroba yang berkembang biak pada permukaan dinding saluran pencernaan, dan tidak menembus terlalu jauh ke dalam sel-sel mukosa, (2) mikroba yang menembus sel-sel mukosa dan berkembang biak di dalam sel-sel tersebut tetapi tidak menyebar ke jaringan-jaringan yang lebih dalam, (3) mikroba yang menyebar ke jaringan-jaringan yang lebih dalam baik dengan cara menembus sel-sel mukosa atau diantara sel-sel mukosa misalnya Salmonella yang menyebabkan salmonellosis (Supardi dan Sukamto 1999).
Enam mikroba patogen yang menjadi penyebab utama KLB keracunan pangan di Amerika Serikat, yaitu Campylobacter jejuni, Clostridium perfringens, Escherichia coli O157:H7, Lysteria
monocytogenes, Salmonella, dan Staphylococcus aureus (Doores 1999). Mikroba lain yang banyak
menimbulkan KLB keracunan pangan di Indonesia adalah Escherichia coli, Bacillus cereus,
Staphylococcus aureus, Clostridium perfringens, Salmonella, Vibrio cholera, dan Pseudomonas cocovenenans (Badan POM RI 2002, 2003a, 2004). Gejala dan akibat yang ditimbulkan, jumlah yang
dapat menyebabkan keracunan pangan, dan pencegahan mikroba patogen tersebut dapat dilihat pada Tabel 1. berikut ini.
Tabel 1. Mikroba patogen penyebab keracunan pangan*
Mikroba Jumlah Akibat Gejala Pencegahan
C. jejuni 104 sel/ml Aborsi,
infertilitas, enteridis
Sakit perut, demam kadang > 40oC, diare, muntah Pemanasan (55-60oC) C. perfringens 5x105 sel/ml
Diare akut Diare Pendinginan
Mikroba Jumlah Akibat Gejala Pencegahan E. coli EPEC ETEC EIEC EHEC 106-109 sel 108-109 sel 106 sel 10-100 sel Diare akut sampai diare berdarah
Diare berair, muntah, dan demam
Diare berair, kejang perut, demam
Diare basiler (berlendir, berdarah)
Diare berdarah
Pemasakan (<70oC; 2 menit)
L. monocytogenes 103 sel Aborsi Demam, gangguan
gastroenteritis, gejala mirip flu Pemasakan medium atau pada suhu 70oC
Salmonella sp. 105-107 sel Salmonelosis Typhoid
Non-typhoid
Demam enterik (demam 39-40oC, kejang perut, sakit kepala, hilang nafsu makan), konstipasi. Sakit perut, diare, muntah dan demam
Pemanasan 70-75oC (3-7 menit); 66oC (12 menit); 60oC (78-83 menit)
S. aureus 106 sel/ml Diare Mual, muntah, kejang
perut, diare
Pendinginan (-10)-0oC Pemanasan 66oC; 10 menit
Vibrio sp. 105-107 sel Kolera Diare, diare disertai serpihan mukus Pemasakan (>70oC) P. cocovenenans 2 mg/100g Keracunan asam bongkrek; toksoflavin
Sakit perut, keringat berlebihan, lelah mual
pH < 5,5 atau penambahan garam NaCl (2,75-3,0%)
B. cereus 105 sel/g Diare Diare, kejang perut,
muntah Pendinginan (10oC), pemanasan (60oC) Morganella sp. Keracunan histamin
Mual, muntah, diare, kejang perut, sakit kepala, rasa terbakar
Pembekuan, Pendinginan (1oC) *Badan POM RI (2003b)
B. Salmonella Typhimurium
Salmonella merupakan salah satu genus dari famili Enterobacteriaceae. Taksonomi Salmonella
sangatlah kompleks. Berdasarkan skema Kauffman-white dalam Brenner et al. (2000) genus
Salmonella terdiri dari dua spesies diantaranya adalah Salmonella bongori (V) dan Salmonella enterica. Spesies Salmonella enterica ini terdiri dari enam subspesies diantaranya adalah (1) Salmonella enterica subsp. enterica (I), (2) Salmonella enterica subsp. salamae (II), (3) Salmonella
enterica subsp. arizonae (IIIa), (4) Salmonella enterica subsp. diarizonae (IIIb), (5) Salmonella enterica subsp. houtenae (IV), dan (6) Salmonella enterica subsp. indica (VI). Salmonella enterica
subsp. enterica terdiri dari 1.454 serotype/serovar dan salah satunya adalah serovar Typhimurium. Oleh karena itu, kata “Typhimurium” pada Salmonella Typhimurium atau biasa disingkat dengan
S. Typhimurim ditulis tidak dengan huruf miring dan juga ditulis dengan huruf kapital diawal katanya
(Brenner et al. 2000).
Salmonella Typhimurium merupakan bakteri Gram negatif, fakultatif anaerob, berbentuk batang,
tidak membentuk spora dan Salmonella Typhimurium juga memiliki flagella peritrikus sehingga bersifat motil. Salmonella Typhimurium berdiameter 0,7 hingga 1,5 µm dan dengan panjang 2 hingga 5 µm. Suhu minimum untuk pertumbuhan Salmonella Typhimurium adalah 45oC, sedangkan suhu pertumbuhan optimumnya adalah 35-37oC (D’Aoust 2000).
Bakteri dari genus Salmonella merupakan bakteri penyebab infeksi yang jika tertelan masuk dan berkembang biak di dalam tubuh akan menimbulkan gejala yang disebut salmonellosis. Penyakit yang disebabkan oleh Salmonella dibagi menjadi dua grup besar yaitu nontyphoid salmonellosis (gastroenteritis) dan typhoid salmonellosis (demam typhoid). Gastroenteritis disebabkan karena infeksi Salmonella Typhimurium yang terbatas pada epithelium usus sedangkan demam typhoid disebabkan karena infeksi yang terjadi pada keseluruhan sistem.
Typhoid salmonellosis (demam typhoid) memiliki gejala awal yang agak berbeda dan jauh lebih lambat (24-48 jam setelah konsumsi) daripada nontyphoid salmonellosis (12 jam setelah konsumsi). Demam typhoid akan mengalami peningkatan secara bertahap setiap harinya dan sering kali muncul bintik merah pada kulit. Gejala yang timbul pada demam typhoid adalah demam dengan suhu 39-40oC, kejang perut, sakit kepala, hilang nafsu makan, dan konstipasi. Penderita mungkin mengalami perforsi dan pendarahan usus dan koma. Penderita yang telah sembuh seringkali menjadi
asymptomic carriers dimana organisme ini tetap berada dalam kantong empedu dan usus. Sedangkan
gastroenteritis digejalai dengan mual, muntah, kejang perut, dan diare (Ziprin dan Hume 2001). Pangan yang sering terkontaminasi Salmonella Typhimurium adalah telur dan hasil olahannya, ikan dan hasil olahannya, daging ayam, daging sapi, susu dan hasil olahannya. Keracunan pangan oleh
Salmonella disebabkan karena pangan mengandung Salmonella dalam jumlah yang signifikan yaitu
107 sel (Jay et al. 2005).
C. Metode Identifikasi Salmonella Typhimurium Secara Konvensional
Analisis pangan terhadap kemungkinan adanya bakteri patogen atau bakteri pembusuk merupakan standar yang diharuskan untuk mengetahui kualitas pangan dan menjamin keamanan pangan (de Boer dan Baumer 1999). Analisis tersebut biasanya menggunakan metode konvensional yang telah distandarkan sehingga setiap negara di dunia memiliki standar yang sama dalam menilai kualitas pangan. Metode deteksi konvensional yang dimaksud ialah metode pengkulturan mikroba pada media spesifik dan menghitung sel mikroba yang hidup dalam pangan. Prinsipnya ialah mikroba bermultiplikasi pada media pertumbuhan sehingga dapat dideteksi. Metode ini sensitif, dapat memberi hasil uji kualitatif maupun kuantitatif, dan dapat menjadi standar bagi uji mikrobiologi terhadap produk pangan secara internasional.
Analisis Salmonella terdiri dari beberapa tahapan, diantaranya adalah pra-pengayaan, pengayaan selektif, isolasi dengan agar selektif, tes biokimia, identifikasi dan uji serologi. Salmonella tidak dapat berkompetisi secara baik dengan bakteri-bakteri yang umum pada pangan (Ray 2001). Oleh karena itu tahap pra-pengayaan dengan media Lactose Broth (LB) dibutuhkan untuk membantu memperbaiki sel yang rusak, melarutkan zat toksik atau zat penghambat, dan juga menyediakan keuntungan nutrisi khususnya bagi Salmonella (Vanderzant dan Splittoesser 1992).
Pada media Lactose Broth (LB), laktosa akan difermentasi oleh sebagian besar bakteri
non-Salmonella sehingga menyebabkan penurunan pH media. Penurunan pH media akan menghambat
pertumbuhan bakteri non-Salmonella, sementara bakteri Salmonella dapat tetap tumbuh. Pada tahap ini inkubasi dilakukan pada suhu 37oC dan dianggap positif jika terjadi kekeruhan di media LB.
Metode pengayaan selektif Rappaport-Vassiliadis medium (RV) yang mengandung senyawa selektif seperti malachite green dan magnesium klorida yang dikombinasikan pada pH rendah (5,2 ± 2) akan menghambat pertumbuhan mikroba alami yang berasal dari saluran pencernaan selain
Salmonella. Media yang digunakan pada tahap isolasi terdiri dari tiga jenis agar selektif yaitu Hektoen Enteric Agar (HEA), Xylose Lysine Deoxycholate Agar (XLDA), dan Bismuth Sulfite Agar (BSA).
Dari ketiga media yang berbeda ini akan ditemukan koloni spesifik yang diindikasikan Salmonella. Pada media HEA dan XLDA yaitu ditandai dengan koloni dengan bintik hitam di tengah yang menghasilkan H2S, sedangkan pada media BSA koloni Salmonella akan menghasilkan warna coklat hingga hitam dengan kilau metalik (Difco dan BBL manual 2003).
Tahap akhir pada metode konvensional adalah tes biokimia, identifikasi, dan uji serologi. Salah satu langkahnya adalah dengan melihat pertumbuhan Salmonella pada media TSIA (Triple Sugar Iron
Agar) dan LIA (Lysine Iron Agar). Pada media TSIA, jika hasil positif maka media akan berwarna
kuning dengan adanya indikator pH fenol merah karena terfermentasinya laktosa oleh Salmonella. Sedangkan pada media LIA akan terbentuk warna gelap pada agar miring yang menunjukkan terjadinya deaminasi lisin dan ammonia yang terbentuk akan bereaksi dengan ferric ammonium citrate serta endapan hitam pada dasar tabung yang menunjukkan adanya produksi H2S (Difco dan BBL manual 2003).
Saat ini telah banyak teknik yang dikembangkan untuk mempermudah pelaksanaan metode konvensional, misalnya: gravimetric diluter, pulsifier dan stomacher yang mempermudah homogenisasi; spiral plater, dipslide, dan petrifilm untuk enumerisasi dan deteksi; colony counter dan kit uji untuk konfirmasi atau identifikasi (de Boer dan Beumer 1999). Meskipun demikian waktu pendeteksian tidak berkurang secara signifikan.
D. Metode Isolasi dan Identifikasi Salmonella Typhimurium Secara Cepat
dengan Real-Time PCR
Metode deteksi cepat patogen dan kontaminan mikrobiologi lainnya dalam pangan merupakan hal yang sangat penting untuk menjamin keamanan pangan konsumen. Keuntungan dari metode cepat dibandingkan dengan metode konvensional adalah waktu lebih singkat (4-48 jam), tidak membutuhkan banyak tenaga, serta lebih sensitif dan akurat (Patel dan Williams 1994, Chen et al. 2009).
Metode cepat yang dalam dekade ini berkembang pesat adalah metode deteksi berbasiskan DNA. Metode berbasiskan DNA memiliki spesifikasi terbaik dan sesuai untuk mendeteksi patogen dalam pangan (de Boer dan Baumer 1999). Banyak uji yang berbasiskan DNA, tapi hanya metode probe, PCR dan bakteriofag yang telah dikembangkan secara komersial untuk mendeteksi patogen pencemar pangan (foodborne patogen).
Reaksi berantai polimerase atau lebih umum dikenal sebagai PCR (Polymerase Chain Reaction) merupakan suatu teknik atau metode perbanyakan DNA secara enzimatik tanpa menggunakan organisme. Dengan teknik ini, DNA dapat dihasilkan dalam jumlah besar dengan waktu relatif singkat sehingga memudahkan berbagai teknik lain yang menggunakan DNA. Teknik ini dirintis oleh Kary Mullis pada tahun 1983. Penerapan PCR banyak dilakukan di bidang biokimia dan biologi molekuler karena relatif mudah dan hanya memerlukan jumlah sampel yang kecil.
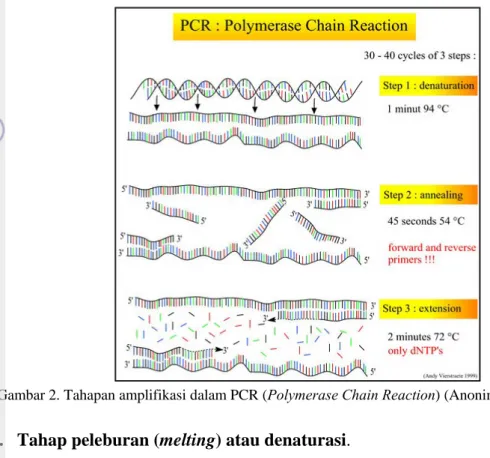
Secara prinsip, baik real-time PCR maupun PCR konvensional merupakan proses yang dilakukan berulang-ulang antara 20–30 kali siklus. Setiap siklus terdiri atas tiga tahap utama (Pestana et al. 2010). Berikut adalah tiga tahap utama kerja PCR dalam satu siklus, ketiga tahap utama dalam proses amplifikasi tersebut dapat dilihat lebih jelas pada Gambar 2 berikut ini.
Gambar 2. Tahapan amplifikasi dalam PCR (Polymerase Chain Reaction) (Anonim 2009).
1. Tahap peleburan (melting) atau denaturasi.
Tahap ini berlangsung pada suhu tinggi, 94–96°C ikatan hidrogen DNA terputus (denaturasi) dan DNA utas ganda menjadi utas tunggal. Biasanya pada siklus awal PCR, tahap ini dilakukan lebih lama (5 menit) untuk memastikan semua berkas DNA terpisah. Pemisahan ini menyebabkan DNA tidak stabil dan siap menjadi template (patokan) bagi primer. Umumnya, waktu/durasi yang dibutuhkan untuk tahap ini yaitu selama 1–2 menit.
2. Tahap penempelan atau annealing.
Primer menempel pada bagian Template DNA yang komplementer urutan basanya. Tahap ini dilakukan pada suhu antara 45–60°C. Penempelan ini bersifat spesifik. Suhu yang tidak tepat menyebabkan tidak terjadinya penempelan atau primer menempel di sembarang tempat. Umumnya, waktu/durasi yang dibutuhkan untuk tahap ini yaitu selama 1–2 menit.
3. Tahap pemanjangan (extension) atau elongasi.
Suhu untuk proses ini tergantung dari jenis enzim DNA polimerase yang dipakai. Karena suhu dinaikkan ke dalam kisaran suhu optimum kerja enzim DNA polimerase. Dengan Taq polimerase, proses ini biasanya dilakukan pada suhu 70-76°C. Pada tahap ini DNA polimerase akan memasangkan dNTP yang sesuai pada pasangannya, jika basa pada template adalah A, maka akan dipasang dNTP, begitu seterusnya (pasangan A adalah T, dan C dengan G, begitu pula sebaliknya). Enzim akan memperpanjang rantai baru ini hingga ke ujung. Lamanya waktu
ekstensi bergantung pada panjang daerah yang akan diamplifikasi, misalnya adalah 1 menit untuk setiap 1000 bp.
Selain ketiga proses tersebut umumnya tahap kerja PCR didahului dan diakhiri oleh tahapan berikut:
1. Pra-denaturasi
Dilakukan selama 1-9 menit di awal reaksi untuk memastikan kesempurnaan denaturasi dan mengaktivasi DNA Polimerase (jenis hot-start/aktif jika dipanaskan terlebih dahulu).
2. Final Elongasi
Umumnya dilakukan pada suhu optimum enzim (70-72oC). Tahap ini dilakukan selama 5-15 menit untuk memastikan bahwa setiap utas tunggal yang tersisa sudah diperpanjang secara sempurna. Proses ini dilakukan setelah siklus PCR terakhir.
Proses amplifikasi PCR dilakukan dengan menggunakan mesin thermal cycler yang dapat menaikkan dan menurunkan suhu dalam waktu cepat sesuai kebutuhan siklus PCR. Pada awalnya untuk melakukan proses tersebut digunakannya tiga penangas air (water bath) untuk melakukan
melting, annealing dan extention secara manual, berpindah dari satu suhu ke suhu lainnya
menggunakan tangan. Tetapi sekarang mesin thermal cycler sudah terotomatisasi dan dapat diprogram sesuai kebutuhan.
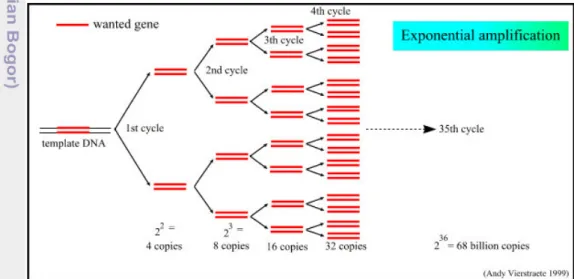
Secara teoritis, PCR dapat mengamplifikasi satu salinan DNA menjadi satu juta kali dalam waktu kurang dari 2 jam (Gambar 3.) maka berpotensi untuk mengurangi bahkan menghilangkan kebutuhan untuk pengayaan kultur, namun kehadiran inhibitor dalam pangan dan dalam berbagai media kultur dapat mencegah terikatnya primer dan mengurangi efisiensi amplifikasi sehingga sangat sensitif dicapai dengan PCR dan kultur murni sering berkurang bila menguji pangan. Oleh karena itu, beberapa pengayaan kultur diperlukan sebelum dilakukannya analisis.
Gambar 3. Jumlah DNA yang dihasilkan dari proses amplifikasi (Anonim 2009)
Komponen lain yang dibutuhkan untuk pengujian ini selain template DNA yang akan digandakan dan enzim DNA polimerase, diantaranya adalah:
1. Primer
Primer adalah sepasang DNA utas tunggal atau oligonukleotida pendek yang menginisiasi sekaligus membatasi reaksi pemanjangan rantai atau polimerisasi DNA. PCR hanya mampu
menggandakan DNA pada daerah tertentu sepanjang maksimum 10000 bp, dan dengan teknik tertentu bisa sampai 40000 bp. Primer dirancang untuk memiliki sekuen yang komplemen dengan template DNA, sehingga dirancang agar menempel mengapit daerah tertentu yang diinginkan. Langkah pertama dalam perancangan primer adalah mencari/membuat urutan DNA/gen yang diinginkan, umumnya dapat menggunakan basis data umum seperti NCBI. Setelah urutan DNA/gen yang diinginkan diperoleh, kemudian software untuk merancang primer digunakan untuk mempermudah dan memaksimalkan keberhasilan dalam merancang primer. Langkah berikutnya adalah mempertimbangkan dengan hati-hati daerah gen yang akan digunakan sebagai template DNA. Gen yang memiliki struktur sekunder atau urutan nukleotida yang panjang harus dihindari dalam perancangan primer (Pestana et al. 2010).
Besarnya konsentrasi dari primer yang digunakan merupakan hal yang menentukan keberhasilan pengujian. Jika konsentrasi primer pada pengujian dengan real-time PCR yang digunakan terlalu tinggi, maka akan meningkatkan kesempatan untuk terjadinya mispriming yang artinya akan menghasilkan produk PCR yang tidak spesifik karena primer berikatan tidak hanya dengan gen target, tetapi dengan gen-gen lainnya pada template DNA yang ditambahkan (Pestana
et al. 2010), namun jika konsentrasi primer yang digunakan terlalu rendah, maka akan dihasilkan
suatu metode pengujian yang tidak sensitif yang menyebabkan terjadinya false-negative dimana sampel yang positif (mengandung gen target) akan terdeteksi negatif (Lee et al. 2006). Oleh karena itu penentuan konsentrasi primer sangat dibutuhkan dalam pengujian dengan real-time PCR.
2. dNTP (deoxynucleoside triphosphate)
dNTP atau building blocks sebagai ‘batu bata’ penyusun DNA yang baru. dNTP terdiri atas empat macam sesuai dengan basa penyusun DNA, yaitu dATP, dCTP, dGTP dan dTTP.
3. Buffer PCR
Buffer yang biasanya terdiri atas bahan-bahan kimia untuk mengkondisikan reaksi agar berjalan optimum dan menstabilkan enzim DNA polimerase.
4. Kofaktor
Kofaktor berfungsi untuk meningkatkan jumlah akhir dari reaksi. Kofaktor tersebut berupa Ion logam bivalen, umumnya magnesium klorida (Mg2+), sebagai kofaktor bagi enzim DNA polimerase. Tanpa ion ini enzim DNA polimerase tidak dapat bekerja (Pestana et al. 2010). Prinsip amplifikasi real-time PCR sama dengan PCR standar, hanya saja pada real-time PCR ditambahkan label berfluoresensi (fluoresence dye) sehingga penggunaan teknik real-time PCR lebih efisien dan efektif dibandingkan PCR standar (Edward et al. 2004). Terdapat dua jenis komponen label berfluoresensi yang umum digunakan dalam proses real-time PCR, diantaranya adalah label yang berikatan dengan DNA (DNA binding dyes) dan komponen kimia yang berbasiskan probe (Probe-based chemistries).
Salah satu contoh label yang berikatan dengan DNA adalah SYBR® green I dimana label tersebut merupakan label yang tidak spesifik dan akan berikatan dengan semua jenis DNA utas ganda. Sedangkan contoh komponen kimia yang berbasiskan probe adalah TaqMan, Molecular Beacon, dan Scorpion yang merupakan susunan/sekuen probe yang spesifik. Prinsip dari probe tersebut adalah dengan menggunakan keberadaan dari transfer energi resonansi fluoresensi/Fluorescence Resonance
dari DNA polimerase untuk mendeteksi proses amplifikasi yang terjadi di dalam real-time PCR (Pestana et al. 2010).
1. DNA Binding Dyes, SYBR
®green I
Keuntungan dari SYBR® green I adalah mengukur intensitas fluoresen secara proporsional sesuai dengan produk PCR yang dihasilkan. Sedangkan kekurangannya adalah SYBR® green I yang merupakan label fluoresen yang tidak spesifik sehingga dapat menghasilkan sinyal pengujian false-positive karena terjadinya primer-dimer atau terbentuknya produk yang tidak spesifik oleh karena itu setiap pengujian, penting dilakukannya penganalisisan formasi dari kurva pelelehan (melting curve) (Pestana et al. 2010).
SYBR® green I merupakan label fluoresen yang efektif dari segi biaya jika dibandingkan dengan komponen label kimia lainnya dan juga mudah digunakan. Penentuan konsentrasi primer yang tepat/optimum dapat dengan mudah dicapai dengan menggunakan SYBR® green I sebagai bahan fluoresen dibandingkan dengan menggunakan bahan yang lainnya seperti TaqMan dan Molecular Beacon. Ketika SYBR® green I berada dalam kondisi bebas dalam larutan, maka akan menunjukkan level fluoresen yang relatif rendah, tetapi ketika dsDNA ditambahkan, fluoresen yang berpendar akan meningkat lebih dari 1000 kali lipat. Akumulasi dari amplikon/produk amplifikasi PCR meningkat seiring dengan meningkatnya siklus reaksi, maka intensitas fluoresen juga akan meningkat karena molekul SYBR® green I berikatan dengan DNA, dan kemudian akumulasi dari produk yang dihasilkan dapat diukur dalam real-time PCR. SYBR® green I dapat berikatan dengan DNA utas ganda pada suhu 55oC, namun pada suhu suhu 95oC SYBR® green I akan terdisosiasi/terlepas dari DNA utas ganda. Hal tersebut dapat dilihat pada Gambar 4. berikut ini.
Gambar 4. DNA binding dyes dalam real-time PCR. Fluoresen secara dramatis meningkat ketika molekul dye berikatan dengan DNA (Pestana et al. 2010)
Sensitifitas deteksi dengan menggunakan SYBR® green I dipengaruhi oleh pembentukan primer-dimer, spesifisitas primer yang rendah, konsentrasi primer (dapat membatasi), dan terbentuknya struktur sekunder pada produk PCR. Semua faktor tersebut dapat mengarahkan pada terbentuknya produk DNA utas ganda yang tidak diharapkan yang dapat berikatan dengan SYBR® green I dan menghasilkan sinyal fluoresen. Telah dijelaskan sebelumnya bahwa SYBR® green I tidak dapat membedakan satu DNA dengan DNA yang lainnya, oleh karena itu penting untuk menganalisis kurva pelelehan pada akhir pengujian dengan real-time PCR (Pestana et al. 2010).
2. Probe-Based Chemistry
Penggunaan berbasiskan probe merupakan pendeteksian yang lebih spesifik karena jenis fluoresen tersebut menggunakan pemeriksaan/penyelidikan internal disamping penggunaan sepasang primer yang digunakan untuk mengamplifikasi daerah tertentu. Penggunaan probe lebih mahal dan perlu dilakukannya perancangan sekuen nukleotida agar sekuen pada probe tersebut sesuai dengan sekuen pada gen target. Oleh karena itu deteksi dengan menggunakan probe nantinya dibutuhkan proses validasi dan optimasi yang terpisah khusus untuk probe, namun dapat menghasilkan spesifisitas yang lebih tinggi jika menggunakan Molecular Beacon (Pestana et al. 2010).
Real-time PCR melakukan amplifikasi dan deteksi dalam satu tahapan sebab akumulasi produk
spesifik dicatat secara kontinyu selama siklus. Hal ini tidak dapat dilakukan pada PCR standar yang masih mengandalkan elektroforesis gel agarosa untuk mengkuantitasi amplikon. Selain itu, hasil dari elektroforesis gel agarosa dapat memperpanjang waktu deteksi dan timbulnya kontaminasi.
Pendeteksian produk real-time PCR secara kuantitatif berbeda dengan PCR standar yang mengkuantitasi amplikon di akhir fase amplifikasi (fase plato) dan juga berdasarkan panjang basa atau bobot molekul padahal molekul yang berbeda mungkin saja memiliki ukuran yang sama atau hampir sama. Kuantitasi produk real-time PCR terdeteksi pertama kali di setiap siklus (fase eksponensial) dan dihitung berdasarkan threshold cycle (Ct) yaitu waktu dimana intensitas fluoresen lebih besar dari pada fluoresen yang ditimbulkan oleh noise (background fluorescence). Noise dapat disebabkan oleh penempelan larutan isolat DNA beserta pereaksi-pereaksi PCR pada dinding tabung microwell.
Keunggulan real-time PCR lainnya ialah analisis dapat dilakukan tanpa membuka tabung sehingga mengurangi resiko kontaminasi amplikon PCR atau molekul target lainnya. Menurut Edward
et al. (2004), aplikasi teknologi real-time PCR mengurangi waktu penanganan atau pengujian dan
meningkatkan keakuratan kuantifikasi metode PCR.
Sebelum tahap amplifikasi dengan real-time PCR, diperlukan tahap persisapan/pra-amplifikasi, kemudian setelah tahap amplifikasi diperlukan evaluasi produk real-time PCR. Tahap pra-amplifikasi PCR standard dan real-time PCR tidak berbeda, meliputi persiapan sampel bakteri dan isolasi DNA untuk memperoleh isolat DNA sebagai DNA target amplifikasi. Protokol yang baik dalam mempersiapkan isolat DNA adalah fokus pada tahap pengumpulan/pemanenan patogen, penghilangan inhibitor yang terdapat pada pangan atau pada media kultur, dan pengisolasian DNA (Lee et al. 2006). Prinsip dasar isolasi DNA adalah serangkaian proses untuk memisahkan DNA dari komponen-komponen sel lainnya. Hasil ekstraksi merupakan tahapan penting untuk langkah berikutnya. Oleh sebab itu, tahapan ini harus dilakukan dengan baik dan bebas kontaminasi. Terdapat enam tahap dalam mengisolasi DNA, yaitu (1) preparasi sampel, (2) pelisisan sampel yang umumnya menggunakan buffer yang mengandung Tris.HCl pH8,0; EDTA pH 8,0; CTAB, proteinase K, dan SDS (sodium dodecylsulphate), (3) proteksi dan stabilisasi DNA dengan menggunakan buffer TE yang mengandung Tris.HCl dan EDTA pH 8,0 dan juga ditambahkan NaCl, (4) pemisahan DNA dari debris sel dilakukan dengan cara sentrifugasi dan juga ditambahkan dengan fenol, kloroform, dan isoamil alkohol dengan perbandingan tertentu atau dengan dididihkan pada air suhu 100oC, (5) presipitasi DNA dengan menambahkan etanol 96% atau isopropanol, sedangkan (6) pemekatan DNA dilakukan dengan pencucian menggunakan etanol 70% dan ditambahkan dengan buffer TE (Tris.HCl dan EDTA). Berdasarkan prinsip tersebut, banyak metode untuk mengisolasi/mengekstraksi DNA dari sel mikroba salah satunya adalah metode pendidihan, dan dari berbagai metode tersebut, banyak industri yang mengembangkan suatu kit untuk memudahkan pengisolasian/pengekstraksian DNA.
Metode pendidihan (boiling method) merupakan salah satu metode untuk mengisolasi/ mengekstraksi DNA dari sel mikroba. DNA yang berasal dari bakteri Gram negatif (contohnya:
Salmonella) dapat dengan mudah diisolasi/diekstraksi dengan menggunakan metode pendidihan/
mendidihkan sel bakteri di dalam air (Lee et al. 2006).
Tahap isolasi DNA dengan metode pendidihan dilakukan setelah tahap enrichment pada kultur murni maupun pada sampel pangan. Tahap enrichment ini berfungsi untuk menyembuhkan sel mikroba yang rusak maupun memperbanyak mikroba agar memberi keyakinan bahwa mikroba yang diisolasi adalah mikroba hidup. Selain itu juga untuk mengencerkan komponen inhibitor PCR yang terdapat pada matriks sampel (Rådström et al. 2004).
Bahan yang pertama kali digunakan pada metode pendidihan adalah buffer TE dimana mengandung Tris HCl 1 M pH 8,0 dan EDTA 0,5 M yang dicampur dengan pelet yang dihasilkan setelah sentrifugasi sampel. Proses sentrifugasi dan resuspensi pelet yang dihasilkan dengan buffer TE secara berulang berfungsi untuk mencuci sampel (kultur murni/sampel spike) dari inhibitor-inhibitor yang terkandung di dalamnya yang dapat mengganggu tahap amplifikasi DNA nantinya (Lee at al. 2006). Selain itu buffer TE juga berfungsi untuk menjaga kestabilan DNA agar tidak terdegradasi ketika pelisisan sel terjadi.
Kemudian bahan berikutnya adalah penambahan lisozim ke dalam pelet bersamaan dengan ditambahkannya buffer TE. Lisozim berfungsi untuk melisiskan dinding sel bakteri dimana lisozim dapat merusak membran luar sel bakteri. Aktivitas lisozim efektif pada suhu ruang. Kemudian pada metode pendidihan juga ditambahkan proteinase K. Proteinase K merupakan enzim proteolitik yang digunakan untuk menghilangkan protein. Protein merupakan salah satu inhibitor dalam proses amplifikasi DNA. Suhu optimum aktivitas enzim proteinase K adalah 55-60oC selama 1 jam. Semakin lama inkubasi, maka daya recovery DNA semakin baik (Sambrook et al. 1989).
Pendidihan di dalam air yang bersuhu 100oC berfungsi untuk menginaktivasi enzim proteinase K dan enzim nuklease atau DNAse dimana dapat mencerna asam nukleat dan menyebabkan penurunan kualitas maupun kuantitas DNA selama penyimpanan. Pendidihan dengan pemanasan 100oC juga dapat mempercepat lisis dinding sel bakteri sehingga DNA dapat diekstraksi sekaligus mempermudah proses denaturasi rantai DNA ketika dilakukan amplifikasi dengan PCR. Selain itu pendidihan juga dapat berfungsi mendenaturasi protein-protein inhibitor. Proses pendidihan tidak dapat mendenaturasi DNA plasmid karena secara topologi intertwined (Sambrook et al. 1989), namun dapat mendenaturasi DNA kromosomal.
Pendinginan segera dilakukan di dalam freezer setelah dilakukannya pendidihan agar DNA kromosomal dapat terenaturasi. Proses pendinginan ini juga menyebabkan debris sel, protein-protein inhibitor dan DNA plasmid mengendap. DNA kromosomal akan larut dalam supernatan sedangkan debris sel, protein inhibitor, dan DNA plasmid akan terendapkan pada pelet setelah proses sentrifugasi dimana dilakukan setelah proses pendinginan tadi. Dan supernatan yang dihasilkan tersebut diambil sebagai isolat DNA yang akan digunakan pada tahap amplifikasi selanjutnya.
Setelah persiapan isolat DNA selesai, maka dilakukan tahap amplifikasi yang dijalankan dalam
thermal cycler dan dihasilkan/ditampilkan dalam bentuk grafik pada layar komputer dengan software
yang aplikabel terhadap thermal cycler, contohnya adalah software IQ-5 (Bio-Rad). Grafik-grafik yang diperoleh berupa grafik amplifikasi, kurva standar, kurva pelelehan (melt curve) dan kurva puncak pelelehan (melt peak curve). Grafik tersebut digunakan untuk mengevaluasi kinerja amplifikasi real-time PCR.
1. Kurva Amplifikasi
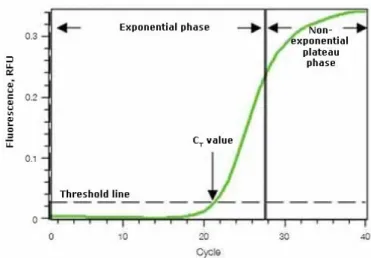
Kurva amplifikasi terbentuk sejak proses amplifikasi dimulai. Kurva ini berfungsi untuk menentukan apakah dalam thermal cycler terjadi amplifikasi atau tidak. Kurva amplifikasi dapat dilihat pada Gambar 5. berikut ini.
Gambar 5. Grafik sigmoid proses amplifikasi dengan real-time PCR (Pestana et al. 2010) Amplifikasi ditetapkan berdasarkan intensitas fuoresen, semakin banyak produk amplifikasi yang dihasilkan, semakin besar akumulasi fluoresen yang terbaca. Peningkatan fuoresen tersebut ditandai dengan terbentuknya grafik sigmoid, seperti yang tergambar pada Gambar 5. (garis hijau).Grafik sigmoid akan berpotongan dengan baseline threshold yang telah ditentukan secara otomatis oleh program. Titik perpotongan antara grafik sigmoid dan baseline threshold jika direfleksikan pada sumbu-x (Cycle) adalah threshold cycle (Ct) bagi sampel yang diamplifikasi.
Nilai Ct adalah siklus di atas noise dimana akumulasi produk (senilai 2n, n adalah jumlah pengulangan siklus amplifikasi) terbaca pertama kali pada fase eksponensial. Fase eksponensial berakhir menjadi fase plato saat pereaksi dalam campuran reaksi PCR sudah habis. Nilai Ct digunakan dalam kurva standarsebagai fungsi terhadap log konsentrasi bakteri.
2. Melt Curve dan Melt Peak Curve
Setelah pengujian dengan real-time PCR selesai, thermo cycler dapat disesuaikan untuk menghasilkan kurva pelelehan (melt curve) dan kurva puncak pelelehan (melt peak curve) dengan meningkatkan suhunya sedikit demi sedikit hingga mencapai titik pelelehan dimana DNA untai ganda menjadi DNA untai tunggal dan kemudian mengukur perubahan fluoresen yang dihasilkan. Pada titik pelelehan, untai ganda DNA terpisah dan sinyal fluoresen pun turun. Kurva pelelehan menghubungkan laju perubahan Relative Fluorescence Unit (RFU) per waktu (T) (-d(RFU)/dT) pada sumbu-y dengan suhu pada sumbu-x, kurva tersebut akan menunjukkan suhu pelelehan (Tm). Suhu pelelehan merupakan suhu dimana 50% amplikon DNA untai ganda terpisah menjadi dua untai tunggal.
Puncak kurva pada melt peak curve merupakan nilai Tm amplikon, jika nilainya ditarik menuju sumbu-x. Suhu Pelelehan/melting temperature (Tm) tergantung pada komposisi dasar dari produk yang terbentuk. Semua produk PCR untuk primer set tertentu harus memiliki nilai suhu pelelehan (Tm) yang sama kecuali jika terdapat adanya kontaminasi, mispriming, atau primer-dimer (Pestana et al. 2010). Amplikon yang berasal dari DNA target yang sama akan memiliki nilai Tm yang sama, ditunjukkan dengan puncak pada titik suhu yang sama. Melt peak
curve mampu menunjukkan ada atau tidaknya produk non-spesifik. Produk non-spesifik akan
membentuk puncak pada suhu yang berbeda dengan amplikon (produk spesifik) atau melt peak
curve dapat pula memiliki lebih dari satu puncak suhu. Bentuk kurva pelelehan dan kurva puncak
Gambar 6. Kurva pelelehan/melt curve (kiri) dan kurva puncak pelelehan/melt peak curve (kanan) (Hoffman et al. 2007)
Setelah proses amplifikasi, jika molekul PCR yang terbentuk memiliki panjang yang sama maka akan terbentuk single curve (satu puncak dan satu nilai Tm), namun jika lebih dari satu produk PCR yang dihasilkan yang tidak homogen, maka akan terbentuk/teramati beberapa transisi termal (terbentuk lebih dari satu puncak/nilai Tm). Jika hal tersebut terjadi, perlu dibuktikan dengan elektroforesis gel untuk meyakinkan bahwa terdapat adanya lebih dari satu jenis DNA/produk PCR yang teramplifikasi (Gambar 7.).
Gambar 7. Analisis kurva pelelehan (melt curve), A. Dua jenis puncak yang dihasilkan mengindikasikan nilai Tm dari dua jenis produk PCR, B. Analisis elektroforesis gel pada produk PCR dari hasil yang terbentuk pada kurva A. Kedua jenis produk PCR tersebut dibuktikan dengan terpisahnya/diperolehnya dua pita dalam satu garis pada gel (Pestana et al. 2010).