BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Temulawak (Curcuma xanthorrhiza Roxb.) dikenal dengan banyak nama di berbagai daerah, seperti temu besar (bahasa Melayu), koneng golek temu raya (Sunda), dan temu labak (Madura). Tanaman ini tidak hanya dikenal sebagai bahan baku jamu tradisional dalam negeri saja, tetapi sudah sejak lama dikenal di Eropa Barat sebagai bahan obat-obatan (Hayati, 2003).
Temulawak termasuk salah satu jenis tumbuhan yang tidak dapat dipisahkan dari kehidupan masyarakat Asia Tenggara. Curcuma berasal dari kata Arab, kurkum yang berarti kuning. Xanthorrhiza berasal dari kata Yunani, xanthos yang berarti kuning dan rhiza berarti umbi akar. Jadi, Curcuma xanthorrhiza Roxb. berarti akar kuning (Hayati, 2003).
2.1.1 Sistematika Tumbuhan
Menurut Hayati (2003), klasifikasi temulawak adalah sebagai berikut: Kerajaan : Plantae Divisi : Spermatophyta Kelas : Monocotyledoneae Bangsa : Zingiberales Suku : Zingiberaceae Marga : Curcuma
2.1.2 Morfologi Tumbuhan
Temulawak termasuk terna tahunan dengan tinggi mencapai 1-2 meter. Terna adalah tumbuhan dengan batang lunak tidak berkayu atau hanya mengandung jaringan kayu sangat sedikit. Pada akhir masa tumbuhnya tumbuhan ini akan mati hingga bagian pangkalnya tanpa ada bagian batang yang tersisa di atas tanah (Hayati, 2003).
Daun temulawak berbentuk bulat telur panjang dengan ujung lancip, berwarna hijau dan di tengah-tengahnya terdapat guratan merah kecoklatan. Berbunga majemuk yang terletak di ujung batang, keluar dari akar dekat pangkal batang, berbentuk bulir pendek dan lebar. Setiap bunga yang berbentuk malai dilindungi kelopak yang cukup besar, didukung oleh penumpu yang berwarna putih, dan mahkotanya berwarna putih kekuningan atau kuning tua (Hayati, 2003).
Rimpang temulawak berbentuk silindris, memiliki buku dengan diameter mencapai 5-6 cm, dan panjang rimpang mencapai 10 cm. Rimpang induk dapat membentuk cabang rimpang ke kiri dan ke kanan. Rimpang ranting dapat menyabang ke berbagai arah sebagai anakan. Apabila umbi temulawak dibelah akan tercium aroma khas yang agak menyengat, ditambah rasa pahit (Hayati, 2003).
2.1.3 Kandungan Kimia
Rimpang temulawak mengandung zat yang disebut sebagai kurkumin. Selain mengandung kurkumin, temulawak juga mengandung sejenis minyak atsiri, yaitu Phellandreen, kamfer, glukosida, tumerol, Myrcene, Xanthorrizol, Safuranogermacrene, P-Tolyletycarbinol, dan zat tepung. Adanya zat-zat
tersebut membuat aroma temulawak menjadi khas. Temulawak mengandung minyak atsiri sebesar 7,3-30% dan kurkumin sebesar 1,4-4% (Hayati, 2003).
Berdasarkan penelitian Halim, et al. (2006), hasil pengujian skrining fitokimia ekstrak temulawak dalam pelarut air menunjukkan bahwa di dalam ekstrak temulawak terdapat triterpenoid, fenol, flavonoid, dan saponin. Senyawa fenol dilaporkan memiliki aktivitas antioksidan, antitumor, antivirus dan antibakteri yang signifikan. Temulawak mengandung polifenol berupa campuran senyawa diarilheptanoid, yakni kurkumin, demetoksi kurkumin, dan bisdemetoksikurkumin. Keberadaan gugusan fenolik pada ketiga senyawa tersebut dilaporkan menyebabkan aktivitas antioksidan yang kuat pada sistem biologis, sehingga dapat mencegah penyakit-penyakit yang berhubungan dengan reaksi peroksidasi (Ahsan, et al., 1999). Senyawa fenol merupakan senyawa yang memiliki paling sedikit satu cincin aromatik yang berikatan dengan satu atau lebih gugus OH. Kapasitas antioksidan dari senyawa fenolik disebabkan oleh disumbangkannya atom hidrogen dari gugus hidroksil (OH) aromatik kepada radikal bebas (Duthie dan Crozier, 2000).
2.2 Antioksidan
Antioksidan adalah senyawa yang mempunyai struktur molekul yang dapat memberikan elektronnya kepada molekul radikal bebas tanpa terganggu sama sekali dan dapat memutus reaksi berantai dari radikal bebas. Radikal bebas adalah atom atau senyawa yang kehilangan pasangan elektronnya (Kumalaningsih, 2006).
katalase dan glutation peroksidase), vitamin-vitamin (seperti vitamin E, vitamin C, vitamin A dan beta karoten), ataupun senyawa lain (misalnya flavonoid, albumin, bilirubin, seruloplasmin dan lain-lain). Antioksidan enzimatis merupkan pertahanan utama (primer) terhadap kondisi stress oksidatif (Winarsi, 2007). Penggunaan senyawa antioksidan semakin berkembang, baik untuk makanan maupun untuk pengobatan seiring dengan bertambahnya pengetahuan tentang aktivitas radikal bebas (Boer, 2000).
Berdasarkan fungsinya, antioksidan dapat dibedakan menjadi 5, yaitu: 1. Antioksidan primer
Antioksidan ini berfungsi untuk mencegah terbentuknya radikal bebas baru karena ia dapat merubah radikal bebas yang ada menjadi molekul yang berkurang dampak negatifnya, yaitu sebelum sempat bereaksi. Antioksidan primer yang ada dalam tubuh yang sangat terkenal adalah enzim superoksida dismutase. Enzim ini sangat penting karena dapat melindungi hancurnya sel-sel dalam tubuh akibat serangan radikal bebas (Kumalaningsih, 2006).
2. Antioksidan Sekunder
Antioksidan sekunder merupakan senyawa yang berfungsi menangkap radikal bebas serta mencegah terjadinya reaksi berantai sehingga tidak terjadi kerusakan yang lebih besar. Contoh yang populer dari antioksidan sekunder adalah vitamin E, vitamin C, dan beta karoten yang dapat diperoleh dari buah-buahan (Kumalaningsih, 2006).
3. Antioksidan Tersier
jaringan yang rusak karena serangan radikal bebas. Biasanya yang termasuk kelompok ini adalah jenis enzim, misalnya metionin sulfoksidan reduktase yang dapat memperbaiki DNA dalam inti sel. Enzim tersebut bermanfaat untuk perbaikan DNA pada penderita kanker (Kumalaningsih, 2006).
4. Oxygen Scavenger
Antioksidan yang termasuk oxygen scavenger mengikat oksigen sehingga tidak mendukung reaksi oksidasi, misalnya: vitamin C (Kumalaningsih, 2006).
5. Chelators atau sequesstrants
Antioksidan ini mengikat logam yang mampu mengkatalisis reaksi oksidasi misalnya asam sitrat dan asam amino (Kumalaningsih, 2006).
Mekanisme kerja antioksidan secara umum adalah menghambat oksidasi lemak. Oksidasi lemak terdiri dari beberapa tahap, yaitu:
1. Inisiasi: LH + R* L* + RH
Dimana LH merupakan molekul substrat, contohnya lipid, dan R* merupakan radikal pengoksidasi. Oksidasi lipid menghasilkan radikal asam lemak yang sangat reaktif (L*) yang dapat dengan cepat bereaksi dengan oksigen membentuk radikal peroksil lipid (LOO*) (Antolovich, et al., 2002). 2. Propagasi: L* + O2 LOO*
LOO* + LH L* + LOOH
Radikal peroksil adalah pembawa rantai yang dapat mengoksidasi lipid lebih jauh, menghasilkan hidroperoksid lipid (LOOH) (Antolovich, et al., 2002).
3. Branching: LOOH LO* + HO*
2LOOH LOO* + LO* + H2O
Pemecahan dari hidroperoksid lipid melibatkan katalis ion logam transisi. Tahap ini akan menghasilkan peroksil lipid dan alkoksi lipid radikal (Antolovich, et al., 2002).
4. Terminasi: LO* + LO* produk non radikal LOO* + LOO* produk non radikal LO* + LOO* produk non radikal
Reaksi terminasi mencakup penggabungan radikal-radikal membentuk produk non radikal (Antolovich, et al., 2002).
2.3 Radikal Bebas
Radikal bebas adalah atom atau molekul yang memiliki elektron tidak berpasangan (unpaired electron). Adanya electron yang tidak berpasangan menyebabkan senyawa tersebut sangat reaktif mencari pasangan, dengan cara menyerang dan mengikat elektron molekul yang berada di sekitarnya. Target utama radikal bebas adalah protein, asam lemak tak jenuh dan lipoprotein, serta unsur DNA termasuk karbohidrat (Winarsi, 2007).
Antioksidan dalam tubuh bermanfaat untuk mencegah reaksi oksidasi yang ditimbulkan oleh radikal bebas baik berasal dari metabolisme tubuh maupun faktor eksternal lainnya. Berdasarkan asalnya, antioksidan terdiri atas antioksigen yang berasal dari dalam tubuh (endogen) dan dari luar tubuh (eksogen). Adakalanya sistem antioksidan endogen tidak cukup mampu mengatasi stres oksidatif yang berlebihan. Oleh karena itu,
diperlukan antioksidan dari luar (eksogen) untuk mengatasinya (Kukic, et al., 2006).
Radikal bebas diduga merupakan penyebab kerusakan sel yang mendasari timbulnya berbagai macam penyakit, seperti kanker, jantung koroner, rematik artritis, penyakit respiratorik, katarak, penyakit hati, serta berperan utama pada proses penuaan dini. Radikal bebas terbentuk dalam tubuh sebagai produk samping proses metabolisme, selain itu juga dapat berasal dari luar tubuh yang terserap melalui pernafasan atau kulit (Bast, et al., 1991).
2.4 Metode Fosfomolibdenum
Metode ini didasarkan pada proses reduksi dari Mo (VI) menjadi Mo (V) oleh antioksidan sehingga dapat membentuk kompleks fosfat/Mo(V) yang berwarna hijau. Untuk sampel yang tidak diketahui komposisinya, kaasitas antioksidan dapat dinyatakan sebagai ekivalensi α-tokoferol atau asam askorbat (Melo, et al., 2012).
2.5 Spektrofotometri Sinar Tampak
Spektrofotometri merupakan suatu metode analisis yang mempelajari interaksi antara materi dengan radiasi elektromagnetik. Spektrofotometri serapan sinar tampak dan ultraviolet memanfaatkan sinar dengan panjang gelombang 400-750 nm untuk daerah sinar tampak dan 200-400 nm untuk daerah sinar UV. Ada beberapa hal yang harus diperhatikan dalam analisis dengan spektrofotometri terutama untuk senyawa yang semula tidak berwarna yang akan dianalisis dengan spektrofotometri visibel karena
senyawa tersebut harus diubah terlebih dahulu menjadi senyawa yang berwarna (Gandjar dan Rohman, 2007).
Menurut Gandjar dan Rohman (2007), berikut adalah tahapan-tahapan yang perlu diperhatikan pada analisis kuantitatif dengan menggunakan spektrofotometri visibel:
a. Pembentukan molekul yang dapat menyerap sinar visibel
Hal ini perlu dilakukan jika senyawa yang dianalisis tidak menyerap pada daerah tersebut. Cara yang digunakan adalah dengan merubahnya menjadi senyawa lain atau direaksikan dengan pereaksi tertentu. Pereaksi yang digunakan harus memenuhi beberapa persyaratan yaitu:
- Reaksinya selektif dan sensitif
- Reaksinya cepat, kuantitatif dan reprodusibel - Hasil reaksi stabil dalam jangka waktu yang lama b. Waktu Operasional (Operating time)
Cara ini biasa digunakan untuk pengukuran hasil reaksi atau pembentukan warna. Tujuannya adalah untuk mengetahui waktu pengukuran yang stabil. Waktu operasional ditentukan dengan mengukur hubungan antara waktu pengukuran dengan absorbansi larutan.
c. Pemilihan panjang gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal. Untuk memilih panjang gelombang maksimal, dilakukan dengan membuat kurva hubungan antara absorbansi dengan panjang gelombang dari suatu larutan baku pada
konsentrasi tertentu. Ada beberapa alasan mengapa pengukuran harus menggunakan panjang gelombang maksimal, yaitu:
- Pada panjang gelombang maksimal, kepekaannya juga maksimal karena pada panjang gelombang maksimal tersebut, perubahan absorbansi untuk setiap satuan konsentrasi adalah yang paling besar.
- Di sekitar panjang gelombang maksimal, bentuk kutva absorbansi datar dan pada kondisi tersebut hukum Lambert-Beer akan terpenuhi.
- Jika dilakukan pengukuran ulang maka kesalahan yang disebabkan oleh pemasangan ulang panjang gelombang akan kecil sekali, ketika digunakan panjang gelombang maksimal.
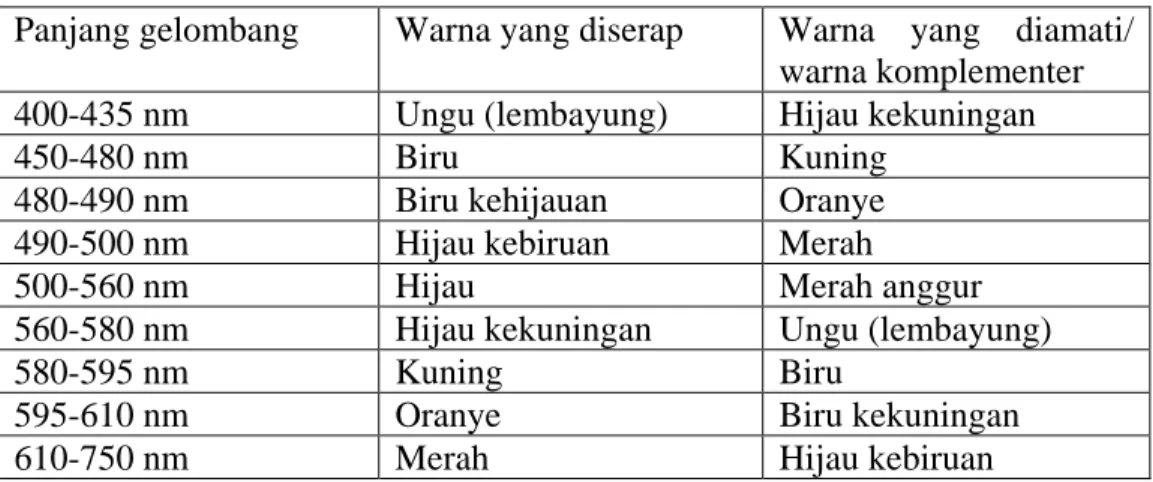
Tabel 2.1 Hubungan antara warna dengan panjang gelombang sinar tampak
Panjang gelombang Warna yang diserap Warna yang diamati/ warna komplementer 400-435 nm Ungu (lembayung) Hijau kekuningan
450-480 nm Biru Kuning
480-490 nm Biru kehijauan Oranye
490-500 nm Hijau kebiruan Merah
500-560 nm Hijau Merah anggur
560-580 nm Hijau kekuningan Ungu (lembayung)
580-595 nm Kuning Biru
595-610 nm Oranye Biru kekuningan
610-750 nm Merah Hijau kebiruan
d. Pembuatan kurva baku
Dibuat seri larutan baku dari zat yang akan dianalisis dengan berbagai konsentrasi. Masing-masing absorbansi larutan dengan berbagai konsentrasi diukur, kemudian dibuat kurva yang merupakan hubungan antara absorbansi (y) dengan konsentrasi (X).
e. Pembacaan absorbansi sampel atau cuplikan
Absorban yang terbaca pada spektrofotometer hendaknya antara 0,2 sampai 0,8 atau 15% sampai 70% jika dibaca sebagai transmitans. Anjuran ini berdasarkan anggapan bahwa kesalahan dalam pembacaan T adalah 0,005 atau 0,5% (kesalahan fotometrik).