Mekanisme terjemahan inisiasi di bersel satu
Fransiskus Poulin dan Nahum Sonenberg.
Inisiasi sintesis protein terdiri dalam perekrutan ribosom inisiator tRNA kompleks untuk kodon inisiasi dari messenger RNA. Di prokaryotes, proses ini melibatkan interaksi langsung ribosomal RNA dengan mRNA. Sebaliknya, bersel satu telah berevolusi mekanisme canggih yang sebagian besar mengandalkan interaksi protein-RNA dan protein-protein. Bersel satu telah mengambil keuntungan dari evolusi dari struktur mRNA novel, seperti 5' topi, dan Poli ekor (), untuk
mengembangkan mekanisme baru untuk perekrutan ribosom untuk mRNA.
Akibatnya, peralatan inisiasi eukariotik terjemahan kini mesin kompleks yang terdiri dari setidaknya sebelas faktor. Kerumitan ini menyediakan suatu tanah subur untuk meningkatkan peraturan, dan banyak mekanisme baru telah diadopsi oleh bersel satu untuk mengontrol sintesis protein. Memang, banyak faktor terjemahan adalah phosphoproteins fungsi yang dapat diatur oleh ekstraseluler sinyal. Kami akan menjelaskan di sini mekanisme terjemahan inisiasi di bersel satu, dengan penekanan khusus pada faktor-faktor terjemahan dan fungsi mereka.
Pengenalan
dengan konfirmasi struktur ribosom yang ribozyme (Lihat Bab 15 oleh B.T.
Wimberly), terjemahan muncul sebagai suatu proses untuk sebagian besar didorong oleh RNA. Dengan demikian, inisiasi sintesis protein tampaknya ditujukan kepada Majelis rRNA katalitik dan inisiator tRNA pada kodon AUG benar template mRNA. Untai ini mungkin sekarang secara luas diakui sebagai bintang-bintang, tetapi mereka tetap tidak bisa melakukan sendiri. Memang terjemahan mesin, terutama di bersel satu telah berkembang membutuhkan sejumlah faktor-pertumbuhan.1
protein yang fokus dari tinjauan ini adalah bagian penting yang dimainkan oleh faktor eukariotik inisiasi (eIFs) dalam menyatukan inisiator tRNA, ribosom dan mRNA.
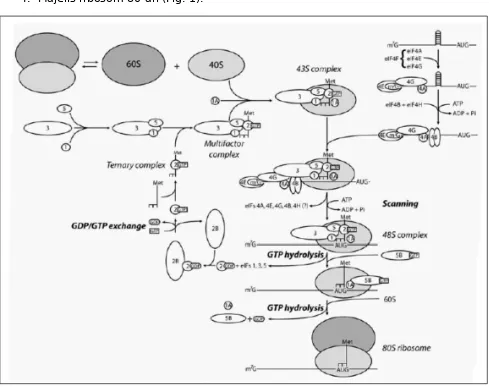
Di bersel satu setidaknya sebelas berbeda inisiasi faktor diperlukan untuk benar memulai translation. secara kolektif, mereka memastikan bahwa tRNA methionyl-inisiator (Met-tRNAiMet) adalah membawa situs P ribosom untuk AUG methionyl-inisiator dari mRNA. Secara konseptual, proses ini dapat dibagi dalam empat langkah:
1. pembentukan 43S pre-initiation kompleks ketika Met-tRNAiMet disampaikan oleh eIF2 ke situs P subunit ribosomal 40-an;
3. pemindaian 5' diterjemahkan daerah (UTR) dan pengakuan dari kodon AUG, dan
4. Majelis ribosom 80-an (Fig. 1).
Gambar 1 model Scanning inisiasi eukariotik terjemahan. Met-tRNAiMet berinteraksi dengan eIF2 GTP untuk membentuk kompleks terner. Multifactor kompleks adalah menengah fasilitasi Met-tRNAiMet perekrutan untuk subunit ribosomal 40-an, yang menghasilkan 43S kompleks. Faktor eIF4 mempromosikan perekrutan 43S kompleks ke ujung 5' mRNA. 43S kompleks kemudian scan mRNA 5' diterjemahkan wilayah pelokalan AUG inisiator (48S kompleks). Tidak diketahui apakah faktor eIF4
berpartisipasi dalam proses pemindaian. Base memasangkan antara anticodon Met-tRNAiMet dan kodon AUG mengaktifkan eIF2 GTPase, yang menyebabkan pelepasan faktor terikat. eIF1A dan eIF5B berinteraksi untuk mempromosikan ribosomal
Hanya standar "scanning" mekanisme digunakan oleh sebagian besar mRNA sitoplasma akan dipertimbangkan di sini. Pembaca diarahkan untuk ulasan terbaru oleh Jackson2 dan Hellen & Sarnow3 untuk pembahasan rinci jalur inisiasi alternatif.
Urutan genom beberapa archaea mengungkapkan bahwa terjemahan dalam archaea adalah hibrida antara bakteri dan eukariotik systems.4, 5 mRNA archaea yang membuka tutup, polisistronik, kekurangan (A) berbuntut panjang poli, dan urutan coding mereka yang paling sering didahului oleh suatu Pembersih -Dalgarno elemen. Berbeda dengan mekanisme bakteri untuk seleksi kodon inisiasi, genom archaea mengandung homolog faktor inisiasi banyak yang dianggap eksklusif eukaryotic.68 Kita tidak akan membahas terjemahan dalam archaea secara lebih rinci, kecuali untuk menunjukkan bahwa faktor archaea telah digunakan dalam tahun terakhir untuk mendapatkan wawasan struktural dan fungsional yang penting ke dalam mekanisme inisiasi terjemahan eukariotik (lihat di bawah).
Pembentukan Kompleks pra-inisiasi 43S Inisiator tRNA
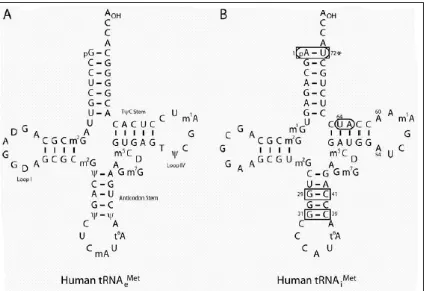
Terjemahan diprakarsai oleh khusus Met-tRNA di setiap organism.9 Karena fungsinya yang unik, inisiator Met-tRNA (Met-tRNAiMet) menyajikan banyak fitur fungsional dan struktural yang membedakannya dari elongator Met-tRNA. Pada eukariota, Met-tRNAiMet berinteraksi khusus dengan eIF2 · GTP kompleks (lihat di bawah), yang memberikan secara eksklusif ke ribosom P site.10 interaksi khusus ini dapat dijelaskan oleh perbedaan urutan antara inisiator dan bentuk elongator dari tRNA (Gambar 2). Beberapa kekhususan urutan mempromosikan aktivitas Met-tRNAiMet dalam inisiasi (Gambar 2). Ini termasuk A1: U72 pasangan basa yang sangat penting untuk fungsi inisiator dan viabilitas sel pada S. cerevisiae11 dan, ketika bermutasi ke G1: C72 hadir dalam elongator Met-tRNA, melemahkan afinitas manusia Met-tRNAiMet untuk eIF2 oleh faktor 10.12 Fungsi kritis A1: pasangan basa U72 dalam inisiasi ditegaskan oleh konservasi hampir universal di antara sitoplasma tRNA inisiator eukariotik, dan ditendang dari semua eukariotik elongator tRNAs.13 Selain itu, Met-tRNAiMet lingkaran IV berisi A60 di tempat pirimidin 60, dan A54 bukan T54 hadir dalam urutan TγC ditemukan di elongator tRNA (Gambar 2).
Kehadiran A pada posisi 54 dan 60 tidak mutlak diperlukan, karena hanya substitusi A54U adalah mematikan yeast.11 Sebagai perbandingan, substitusi ganda A54, A60 ke T54, U60 dalam tRNA manusia memiliki efek minimal pada in vitro inisiasi
assay.14 Sebuah ragi Met-tRNAi Bertemu dengan kedua G1: C72 dan T54 mutasi menyelamatkan sebuah elongator tRNAMet-habis ketegangan, menunjukkan kebutuhan residu ini untuk fungsi inisiator dan diskriminasi terhadap elongator tRNAMet.15 Akhirnya, Met-tRNAiMet berisi tiga berturut-turut G: C pasangan basa dalam batang antikodon (Gambar 2). Mengganti nukleotida ini dengan yang ditemukan di elongator tRNA mengurangi aktivitas inisiator dalam vitro.14
Gambar 2
Elemen tertentu dalam tRNA inisiator manusia. Struktur elongator manusia (A) dan inisiator (B) Met-tRNA. Dasar penting untuk meningkatkan fungsi inisiator kemas, sedangkan yang diskriminasi terhadap fungsi elongator dilingkari. Tanda bintang menunjukkan situs pengikatan eIF2. Posisi 64 di jamur dan tanaman Met-tRNAiMet memiliki kelompok phosphoribosyl melekat pada ribosa 2'-OH. Posisi 54 adalah penting untuk fungsi inisiator ragi Met-tRNAiMet.
Kekhususan urutan lainnya adalah penting bagi diskriminasi inisiator dan elongator tRNAMet (Gambar 2). Posisi 64 di tanaman dan jamur memiliki kelompok 2'-O-phosphoribosyl unik, yang mengganggu struktur TψC stem.9, 16 Modifikasi ini mencegah fungsi elongator dari Met-tRNAiMet, 17,18 mungkin dengan menghambat interaksi dengan eEF1A · GTP complex.19, 20 Pada vertebrata, telah diusulkan bahwa batang gangguan TγC adalah karena sifat dari pasangan basa di dasar stem.21 Memang, mutasi pada pasangan basa A50: U64 dan U51: A63
menghasilkan suatu tRNA inisiator yang berpartisipasi dalam perpanjangan dan, bila dikombinasikan dengan A1: U72 -> G1: C72 mutasi, menyebabkan hampir wild type elongator function.21
eIF2
faktor pertukaran nukleotida (GEF) eIF2B (Gambar 1; lihat di bawah). Sebuah homolog eIF2 hadir dalam archaea tetapi tidak dalam bakteri, di mana IF2 memberikan fMet-tRNAfMet ke 30S subunit.7
Gen penting menyandikan α, β dan γ subunit eIF2 di S. cerevisiae. Mutasi dalam semua tiga subunit mempengaruhi akurasi Agustus inisiasi kodon selection.22 Biokimia dan genetik analisis menunjukkan bahwa eIF2γ kemungkinan mengikat GTP dan Met-tRNAiMet.10, 22 Interaksi antara eIF2γ dan tRNA inisiator dikurangi dengan Y142H dan mutasi N135K di yeast.23, 24 N135K mutan juga meningkatkan hidrolisis GTP, 24 sedangkan mutasi K250R meningkatkan off-tingkat untuk PDB dan GTP.23 ini pengamatan baru-baru ini diperkuat oleh struktur kristal dari eIF2γ
archaea (a-eIF2γ) dari Pyrococcus abyssi.25 Urutan similarity7 menunjukkan bahwa-eIF2γ adalah homolog struktural dekat pemanjangan faktor eEF1A dan EF1A bakteri (lihat Bab 20 oleh P. Nissen dkk dan ref. 25). Hal ini paling jelas dalam struktur nukleotida bebas, yang menunjukkan bahwa tiga domain dari-eIF2γ sangat mirip dengan setara mereka di eEF1A dan EF1A, meskipun orientasi relatif mereka agak different.25 demikian, saku mengikat PDB dari- eIF2γ adalah identik dengan EF1A. Superimposisi domain 2 dan 3 dari EF1A · · GTP struktur Phe-tRNAPhe pada domain yang bersangkutan di-eIF2γ menunjukkan bahwa Phe-tRNAPhe mudah dapat
diakomodasi oleh struktur, kecuali untuk sisi Phe chain.25 Hal ini pada gilirannya menunjukkan saku mengikat rantai samping Bertemu Met-tRNAiMet, yang mungkin menjelaskan mengapa kelompok methionyl meningkatkan initiation.26 Struktur ini juga menunjukkan bahwa-eIF2γ tidak memiliki fitur yang memungkinkan untuk mengikat aminoasil EF1A-tRNA nonspesifik, membantu untuk menjelaskan
pengecualian elongator tRNA dari eIF2.25 Sayangnya, tidak ada perbedaan dapat diamati ketika membandingkan struktur PDB-terikat dari-eIF2γ ke bentuk terikat GMP-PNP, yang mungkin menunjukkan eIF2β yang memiliki peran dalam tRNAi Met mengikat eIF2. Oleh karena itu, penjelasan struktural bagaimana hidrolisis GTP menyebabkan pelepasan Met-tRNAiMet mungkin akan memerlukan co-kristal dari-eIF2γ dengan-eIF2β, a-eIF2α atau keduanya, bersama dengan tRNA inisiator. Sebuah aspek yang menarik dari struktur-eIF2γ adalah terjadinya dilestarikan empat sistein klaster yang ditemukan untuk mengkoordinasikan seng atom.25 Peran spesifik motif ini tidak diketahui, namun maknanya telah disorot dalam ragi mana bermutasi kedua sistein (C155) menjadi serin yang menyebabkan
pertumbuhan yang lambat phenotype.27
Sementara eIF2γ membentuk inti struktural eIF2, fungsi penting juga dilakukan oleh eIF2β.10 skrining genetik dalam ragi mengidentifikasi mutasi eIF2β dalam penting Cys2-Cys2 seng-jari motif ditemukan dalam domain karboksi-terminal eIF2β.22 Dua mutan (S264Y dan L254P) yang ditandai biokimia dan berunding kegiatan GTPase intrinsik eIF2, melibatkan eIF2β dalam mempromosikan eIF2γ GTPase activity.24 Independen hidrolisis GTP, yang S264Y mutan juga meningkatkan tRNA inisiator disosiasi dari eIF2.24 Selain itu, seng-jari Motif merupakan bagian dari daerah yang mengikat mRNA yang lebih besar, dan karena itu bisa menjadi penting untuk
memfasilitasi interaksi kodon-antikodon di eIF2.28 mRNA sifat mengikat juga dianggap berasal dari tiga mengulangi lisin ditemukan di amino-terminus eIF2β.28 Selain itu, ini mengulangi memediasi interaksi yang saling eksklusif eIF5 dan eIF2Bε dengan eIF2β.29, 30 Dalam perjanjian dengan adanya eIF2B dan eIF5 dalam
terdiri dari dua domain struktural independen dihubungkan oleh heliks dilestarikan linker.31 N-terminal domain dari-eIF2β sesuai dengan domain pusat ragi eIF2β, yang bertanggung jawab untuk interaksi dengan eIF2γ.32 Struktur dari domain
C-terminal mengungkapkan peran penting untuk atom seng dalam mempertahankan integritas struktural dari domain.31 mutasi eIF2β Ragi terlibat dalam inisiasi kodon selection22 mempengaruhi residu yang dilestarikan di a-eIF2β. Empat dari residu ini (Lys122, Arg125, Val 126 dan Ile140) yang terletak di dekat dalam struktur
C-terminal domain, 31 dan bisa berfungsi sebagai tempat pengikatan komponen translasi lain yang terlibat dalam inisiasi kodon recognition.31
Fosforilasi residu serin dilestarikan (Ser51) di eIF2α mengkonversi eIF2 · PDB dari substrat inhibitor kompetitif eIF2B.10 Sedangkan eIF2α diperlukan untuk ragi
bertahan hidup dalam kondisi normal, tidak penting asalkan β dan subunit γ sebagai serta tRNA inisiator yang overexpressed.33 Penghapusan subunit α dari eIF2
menyebabkan peningkatan 18 kali lipat dalam Km dari eIF2B katalis pertukaran nukleotida, menunjukkan bahwa eIF2α diperlukan untuk interaksi antara eIF2 dan eIF2B yang mempromosikan tarif liar jenis nukleotida exchange.34 Konsisten dengan ini, fosforilasi eIF2α pada Ser51 meningkatkan afinitas untuk subcomplex peraturan eIF2B (α, β, δ), dengan cara yang menghambat fungsi katalitik
subcomplex eIF2B (γ, ε) .35 Secara bersama-sama , data ini jelas menunjukkan bahwa subunit eIF2 telah berkembang menjadi pertama dan terutama regulator inisiasi penerjemahan. Struktur sinar-X dari N-terminal dua-pertiga dari eIF2α manusia telah solved.36 Struktur ini mengandung dua domain: oligonukleotida N-terminal mengikat (OB) domain yang mirip dengan yang di IF137 dan eIF1A, 38 dan C- Terminal heliks domain.36 The Ser51 residu terletak di loop terstruktur
menghubungkan β3 dan β4 dari domain OB. The diduga RNA situs pengikatan domain OB tidak memiliki sekelompok muatan positif yang diamati pada anggota lain dari keluarga OB, yang konsisten dengan eIF2α tidak berinteraksi dengan RNA.36 interaksi Protein-protein yang melibatkan eIF2α dapat dimediasi oleh sangat lestari alur yang diamati antara OB dan heliks domains.36
eIF2B
eIF2B adalah GEF heteropentameric yang diperlukan untuk mendaur ulang tidak aktif eIF2 · PDB kompleks menjadi eIF2 · GTP (Gambar 1). eIF2B hadir dalam sel dalam jumlah yang lebih rendah dari eIF2.39 Fosforilasi eIF2 pada Ser51 dari yang α subunit disekap eIF2B, sehingga menindas terjemahan initiation.10 metode genetik dan biokimia menunjukkan bahwa eIF2B dibagi menjadi subcomplex katalitik terdiri eIF2Bγ dan eIF2Bε, dan subcomplex peraturan yang terdiri dari eIF2Bα, eIF2Bβ dan eIF2Bδ.40 katalitik subcomplex dapat melakukan reaksi pertukaran guanylate bahkan ketika eIF2α difosforilasi, kecuali subcomplex peraturan hadir untuk memodulasi activity.40 nya
complex.42
eIF2Bα, eIF2Bβ dan eIF2Bδ juga menampilkan homologi urutan satu sama lain. Ketiga subunit diperlukan untuk subcomplex peraturan untuk mengikat eIF2α dan membedakan antara terfosforilasi dan nonphosphorylated forms.40 eIF2Bβ dan eIF2Bδ sangat penting dalam ragi, tapi eIF2Bα adalah dispensable.10 Namun, tidak adanya eIF2Bα membuat eIF2B sensitif terhadap status fosforilasi dari eIF2α, baik dengan ragi dan tikus factors.40, 43 Singkatnya, eIF2B tampaknya telah berevolusi untuk berfungsi dalam dua peran: a GEF untuk mendaur ulang eIF2 · PDB, dan regulator untuk menanggapi fosforilasi eIF2α.
Menariknya, mutasi dalam lima subunit eIF2B manusia berhubungan dengan leukoencephalopathy dengan menghilang materi putih (VWM), penyakit otak yang langka biasanya mempengaruhi children.44, 45
Ini adalah pertama penyakit didokumentasikan terkait dengan mutasi pada faktor penerjemahan. Banyak mutasi missense diamati pada subunit eIF2B berbeda, tapi mutasi omong kosong selalu ditemukan heterozygous.44, 45 Data ini menunjukkan bahwa mutasi sepenuhnya menonaktifkan eIF2B yang mematikan ketika homozigot, dalam perjanjian dengan peran penting dari eIF2B.10 The saraf pusat Sistem
spesifisitas penyakit ini mengejutkan. Regulasi translasi oleh eIF2B melibatkan fosforilasi eIF2 pada subunit dalam menanggapi berbagai sinyal stres (lihat di
bawah). Dengan demikian, adalah mungkin bahwa otak lebih peka terhadap respon stres diubah dibawa oleh eIF2B bermutasi. Memang, kerusakan neurologis diamati selama atau setelah episode demam di VWM patients.44, 45
eIF3
Yang terbesar dan paling kompleks faktor inisiasi, eIF3, terdiri dari hingga 11
subunit nonidentical pada mamalia, 6 di antaranya dilestarikan dalam ragi (Tabel 1) .1,10 Dalam perjanjian dengan konstitusi yang rumit, eIF3 memiliki beberapa fungsi dalam inisiasi penerjemahan :
diperkirakan untuk mempromosikan pemisahan 40S dan 60S subunit ribosom, ia berpartisipasi dalam perekrutan kompleks terner dengan 40S subunit, dan diperlukan untuk perekrutan mRNA ke pra-inisiasi complex.1, 10
Tabel 1. eIF3 komposisi subunit. tabel 1
eIF3 komposisi subunit.
Table 1eIF3 subunit composition
Former Designation
Subunit Name Human
S. cerevisiae
eIF3a
p170
Tif32p/Rpg1p
Former Designation
Subunit Name Human
S. cerevisiae
eIF3c
p110
Nip1p
eIF3d
p66
None
eIF3e
p48
None
eIF3f
p47
None
eIF3g
p44
Tif35p
eIF3h
p40
None
eIF3i
p36
Tif34p
eIF3j
p35
Hcr1p
eIF3k
p28
None
eIF3 dan eIF1A diperkirakan meningkatkan ribosom disosiasi, tetapi mekanisme ini masih
kurang characterized.1 Penelitian terbaru menunjukkan bahwa eIF3 mencegah 60S subunit dari
mengganggu 43S pra-inisiasi complex.46 ini konsisten dengan pengamatan sebelumnya dari
eIF3 dikaitkan dengan asli 40S subunit, 47 yang menyiratkan bahwa kompleks terner mengikat
preformed 40S · eIF3 kompleks. Memang, kompleks terner terikat 40S subunit dalam ketiadaan
eIF3 adalah mudah dipisahkan oleh 60S subunits.46 demikian, eIF3 tampaknya diperlukan untuk
stabilisasi kompleks terner mengikat subunit ribosom kecil.
Studi tentang eIF3 dalam ragi baru-baru ini menjelaskan perannya dalam perekrutan terner
kompleks untuk 40S subunit. eIF3 dari S. cerevisiae terdiri dari inti dari lima subunit penting
yang dilestarikan pada mamalia (Tabel 1): eIF3a, eIF3b, eIF3c, eIF3g dan eIF3i.10, 48,49 inti
kompleks co-memurnikan dengan eIF5, 48 an interaksi yang juga telah diamati pada mamalia
cells.50 interaksi ini dimediasi oleh amino-terminus eIF3c, 30,51 dan penting untuk
menjembatani eIF3 untuk eIF2, karena keduanya secara bersamaan dapat mengikat C-terminal
motif bipartit dari eIF5 (Gambar. 3) .51 eIF1 juga dapat berinteraksi dengan eIF3c, 49,52 dan
kompleks multifaktor besar yang terdiri dari eIF1/eIF2/eIF3/eIF5 / Met-tRNAiMet diamati in
vivo dalam ketiadaan 40S subunit (Gambar 1). 51 Sejak eIF1, eIF5 dan tiga eIF2 subunit
mempromosikan ketat Agustus seleksi, 10,22,24 eIF3 berpotensi memiliki fungsi struktural
dalam pengakuan Agustus Dengan demikian, beberapa interaksi protein-protein dimediasi oleh
eIF3 tampaknya penting dalam rekrutmen atau stabil pengikatan kompleks terner untuk 40S
subunit (Gambar 3).
kompleks inisiasi dikoordinasikan oleh eIF3 dan eIF4G. eIF4G berfungsi sebagai perancah
molekul yang mengikat PABP, eIF4E, eIF4A, eIF3 dan Mnk1 (lihat teks untuk detail). eIF4G
berpartisipasi dalam perekrutan ribosom, dan menyatukan topi dan poli (A) ekor mRNA. eIF3
berinteraksi dengan eIF1, eIF5, eIF4B, eIF4G dan 40S ribosom. eIF3 memediasi pengikatan
kompleks terner dengan 40S subunit, mungkin melalui eIF5. Selain itu, interaksi eIF3 ke eIF4G
berpikir untuk bertindak sebagai jembatan antara kompleks 43S dan tutup 5 '. Subunit dari eIF3
yang berinteraksi dengan eIF4G tidak diketahui. Interaksi antara eIF3 dan eIF4G belum diamati
dalam ragi. Sebaliknya, interaksi eIF5 dengan C-terminus eIF4G (panah putus-putus) bisa
mempromosikan 43S perekrutan kompleks untuk mRNA 5 '. The bipartit motif di C-terminus
eIF5 berinteraksi dengan tiga mengulangi lisin (kotak hitam) di N-terminus eIF2β.
Sebuah homolog ragi eIF3j mamalia tidak terkait dengan dimurnikan eIF3 kompleks inti. 48 Namun, tampaknya bahwa setidaknya sebagian kecil dari eIF3j dimasukkan ke eIF3.53 Seperti rekannya mamalia nya, 54 ragi eIF3j berinteraksi dengan
eIF3a.53 Menariknya, urutan asam amino dari eIF3j mirip dengan wilayah tengah eIF3a, dan bentuk motif yang cukup untuk mengikat motif RNA pengakuan (RRM) dari eIF3b. Penghapusan eIF3j tidak mematikan, namun menyebabkan destabilisasi eIF3 dan faktor yang terkait, menunjukkan bahwa itu adalah penting dalam
menstabilkan interaksi eIF3a dengan eIF3b.53 Interaksi kedua sangat penting dalam ragi, karena penghapusan eIF3b RRM rilis eIF3a dan menginduksi pemecahan
kompleks multifaktor, dengan sisa eIF3b-eIF3g-eIF3i tidak mampu mengikat 40S subunits.53 untuk mendukung pengamatan ini, subcomplex dimurnikan dari eIF3 mengandung eIF3a, eIF3b dan eIF3c ditemukan untuk mengintegrasikan eIF3j, eIF1 dan eIF5, dan dapat menyelamatkan terjemahan in vitro hampir seefisien
dimurnikan eIF3 inti complex.55
Akhirnya, eIF3 diperlukan untuk perekrutan mRNA untuk 43S kompleks pra-inisiasi. Pada mamalia, ini diduga disebabkan oleh interaksi dari eIF3 dengan eIF4F, yang bertindak sebagai jembatan untuk mRNA melalui interaksi eIF4E dengan tutup structure.56, 57 The subunit eIF3 bertanggung jawab untuk interaksi ini belum teridentifikasi belum, dan tidak ada laporan dari interaksi yang sama dalam ragi. Namun, baru-baru ini melaporkan bahwa ragi eIF5 dapat berinteraksi dengan setengah karboksi-terminal eIF4G, dan dapat bertindak sebagai penghubung antara eIF3 dan mRNA (Gambar 3) .58 Faktor lain yang bisa terlibat dalam merekrut 43S kompleks pra-inisiasi mRNA adalah eIF4B (lihat di bawah), yang berinteraksi dengan eIF3a pada mamalia, 59 dan dengan eIF3g di S. cerevisiae.60
Rekrutmen dari 43S Kompleks mRNA Struktur Cap
tetapi juga berpartisipasi dalam proses lain seperti mRNA splicing dan nucleocytoplasmic transport.62 The rekrutmen 43S kompleks untuk mRNA
dimediasi oleh eIF4 kelompok faktor. Fungsi faktor ini telah sepenuhnya dibahas di tempat lain, 63 dan dengan demikian hanya ringkasan pemahaman kita saat ini akan disajikan di sini.
eIF4E
eIF4E berinteraksi dengan struktur topi dan, bersama-sama dengan eIF4G dan eIF4A, membentuk kompleks eIF4F (Gambar 1). eIF4E merupakan faktor penting yang dilestarikan di semua kerajaan eukariotik. Struktur ragi dan eIF4E tikus terikat m7GDP diselesaikan, 64,65 dan menunjukkan konservasi modus topi-mengikat. Memang, semua asam amino yang terlibat dalam pengakuan cap dilestarikan dari ragi ke manusia, yang sangat menunjukkan asal nenek moyang. Mengingat fakta bahwa homolog eIF4E tidak hadir dari archaea, maka akan sangat menarik untuk menjawab pertanyaan tentang asal-usul factor.66 ini Mengapa eukariota memilih untuk menggunakan struktur topi untuk memulai terjemahan? Apa keuntungan selektif dicapai dengan mengadopsi seperti modus perekrutan ribosom berbeda secara radikal?
Dalam mouse dan manusia, eIF4E difosforilasi di satu situs utama, serin 209,67 Fungsi fosforilasi ini tidak sepenuhnya dipahami. Fosforilasi eIF4E berkorelasi dengan tingkat terjemahan meningkat, tetapi masih diperdebatkan apakah fosforilasi meningkatkan afinitas pengikatan tutup eIF4E.6870 Struktur
menunjukkan bahwa Ser209 terfosforilasi bisa membentuk jembatan garam dengan Lys159, yang akan bertindak sebagai penjepit di atas lintasan yang diusulkan mRNA path.64 Namun, analisis struktural lebih baru dari eIF4E full-length kompleks
dengan m7GpppA menunjukkan bahwa jarak antara Ser209 dan Lys159 akan terlalu lama untuk membentuk garam bridge.68 Bahkan, wilayah lingkaran C-terminal dari eIF4E, yang meliputi Ser209, berinteraksi dengan kedua nukleotida mRNA. Oleh karena itu, fosforilasi Ser209 masih bisa memiliki efek pada afinitas eIF4E untuk capped mRNA.68
Meskipun secara struktural, makna biologis fosforilasi eIF4E tidak segera jelas. Studi pada mutan fosforilasi eIF4E telah menunjukkan bahwa mereka dapat
mengembalikan terjemahan serta tipe liar protein dalam in vitro assay.71 Varian ini eIF4E juga dapat menyelamatkan fenotipe mematikan penghapusan eIF4E di
yeast.71 Sebaliknya, transgenik Drosophila melanogaster mengekspresikan sebuah eIF4EI fosforilasi mutan (S251A, analog dengan S209A) menampilkan mengurangi viabilitas (kelangsungan hidup 65%) dalam mutan latar belakang eIF4EI, dengan hidup lalat memiliki retardasi pertumbuhan defects.72 Cacat ini tidak diamati ketika S251D mutan digunakan untuk meniru konstitutif residu terfosforilasi.
eIF4E difosforilasi in vivo oleh kinase Mnk1.73, 74 Dalam rangka untuk
memfosforilasi eIF4E, Mnk1 perlu direkrut ke C-terminal bagian dari eIF4G (Gambar 3) .75 Tampaknya sangat tidak mungkin bahwa seperti mekanisme yang canggih akan memiliki berkembang jika tidak memiliki tujuan. Oleh karena itu kami
menyimpulkan bahwa fosforilasi eIF4E harus memainkan peran peraturan penting in vivo, setidaknya pada eukariota lebih tinggi. Ini mungkin akan lebih dihargai
eIF4G
Dua protein terkait, eIF4GI dan eIF4GII, berfungsi sebagai protein adaptor modular yang menengahi serangkaian interaksi protein-protein berpuncak pada rekrutmen 43S kompleks untuk mRNA 5 '(Gambar 3) .63,76,77 eIF4G telah berkembang sekitar pusat inti filogenetis dilestarikan (Gambar 4) .66 inti ini terkandung dalam fragmen tengah protein dan memiliki dua domain interaksi: pertama berinteraksi dengan RNA helikase eIF4A, 78,79 dan yang kedua adalah domain yang mengikat RNA . 80,81 Selain itu, fragmen ini eIF4G mamalia juga mengandung eIF3 interaksi domain.56, 78 Struktur sinar-X dari bagian tengah eIF4GII manusia telah
diselesaikan, dan pameran domain berbentuk bulan sabit yang terdiri dari sepuluh heliks alfa disusun dalam lima mengulangi PANAS. 82 Protein mengandung
mengulangi PANAS terlibat dalam perakitan kompleks multiprotein besar, yang mungkin difasilitasi oleh luas permukaan yang besar dan dapat diakses dari domain.83
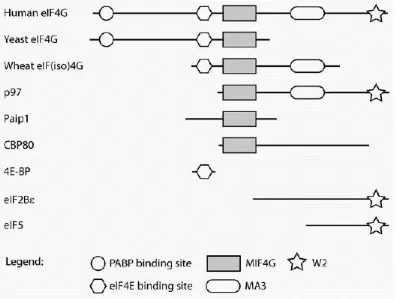
Gambar 4
domain HEAT dan merupakan inti lestari protein. The karboksi-terminal ketiga eIF4G mamalia terdiri dari sebuah domain MA3 (dinamai Mouse Apoptosis gen-3, yang diinduksi pada sel death149), dan domain W2 (dinamai setelah dua tryptophans dilestarikan). MIF4G adalah umum bagi banyak protein yang terlibat dalam penerjemahan dan omong kosong-dimediasi mRNA pembusukan. Antara lain, sebuah homolog MIF4G telah diamati dalam translasi represor p97, 150 yang translasi aktivator Paip1, 151 tutup mengikat protein nuklir CBP80, 152 dan mRNA omong kosong-dimediasi pembusukan protein 2 (NMD2/Upf2, lihat Bab 13) .66,153 The MA3 dan W2 domain tampaknya telah ditambahkan kemudian dalam evolusi, dan sebagian besar terlibat dalam peraturan interactions.84 Dalam eIF4G mamalia, domain MA3 berinteraksi dengan eIF4A, 78 dan domain W2 dengan kinase eIF4E Mnk.75 eIF5 dan eIF2Bε juga menampilkan domain W2, 93 tetapi dalam kasus ini penting bagi interaksi dengan eIF2β.
Perpanjangan inti pusat eIF4G untuk menyertakan situs eIF4E-mengikat menghasilkan domain eIF4G yang perlu dan cukup untuk terjemahan topi-dependent initiation.84 Situs 4E-mengikat tampaknya hanya diperlukan untuk menargetkan eIF4G mRNA. Memang terjemahan topi-independen dari mRNA yang mengandung unsur besi respon (IRE) dapat diarahkan oleh inti pusat eIF4G, jika domain ini menyatu dengan protein IRE-mengikat IRP-1.85, 86
Amino-terminal porsi eIF4G juga mengandung domain interaksi untuk poli (A) binding protein (PABP) .87,88 PABP adalah protein sitoplasma yang mengikat poli (A) ekor hadir pada ujung-3 messenger RNA. Interaksi dengan eIF4G menyediakan link fisik antara tutup dan poli (A) ekor (Gambar 3). Hal ini juga menjelaskan
pengamatan bahwa poli (A) ekor dapat beroperasi sebagai penambah terjemahan initiation.89, 90 Pentingnya tutup-poli (A) interaksi ekor dibahas lebih rinci dalam Bab 12.
C-terminus eIF4G telah jauh diperpanjang selama ekspansi eukaryotes.66 Sebuah domain interaksi eIF4A kedua hadir pada manusia eIF4G.78 domain ini absen dari ragi eIF4G, tetapi dapat ditemukan dalam Arabidopsis dan Drosophila eIF4G
eIF4A
eIF4A adalah anggota dari keluarga besar RNA helicases disebut MATI kotak, setelah salah satu dari mereka 8 dilestarikan motifs.94 Dalam ragi, eIF4A dikodekan oleh dua gen yang inaktivasi simultan lethal.95 Ada tiga isoform eIF4A pada mamalia, namun hanya eIF4AI dan eIF4AII tampaknya terlibat dalam terjemahan initiation.96 Menariknya, eIF4A mamalia dapat berinteraksi dengan ragi eIF4G1 in vitro, 79 bahkan jika tidak dapat melengkapi mutan ragi cacat dalam eIF4A.97 Bahkan eIF4A mamalia muncul untuk bertindak sebagai inhibitor translasi pada ragi, 79 seperti eIF4AIII menghambat terjemahan dalam mammals.96 eIF4A adalah satu-satunya faktor eIF4 memiliki homolog dalam archaea.6
eIF4A adalah ATPase bergantung RNA dan dapat bersantai kopel RNA dengan sendirinya atau, lebih efisien, sebagai bagian dari eIF4F complex.63 Kegiatan helikase intrinsik eIF4A relatif lemah, namun sangat dirangsang oleh eIF4B,
meskipun dua protein lakukan tidak muncul untuk berinteraksi directly.98 Penelitian terbaru menunjukkan bahwa eIF4A adalah helikase nonprocessive yang terbatas pada satu putaran dari unwinding.99, 100 Kehadiran eIF4B (atau eIF4H) dapat membatasi RNA re-asosiasi dan memungkinkan unwinding lagi duplexes.99, 100 Perlu dicatat bahwa fungsi eIF4A terutama sebagai bagian dari kompleks eIF4F, tetapi itu tampaknya perlu ditukar dengan eIF4A gratis untuk efek unwinding.101 Ada kemungkinan bahwa proses daur ulang yang menyampaikan processivity ke kompleks. Sebuah pertanyaan yang tak terjawab adalah bagaimana eIF4A
memfasilitasi ribosom bindingγ eIF4F umumnya diyakini menargetkan eIF4A ke mRNA, yang kemudian terurai struktur sekunder untuk memungkinkan perekrutan ribosom. Peran eIF4A bisa memanfaatkan energi dari hidrolisis ATP untuk mengatur ulang struktur RNA, atau mungkin kompleks RNA-protein, sehingga memungkinkan 40S subunit mengikat mRNA.102, 103
eIF4B
Fungsi eIF4B dalam inisiasi penerjemahan tidak sepenuhnya jelas. In vitro, eIF4B meningkatkan aktivitas helikase dari eIF4A dan eIF4F, 98 dan mempromosikan 48S kompleks assembly.84, 104 Namun, eIF4B tidak diperlukan dalam tes mengikat ribosom, 84.104 dan strain ragi dengan terganggu eIF4B gen display cacat translasi dan fenotipe pertumbuhan lambat , tetapi viable.105, 106
eIF4B homodimerizes dan berinteraksi dengan RNA melalui N-terminal RRM dan motif arginin kaya C-terminal (ARM) .59,107,108 Sejak eIF4B juga menunjukkan RNA-anil aktivitas, diusulkan bahwa itu bisa memainkan peran dalam mediasi interaksi antara rRNA dan mRNA.109 Konsisten dengan hipotesis ini, eIF4B dapat berinteraksi dengan 18S rRNA in vitro, dan sekaligus dapat mengikat dua RNA molecules.110
eIF4H merupakan faktor baru ini diidentifikasi bahwa saham homologi fungsional dan urutan dengan eIF4B, sebagian besar dengan RRM domain.111 Ini lemah mengikat RNA dan merangsang sintesis protein in vitro, serta ATPase dan helikase aktivitas eIF4A dan eIF4F.99, 100.111.112 Sebuah laporan baru-baru ini
menunjukkan bahwa virion tuan protein penutup (VHS) virus herpes simpleks berinteraksi dengan eIF4H.113 protein ini mempercepat degradasi mRNA, yang memodulasi tingkat ekspresi gen virus dan seluler. Tampaknya VHS ditargetkan sampai akhir mRNA 5 'melalui interaksi dengan eIF4H.113
Pergi ke:
Scanning dan Lokalisasi Inisiator AUG mRNA 5 'UTR
Setelah mengikat ujung 5 'dari mRNA, kompleks pra-inisiasi harus menemukan kodon Agustus Hal ini diyakini bahwa faktor ribosom dan terkait bermigrasi melalui 5 'UTR sampai Met-tRNAiMet dapat membentuk pasangan basa produktif dengan kodon inisiasi. Ini telah didefinisikan sebagai model scanning, 114,115 dan
konsisten dengan data eksperimen. Sebagai contoh, penyisipan sebuah hulu AUG biasanya menciptakan terjemahan situs awal yang baru. Selain itu, penyisipan struktur sekunder yang stabil di UTR 5 'secara dramatis mengurangi efisiensi translasi, mungkin dengan menghambat ribosom movement.116 Minimnya set faktor yang dibutuhkan untuk perakitan kompleks 48S pada kodon inisiasi telah baik didefinisikan dalam beberapa tahun terakhir (lihat di bawah ) .117,118 Namun demikian, pemindaian belum pernah diuji biokimia dan sedikit yang diketahui tentang mekanisme.
eIF1
Urutan homolog dari eIF1 telah diidentifikasi dalam archaea dan bakteri, yang menunjukkan asal kuno untuk factor.8 ini Dalam ragi, eIF1 sangat penting untuk kelangsungan hidup, 119 dan pemutaran genetik telah mengidentifikasi sejumlah mutasi yang mempengaruhi kesetiaan inisiasi kodon selection.22 ini mutasi
mengguncang salah kompleks diposisikan, atau menstabilkan yang diposisikan dengan benar.
eIF1A
eIF1A adalah homolog eukariotik dari IF1 bakteri dan archaea a-eIF1A.8 Struktur 3D eIF1A menunjukkan adanya kandungan domain OB mirip dengan IF1.37, 38 eIF1A sangat penting dalam S. cerevisiae dan tampaknya memiliki beberapa peran dalam terjemahan initiation.1 Pestova dkk melaporkan bahwa eIF1A bertindak bersinergi dengan eIF1 untuk mempromosikan perakitan kompleks 48S di inisiasi codon.117 Namun, eIF1A tanpa eIF1 hanya dapat mempromosikan pembentukan sebuah kompleks menyimpang terletak dekat dengan topi. Ini topi-proksimal kompleks bukanlah perantara translasi, dan itu tidak dapat mencapai AUG codon.117 eIF1A juga mempromosikan pengikatan terner kompleks untuk 40S terisolasi subunits.46, 121 Selain itu, eIF1A berinteraksi dengan eIF5B.122 Seiring dengan studi struktural dari 30S · IF1 kompleks, 123 ini menunjukkan bahwa eIF1A menempati situs A dari ribosom subunit kecil dan, dalam hubungannya dengan eIF5B, mengarahkan tRNA inisiator ke P site.124
Subunit ribosom 60S Bergabung
Setelah kompleks pra-inisiasi telah mencapai kodon inisiator, dasar pasangan antara Agustus dan Met-tRNAiMet antikodon memunculkan serangkaian peristiwa yang berujung pada bergabung dari subunit ribosom 60S untuk membentuk
ribosom aktif yang kompeten untuk perpanjangan. Ini melibatkan pelepasan faktor inisiasi terikat pada 40S subunit, yang membutuhkan hidrolisis GTP. Rekrutmen dari 60S subunit tidak spontan setelah rilis faktor, dan itu memerlukan faktor inisiasi tambahan.
eIF5
mirip dengan karboksi-terminus eIF2β, termasuk motif seng-jari Cys2-Cys2, dan diharapkan untuk mengadopsi fold.31 serupa
Pengamatan terbaru menunjukkan bahwa eIF5 bertindak sebagai jembatan antara eIF3 dan eIF2, dan karena itu akan berpartisipasi dalam perekrutan terner kompleks untuk 40S subunit (lihat di atas) .51 Hal ini juga telah menunjukkan bahwa ragi eIF5 dapat berinteraksi secara bersamaan dengan eIF3 dan eIF4G , dan dengan
demikian bisa mengambil bagian dalam 43S perekrutan kompleks untuk mRNA.58 Interaksi ini semua dimediasi oleh domain C-terminal eIF5, sementara wilayah mengaktifkan GTPase tampaknya berada di N-terminus.58 Menariknya, amino-terminus eIF5 saham homologi urutan dengan fragmen karboksi-terminal eIF2β.29, 31
eIF5B
eIF5B pertama kali diidentifikasi sebagai faktor terjemahan dalam ragi, dan jamur disebut IF2 (yIF2) untuk homologi kepada prokariotik IF2.126 Manusia, 127.128 Drosophila, 129 dan archaeal7 homolog juga diidentifikasi, membuat IF2/eIF5B faktor terjemahan universal dilestarikan. Gangguan gen eIF5B (FUN12) dalam ragi menyebabkan fenotipe pertumbuhan lambat berat, terkait dengan cacat dalam terjemahan initiation.126 Ia kemudian menunjukkan bahwa eIF5B memiliki fungsi analog dengan IF2 prokariotik dalam menengahi bergabung dari subunit ribosom 60S. 130 Persyaratan untuk kedua eIF2 dan eIF5B sangat menyarankan bahwa inisiasi translasi pada eukariota membutuhkan hidrolisis dua molekul GTP (Gambar 1) .125 Hal ini konsisten dengan analisis kinetik inisiasi translasi in vitro, 131 dan menawarkan kemungkinan tambahan untuk regulasi.
Struktur eIF5B telah mengungkapkan architecture.132 biasa ini terdiri dari tiga N-terminal domain (I, II, III) dihubungkan dengan panjang heliks ke domain IV. Domain Saya adalah domain G, domain II dan IV β-barrel dan domain III memiliki sebuah novel / β / sandwich fold.132 G domain dan β-barrel domain II menampilkan struktur dan pengaturan mirip dengan domain homolog di EF1A, eEF1A dan-eIF2γ.25, 132 ini menunjukkan bahwa mereka membentuk struktur inti hadir di semua GTPases terlibat dalam translation.124 GTP-bound eIF5B memfasilitasi 60S subunit
bergabung, tetapi hidrolisis GTP terjadi setelah 80S pembentukan dan diperlukan untuk pelepasan eIF5B.130 Perbandingan eIF5B · GTP dan eIF5B · PDB menunjukkan bahwa, seperti GTPases lainnya, hidrolisis GTP menginduksi konformasi saklar sederhana dalam domain G. Modifikasi kecil namun diperkuat melalui penataan ulang terkoordinasi domain II-IV, sehingga pergerakan domain IV.132 Domain IV sangat penting untuk in vivo fungsi eIF5B dan berinteraksi dengan eIF1A,
menunjukkan bahwa pelepasan eIF1A dan eIF5B dari ribosom bisa coupled.122 Pergi ke:
Peraturan Inisiasi Terjemahan
tingkatan. Namun, umumnya lebih efisien untuk mengatur jalur kompleks pada tahap inisiasi mereka, dan ini adalah di mana kontrol translasi paling sering occurs.133 Dua faktor yang diketahui memainkan peran penting dalam regulasi inisiasi terjemahan: eIF2 dan eIF4E. Kegiatan eIF2 dikendalikan oleh laju GTP daur ulang, dan dengan demikian oleh ketersediaan eIF2B.10 Fungsi eIF4E diatur oleh penggabungan menjadi eIF4F, yang dihambat oleh Protein eIF4E-Binding (4E-BPs) . 63 Kedua mekanisme ini mengalami fosforilasi peraturan dan dengan demikian dapat menyediakan sarana yang cepat dan reversibel untuk mempertahankan homeostasis seluler sebagai respons terhadap sinyal lingkungan. Kami akan
memberikan gambaran singkat tentang bagaimana aktivitas eIF2 dan eIF4E dapat diatur. Pembaca diarahkan ke kajian terbaru oleh Dever134 untuk diskusi yang lebih rinci tentang bagaimana regulasi gen spesifik dapat dicapai oleh modulasi aktivitas faktor penerjemahan umum. Sebuah mendalam review dari mekanisme kontrol translasi beberapa dapat ditemukan dalam referensi 135.
eIF2α Kinase
Sebagaimana disebutkan di atas, fosforilasi eIF2α pada Ser51 hasil dalam konversi eIF2 dari substrat inhibitor kompetitif eIF2B. Pentingnya dan fleksibilitas dari acara ini regulasi ditekankan oleh penampilan berturut-turut dari empat dikenal eIF2 • kinase melalui garis keturunan eukariotik: mamalia memperoleh double-stranded RNA-activated protein kinase (PKR), vertebrata, inhibitor kinase hemin-diatur (HRI), metazoa, para PKR seperti ER kinase (merembes), sedangkan semua eukariota memiliki kinase GCN2.10, 136.138 Keempat kinase diaktifkan oleh lingkungan stress.139 PKR merupakan bagian dari respon anti-virus, karena ekspresinya diinduksi oleh interferon dan fungsi kinase yang diaktifkan oleh double-stranded RNA.138 HRI mengatur sintesis protein dalam sel erythroid dalam menanggapi kekurangan heme, heat shock dan oksidatif dan osmotik stress.137, 140 merembes diaktifkan sebagai bagian dari dilipat respon protein, yang disebabkan oleh stres ke endoplasma reticulum.136 Akhirnya aktivitas GCN2 dapat dirangsang oleh berbagai kondisi, yang terbaik ditandai menjadi asam amino starvation.10, 141
Protein eIF4E-Binding
Kompleks m7GpppX · · eIF4E eIF4G mengarahkan 43S pra-inisiasi kompleks untuk akhir mRNA 5 '. The 4E-BPs khusus menghambat cap tergantung inisiasi terjemahan dengan mencegah interaksi eIF4E dengan eIF4G.63 Tiga 4E-BPs diidentifikasi dan ditemukan memiliki fungsi yang sama, namun 142.143 4E-BP1 telah lebih teliti ditandai. Pengikatan 4E-BP1 ke eIF4E adalah reversibel, dan diatur oleh negara fosforilasi 4E-BP1. Setelah stimulasi sel dengan serum, faktor pertumbuhan atau hormon, 4E-BP1 menjadi terfosforilasi pada serin spesifik / residu treonin dan berdisosiasi dari eIF4E untuk meringankan translasi inhibition.63, 144 Sebaliknya, menekankan seluler seperti kekurangan gizi atau infeksi virus akan menyebabkan penurunan 4E -BP1 fosforilasi dan meningkatkan afinitas untuk eIF4E.63, 67
dan mungkin lainnya kinase (s) yang belum menjadi identified.144146 Kegiatan FRAP / mTOR dimodulasi oleh ketersediaan nutrisi seperti asam amino, dan dengan konsentrasi intraselular ATP.146148 Mengingat bahwa FRAP / mTOR sinyal tidak hanya untuk 4E-BP1 tetapi untuk target translasi lainnya (eIF4B, eIF4GI, eEF2 dan S6K1), itu muncul sebagai sensor molekul mampu mengintegrasikan input yang beragam untuk memodulasi sintesis protein dalam menanggapi nutrisi dan energik status.146 sel, 148
Pergi ke: Kesimpulan
Analisis struktural dan fungsional dari faktor inisiasi translasi eukariotik
mengungkapkan bahwa mereka memiliki kemungkinan besar berevolusi untuk mengambil keuntungan dari banyak elemen struktur RNA yang khusus untuk eukariota. Terjemahan archaea menggambarkan evolusi sintesis protein dari mesin Eubacteria pada eukariota, menunjukkan karakteristik dari kedua sistem. Sebagai contoh, mRNA archaea memiliki urutan Shine-Dalgarno tapi memanfaatkan faktor homolog dengan eIF2 untuk pengiriman Met-tRNAiMet ke ribosom. Banyak faktor inisiasi terjemahan eukariotik tidak memiliki rekan-rekan di prokariota, dan harus telah berevolusi bersama dengan fitur unik mRNA eukariotik (struktur topi, poli (A) ekor). Kurangnya Archaea 5 'topi atau poli panjang (A) ekor dan, karenanya, adalah tanpa faktor yang berhubungan dengan eIF3, eIF4G atau eIF4E. Oleh karena itu dapat dipertimbangkan bahwa eIF4G telah berkembang melalui pertambahan berbagai domain interaksi sekitar inti pusat dilestarikan. Sebuah situs eIF4E mengikat bisa demikian telah ditambahkan setelah 5 'struktur cap telah berkembang, dan domain interaksi PABP setelah poli (A) ekor dikembangkan.
Dengan demikian, elemen struktur RNA tampaknya telah memainkan peran penting dalam mengarahkan evolusi dari mesin translasi eukariotik. Peningkatan
kompleksitas yang mengakibatkan bertugas untuk mengembangkan mekanisme peraturan baru untuk mengendalikan ekspresi gen, seperti penyerapan eIF4E oleh 4E-BPs atau fosforilasi eIF2α. Setelah berkembang, mekanisme pengaturan dapat dikenakan perbaikan lebih lanjut. Misalnya, mamalia telah berevolusi empat kinase eIF2α berbeda. Sebagai konsekuensi dari kemampuan regulasi meningkat, inisiasi terjemahan telah menjadi proses yang sangat dinamis yang dapat hati-hati dan cepat termodulasi dalam menanggapi perubahan lingkungan. Dengan demikian, kemampuan untuk terjemahan kontrol yang lebih baik kemungkinan telah