PERBANDINGAN HASIL SINTESIS OKSIDA PEROVSKIT La1-xSrxCoO3-
δDARI
TIGA VARIASI METODE
(Sol-Gel, Solid-State, Kopresipitasi)
Oleh :
ELYS IDAYATI
NRP. 1405 100 028
Pembimbing
Hamzah Fansuri, M.Si., Ph.D
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT TEKNOLOGI SEPULUH NOPEMBER
SURABAYA
PERBANDINGAN HASIL SINTESIS OKSIDA PEROVSKIT La1-xSrxCoO3-
δDARI
TIGA VARIASI METODE
(Sol-Gel, Solid-State, Kopresipitasi)
Elys idayati Hamzah Fansuri, M.Si, Ph.D
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember
Abstrak
Perovskit merupakan oksida logam yang memiliki struktur umum ABO3, dimana A adalah ion–ion logam
blok s, d, atau f sedangkan B merupakan ion–ion logam transisisi. Dalam penelitian ini, perovskit yang berbasis LaCoO3 disubtitusi dengan Sr pada sisi A-nya dengan variasi x = 0,1-0,5 sehingga terbentuk La1-xSrxCoO3-δ
(LSC). Perovskit LSC ini disintesis dengan 3 variasi metode yakni Sol-Gel, Solid-State dan Kopresipitasi. Penelitian ini dimulai dengan preparasi oksida perovskit La1xSrxCoO3-δ dari bahan–bahan murni. Bubuk
perovskit yang dihasilkan dari hasil preparasi dikarakterisasi dengan XRD dan dianalisa juga dengan DTA/TGA, untuk mengetahui suhu sintering minimum untuk pembakaran (kalsinasi). untuk mendukung hasil analisa XRD dilakukan juga analisa ICP dan XRF. Difraktogram sinar-X untuk perovskit LSC yang disintesis dengan metode Sol-Gel dan Solid-State, muncul puncak pada 2θ = 23 dan 33 dengan intensitas tinggi, sehingga dapat disimpulkan perovskit LSC telah terbentuk, Sedangkan pada metode Kpresipitasi belum terbentuk perovskit.
Kata kunci : perovskit, Sol-Gel, Solid-State, Kopresipitasi, LaCoO3, LSC
1. Pendahuluan
Perovskit merupakan oksida logam yang memiliki struktur umum ABO3, dimana A
adalah ion–ion logam blok s, d, atau f yang berukuran lebih besar sedangkan B merupakan ion–ion logam transisisi (Tien-Thao et al., 2008). Selama 2 dekade terakhir, oksida logam dengan struktur perovskit ini, secara konsisten direkomendasikan sebagai katalis untuk deep oxidation hidrokarbon. Hal ini dikarenakan perovskit merupakan material yang berpotensi meningkatkan hasil konversi (Pecchi,2008). Sebagaimana kita tahu oksida-oksida perovskit (ABO3) telah lama dikenal sebagai bahan yang
dapat menyerahkan ion-ion oksigen yang menyusun strukturnya (oksigen kisi) tanpa dirinya sendiri mengalami perubahan struktur yang berarti. Oksigen kisi ini dapat bereaksi dengan lebih selektif dengan pereaksi lain dibandingkan dengan oksigen dalam fasa gas. Sebagai akibatnya, oksida ini menyimpan potensi tinggi sebagai sumber oksigen dalam reaksi-reaksi oksidasi reduksi yang selektif, salah satunya adalah reaksi oksidasi gas metana menjadi syngas (campuran gas CO dan H2) serta
methanol dalam upaya merubah bahan bakar gas menjadi cair.
Diantara bermacam oksida perovskit, LaCoO3 telah banyak diteliti untuk berbagai
keperluan seperti sebagai superkonduktor, bahan elektroda, bahan magnetik, dan katalis (Junwu, 2007). Oksida perovskit berbasis LaCoO3 telah
menunjukkan aktifitas yang baik dalam proses oksidasi selektif gas metana menjadi syngas. Sebagai contohnya adalah La0.3Sr0.7Co0.8Ga0.2O
3-yang dilaporkan oleh Yaremchenko et al. (2003) serta La1-xSrxCo1-yFeyO3- yang dilaporkan oleh
Yang et al. (2005). Dilaporkan bahwa ke dua oksida berbasis LaCoO3 tersebut mampu
mengoksidasi gas metana secara selektif menjadi syngas.
LaCoO3 sebelumnya telah diteliti diakhir
tahun 2007 dalam kerangka kerjasama dengan Centre for Fuels and Energy, Curtin University of Technology di Perth, Western Australia oleh hamzah Fansuri,Ph.D. Pada penelitian tersebut ion Co3+ disubtitusi dengan ion Cu2+ untuk membentuk perovskit LaCo1-xCuxO3-δ+, dengan menggunakan
metode kopresipitasi.. Hasil penelitian tersebut menunjukkan bahwa oksida perovskit LaCoO3 dan
sebagai bahan membran oksigen transfer yang ditandai oleh kedapatbalikan proses reduksi-reoksidasi. Hasil yang sama sebenarnya juga telah dilaporkan sebelumnya oleh Fansuri dan Onggo (1998 dan 1999). Namun, pada penelitian-penelitian tersebut pokok pembahasan masih berkisar pada aktivitas katalitik untuk reaksi oksidasi dan belum ada pembahasan mengenai sifat-sifat lain yang diperlukan oleh membran transfer oksigen.
LaCoO3 yang memiliki struktur
perovskit ini memilki tingkat kestabilan struktur yang tinggi, yang menyebabkan oksida ini dapat disubtitusi parsial tanpa mengubah struktur dasarnya (Tien-Thao,2008). Untuk itu pada penelitian ini akan dicoba subtitusi Sr terhadap La pada komposisi LaCoO3 sehingga dihasilkan
oksida perovskit La1-xSrxCoO3-δ. Subtitusi
parsial ion Sr2+ pada LaCoO3, La1-xSrxCoO3-δ,
LSC memiliki konduktivitas elektronik dan ion oksigen yang tinggi pada temperatur yang tinggi pula. Sehingga berdasarkan sifat inilah, LSC sangat diminati untuk dijadikan bahan materi membran pada reaksi oksidasi parsial metana menjadi syngas (Kim, 2006).
Oksida lantanum kobaltit yang disubstitusi dengan sronsium, La1-xSrxCoO3-δ
(LSC) telah diteliti secara intensif semenjak beberapa tahun silam (Yaremchenko et al., 2003). LSC merupakan konduktor elektronik yang sangat baik dan sebagai katalis aktif pada reaksi reduksi oksigen (Ovenstone, 2008). Sifat inilah yang dapat menghantarkan LSC sebagai bahan yang sesuai untuk pembuatan reaktor membran-katalitik dalam reaksi oksidasi parsial metana menjadi syngas atau metanol. Namun demikian, penelitian tentang penggunaan oksida LSC sebagai reaktor membran katalitik masih jarang ditemui. Pada penelitian sebelumnya yang dilakukan Bialobok et al., 2007 melaporkan bahwa substitusi stronsium dapat meningkatkan stabilitas dimensi pada perovskit LSC. Namun Wei et al., 2008 melaporkan bahwa Sr2+ pada La
1-xSrxMnO3 dapat
meningkatkan reaktivitas terhadap O2 tetapi
menurunkan selektifitas terhadap syngas. Sedangkan Tsipis et al., 2005 melaporkan bahwa meskipun konsentrasi Sr2+ ini dapat menyebabkan kekosongan O2 dan kemunduran
sifat transport, namun konsentrasi Sr2+ akan
menguntungkan bila dihubungkan dengan rendahnya kestabilan dimensi dan
termodinamika pada potensial gradient O2 yang
besar yang dikehendaki pada pengoperasian reaktor membran nantinya.
Dalam beberapa literatur, disebutkan bahwa perovskit dapat disintesis melalui 3 metode yang berbeda, yakni solid-state, sol-gel, dan kopresipitasi. Selama ini beberapa peneliti hanya mensintesis perovskit dengan salah satu metode tersebut tanpa mengetahiu secara pasti mana diantara ketiga metode tersebut yang lebih baik dan optimal dalam sintesis perovskit. Maka dari itu pada penelitian kali ini, perovskit La1-xSrxCoO3-δ
akan disintesis dengan metode solid-state, sol-gel, dan kopresipitasi. Hasil sintesis dari ketiga metode tersebut dipelajari dan dibandingkan metode mana yang lebih efektif, efisien dan menghasilkan perovskit yang paling baik dalam segi kualitas maupun kuantitasnya. Untuk mendukung hasil penelitian tersebut, produk hasil sintesis dianalisis dengan XRD sehingga didapatkan informasi tentang struktur perovskit yang terbentuk, selain itu juga dilakukan DTA/TGA untuk menentukan suhu kalsinasi.
1.1 Perovskit
` Istilah perovskite memilki dua pengertian, pertama perovskite merupakan mineral partikular dengan rumus kimia CaTiO3 (disebut juga calcium titanium oxide). Mineral ini ditemukan di pegunungan Ural Rusial oleh Gustav Rose pada tahun 1839 dan kemudian dinamakan oleh mineralogist Rusia, L. A perovski (1792 - 1856). Kedua, umumnya mineral – mineral dengan struktur kristal yang sama sebagai CaTiO3 (disebut struktur perovskite) (Tejuca, 1993).
Perovskit merupakan oksida logam yang memiliki rumus umum ABO3 dengan A adalah
ion-ion logam blok s-, d-, atau f- yang berukuran lebih besar sedangkan B merupakan ion-ion logam transisi (Tien-Thao et al., 2008). Hal ini sesuai dengan pernyataan Zeng et al (2007) bahwa Oksida-oksida perovskit adalah jenis bahan dasar yang banyak digunakan sebagai membran MIEC. Oksida perovskit secara umum memiliki rumus ABO3, di mana A adalah ion-ion logam (biasanya
keseimbangan muatan dengan muatan negatif 6 yang dibawa oleh tiga ion oksigen.
Perovskit telah menjadi pilihan utama pada dekade lalu karena memiliki banyak aplikasi. Sebagai contoh, sifat oxygen-permeating dari perovskite LaSrBFeO3 (B = Co,
Ga) membuatnya seperti membran, sedangkan yang menarik pada rangkaian La 1−xCaxMnO3
adalah karena sifat magnetisnya. Perovskit secara luas juga pelajari dalam bidang katalis heterogen, terutama untuk reaksi oksidasi, seperti ketika oksidasi sempurna atau oksidasi parsial pada metana. Sebagai tambahan, dalam adisi ini, perovskite tereduksi secara parsial menghasilkan partikel logam di dalam kekosongan kation perovskit yang stabil. Sebab Co dan Fe adalah katalis logam yang secara luas disesuaikan untuk sintesis Fischer Tropsch,kita menggabungkan kedua metal tersebut dalam suatu perovskit berbasis La untuk mendapatkan efisiensi katalis untuk pembentukan light olefin dari syngas setelah reduksi parsial (Galasso,1969).
1.2 Sifat dan Kelebihan Perovskit
Kelebihan yang dimiliki oleh oksida perovskit adalah sebagian dari ion-ion oksigen penyusun strukturnya dapat dilepaskan (mengalami reduksi) tanpa dirinya mengalami perubahan struktur yang berarti. Kekosongan ion oksigen ini selanjutnya dapat diisi kembali oleh ion oksigen lain melalui reaksi reoksidasi. Dengan sifat seperti ini, oksida perovskit dapat berperan sebagai oksidator atau sumber oksigen bagi suatu reaksi oksidasi yang bersifat reversible karena dapat direoksidasi. Hal ini sesuai dengan apa yang telah dilaporkan oleh Fansuri dan Onggo (1998 dan 1999) yakni oksida perovskit LaCoO3 telah banyak diteliti
dan memiliki sifat oksidasi dan reduksi yang baik, ia dapat mempertahankan integritas strukturnya saat berada dalam keadaan tereduksi dan kembali ke keadaan asalnya setelah direoksidasi. Selain itu provskit juga memiliki tingkat kestabilan struktur yang relatif tinggi maka substitusi isomorfis dengan menggunakan kation-kation sejenis atau yang berukuran sama sangat mungkin dilakukan (Tien-Thao et al., 2006).
1.3 Struktur Perovskit
Perovskit merupakan oksida logam yang memiliki rumus umum ABO3 dengan A
adalah ion-ion logam blok s-, d-, atau f- yang
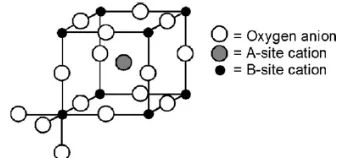
berukuran lebih besar sedangkan B merupakan ion-ion logam transisi (Tien-Thao et al., 2008). Jumlah muatan kation A dan B adalah +6, yang dapat tersusun dari kation yang bermuatan (1+5), (2+4) atau (3+3), hal tersebut agar terjadi keseimbangan muatan dengan muatan negatif 6 yang dibawa oleh tiga ion oksigen (Wold Aaron dan Kirby Dwight, 1993). Gambar kisi kristal perovskit kubus ideal ditunjukkan pada gambar 1, yang mana pada posisi A ditempati oleh kation yang berdiameter lebih besar meliputi La3+,Sr2+ dan Ca2+. Sedangkan pada posisi B ditempati oleh unsur-unsur golongan logam transisi yang memiliki ukuran lebih kecil meliputi Fe3+, Fe2+, Co3+, Co2+, Mn3+,Ru3+ dll.
Gambar 1 kisi kristal perovskit kubus ideal ABO3
(Mundscau, 2008).
Struktur perovskit yang sering diadopsi oleh bahan–bahan dengan stoikiometri ABO3,
mungkin merupakan fasa terner yang banyak dijumpai. Jangkauan oksida berstruktur perovskit ini dibatasi oleh ukuran realatif kation A dan B, bila jumlah muatan kedua kation tersebut sama dengan 6. Besar relatif ruang yang ditempati oleh kation A dan B berakibat struktur perovskit ini seperti sering dijumpai pada oksida terner ABO3
yang terbentuk dengan satu kation yang berukuran besar dan satu yang berukuran kecil. Dalam beberapa oksida yang lebih rumit posisi A dan B pada perovskit diisi oleh dua atau lebih kation. Rumus yang kelihatan rumit seperti La2MgRuO6
dapat ditulis ulang La(Mg0,5Ru0,5)O3 yang
merupakan perovskit dengan La pada posisi A dan campuran acak Ru dan Mg pada posisi B (Ismunandar, 2004).
Oksida-oksida perovskit adalah jenis bahan dasar yang banyak digunakan sebagai membran MIEC. Oksida perovskit secara umum memiliki rumus ABO3, di mana A adalah ion-ion
lantanida dan aktinida) berukuran besar sedangkan B adalah ion dari logam transisi. Total muatan ion dari kedua logam tersebut haruslah 6 agar terjadi keseimbangan muatan dengan muatan negatif 6 yang dibawa oleh tiga ion oksigen. Struktur umum oksida perovskite ditunjukkan oleh Gambar 2
Gambar 2. Struktur umum kisi oksida perovskit ABO3
(Zeng et al., 2007).
2. Eksperimen 2.1 peralatan
Peralatan yang digunakan dalam percobaan ini adalah peralatan dari gelas maupun polietilena, oven, hot plate, pengaduk (magnetik) stirrer, neraca analitik. Instrumen yang digunakan adalah Tubular Furnace, Thermogravimetri Analysis (TGA), Differential Thermal Analysis (DTA), Difraksi sinar-X (XRD) Philips X-pert, Inductive Coupled plasma (ICP), dan X-ray Fluoresece spektroskopi (XRF).
2.2 Bahan
Bahan – bahan yang digunakan dalam penelitian ini adalah lanthanum oksida (La2O3),
Cobalt (III) Nitrat (Co(NO3)3), Strontium Nitrat
(Sr(NO3)2 ), Asam Sitrat 1M, Natrium
Hidroksida (NaOH) 1M dan Metanol 1M.
2.3 Metode
2.3.1 Sintesis La1-xSrxCoO3-δ dengan Metode
Sol-Gel
Lanthanum oksida (La2O3) dilarutkan
dalan asam nitrat hingga tepat larut (dengan air sesedikit mungkin) sehingga terbentuk larutan La(NO3)3. Kemudian diambil beberapa gram
garam – garam nitrat yakni Sr(NO3)2, dan
Co(NO3)3 lalu dilarutkan dengan air hingga
larut. Selanjutnya semua larutan tersebut dicampur dan diaduk hingga homogen. Asam sitrat juga ditambahkan dengan perbandingan 1:1 (kation logam : Asam Sitrat). Untuk menghilangkan kelebihan air maka dilakukan evaporasi dengan memanaskan larutan tersebut selama beberapa ± 3 jam pada suhu 80oC hingga terbentuk gel. Selanjutnya dikeringkan dalam oven selama ± 12 jam dengan suhu 100oC. Lalu dianalisa DTA/TGA untuk mendapatkan suhu kalsinasi. Terakhir dilakukan kalsinasi pada suhu 750oCselama 2 jam.
2.3.2 Sintesis La1-xSrxCoO3-δ dengan Metode
Solid-State
Pada Metode Solid-State, perovskit La,5Sr0,5CoO3 disintesis dari oksida – oksida logam
yakni La2O3, Co3O4, dan SrO. Oksidal logam
tersebut ditimbang beberapa gram dan dicampur jadi satu. Campuran oksida tersebut dhaluskan dengan ball-milling dengan kecepatan 400 rpm selama 4 jam (Mundscau,2008) dan ditambahkan metanol sebagai zat pendispersi. Lalu dilakukan evaporasi, lalu dilakukan analisa DTA/TGA untuk menentukan suhu kalsinasi. Selanjutnya campuran tersebut dikalsinasi dalam furnace elektrik dengan suhu 750oC. Suhu dipertahankan selama 2 jam. Setelah itu material perovskit dikeluarkan dari furnace, dan didinginkan untuk digerus ulang menggunakan ball-milling.. Kemudian dimasukkan kembali kedalam furnace untuk melanjutkan kalsinasi dengan suhu yang sama selama 2 jam. Langkah ini dilakukan 3 kali dalam satu kali periode kalsinasi.
2.3.3 Sintesis La1-xSrxCoO3-δ dengan Metode
Kopresipitasi
Oksida-oksida perovskit La1-xSrxCoO3-δ
(x=0,1-0,5) disintesis menggunakan metode kopresipitasi sebagaimana dilakukan oleh Fansuri (200-). Langkah pertamanya yaitu menimbang serbuk putih La2O3 sesuai dengan komposisi
perovskit yang akan dibuat lalu melarutkannya ke dalam larutan asam nitratt 1 M. Agar reaksi berjalan sempurna maka proses pelarutan dilakukan dengan menggunakan magnetic stirrer pada suhu ruang. Setelah diperoleh larutan jernih La(NO3)2,
kemudian diuapkan sampai tersisa 1/4 larutan. Sr(NO3)2, dan Co(NO3)3 disiapkan dengan
dengan sedikit air hingga larut sempurna. Selanjutnya larutan dicampurkan dan diaduk hingga homogen dan dipanaskan sampai terbentuk kristal ungu kehitaman. Kristal yang diperoleh dikeringkan 100 oC selama beberapa jam untuk menghilangkan kandungan airnya lalu dianalisa dengan DTA-TGA untuk memperoleh suhu kalsinasi. Oksida perovskit yang dihasilkan pada tahapan ini berbentuk serbuk. Berikutnya, oksida dikalsinasi pada 750
o
C selama total waktu 10 jam kemudian dikarakterisasi dengan XRD.
2.4 Karakterisasi Oksida Perovskit La
1-xSrxCoO3-δ Hasil Sintesis
Oksida perovskit yang diperoleh akan dikaraktarisasi dengan Termogravimetri Analisis (TGA) dan Differential Thermal Analysis (DTA) setaram setsys-1750. TGA digunakan untuk mengetahui suhu kalsinasi minimum, Sedangkan untuk mengetahui struktur oksida perovskit yang terbentuk digunakan X-ray Diffraction (XRD).
3. Hasil dan Pembahasan
3.1 Sintesis dan karakterisasi Okida Perovskit La1-xSrxCoO3-δ dengan metode Sol-Gel
Pertama-tama La2O3 yang berupa
bubuk putih ditimbang beberapa gram sesuai hasil perhitungan stoikiometri dari komposisis yang diharapkan, lalu La2O3 dilarutkan dengan
HNO3, Sehingga dihasilakan larutan bening
(larutan I). Larutan II, dibuat dengan melarutkan beberapa gram Co(NO3)2.6H2O berupa kristal
berwarna merah maroon dengan aquades sesedikit mungkin hingga tepat larut. Sehingga dihasilakan larutan merah pekat. . Selanjutnya Strontiun yang berupa butiran kristal putih ditimbang dengan 5 variasi subtitusi (x = 0.1; 0,2; 0,3; 0,4 dan 0,5 ) dan dilarutkan dengan beberapa tetes aquades Ketiga larutan tersebut dicampur menjadi satu dan diaduk beberapa saat hingga homogen. Larutan yang dihasilkan berwarna merah keunguan. Selanjutnya ditambahkan asam sitrat sebagai agen pengompleks (complexing agent) dengan perbandingan 1:1 (kation logam:asam sitrat). Larutan di diamkan beberapa jam agar reaksi lebih sempurna sebelum akhirnya dievaporasi
pada suhu ± 80oC selama 2-3 jam hingga terbentuk gel. Lalu didinginkan sebelum dilanjutkan proses drying atau pengeringan sampel yang dilakukan dalam oven dengan suhu 100oC selama kurang lebih semalaman hingga didapatkan padatan kering. Padatan diambil dari cawan dan dihaluskan dengan mortar sehingga dihasilkan serbuk halus berwarna kemerahan. Suhu kalsinasi ditentukan dengan analisa DTA/TGA (Setaram Setsys-1750) terhadap serbuk yang dihasilkan. Sedangkan Pengamatan terhadap transformasi unsur/mineral dilakukan dengan analisis XRD serbuk hasil kalsinasi pada pembakaran 750oC.
-25
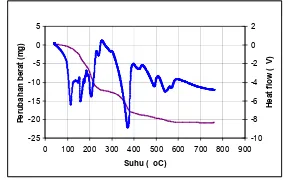
Gambar 3 Termogram oksida perovskit LSC
Kurva DTA pada gambar 3 teridentifikasi 4 puncak endotermis pada suhu 114oC, 150oC, 207oC dan 371oC. 3 dari puncak – puncak tersebut muncul disekitar suhu ± 100 – 250 oC, merupakan puncak yang berhubungan dengan hilangnya air fisis dan oksidasi senyawaan organik.. Puncak pada 114 oC menunjukkan hilangnya air permukaan, pada 150 oC menunjukkan hilangnya pelarut organik yang digunakan, sedangkan kehilangan air oklusi ditunjukkan dengan adanya puncak yang muncul dari kurva DTA pada suhu 207 oC. Indikasi dari fenomena ini ditunjukkan pula dari kurva TGA, yakni dengan adanya loss massa sebesar ∆m 1 = 33,43 %. Puncak endotermis pada T = 371 oC terjadi kehilangan berat sebesar ∆m 2 = 15,12% yang dimungkinkan oleh hilangnya gugus hidroksil dan molekul air yang terserap pada kisi – kisi kristal. Sedangkan pada T = 371 – 600 oC terjadi pengurangan berat sebesar ∆m 3 = 6,91% yang berkaitan dengan pembentukan struktur La 1-xSrxCoO3-δ.
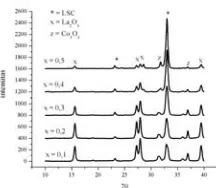
Pola hasil XRD dari oksida perovskit La 1-xSrxCoO3-δ dengan 5 variasi komposisi subtitusi Sr
Gambar 4 Difraktogram Sinar-X LSC
terbentuk dengan sempurna. Hal ini dilihat dari puncak puncak perovskit yang muncul yakni pada 2θ = 23,32 dan 33, bukan merupakan puncak-puncak utama karena intensitasnya yang lebih rendah dari puncak-puncak lain. Setelah dicocokkan dengan database, puncak– puncak tertinggi pada pola difraksi kristal perovskit La0,9Sr0,1CoO3-δ dan La0,8Sr0,2CoO3-δ
ini merupakan puncak karakteristik dari oksida lantanum (La2O3) pada 2θ = 15,6; 27,2; 27,9
dan 39,4. Selain itu muncul pula puncak– puncak karakteristik dari Oksida kobalt (Co3O4)
pada 2θ = 19; 31,3 dan 36,9. Dari sini dapat diambil suatu kesimpulan sementara bahwa kemungkinan reaksi pembentukan perovskit ini belum berjalan sempurna, yang mana disebabkan karena pada proses sintesis perovskit La0,9Sr0,1CoO3-δ dan La0,8Sr0,2CoO3-δ
ini langsung dievaporasi setelah pencampuran semua larutan prekursor tanpa didiamkan beberapa lama (ageing) agar reaksi berjalan lebih sempurna. Sedangkan untuk Perovskit La 1-xSrxCoO3-δ dengan subtitusi Sr = 0,3; 0,4 dan
0,5, struktur perovskit sudah terbentuk yakni dengan munculnya puncak pada 2θ = 23 dan 33, dengan intensitas masing – masing 11,35 dan 100 untuk La0,7Sr0,3CoO3-δ . Untuk
La0,6Sr0,4CoO3-δ muncul puncak karakteristik
perovskit pada 2θ = 23 dan 33 dengan intensitas 7,06 dan 100. Sedangkan untuk perovskit dengan komposisi La0,5Sr0,5CoO3-δ muncul
puncak pada pada 2θ = 23 dan 33 dengan intensitas 5,04 dan 100. Dari hasil XRD kelima varisi dengan metode Sol-Gel ini dapat diketahui bahwa perovskit La0,5Sr0,5CoO3-δ
paling baik diantara variasi yang lain, dimana puncak yang muncul sesuai dengan kode PDF yang ada dan intensitas puncak–puncak lain yang muncul sebagai impuriti relatif kecil. Pada gambar 4.3 dapat dilihat bahwa semakin banyak
suntitusi Sr yang ditambahkan pada komposisi perovskit LSC maka intensitas dari puncak – puncak perovskit semakin tinggi dan puncak– puncak lain (La2O3 dan Co3O4) semakin menurun
intensitasnya.
Hal ini didukung pula dengan hasil XRF pada tabel 1 menunjukkan bahwa komposisi perovskit La0,9Sr0,1CoO3-δ yang dihasilkan adalah
69% La; 5,97% Sr dan 23,97% Co. Sedangkan berdasarkan perhitungan seharusnya % komposisi untuk perovskit La0,9Sr0,1CoO3-δ ini adalah 51,945
La; 3,64% Sr dan 24,48% Co. Jika deviasi untuk instrumen XRF ini ±5%, maka % komposisi untuk Sr dan Co masih dapat diterima, tetapi banyak La dalam komposisi perovskit La0,9Sr0,1CoO3-δ, sedikit
menyimpang dari yang diharapkan, yakni kelebihan La sekitar 18% dari komposisis yang seharusnya.
Tabel 1 Komposisi yang terkandung Dalam Serbuk Sampel La0,9Sr0,1CoO3-δ dari hasil analisis XRF
UNSUR % MASSA
SENYAWA % MASSA
P 0,16 P2O5 0,3
Ca 0,36 CaO 0,43
Cr 0,32 Cr2O3 0,37
Co 23,5 Co3O4 25,8
Sr 5,97 SrO 5,68
La 69,6 La2O3 67,1
W 0,16 WO3 0,02
CuO 0,038
Dari hasil XRF diatas juga dideteksi adanya kandungan Co3O4 sebesar 25,8%, yang
sesuai dengan hasil XRD bahwa dalam perovskit yang dihasilkan terbentuk Co3O4 yang mungkin
Komposisi perovskit dengan subtitusi Sr = 0,2–0,5 ditentukan dengan ICP yang mana hasil analisisnya disajikan dalam tabel 2 Dari hasil ICP tersebut diketahui bahwa komposisi perovskit yang telah disintesis belum sesuai dengan formulasi yang hendak dicapai. Misalnya saja pada komposisi perovskit La0,8Sr0,2CoO3-δ, yang mana seharusnya dalam
komposisi tersebut mengandung La:Sr:Co = 0,8:0,2:1, tetapi pada kenyataanya hasil ICP menunjukan hal berbeda, yakni komposisi La dan Sr dalam La0,8Sr0,2CoO3-δ kurang.
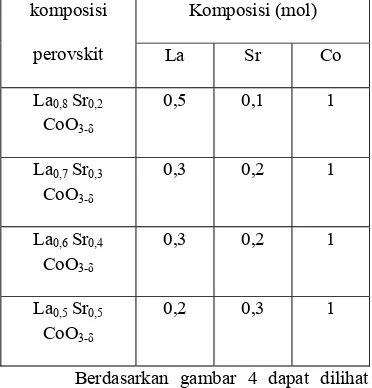
Tabel 2 perbandingan mol komposisi logam dalam oksida perovskit LSC yang disintesis
komposisi
Berdasarkan gambar 4 dapat dilihat perbedaan struktur perovskit yang telah disintesis dari 5 variasi komposisi. Dari gambar tersebut jelas terlihat bahwa perovskit dengan subtitusi Sr = 0,1 dan 0,2, belum terbentuk sempurna, sedangkan perovskit dengan komposisi La0,7Sr0,3CoO3-δ, La0,6Sr0,4CoO3-δdan
La0,5Sr0,5CoO3-δ, sudah terbentuk meski belum
murni. Hal ini data dilihat dari munculnya puncak–puncak utama yang karakteristik dengan puncak–puncak dari perovskit LSC, yakni pada 2θ = 23 dan 33. Tetapi dari pola difraksi XRD tersebut juga muncul puncak– puncak lain, dan setelah dicocokkan dengan database, diketahui bahwa puncak-puncak tersebut merupakan puncak dari La2O3 dan
Co3O4, seperti halnya pada hasil XRD dari
perovskit La0,9Sr0,1CoO3-δ dan La0,8Sr0,2CoO3-δ.
Bedanya puncak–puncak dari La2O3 dan Co3O4
pada perovskit La0,9Sr0,1CoO3-δ dan
La0,8Sr0,2CoO3-δ intensitasnya realtif tinggi
terhadap puncak perovskit, sedangkan pada hasil XRD dari perovskit dengan komposisi La0,7Sr0,3CoO3-δ, La0,6 Sr0,4CoO3-δ dan
La0,5Sr0,5CoO3-δ, puncak–puncak dari La2O3 dan
Co3O4 intensitasnya realtif lebih rendah jika
dibandingkan puncak–puncak perovskit. Ini artinya perovskit La0,7Sr0,3CoO3-δ, La0,6 Sr0,4CoO3-δ dan
La0,5Sr0,5CoO3-δsudah terbentuk tapi belum murni.
Dan dilihat dari segi kristalinitas, perovskit La0,5Sr0,5CoO3-δ lebih tinggi tingkat kristalinitasnya
dibandingkan formulasi yang lain.
3.2 Sintesis dan karakterisasi Okida Perovskit La1-x
SrxCoO3-δ dengan Metode Solid-State
Metode Solid-State adalah suatu metode sintesis yang prekursornya berasal dari padatan– padatan, dalam hal ini adalah logam – logam oksida dari komponen penyusun perovskit, yakni Lantanum oksida (La2O3) yang berupa bubuk halus
berwarna putih, kobalt okksida (Co3O4) berupa
bubuk hitam dan stronsium oksida (SrO) yang berupa serbuk berwarna ungu. Kobalt oksida dan strontium oksida ini di buat sendiri dengan memanaskan garam nitrat pada suhu tinggi.
Sitesis oksida perovskit La1-xSrxCoO3-δ
diawali dengan menimbang La2O3, Co3O4 dan SrO
beberapa gram sesuai hasil perhitungan stoikiometri dari komposisi yang diaharapkan. Selanjutnya. Bahan–bahan tersebut di campur dan digerus dengan mortar dimana sebelumnya telah ditambahkan beberapa tetes metanol ke dalam campuran. Metanol ini berfungsi sebagai zat pendispersi agar semua bahan mudah tercampur dan mudah bereaksi karena reaksi padat–padat ini umumnya akan berjalan lebih lambat jika dibandingkan dengan reaksi fasa cair. Metanol disini dipilih sebagai zat pendispersi karena metanol sebagaimana kita tahu merupakan bahan organik yang bersifat volatil, jadi dengan penambahan metanol nantinya akan memudahkan untuk pemurnian produk yang hendak disintesis.
dengan tujuan seperti yang disebutkan sebelumnya pada sintesis dengan metode Sol-Gel. Ada sedikit perbedaan pada metode Solid-State jika dibandingkan dengan metode lainnya (Sol-Gel dan Kopresipitasi), yakni dalam hal kalsinasi. Pada metode ini kalsinasi dilakukan sebanyak 3 kali dengan kurun waktu dan suhu yang sama ( 750oC selama 2 jam). Hal ini dikarenakan reaksi yang terjadi dalam metode Solid-State ini adalah reaksi antara padat dan padat, yang mana secara teoritis reaksi antara padatan ini akan berjalan lebih lambat. Selain itu dalam metode ini juga tidak dilakukan perlakuan–perlakuan khusus atau penambahan zat–zat lain sebagai agen pembantu reaksi seperti pada metode yang lain yakni dilakukan penambahan agen pengompleks, evaporasi dan drying begitu pula pada metode kopresiptasi yakni perlu penambahan agen pengendap, pengaturan pH dan lain–lain. Metode ini cenderung lebih praktis, dan mengahsilkan produk yang lebih melimpah dibanding Sol-Gel dan Kopresipitasi tapi dari segi efisiensi waktu Sol-Gel dan Kopresipitasi lebih unggul.
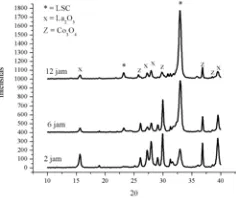
Pada metode Solid-State, reaksi pembentukan perovskit sangat dipengaruhi oleh suhu dan lamanya waktu kalsinasi.Hal ini dapat ditunjukkan dari hasil XRD dari perovakit La0,9Sr0,1CoO3-δ pada kalsinasi 2 jam pertama,
pada perovskit dengan subtitusi Sr = 0,1, intensitas puncak dari puncak karakteristik perovskit yakni pada 2θ = 23 dan 33 relatif rendah dibandingkan puncak–puncak lain dan muncul puncak lain yakni puncak dari La2O3
dan Co3O4. Namun setelah dikalsinasi selama 6
jam, hasil XRD menunjukkan perubahan dimana intensitas dari puncak–puncak impurities lebih rendah dari sebelumnya dan puncak karakteristik perovskit sedikit meningkat yang mana semula pada 2θ = 33 intensitasnya 21,73 menjadi 27,51. Sedangkan setelah kalsinasi selama 12 jam, pola XRD menunjukkan perubahan yang signifikan dimana intensitas dari puncak perovskit semakin tinggi yakni pada 2θ = 23 intensitasnya mencapai 10,51 sedang sebelumnya hanya 2,7. Sedangkan pada 2θ = 33 intensitasnya 90,71 mendekati 100 sesuai dengan standar PDF 36-1392. Akan tetapi perovskit yang terbentuk ini masih belum
murni, ini dapat dilihat dari masih banyaknya puncak–puncak lain (lihat gambar 5).
2θ
Gambar 5 Difraktogram Sinar-X perovskit La 1-xSrxCoO3-δ dengan subtitusi x = 0,1 pada kalsinasi
2 jam, 6 jam dan 12 jam
Hal yang serupa juga di tunjukkan dari hasil XRD pada gambar 6 dari perovskit La0,8Sr0,2CoO3-δ.. Pada kalsinasi pertama belum
terbentuk perovskit, ini ditunjukkan dengan tidak munculnya puncak pada 2θ = 23. Sedangkan pada 2θ = 33, muncul puncak tapi intensitasnya masih relatif rendah. Setelah dikalsinasi selama 6 jam, pola XRD menunjukkan perubahan positif, dimana pada sudut 2θ = 23 telah muncul puncak kecil dengan intensitas 8,09. Sedangkan pada 2θ = 32,95 puncak perovskit muncul dengan intensitas 100. Untuk kalsinasi selama 12 jam, hasil XRD menunjukkan bahwa perovskit sudah terbentuk yang ditunjukkan dengan munculnya puncak – puncak pada 2θ = 23 dan 32,9, dengan intensitas 8,98 dan 100. Puncak – ang cukup tinggi, setelah 12 jam kalsinasi intensitasnya relatif menurun dan hanya berupa puncak – puncak kecil dengan intensitas ± 15.
Gambar 6 Difraktogarm sinar-X La0,8Sr0,2CoO3-δsetelah
Hasil XRD dari La0,7Sr0,3CoO3-δ. Juga
menunjukkan pola yang hampir sama (lihat gambar7. Dari gambar 7 dapat diinformasikan bahwa pada pembakaran awal selama 2 jam, masih belum terbentuk struktur perovskit hal ini ditunjukkan dengan tidak munculnya puncak kecil pada 2θ = 23 dan 33. Puncak – puncak yang muncul adalah puncak dari La2O3 dan
Co3O4 yang merupakan prekursor awal dari
sintesis peroskit ini. Ini artinya terjadi reaksi namun belum sempurna. Hal ini dimungkinkan karena pembkaran yang dilakukan pada sampel masih kurang.
2θ
Gambar 7 Pola XRD perovskit La0,7Sr0,3CoO3-δ
setelah kalsinasi 2 jam, 6 jam dan 12 jam
Setelah dilanjutkan kalsinasi selama 6 jam, pola XRD menunjukkan perubahan positif yakni semakin meningkatnya intensitas dari puncak – puncak karakteristik perovskit pada 2θ = 33 sebesar 100, sedangkan puncak pada 2θ = 23 muncul puncak meskipun masih sangat kecil. Dan setelah dilakukan pemanasan selama 12 jam, intensitas semakin meningkat yakni 5,26 pada 2θ = 23 dan 100 pada 2θ = 33. Selain itu puncak – puncak lain yang teridentifikasiDari semua uaraian diatas dapat disimpulkan bahwa untuk metode Solid-State reaksi sangat dipengaruhi suhu dan waktu kalsinasi
Dari ketiga variasi yang dihasilkan dengan metode Solid-State dengan perlakuan dan kondisi yang sama ini, didapatkan suatu informasi bahwa perovskit dengan subtitusi Sr = 0,1 memiliki tingkat kemurnian yang lebih tinggi dibandingkan dengan komposisi lainya yakni La0,7Sr0,3CoO3-δ dan La0,9Sr0,1CoO3-δ .
Gambar 8 Pola XRD dari 3 variasi komposisi perovskit setelah 12 jam kalsinasi dengan metode
Solid-State.
3.3 Sintesis dan Karakterisasi Oksida Perovskit dengan Metode Kopresipitasi
Metode presipitasi merupakan
pengendapan suatu padatan dari larutan. Umumnya pembuatan material dengan metode kopresipitasi ini menggunakan agen pengendap yaitu berupa basa untuk mempercepat proses pengendapan. Basa yang digunakan biasanya alkali hidroksida atau karbonat karena kelarutan logam transisi pada garam alkali tersebut sangat rendah, sehingga dapat dicapai penjenuhan yang akan menghasilkan endapan dengan ukuran partikel yang sangat kecil. Selain itu mudah terdekomposisi dengan pemanasan membentuk oksida tanpa menghasilkan racun bagi katalis sehingga aman bagi lingkungan (Perego, 1997). Akan tetapi pada penelitian oksida perovskit La1-xSrxCoO3-δ (x = 0,1-0,5) disintesis
menggunakan metode kopresipitasi tanpa penambahan presipitant agent melainkan dengan cara penguapan sebagaimana dilakukan oleh Fansuri (200-).
Hal ini dilakukan karena setelah dilakukan prosedur dengan menggunakan agen pengendap NaOH, endapan yang diperoleh sangat sedikit meskipun pH larutan telah diturunkan sampai kondisi yang diharapkan yakni pada pH 9-10. Langkah-langkah dalam penelitian ini hampir mirip dengan metode Sol-Gel hanya saja dalam metode Sol-Gel perlu ditambahkan agen pengompleks untuk membentuk gel. Langkah pertamanya yaitu menimbang serbuk putih La2O3 sesuai dengan
magnetic stirrer pada suhu ruang. Setelah diperoleh larutan jernih La(NO3)2, kemudian
diuapkan sampai tersisa 1/4 larutan. Sr(NO3)2,
dan Co(NO3)3 disiapkan dengan perbandingan
mol sesuai komposisi yang diinginkan kemudian masing–masing dilarutkan dengan sedikit air hingga larut sempurna. Selanjutnya larutan dicampurkan dan diaduk hingga homogen dan dipanaskan sampai terbentuk kristal ungu kehitaman. Kristal yang diperoleh dikeringkan 100 oC selama beberapa jam untuk menghilangkan kandungan airnya lalu dianalisa dengan DTA-TGA untuk memperoleh suhu kalsinasi Oksida perovskit yang dihasilkan pada tahapan ini berbentuk serbuk. Berikutnya, oksida dikalsinasi pada 750 oC selama total waktu 10 jam kemudian dikarakterisasi dengan XRD.
Difraktogram sinar-X dari perovskit LSC dengan subtitusi Sr = 0,1-0,5, ditunjukan pada Gambar 9, dimana a) La0,9Sr0,1CoO3-δ, b)
La0,8Sr0,2CoO3-δ, c) La0,7Sr0,3CoO3-δ, d) La0,6
Sr0,4CoO3-δ, dan e) La0,5Sr0,5CoO3-δ. Dari kelima
variasi tersebut, hasil XRD menunjukkan pola yang serupa, hanya satu komposisi perovskit yang menunjukkan pola berbeda yakni La0,8Sr0,2CoO3-δ, dimana muncul puncak pada 2θ
= 30, dan puncak tersebut disinyalir puncak dari La2O3. Perovskit yang disintesis dengan metode
kopresipitasi ini, belum sesuai dengan yang database pada PDF win, meski telah muncul puncak pada puncak karakteristik perovskit yakni pada 2θ = 23 dan 33, tetapi intensitasnya tidak sesuai.
Gambar 9 Difraktogram sinar-X La1-xSrxCoO3-δ
dengan subtitusi x = 0,1; 0,2; 0,3; 0,4 dan 0,5
4.4 Perbandingan Hasil Síntesis Okida Perovskit LSC dengan 3 Variasi Metode (Sol-Gel, Solid-State dan Kopresipitasi).
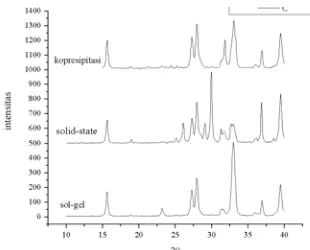
Penelitian ini bertujuan untuk mempelajari sintesis perovskit dengan metode Sol-Gel, Solid-State dan Kopresipitasi, serta membandingkan hasil sintesisnya. Sintesis perovskit dengan metode Sol-Gel menghasilkan perovskit yang relatif lebih baik dibandingkan Kopresipitasi dan Solid-State. Hal ini dapat dilihat dari hasil XRD pada Gambar 10. Pada gambar tersebut dibandingkan difraktogram perovskit LSC dengan subtitusi Sr = 0,7 yang disintesis dengan 3 variasi metode dengan kondisi kalsinasi yang sama yakni pada suhu 750oC dengan laju pemanasan 3oC/menit selama 2 jam.
Gambar 10 Difraktogram perovskit La0,7Sr0,3CoO3-δ
dari tiga metode yang berbeda
Puncak karakteristik perovskit seharusnya muncul pada 2θ = 23 dan 33. Namun pada difraktogram sinar-X perovskit La0,7Sr0,3CoO3-δ
puncak-puncak lain yakni La2O3 dan Co3O4, tetapi
intensitasnya relatif kecil (lihat Gambar 11). Sintesis dengan metode Solid-State ini membutuhkan waktu kalsinasi yang lebih lama dibandingkan metode lain. Jika ditinjau dari segi kristalinitas, perovskit yang disintesis dengan metode Solid-State kristalinitasnya lebih tinggi
Gambar 11 Hasil XRD perovskit La0,7Sr0,3CoO3-δ dengan metode Solid-State (12
jam kalsinasi)
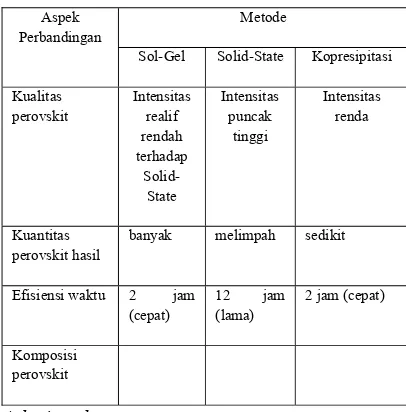
Tabel 3. Perbandingan metode Sol-Gel, Solid-State dan Kopresipitasi
Aspek Perbandingan
Metode
Sol-Gel Solid-State Kopresipitasi
Kualitas
banyak melimpah sedikit
Efisiensi waktu 2 jam (cepat)
Berdasarkan hasil penelitian, diperoleh kesimpulan bahwa sintesis perovskit LSC dengan metode Sol-Gel dan Solid-State telah terbentuk, yang ditunjukkan dengan munculnya puncak pada 2θ = 23 dan 33, tetapi masih terbentuk senyawa lain yakni La2O3 dan Co3O4.
Sedangkan perovskit yang disintesis dengan
metode Kopresipitasi belum terbentuk struktur perovskit. Sintesis dengan metode Sol-Gel akan menghasilkan produk banyak dalam waktu yang realif cepat dan hasil kualitas perovskit yang cukup baik. Sedangkan metode Solid-State menghasilkan produk yang melimpah dan kristalinitas perovskit tinggi tetapi membutuhkan waktu sintesis yang lebh lama
DAFTAR PUSTAKA
Białobok, Beata, J. Trawczynski, W. Mista & M. Zawadzki, (2007), Ethanol combustion over
strontium and cerium-doped LaCoO3
catalysts, Applied Catalysis B: Environmental,
vol 72, pp. 395-403
Chorkendorff, I and Niemantsverdriet, J.W., (2003), Concepts of Modern Catalysis and Kinetics, Wiley-VHC, Winheim
Daintith, John, (1990), Kamus Lengkap Kimia, Erlangga, Jakarta
Doyle, G. (1981), The Reductive Carbonylation of Methanol with Homogeneous Iron-Cobalt, Catalysts. Journal of Molecular Catalysis, 13, 237-247.
Fansuri, H., (2008), Pengembangan Bahan Penghantar Ion Oksigen Berbasis Oksida Perovskit
LaCoO3 Sebagai Membran Katalis Pada
Reaksi Oksidasi Parsial Gas Metana, FMIPA-ITS, Surabaya
Fogler, H. S., (1999), Element of Chemical Reaction Engineering, Third edition., Prentice-Hall Inc., New Jersey
Ismunandar, (2004), Padatan Oksida Logam: Struktur Sintesis dan Sifat – Sifatnya, FMIPA-ITB, Bandung
Kasmayadi, W dan Murwani, I, (2007), Analisis Termal Dan Studi Transformasi Fase Sistem Badan Keramik Lempung Batu
Kumbung Lombok, Feldspar, Akta Kimindo
Vol. 3 No. 1 Oktober 2007 : 43 - 48
Kim, Jung-Min, Gab-Jin Hwang, Sang-Ho Lee, Chu-Sik Park, Jong-Won Kim & Young-Ho Kim, (2006), Properties of oxygen permeation and partial oxidation of methane in
La0.6Sr0.4CoO3-δ(LSC)-La0.7Sr0.3Ga0.6Fe0.4O
3-δ(LSGF) membrane, Journal of Membrane
Science, vol. 250, pp. 11-16
Martinez ,A.,Arias,Rida,K.et al., (2008), Effect of Strontium and Cerium Doping on Struktural
Characteristics and Activity for C3H6
Combustion of Perovskit LaCrO3 Prepared
Mundscau, M.V.,Cristtopher G.B., David A.G.Jr.,(2008), Diesel Fuel Reforming Using Catalytic Membran Reaktor , Catalysis Today, 136 (2008) 190 - 205
Pecchi, Gina, (2008), Structural Magnetic and Catalytic Properties of Perovskit-type
Mixed Oxides LaMn1-yCoyO3 (y = 0,0;
0,1; 0,3; 0,5; 0,7; 0,9; 1), Journal of Molecular Catalysis A: Chemical, 282, 158 – 166
Perego, C., Villa, P., (1997), Catalyst Preparation Methods, Catalysis Today, 34
Rivas,M.E., Fierro,J.L.G.,Goldwasser,M.R.,Griboval-Constant,A., (2008), H2 Production From
CH4 Decomposition: Regeneration
Capability and Performance of Nicel and Rhodium Oxide Catalysts, Jurnal of Power Sources 184 (2008) 265 - 275
Tejuca, Luis G., (1993), Properties and applications of perovskite-type oxides, Dekker, New York, 382. ISBN 0-8247-8786-2.
Tsipis, E.V., M.V. Patrakeev, V.V. Kharton, A.A. Yaremchenko, G.C. Mather, A.L. Shaula, I.A. Leonidov, V.L. Kozhevnikov & J.R. Frade, (2005), Transport properties and thermal expansion of Ti-substituted La1−xSrxFeO3−δ (x=0.5-0.7), Solid State
Sciences, vol. 7, pp. 355-365
Wang, H., Cong, Y., Zhu, X. & Yang, W. (2003), Oxidative Dehydrogenation of Propane in a Dense Tubular Membrane Reactor., React. Kinet. Catal. Lett., 79, 351-356
Wei, H.J., Y. Cao, W.J. Ji & C.T. Au, (2008), Lattice
oxygen of La1-xSrxMO3 (M=Mn, Ni) and
LaMnO3-δFβ perovskite oxides for the
partial oxidation of methane to synthesis
gas, Catalysis Communications, vol. 9, pp.
2509–2514
West, Anthony R. (1984), Solid State Chemistry and Its Applications, John Willey &Sons, New York.
Yaremchenko, A. A., Valente, A. A., Kharton, V. V., Tsipis, E. V., Frade, J. R., Naumovich, E. N., Rocha, J. & Marques, F. M. B. (2003), Oxidation of Dry Methane on the Surface of Oxygen Ion-conducting Membranes, Catalysis Letters, 91, 169-174.
Zeng, P., Z. Chen, W. Zhou, H. Gu, Z. Shao & S. Liu, (2007), Re-evaluation of
Ba0.5Sr0.5Co0.8Fe0.2O3-δ perovskite as