BAB III
ANALISIS KUALITATIF KARBOHIDRAT
TUJUAN :
Mengetahui prinsip dasar uji kualitatif karbohidrat
Mengetahui perbedaan prinsip dari masing-masing metode A. Pre-lab
1. Sebutkan dan jelaskan jenis-jenis karbohidrat dan beri contoh masing-masing 3 ?
Monosakarida merupakan suatu molekul yang terdiri dari lima atau enam atom C, contoh: glukosa, fruktosa, dan galaktosa
Disakarida merupakan ikatan yang terdiri dari 2 monosakarida, contoh: sukrosa, laktosa, dan maltosa
Oligosakarida adalah polimer dari 2-10 monosakarida, contoh: rafinosa, stakiosa, dan verbaskosa
Gula alkohol adalah bentuk alkohol dari monosakarida, contoh: sorbitol, manitol, dan dulsitol
Polisakarida adalah polimer yang terdiri lebih dari 10 monomer monosakarida, contoh: pati, dekstrin, dan glikogen
Serat merupakan polisakarida non pati, terdiri dari serat yang larut air dan tidak larut air, contoh: lignin, hemiselulosa (tidak larut air), dan pektin (larut air) (Almatsier, 2009).
2. Bagaimana prinsip analisis karbohidrat menggunakan uji Molisch?
Larutan contoh ditambahkan pereaksi α-naftol 10% dan dikocok. Secara hati-hati tambahkan H2SO4 pekat sehingga timbul dua lapisan cairan dalam tabung reaksi di mana larutan contoh akan berada di lapisan atas. Cincin berwarna merah ungu pada batas kedua cairan menunjukkan adanya karbohidrat dalam larutan contoh (Winarno, 2008).
3. Bagaimanakah reaksi yang terjadi antara larutan yodium dengan sampel?
Reaksi yodium akan menimbulkan warna biru yang menandakan adanya pati dalam sampel, warna merah menunjukkan adanya glikogen dan eritrodekstrin, warna coklat menandakan adanya dekstrin, sedangkan monosakarida dan disakarida tidak berwarna (Winarno, 2008) 4.Apa fungsi dari uji benedict dan sampel apa saja yang bereaksi positif terhadap reagen benedict?
bereaksi positif adalah glukosa dan fruktosa. Ada tidaknya sifat pereduksi dari suatu molekul gula ditentukan oleh ada tidaknya gugus hidroksil bebas yang reaktif. Pada glukosa terletak pada karbon nomor 1 (anomerik) sedangkan fruktosa terletak pada karbon nomor 2. Sukrosa tidak mempunyai gugus hidroksil bebas yang reaktif karena keduanya sudah saling terikat (Winarno, 2008).
5.Jelaskan prinsip dari uji barfoed!
Sampel direaksikan dengan kupri asetat dan asam asetat kemudian dilakukan pemanasan dengan air mendidih selama 1 menit. Timbulnya endapan berwarna merah oranye menandakan adanya monosakarida di dalam sampel (Winarno, 2008).
B. Tinjauan Pustaka 1. Reagen molisch
Reagen molisch adalah larutan alfa-naftol dalam alkohol. Fungsi α-naftol sebagai pereaksi agar terbentuknya cincin ungu sedangkan alkohol berfungsi untuk melindungi agar karbohidrat tidak rusak ketika H2SO4 dimasukkan ke dalam sampel . Terjadi reaksi dehidrasi karbohidrat oleh asam sulfat dan alfa naftol yang akan membentuk senyawa kompleks berwarna ungu. Di mana asam sulfat berfungsi sebagai pembentukan senyawa furfural dan sebagai agen kondensasi (Nur MN, 2014).
2. H2SO4
H2SO4 atau asam sulfat merupakan asam mineral (anorganik) yang kuat. Zat ini larut dalam air pada semua perbandingan. Asam sulfat mempunyai banyak kegunaan, termasuk dalam kebanyakan reaksi kimia. Kegunaan utama termasuk pemrosesan sintesis kimia, pemrosesan air limbah dan pengilangan minyak (Gimantoro H, 2008).
3. Larutan yodium
Larutan yodium berisi Larutan 0,127 g I2 dalam 100 mL air yang mengandung 3 g KI. Larutan ini berfungsi sebagai larutan yang diadsorpsi oleh larutan polisakarida dan akan memberikan warna. Warna yang dihasilkan akan bergantung pada jenis polisakarida pengadsorpsi (Haris H, 2014).
4. Reagen barfoed
Reagen Barfoed merupakan asam lemah dan hanya dapat mereduksi monosakarida. Reagen barfoed berisi larutan kupri asetat dalam air dan asam asetat glasial. Reagen ini harus selalu dalam keadaan segar (Haris H, 2014).
5. Reagen benedict
reduksi ion kupri dalam suasana basa perlu ditambahkan zat pengompleks yang berfungsi untuk mencegah pengendapan CuCO3 dalam larutan natrium karbonat (Haris H, 2014). 6. Glukosa
Glukosa merupakan salah satu monosakarida dengan enam atom C (heksosa). Glukosa dapat disebut juga sebagai gula anggur. Glukosa memiliki rumus kimia C6H12O6. Glukosa bersifat simetrik atau mengikat keempat gugus yang berlainan, yaitu pada posisi nomor 2, 3, 4, dan 5 (Winarno, 2008). Berikut adalah gambar stuktur glukosa (Nur MN, 2014):
Fruktosa dinamakan juga levulosa atau gula buah. Fruktosa merupakan gula yang paling manis. Fruktosa memiliki rumus kimia seperti glukosa namun berbeda strukturnya. Gula ini terutama terdapat dalam madu bersama glukosa, dalam buah, nektar bunga, dan juga dalam sayur (Almatsier, 2009). Berikut adalah gambar stuktur fruktosa (Nur MN, 2014):
Sukrosa dinamakan juga gula tebu atau gula bit. Bila dicernakan atau dihidrolisis sukrosa pecah menjadi satu unit glukosa dan fruktosa. Pada pembuatan sirup sebagian sukrosa akan terurai menjadi glukosa dan fruktosa (Almatsier, 2009). Berikut adalah gambar stuktur sukrosa (Nur MN, 2014):
Gambar 3. Struktur Sukrosa 9. Maltosa
biji-bijian berkecambah dan di dalam usus manusia pada pencernaan pati. Bila dicernakan atau dihidrolisis, maltosa pecah menjadi dua unit glukosa (Almatsier, 2009). Berikut adalah gambar stuktur maltosa (Nur MN, 2014):
O
Pati adalah karbohidrat polimer glukosa,yang terdiri atas amilosa dan amilopektin. Amilosa merupakan bagian polimer linier dengan ikatan α-(1−> 4) unit glukosa. Amilopektin merupakan polimer α-(1−> 4) unit glukosa dengan rantai samping α-(1−> 6) unit glukosa (Herawati H, 2009). Berikut adalah struktur pati (Herawati H, 2009):
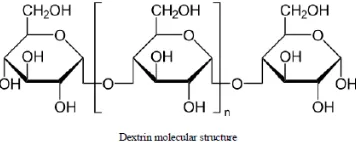
Gambar 5. Struktur Pati 11. Dekstrin
Dekstrin adalah glukosa yang terdiri dari polimer sakarida dengan ikatan α-1,4
D-glucose, memiliki rumus umum yang sama dengan pati tetapi lebih kecil dan sedikit kompleks. Polisakarida ini diproduksi dengan hidrolisa pati, yang dapat dicapai dengan bantuan enzim (Pudiastuti L et al, 2013). Berikut adalah gambar stuktur dekstrin (Loto, 2013):
Gambar 6. Struktur Dekstrin
2. Uji Yodium
3. Uji Barfoed
4. Uji Benedict
a. Tuliskan data hasil uji Molisch
Senyawa Hasil Uji Molisch Keterangan H2SO4
Glukosa + Endapan merah Cincin ungu
Sukrosa + Endapan merah Ungu pekat
Pati + Endapan merah Ungu pekat
b. Bahas dan bandingkan data-data hasil uji Molisch dari beberapa sampel dalam percobaan ini!
Prinsip
Larutan contoh ditambahkan pereaksi α-naftol 10% dan dikocok. Secara hati-hati tambahkan H2SO4 pekat sehingga timbul dua lapisan cairan dalam tabung reaksi di mana larutan contoh akan berada di lapisan atas. Cincin berwarna merah ungu pada batas kedua cairan menunjukkan adanya karbohidrat dalam larutan contoh (Winarno, 2008).
Reaksi
Sampel direaksikan dengan reagen molisch dan H2SO4 pekat. Pada saat direaksikan dengan reagen molisch, terbentuk endapan merah. Setelah direaksikan dengan H2SO4 pekat, warna sampel berubah menjadi ungu pekat. Berikut adalah reaksi pembentukan warna ungu pekat (Gambar 7) (Maligan, 2014):
Gambar 7. Reaksi pembentukan warna ungu pekat Mekanisme uji
senyawa furfural. Penggunaan asam sulfat ini dapat digantikan misalkan dengan HCl atau HI asalkan bersifat sama-sama pekat (Pramafisi, 2014).
Apabila asam pekat ditambahkan pada larutan sampel secara hati-hati melalui dinding tabung reaksi, akan terbentuk dua lapisan zat cair. Pada batas kedua larutan cair ini akan terbentuk cincin ungu karena kondensasi furfural dengan α-naftol. Jika langsung ke larutan maka akan merusak langsung karbohidrat dan yang terbentuk adalah warna ungu pada larutan. Selain itu, pemberian melalui dinding akan memberikan bentuk cincin yang sempurna. cincin ungu yang sudah terbentuk harus dihindari dari guncangan karena bila terkena guncangan maka partikel alcohol yang melindungi karbohidrat akan terurai dan asam pekat akan masuk lalu merusak karbohidrat yang ada. Pemanasan tidak dilakukan karena asam pekat sudah bersifat panas (eksoterm) sehingga apabila dilakukan pemanasan, reaksi kondensasi cincin ungu akan terlalu cepat sehingga tak dapat terlihat dan karbohidrat akan rusak terlebih dahulu (Pramafisi, 2014).
Analisis prosedur
Sebelum melakukan percobaan, alat dan bahan disiapkan. Alat yang dibutuhkan yaitu tabung reaksi, rak tabung reaksi, pipet ukur 1 ml, labu hisap, bulb, dan pipet tetes. Bahan yang dibutuhkan yaitu sampel (glukosa, sukrosa, dan pati), reagen molisch (5 % alpha-naftol dalam 95% alkohol), larutan H2SO4 pekat. Langkah pertama yang dilakukan adalah memasukkan sampel sebanyak 1 ml ke dalam tabung reaksi. Kemudian tambahkan 2 tetes reagen molisch dan dilakukan pengocokan. Setelah pengocokan akan terbentuk endapan merah. Lalu tambahkan larutan H2SO4 pekat di ruang asam. Pada saat menambahkan H2SO4 diharuskan memakai sarung tangan lateks dan masker dengan catrigde karena sampel akan mengalami pemanasan dan memiliki bau yang menyengat. Hal ini dilakukan untuk mengikis alkohol pada alpha-naftol agar bereaksi dengan sampel dan membentuk cincin berwarna ungu.
Analisis hasil
penambahan H2SO4, dilakukan pengocokan pada sampel. Sukrosa merupakan golongan disakarida yang terdiri dari glukosa dan fruktosa. Sampel pati juga menunjukkan hasil yang positif yaitu terbentuk senyawa kompleks berwarna ungu. Pati adalah golongan polisakarida. Menurut Winarno (2008) pati memiliki ikatan alpha-glikosidik diantara homopolimer glukosa. Hal tersebut menandakan pati mengandung karbohidrat di dalamnya.
2. Uji Yodium
a. Tuliskan data hasil uji Yodium!
Senyawa Hasil Uji Keterangan
Dekstrin - Coklat pekat
Maltosa - Tidak berubah warna
Glukosa - Tidak berubah warna
Pati + Biru kehitaman
b. Bahas dan bandingkan data-data hasil uji Yodium dari beberapa sampel dalam percobaan ini!
Prinsip
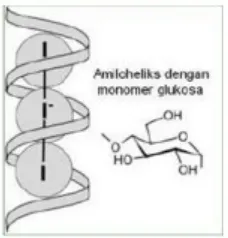
Reagen yang digunakan adalah larutan I2 dalam KI (kalium iodida). KI akan diubah menjadi triiodida. Pada sampel yang mengandung pati maka, triiodida akan masuk ke dalam struktur heliks pati sehingga terjadi penyerapan dan memberikan warna. Warna yang dihasilkan akan bergantung pada jenis polisakarida pengadsorpsi. Pada pati akan terbentuk warna biru kehitaman (Winarno, 2008).
Reaksi
Reaksi penggabungan triiodida dengan struktur heliks pada pati dapat dilihat pada Gambar 8 (Bestari, 2012).
Gambar 8. Molekul iodium bergabung dengan struktur heliks pati
Mekanisme pengujian yaitu dengan penambahan larutan I2 dalam KI ke dalam larutan koloid yang telah diencerkan yaitu larutan pati, kemudian terjadi perubahan warna. Larutan koloid pati yang berwarna putih keruh dicampurkan dengan larutan I2 dalam KI yang berwarna kuning kecoklatan menghasilkan campuran berwarna biru tua pekat. Adanya perubahan warna menjadi biru tua mengindikasikan bahwa zat pati yang terkandung merupakan golongan polisakarida. Penambahan iodium ini akan bereaksi dengan amilum pati membentuk suatu senyawa kompleks adsorpsi yang berwarna spesifik yakni khusus pati berwarna biru. Di dalam pati, terdapat unit-unit glukosa (monosakarida) yang membentuk rantai heliks karena adanya ikatan dengan konfigurasi pada tiap unit glukosanya. Bentuk ini menyebabkan zat pati dapat membentuk kompleks dengan molekul iodium yang dapat masuk ke dalam spiralnya, sehingga menyebabkan warna biru tua pada kompleks tersebut (Bestari, 2012).
Analisis prosedur
Sebelum melakukan pengujian, persiapan alat perlu dilakukan. Alat yang dibutuhkan dalam pengujian ini adalah cawan petri dan pipet tetes, sedangkan bahan yang dibutuhkan adalah larutan iodium 5%, dekstrin, maltosa, glukosa, dan pati. Langkah pertama yang dilakukan adalah teteskan 1 tetes sampel diatas cawan petri. Kemudian tambahkan 1 tetes larutan iodium. Amati perubahan warna yang terjadi. Hasil positif ditandai dengan perubahan warna menjadi biru kehitaman.
Analisis hasil
tersusun dari rantai bercabang dan hanya memberikan warna merah dengan iodin karena tidak terbentuk helix serta sedikit cenderung mengadakan retrodegradasi.
3. Uji Barfoed
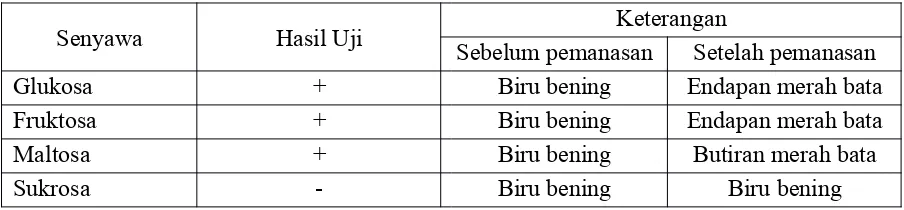
a. Tuliskan data hasil Barfoed test!
Senyawa Hasil Uji Sebelum pemanasanKeteranganSetelah pemanasan
Glukosa + Biru bening Endapan merah bata
Fruktosa + Biru bening Endapan merah bata
Maltosa + Biru bening Butiran merah bata
Sukrosa - Biru bening Biru bening
b. Bahas dan bandingkan data-data hasil uji Barfoed dari beberapa sampel dalam percobaan ini!
Prinsip
Prinsip uji barfoed adalah mereaksikan sampel dengan reagen barfoed yang mengandung kupri asetat dan asam asetat membentuk kupro oksida (Cu2O). Gula pereduksi monosakarida dan beberapa disakarida akan mereduksi Cu2+ menjadi Cu+. Reaksi tersebut menghasilkan endapan merah bata pada sampel dalam suasana asam.
Reaksi
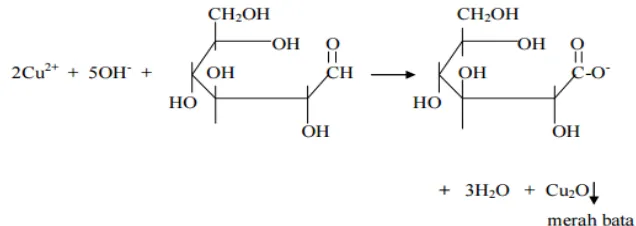
Endapan merah bata dihasilkan dari reduksi ion Cu2+ menjadi ion Cu+ sehingga menghasilkan kupro oksida. Berikut adalah reaksi reduksi Cu2+ menjadi Cu+ (Gambar 9) (Maligan, 2014):
Gambar 9. Reduksi Cu2+ menjadi Cu+
Mekanisme uji
kecuali pada waktu percobaan yang diperlama. Uji ini untuk menunjukkan adanya gula pereduksi monosakarida dan disakarida (Winarno, 2008).
Analisis prosedur
Persiapan alat dan bahan dilakukan sebelum melakukan pengujian. Alat yang dibutuhkan adalah tabung reaksi, rak tabung reaksi, pipet ukur 1 ml, labu hisap, pipet tetes, beaker glass 250 ml, penangas air, dan bulb. Bahan yang dibutuhkan adalah glukosa, fruktosa, maltose, sukrosa, dan barfoed. Langkah pertama dalam melakukan pengujian adalah meneteskan sebanyak 5 tetes ke dalam tabung reaksi, kemudian tambahkan 1 ml reagen barfoed. Selanjutnya panaskan sampel dalam penangas air tunggu hingga sampel membentuk endapan merah lalu diamati.
Analisis hasil
Uji barfoed bertujuan untuk mengetahui ada tidaknya gula pereduksi monosakarida dan disakarida pada sampel. Sampel yang digunakan adalah glukosa, maltosa, fruktosa, dan sukrosa. Berdasarkan hasil pengujian, hasil positif ditandai dengan munculnya endapan merah bata setelah dilakukan pemanasan. Pada sampel glukosa, maltosa, dan fruktosa menandakan hasil positif. Menurut winarno (2008) ada tidaknya sifat pereduksi dari suatu molekul karbohidrat ditentukan oleh ada tidaknya gugus hidroksil (OH) bebas yang reaktif. Pada glukosa (aldosa) gugus hidroksil yang reaktif terletak pada atom karbon nomor 1 (anomerik) sedangkan fruktosa (ketosa) terletak pada karbon nomor 2. Pada maltosa terbentuknya endapan merah lebih lama daripada fruktosa dan glukosa, karena maltosa merupakan disakarida yang memiliki gugus karbonil yang berpotensi bebas, yang dapat dioksidasi.
Pada sampel sukrosa, hasil pengujian negatif karena ridak terjadi perubahan warna dan tidak terbentuk endapan merah. Hal tersebut dikarenakan sukrosa tidak memiliki gugus OH bebas yang reaktif karena keduanya sudah saling terikat. Sukrosa tergolong gula invert. Gula invert ini jika dipanaskan dalam air akan terurai menjadi susunan monosakaridanya yaitu glukosa dan fruktosa. Kelarutannya sangat besar dan tidak dapat membentuk kristal kembali (Winarno, 2008).
b. Bahas dan bandingkan data-data hasil uji Benedict dari beberapa sampel dalam percobaan ini!
Prinsip
Prinsip uji benedict adalah mereaksikan sampel dengan reagen benedict yang mengandung natrium karbonat dan kupri asetat membentuk kupro oksida (Cu2O). Gula pereduksi monosakarida dan beberapa disakarida akan mereduksi Cu2+ menjadi Cu+. Reaksi tersebut menghasilkan endapan merah bata pada sampel dalam suasana basa.
Reaksi
Reaksi pada uji benedict ditandai dengan terbentuknya endapan merah pada sampel. Hal tersebut terjadi karena sampel mereduksi Cu2+ menjadi Cu+. Berikut adalah reaksi reduksinya (Gambar 10) (Maligan, 2014):
Gambar 10. Reduksi Cu2+ menjadi Cu+ Mekanisme uji
Reagen Benedict adalah larutan yang terdiri dari CuSO4, Na2CO3, Na sitrat dan H2O. Kompenen-komponen tersebut akan bereaksi dengan gula pereduksi dalam suasana alkalis dan menjadi Cu+ yang mengendap menjadi Cu2O. Suasana alkalis diperoleh dari Na2CO3 dan Na sitrat yang terdapat pada reagen Benedict (Kusbandari A, 2015)
Analisis prosedur
Persiapan alat dan bahan dilakukan sebelum melakukan pengujian. Alat yang dibutuhkan adalah tabung reaksi, rak tabung reaksi, pipet ukur 1 ml, labu hisap, pipet tetes, beaker glass 250 ml, penangas air, dan bulb. Bahan yang dibutuhkan yaitu glukosa, fruktosa, sukrosa dan reagen benedict. Langkah pertama yang dilakukan adalah meneteskan sampel sebanyak 2 tetes ke dalam tabung reaksi. Kemudian tambahkan reagen benedict sebanyak 1 ml menggunakan pipet ukur 1 ml. Setelah itu, panaskan sampel diatas bunsen sampai sampel membentuk endapan merah.
Analisis hasil
gugus yang dapat mereduksi (pereduksi) sehingga hasil mengujian menunjukkan hasil yang positif. Pada sampel sukrosa, tidak terjadi perubahan warna atau pembentukan endapan. Menandakan sukrosa bukan tergolong gula pereduksi.
PERTANYAAN
1. Bagaimana membedakan monosakarida dan disakarida dengan menggunakan Barfoed test?
Membedakan monosakarida dan disakarida pada uji barfoed dapat diketahui dengan mengukur lamanya sampel membentuk endapan merah bata pada hasil reaksi positif keduanya. Senyawa monosakarida akan lebih cepat membentuk endapan merah bata dibandingkan dengan senyawa disakarida. Hal ini terjadi karena suasana asam yang terdapat pada reagen barfoed yang dapat menyebabkan perbedaan lamanya pembentukan endapan pada monosakarida dan disakarida (Sumardjo, 2006).
2. Bagaimana mengidentifikasi gula pereduksi sampel pada uji Benedict?
KESIMPULAN
DAFTAR PUSTAKA
Almatsier, Sunita. 2009. Prinsip Dasar Ilmu Gizi. Jakarta: PT Gramedia Pustaka Utama.
Gimantoro, Hadi. 2008. Asam Sulfat (Sulfuric Acid / H2SO4). Bogor:
Akademi Kimia Analis Bogor
Haris, Hasrah. 2014. Uji Kualitatif Karbohidrat. Makassar: Universitas Hasanuddin
Herawati, H. 2010. Potensi Pengembangan Produk Pati Tahan Cerna Sebagai Pangan Fungsional. Jawa Tengah: Balai Pengkajian Teknologi Pertanian
Loto, C.A. and Loto, R.T. 2013. Effect of Dextrin and Thiourea Additives on the Zinc Electroplated Mild Steel in Acid Chloride Solution. International Journal of Electrochemical Science 8: 12434-12450
DAFTAR PUSTAKA TAMBAHAN
Bestari, Diah Devi. 2012. Pengujian Pati dari Umbi Singkong. Bali: Universitas Pendidikan Ganesha
Kusbandari A. 2015. Analisis Kualitatif Kandungan Sakarida dalam Tepung dan Pati Umbi Ganyong (Canna edulis Ker.). Pharmaҫiana. 5(1): 38
Maligan, Jaya Mahar. 2014. Kimia Pangan Analisis Karbohidrat. Malang: Universitas Brawijaya