BAB II
TINJAUAN PUSTAKA
2.1 Uraian tumbuhan
Rumput laut tergolong tumbuhan berderajat rendah, umumnya tumbuh melekat pada substrat tertentu, tidak mempunyai akar, batang maupun daun sejati; tetapi hanya menyerupai batang yang disebut talus. Rumput laut tumbuh di alam dengan melekatkan dirinya pada karang, pasir, batu dan benda keras lainnya (Anggadiredja, dkk., 2011).
2.1.1 Habitat dan sebaran rumput laut
Pertumbuhan rumput laut Glacilaria sp umumnya lebih baik di tempat dangkal daripada di tempat dalam. Substrat tempat melekatnya dapat berupa batu, pasir, lumpur dan karang, kebanyakan lebih menyukai intensitas cahaya yang lebih tinggi. Suhu merupakan faktor penting untuk pertumbuhan dan pembiakan. Suhu optimum untuk pertumbuhan adalah antara 20℃−28℃ , tumbuh pada kisaran kadar garam yang tinggi dan tahan sampai kadar garam 50 permil, dalam keadaan basah dapat tahan hidup di atas permukaan air selama satu hari (Aslan, 1998).
Rumput laut Glacilaria sp mempunyai wilayah sebaran budidaya berada di tambak-tambak di Pantai Utara Jawa (Serang, Bekasi, Karawang, Indramayu, Cirebon, Brebes, Tegal, Pemalang, Jepara dan Lamongan), Nusa Tenggara Barat (Sekotong, Lombok Barat dan Teluk Cempi Dompu), Sulawesi Selatan (Jeneponto, Takalar, Maros, Bulukumba, Sinjai, Bone, Wadjo dan Palopo), serta Sumatera Selatan (Lampung) (Anggadiredja, dkk., 2011).
2.1.2 Sistematika tumbuhan
Berdasarkan hasil identifikasi LIPI, taksonomi rumput laut Glacilaria verrucosa (Hudson) Papenfus diklasifikasikan sebagai berikut:
Divisi : Rhodophyta Kelas : Rhodopyceae Bangsa : Gigartinales Suku : Glacilariaceae Marga : Glacilaria
Jenis : Glacilaria verrucosa (Hudson) Papenfus 2.1.3 Nama daerah
Glacilaria verrucosa mempunyai berbagai nama daerah yaitu bulung
rambut (Bali) dan sango-sango (Sulawesi) (Anggadiredja, dkk., 2011). 2.1.4 Morfologi tumbuhan
Ciri-ciri yang dipunyai Glacilaria verrucosa yaitu talus berbentuk silindris, licin, dan berwarna kuning-coklat atau kuning hijau. Percabangan berseling tidak beraturan, memusat ke arah pangkal. Cabang lateral memanjang menyerupai rambut, ukuran sekitar 25 cm dengan diameter talus 0,5-1,5 mm (Anggadiredja, dkk., 2011).
2.1.5 Perkembangbiakan rumput laut
Faktor biologi utama yang menghambat produktivitas rumput laut yaitu faktor persaingan dan pemangsa dari hewan herbivora. Faktor morbiditas dan mortalitas rumput laut itu sendiri juga dapat disebabkan oleh penyakit akibat dari infeksi mikroorganisme, tekanan lingkungan perairan (fisika dan kimia perairan)
yang buruk, serta tumbuhnya tanaman penempel (parasit) (Anggadiredja, dkk., 2011).
Perkembangbiakan rumput laut dapat terjadi melalui dua cara, yaitu secara vegetatif dengan talus dan secara generatif dengan talus diploid yang menghasilkan spora. Perbanyakan secara vegetatif dikembangkan dengan cara stek, yaitu potongan talus yang kemudian tumbuh menjadi tanaman baru. Sementara, perbanyakan secara generatif dikembangkan melalui spora, baik alamiah maupun melalui budidaya. Pertemuan dua gamet membentuk zygot yang selanjutnya berkembang menjadi sporofit. Individu baru inilah yang mengeluarkan spora dan berkembang melalui pembelahan dalam sporogenesis menjadi gametofit (Anggadiredja, dkk., 2011).
2.2 Kandungan kimia
Rumput laut Glacilaria verrucosa merupakan jenis Glacilaria, yang menghasilkan metabolit primer senyawa hidrokoloid yang disebut agar (Anggadiredja, dkk, 2010). Jenis rumput laut yang termasuk dalam kelas Rhodophyceae (alga merah) mengandung pigmen antar lain adalah klorofil a, klorofil d, dan karoten, lutein, zeaxanthin, fikosianin dan fikoeritrin. Fikoeritrin merupakan pigmen yang dominan yang menyebabkan warna merah pada alga merah (Dawes, 1981).
2.3 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan menggunakan pelarut
cair. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam golongan minyak atsiri, alkaloid, flavonoid dan lain-lain. Diketahuinya senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut dan cara ekstraksi yang tepat (DepKes RI, 2000).
Menurut Departemen Kesehatan RI (2000), beberapa metode ekstraksi yang sering digunakan dalam berbagai penelitian antara lain yaitu:
A. Cara dingin 1. Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada suhu kamar. Maserasi kinetik dilakukan dengan pengadukan yang kontinu. Remaserasi dilakukan dengan pengulangan penambahan pelarut setelah dilakukan penyarian maserat pertama dan seterusnya.
2. Perkolasi
Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada suhu kamar. Proses perkolasi terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) yang terus- menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan.
B. Cara panas 1. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
2. Digesti
Digesti adalah proses penyarian simplisia dengan pengadukan secara terus-menerus pada temperatur yang lebih tinggi dari suhu kamar, yaitu secara umum dilakukan pada temperatur 40-50°C.
3. Sokletasi
Sokletasi adalah proses penyarian simplisia dengan menggunakan pelarut yang selalu baru, yang umumnya dilakukan dengan alat khusus (menggunakan alat Sokhlet) sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
4. Infundasi
Infundasi adalah proses penyarian simplisia dengan menggunakan pelarut air pada temperatur 90°C selama waktu 15 menit.
5. Dekoktasi
Dekoktasi adalah proses penyarian simplisia dengan menggunakan pelarut air pada temperatur 90°C selama 30 menit.
2.4 Radikal bebas
Radikal bebas adalah setiap molekul yang mengandung satu atau lebih elektron yang tidak berpasangan. Radikal bebas sangat reaktif dan dengan mudah menjurus ke reaksi yang tidak terkontrol menghasilkan ikatan silang dengan DNA, protein, lipida, atau kerusakan oksidatif pada gugus fungsional yang penting pada biomolekul. Perubahan ini akan menyebabkan proses penuaan. Radikal bebas juga terlibat dan berperan dalam patologi dari berbagai penyakit degeneratif, yakni kanker, aterosklerosis, jantung koroner, katarak dan penyakit
degeneratif lainnya (Silalahi, 2006). Radikal bebas dapat masuk dan terbentuk dalam tubuh melalui pernafasan, kondisi lingkungan yang tidak sehat dan makanan berlemak (Kumalaningsih, 2006).
2.5 Antioksidan
Antioksidan adalah senyawa yang mempunyai struktur molekul yang dapat memberikan elektronnya kepada molekul radikal bebas dan dapat memutus reaksi berantai dari radikal bebas (Kumalaningsih, 2006). Antioksidan atau reduktor berfungsi untuk mencegah terjadinya oksidasi atau menetralkan senyawa yang telah teroksidasi dengan cara menyumbangkan hidrogen dan atau elektron (Silalahi, 2006).
Menurut Kumalaningsih (2006), antioksidan dapat dikelompokkan menjadi 5 yakni:
a. Antioksidan primer
Antioksidan ini berfungsi untuk mencegah terbentuknya radikal bebas yang baru karena dapat merubah radikal bebas yang ada menjadi molekul yang berkurang dampak negatifnya, yaitu sebelum sempat bereaksi. Contohnya adalah enzim superoksida dismutase (SOD) yang berfungsi sebagai pelindung hancurnya sel-sel dalam tubuh karena radikal bebas.
b. Antioksidan sekunder
Antioksidan sekunder merupakan senyawa yang berfungsi menangkap radikal bebas serta mencegah terjadinya reaksi berantai sehingga tidak terjadi kerusakan yang lebih besar. Contohnya adalah vitamin E, vitamin C dan betakaroten yang dapat diperoleh dari buah-buahan.
c. Antioksidan tersier
Antioksidan tersier merupakan senyawa yang memperbaiki kerusakan sel- sel dan jaringan yang rusak karena serangan radikal bebas, biasanya yang termasuk kelompok ini adalah jenis enzim misalnya metionin sulfoksidan reduktase yang dapat memperbaiki DNA dalam inti sel. Enzim tersebut bermanfaat untuk perbaikan DNA pada penderita kanker.
d. Oxygen scavanger
Antioksidan yang termasuk oxygen scavanger mengikat oksigen sehingga tidak mendukung reaksi oksidasi, misalnya vitamin C.
e. Chelators atau sequesstrants
Mengikat logam yang mampu mengkatalisis reaksi oksidasi misalnya asam sitrat dan asam amino. Khasiat antioksidan untuk mencegah berbagai penyakit akibat pengaruh oksidatif akan lebih efektif jika kita mengkonsumsi sayur-sayuran dan buah-buahan yang kaya akan antioksidan dari berbagai jenis daripada menggunakan antioksidan tunggal. Efek antioksidan lebih efektif daripada suplemen antioksidan yang diisolasi (Silalahi, 2006).
2.5.1 Antioksidan alami
Sayur-sayuran dan buah-buahan kaya akan zat gizi (vitamin, mineral, serat pangan) serta berbagai kelompok zat bioaktif lain yang disebut zat fitokimia. Zat bioaktif ini bekerja secara sinergis, meliputi mekanisme enzim detoksifikasi, peningkatan sistem kekebalan, pengurangan agregasi platelet, pengaturan sintesis kolesterol dan metabolisme hormon, penurunan tekanan darah, antioksidan, antibakteri serta efek antivirus (Silalahi, 2006).
Senyawa antioksidan alami tumbuhan umumnya adalah senyawa fenolik atau polifenolik yang dapat berupa golongan flavonoid, turunan asam sinamat, kumarin dan tokoferol. Golongan flavonoid yang memiliki aktivitas antioksidan meliputi flavon, flavonol, isoflavon, katekin, flavanon dan kalkon. Senyawa antioksidan alami polifenolik dapat bereaksi sebagai pereduksi, penangkap radikal bebas, pengkelat logam dan peredam terbentuknya singlet oksigen (Kumalaningsih, 2006).
2.5.2 Vitamin C
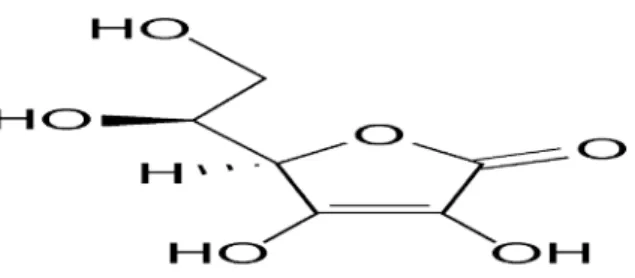
Vitamin C atau asam askorbat mempunyai berat molekul 176,13 dengan rumus molekul C6H8O6. Asam askorbat mengandung tidak kurang dari 99,0% C6H8O6. Pemerian vitamin C adalah hablur atau serbuk putih atau agak kuning. Oleh pengaruh cahaya lambat laun menjadi berwarna gelap. Dalam keadaan kering stabil di udara, dalam larutan cepat teroksidasi. Melebur pada suhu lebih kurang 190o. Kelarutan vitamin C mudah larut dalam air, agak sukar larut dalam etanol, praktis tidak larut dalam kloroform, dalam eter dan dalam benzen (Ditjen POM, 1995). Rumus bangun Vitamin C dapat dilihat pada Gambar 2.1.
Gambar 2.1 Rumus bangun vitamin C (Silalahi, 2006).
Vitamin C merupakan salah satu senyawa kimia yang mempunyai potensi sebagai antioksidan dengan mendonorkan hidrogen dari gugus hidroksilnya kepada radikal bebas, selain itu juga berperan dalam pencegahan penyakit jantung
koroner, mencegah kanker, meningkatkan sistem kekebalan tubuh terhadap infeksi dan virus serta dalam regenerasi vitamin E (Silalahi, 2006).
2.5.3 Betakaroten
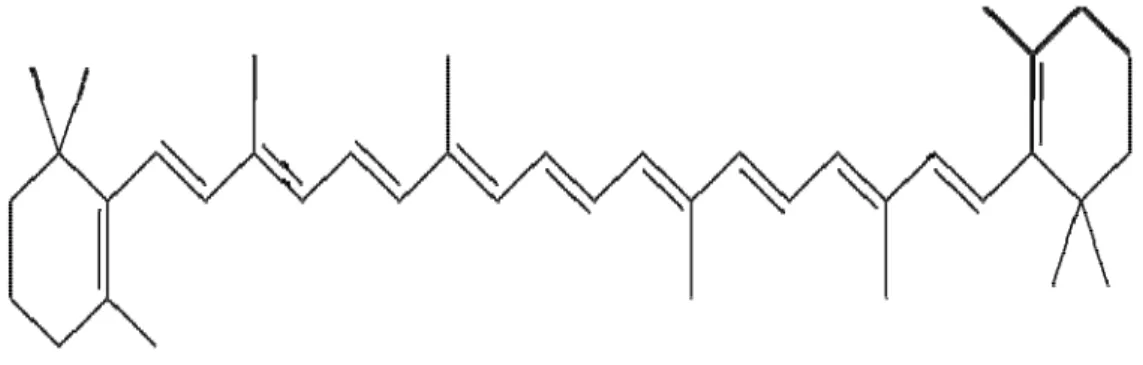
Betakaroten merupakan salah satu provitamin A yang berperan sebagai antioksidan dan dipercaya dapat menurunkan resiko penyakit jantung dan kanker. Betakaroten terdapat pada aprikot, wortel dan mangga dan dengan mengkonsumsi 50 mg betakaroten tiap hari dalam menu makanan dapat mengurangi risiko terkena penyakit jantung (Kosasih, 2004). Rumus bangun betakaroten dapat dilihat pada Gambar 2.2.
Gambar 2.2 Rumus bangun betakaroten (Silalahi, 2006).
Betakaroten bekerja sebagai antioksidan dengan cara memperlambat fase inisiasi. Pemberian vitamin A dalam dosis tinggi dapat bersifat toksis. Akan tetapi, betakaroten dalam jumlah banyak mampu memenuhi kebutuhan vitamin A dan selebihnya tetap sebagai betakaroten yang berfungsi sebagai antioksidan (Silalahi, 2006).
2.5.4 Vitamin E
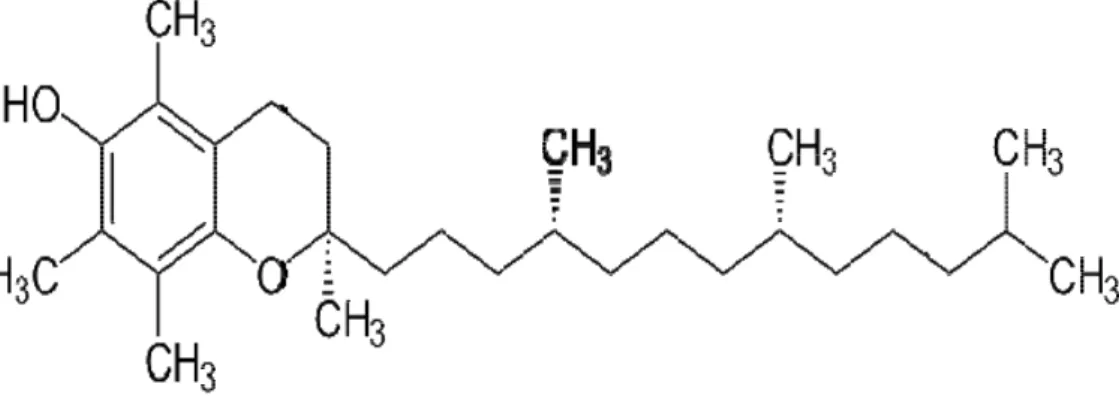
Vitamin E terdiri dari struktur tokoferol, bersifat tidak larut dalam air tapi larut dalam lemak atau minyak. Struktur molekul vitamin E di bawah menunjukkan bahwa vitamin E merupakan suatu antioksidan yang efektif, yang
dengan mudah menyumbangkan atom hidrogen pada gugus hidroksil (OH) dari struktur cincin ke radikal bebas sehingga radikal bebas menjadi tidak reaktif. Dengan menyumbangkan hidrogen, vitamin E sendiri menjadi suatu radikal, tetapi lebih stabil karena elektron yang tidak berpasangan pada atom oksigen mengalami delokalisasi ke dalam struktur cincin aromatik (Silalahi, 2006).
Gambar 2.3 Rumus bangun vitamin E (Silalahi, 2006). 2.5.5 Polifenol
Polifenol adalah kelompok zat kimia yang ditemukan pada tumbuhan. Zat ini memiliki tanda khas yakni memiliki banyak gugus fenol dalam molekulnya. Polifenol memiliki spektrum luas dengan sifat kelarutan pada suatu pelarut yang berbeda-beda. Hal ini disebabkan oleh gugus hidroksil pada senyawa tersebut yang dimiliki berbeda jumlah dan posisinya (Hattenschwiler, 2000). Struktur dasar polifenol dapat dilihat pada Gambar 2.4.
Turunan polifenol sebagai antioksidan dapat menstabilkan radikal bebas dengan melengkapi kekurangan elektron yang dimiliki radikal bebas, dan menghambat terjadinya reaksi berantai dari pembentukan radikal bebas. Polifenol merupakan komponen yang bertanggung jawab terhadap aktivitas antioksidan dalam buah dan sayuran (Hattenschwiler, 2000).
2.6 Spektrofotometer UV-Visible
Prinsip kerja Spektrofotometer Visible adalah sinar/cahaya dilewatkan melewati sebuah wadah (kuvet) yang berisi larutan, dimana akan menghasilkan spektrum. Sebagian dari cahaya tersebut akan diserap dan sisanya akan dilewatkan. Nilai absorbansi dari cahaya yang dilewatkan akan sebanding dengan konsentrasi larutan di dalam kuvet. Alat ini menggunakan hukum Lambert Beer sebagai acuan (Ewing, 1975).
Ahli kimia telah lama menggunakan warna sebagai bantuan dalam mengenali zat-zat kimia. Spektrofotometri dapat dianggap sebagai perluasan suatu pemeriksaan visual, yaitu dengan menggunakan alat untuk mengukur absorpsi energi radiasi macam-macam zat kimia dan memungkinkan dilakukannya pengukuran kualitatif dari suatu zat dengan ketelitian yang lebih besar (Day, 1994).
Spektrofotometer UV/Visibel pada dasarnya terdiri atas sumber sinar monokromator, tempat sel untuk zat yang diperiksa, detektor, penguat arus dan alat ukur atau pencatat. Panjang gelombang untuk sinar ultraviolet antara 200-400 nm sedangkan panjang gelombang untuk sinar tampak/visible antara 400-750 nm (Rohman, 2007).
2.7 Penentuan aktivitas antioksidan dengan metode DPPH
Metode untuk menentukan aktivitas antioksidan ada beberapa cara, yaitu: (1). BCB Method (β-Carotene Bleaching Method) atau Metode Pemutihan β- karoten, (2). DPPH (1,1-difenil-2- picrylhydrazil) Radical Scavenging Method (Metode Pemerangkapan Radikal Bebas DPPH), (3). Thiobarbituric Acid-
Reactive Substance (TBARS) Assay, (4). ORAC Assay (Oxygen-Radical
Absorbance Capacity), (5). CUPRAC Assay (Cupric Reducing Antioxidant
Capacity), (6). FRAP Assay (Ferric Reducing Antioxidant Power), (7). Determination of Conjugated Dienes, (8). Determination of Lipid Hydroperoxides (De la Rosa, 2010).
Pada tahun 1922, Goldschmidt dan Renn menemukan senyawa berwarna ungu radikal bebas stabil DPPH, yang sekarang digunakan sebagai reagen kolorimetri untuk proses redoks. DPPH berwarna sangat ungu seperti KMnO4 dan bentuk tereduksinya yaitu 1,1-difenil-2- picrylhydrazine (DPPH-H) yang berwarna oranye-kuning. DPPH bersifat tidak larut dalam air (Ionita, 2005).
DPPH merupakan radikal bebas yang stabil pada suhu kamar dan sering digunakan untuk mengevaluasi aktivitas antioksidan beberapa senyawa atau ekstrak bahan alam. Interaksi antioksidan dengan DPPH baik secara transfer elektron atau radikal hidrogen pada DPPH, akan menetralkan radikal bebas dari DPPH dan membentuk DPPH tereduksi. Jika semua elektron pada radikal bebas DPPH menjadi berpasangan, maka warna larutan berubah dari ungu tua menjadi kuning terang dan absorbansi pada panjang gelombang 517 nm akan hilang.
Perubahan ini dapat diukur sesuai dengan jumlah elektron atau atom hidrogen yang ditangkap oleh molekul DPPH akibat adanya zat reduktor (Molyneux, 2004).
Metode DPPH merupakan suatu metode yang cepat, sederhana, dan murah yang dapat digunakan untuk mengukur kemampuan antioksidan yang terkandung dalam makanan. Metode DPPH dapat digunakan untuk sampel yang padat dan juga dalam bentuk larutan dan berlaku untuk keseluruhan kapasitas antioksidan sampel. Prinsipnya adalah elektron ganjil pada molekul DPPH memberikan serapan maksimum pada panjang gelombang tertentu yang berwarna ungu. Warna ini akan berubah dari ungu menjadi kuning lemah apabila elektron ganjil tersebut berpasangan dengan atom hidrogen yang disumbangkan senyawa antioksidan. Perubahan warna ini berdasarkan reaksi kesetimbangan kimia (Prakash, 2001).
Molyneux (2004), menyatakan bahwa suatu zat mempunyai sifat antioksidan bila nilai IC50 kurang dari 200 ppm. Bila nilai IC50 yang diperoleh berkisar antara 200-1000 ppm, maka zat tersebut kurang aktif namun masih berpotensi sebagai zat antioksidan. Rumus molekul DPPH dapat dilihat pada Gambar 2.5.
a b
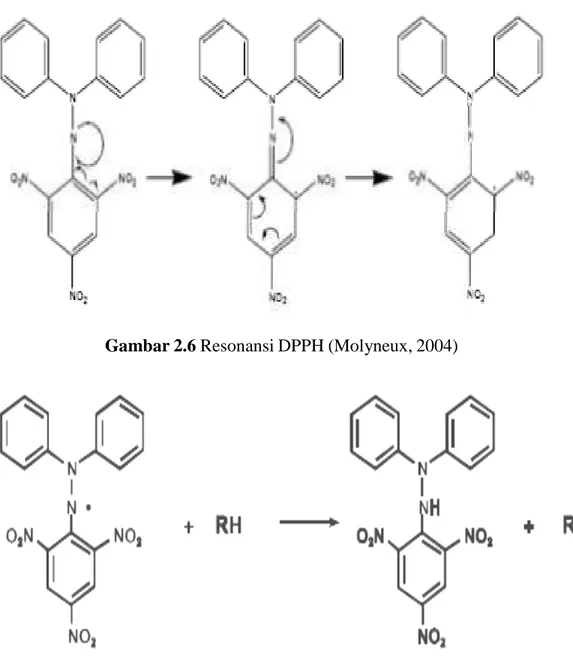
Gambar 2.5 Rumus Bangun DPPH (Molyneux, 2004) Keterangan:
DPPH merupakan radikal bebas yang stabil karena dialaminya. Resonansi DPPH dan reaksi DPPH dengan atom
resonansi yang H netral yang berasal dari senyawa-senyawa yang bersifat antioksidan dapat dilihat pada Gambar 2.6 dan Gambar 2.7.
Gambar 2.6 Resonansi DPPH (Molyneux, 2004)
Gambar 2.7 Reaksi antara DPPH dengan atom H netral yang berasal dari antioksidan (Molyneux, 2004).
Parameter yang dipakai untuk menunjukan aktivitas antioksidan adalah harga konsentrasi efisien atau efficient concentration (EC50) atau Inhibition
menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat antioksidan yang memberikan % penghambatan 50%. Zat yang mempunyai aktivitas antioksidan tinggi, akan mempunyai harga EC50 atau IC50 yang rendah (Molyneux, 2004).
2.7.1 Pelarut
Metode ini akan memberikan hasil yang baik dengan menggunakan pelarut metanol atau etanol dan kedua pelarut ini tidak mempengaruhi dalam reaksi antara sampel uji sebagai antioksidan dengan DPPH sebagai radikal bebas (Molyneux, 2004).
2.7.2 Pengukuran absorbansi panjang gelombang
Panjang gelombang maksimum (λmaks) yang digunakan dalam pengukuran sampel uji sangat bervariasi. Menurut beberapa literatur panjang gelombang maksimum untuk DPPH antara lain 515 nm, 516 nm, 517 nm, 518 nm, 519 nm dan 520 nm. Pada prakteknya hasil pengukuran yang memberikan peak maksimum itulah panjang gelombangnya yaitu sekitar panjang gelombang yang disebutkan diatas (Molyneux, 2004).