KAJIAN ADSORPSI RHODAMIN B PADA HUMIN Radna Nurmasari, Maria Dewi Astuti, Dewi Umaningrum, Dita Amilia Khusnaria
Program Studi Kimia FMIPA Universitas Lambung Mangkurat
Jl. A. Yani Km. 38 Banjarbaru Kalimantan Selatan Telp. 0511-4782899
Email : [email protected]
Abstrak. Telah dilakukan penelitian tentang adsorpsi zat warna rhodamin B menggunakan adsorben
humin. Penelitian ini bertujuan untuk menentukan kondisi optimum pH, waktu kontak optimum dan kapasitas adsorpsi rhodamin B pada humin. Humin diperoleh dari tanah gambut yang diekstraksi menggunakan larutan NaOH 0.1 N dengan perbandingan pelarut 1 :10, kemudian dilanjutkan dengan penambahan larutan HCl 0,1 M dan HF 0,3 M untuk menghilangkan pengotor yang terdapat pada humin. Kondisi pH optimum adsorpsi zat warna Rhodamin B pada humin tercapai pada pH 2. Waktu kontak optimum adsorpsi rhodamin B adalah 30 menit. Kapasitas adsorpsi zat warna rhodamin B pada humin adalah 4,201 mg/g.
Kata Kunci : adsorpsi, humin, rhodamin B
Abstract. The research had been done to discuss about dye adsorption of rhodamine B using humin
adsorbent. This study was aimed to determine the optimum conditions of pH, the optimum contact time and the adsorption capacity of humin. Humin was acquired from peat, extracted with NaOH 0,1 N with a solvent ratio 1:10 followed by purification by using HCl 0,1 M and HF 0,3 M. The optimum condition of adsorption of rhodamine B dye which was acquired of pH 1,and the optimum contact time was 30 minutes. The adsorption capacity of rhodamine B dye was 4,201 mg/g respectively.
Key words : adsorption, humin, rhodamine B
PENDAHULUAN
Pesatnya penggunaan zat warna sintetik pada berbagai bidang industri menyebabkan dihasilkannya limbah cair zat warna dalam jumlah besar. Pembuangan limbah zat warna secara langsung menyebabkan masalah yang serius terhadap lingkungan karena sifatnya yang
karsinogenik dan toksik. Limbah yang
berbahaya dan memiliki daya racun tinggi umumnya berasal dari buangan industri seperti industri tekstil, industri obat, dan industri makanan. Limbah zat warna yang dihasilkan dari industri tekstil umumnya merupakan
senyawa organik non-biodegadable, yang dapat
menyebabkan pencemaran lingkungan terutama lingkungan perairan [1]. Beberapa metode yang
telah dilakukan untuk mengatasi permasalahan tersebut antara lain degradasi menggunakan mikroba, oksidasi secara kimia, koagulasi, titrasi, dan pemisahan menggunakan membran.
Akan tetapi, beberapa teknik tersebut
mempunyai kelemahan dan keterbatasan seperti biaya yang tinggi. Teknik adsorpsi merupakan solusi alternatif yang efektif dalam proses pengolahan limbah zat warna di lingkungan perairan. Adsorpsi adalah peristiwa penyerapan suatu zat pada permukaan zat lain. Metode ini
merupakan metode alternatif yang tidak
memerlukan pre-treatment dan biaya yang relatif rendah, sehingga banyak peneliti yang mencari bahan yang lebih murah dan berlimpah seperti humin [2].Salah satu sumber utama senyawa humin adalah tanah gambut. Kalimantan Selatan
adalah salah satu propinsi yang memiliki areal lahan gambut yang cukup luas, salah satunya
diantaranya adalah Kabupaten Banjar,
khususnya di Kecamatan Gambut. Pemanfaatan gambut di Indonesia sendiri memang baru dimulai dalam taraf berkembang. Gambut merupakan jenis tanah yang secara alami mengandung senyawa humat sebagai komponen terbesar. Secara kimia terdapat tiga fraksi senyawa humat, yaitu asam humat, asam fulvat, dan humin. Ketiga fraksi ini merupakan komponen yang diperlukan oleh tanah untuk menjaga kesuburan pada tanah [3].
TINJAUAN PUSTAKA
Humin merupakan fraksi senyawa humat yang tidak larut dalam air pada semua kondisi pH dan larutan alkali dengan warna hitam. Kompleks humin merupakan senyawa dengan berat molekul yang tinggi jika dibandingkan dengan kompleks karbohidrat. Humin dalam tanah lebih lama mengalami dekomposisi jika dibandingkan dengan fraksi humat lainnya.
Beberapa fungsi humin di dalam tanah antara lain adalah untuk meningkatkan daya serap air tanah, menjaga kestabilan tanah, dan meningkatkan kesuburan tanah. Berdasarkan fungsi tersebut di atas maka humin dapat dikatakan sebagai komponen dalam kesuburan tanah [3].
Humin sendiri adalah residu padat yang terbentuk setelah adanya proses ekstraksi humus dalam alkali. Untuk memisahkan komponen organik humin dari komponen anorganiknya maka humin didekstruksi dengan menggunakan campuran hidrogen fluorida dan asam klorida
dimana komponen anorganiknya akan
mengalami dekomposisi namun komponen organiknya sendiri juga akan mengalami perubahan secara signifikan [4].
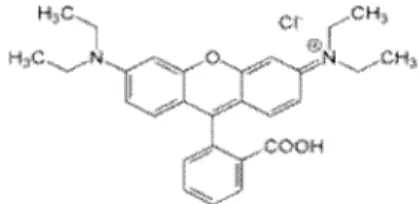
Rhodamin B dengan rumus kimia
C28H31N2O3Cl adalah zat warna sintetis
berbentuk serbuk kristal berwarna kehijauan, berwarna merah keunguan dalam bentuk terlarut
pada konsentrasi tinggi dan berwarna merah terang pada konsentrasi rendah. Rhodamin B
termasuk pewarna golongan xanthene basa.
Rhodamin B sangat larut dalam air dan alkohol, serta sedikit larut dalam asam klorida dan
natrium hidroksida. Rhodamin B sering
digunakan sebagai zat pewarna untuk kertas, pewarna untuk tekstil, dan sebagai reagensia [5].
Gambar 1. Struktur molekul rhodamin B
Adsorpsi merupakan suatu proses yang terjadi ketika suatu fluida (cairan atau gas) terikat kepada suatu padatan dan akhirnya membentuk suatu film (lapisan tipis) pada permukaan padatan tersebut. Sistem adsorpsi adalah suatu sistem yang memanfaatkan kemampuan zat padat untuk menjerap suatu zat dan penjerapan tersebut hanya berlangsung pada permukaannya saja. Zat yang menjerap disebut adsorben sedangkan ion, atom atau molekul yang dijerap disebut adsorbat.
Kualitas material adsorben
dipertimbangkan sesuai dengan berapa banyak adsorbat (logam berat) yang dapat ditarik dan tersisa. Untuk itu biasanya ditentukan logam yang diambil oleh biosorben sebagai jumlah satuan berat adsorbat per satuan berat kering adsorben. Ada dua model kesetimbangan adsorpsi yaitu isotherm Langmuir dan isotherm Freundlich. Model isoterm Langmuir menggunakan pendekatan kinetika, yaitu pada permukaan adsorben terdapat situs-situs aktif bersifat homogen yang proporsional dengan luas permukaan. Masing-masing situs aktif hanya dapat mengadsorpsi satu molekul adsorbat saja sehingga adsorpsi hanya akan terbatas pada pembentukan lapisan tunggal (monolayer) [6].
Isoterm Langmuir dinyatakan dengan persamaan : ) 1 ( 1 L e e L m e C K C K q q
Model isoterm Freundlich menggunakan asumsi bahwa adsorpsi berjalan secara fisika. Model isoterm Freundlich (merupakan persamaan empirik yang dinyatakan dengan persamaan :
y = k c1/n (2)
dimana k dan c adalah konstanta empiris. Jika persamaan (2) diaplikasikan untuk gas, maka y adalah jumlah gas yang teradsorpsi dan c digantikan dengan tekanan gas [7].
BAHAN DAN METODE Alat
Alat-alat yang digunakan dalam penelitian ini adalah : Alat-alat yang digunakan adalah
alat-alat gelas (Pyrex), neraca OHAUS merk
Galaxy 400, pengaduk kayu, kertas saring,
termometer, hot plate merk Barnstead No.
SP46920, pH meter merk Cyberscan, shaker
merk GKL 3005, oven merk Carbolyte,
spektrofotometer UV-Vis digital 200t, dan FTIR Shimadzu.
Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah humin dari tanah gambut yang berasal dari kecamatan Gambut Kabupaten Banjar Kalimantan Selatan, kertas pH merk EX-1-14, akuades, kertas saring Whatman No.42. Bahan kimia yang dengan kualitas p.a yang digunakan dalam penelitian ini adalah HCl pekat
(37% dan ρ=1,19 kg/l (b/v)) E.Merck, HNO3
(69,5% dan ρ= 1,5 kg/l (b/v)), HF (40%, ρ=1,13
g/mol) E.Merck, asam asetat glasial Ajax Chemicals, AgNO3 Ajax Chemicals, NaOH E.Merck, dan zat warna rhodamin B.
Prosedur Penelitian
Ekstraksi humin dari tanah gambut
Tanah gambut ditimbang sebanyak 500 gram. Tanah gambut dimasukkan ke dalam toples plastik kemudian diekstraksi dengan 5 L NaOH 0,1 N (perbandingan tanah dengan pelarut 1:10) selama 24 jam. Endapan yang terbentuk merupakan humin dan pengotor-pengotornya.
Pemurnian humin
Endapan humin yang diperoleh dimurnikan dengan menggunakan larutan campuran HCl 0,1 M dan HF 0,3 M sebanyak 1 L, kemudian digojog dengan shaker selama 24 jam dan dilakukan sebanyak 3 kali. Pemurnian antara HF dan HCl bertujuan untuk membebaskan humin dari pengotor bahan-bahan anorganik seperti lempung dan logam. Setelah itu dikarakterisasi dengan menggunakan metode spektrofotometer inframerah.
Penentuan pH optimum adsorpsi zat warna pada humin
Sebanyak 1 gram humin ditimbang
kemudian dimasukkan ke dalam 50 mL larutan rhodamin B dengan konsentrasi 100 ppm. Interaksi dilakukan pada variasi pH larutan rhodamin B yaitu pH 0,5; 1; 2; 3; 4; 5; 6; 7; 8; 9; dan 10 dengan cara digojog selama 1 jam. Campuran didiamkan selama 24 jam kemudian endapan dipisahkan dengan cara disaring. Filtrat yang diperoleh kemudian dianalisis dengan spektrofotometer UV-Vis digital 200t pada panjang gelombang 555 nm.
Penentuan waktu optimum adsorpsi zat warna pada humin
Sebanyak 1 gram humin dimasukkan ke dalam 50 ml larutan rhodamin B dengan konsentrasi 100 ppm. Interaksi dilakukan pada
pH awal larutan rhodamin B yaitu pH optimum yang diperoleh dari percobaan sebelumnya, dengan variasi waktu kontak 5, 10, 15, 20, 30, 45, 60, 75, dan 90 menit, kemudian filtrat dan endapan dipisahkan dengan cara disaring. Filtrat yang diperoleh kemudian dianalisis dengan spektrofotometer UV-Vis untuk rhodamin B pada panjang gelombang 555 nm.
Penentuan kapasitas adsorpsi zat warna
Sebanyak 50 mL larutan zat warna rhodamin B dengan variasi konsentrasi yaitu 20, 40, 60, 80, dan 100 ppm dimasukkan ke dalam erlenmeyer 250 mL. Kemudian ditambahkan masing-masing 1 gram adsorben humin dan digojog selama pH optimum dan waktu optimum dengan menggunakan shaker. Larutan
yang telah digojog kemudian disaring
menggunakan kertas saring Whatman no.42 dan sisa zat warna rhodamin B dalam filtrat dianalisis menggunakan UV-Vis.
HASIL DAN PEMBAHASAN
Identifikasi Gugus Fungsional Humin dari Tanah Gambut dengan FTIR
Larutan NaOH diketahui sangat efektif mengekstrak senyawa humin, dimana senyawa humin tidak larut dalam NaOH dan humin berada di fase padatnya. Larutan 0,1 N NaOH lebih disukai karena sifat ekstraksinya tidak terlalu kuat dibanding 0,5 N NaOH Proses selanjutnya adalah pemurnian humin, hal ini dilakukan dengan cara melarutkan humin hasil isolasi ke dalam larutan campuran 0,1 N HCl dan 0,3 N HF. Kedua pereaksi tersebut berfungsi untuk memisahkan kontaminan berupa bahan-bahan anorganik dari humin terutama silika dan logam. Setelah itu baru endapan yang dihasilkan disaring dan dibilas dengan akuades hingga
endapan tersebut bebas dari Cl-. Endapan
kemudian dikeringkan dengan menggunakan
oven pada suhu 70oC. Endapan kering yang
dihasilkan merupakan humin murni. Dari hasil penelitian didapatkan 131 gram humin dari 1500 gram tanah gambut dengan rendemen sebesar 8,7%.
Kemampuan humin berinteraksi dengan zat warna rhodamin B disebabkan oleh sebagian
besar gugus-gugus fungsional humin
mengandung –COOH, fenolat, enolat, -OH
alkoholat dan –C=O. Karakterisasi ini
diharapkan sebagai indikasi kualitatif
keberhasilan sintesis humin melalui munculnya atau perubahan serapan karakteristik untuk gugus-gugus fungsional pada adsorben ataupun bentuk pita serapannya. Spektra IR humin hasil
pemurnian humin dan humin yang
diinteraksikan dengan zat warna rhodamin B dapat dilihat pada Gambar 2
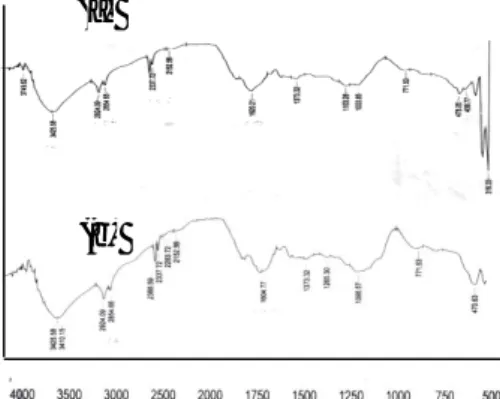
Gambar 3.Spektra inframerah (a) humin hasil pemurnian (b) humin setelah dikontakkan dengan rhodamin B.
Pada Gambar 3 (a) serapan karakteristik humin pada bilangan gelombang 3425,58 cm-1 yang menunjukkan vibrasi ulur –OH, pada bilangan gelombang 1620,21 cm-1 yang menunjukkan vibrasi ulur C=O dari gugus – COOH, serapan pada bilangan gelombang 2924,09 cm-1 dan 2854,65 cm-1 yang mengidentifikasikan adanya vibrasi ulur C-H alifatik.
Hal ini sesuai dengan penelitian
sebelumnya bahwa adanya serapan pada panjang (a) (b) T ra ns m it an (% )
gelombang 3425,3 cm-1 yang menunjukkan vibrasi ulur –OH, serapan pada bilangan
gelombang 2920,0 cm-1 yang
mengidentifikasikan adanya vibrasi ulur C-H
alifatik, bilangan gelombang 1608,5 cm-1
menunjukkan sebagai C=C aromatik. Selain itu
C=C aromatik ditunjukkan pula dengan
munculnya pita serapan lemah pada bilangan gelombang sekitar 1508,2 cm-1 dan 1512,1 cm-1, serapan pada bilangan gelombang sekitar 1300 cm-1 semakin lemah dan muncul serapan baru
pada bilangan gelombang 1705,0 cm-1 yang
menunjukkan vibrasi ulur C=O dari gugus – COOH. Serapan ini muncul akibat dari proses pemurnian dengan HCl/HF dimana dalam proses tersebut sebagian mineral-mineral lepas dan digantikan oleh ion H+ yang dihasilkan dari larutan HCl/HF sehingga membentuk –COOH [8] Pada Gambar 3 (b) humin yang telah dikontakkan dengan rhodamin B pada bilangan gelombang 3425,58 cm-1 dan 3410,15 cm-1 yang menunjukkan vibrasi ulur –OH, serapan pada bilangan gelombang 2924,09 cm-1 dan 2854,65 cm-1 serapan yang mengidentifikasikan adanya vibrasi ulur C-H alifatik, dan pada
serapan panjang gelombang 1604,77 cm-1
menunjukkan adanya vibrasi ulur C=O dari gugus –COOH. Pengaruh pH larutan terhadap besar kecilnya kemampuan humin untuk menyerap zat warna memiliki kaitan yang erat dengan kedudukan ionik gugus-gugus fungsinya. Humin termasuk senyawa humat yang memiliki gugus karboksilat dan –OH fenolat. Pemberian perlakuan variasi pH mengubah konsentrasi ion H+ dan ion OH- dalam larutan.
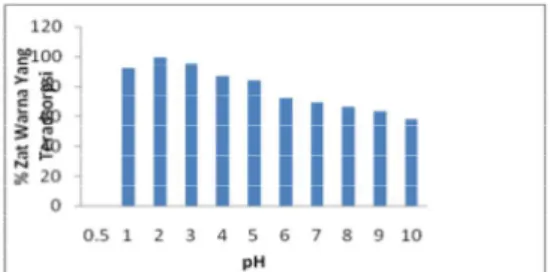
Gambar 4. Grafik pengaruh pH larutan terhadap % zat warna rhodamin B yang teradsorpsi pada humin.
Pada pH asam (pH<7) konsentrasi ion H+ lebih besar daripada ion OH-, sebaliknya pada pH basa (pH>7) konsentrasi ion OH- akan lebih besar daripada H+.
Dari penelitian didapatkan bahwa rhodamin B menunjukkan perilaku yang mirip dalam terabsorpsinya ke humin. Yaitu optimal pada pH asam dan menurun pada pH basa. Dari sisi zat warna relatif mudah dijelaskan tetapi dari sisi humin sulit dijelaskan karena logikanya pada pH basa permukaan humin seharusnya bermuatan negatif. Untuk rhodamin B, pada pH asam, ion
Cl- lepas dari rhodamin B dan rhodamin B
menjadi bermuatan positif. Menurut [9], pada pH asam gugus –COOH terdisosiasi melepaskan ion H+ dan menjadi muatan negatif yaitu – COO-, maka akan terjadi interaksi elektrostatik antara rhodamin B dengan permukaan humin yang bermuatan negatif.
Pelepasan ion Cl- akan terhambat karena tertekan oleh ion OH- dalam larutan, sehingga interaksinya dengan humin menjadi kecil. Adsorpsi optimum zat warna rhodamin B adalah pada pH 2 sebesar 99,372 %.
Pengaruh waktu kontak optimum adsorpsi
Pengaruh waktu kontak terhadap adsorpsi zat warna rhodamin B dipelajari dengan menggunakan zat warna rhodamin B dengan konsentrasi 100 ppm pada pH optimum adsorpsi. Variasi waktu kontak yang digunakan adalah 5, 10, 15, 30, 45, 60, 75, dan 90 menit. Kemudian dibuat grafik hubungan zat warna
Gambar 5. Struktur zat warna rhodamin B sebelum dan sesudah dilarutkan dalam air
O N H3C H3C N CH3 CH3 COOH (Z) (Z) (E) Cl -O N H3C H3C N CH3 CH3 COOH (Z) (Z) (E) Cl -+ + + bermuatan positif
yang teradsorpsi dalam satuan % terhadap variasi waktu yang dapat dilihat pada Gambar 7.
Gambar 6. Grafik pengaruh waktu kontak optimum larutan terhadap % zat warna rhodamin B yang teradsorpsi pada humin
Berdasarkan pada Gambar 6 terlihat bahwa jumlah zat warna rhodamin B yang teradsorpsi meningkat dengan semakin lamanya waktu kontak, kemudian berangsur-angsur berkurang dengan bertambahnya waktu kontak. Adsorpsi optimum pada zat warna rhodamin B terjadi pada waktu kontak 30 menit sebesar 82,08 %.
Pada zat warna rhodamin B jumlah zat warna yang teradsorpsi semakin meningkat seiring pertambahan waktu. Hingga pada menit ke 30, tercapai waktu optimum untuk adsorpsi zat warna rhodamin B. Pada menit ke 45
rhodamin B yang teradsorpsi semakin
berkurang. Zat warna rhodamin B menunjukkan penurunan adsorpsi yang sangat tajam karena jika waktu kontaknya lebih dari 30 menit, maka akan terjadi penurunan adsorpsi. Waktu kontak yang digunakan untuk perlakuan selanjutnya adalah 30 menit untuk zat warna rhodamin B.
Kapasitas Adsorpsi
Penentuan kapasitas adsorpsi dari adsorben yang digunakan dapat ditentukan dengan mengamati pola adsorpsi oleh adsorben yang
diinteraksikan dengan larutan zat warna
rhodamin B dengan variasi konsentrasi awal. Pada penelitian ini digunakan variasi konsentrasi awal yaitu 20, 40, 60, 80, dan 100 ppm.
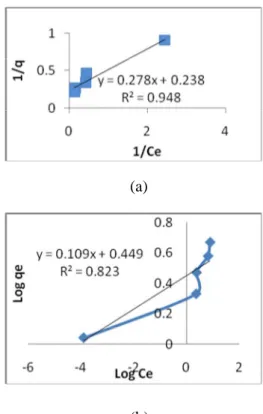
Kapasitas adsorpsi dari adsorben ditentukan dengan persamaan isoterm Langmuir dan isoterm Freundlich. Perbandingan antara banyaknya zat warna rhodamin B yang teradsorpsi oleh humin dalam penelitian ini disajikan pada Gambar 7.
(a)
(b)
Gambar 7 Grafik linierisasi isoterm Langmuir dan Freundlich untuk zat warna rhodamin B: (a) isoterm Langmuir untuk zat warna rhodamin B, (b) isoterm Freundlich untuk zat warna rhodamin B.
Asumsi dasar model isoterm Langmuir adalah
pembentukan adsorbat monolayer pada
permukaan luar media. Setelah itu tidak terjadi penyerapan lebih lanjut. Langmuir menjelaskan bahwa pada permukaan adsorben terdapat situs aktif yang jumlahnya sebanding dengan luas permukaan adsorben, sehingga bila situs aktif pada permukaan adsorben telah jenuh oleh zat warna, maka penambahan konsentrasi tidak lagi dapat meningkatkan kemampuan adsorpsi dari adsorben tersebut.
Model Freundlich menunjukkan tingkat heterogenitas permukaan media. Persamaan Freundlich menyatakan distribusi energi dari situs adsorpsi lebih bertipe eksponensial dari pada tipe seragam sebagaimana diasumsikan
pada model Langmuir. Isoterm adsorpsi
Freundlich terjadi secara fisika dan cenderung
membentuk multilayer pada permukaan
adsorben. Persamaan Freundlich tidak berlaku jika konsentrasi adsorbat terlalu tinggi.
Adsorpsi terbesar zat warna dengan menggunakan adsorben humin sesuai dengan proses adsorpsi Langmuir. Hal ini ditunjukkan dengan nilai R2 > 0,9 sehingga kapasitas adsorpsi (qm) dapat ditentukan secara langsung dengan isoterm Langmuir. Gambar 10. di atas
menunjukkan bahwa adsorpsi zat warna
rhodamin B menggunakan adsorben humin sesuai dengan pola adsorpsi Langmuir, karena kurva yang diperoleh cenderung menunjukkan suatu hubungan garis lurus, berarti pada permukaan adsorben terdapat situs-situs aktif yang bersifat homogen yang jumlahnya proporsional dengan luas permukaan. Masing-masing situs aktif hanya dapat mengadsorpsi satu molekul adsorbat saja sehingga adsorpsi hanya akan terbatas pada pembentukan lapisan tunggal (monolayer). Hal ini ditunjukkan dengan nilai R2 > 0,9 sehingga kapasitas adsorpsi (qm) dapat ditentukan secara langsung dengan isoterm Langmuir. Dari data penelitian maka didapatkan nilai kuadrat terkecil dimana nilai R2 yang diperoleh untuk model isotermal Langmuir pada rhodamin B sebesar 0,948 dengan nilai kolerasi (r) sebesar 0,973.
Berdasarkan persamaan Langmuir dapat diperoleh nilai konstanta kesetimbangan (K) dan kapasitas adsorpsi maksimum (qm), dimana harga K dan qm diperoleh dari intersep dari lereng pengaluran 1/Ce terhadap 1/Ceq. Hasil perhitungan untuk zat warna rhodamin B diperoleh nilai K sebesar 0,856 mg/g dan qm
sebesar 4,201 mg/g. Kapasitas adsorpsi
rhodamin B adalah 4,201 mg/g.
KESIMPULAN
Berdasarkan hasil penelitian di atas dapat disimpulkan bahwa:
1. Adsorpsi zat warna rhodamin B oleh humin
mencapai optimum pada pH 2.
2. Adsorpsi rhodamin B oleh humin mencapai
optimum pada waktu kontak 30 menit.
3. Kapasitas adsorpsi rhodamin B oleh humin
adalah sebesar 4,201 mg/g.
UCAPAN TERIMAKASIH
Ucapan terimakasih disampaikan kepada Dita Amilia Khusnaria yang telah membantu penelitian ini.
DAFTAR PUSTAKA
1 Vimonses, V., S. Lei., B. Jin., C. W. Chow., and C. Saint. 2009. Adsorption of Congo Red by Three Australian Kaolins. Appl. Clay Sci., 43: 465-472.
2 Gupta, V. K., A. Mittal., L. Krishnan. 2006. Adsorption Treatment and Recovery of the Hazardous Dye, Brilliant Blue FCF, Over
Bottom Ash and De-oiled Soya. Colloid
Interface Sci. 293: 16-26.
3 Stevenson, F.S. 1982. Humus Chemistry”:
Genesis, Composition, Reaction, 1st ed., John Wiley and Sons, New York.
4 Aiken G.R., D.M. McKnight., R.L. Wershaw.,
dan P. MacCarthy. 1985. Humic Subtances in
Soil, Sediment and Water : Geochemistry,
Isolation, and Characterization), An
Introduction John Wiley & Sons, New York.
5 Hastomo, A.E. 2008. Analisis Rhodamin B
dan Metanil Yellow di Kotamadya Surakarta dengan Metode Kromatografi Lapis Tipis.
Laporan Penelitian Fakultas Farmasi
Universitas Muhammadiyah, Surakarta. 6 Amri, A., Supranto dan M. Fahrurozi. 2004.
Kesetimbangan Adsorpsi Optional Campuran Biner Cd(II) dan Cr(III) dengan Zeolit Alam
Terimpregnasi 2-Merkaptobenzotiazol.
7 Bird, T. 1987. Kimia Fisik untuk Universitas. PT. Gramedia. Jakarta
8 Umaningrum, D., D. Ariani., & D. R. Mujiyanti. 2006. Isolasi Humin Dari Tanah Gambut Dan Aplikasinya Sebagai Adsorben
Zat Warna Methilene Blue. Laporan
Penelitian FMIPA Jurusan Kimia Universitas Lambung Mangkurat, Banjarbaru.
9 Alimin, 2005. Fraksinasi Asam Humat dan Pengaruhnya Pada Kelarutan Ion Logam
Seng (II) Dan Kadmium (II). Jurnal ILMU