BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Elektrokimia
Sel Volta
Sel Volta adalah sel elektrokimia yang menghasil-kan arus listrik sebagai akibat terjadinya reaksi pada kedua elektroda secara spontan
Misalnya : sebatang logam seng tercelup dalam larutan seng sulfat dan sebatang logam tercelup dalam larutan tembaga sulfat
Logam seng mempunyai
kecenderungan untuk melarut sebagai ion seng, Zn 2+, tetapi sebaliknya ion seng dalam larutan mempunyai kecende-rungan untuk mengendap sebagai atom Zn.
▸ Baca selengkapnya: aki merupakan sel elektrokimia yang digunakan sebagai sumber arus. elektroda pada sel aki berupa…
(2)BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Kecenderungan Zn untuk melarut > daripada kecenderungan Zn2+ untuk mengendap. (kesetimbangan kanan)
Kecenderungan Cu2+ untuk
mengendap sebagai Cu > daripada kecenderungan Cu untuk melarut
Cu Cu2+ + 2e ... 2)
Kedudukan kesetimbangan agak ke kiri + + + + + + + + +++++++ -Zn -+ -+ + + + + + + Cu
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Jika kedua elektroda itu digabungkan menjadi sel volta (gambar di bawah ini)
Jembatan garam + Cu e -Zn Zn2+ SO4 2-Cu2+ SO4 2 -
-BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Kelebihan elektron pada elektroda Zn akan mengalir ke elektroda Cu dimana terdapat kekurangan elektron, maka Zn akan terus melarut menghasilkan elektron, sedangkan ion-ion Cu2+ akan terus mengendap sebagai Cu.
Elektroda Zn terdapat kelebihan elektron, jadi polaritas elektroda ini adalah (-); Elektroda ini disebut Anoda, karena di sini terjadi setengah reaksi Oksidasi
Zn Zn2+ + 2e
Polaritas elektroda Cu yang kekurangan elektron adalah (+); Elektroda ini disebut Katoda, karena disini terjadi setengah-reaksi Reduksi.
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Jumlah dari kedua setengah reaksi ini reaksi sel ;
Cu2+ + 2e Cu
Zn Zn2+ + 2e
Zn + Cu2+ Zn2+ + Cu ... (3)
Arus listrik yang dihasilkan pada sel di atas adalah karena reaksi (3) di atas. Jembatan garam yang digunakan pada pem-buatan sel di atas adalah sebuah pipa berbentuk U yang berisi elektrolit (biasanya KCl atau KNO3)
dan agar-agar padat
Alat ini biasanya digunakan untuk membuat kontak listrik antara dua larutan elektrolit dalam sel volta
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Lebih sederhana ialah dengan menggunakan secarik kertas saring yang sebelumnya dicelupkan ke dalam larutan pekat KCl.
A.
Cara penulisan sel Volta
Menurut perjanjian sel ini ditulis sebagai berikut :
Zn | Zn2+ || Cu2+ | Cu ... (4)
Elektroda negatif (anoda) ditulis di sebelah kiri
Elektroda positif (katoda) ditulis di sebelah kanan.
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Tanda | menyatakan perbatasan antara dua fasa yang berbeda Tanda || khusus digunakan untuk
menunjukkan penggunaan “jembatan garam” dalam mengadakan hubungan listrik antara dua larutan elektrolit.
Jika hubungan ini dibuat melalui suatu dinding berpori maka perbatasan antara kedua larutan itu tidak dinyatakan dengan tanda || melainkan dengan memakai tanda I
B. Cara menurunkan reaksi sel
Tiap reaksi sel merupakan reaksi redoks, maka Reaksi sel = jumlah setengah reaksi oksidasi dan reduksi.
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Reaksi sel = Reaksi pada anoda +
Reaksi pada katoda
………(5) Untuk sel (4)
Oksidasi (pada Anoda) : Zn Zn2+ + 2e
Reduksi (Pada Katoda) : Cu2+ + 2e Cu
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
C. Hubungan antara potensial sel
dan potensial elektroda
Esel = Ekatoda - Eanoda ...(6a)
Bila zat-zat dalam larutan berada dalam Keadaan standard yaitu pada konsentrasi 1 molar, maka
Eselo = E o katoda - E o anoda ...(6a) = E o + - E o +
Jika seandainya sel (4) ditulis sebagai Cu | Cu2+ || Zn2+ | Zn ... (7)
Reaksi sel yang diturunkan menurut persamaan (5)
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Oksidasi : Cu
Reduksi : Zn2+ + 2e
Cu2+ + 2e
Zn
Reaksi sel : Cu + Zn 2+ Cu2+ + Zn ... (8)
Reaksi ini tidak spontan, artinya tidak terjadi dengan sendiri, dan potensial dari sel yang ditunjukkan oleh persamaan (7) adalah negatif.
Reaksi (8) hanya dapat terjadi jika dialirkan arus listrik dari luar, sehingga sel berfungsi sebagai sel elektrolisis.
D. Elektroda Pembanding
Beda potensial dapat diukur dengan perbedaan antara dua buah elektroda (potensial sel)
Untuk dapat memberikan harga tertentu pada potensial elektroda,
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
maka didefinisikan elektroda hidrogen
standar sebagai elektroda
pembanding, potensial diberi harga 0 volt
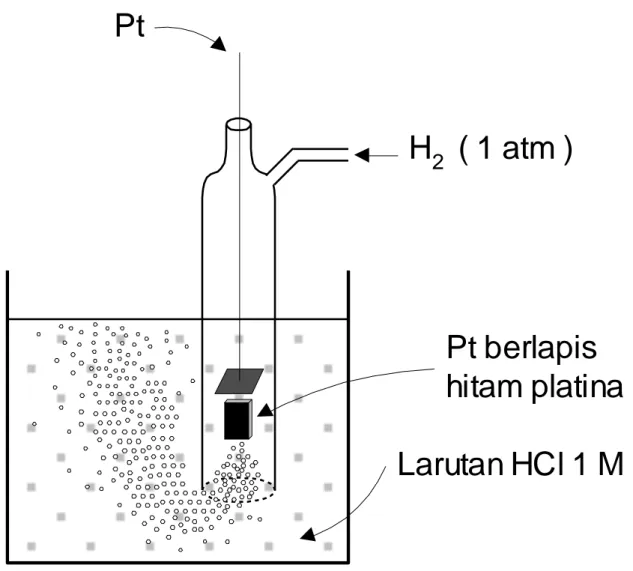
Elektroda hidrogen standar terdiri atas logam platina berlapis hitam platina, tercelup dalam la-rutan yang mengandung ion H+ pada konsentrasi 1,0 M & dialiri gas hidrogen pada tekanan 1 atm
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Pt
H2 ( 1 atm )
Pt berlapis hitam platina Larutan HCl 1 M
Gambar 3 Elektroda hidrogen standar Pt | H2 (1 atm) | H+ (1 M)
Potensial setiap elektroda dapat
ditentukan de-ngan cara
menggabungkannya dengan elektroda hidrogen standar dan potensial dari
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
sel yang diperoleh diukur berdasarkan persamaan (6) potensial elektroda itu kemudian dihitung. Contoh : V 0,34 = E 0 -E 34 , 0 E E = ) (25 V 0,34 = E Cu, | M) (1 Cu | M) (1 H || atm) (1 H | V 0,76 -= E E -0 76 , 0 E -E = ) (25 V 0,76 = E Pt, | atm) (1 H | M) (1 H || M 1 Zn | | | | + 2 + 2 | | | 2 + + 2 2 2 2 2 2 2 2 2 Cu Cu Cu Cu H Cu Cu Zn Zn Zn Zn Zn Zn H E C Pt E C Zn
Uraian di atas dapat disimpulkan :
Potensial dari setiap elektroda x ialah potensial dari sel yang dibentuk dari elektroda ini dan elektroda hidrogen standar, dengan elektroda x ditulis di sebelah kanan.
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Elektroda H2 standar || Elektroda x
………….. (9) E = E - E E = E - 0 E = E sel x sel x x sel H2
Karena elektroda x ditulis di sebelah kanan (kato-da) maka potensial elektroda, menurut definisi di atas adalah untuk reaksi reduksi
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Elektroda Pembanding Kalomel
Elektroda hidrogen standar tidak mudah dibuat, sehingga kurang praktis maka digunakan elektrodakalomel sebagai elektroda
pembanding.
Potensial dari elektroda ini sebagai berikut :
Hg | Hg2Cl2 (s) | KCl (aq)
Bergantung pada konsentrasi larutan KCl yang digunakan.
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Elektroda Kalomel 0,1 M Hg | Hg2Cl2 (s) | KCl (0,1 M) E = 0,3338 - 7,5 x 10-5 (t - 25) ……….. (10a) Elektroda Kalomel 1,0 M Hg | Hg2Cl2 (s) | KCl (1,0 M) E = 0,2800 - 2,4 x 10-4 (t - 25) ……….. (10b)
Elektroda Kalomel jenuh
Hg | Hg2Cl2 (s) | KCl (jenuh)
E = 0,2415 - 7,6 x 10-4 (t - 25) ……….. (10c)
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Dua bentuk konstruksi elektroda kalomel seperti gambar di bawah ini
Hg Hg + Hg2Cl2 KCl Kapas Hg Hg + Hg2Cl2 KCl Kapas
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Cara Pengukuran Potensial Sel
Kedua elektroda dalam sel volta diukur pada arus nol (rangkaian terbuka) daya gerak listrik sel.Voltmeter Potensiometer
Berdasar metode kompensasi Poggendorff
Memberikan harga lebih kecil dari pada daya gerak listrik sel
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Ketergantungan Potensial pada
konsentrasi
Persamaan Nernst - G = n F E atau
G = - n F E …………. (11)
E dalam volt
F = tetapan Faraday dalam Coulomb = 96500 coulomb G = Energi dalam satuan Joule
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Energi bebas :
G = G RT ln C D A B ... (12) c d a b Go = perubahan energi bebas standar
R = tetapan gas = 8,31 JK-1 mol-1
[A], [B], …. = konsentrasi zat A, B, …. Substitusikan persamaan (11) ke dalam persamaan (12) memberikan
- n F E = - n F E + RT ln C D A B E = E - RT nF ln C D A B ... (13) c d a b c d a b atauBINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Persamaan ini menyatakan
kebergantungan potensial E pada konsentrasi, dikenal sebagai persamaan NERNST. Harga n dalam persamaan tersebut adalah = jumlah elektron yang dipertukarkan.
Soal 1
Hitung potensial dari elektroda Zn | Zn2+ (0,1 molar) dan dari elektroda Cu | Cu2+ (0,01 molar) pada 25 C
Soal 2
Hitung potensial dair sel Zn | Zn2+ (0,1 m) || Cu2+ (0,01 m) | Cu pada 25 C
Potensial standar, Eo ada
hubungannya dengan tetapan
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Jika suatu reaksi mencapai kesetimbangan pada suhu dan tekanan tertentu, maka G = 0 dan persamaan (12) ditulis sebagai
0 = G RT ln C D A B G = - RT ln C D A B c d a b c d a b atau, G = - RT ln K ... (14) K = tetapan kesetimbangan Bagi zat-zat dalam larutan dalam keadaan standar G = Go dan E = Eo sehingga persamaan (11) mengambil bentuk
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Jika persamaan ini kemudian disubstitusikan ke dalam persamaan (14) didapat
E = RT
nF ln K ... (16) K = tetapan kesetimbangan
Berbagai Jenis Elektroda
Tiap sel Volta terdiri atas dua buah elektroda atau setengah - sel.
Beberapa jenis elektroda yang penting A. Elektroda logam - ion logam
Elektroda jenis ini terdiri atas sebuah logam aktif yang tercelup dalam larutan yang mengandung ionnya sendiri. Potensialnya bergantung pada konsentrasi ion ini.
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
B. Elektroda Gas
Yang paling penting dari elektroda jenis ini elektroda hidrogen : Pt | H2
| H+
Dapat digunakan untuk
menentukan pH larutan, karena potensi
C. Elektroda logam - garam tak larut Elektroda jenis ini terdiri atas logam berlapis. Salah satu garamnya yang sukar larut dan tercelup dalam larutan yang mengandung anion garam tersebut.
D. Elektroda membran
Salah satu elektroda membran penting adalah elektroda gelas yang banyak dipakai dalam pengukuran pH larutan.
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Jenis-jenis sel Volta
Bergantung pada kombinasi kedua elektrodanya dapat dibedakan dua jenis sel Volta
A. Sel kimia
B. Sel konsentrasi
Sel kimia, dibentuk dari dua elektroda yang berbeda jenisnya; Sel ini disebut sel kimia oleh karena reaksi selnya adalah reaksi kimia
A. Sel kimia dengan dua larutan elektrolit
B. Sel kimia dengan satu larutan elektrolit
Sel konsentrasi digunakan dua elektroda yang sama, tetapi dengan
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
konsentrasi larutan elektrolitnya yang berbeda
A. Sel konsentrasi dengan satu larutan elektrolit
B. Sel konsentrasi dengan dua larutan elektrolit
Sel Volta sebagai sumber energi A. Sel primer
B. Sel sekunder
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Elektrolisis
1. Reaksi-reaksi pada elektroda
Sel elektrolisis arus listrik bagi suatu sumber dari luar sel dialirkan ke dalam larutan di dalam sel.Ion-ion positif (kation) ke arah elektroda negatif (katoda)
Ion-ion negatif (anion) ke arah elektroda positif (anoda)
Kedua elektroda terjadi reaksi kimia akibat dari pada proses perpindahan elektron
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Peristiwa reduksi : Proses terjadinya absorpsi elektron oleh ion positif atau oleh air
Peristiwa oksidasi : Proses terjadinya pelepasan elektron
Reaksi Redoks (Reduksi - Oksidasi) bergantung pada berbagai faktor :
Keadaan dan jenis elektrolit dalam sel
Jenis elektroda yang digunakan
Beda potensial listrik antara kedua elektroda
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
2. Elektrolisis leburan elektrolit
Elektrolisis ini penting dalam pembuatan logam-logam aktif, seperti Na, Mg dan Al
Pada elektrolisis MgCl2, terjadi
reaksi-reaksi sebagai berikut :
Oksidasi : Reduksi : Reaksi Sel : 2Cl- Cl2 + 2e Mg2+ + 2e Mg MgCl2 Mg + Cl2
Pada pembuatan logam Al, digunakan larutan Al2O3, dalam Na3AlF6 (Kriolit)
Elektrolisis dilakukan pada 850 oC Grafit sebagai kedua elektroda
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Reaksi-reaksi yang terjadi
Oksidasi : Reduksi : Reaksi Sel :
6O2- 3O2 + 12e 4Al3+ + 12e 4Al
2Al2O3 4Al + 3O2
3. Elektrolisis larutan elektrolit
Keadaan di sini lebih rumit, oleh karena adanya molekul-molekul pelarut yang dapat pula dioksi-dasi (pada anoda) atau direduksi (pada katoda)
Jadi pada masing-masing elektroda terdapat beberapa kemungkinan reaksi
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
a. Elektrolisis HCl : oksidasi : 2Cl- Cl
2 + 2e
(elektroda lamban) : reduksi : 2H+ + 2e H2
b. Elektrolisis HCl : oksidasi : 2Cl- Cl
2 + 2e
(elektroda lamban) : reduksi: 2H2O + 2e H2 +
2OH
-c. Elektrolisis NaCl : oksidasi : 2Cl- Cl2 + 2e
(anoda, grafit, : reduksi : Na+ + e Na katoda merkuri)
d. Elektrolisis K2SO4 : oksidasi : 2H2O 4H+ +
O2 + 4e
(elektroda lamban) : reduksi : 2H2O + 2e
H2 + 2OH
-e. Elektrolisis AgNO3 : oksidasi : 2H2O 4H+ +
O2 + 4e
(elektroda lamban) : reduksi : Ag+ + e Ag f. Elektrolisis AgNO3 : oksidasi : Ag Ag+ + e
(anoda perak, reduksi : Ag+ + e Ag katoda perak)
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Dari contoh-contoh tersebut bahwa tidak selalu terjadi reduksi atau oksidasi dari ion-ion dalam larutan, terutama kation logam-logam aktif (Na+, K+, Mg2+) dan anion yang mengandung oksigen (SO42-, NO3-,
PO43-). Hal ini disebabkan karena
reduksi atau oksidasi dari zat-zat ini disertai dengan energi aktivasi yang tinggi sehingga reaksi-reaksi relatif lebih sulit terjadi.
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
4. Banyaknya reaksi yang terjadi
Menurut Faraday, massa zat yang dihasilkan atau yang bereaksi dalam elektrolisis. Berbanding lurus dengan jumlah muatan listrik yang lewat dalam larutan
Berbanding lurus dengan berat atom atau berat molekul zat terlarut
Berbanding terbalik dengan jumlah elektron per mol yang diperlukan untuk menimbulkan perubahan bilangan oksidasi yang terjadi.
Jumlah muatan listrik yang lewat
Q = I t Coulomb I = kuat arus dalam Ampere
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Jika A menyatakan berat atom atau berat molekul dan n ialah jumlah mol elektron yang diperlukan per mol zat yang bereaksi atau dihasilkan, maka
W W A I t n = A I t n F ... (17)
W = massa zat yang bereaksi/dihasilkan (gram)
1
= tetapan perbandingan F
Harga F dapat ditentukan Ag+ + e Ag
Ditemukan bahwa muatan listrik 1 Coulomb (1 Ampere yang mengalir selama 1 detik)
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Pada contoh ini :
A = 107,868 ; I = 1 ampere ; t = 1 detik n = 1 ; W = 1,11800 x 10-3 g
Menurut persamaan di atas
111800 1 1 1 , x 10 = 107,868 F = 96483 Coulomb F = 96500 Coulomb F = tetapan Faraday -3 F 5.
Penggunaan Elektrolisis
Elektrolisis adalah proses yang penting sekali dalam industri, terutama di negara-negara yang dapat menyediakan tenaga listrik dengan murah.
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Proses ini digunakan, misalnya dalam pembuatan logam-logam natrium,
magnesium atau alumi-nium,
pembuatan hidrogen peroksida, Kalium kromat, gas hidrogen dan klor, dan sejumlah besar zat-zat lainnya.
Gas hidrogen yang dibuat dengan proses elektrolisis sangat murni dan oleh karenanya sangat baik untuk digunakan dalam proses hidrogenasi minyak dalam pembuatan margarin. Proses elektrolisis juga banyak dipakai dalam “electroplating” dimana permukaan suatu logam dilapisi dengan logam lain yang lebih mulia; misalnya besi dapat dilapisi dengan nekel, tembaga dan krom. Proses pelapisan ini dikerjakan untuk
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
melindungi logam terhadap korosi atau dengan tujuan dekoratif.
Aplikasi penting lainnya adalah dalam pemurnian logam-logam tertentu, misalnya pemurnian tembaga untuk dipakai sebagai kabel penghantar arus listrik.
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Peristiwa korosi dan cara
pencegahannya
1. Korosi sebagai peristiwa
elektrokimia
Pada dasarnya proses korosi adalah proses per-pindahan elektron, jadi merupakan proses redoks.
Korosi secara elektrokimia terjadi jika pada sistem korosi terdapat bagian-bagian yang dapat berperan sebagai anoda maupun sebagai katoda dalam
lingkungan yang mengandung
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
- + Cu Zn e Zn2+ Cu2+ Cu2+ + 2e Zn Zn2+ +2e Cu
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
2. Korosi yang disertai absorpsi
oksigen
Tiap proses korosi terdiri atas dua proses yaitu
Oksidasi pada pusat anoda
Reduksi pada pusat katoda
Kedua proses ini terjadi bersamaan Oksidasi merupakan pelarutan logam Dalam lingkungan netral atau basa terdapat kemungkinan reduksi dari air, 2 H2O + 2e H2 + 2OH-
Reaksi ini tidak terjadi dalam jumlah yang berarti oleh karena pada umumnya pembentukan gas hidrogen pada permukaan logam tidak berlang-sung dengan mudah.
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Jika dalam larutan terdapat oksigen, maka reaksi reduksi
2 H2O + O2 + 4e 4OH-
akan terjadi jauh lebih mudah.
3. Korosi karena reaksi
diferensial
Sekalipun tidak terdapat pusat-pusat katoda pada permukaan besi berupa logam yang relatif lebih mulia, namun korosi dapat berlangsung jika kon-sentrasi oksigen pada bagian-bagian permukaan tidak sama
Sebatang logam besi yang dicelupkan vertikal ke dalam air mengalami korosi pada ujung yang tercelup.
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Berdasarkan persamaan Nernst, potensial dari suatu elektroda di mana terjadi reaksi
2 H2O + O2 + 4e 4OH-
Bergantung pada tekanan gas oksigen
E PO = E - RT 4F ln OH = E - RT 4F ln OH + RT 4F ln PO -2 4 2BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Udara Air Pusat Katoda 2H2O + O2 + 4e 4OH -Pusat Anoda Fe Fe2+ + 2e a Korosi mulai di sebelah bawah
{
{
4. Cara-cara pencegahan korosi
Mencegah kontak antara logam dan lingkungan yang dapat menyebabkan korosi dapat dilakukan dengan mengecat permukaan logamLapisan cat harus menutupi permukaan logam dengan sempurna, tidak berpori dan tidak mudah rusak.
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Cara lain, melapisi permukaan logam dengan logam lain
Contoh : Besi dilapisi dengan Seng, Timah atau Krom
Pelapisan dengan Krom tujuannya dekoratif
Pelapisan dengan seng dikenal sebagai proses Galvanisasi, lebih efektif daripada pelapisan dengan timah.
Metode lain dalam pencegahan korosi ialah
Dengan cara mencegah terjadinya reaksi pada pusat anoda atau
Pada pusat katoda dengan menggunakan inhibitor
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Inhibitor Anodik : Zat pengoksidasi seperti nitrit, nitrat, kromat atau dikromat. Inhibitor Katodik : Mempengaruhi
reaksi pada katoda
Proteksi Katodik : Cara lain dalam pencegahan korosi.
Cara ini banyak
digunakan untuk
melindungi pipa-pipa besi dalam tanah. Pipa yang dilindungi itu dihubungkan dengan logam yang lebih aktif dari besi.
BINA NUSANTARA
Edisi : 1 Revisi : 2 Sept - 1999
Contoh : Korosi besi dalam lingkungan netral yang mengandung oksigen
Permukaan besi selalu mengandung zat-zat asing dalam bentuk atom logam yang relatif lebih mulia, misalnya tembaga, yang dapat berperan sebagai pusat-pusat katoda dalam proses korosi.
Proses korosi diawali dengan pelarutan besi menjadi ion besi (Fe2+). Elektron-elektron yang dilepaskan tertarik pada pusat-pusat katoda (Cu) dan di sini terjadi reduksi yang melibatkan air dan oksigen terlarut.
BINA NUSANTARA
Edisi : 1 Revisi : 0 Sept - 2005
Ion OH- yang dihasilkan berdifusi ke dalam larutan dan bereaksi dengan ion Fe2+ membentuk Fe(OH)2 yang
kemudian mengendap pada
permukaan besi.
Endapan ini berwarna hijau muda dapat teroksidasi lebih lanjut (jika persediaan oksigen cukup) menjadi besi oksidasi terhidrasi yang dikenal sebgai karatan besi dengan warnanya yang khas yaitu merah coklat.
A. Fe Fe2+ + 2e
B. Fe2+ + 2OH- Fe(OH)
2 (endapan hijau)
C. 4Fe(OH)2 + O2 2H2O + 2Fe2O3.H2O