Deskripsi Domba Priangan
Pada umumnya, domba diusahakan oleh peternak di pedesaan dalam jumlah kecil sekitar 3−5 ekor per keluarga. Sistem pemeliharaannya dilaksanakan secara tradisional yang dicirikan dengan pemeliharaan, perkandangan, dan penyediaan makanan yang serba sederhana, padahal sistem pemeliharaan memberi pengaruh yang besar pada produktivitas dan pengembangan usaha ternak. Sistem pemeliharaan tradisional akan menghasilkan pertumbuhan produksi domba yang sangat lambat. Sistematika klasifikasi domba (Ovis aries) adalah sebagai berikut.
Kingdom : Animalia Filum : Chordata Kelas : Mamalia Ordo : Artodactyla Famili : Bovidae Genus : Ovis Spesies : Ovis aries
Menurut Sudarmono dan Sugeng (2005), di Indonesia terdapat berbagai tipe domba, yaitu
1. Domba asli Indonesia atau disebut dengan domba kampung atau lokal. Ciri-cirinya, berbadan kecil, lambat dewasa, warna bulu tidak seragam, dan karkasnya rendah.
2. Domba priangan atau disebut dengan domba garut yang merupakan persilangan antara domba asli, merino, dan ekor gemuk dari Afrika Selatan. Domba priangan banyak terdapat di Garut sebagai domba laga dengan ciri-ciri sebagai berikut: mempunyai tubuh besar dan lebar (60 kg untuk jantan dan 35 kg untuk betina); jantan bertanduk dan melengkung ke belakang; daun telinga ramping; warna bulu kombinasi putih hitam dan cokelat atau warna campuran.
3. Domba ekor gemuk banyak terdapat di Jawa Timur, Madura, Sulawesi, dan Lombok. Ciri-cirinya, bentuk badan besar (50 kg untuk jantan dan 40 kg
untuk betina), bertanduk pada yang jantan, dan berekor panjang (pada bagian pangkalnya besar dan menimbun lemak yang banyak, ujung ekornya kecil tidak berlemak).
Domba garut merupakan plasma nutfah domba di Indonesia. Populasi domba garut di Kabupaten Garut mencapai 405 369 ekor dengan rincian 81 644 ekor anak domba, 92 189 ekor domba muda, dan 231 546 ekor domba dewasa (DPPK 2006). Populasi domba di Indonesia pada 2005 adalah sebesar 8 306 928 ekor (Dirjennak 2005). Jika diperhatikan pada angka populasi domba tersebut, maka Kabupaten Garut menyumbang angka sebesar 4.89% pada populasi nasional. Angka tersebut amat kecil sehingga persentase penyumbangan terhadap populasi nasional masih perlu ditingkatkan. Hastono dan Masbulan (2001) menyatakan bahwa salah satu cara untuk meningkatkan produktivitas ternak domba dengan cara meningkatkan efisiensi reproduksi ternak.
Tipe kelahiran berpengaruh pada bobot lahir anak domba baik jantan maupun betina. Bobot lahir pada kelahiran tunggal baik jantan maupun betina lebih besar jika dibandingkan dengan bobot lahir pada tipe kelahiran kembar (Dedi 2006). Hal ini disebabkan oleh volume uterus induk terbatas. Apabila di dalam uterus terdapat lebih dari satu fetus, maka pertumbuhannya agak terganggu karena keterbatasan jumlah makanan dan ruang yang tersedia. Hasil penelitian Dedi (2006) di Kelompok Peternakan Margawati Garut menunjukkan bahwa bobot lahir anak domba jantan dengan tipe kelahiran tunggal, kembar, dan triplet masing-masing sebesar 2.81+0.54, 1.90+0.25, dan 1.40+0.15 kg, sedangkan pada anak domba betina masing-masing sebesar 2.49+0.47, 1.61+0.27, dan 1.25+0.15 kg.
Anatomi Sistem Reproduksi Hewan Betina
Sistem alat reproduksi hewan betina secara umum terdiri atas dua buah indung telur (ovarium), dua buah tuba fallopii (fallopian tube) atau oviduk, uterus, serviks, vagina, dan vulva, seperti yang terdapat pada Gambar 1. Pada mamalia, indung telur selalu sepasang dan ukurannya bergantung pada umur dan keadaan saluran reproduksi hewan betina tersebut.
Gambar 1 Anatomi sistem reproduksi domba betina (Toelihere 1981).
Pada Gambar 1 terlihat bahwa ovarium adalah organ esensial reproduksi pada betina yang mempunyai dua fungsi, yaitu organ endokrin (menghasilkan hormon estrogen dan progesteron yang langsung diserap oleh pembuluh darah) dan eksokrin atau sitogenik (menghasilkan sel telur atau ovum yang dilepaskan dari kelenjar). Ovarium merupakan kelenjar yang terdiri atas ovarium kanan (di belakang ginjal kanan) dan ovarium kiri (di belakang ginjal kiri). Ovarium pada domba betina berbentuk oval dengan diameter sekitar 5.0−10.0 mm (Toelihere 1981 dan Wodzicka-Tomaszewska et al. 1991). Ovarium terdiri atas zona veskular (medulla) dan zona parenkima. Telur (ovum) dihasilkan oleh ovarium melalui ovulasi pada masa pubertas. Peristiwa pembetukan, pertumbuhan, dan pematangan gamet betina disebut dengan oogenesis yang terjadi secara periodik. Telur yang dilepaskan dari ovarium akan diterima oleh infundibulum kemudian dibawa ke tuba falopii untuk melakukan proses pembuahan yang disebut dengan fertilisasi. Ovum yang sudah dibuahi dibawa ke dalam uterus dan berkembang menjadi embrio, kemudian menjadi fetus, akhirnya keluar dari uterus melalui vagina dan vulva sebagai anak (neonat).
Tuba falopii Ovari Cornua uteri Corpus uteri Cervix Vagina
Tuba fallopii mempunyai panjang sekitar 15.0−19.0 cm dan berbentuk kelok-kelok. Tuba fallopii terbagi menjadi (a) infundibulum yang merupakan perluasan ujung ovarium dan terdapat fimbriae yang membungkus sebagian atau seluruh ovarium pada waktu ovulasi; (b) ampulla yang merupakan bagian tengah dari oviduk tempat terjadinya pembuahan; (c) isthmus yang merupakan bagian akhir dari oviduk yang terbuka langsung ke bagian ujung runcing uterus. Dinding tuba falopii terdiri atas mukosa, muskulator, dan selaput serosa di bagian luar. Mukosa terdiri atas sel-sel epitel permukaan, serabut-serabut otot, dan suatu jaringan ikat di bawahnya yang mengandung pembuluh darah dan limfe. Saluran darah untuk tuba falopii datang dari A. utero-ovariumi. Pada saat ovulasi, ovum didorong ke dalam ujung oviduk yang berfimbriae. Kapasitas sperma, fertilisasi, dan pembelahan embrio terjadi di dalam tuba falopii. Perjalanan sperma ke tempat fertilisasi dan pengangkutan ovum ke uterus untuk perkembangan selanjutnya diatur oleh cilier dan kontraksi muskular yang diatur oleh hormon-hormon estrogen dan progesteron. Cairan lumen tuba falopii merupakan lingkungan yang baik untuk terjadinya fertilisasi dan permulaan perkembangan embrio. Cairan ini disekresi secara aktif dari lapisan epitel tuba dan kadarnya diatur oleh hormon-hormon yang dihasilkan ovarium. Hormon-hormon yang dihasilkan ovarium ini memegang peranan penting dalam pengaturan metabolisme uterus (Toelihere 1981).
Uterus adalah suatu struktur saluran berotot yang diperlukan untuk penerimaan ovum yang telah dibuahi, penyediaan nutrien, dan perlindungan fetus. Fungsi uterus, yaitu (1) sebagai media pengangkutan sperma ke tuba falopii dengan cara kontraksi, (2) mengandung cairan uterus sebagai medium yang bersifat suspensi bagi blastocyt (sebelum implantasi), (3) menjadi tempat pembentukan plasenta dan perkembangan fetus (sesudah implantasi). Uterus terdiri atas dua tanduk (kornua) yang menggulung dengan panjang sekitar 10.0−12.0 cm, badan (korpus) berukuran sekitar 1.0−4.0 cm, dan leher (serviks). Kedua kornua digabung oleh suatu ligamentum ke dinding pelviks dan dinding abdomen. Sebagian kornua menggulung ke arah depan bawah, sedangkan sebagian lain ke bagian belakang uterus dilanjutkan dengan serviks yang agak menonjol ke vagina. Di bagian dalam kornua terdapat sejumlah tonjolan-tonjolan
kecil yang disebut dengan karunkula atau kotiledon yang berfungsi sebagai penghubung antara dinding uterus dan plasenta. Pada ruminansia, cornua uteri berkembang dengan baik karena sebagai tempat pertumbuhan fetus, sedangkan pada kuda terjadi di corpus uteri. Uterus meliputi endometrium (mukosa dan submukosa), miometrium (lapisan urat daging), dan perimetrium atau serosa (sebuah membran yang menjadi ligamentum lebar). Pada domba, mukosa menghasilkan musin. Lendir dari serviks menjadi lebih cair pada waktu berahi dan membentuk sumbatan selama bunting. Uterus menerima darah dari A. uterina media, A. utero ovariumi, dan satu cabang dari A. pudenda interna. Pembuluh-pembuluh darah ke uterus sangat banyak, berdinding tebal, dan berliku-liku. Sekresi uterus berupa cairan luminal uterus yang merupakan kombinasi antara plasma darah dan sekresi kelenjar uterus. Sirkulasi metabolit nutrien yang terdapat dalam induk dapat diekskresikan ke dalam sistem reproduksi dan diserapsi oleh embrio.
Cervix atau leher uterus merupakan suatu otot tubular sfingter yang sangat kuat dan terdapat antara vagina dan uterus. Dinding lebih keras, lebih tebal, dan lebih kaku daripada dinding uterus atau vagina. Dinding cervix terdiri atas mukosa, muskularis, dan serosa. Sel-sel yang menghasilkan mukus pada mucosa mempunyai permukaan sekretoris yang luas. Aktivitas sekretoris yang tertinggi ditemukan pada waktu estrus dan pada waktu berahi mukus cervix terdapat dalam keadaan yang paling encer. Panjang cervix kurang lebih 2.5−5.0 cm dan diameter 2.0-3.0 cm.
Vagina adalah organ kelamin betina dengan struktur selubung muskuler yang berada di dalam pelvis antara uterus dan vulva. Dinding vagina terdiri atas mukosa, muskularis, dan serosa. Pemberian darah dan syaraf untuk vagina datang dari cabang-cabang A. Urogenitalia dan pudenda interna, sedangkan saraf-saraf dari plexus pelvis. Vulva adalah bagian terluar saluran reproduksi yang terentang dari vagina sampai dengan bagian yang paling luar. Labia vulva ditutupi oleh bulu-bulu yang jarang untuk menjaga lubang luar saluran reproduksi.
Fisiologi Reproduksi Hewan Betina Pubertas
Pubertas adalah periode pada saat saluran reproduksi untuk pertama kalinya berfungsi. Elmer (1981) menyatakan bahwa pubertas adalah periode ketika alat-alat kelamin mulai berfungsi yang diikuti dengan munculnya tingkah laku berahi serta terjadinya ovulasi. Masa pubertas antarhewan berbeda-beda bergantung pada spesies hewan, iklim, makanan, hereditas, kesehatan, dan tingkat pelepasan hormon. Selanjutnya, Ramirez (1973) menjelaskan bahwa hewan kecil mencapai pubertas lebih cepat daripada hewan besar. Pencapaian pubertas erat kaitannya dengan bobot badan daripada umur (Hafez 1980).
Berahi
Berahi adalah suatu keadaan yang ditandai gejala keinginan dan bersedia untuk melakukan aktivitas kawin (Toelihere 1981; Hafez 1987). Pada keadaan tersebut, aktivitas ovarium meningkat dengan adanya aktivitas ovum yang mengarah ke pematangan di bawah kontrol kelenjar adenohipofisis dan folikel akan tumbuh serta berkembang menjadi folikel de Graaf; folikel tersebut menghasilkan estradiol yang menyebabkan perubahan pada saluran reproduksi (Toelihere 1981).
Siklus berahi adalah interval waktu antara permulaan estrus sampai ke permulaan estrus berikutnya. Panjang siklus berahi dipengaruhi oleh bangsa, genetik, dan lingkungan (Hafez 1980). Pada domba, siklus berahi terdiri atas fase proestrus selama 2 hari, estrus sekitar 1−2 hari, metesrus sekitar 3−5 hari, dan diestrus sekitar 7−10 hari (Toelihere 1981 dan Lindsay et al. 1982). Proestrus adalah periode pemantapan berupa pambesaran folikel, penebalan dinding vagina, dan penaikan vaskularitas uterin. Estrus adalah periode berahi ketika penerimaan seekor betina terhadap pejantan semakin tinggi dan pecahnya folikel ovarium yang dikenal dengan ovulasi. Metestrus adalah periode pembentukan korpus luteum dan terjadi perubahan pada dinding uterus serta vagina. Beberapa sifat biologis domba tertera pada Tabel 1 (Sarwono 2005).
Tabel 1 Sifat biologis domba (Sarwono 2005) Sifat biologis
1. Berahi pertama Umur 8−10 bulan 2. Perkawinan I Umur 18 bulan 3. Perkawinan II Umur 34 bulan 4. Siklus berahi 17 hari
5. Lama berahi 30 jam (3−72 jam) 6. Perkawinan* Pada waktu estrus
7. Ovulasi* 18−40 jam sesudah terjadi estrus, spontan 8. Fertilisasi* 2−3 jam sesudah ovulasi
9. Implantasi* 9−11 hari sesudah fertilisasi 10. Lama bunting 141−159 hari
11. Interval beranak 7−8 bulan sekali 12. Jumlah anak 1−4 ekor 13. Bobot lahir (tunggal) 1−4 kg
14. Pertumbuhan normal Umur 14−24 bulan 15. Dewasa tubuh Umur 18−24 bulan 16. Umur disapih 5 bulan
17. Kebiasaan merumput Pagi dan sore 18. Sifat bergerombol Besar
19. Adaptasi 0−1 000 m dpl
20. Bobot karkas 8.7 kg (ekor kurus); 11.3 kg (ekor gemuk) 21. Bobot hidup 18.8 kg (ekor kurus); 23.9 kg (ekor gemuk)
Keterangan : * Smith dan Mangkoewidjojo (1988)
Diestrus adalah periode terakhir dan terlama dari siklus berahi pada mamalia (Toelihere 1981). Diestrus ditandai dengan korpus luteum yang sudah matang, endometrium menebal, serviks menutup, lendir cairan vagina mulai kabur dan lengket, selaput mukosa memucat, serta otot uterus mengendor. Pada akhir periode ini, korpus luteum mengalami retrogresif secara perlahan-lahan dan endometrium beregresi ke ukuran semula. Kemudian, mulai terjadi perkembangan folikel primer dan sekunder, akhirnya siklus kembali ke proestrus. Hormon reproduksi hewan betina
Sekresi hormon-hormon reproduksi pada hewan betina bergantung pada fase-fase siklus berahi, yaitu proestrus, estrus, metestrus, dan diestrus. Pada fase-fase proestrus, rangsangan terhadap hipotalamus mulai ada akibat penurunan konsentrasi hormon progesteron setelah korpus luteum mengalami regresi (Edey et al. 1981; Foster et al. 1985). Adanya rangsangan pada hipotalamus akan
menghasilkan gonadotropin releasing hormone (GnRH) yang dialirkan melalui saraf ke adenohipofisis. Gonadotropin releasing hormone akan merangsang adenohipofisis menghasilkan follicle stimulating hormone (FSH) masuk ke dalam aliran darah semakin bertambah dan akan merangsang pertumbuhan dan perkembangan sel-sel granulosa dan teka folikel dalam ovarium yang akhirnya akan menghasilkan hormon estrogen (McDonald 1977). Di ovarium hormon estrogen dihasilkan oleh folikel, sedangkan hormon progesteron dihasilkan oleh korpus luteum (Frandson 1992). Selain itu, ovarium juga memproduksi hormon androgen dan testosteron. Hormon estrogen dan progesteron termasuk hormon steroid karena mempunyai struktur kimia yang berintikan steroid. Kedua hormon tersebut secara fisiologis sebagian besar diproduksi oleh kelenjar endokrin sistem reproduksi. Pada betina subur kedua hormon tersebut dihasilkan oleh ovarium dan berlangsung secara siklik. Follicle stimulating hormone berperan utama dalam pemasakan folikel, sedangkan luteinizing hormone (LH) berperan dalam ovulasi.
Estrogen
Estrogen disintesis dari kolesterol terutama di ovarium dan kelenjar lainnya (korteks adrenal, testis, dan plasenta). Biosintesis estrogen di ovarium dipengaruhi oleh FSH. Estrogen secara langsung mempengaruhi pertumbuhan dan perkembangan alat kelamin, yaitu vagina, serviks, uterus, dan tuba falopii. Kehadiran estrogen mengakibatkan sekreta kelenjar vagina dan serviks menjadi cair serta jumlahnya bertambah banyak; kelenjar dan pembuluh darah endometrium mengalami proliferasi.
Estrogen endogen terdiri atas estradiol, estriol, dan estron yang diproduksi oleh ovarium dan plasenta. Estradiol merupakan hormon yang paling banyak disekresi dan kemampuan estrogeniknya juga yang paling kuat. Konsentrasi estradiol dalam darah akan meningkat mulai fase folikuler dan mencapai puncak pada fase puncak estrus, kemudian menurun setelah ovulasi (Vallet et al. 1990). Estrogen merangsang epitel yang melapisi vagina dan vulva, aktivitas muskular dari tuba uterus, dan menaikkan kepekaan organ untuk menghasilkan progesteron. Foster et al. (1985) menyatakan bahwa peningkatan konsentrasi estrogen dalam
darah mencapai maksimal akan merangsang munculnya tingkah laku kelamin hewan betina untuk melakukan aktivitas seksual. Keadaan ini diikuti juga dengan jumlah LH mencapai puncak dalam waktu yang singkat menjelang ovulasi. Ditambahkan oleh McDonald (1977) dan Robertson (1977) bahwa menjelang akhir berahi, konsentrasi estrogen menurun dan beberapa jam kemudian akan terjadi ovulasi. Ovulasi terjadi akibat adanya rangsangan pada gonadotropin adenohipofisis sebagai respons umpan balik hormon estrogen yang disekresikan oleh folikel de Graaf.
Progesteron
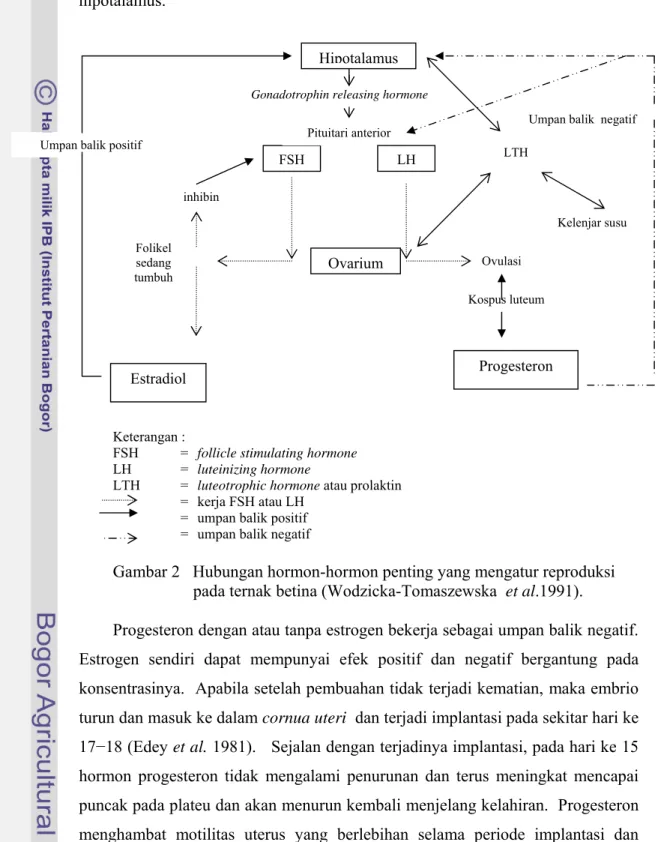
Setelah ovulasi, bagian-bagian reseptor LH pada sel granulosa ditempati oleh LH yang merangsang adenilsiklase. Pasokan darah ke dalam sel-sel granulosa meningkat sehingga sel-sel tersebut tumbuh dan membelah membentuk korpus luteum (mencapai bentuk morfologi maksimum pada sekitar hari ke tujuh setelah ovulasi). Pada hari ke empat setelah ovulasi, hormon progesteron mulai meningkat dan mencapai puncaknya pada hari ke tujuh, kemudian cepat menurun pada hari ke limabelas (Robertson 1977). Herdis (2005) menyatakan bahwa hormon progesteron meningkat setelah ovulasi. Frandson (1992) menyatakan bahwa hormon progesteron dihasilkan oleh korpus luteum (utama), korteks adrenal, plasenta, dan testis. Progesteron amat penting dalam rangka mempertahankan kebuntingan. Selama kebuntingan, progesteron menahan timbulnya ovulasi melalui inhibisi umpan balik FSH dan LH dari adenohipofisis. Progesteron dikenal dengan hormon kebuntingan karena menyebabkan penebalan endometrium dan perkembangan uterus sebelum terjadinya implantasi ovum yang dibuahi (Frandson 1992). Skema hubungan antara hormon-hormon tersebut terdapat pada Gambar 2.
Hipotalamus mensekresi GnRH yang menyebabkan dilepaskannya FSH dan LH dari hipofisis sehingga folikel mengalami pertumbuhan. Folikel menghasilkan estrogen, androgen, dan inhibin. Inhibin bekerja sebagai umpan balik negatif terhadap FSH saja, sedangkan estradiol dapat bekerja sebagai umpan balik positif terhadap hipotalamus. Sentakan LH menyebabkan terjadinya ovulasi dan
terbentuknya korpus luteum. Korpus luteum kemudian menghasilkan progesteron yang bekerja sebagai umpan balik negatif terhadap pituitari dan hipotalamus.
Keterangan :
FSH = follicle stimulating hormone LH = luteinizing hormone
LTH = luteotrophic hormone atau prolaktin = kerja FSH atau LH
= umpan balik positif = umpan balik negatif
Gambar 2 Hubungan hormon-hormon penting yang mengatur reproduksi pada ternak betina (Wodzicka-Tomaszewska et al.1991).
Progesteron dengan atau tanpa estrogen bekerja sebagai umpan balik negatif. Estrogen sendiri dapat mempunyai efek positif dan negatif bergantung pada konsentrasinya. Apabila setelah pembuahan tidak terjadi kematian, maka embrio turun dan masuk ke dalam cornua uteri dan terjadi implantasi pada sekitar hari ke 17−18 (Edey et al. 1981). Sejalan dengan terjadinya implantasi, pada hari ke 15 hormon progesteron tidak mengalami penurunan dan terus meningkat mencapai puncak pada plateu dan akan menurun kembali menjelang kelahiran. Progesteron menghambat motilitas uterus yang berlebihan selama periode implantasi dan Umpan balik positif
Umpan balik negatif Hipotalamus
Gonadotrophin releasing hormone
FSH Estradiol Ovarium Progesteron Pituitari anterior LH inhibin LTH Ovulasi Kospus luteum Kelenjar susu Folikel sedang tumbuh
dalam periode kebuntingan. Perubahan rasio estrogen dan progesteron dapat menaikkan kepekaan uterus terhadap oksitosin dan kemungkinan akan mengakibatkan kelahiran (Frandson 1992).
Fungsi Mineral Na+, K+, Cl-, dan S2-dalam Tubuh Ternak
Lingkungan internal ialah cairan dalam tubuh hewan yang merupakan tempat hidup bagi sel penyusun tubuh. Cairan tubuh hewan meliputi darah, cairan interstisial, cairan selomik, dan cairan lain yang terdapat dalam tubuh. Kehidupan dapat dipertahankan jika hewan tersebut mampu menjaga stabilitas lingkungan internalnya, seperti pH, suhu tubuh, kadar garam, dan kandungan nutrien. Stewart (1983) menyatakan bahwa keseimbangan ion-ion stabil seperti natrium (Na+), kalium (K+), dan klorida (Cl-) berperan utama sebagai penentu keseimbangan
asam-basa dalam cairan biologis. Ditambahkan oleh Dishington (1975) dan Block (1984) bahwa ion sulfur (S2-) juga mempengaruhi keseimbangan cairan biologis, walaupun S tidak termasuk ion stabil. Ion SO42- secara langsung bersifat
asam terhadap cairan biologis dan dapat mengubah keseimbangan asam-basa jika ditambahkan dalam konsentrasi yang tinggi dalam ransum. Menurut Block (1994), keseimbangan asam-basa di dalam tubuh diatur melalui sistem buffer, fungsi ginjal, dan seluler respirasi.
Menurut Horst et al. (1997) dan Riond (2001), ion-ion Na+, K+, dan Cl- diserap oleh tubuh sebanyak 100%. Kation diserap dari saluran usus dan kation-kation tersebut meningkatkan ion-ion kuat dalam plasma sehingga menghasilkan alkalosis metabolik. Sebaliknya, di bagian akhir usus, terjadi penyerapan ion Cl-. Lebih lanjut dijelaskan oleh Horst (1997) bahwa Cl- diserap lebih banyak daripada SO42- sehingga Cl- merupakan asiditif yang lebih kuat untuk mengasamkan darah.
Horst et al. (1997) menyatakan bahwa Cl- diserap sebanyak 1.6 kali daripada
SO42-. Urutan zat-zat kimia yang mempunyai sifat keasaman dari terkuat ke
terendah ialah HCl, NH4Cl, CaCl2, CaSO4, MgSO4, dan S.
Pada semua spesies hewan, jumlah konsentrasi Na+ di luar sel lebih banyak daripada di dalam sel (Isnaeni 2006). Menurut Murray et al. (2003), cairan ekstrasel ditandai dengan kandungan Na+ serta Ca2+ yang tinggi, dan Cl
-merupakan anion utama. Kadar glukosa lebih tinggi dalam cairan ekstrasel daripada dalam sel, sedangkan untuk kadar protein terjadi sebaliknya. Georgevskii et al. (1982) menyatakan bahwa ion Na+ dan Cl- dalam plasma lebih tinggi daripada dalam sel darah merah. Konsentrasi Na+ dan Cl- dalam plasma lebih banyak daripada konsentrasi K+ (sekitar 20:1), tetapi konsentrasi Na+ dan Cl- tidak sama. Secara keseluruhan, konsentrasi Cl- didistribusikan ke seluruh tubuh dalam proporsi sama dengan Na+, tetapi pada tulang umumnya dengan posisi
lebih rendah, walaupun disertai adanya Cl- dalam sel red bone marrow. Sebaliknya, Cl- lebih tinggi daripada Na+ dalam jaringan lunak.
Lingkungan internal sangat kaya akan ion K+ serta Mg2+, sedangkan fosfat merupakan ion utamanya (Murray et al. 2003). Cairan intraseluler mengandung ion kation Na+ dan anion Cl- dalam jumlah yang sedikit, tetapi banyak
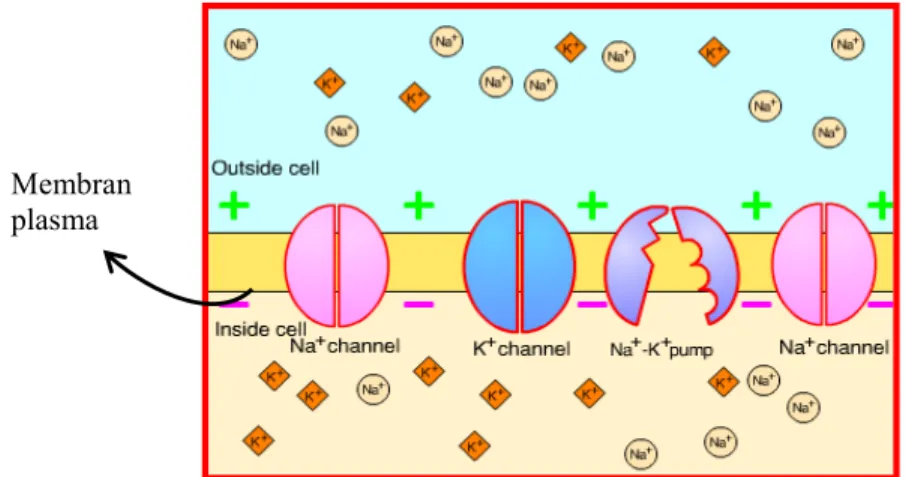
mengandung ion K+ (sekitar 90% dari jumlah K berada di dalam protoplasma sel), dan anion organik alami yang tidak bisa melewati membran. Proporsi ion individu dijaga dengan mekanisme yang disebut pompa Na, ion Na+ dipompa keluar dari sel seperti yang terdapat pada Gambar 3.
Gambar 3 Keadaan cairan intraseluler dan ekstraseluler (Campbell et al. 2004). Pada Gambar 3, digambarkan keadaan cairan intraseluler dan ekstraseluler yang mempunyai komposisi ionik yang berbeda. Membran plasma adalah lapisan fosfolipid dengan protein membran yang terkait. Ion tidak dapat berdisfusi menembus lipid karena tidak dapat larut dalam lipid. Di dalam sel, kation utama
Membran plasma
(ion bermuatan positif) adalah K+, meskipun terdapat Na+; dan anion utamanya protein, asam amino, sulfat, fosfat, dan ion bermuatan negatif lainnya. Ion Cl
-dalam jumlah sedikit. Di luar sel, kebalikannya Na+ menjadi kation utama dan
konsentrasi K+ berada dalam jumlah jauh lebih rendah (Campbell et al. 2004). Banyaknya ion-ion mineral yang terdapat di cairan intrasel selalu mempertahankan konsentrasi Na+dalam jumlah yang rendah dan konsentrasi K+ dalam jumlah yang tinggi, bersama-sama dengan potensial listrik yang netto negatif di sisi dalam (Tabel 2).
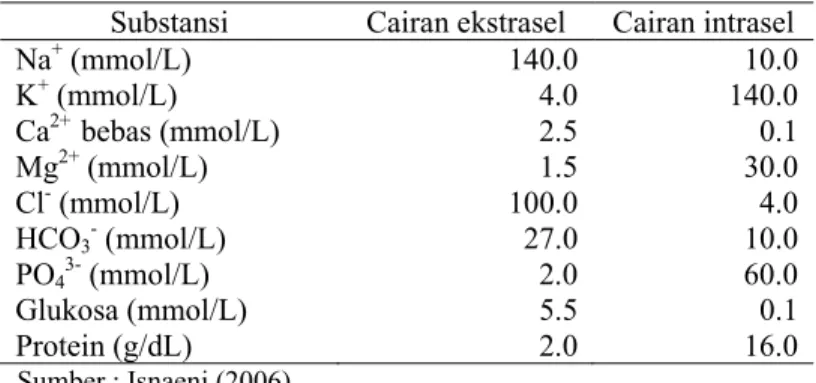
Tabel 2 Perbandingan konsentrasi bahan-bahan di luar dan dalam membran sel mamalia
Substansi Cairan ekstrasel Cairan intrasel
Na+ (mmol/L) 140.0 10.0 K+ (mmol/L) 4.0 140.0 Ca2+ bebas (mmol/L) 2.5 0.1 Mg2+ (mmol/L) 1.5 30.0 Cl- (mmol/L) 100.0 4.0 HCO3- (mmol/L) 27.0 10.0 PO43- (mmol/L) 2.0 60.0 Glukosa (mmol/L) 5.5 0.1 Protein (g/dL) 2.0 16.0 Sumber : Isnaeni (2006)
Pada Tabel 2, terlihat bahwa urutan mineral terbanyak ke terendah pada ekstrasel ialah Na, Cl, K, Ca2+, P, dan Mg2+. Keadaan seperti ini, membran sel
bersifat impermeabel terhadap ion Na+, permeabel terhadap ion K+, dan ada perbedaan potensial antara bagian luar dan dalam membran. Isnaeni (2006) menyatakan bahwa jika di bagian dalam membran sel bermuatan lebih negatif dan di bagian luar membran bermuatan lebih positif maka keadaan tersebut disebut dengan keadaan polar (keadaan sedang tidak menjalarkan rangsangan). Perbedaan komposisi ionik dalam cairan intraseluler dan ekstraseluler menyebabkan membran berpotensial. Campbell et al. (2004) menyatakan apabila terdapat difusi K+ yang stabil keluar sel menuruni gradien konsentrasinya
(anion-anion yang terdapat di dalam sel tidak dapat mengikutinya) dan difusi Na+ yang stabil ke dalam sel akan menyebabkan bagian dalam sel menjadi bermuatan negatif. Kehilangan gradien dicegah oleh pompa natrium-kalium dengan
menggunakan ATP secara aktif untuk mengangkut Na+ keluar dari sel dan K+ masuk ke dalam sel. Pompa ini mencegah perpindahan air yang berlebihan masuk ke dalam sel. Penyaringan ion Na+ yang bermuatan positif dari sel mengakibatkan
permukaan internal membran menjadi negatif. Pada waktu yang sama pompa memaksa ion K+ ke dalam sel sehingga konsentrasi K+ lebih tinggi dari sekitarnya (Georgevskii et al. 1982).
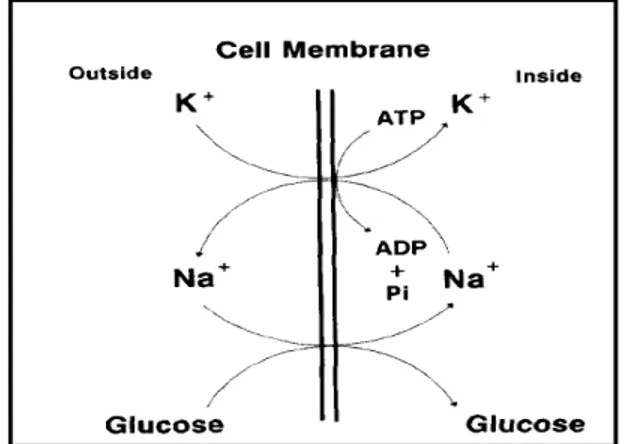
Apabila terdapat rangsangan, maka membran akan mengalami perubahan elektrokimia dan perubahan fisiologis. Hal ini menyebabkan membran menjadi permeabel terhadap Na+ dan sangat impermeabel terhadap K+ sehingga sejumlah besar ion Na+ akan berdifusi ke dalam sel, sedangkan ion K+ akan lebih banyak ditahan di dalamnya. Keadaan seperti di atas akan mengubah potensial membran sehingga keadaan pada sisi dalam membran menjadi lebih positif dan bagian luar membran menjadi lebih negatif. Pompa yang mempertahankan gradien ini adalah ATPase yang diaktifkan oleh Na+ dan K+. Pompa Na+-K+-ATPase terdapat pada Gambar 4.
Gambar 4 Mekanisme pemompaan yang bergantung pada Na+-K+-ATP pada waktu difusi glukosa ke dalam sel (Block 1994).
Pada Gambar 4, enzim ATPase merupakan protein integral membran yang memerlukan fosfolipid untuk aktivitasnya. Block (1994) dan Murray et al. (2003) menyatakan bahwa glukosa dan Na+ terikat pada molekul pengangkut glukosa di tempat yang berlainan. Enzim ATPase mempunyai tempat pengikatan baik untuk ATP maupun Na+, tetapi tempat pengikatan ikatan K+ terletak pada sisi
ekstraseluler membran. Pompa menggerakkan 3 ion Na+ dari bagian dalam sel ke bagian luar dan membawa 2 ion K+ dari bagian luar ke bagian dalam untuk
setiap molekul ATP yang dihidrolisis menjadi ADP oleh enzim ATPase yang terikat-membran. Proses pengangkutan aktif berbeda dengan difusi dalam hal molekul yang diangkut untuk menjauhi keseimbangan termodinamik sehingga diperlukan energi dalam bentuk ATP. Mekanisme ini membutuhkan ATP sekitar 40% dari jumlah total energi yang dibutuhkan untuk pemeliharaan sel.
Na+ bergerak ke dalam sel dengan mengikuti gradien elektrokimia dan menarik glukosa bersama dengannya. Semakin besar gradien Na+, maka semakin banyak glukosa yang masuk ke dalam sel. Jika jumlah ion Na+ dalam cairan ekstrasel rendah, pengangkutan glukosa akan terhenti. Oleh karena itu, perlu untuk mempertahankan gradien Na+ yang curam. Simport Na+-glukosa
bergantung pada gradien yang dihasilkan oleh pompa Na+/K+ yang mempertahankan konsentrasi Na+ intrasel yang rendah. Glukosa beserta Na+ dilepas ke dalam sitosol sehingga memungkinkan si pembawa mengangkut lebih banyak. Ion Na+ diangkut mengikuti gradien konsentrasi dan pada saat yang
bersamaan akan menyebabkan si pembawa mengangkut glukosa melawan gradien konsentrasinya. Energi bebas yang diperlukan untuk pengangkutan aktif diperoleh dari hidrolisis ATP yang terikat dengan pompa natrium yang melepaskan Na+ dari sel dalam proses pertukaran K+. Pengangkutan aktif glukosa dihambat oleh ouabain (suatu inhibitor pompa natrium). Pompa Na+/K+
membutuhkan ATP, masuknya 1 mol glukosa menghasilkan 1 ATP di dalam sel. Pengeluaran Na+ dan K+ dalam urin termasuk hubungan timbal balik dimana K+ dilindungi oleh tubuh di saat mengorbankan atau mengeluarkan Na+. Mobilisasi dalam H+ proksimal tubular pada ginjal, sekresi H+ dan produksi NH3
dalam distal tubul ginjal bergantung pada reabsorpsi Na+ untuk secara listrik
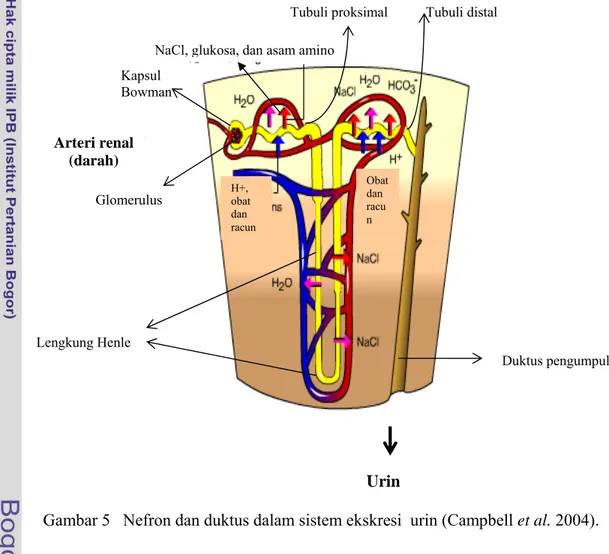
menetralkan absorpsi HCO3- dari sel ke darah (Gambar 5).
Darah dari arteri renal masuk ke dalam glomerulus, kemudian air dan molekul-molekul kecil lainnya mendorong darah masuk ke kapsula Bowman (Gambar 5). Di kapsula Bowman terjadi filtrasi dan cairan yang disaring disebut dengan filtrat. Filtrat mengalir melalui tubula proksimal dan terjadi pengeluaran NaCl, glukosa, HCO3, dan asam amino secara aktif serta diserap kembali oleh
pembuluh darah. Selain itu, terjadi pelepasan H+ dan NH3 dari darah ke tubula
proksimal. Filtrat menjadi lebih encer daripada pH interstitial, kemudian air ikut keluar secara osmosis. Filtrat bergerak menuju lengkung Henle (menurun) yang permeabeal terhadap air, tetapi tidak terhadap garam-garam sehingga filtrat menjadi lebih pekat karena banyak air yang keluar.
Gambar 5 Nefron dan duktus dalam sistem ekskresi urin (Campbell et al. 2004). Lengkung Henle yang menaik permeabel terhadap garam-garam, tetapi tidak permeabel terhadap air. Garam-garam keluar secara aktif dan diserap kembali oleh darah. Filtrat melanjutkan perjalanannya ke tubular distal dan melakukan pengeluaran NaCl, HCO3 (secara aktif) serta air (secara osmosis), kemudian
diserap kembali oleh darah. Selain itu, terjadi pelepasan ion H+, obat-obatan, racun, kelebihan K+ dari darah ke tubular distal.
Lengkung Henle Arteri renal (darah) Urin Glomerulus Kapsul Bowman
NaCl, glukosa, dan asam amino
Tubuli proksimal Tubuli distal
Duktus pengumpul Obat dan racu n H+, obat dan racun
Tubuli distal membantu mengatur pH darah melalui reabsorpsi HCO3 yang
merupakan sejenis penyangga (buffer) dan berfungsi sebagai homeostasis K+ dan
Na+. Filtrat dialirkan ke duktus pengumpul yang permeabel terhadap air dan urea,
tetapi tidak terhadap garam-garam; dan mengalir ke arah medula renal dan dikumpulkan di saluran ini sebelum dikeluarkan menjadi urin. Di duktus pengumpul, air dan urea diabsorpsi kembali oleh darah. Sisa filtrat akan dikeluarkan berupa urin (Campbell et al. 2004).
Selanjutnya, Block (1994) menjelaskan bahwa sekitar 90% dari HCO3-
direabsorpsi secara langsung dari tubulus proksimal melalui pertukaran Na+- H+. Ion H+ yang disekresi ke dalam lumen tubulus (sebagai penukar Na+) akan berikatan dengan HCO3- yang terdapat dalam filtrat glomerulus sehingga
terbentuk asam karbonat (H2CO3). Asam karbonat akan berdisosiasi menjadi air
(H2O) dan karbon dioksida (CO2). Karbon dioksida maupun H2O akan berdifusi
ke luar lumen tubulus, masuk ke sel tubulus. Dalam sel tubulus tersebut, karbonik anhidrase akan mengkatalisis reaksi CO2 dengan H2O, kembali membentuk
H2CO3. Disosiasi H2CO3 menghasilkan HCO3- dan H+. Ion H+ disekresi kembali
sedangkan HCO3- akan masuk ke dalam darah peritubular bersama dengan Na+.
Ion Cl- ditranspor secara aktif keluar dari bagian asenden dan diikuti secara pasif
oleh Na+. NaCl selanjutnya akan secara pasif berdifusi masuk ke bagian desenden lengkung. Jika Cl- yang terdapat pada filtrat glomular berlebih, Cl- dalam filtrat
dan HCO3- dalam sel mungkin bertukar. Akibatnya, terjadi reabsorpsi NaCl dan
pengurangan absorpsi HCO3-. Apabila ternak dalam keadaan stress, cairan
ekstraseluler agak asidosis karena ginjal mengubah reabsorpsi ion HCO3-. Dua
fungsi tubulus distal yang penting adalah pengaturan keseimbangan air dan asam-basa. Pada fungsi sel yang normal, pH cairan ekstrasel harus dapat dipertahankan antara 7.35 dan 7.45. Selain reabsorpsi dan penyelamatan sebagian besar dari HCO3-, ginjal juga membuang H+ yang berlebihan. Asam-asam ini dibuang
melalui cairan tubulus sehingga urin dapat mencapai pH sampai serendah 4.5 (perbedaan ion hidrogen 800 kali lebih besar daripada ion hidrogen dalam plasma). Di sepanjang tubulus, H+ akan disekresi ke dalam cairan tubulus. Ion hidrogen dapat diekskresikan dalam bentuk kombinasi dengan fosfat berbasa dua
diekskresi sebagai garam asam berbasa satu yang dapat dititrasi (NaH2PO4)
atau sebagai ion amonium (NH4+). Amonia berdifusi dengan mudah ke dalam
lumen tubulus, tetapi jika telah berikatan dengan H+ membentuk partikel NH 4+
yang bermuatan dan tidak dapat lagi berdifusi kembali ke dalam sel tubulus. Apabila pH urin mencapai 4.5, jumlah H+ bebas yang dapat diekskresi terbatas jumlahnya. Oleh karena itu, mekanisme amonium (dan mekanisme fosfat) berperanan sangat penting dalam pembuangan beban asam, karena NH4+ tidak
mempengaruhi pH urin. Pelepasan H+ oleh NH3 atau HPO42- juga berakibat pada
penambahan HCO3- baru ke dalam plasma untuk setiap ion H+ yang diekskresi ke
dalam urin. Ion H+ yang disekresi berasal dari H2CO3 yang terdapat dalam
tubulus sehingga meninggalkan HCO3- dalam sel tubulus tersebut. Sebaliknya,
jika HCO3- direabsorpsi dari cairan tubulus, maka H2CO3- sesungguhnya hanya
diselamatkan karena satu H+ akan dikembalikan ke dalam plasma untuk setiap H+ yang disekresi ke dalam cairan tubulus.
Keseimbangan asam-basa menyangkut pertukaran ion H+ dan komponen-komponen media internal yang mampu menyumbangkan atau menerima ion. Substansi yang mampu menyumbangkan ion adalah asam, sedangkan yang mampu mengikat hidrogen adalah basa. Faktor lain dalam pelepasan ion H+ untuk menjaga keseimbangan asam-basa mungkin dengan cara pembentukan amonia yang intensif dan pemasukan sejumlah besar garam-garam kalium. Zat-zat yang difiltrasi oleh ginjal ada 3 macam, yaitu elektrolit, nonelektrolit, dan air. Beberapa jenis elektrolit yang paling penting adalah Na+, K+, Ca2+, Mg2+, HCO3-,
Cl-, dan HPO42-. Senyawa nonelektrolit yang penting antara lain glukosa dan
asam amino. Metabolit yang merupakan produk akhir dari proses metabolisme protein, yaitu urea, asam urat, dan kreatinin (Price dan Wilson 1995).
Miller (1975) menjelaskan bahwa pengeluaran melalui urin merupakan metode utama homeostasis regulasi untuk Na+ dan K+ sehingga konsumsi mineral-mineral tersebut akan langsung mempengaruhi pengeluaran Na+ dan K+. Ditambahkan oleh Maltz dan Silanikove (1996) bahwa pengeluaran melalui urin merupakan homeostasis utama dalam pengaturan Na+, K+, dan Cl-. Pengeluaran urin tersebut sangat berhubungan langsung dengan konsumsi Na+, K+, dan
ion K+ melalui ginjal dengan mekanisme regulasi untuk mempertahankan rasio Na+:K+ konstan dalam cairan ekstraseluler. Mineralokortikoid atau aldosteron
kemungkinan juga mempengaruhi regulasi permeabilitas membran dan mekanisme pasangan Na+:K+. Transfer aktif ion Na+ dan K+ terjadi pada beberapa tempat, yaitu di eritrosit (berhubungan dengan fungsi pernapasan), epitel saluran ginjal, dan membran organel tertentu. Ion K+ dalam sel darah merah mempengaruhi transportasi O2 dan CO2 oleh haemoglobin. Block (1994)
menyatakan bahwa keadaan netral selalu dijaga pada sel darah merah dalam jaringan, plasma, dan paru-paru. Senyawa CO2 dihasilkan dari metabolisme
jaringan yang bereaksi dengan H2O untuk membentuk H2CO3 di dalam sel darah
merah dengan peranan karbonik anhidrase. Beberapa H2CO3 masuk ke plasma,
kemudian bereaksi dengan KHbO2 untuk membentuk HCO3-; pelepasan O2 untuk
respirasi dan K+ dari KHbO2. Asam bikarbonatmasuk ke plasma mengubah Cl-.
Natrium bikarbonat dibentuk dalam plasma dan Cl- yang masuk ke dalam sel darah merah dinetralisir oleh K+ yang menghasilkan perubahan menjadi HCO3
-dan Cl-. Kebalikan reaksi ini terjadi di dalam paru-paru, yaitu Cl- dikirim balik
ke plasma, melepaskan K+ ke buffer terbentuk KHbO
2 baru. Ion klorida yang
kembali ke plasma dinetralisir dengan cara mengeluarkan Na+ ketika HCO3
-masuk kembali ke sel darah merah untuk mengeluarkan atau menggeser CO2
dalam respirasi. Jika ion-ion ini tidak seimbang satu dengan yang lain akan mengakibatkan keracunan yang menghasilkan alkalosis atau asidosis. Hal ini kemungkinan karena ketidakseimbangan perubahan HCO3- dan H+.
Yingst et al. (2001) menyatakan bahwa peningkatan konsentrasi K+ dari 4 menjadi 10 mM pada tikus mengakibatkan peningkatan aktivitas pompa Na+ dan konsentrasi ion Ca2+ bebas dalam darah. Ion K+ meningkatkan pompa Na+ dalam rangka meningkatkan konsentrasi Ca2+ sehingga meningkatkan pula Ca2+ bebas
dalam darah yang ditingkatkan oleh pompa Na+ dalam beberapa sel. Dijelaskan juga oleh Burnay et al. (1994) dan Capponi et al. (1987) bahwa penambahan konsentrasi K+ memungkinkan untuk meningkatkan sekresi aldosteron oleh depolarisasi membran yang membuka saluran tegangan Ca2+ serta untuk membiarkan masuknya Ca2+ ekstraseluler. Pada bagian lain, polarisasi
keseimbangan K+ (Quinn et al. 1987). Walaupun penambahan konsentrasi K+ yang berlebihan akan meningkatkan sekresi aldosteron, juga akan meningkatkan pompa Na+ oleh kehadiran peningkatan jumlah konsentrasi K+ yang menyelimuti
pompa (Glynn 1956).
Menurut Harris dan Beede (1993), kation diet berasal dari natrium (Na+) dan kalium (K+) yang bersifat basa, sedangkan anion diet berasal dari khlor (Cl-), sulfur (S2-), dan fosfor (P2-) yang bersifat asam. Level K+ dalam plasma
kebanyakan lebih rendah daripada level Na+. Goff (2000) menyatakan bahwa efisiensi S2- pengaruhnya pada penurunan pH darah dan dalam pencegahan hipokalsemia hanya sekitar 25% dari total S2- dalam ransum. Underwood dan Suttle (1999) menyatakan bahwa penyerapan S2- lebih kecil daripada Cl- atau K+.
Perpindahan cairan melintasi sel sekretoris epitel tidak sama dengan perpindahan padatan khususnya ion-ion. Pada sel sekretoris epitel, perpindahan ion Cl- dari bagian basal ke bagian apeks sel berperan mengatur perjalanan mendorong perpindahan air. Air mengikuti perpindahan ion-ion dan disimpan kembali untuk keseimbangan osmotik serta berakumulasi di dalam lumen. Mekanisme tersebut juga terjadi di dalam oviduk. Sel-sel epitelial meningkat tinggi pada waktu estrus, ketika produksi cairan mencapai maksimum. Peningkatan sel-sel epitelial tersebut akan meningkatkan luas area interseluler yang merupakan tempat akumulasinya ion-ion. Peningkatan viskositas cairan lumen terjadi akibat produksi dan sekresi estrus berupa glikoprotein; hal ini mungkin untuk mencegah terjadinya difusi yang cepat. Pada oviduk, proses ini terdapat di bagian yang tidak ada silianya. Jaringan-jaringan menjaga perbedaan potensial listrik transmural dan ion-ion Cl- yang ditunjukkan dengan pergerakan secara khusus pada sekretori. Mekanisme sekresi cairan di dalam oviduk dapat dilihat pada Gambar 6.
Pada Gambar 6, tampak bahwa bagian basal sebagai cairan pada ekstraseluler dan bagian apeks sebagai lumen oviduk. Glukosa diangkut terutama dari bagian basal ke apeks secara langsung melalui diffusi. Laktat dibentuk sebagai hasil dari metabolisme glukosa dan terutama muncul di bagian basal. Selanjutnya, penurunan laju glukosa dan laktat pada bagian apeks dari sel epitelial terjadi pada hari ke 3 sesudah kawin (ketika embrio lewat oviduk masuk ke dalam
uterus). Penurunan glukosa dan laktat terjadi bersamaan dengan menurunnya konsentrasi estrogen dan atau meningkatnya konsentrasi progesteron sesudah ovulasi.
Gambar 6 Skematik sel epitelial oviduk sebagai suatu lapisan polar pada suatu permeabel (Leese et al. 2001).
Peningkatan Cl- fluks dipengaruhi oleh mekanisme Ca2+. Ion kalsium yang berasal dari darah masuk ke dalam sel epitel tuba falopii sehingga di dalam sel epitel jumlah Ca2+ meningkat. Pada waktu Ca2+ masuk ke dalam sel epitel, diikuti oleh masuknya Cl- dan air. Kemudian, Cl- dan cairan disekresi ke dalam lumen.
Respons Ruminan terhadap Perbedaan Kation-Anion Ransum
Setiap sistem hidup selalu bereaksi terhadap perubahan-perubahan yang terjadi pada lingkungannya, mengatur, dan mengontrol reaksi yang ditimbulkan; berarti tubuh melakukan homeostasis (Isnaeni 2006). Mekanisme pengendalian kondisi homestasis pada hewan berlangsung melalui sistem umpan balik. Stewart (1983) menyatakan bahwa penambahan anion (Cl- dan S2-) ke dalam cairan tubuh melalui penambahan suplemen dalam ransum, akan menurunkan pH cairan tubuh. Dersjant-Li et al. (2002) menjelaskan bahwa pH darah dipengaruhi oleh pH
BAGIAN BASAL Glukosa Laktat Laktat Glukosa Permeabel Penghubung yang kuat BAGIAN APEKS
ransum. Artinya, apabila pH ransum tinggi, pH darah juga akan tinggi. Ternak dapat toleran terhadap suatu tingkatan pH darah dan menjaga pH darah tertentu agar homeostasis dengan cara membutuhkan energi.
Penelitian-penelitian mengenai keseimbangan kation-anion telah banyak dilakukan, tetapi sebagian besar pada bidang sapi perah. Pemberian ransum berdasarkan PKAR, menurut Riond (2001) pada umumnya dalam rangka mencegah hipokalsemia sesudah beranak pada sapi perah. Beberapa peneliti melaporkan bahwa peningkatan PKAR memberi pengaruh yang jelas pada kejadian milk fever. Parturient paresis atau parturien hipokalsemia, atau disebut juga dengan milk fever adalah suatu penyakit gangguan metabolik yang disebabkan oleh peningkatan permintaan Ca2+ secara tiba-tiba yang akan ditempatkan pada bagian plasma darah (Roche et al. 2003b). Kejadian tersebut biasanya pada waktu atau sekitar mendekati beranak, terutama banyak terjadi pada sapi perah dengan produksi susu yang tinggi. Karakteristik penyakit ini, yaitu menurunnya konsentrasi Ca2+ dalam plasma secara cepat karena banyaknya Ca2+ yang hilang karena pembentukan susu (Horst et al. 1997). Ransum dengan anion yang relatif lebih banyak (PKAR rendah) akan mencegah milk fever, sedangkan ransum dengan kation yang relatif lebih banyak (PKAR tinggi) akan mengakibatkan terjadi milk fever (Block 1994, Vagnoni dan Oetzel 1998). Pemberian ransum dengan keseimbangan kation-anion negatif lebih baik dilakukan pada sapi-sapi perah pada waktu masa kering sebelum beranak untuk mengurangi peristiwa milk fever selain untuk mencegah parturient paresis (Hu dan Murphy 2004). Roche et al. (2002) menyatakan bahwa dikatakan parturien hipokalsemia atau milk fever jika darah mengandung Ca2+ <1.4 mmol/L, sedangkan apabila Ca2+ <2.0 mmol/L dikatakan subklinis.
Perbedaan kation-anion ransum (PKAR), yaitu perbedaan miliequevalen antara kation dan anion tertentu dalam ransum dengan cara pengurangan miliekuivalen anion dari miliekuivalen kation dalam seluruh ransum. Pada umumnya, mineral yang sering digunakan dalam perhitungan PKAR, yaitu dua macam kation (Na+ dan K+) dan dua macam anion (Cl- dan S2-). Pada proses perhitungan keseimbangan kation-anion, tidak semua mineral dalam ransum yang dihitung. Akan tetapi, hanya beberapa mineral tertentu saja yang perlu
diperhatikan. Harris dan Beede (1993), menyatakan bahwa mineral-mineral yang sering digunakan untuk menghitung keseimbangan kation-anion, yaitu Na+
dan K+ untuk kation serta Cl- dan S2- untuk anion. Bobot molekul, nilai valensi,
bobot ekuivalen, dan bobot miligram ekuivalen pada masing-masing mineral tersebut terdapat pada Tabel 3.
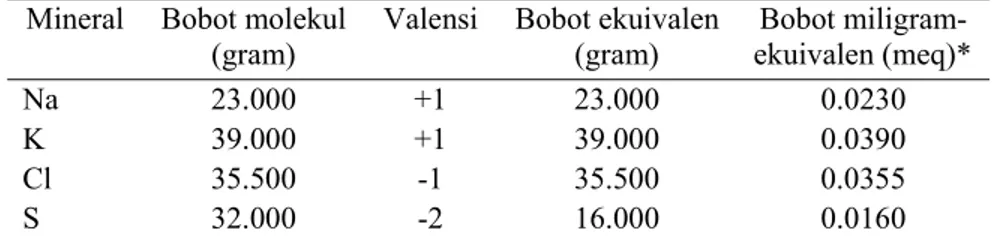
Tabel 3 Bobot molekul, nilai valensi, bobot ekuivalen, dan bobot miligram ekuivalen mineral-mineral yang digunakan untuk menghitung keseimbangan kation-anion ransum
Mineral Bobot molekul (gram)
Valensi Bobot ekuivalen (gram) Bobot miligram-ekuivalen (meq)* Na 23.000 +1 23.000 0.0230 K 39.000 +1 39.000 0.0390 Cl 35.500 -1 35.500 0.0355 S 32.000 -2 16.000 0.0160
Keterangan: * Bobot meq (mg) hasil perhitungan dari bobot molekul dibagi nilai valensi dan dibagi 1000 ( Sumber: Harris dan Beede 1993)
Perhitungan nilai PKAR yang digunakan oleh Mongin (1981) dan Stewart (1983) adalah persamaan sebagai berikut.
PKAR (meq) = (Na+K–Cl) (meq/100 g BK ransum)
Akan tetapi, persamaan Patience dan Wolynetz (1990) menggunakan kation dan anion yang lebih banyak daripada Mongin sehingga persamaannya menjadi sebagai berikut.
PKAR (meq) = [(Na+K+Ca+Mg) – (Cl+S+P)] (meq/100 g BK ransum) Selanjutnya, dalam penelitian-penelitian yang dilaksanakan oleh Harris dan Beede (1993), Moore et al. (2000), Roche et al. (2003a), Roche et al. (2003b), Borucki-Castro et al. (2004), Roche et al. (2005) digunakan persamaan berdasarkan Tucker et al. (1992) berikut ini.
PKAR (meq) = (Na+K) – (Cl+S) (meq/100 g BK ransum).
Block (1994) menjelaskan bahwa PKAR rendah yang diberikan pada sapi perah pada waktu peripartum dapat mengurangi hipokalsemia peripartum melalui meningkatnya ion Ca2+ dalam darah, Ca2+ dalam urin, dan bertanggung jawab atas hormon homeostatis Ca2+. Selanjutnya, Roche et al. (2003a) menerangkan bahwa
pengurangan PKAR pada waktu sebelum beranak, kemudian dilanjutkan dengan penambahan Ca2+ yang dikonsumsi pada waktu sesudah beranak, akan
mengurangi kejadian hipokalsemia dan produksi susu meningkat. Bertambahnya Ca2+ dalam darah dan urin, pertama disebabkan oleh PKAR yang menurun (rendah) yang mengakibatkan Ca2+ mengalami homeostasis dengan cara meningkatkan penyerapan di usus sehingga meningkat juga dalam pengeluaran (Schonewille et al. 1994, Roche et al. 2003b). Kedua, meningkatnya penyerapan Ca2+ kembali dari tulang (Block 1984, Goff et al. 1991). Dari beberapa uraian tersebut di atas dapat disimpulkan bahwa PKAR negatif mampu mencegah terjadinya milk fever karena ransum tersebut mempunyai beberapa kelebihan, yaitu (1) lebih responsif terhadapnya peningkatan parathyroid hormone (PTH) (Goff et al. 1991). Fungsi PTH adalah mengatur reabsorpsi Ca2+ dan HPO
42- di
sepanjang tubulus; (2) meningkatkan pengaliran Ca2+ melalui pertukaran Ca2+ pool, tanpa mengubah ukuran pool terutama sekali ketika permintaan Ca2+ meningkat (Takagi dan Block 1991b); (3) mempertinggi reabsorpsi Ca2+ dari tulang (Goff dan Horst 1998).
Riond (2001) melaporkan hasil penelitiannya bahwa peningkatan PKAR dari 100 menjadi 250 meq/kg bahan kering ransum akan meningkatkan jumlah konsumsi bahan kering pada sapi perah. Begitu juga hasil penelitian West et al. (1992), Delaquis dan Block (1995) menunjukkan bahwa semakin meningkat PKAR, jumlah konsumsi bahan kering juga semakin meningkat. Menurut Escobosa et al. (1984), Harris dan Beede (1993), Delaquis dan Block (1995), dan Roche et al. (2005), ransum dengan keseimbangan kation-anion positif yang diberikan pada sapi perah selama laktasi dapat meningkatkan produksi susu. Peningkatan produksi susu ini akibat peningkatan jumlah konsumsi bahan kering. Hal ini sejalan dengan hasil penelitian, West et al. (1991), Riond (2001) bahwa semakin tinggi PKAR dalam ransum yang diberikan pada sapi perah, semakin meningkat produksi susunya. Pemberian PKAR sebesar +15 sampai dengan +20 mEq/100 g bahan kering ransum menghasilkan jumlah konsumsi bahan kering ransum yang optimum (Roche et al. 2000). Borucki-Castro et al. (2004) melaporkan bahwa dengan peningkatan PKAR dari +14 menjadi +45 mEq/ 100g bahan kering ransum tidak berpengaruh nyata pada jumlah produksi susu.
Selain meningkatkan jumlah konsumsi bahan kering dan produksi susu, peningkatan PKAR ransum juga meningkatkan pH darah, pH urin (West et al. 1992, Moore et al. 2000, Dersjant-Li et al. 2002, Riond 2001, Borucki-Castro et al. 2004, Hu dan Murphy 2004, Roche et al. 2005, Apper-Bossard et al. 2006, Kienzle et al. 2006), HCO3 darah (Borucki-Castro et al. 2004, Hu dan Murphy
2004, Roche et al. 2005, Apper-Bossard et al. 2006), pO2 darah, SIDb darah,
Na/creat, Cl/creat, S/creat, Hy/creat (Roche et al. 2003a), kelebihan basa (Borucki- Castro et al. 2004, Roche et al. 2005), NH3 darah, pCO2, Na+ darah,
Fe darah (Roche et al. 2005), dan haemoglobin (Hb) darah (Dersjant-Li et al. 2002). Akan tetapi, terjadi penurunan kadar K+ darah, Cl- darah (Hu dan Murphy 2004, Roche et al. 2005), Mg darah (Roche et al. 2005), P2- darah (Borucki-Castro 2004), Ca2+ urin baik pada awal laktasi maupun tengah laktasi (Delaquis dan
Block 1995, Borucki-Castro 2004). Peningkata HCO3- dalam plasma darah
terjadi akibat peningkatan penyerapan Na+ dan K+ (Stewart 1983). Jika konsentrasi Na+ darah naik, konsentrasi K+ dan Cl- akan menurun (Roche et al. 2005). Borucki-Castro et al. (2004) menyarankan urutan pemeriksaan terhadap pengeluaran P2-, sebaiknya dilakukan dimulai dari feses, susu, dan terakhir urin.
Sebaliknya, hasil penelitian Morton dan Roach (2002) dan Chan et al. (2005) diperoleh hasil bahwa pertambahan PKAR menurunkan jumlah konsumsi bahan kering ransum yang dicobakan pada musim dingin. Akibatnya, produksi susunya juga menjadi menurun seiring dengan penurunan jumlah konsumsi bahan kering ransum. Selain itu, perubahan PKAR tidak ada pengaruh pada Na+ darah (Hu dan Murphy 2004), Ca2+ feses (Delaquis dan Block 1995), P2- dalam feses dan urin (Borucki-Castro et al. 2004). Hasil penelitian Anggreini (tidak dipublikasikan 2007) pada domba garut jantan, menunjukkan bahwa peningkatan PKAR dari -10 menjadi +40 meq/100 mg bahan kering ransum tidak mempengaruhi jumlah konsumsi ransum bahan kering (BK), konsumsi bahan organik (BO), koefisien cerna BK, koefiesien cerna BO, absorbsi mineral-mineral (P, Mg, Zn), dan pH urin.
Apabila PKAR diturunkan dari 203 menjadi -63 meq/kg bahan kering ransum, jumlah konsumsi bahan kering pada sapi perah periode kering akan menurun (Vagnoni dan Oetzel 1998). Begitu juga hasil penelitian Moore et al.
(2000), Roche et al. (2003a), Roche et al. (2003b) dan Charbonneau et al. (2006) melaporkan penurunan jumlah konsumsi bahan kering ransum akibat penurunan PKAR. Menurut Moore et al. (2000), penurunan jumlah konsumsi bahan kering pada penurunan PKAR ransum disebabkan oleh garam-garam anion yang ditambahkan dalam ransum tersebut tidak palatabel. Selain itu, terjadi penurunan pada pH darah, pH urin (Moore et al. 2000; Roche et al. 2003b; Borucki-Castro et al. 2004, Charbonneau et al. 2006), pO2 darah, Na/creat (Roche
et al. 2003b), HCO3- (Vagnoni dan Oetzel 1998, Charbonneau et al. 2006), risiko
milk fever, pCO2 darah (Charbonneau et al. 2006). Akan tetapi, terjadi
peningkatan pada Ca darah (Moore et al. 2000, Roche et al. 2003b, Charbonneau et al. 2006), Mg darah, pCO2 darah, Ca/creat, Mg/creat, Cl/creat, S/creat (Roche
et al. 2003b), Ca2+ urin (Vagnoni dan Oetzel 1998), S2- urin, Cl- urin (Takagi dan Block 1991a). Nilai PKAR tidak berpengaruh pada jumlah konsumsi ransum (Romo et al. 1991), pH darah, K+ urin (Vagnoni dan Oetzel 1998).
Espino et al. (2003) melaporkan hasil penelitiannya pada induk domba yang sedang bunting satu bulan sebelum beranak sebagai berikut. Pemberian PKAR yang semakin menurun dari +272.6 sampai dengan -88.9 meq/kg bahan kering ransum mengakibatkan penurunan pH darah (kontrol, basa, dan asam masing-masing sebesar 7.44+0.05, 7.45+0.06, dan 7.43+0.02); tetapi meningkatkan Cl -plasma (kontrol, basa, dan asam masing-masing sebesar 106.6+2.8, 106.3+4.9, dan 109.1+4.7 mmol/L); osteocakcin; Ca2+ darah (kontrol, basa, dan asam
masing-masing sebesar 2.56+0.04, 2.52+0.11, dan 2.57+0.07 mmol/L). Sebaliknya, tidak ada pengaruh pada pCO2 (kontrol, basa, dan asam masing-masing sebesar 41.30+6.80, 42.41+7.54, dan 40.54+3.09 mmHg); HCO3- (kontrol,
basa, dan asam masing-masing sebesar 29.67+6.79, 30.03+7.54, dan 27.2+3.09 mmol/L); dan kelebihan basa (kontrol, basa, dan asam masing-masing sebesar 2.79+6.84, 2.94+0.81, dan 1.82+1.13, mmol/L).
Story et al. (2004) menyatakan bahwa pH darah normal sebesar 7.35-7.45, pH darah basa sebesar >7.45, dan pH darah asam sebesar <7.35. Perhitungan nilai pH darah menurut Hu dan Murphy (2004) merupakan hasil modifikasi dari persamaan Henderson-Hasselbalch, yaitu dengan persamaan bahwa pH darah = 6.10+ log10 (HCO3)/(0.03xpCO2). Hasil penelitian Anstey (2005) terhadap nilai
albumin, pH, HCO3-, dan kelebihan basa pada berbagai keadaan darah terdapat
pada Tabel 4 .
Tabel 4 Nilai albumin, pH, HCO3- , dan kelebihan basa pada berbagai keadaan darah
Keadaan darah pH Albumin (g/L) HCO3- Kelebihan basa
Sangat asidemik 7.06 tad 11.00 -15.00
Asidemik 7.25−7.31 60.00 17.50−20.00 -8.00−-5.00
Normal 7.40 42.00 24.50 0.00
Alkalemik 7.47−7.52 25.00 29.00−31.50 +5.00−+8.00
Keterangan : tad = tidak ada data Sumber : Anstey (2005)
Sinuhaji (2007) menjelaskan bahwa pada kedaan normal, pH darah dalam rentang yang sempit agar sel tubuh dapat bekerja dengan baik. Hal ini dimungkinkan dengan adanya sistem penyangga yang dibantu mekanisme kompensasi dan koreksi fisiologis oleh paru-paru dan ginjal. Apabila darah meningkat dari normal disebut alkalemia dan sebaliknya pH darah menurun disebut asidemia. Istilah –osis (asidosis atau alkalosis) merupakan proses yang menyebabkan perubahan kadar asam atau basa dalam darah (asidemia atau alkalemia). Istilah –osis tidak selalu berarti ada perubahan pH darah dan pada asidosis metabolik tidak selalu asidemia. Hal ini karena penumpukan asam dapat dinetralisir oleh sistem penyangga yang dibantu mekanisme kompensasi dan koreksi oleh paru-paru dan ginjal. Akan tetapi, pada umumnya kedua istilah ini, -osis dan –emia selalu disamakan. Dari persamaan Henderson-Hasselbalch terlihat bahwa pH sebagai berikut.
Nilai pH dipengaruhi oleh rasio kadar bikarbonat (HCO3-) dan asam
karbonat darah (H2CO3). Kadar H2CO3 dipengaruhi oleh tekanan darah (pCO2).
Apabila rasio HCO3- dan H2CO3 berubah, pH akan berubah juga. Menurut
Kronfeld (1976), nilai pK untuk kadar bikarbonat (HCO3-) dan kadar asam
(pCO2), maka persamaan antara H2CO3 dan pCO2 adalah H2CO3 (mEq/L) =
pCO2 (mmHg) x 0.03.
Selanjutnya dijelaskan oleh Sinuhaji (2007) bahwa apabila rasio antara HCO3- dan H2CO3 berubah, pH akan naik atau turun. Penurunan pH darah di
bawah normal yang disebabkan oleh penurunan kadar HCO3- darah disebut
dengan asidosis metabolik. Sebagai kompensasi penurunan HCO3- darah, akan
dijumpai pernafasan cepat dan dalam (pernafasan Kussmaul) sehingga tekanan CO2 darah menurun (hipokarbia). Selain itu, ginjal akan membentuk HCO3- baru
(asidifikasi urin) sehingga pH urin akan asam.
Ditambahkan oleh Kronfeld (1976) bahwa apabila rasio kadar HCO3- dan
H2CO3 darah sebesar 20, <20, atau >20, maka masing-masing disebut dengan
normal, asidosis, dan basa metabolik. Asidosis metabolik adalah gangguan asam-basa yang disebabkan oleh penurunan konsentrasi HCO3 darah (Odongo et al.
2006) dan diikuti dengan perubahan K+ plasma menjadi hiperkalemia (Weiderseiner et al. 2004).
Chan et al. (2005) menyatakan bahwa turunnya pH urin merupakan cerminan pengaruh dari anion yang terkandung di dalam ransum. Moore et al. (2000) melaporkan bahwa apabila pH urin lebih rendah dari 6.0, berarti ransum yang diberikan mengandung garam-garam anion yang berlebihan pada waktu melakukan penurunan PKAR. Sebaliknya, apabila pH urin menjadi sekitar 7.3, maka kondisi ini tidak efektif untuk mengontrol hipokalsemia. Ransum dengan perbedaan kation-anion yang negatif, menurut Schonewille et al. (1994) akan mempengaruhi metabolisme Ca. Oleh karena itu, Block (1984) dan Goff et al. (1991) menyarankan ransum untuk sapi perah sebelum beranak berupa ransum dengan perbedaan kation-anion negatif untuk memperbaiki homeostasis Ca pada waktu beranak.
Perubahan pH urin dan pengeluaran Na, K, dan Cl dalam urin bervariasi sesuai dengan perbedaan kation-anion ransum apakah bersifat asam atau basa. Menurut Pratas (1992) bahwa pH urin normal sebesar 7.50–8.50, pH urin basa sebesar >8.50, dan pH urin asam sebesar <7.50. Pratas (1992) menyatakan bahwa ransum dengan penambahan Na2CO3 sebesar 240 g/kg ransum mengakibatkan
7.37 dan dari 7.90 menjadi 8.30. Sebaliknya, pH rumen dan saliva mengalami perubahan yang tidak nyata, masing-masing dari 6.72 menjadi 6.77 dan 8.34 menjadi 8.39. Roche et al. (2002) melaporkan bahwa peningkatan konsentrasi K+
dalam ransum dari 3.32 menjadi 3.83% dari bahan kering ransum, maka akan meningkatkan pH urin dari 7.69 menjadi 7.71 (sebelum beranak) dan dari 7.99 menjadi 8.09 (sesudah beranak).
Rendahnya pH urin menggambarkan pH dalam darah juga rendah (Vagnoni dan Oetzel 1998), karena terdapat hubungan antara adanya peningkatan penyerapan Ca2+ pada saluran pencernaan sehingga pengeluaran Ca pada urin juga tinggi (Vagg dan Payne 1970; Schonewille et al. 1994). Roche (1999) menyatakan bahwa terjadi peningkatan penyerapan Ca2+ dan pengeluaran Ca2+ urin pada sapi perah, jika ditambahkan garam anion dalam ransum sehingga PKAR menjadi -20 meq/100g. Hidroksiprolin (Hy) yang terdapat pada plasma darah (LeClerc dan Block 1989) maupun pada urin (Robin 1994; Russel 1997) dapat digunakan sebagai petunjuk bahwa terdapat penyerapan Ca2+ kembali dari tulang (Moore et al. 2000). Menurut Burkhalter et al. (1979), fourage banyak mengandung Cl- daripada Na+, sedangkan biji-bijian dan roughage rendah
kandungan Cl-.
Pengaruh Kandungan Nutrien pada Reproduksi Ternak Betina
Sistem produksi ternak perlu diperhatikan agar pemeliharaan lebih efisien dan berkelanjutan. Oleh karena itu, perlu melakukan pengembangan program dasar penyusunan ransum yang optimal. Penyusunan ransum yang optimal tersebut untuk menjaga atau mempertinggi reproduksi yang efisien (Hess et al. 2005).
McDonald et al. (1990) menyatakan bahwa nutrien yang terdiri atas asam amino, glukosa, asam lemak terbang atau volatile fatty acid (VFA), dan unsur-unsur lainnya akan menyebar melalui pembuluh darah ke seluruh bagian tubuh termasuk ke kelenjar hormon hipotalamus, hipofisa, dan saluran alat reproduksi. Begitu pula Hess et al. (2005) menyatakan bahwa nutrien yang masuk ke dalam tubuh akan mempengaruhi reproduksi.
Otak sebagai pusat dari sumbu reproduksi meliputi saraf-saraf neurosekretori mulai dari daerah preoptic dan bagian tengah dasar hipotalamus berujung pada stalk median eminence. Saraf-saraf tersebut mengantarkan GnRH ke hypophyseal pintu sistem pembuluh darah, membawa GnRH ke depan kelenjar pituitari (sebagai tempat sintesis dan sekresi gonadotropins, FSH, dan LH) untuk ditingkatkan. Awal pertumbuhan dan perkembangan folikel diatur oleh FSH. Sekresi GnRH dari sel neurosecretory dari bagian tengah dasar hipotalamus meningkatkan sekresi LH. Luteinizing hormone membantu pada akhir pematangan folikel sebelum ovulasi. Produksi estradiol oleh folikel ovarium pada umumnya menyebabkan daerah preoptik saraf-saraf neurosekretori mengeluarkan GnRH, dan hal ini akan menyebabkan pengeluaran LH untuk terjadi ovulasi. Ahirnya, terbentuk korpus luteum yang menghasilkan progesteron untuk menekan keluarnya GnRH dari hipotalamus. Kemunduran luteum yang diikuti dengan berkurangnya progesteron akan membiarkan proses berulang terjadi. Pemeliharaan korpus luteum yang disebabkan oleh kebuntingan induk yang diikuti dengan umpan balik negatif dan sehingga hewan betina tidak estrus selama bunting sampai sesudah beranak.
Hasil penelitian Foster et al. (1985) pada babi, kambing, dan sapi yang diberi ransum dalam jumlah yang terbatas, menunjukkan penekanan pulsa sekresi LH melalui kerja sama antara pulsa pembangkit luteinizing hormoe releasing-hormone (LHRH) dan resultan gonad. Penurunan stimulan saraf-saraf yang masuk ke dalam saraf LHRH mengakibatkan penurunan pulsa LHRH. Hal ini erat hubungannya dengan kemampuan untuk meningkatkan LHRH atau kesensitifan hipofisal terhadap steroid umpan balik negatif. Ketidakcukupan akan nutrien tersebut akan memberi pengaruh negatif pada sumbu hipotalamus-pituitari-gonadal terutama terjadi penurunan sekresi pituitari LH, yang berakibat penurunan sekresi hipotalamus GnRH (Hileman 2000; Cosgrove dan Foxcroft 1996).
Nutrien tersebut akan sangat mempengaruhi metabolisme nutrisi pada saraf-saraf pembangkit hipotalamus LHRH melalui perubahan sekresi LH pada induk babi. Hal ini ditunjukkan adanya pertumbuhan, respons folikel ovarium, dan kemungkinan termasuk terhadap sel telur dan gonadotrofi (Cosgrove et al. 1995).
Makanan mempengaruhi keselamatan embrio karena pengaruhnya pada perkembangan follikel dan sebagai akibatnya kualitas sel telur yang merupakan fungsi rangkaian luteal. Perkembangan prenatal dipengaruhi oleh hereditas, ukuran, nutrisi induk, lama kebuntingan, jumlah anak sekelahiran, posisi fetus di dalam cornua uteri, kompetisi sesama fetus, perkembangan embrio, endometrium sebelum implantasi, ukuran plasenta, dan suhu udara luar. Pada trimester pertama masa kebuntingan, pertumbuhan fetus tidak bergantung pada nutrisi induk dan besarnya fetus. Stress panas di lingkungan luar akan menghambat pertumbuhan fetus dan derajat penghambatan sebanding dengan lamanya stress (Toelihere 1981).
Cairan folikel merupakan suatu hasil transfer konstituen plasma darah dan metabolisme sel granulosa (McNatty 1978). Perubahan-perubahan dalam steroidogenesis folikuler dan sirkulasi konsentrasi steroid mungkin juga akan mempengaruhi lingkungan tuba fallopii dan uterus. Oleh sebab itu, jika ternak diberi zat-zat makanan yang kurang optimal terutama pada waktu estrus, maka kesuburan ternak tersebut akan mengalami penurunan. Histamin bersama-sama dengan prostagldanin E2 juga meningkatkan kontraksi sirkulasi oviduk dan otot longitudinal yang digambarkan pada Gambar 7.
Pada Gambar 7, estrogen (E) dan progesteron (P4) diangkut ke epitelium
oviduk oleh pemasokan darah yang mempengaruhi aliran ion Cl- transepitelial dan sekresi cairan. Histamin dan Ca2+ disekresi oleh sel darah masuk ke dalam sel
epitel sehingga Ca2+ dalam sel meningkat. Platelet-activating factor (PAF) dan ATP yang berasal dari embrio atau sperma juga meningkatkan konsentrasi Ca2+ dalam sel. Perpindahan Ca2+ dari darah ke sel epitel akan mengakibatkan Cl- juga masuk ke dalam sel epitel. Ion kalsium mempengaruhi dan meningkatkan silia di sepanjang tuba falopii.
Gambar 7 Skema beberapa faktor yang mempengaruhi sekresi cairan oviduk dan kontraksi otot halus oviduk (Leese et al. 2001). Robinson (1996) menyimpulkan bahwa ransum dengan level (kandungan vitamin, mineral, dan protein) yang sangat rendah, maka akan merusak ketahanan hidup embrio. Ransum dengan kandungan zat-zat makanan di bawah kebutuhan akan menurunkan aliran darah ke uterus yang diikuti dengan penurunan insulin dalam fetus dan IGF-I sehingga mengganggu pertumbuhan dan perkembangan fetus.
Peluang Jenis Kelamin Anak
Semen yang disekresi oleh organ reproduksi jantan terdiri atas sperma (suatu suspensi yang mengandung sel-sel gamet yang dihasilkan oleh testes) dan plasma semen (bagian cairan yang dihasilkan oleh epididimis, vesikularis, dan prostat) (Hafez 1987; Tolihere 1985). Kandungan semen meliputi, sperma, air, gula sederhana (sebagai bahan bakar bagi sperma), alkali (untuk melindungi sperma dari suasana asam pada saluran jantan uretra dan vagina), prostaglandin (bahan yang menyebabkan terjadinya kontraksi pada uterus dan tuba falopii), vitamin C, mineral seng, dan kolesterol. Selanjutnya, dijelaskan oleh Tolihere (1985) bahwa sebagian sifat fisik dan kimiawi semen ditentukan oleh plasma semen. Plasma
semen mengandung asam sitrat, ergothionine, fruktosa, glyceryphosphorylcholin, sorbitol, asam askorbat, berbagai asam amino, peptida, protein, lipid, asam lemak, sejumlah enzim, antimikroba, imunoglobulin terutama IgA, dan hormon-hormon baik steroid maupun protein (Garner dan Hafez 1987).
Johnson et al. (1997) menyatakan bahwa sperma terdiri atas kepala dan ekor yang keseluruhannya diselubungi oleh membran plasma. Toelihere (1981) menyatakan bahwa sperma merupakan suatu sel kecil, kompak, dan sangat khas, yang tidak tumbuh atau membelah diri (Gambar 8).
Gambar 8 Sperma domba (Toelihere 1981).
Pada Gambar 8, kepala sperma berbentuk oval memanjang, lebar, dan datar; di dalamnya berisi materi inti berupa kromosom yang terdiri atas deoxyribonucleic acid (DNA) yang bersenyawa dengan protein. Bagian anterior kepala diselubungi oleh akrosoma, sedangkan bagian posterior oleh posterior nukleus. Gilbert (1988) menyatakan bahwa akrosom tersebut berasal dari aparatus golgi yang banyak mengandung enzim-enzim pencerna protein dan gula. Sebaliknya, pada bagian ekor yang menghubungkan dengan kepala membentuk pilinan mitokondria yang mengandung selubung berserat dan mengandung mikrotubulus tunggal tanpa selubung (pada ujung ekor).
Membran plasma Acrosoma Nukleus
Selubung posterior nukleus Selubung mitokondria Selubung ekor Ekor Bagian ujung Bagian utama Bagian tengah Kepala
Lapisan luar selubung akrosoma dapat tanggal secara spontan di dalam caput epididymis pada waktu istirahat aktivitas seksual yang lama atau selama pembuahan. Terjadi penanggalan karena pemecahan selubung sel dan selubung luar akrosoma sehingga mengeluarkan bahan-bahan akrosomal berupa enzim-enzim hyalurodinase atau zona lysin yang diperlukan untuk melakukan penerobosan pada dinding ovum. Selubung mitokondria berasal dari pangkal kepala membentuk dua struktur spiral ke arah berlawanan dengan arah jarum jam, yang membungkus 11 fibril di bawahnya. Guyton (1983) menyatakan bahwa sel sperma mengelompok pada bagian leher (antara tengah dan kepala) yang mengandung dua pasang mikrotubulus dan sembilan mikrotubulus ganda tersusun di bagian pinggirnya, sedangkan mitokondria mengelompok pada bagian tengah. Norman et al. (1958) menyatakan bahwa pada suatu media dengan pH 5.5 akan terjadi ionisasi H+ yang berlebih dengan satu atau lebih enzim dan mengaktifkan aktivitas katalitik pada sperma sehingga mempengaruhi siklus metabolis dan terjadi penurunan pada respirasi, glikolisis, dan motilitas. Navarro et al. (2007) melaporkan bahwa pH intraseluler sangat mempengaruhi potensi membran sperma. Woo et al. (2000) menyatakan bahwa Na, K-ATPase adalah suatu heteromerik yang merupakan bagian membran protein yang bertanggung jawab untuk translokasi dari 3 Na+ keluar dari sel dan 2 K+ masuk ke dalam sel dengan menggunakan energi dari hidrolisis 1 mol ATP. Pada sperma, Na, K-ATPase berada di mitokondria. Ditambahkan bahwa pergerakan mikrotubular dijalankan oleh motor dinein. Bagian luar dinein amat sensitif terhadap ion H+. Apabila di bagian luar dinein bersuasana asam, motor tidak bergerak sehingga flagela juga tidak bergerak dan sperma menjadi tidak bergerak juga. Inhibitor Na+,K+-ATPase adalah ouabain, Na+/H+ exchanger, dan amiloride. Murer et al. (2001) melaporkan bahwa sperma tikus yang tidak mengandung inhibitor protease atau protease nexin-1, akan mengalami aglutinasi sperma di vagina dan pada uterusnya tidak ditemukan adanya sperma tersebut.
Ekor sperma terdiri atas bagian tengah, utama, dan ujung. Ujung anterior bagian tengah yang berhubungan dengan kepala disebut dengan daerah implantasi. Pemisahan kepala dan ekor terjadi di bagian ini apabila testes kepanasan atau jika hewan menderita demam tinggi. Pada bagian tengah terdapat
mitokondria yang memberi energi untuk kehidupan dan pergerakan sperma. Bagian ini kaya akan phospholipid, lecithin, dan plasmalogen. Plasmalogen mengandung satu fosfolipid lesitin dan satu asam lemak yang berhubungan dengan gliserol maupun asam fosfat atau kolin. Asam-asam lemak dapat dioksidasi dan merupakan sumber energi endogen untuk aktivitas sperma. Pada bagian utama ekor atau axial core terdiri atas dua serabut sentral yang dikelilingi oleh suatu cincin konsentrik yang terdiri atas sembilan fibril rangkap. Ekor sperma mempunyai semua sarana yang diperlukan untuk motilitas sehingga walaupun ekor yang telah terpisah dari kepala sperma masih dapat bergerak seperti sediakala. Ekor merupakan perpanjangan sentriol yang menyerupai silia. Ekor diselimuti oleh membran yang banyak mengandung ATP yang berfungsi sebagai energi sehingga sperma dapat bergerak masuk menuju ke dalam saluran reproduksi betina. Kecepatan pergerakan sperma domba pada suhu 37o C sebesar 200−250 μm/detik (Toelihere 1981).
Motilitas sperma merupakan salah satu kriteria penting dari kualitas sperma (Lapointe et al. 1998). Pergerakan sperma dipengaruhi oleh ukuran, musin seperti glikoprotein, dan immobilin (Carr et al. 1985). Gerakan sperma memegang peranan penting dalam pengangkutan melewati lendir dari serviks, melewati pertemuan tuba-uterus, dan selama menembus pembungkus sel telur sebelum terjadi pembuahan. Perjalanan sperma di dalam saluran alat reproduksi dipengaruhi oleh kontraksi vagina (untuk masuk ke dalam serviks kemudian sperma berenang melalui mukus), kontraksi kuat uterus, gerakan aktif sperma itu sendiri dengan gerakan ekor untuk bertemu dengan telur (di dalam tuba), gerakan sperma dibantu oleh aktivitas kontraksi otot polos tuba dan juga oleh aliran sekresi tuba ke arah ovarium dan rongga perut (Wodzicka-Tomaszewska et al. 1991). Perjalanan sperma masuk ke dalam tuba fallopii dari vagina dari luar serviks ke dalam terusan serviks dengan cepat, dipengaruhi oleh estrogen dan serviks mengeluarkan mukus hidrat yang tinggi, kadang-kadang melebihi 96% berupa air pada wanita (Suarez dan Pacey 2006). Hunter et al. (1980) menyatakan bahwa bagian kaudal isthmus dari tuba fallopii berfungsi sebagai tempat penyimpanan sperma selama sebelum ovulasi. Sperma-sperma ini bergabung dengan epitelium dan tinggal hidup untuk beberapa hari. Menurut
Wodzicka-Tomaszewska et al. (1991), akrosom akan dilepaskan beberapa saat sebelum sperma memasuki sel telur. Pelepasan akrosom ini sangat penting untuk menetrasi dan melangsungkan pembuahan. Ingermann et al. (2002) menyatakan bahwa gerakan sperma terhambat oleh pH yang rendah dan terjadi penurunan gerakan sperma dari 70 menjadi 32% apabila terjadi penurunan pH dari 7.5–8.5 menjadi 6.45. Carr et al. (1985) menyatakan bahwa gerakan sperma pada semua spesies dihambat oleh cairan yang mempunyai pH rendah karena membran pada sperma tidak permeabel terhadap ion H+ dan pH intraselluler sperma lebih tinggi. Penambahan asam laktat ke dalam buffer pH 7.5 menjadi 4.5 sebagai bahan pengencer sperma akan menghambat dan menurunkan gerakan sperma tikus dan hamster. Menurut Green dan Fishel (1999), faktor-faktor pada cairan oviduk seperti Ca bebas, Na, K, dan substrat energi dapat menyebabkan kemampuan sperma menjadi hiperaktif dalam menyediakan gaya yang dibutuhkan dalam penetrasi penanaman sel telur.
Pada bagian kepala terdapat inti sel dengan DNA-nya yang merupakan materi genetik jantan dan akrosom dengan enzim-enzim hidrolitik yang diperlukan untuk menembus dinding ovum pada waktu fertilisasi (Toelihere 1981). Menurut Gilbert (1988), setiap sel sperma terdiri atas suatu inti haploid, sistem penggerak sperma, dan kumpulan enzim yang dapat membantu inti memasuki sitoplasma sel telur pada saat fertilisasi. Komponen utama suatu inti sel adalah kromatin yang mengandung DNA. Pada saat maturasi sebagian besar organel pada sitoplasma sperma akan menghilang dan tinggal beberapa organel termodifikasi yang tetap melangsungkan fungsi sperma dan inti haploid mengalami perubahan sehingga pilinan serat DNA kromatin (serat berwarna) mengalami pemadatan menjadi pendek dan tebal yang disebut dengan kromosom (badan berwarna).
Kromosom adalah unsur utama dalam penentuan jenis kelamin. Pada mamalia terdapat 46 kromosom yang terdiri atas dua macam kromosom, yaitu XY pada jantan dan XX pada betina. Hafez (1987) menyatakan bahwa kromosom yang dikandung sperma disebut dengan kromosom kelamin, yaitu kromosom X (sperma X) membawa sifat-sifat kebetinaan dan kromosom Y (sperma Y) membawa sifat-sifat kejantanan. Kromosom sperma merupakan faktor penentu