Antibiotik merupakan senyawa organik yang dihasilkan oleh mikroorganisme hidup, yaitu bakteri dan jamur, yang berkhasiat mematikan (bakterisid) atau menghambat pertumbuhan (bakteriostatik)
mikroorganisme lain serta toksisitasnya bagi manusia relatif kecil. Antibiotik dapat digolongkan dalam dua aspek, yaitu berdasarkan struktur kimia dan spektrum kerjanya
Berdasarkan struktur kimia:
1. Golongan Penisilin Amoksisilin, Ampisilin 2. Golongan Sefalosporin Sefileksin
3. Golongan Tetrasiklin Tetrasiklin, Tetrasiklin HCl, Klortetrasiklin HCl, Oksitetrasiklin HCl 4. Golongan Linkosamid Klindamisin
5. Golongan Kuinolon Siprofloksasin 6. Golongan Makrolida Eritromisin
7. Golongan Kloramfenikol Kloramfenikol, Kloramfenikol palmitat, Kloramfenikol sodium suksinat, Tiamfenikol
8. Golongan Aminoglikosid Neomisin Sedangkan, berdasarkan spektrumnya:
1. Spektrum luas efektif terhadap bakteri gram positif dan gram negatif. Contoh : tetrasiklin, kloramfenikol.
2. Spektrum sempit efektif terhadap bakteri gram positif atau gram negatif saja. Contoh : streptomisin (Gram negatif).
Apabila antibiotik berada dalam suatu sediaan lakukan pemisahan melalui ekstraksi. Beberapa metode ekstraksi antara lain :
1. Ekstraksi padat-cair berdasarkan kelarutan zat dalam pelarut.
Prinsip: melarutkan zat uji dalam sampel padat (pengojokan kemudian disaring, sentrifugasi, atau dekantasi) dengan pelarut yang dapat melarutkan zat dengan baik.
2. Ekstraksi cair-cair bergantung pada Kd dan rasio distribusi (D) zat uji dalam pelarut organik/air. Beberapa jenis analisis pendahuluan yang dapat digunakan untuk mengidentifikasi antibiotik, antara lain : 1. Warna
a. Tidak berwarna Contoh : Penisilin, Eritromisin, Kloromisetin. b. Larutan coklat merah Contoh : Rifampisin
2. Rasa rasa sangat pahit kloramfenikol 3. Bau bau khas Penisilin
4. Higroskopis Streptomisin, Kanamisin, dan Rifampisin 5. Kelarutan:
a. mudah larut dalam air : bentuk garam sulfat, kloridanya b. tidak larut air : garam palmitat / stearat
Selanjutnya dapat dilakukan uji kualitatif: 1. Reaksi Warna
a. Zat uji direaksikan dengan 2 mL H2SO4 pekat kemudian dikocok, maka akan terbentuk: — Warna kuning: Streptomisin, Eritromisin, Oksitetrasiklin, Klortetrasiklin, Kloramfenikol — Warna jingga: Tetrasiklin
— Warna kuning coklat: Penisilin
b. Zat uji direaksikan dengan Difenilamin 1% akan menghasilkan senyawa berwarna biru, yaitu Kloramfenikol.
c. Zat uji direaksikan dengan H2SO4 pekat lalu ditambahkan resorcin, maka akan terbentuk: — Warna kuning hijau: Penisilin
— Warna merah: Streptomisin
d. Zat uji direaksikan dengan 2 mL NaOH 40% dan dipanaskan kemudian dikocok dengan piridin, maka akan terbentuk dua lapisan yaitu lapisan piridin berwarna merah dan lapisan air berwarna kuning. Contohnya adalah Tetrasiklin, Oksitetrasiklin, dan Klortetrasiklin.
e. Zat uji direaksikan dengan FeCl3, maka akan terbentuk warna coklat muda pada Tetrasiklin, Oksitetrasiklin, dan Klortetrasiklin.
f. Zat uji direaksikan dengan HCl lalu ditambahkan NaOH sampai netral, kemudian ditambahkan FeCl3, maka akan terbentuk warna ungu, yaitu Streptomisin.
g. Zat uji direaksikan dengan HNO3 pekat, maka akan terbentuk: — Warna kuning coklat: Tetrasiklin
— Warna kuning muda: Penisilin
— Warna jingga: Tetrasiklin, Oksitetrasiklin, dan Klortetrasiklin
h. Zat uji direaksikan dengan H2SO4 dan NaNO2, maka akan menghasilkan larutan berwarna jingga, yaitu Tetrasiklin, Oksitetrasiklin, dan Klortetrasiklin.
i. Zat uji direaksikan dengan vanilin dan H2SO4, maka akan terbentuk: — Warna ungu hijau: Tetrasiklin dan Klortetrasiklin
— Warna merah hijau: Oksitetrasiklin
j. Zat uji direaksikan dengan 5 tetes tembaga nitrat kemudian dipanaskan, maka akan terbentuk: — Warna hijau kuning: Penisilin
— Warna kuning muda: Streptomisin
— Warna abu-abu coklat: Kloramfenikol dan Eritromisin
k. Zat uji direaksikan dengan Na nitroprussid, ferisianida, dan NaOH maka akan membentuk larutan berwarna merah jingga, yaitu Streptomisin.
l. Zat uji diasamkan dengan HCl dan ditambahkan serbuk zink, kemudian dipanaskan selama 5 menit. Setelah itu, ditambahkan 2 tetes NaNO2 10% dan dikocok dengan -naftol basa, maka akan membentuk larutan berwarna merah, contohnya adalah Kloramfenikol.
2. Identifikasi Gugusan a. Gugus Aromatis
Reaksi Marquis
Larutan zat + 1 ml formaldehid + H2SO4 (p) terbentuk cincin berwarna kuning-jingga-merah. b. Gugus OH
Reaksi Diazo
Reagen: Diazo A = asam sulfanilat + HCl + NaOH, Diazo B = NaNO2 dalam air
Larutan zat + Diazo A:B (4:1) + NaOH panaskan merah frambors. Untuk membedakan dengan fenol, bila di tambahkan amil alkohol warna merah akan tertarik.
c. Gugus Keton Reaksi Legalrothera
Larutan zat + larutan Na-Nitroprussid + 1 gr NH4Cl atau (NH4)2SO4 + 2 ml NaOH ungu/biru dan lama-lama warna hilang.
Zat + KI + KIO3 + amilum warna biru e. Membedakan amin primer, sekunder, dan tersier
Reaksi Rumini
5 ml Larutan zat uji + 2 ml larutan aseton 1% + beberapa tetes Na nitroprusid 5%. Warna ungu muncul dan lama-kelamaan berubah menjadi merah amin primer
Warna biru muncul amin sekunder f. Gugus Eter
Reaksi Weber
Reagen : 1% fluoroglusin dalam H2O/Hg + H2SO4 Zat + pereaksi + H2SO4 merah
g. Gugus Halogen Pereaksi Beilstein
Kawat Cu dicelupkan ke HNO3, kemudian dipijar sampai warna hijaunya hilang. Celupkan kawat Cu ke dalam zat, kemudian dipijar kembali dan amati warna. Reaksi ini positif bila warna pijarnya hijau.
3. Identifikasi Umum Golongan a. Reaksi Vitalli Morin
5 mg zat uji + 0,5 ml HNO3(p), kemudian diuapkan di WB sampai kering dan dinginkan berwarna kuning, dilarutkan dalam 5 ml aseton + 1 ml NaOH 0,1 N KOH-etanol warna ↓ jingga coklat. Reaksi ini untuk identifikasi gugus N Heterosiklik, khususnya pada cincin -laktam golongan Penisilin dan Sefalosporin.
b. Reaksi Benedict
Zat uji + 0,5 ml pereaksi Benedict, kemudian dipanaskan selama 3 menit merah bata. Reaksi ini untuk identifikasi senyawa dengan 4 gugus OH pada cincin non aromatis, yaitu golongan Tetrasiklin.
c. Rekasi Fehling
Zat uji direaksikan dengan pereaksi fehling A-fehling B (1:1) kemudian dipanaskan, maka akan terbentuk larutan berwarna merah bata, yaitu golongan Tetrasiklin dan Aminoglikosida.
d. Reaksi Mollisch
2 ml larutan zat uji + pereaksi mollisch (5 tetes α-naftol 3% dalam spiritus) + 2 ml H2SO4 cincin ungu. Reaksi Identifikasi senyawa gula, yaitu pada golongan Aminoglikosida.
e. Reaksi Mayer
Pereaksi: 1 gr raksa klorida (HgCl2) + 4 gr KI.
Zat + pereaksi Mayer + HCl 2N ↓ kuning / lar. Kuning
Reaksi ini untuk identifikasi gugus N heterosiklik, yaitu pada golongan Linkosamid dan Fluorokuinolon.
f. Reaksi Wassicky
Zat uji direaksikan dengan p-DAB dan H2SO4 pekat, maka akan terbentuk warna kuning muda untuk Kloramfenikol dan Penisilin.
Tabel Analisis Sediaan Antibiotik A. Golongan Penisilin
a. Penisilin bau spesifik
Zat + H2SO4(p) + DFA 1% + Resorcin kuning hijau Zat +5 tetes Cu(NH3) Nitras, panaskan hijau kuning
c. Reaksi Iodazida
2 ml lar 0,003 N Iodium (3 ml 0,1 N I2 + 100 ml air) + beberapa tetes lar kanji + 100 mg Na azida padat biru + 50 mg zat kocok warna hilang atau larutan menjadi jernih gelembung nitrogen dari penisilin.
1) AMOKSISILIN
- Isolasi: Sejumlah isi kapsul yang mengandung setara dengan 0,5 g amoksisilin, ditambah dengan 5 ml air. Kemudian didapat filtrat dan residu. Residu yang didapat cuci dengan etanol 96% hingga didapat filtrat dan residu. Lalu residunya dicuci dengan eter. Maka didapat filtrat dan residu. Residu yang didapatkan dikeringkan pada tekanan tidak lebih dari 0,7 kPa selama 1 jam. Residu ini yang akan digunakan untuk identifikasi dengan TLC.
TLC
- Larutan standard: 4 mg/ml pada USP amoxicillin RS dalam 0.1 N asam hidroklorat.
- Larutan sampel: ekuivalen dengan 4 mg/mL dari amoksisilin serbuk kapsul dalam 0,1 N asam Hidroklorat.
- Adsorbent: 0,25 mm lapisan kromatografi silika Gel - Volume aplikasi: 5 mikroliter
- Sistem larutan pengembang: metanol, chloroform, pyridine, air (9:8:1:3)
- Reagen penyemprot: 3 mg/mL dari ninhydrin dalam alcohol
- Analisis sampel: Siapkan larutan sampel, larutan standar, dan kembangkan kromatogram. Pada saat pelarut depan telah bergerak sekitar ¾ dari panjang lempeng, pindahkan lempeng dari chamber, tandai pelarut depan, dan keringkan dalam udara hangat selama 10 menit. Buatlah titik pada lempeng sambil disemprot halus dengan reagen penyemprot dan keringkan pada suhu 110°C selama 15 menit.
- Kriteria penerimaan: nilai Rf untuk titik larutan sampel harus sesuai dengan larutan standar.
Spektrofotometri Infra Merah (IR)
Zat didispersikan dalam kalium bromida P. Puncak-puncak spektrum yang utama terlihat pada bilangan
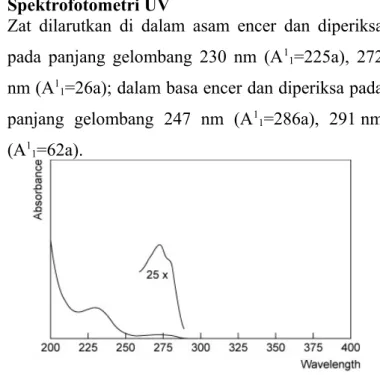
Spektrofotometri UV
Zat dilarutkan di dalam asam encer dan diperiksa pada panjang gelombang 230 nm (A11=225a), 272 nm (A11=26a); dalam basa encer dan diperiksa pada panjang gelombang 247 nm (A11=286a), 291 nm (A11=62a).
Gambar 2. Spektrum Serapan Amoksisilin
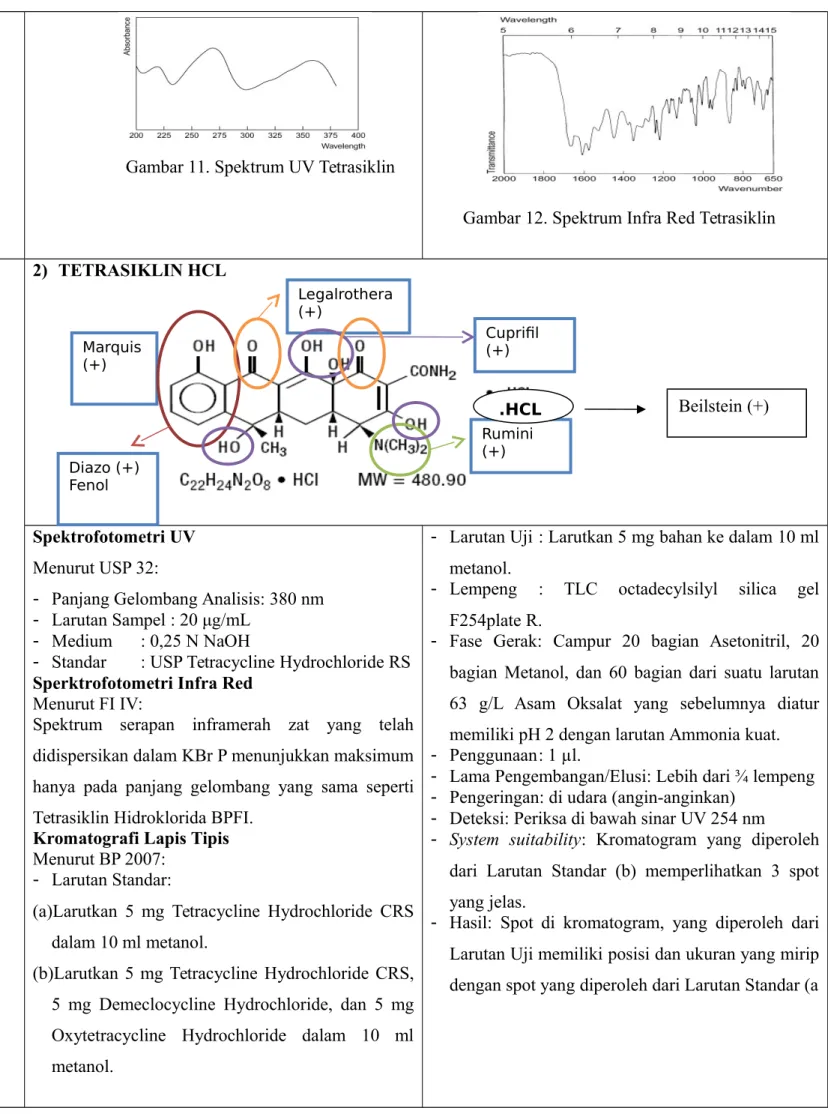
High Performance Liquid Chromatography
(HPLC)
Pada metode ini dapat digunakan dua sistem. Sistem pertama yaitu sistem HY yang menghasilkan indeks retensi (RI) 226. Sistem kedua yaitu sistem HAA yang menghasilkan waktu retensi 3,1 menit. - Tipe: Kromatografi cair
- Detektor: UV 230 nm
- Kolom: 4 mm x 25 cm; berisi bahan pengisi L1 - Volume injeksi: 10 µl
- Laju alir: lebih kurang 1,5 ml/menit. - Faktor kapasitas (k’): 1,1 - 2,8
- Efisiensi kolom: NLT 1700 lempeng teoritis - Faktor ikutan: NMT dari 2,5
gelombang 1775, 1684, 1613, 1583, 1248, 1313 cm−1.
Gambar 1. Spektrum IR Amoksisilin Gambar 3. HPLC Kromatogram Amoksisilin
2) AMPISILIN TLC
a. Ampisilin Kapsul
- Larutan standar: 5 mg/ml USP Ampisilin RS dalam campuran aseton dan 0,1 N asam hidroklorat (4:1)
- Larutan Sampel: 5 mg/ml ampisilin, dari serbuk tablet dalam campuran aseton dan 0,1 N asam hidroklorat (4:1)
- Adsorbent: 0,25 mm kromatografi lapisan yang terbuat dari campuran silika gel.
- Volume aplikasi: 2 mikroliter
- Sistem pelarut pengembang: aseton, toluen, asam asetat glasial, dan air (26:4:1:4)
- Reagen penyemprot: 3 mg/ml ninhidrin dalam alkohol
- Analisis sampel: Siapkan larutan sampel, larutan standar, dan kembangkan kromatogram. Pada saat pelarut depan telah bergerak sekitar ¾ dari panjang lempeng, pindahkan lempeng dari chamber, tandai pelarut depan, dan keringkan dalam udara hangat selama 10 menit. Buatlah titik pada lempeng sambil disemprot halus dengan reagen penyemprot dan keringkan pada suhu 90°C selama 15 menit.
- Kriteria penerimaan: nilai Rf titik larutan sampel harus sesuai dengan larutan standar.
b. Ampisilin Tablet
Spektrofotometri UV
Sampel dilarutkan di dalam asam encer dan diperiksa serapannya pada panjang gelombang 257 nm (A11=9.2a), 262 nm, dan 268 nm.
Gambar 6. Spektrum Serapan Ampisilin
High Performance Liquid Chromatography
(HPLC)
Pada metode ini dapat digunakan dua sistem. Sistem pertama yaitu sistem HY yang menghasilkan indeks retensi (RI) 226. Sistem kedua yaitu sistem HAA yang menghasilkan waktu retensi 3,8 menit.
- Fase Gerak: Asetonitril, air, kalium fosfat monobasa 1M, asam asetat 1N (80:909:10:1) - Pengencer: Air, kalium fosfat monobasa 1M,
asam asetat 1N (989:10:1) - Tipe: Kromatografi cair (LC) - Detektor: UV 254 nm
- Kolom: 4 mm x 30 cm;berisi bahan pengisi L1 dengan ukuran partikel 5-10 µm
- Pre-kolom: 4 mm x 5 cm; 5-10µm L1 - Laju alir: 2 ml/menit
- Identifikasi: Serbukkan satu atau lebih tablet ampisilin, buat larutan yang mengandung 5 mg per ml dalam campuran pelarut aseton P-asam klorida 0,1 N (4:1); lakukan uji identifikasi seperti tertera pada Kapsul Ampisilin.
Spektrofotometri Infra Merah (IR)
Zat didispersikan dalam kalium bromida P. Puncak-puncak spektrum yang utama terlihat pada bilangan gelombang 1775, 1693, 1526, 1308, 1497, 1583 cmˉ1 .
Gambar 5. Spektrum IR Ampisilin
- Tailing factor: NMT 1,4
- Faktor kapasitas (k’): NMT 2,5 - Standar deviasi relatif: NMT 2,0%
Gambar 7. HPLC Kromatogram Amoksisilin dan Ampisilin
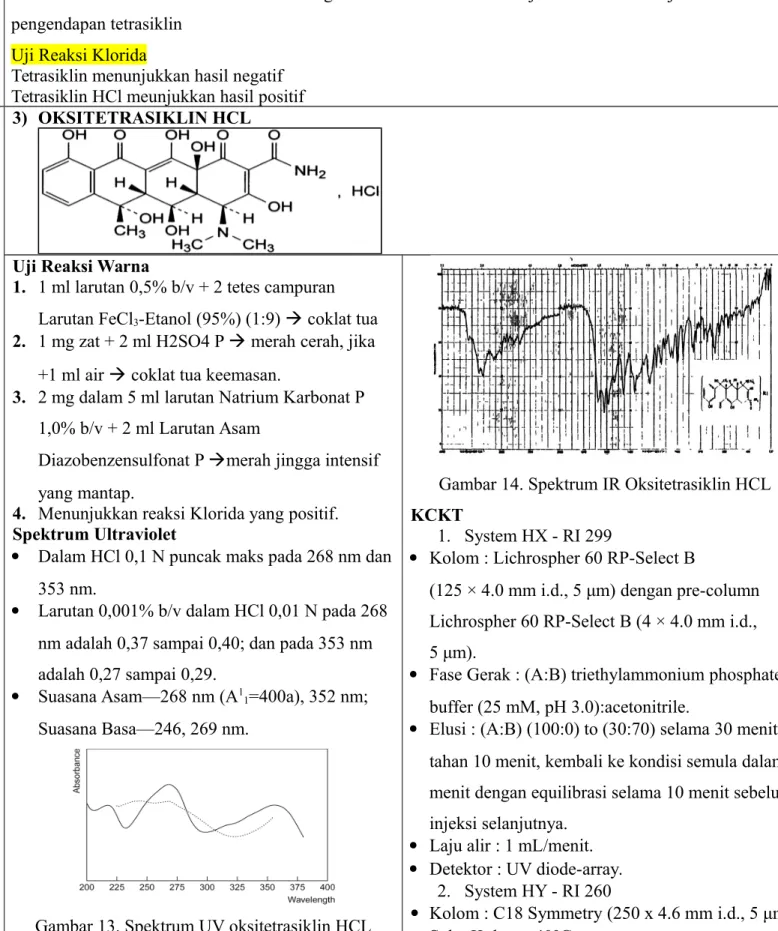
Perbedaan Amoksisilin dan Ampisilin
Perbedaan Amoksisilin Ampisilin
Rumus Bangun
Reaksi Diazo (+) positif (-) negative
Waktu Retensi 3,1 menit 3,8 menit
Fluoresensi (-) Gelap (+) Terang
3) ASAM KLAVULANAT Spektrofotometri UV
Gambar 9. Spektrum Serapan Amoksisilin dan Asam Klavulanat
- Larutan uji: Encerkan secara kuantitatif sejumlah volume Amoksisilin dan Kalium Klavulanat untuk Suspensi Oral yang diukur saksama, yang dikonstitusi seperti tertera pada etiket, dengan air hingga kadar amoksisilin lebih kurang 0,5 mg per ml. Aduk dengan pengaduk mekanik selama 10 menit dan saring. Gunakan filtrat sebagai Larutan uji
High Performance Liquid Chromatography
(HPLC)
- Definisi: Amoksisilin dan Kalium Klavulanat untuk Suspensi Oral mengandung amoksisilin, C16H19N3O5S, setara dengan tidak kurang dari 90,0% dan tidak lebih dari 120,0% dari yang tertera pada etiket, dan mengandung asam klavulanat, C8H9NO5, setara dengan tidak kurang dari 90,0% dan tidak lebih dari 125,0% dari jumlah yang tertera pada etiket. Mengandung satu atau lebih dapar, pewarna, penambah rasa, pengawet, penstabil, pemanis dan bahan pensuspensi.
- Fase gerak: campuran dapar natrium fosfat pH 4,4 dan metanol P (95:5)
- Larutan baku: Timbang saksama sejumlah Amoksisilin BPFI dan Litium Klavulanat BPFI larutkan dalam air hingga diperoleh kadar berturut-turut lebih kurang 0,5 dan 0,2 mg per ml.
dalam waktu 1 jam setelah suspensi diencerkan.
- Tipe: Kromatograf cair (LC) - Detektor: UV 220 nm
- Kolom: 4 mm x 30 cm; berisi bahan pengisi L1 dengan ukuran partikel 3-10 µm
- Laju alir: lebih kurang 2 ml per menit.
- Resolusi(R): NLT dari 3,5 antara puncak amoksisilin dan asam klavulanat
- Efisiensi kolom: NLT 550 lempeng teoritis untuk masing-masing puncak analit
- Tailing factor: NMT 1,5 untuk masing-masing puncak analit
- Simpangan baku relatif: NMT 2,0%.
Gambar10. HPLC Kromatogram Asam Klavulanat dan Amoksisilin
B. GOLONGAN TETRASIKLIN
1) TETRASIKLIN
Kromatografi Lapis Tipis
Sistem TA-Rf 05
- Pelat: Silika Gel G, tebal 250 μm, direndam atau disemprot dengan 0,1M KOH dalam metanol, dan dikeringkan.
- Fase Gerak: Metanol:Larutan ammoniak kuat (100:1,5)
Kromatografi Cair Kinerja Tinggi
- Sistem HX-RI 314; Sistem HY-RI 265; Sistem HAA-Waktu retensi 9,9 menit. (Clarke's Analysis of Drugs and Poisons, 2005)
- System HX
Kolom: Lichrospher 60 RP-Select B (125 × 4.0 mm
Marquis (+)
Diazo (+) Fenol
Rumini (+)
Legalrothera (+)
Sistem TB-Rf 00
- Pelat: Silika Gel G, tebal 250 μm, direndam atau disemprot dengan 0,1M KOH dalam metanol, dan dikeringkan.
Fase Gerak: Sikloheksan - Toluen - Dietilamin (75:15:10)
Sistem TAE-Rf 88
- Pelat: Silika Gel G, tebal 250 μm. - Fase Gerak: Metanol
Dilihat di bawah sinar ultraviolet, memberikan fluoresensi orange; Diasamkan dengan larutan kalsium permanganat, memberikan hasil positif. (Clarke's Analysis of Drugs and Poisons, 2005)
Kromatografi Gas
Berdasarkan TIAFT Book (de Zeeuw 2002):
- Kolom: 3% SE-30 atau OV-1 pada 80 hingga 100 mesh Chromosorb G HP (Dicuci dengan asam dan dimethyldichlorosilane treated), 2m x 2 mm i.d.glass column; Sangat penting bahwa support-nya dimatikan.
- Temperatur kolom: Normalnya antara 100o dan 300o; Untuk kondisi isotermal, panduan untuk temperaturnya kira-kira adalah menggunakan RI:10.
- Gas pembawa: Nitrogen 45 ml/menit.
- Kolom kapiler: 10 hingga 15m x 0,32 atau 0,53 mm, 100%-dimethyl-PSX (X-1)dengan tebal film 1,5 hingga 3 μm.
- Gas pembawa: Helium.
- Temperatur programme: 4 menit pada 135o, 13o/menit hingga 200o, 6o/menit hingga 312o, 6 menit terakhir ditahan.
Spektrum UV
Dalam asam encer, spektrum puncak tampak pada 270 nm (A11=417a), dan 356 nm. (Clarke's Analysis of Drugs and Poisons, 2005)
i.d., 5 μm) dengan pre-column Lichrospher 60 RP-Select B (4 × 4.0 mm i.d., 5 μm).
Fase Gerak: (A:B) triethylammonium phosphate
buffer (25 mM, pH 3.0) - acetonitrile.
Elusi: (A:B) (100:0) to (30:70) selama 30 menit,
tahan 10 menit, kembali ke kondisi semula dalam 3 menit dengan equilibrasi selama 10 menit sebelum injeksi selanjutnya.
Laju alir : 1 mL/menit Detektor: UV diode-array - Sistem HY
Kolom: C18 Symmetry (250 x 4.6 mm i.d., 5 μm) Suhu Kolom: 40°C
Fase Gerak : Terdiri dari 2 campuran larutan, yaitu
0.5 mL Asam Sulfat 2.5M dalam air 500 mL dan 0,5 mL Asam Sulfat 2.5M dalam asetonitril 500 mL
Detektor: UV diode-array
- Sistem HAA
Kolom: C8 Symmetry (250 × 4.6 mm i.d., 5 μm) dengan Symmetry C18 pre-column (20 mm).
Suhu Kolom: 30°C
Fase Gerak : (A:B) yaitu Buffer Fosfat (pH 3.8) :
Asetonitril
Laju alir : 1 mL/menit untuk 6.5 menit,
kemudian meningkat secara linier pada 1.5 mL untuk 6,5 hingga 25 menit dan diamkan selama 3 menit (setimbangkan kembali dengan membuat laju alir pada 1.5 mL/menit)
Detektor: UV diode-array
Spektrum IR (Infra Red)
Puncak-puncak spektrum yang utama nampak pada bilangan gelombang 1612, 1580, 1660, 1226, 1248, 1530 cm−1.(Clarke's Analysis of Drugs and Poisons, 2005)
Gambar 11. Spektrum UV Tetrasiklin
Gambar 12. Spektrum Infra Red Tetrasiklin
2) TETRASIKLIN HCL
Spektrofotometri UV
Menurut USP 32:
- Panjang Gelombang Analisis: 380 nm - Larutan Sampel : 20 μg/mL
- Medium : 0,25 N NaOH
- Standar : USP Tetracycline Hydrochloride RS
Sperktrofotometri Infra Red
Menurut FI IV:
Spektrum serapan inframerah zat yang telah didispersikan dalam KBr P menunjukkan maksimum hanya pada panjang gelombang yang sama seperti Tetrasiklin Hidroklorida BPFI.
Kromatografi Lapis Tipis
Menurut BP 2007: - Larutan Standar:
(a)Larutkan 5 mg Tetracycline Hydrochloride CRS dalam 10 ml metanol.
(b)Larutkan 5 mg Tetracycline Hydrochloride CRS, 5 mg Demeclocycline Hydrochloride, dan 5 mg Oxytetracycline Hydrochloride dalam 10 ml metanol.
- Larutan Uji : Larutkan 5 mg bahan ke dalam 10 ml metanol.
- Lempeng : TLC octadecylsilyl silica gel F254plate R.
- Fase Gerak: Campur 20 bagian Asetonitril, 20 bagian Metanol, dan 60 bagian dari suatu larutan 63 g/L Asam Oksalat yang sebelumnya diatur memiliki pH 2 dengan larutan Ammonia kuat. - Penggunaan: 1 µl.
- Lama Pengembangan/Elusi: Lebih dari ¾ lempeng - Pengeringan: di udara (angin-anginkan)
- Deteksi: Periksa di bawah sinar UV 254 nm - System suitability: Kromatogram yang diperoleh
dari Larutan Standar (b) memperlihatkan 3 spot yang jelas.
- Hasil: Spot di kromatogram, yang diperoleh dari Larutan Uji memiliki posisi dan ukuran yang mirip dengan spot yang diperoleh dari Larutan Standar (a Marquis (+) Diazo (+) Fenol Rumini (+) Legalrothera (+) Cuprifil (+) .HCL Beilstein (+)
Perbedaan Tetrasiklin dan Tetrasiklin HCl
• Pada Kelarutannya
Tetrasiklin : Larut 1 bagian dalam 2500 bagian air.
Tetrasiklin HCl : Larut dalam 10 bagian air. Larutan dalam air jika dibiarkan menjadi keruh karena pengendapan tetrasiklin
• Uji Reaksi Klorida
Tetrasiklin menunjukkan hasil negatif Tetrasiklin HCl meunjukkan hasil positif
3) OKSITETRASIKLIN HCL
Uji Reaksi Warna
1. 1 ml larutan 0,5% b/v + 2 tetes campuran
Larutan FeCl3-Etanol (95%) (1:9) coklat tua
2. 1 mg zat + 2 ml H2SO4 P merah cerah, jika
+1 ml air coklat tua keemasan.
3. 2 mg dalam 5 ml larutan Natrium Karbonat P
1,0% b/v + 2 ml Larutan Asam
Diazobenzensulfonat P merah jingga intensif yang mantap.
4. Menunjukkan reaksi Klorida yang positif. Spektrum Ultraviolet
Dalam HCl 0,1 N puncak maks pada 268 nm dan 353 nm.
Larutan 0,001% b/v dalam HCl 0,01 N pada 268 nm adalah 0,37 sampai 0,40; dan pada 353 nm adalah 0,27 sampai 0,29.
Suasana Asam—268 nm (A11=400a), 352 nm; Suasana Basa—246, 269 nm.
Gambar 13. Spektrum UV oksitetrasiklin HCL
Gambar 14. Spektrum IR Oksitetrasiklin HCL
KCKT
1. System HX - RI 299
Kolom : Lichrospher 60 RP-Select B
(125 × 4.0 mm i.d., 5 μm) dengan pre-column Lichrospher 60 RP-Select B (4 × 4.0 mm i.d., 5 μm).
Fase Gerak : (A:B) triethylammonium phosphate buffer (25 mM, pH 3.0):acetonitrile.
Elusi : (A:B) (100:0) to (30:70) selama 30 menit, tahan 10 menit, kembali ke kondisi semula dalam 3 menit dengan equilibrasi selama 10 menit sebelum injeksi selanjutnya.
Laju alir : 1 mL/menit. Detektor : UV diode-array.
2. System HY - RI 260
Kolom : C18 Symmetry (250 x 4.6 mm i.d., 5 μm) Suhu Kolom : 40°C.
Spektrum IR
Puncak pada bilangan gelombang 1616, 1584, 1665, 1235, 1180, 1138 cm−1
Fase Gerak : 0.5 mL Asam Sulfat 2.5M dalam air 500 mL dan 0,5 mL Asam Sulfat 2.5M dalam
asetonitril 500 mL
Detektor : UV diode-array
4) KLORTETRASIKLIN HCl Spektrum UV
10 ml larutan 0,001% b/v dalam H2SO4 1N dalam tabung imersikan dalam air mendidih 8 menit dinginkan, ganti air yang hilang karena penguapan; Serapan pada 274 nm = 0,74 - 0,76. (FI III)
Suasana asam—266 nm (A11=386a), 359 nm; Suasana basa—253, 284, 346 nm. (Clarke's)
Gambar15. Spektrum UV klortetrasiklin
Spektrum IR
Puncak utama pada 1622, 1580, 1666, 1311, 1041, 1227 cm−1. Dapat muncul polimorfisme.
KCKT
System HY—RI 280 and 282 Sistem HY (Clarke's):
Kolom : C18 Symmetry (250 x 4.6 mm i.d., 5 μm) Suhu Kolom : 40°C.
Fase Gerak : 0.5 mL Asam Sulfat 2.5M dalam air 500 mL dan 0,5 mL Asam Sulfat 2.5M dalam asetonitril 500 mL
Detektor : UV diode-array
KLT Sistem TA—Rf 72; Sistem TB—Rf 00; Sistem TE—Rf 28; Sistem TAE—Rf 81 KCKT Sistem HX—RI 354; Sistem HY—RI 291;
Sistem HAA—retention time, 12.0 min.
Rotasi Jenis
Larutkan 1 gram Klindamisin dalam aquadest dan encerkan hingga 25,0 ml dengan pelarut yang sama (aquadest). Akan didapatkan hasil +130o sampai +150o, diukur dengan perbandingan zat anhidrat.
Spektrofotometri UV
Tidak ada absorpsi yang signifikan pada 230-360 nm.
Gambar 16. Spektrum UV Klindamisin
Spektrofotometri IR
Gambar 17. Spektrum Inframerah klindamisin Terdapat puncak pada bilangan gelombang A. 1690 cm-1(C=O), B. 1513 cm-1 (N-H), C. 1250 cm-1 (C-N), D. 1080 cm-1 (C-O eter), E. 640 cm-1 (C-Cl)
- 2 ml larutan azitromisin + 2 ml H2SO4 lalu dikocok sehingga warna menjadi kuning.
- 2 ml larutan zat + 5 tetes Cu(NO3)2 ammoniakal, lalu dibiarkan 5 menit, kemudian dipanaskan, dan warna menjadi abu-abu coklat.
Spektrum IR
Baku pembanding yang digunakan ialah azitromisin BPFI; biarkan hingga suhu kamar sebelum ampul dibuka. Higroskopik. Setelah dibuka, timbang segera dan buang sisa. Kecuali dinyatakan lain, tidak boleh dikeringkan sebelum digunakan.
Gambar18 . Spektrum IR Azitromisin Keterangan:
1721 cm−1 : Karbonil (Ester) 1188 cm−1 : Eter
1052 cm−1 : C-OH
Kromatografi Cair Kinerja Tinggi
Detektor: UV 210 nm
Kolom : 4,6 mm x 15 cm yang berisi bahan pengisi L1 dengan ukuran partikel 5 mikrometer.
Fase Gerak : campuran asetonitril P-Larutan dapar fosfat (6:4)
Laju alir : lebih kurang 0,9 ml per menit. Suhu Kolom: 30o
Waktu Retensi: lebih kurang 1 menit.
Gambar19 . Kromatogram HPLC Azitromisin
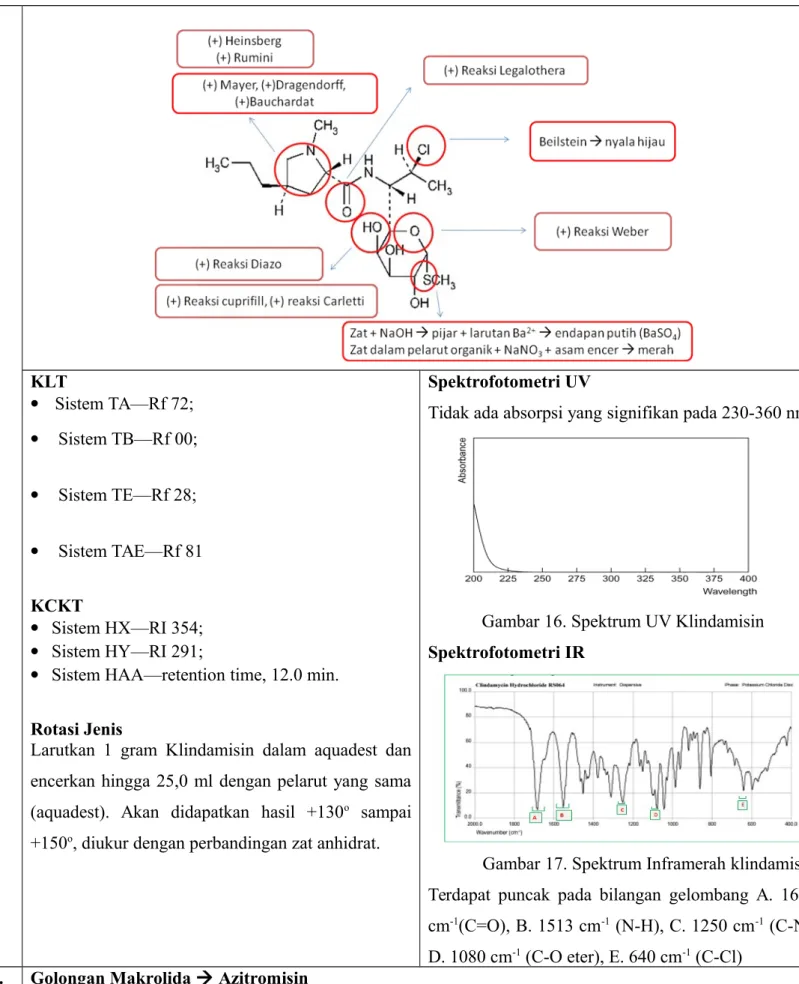
6. GOLONGAN AMINOGLIKOSIDA 1) Streptomisin Sulfat (+) Heinsberg (+) Diazo, Cuprifil (+) Legalrothera
Isolasi Streptomisin Sulfat
Timbang saksama sejumlah zat uji kemudian larutkan dan encerkan dengan air hingga kadar yang diinginkan. Jika dikemas dalam dosis tunggal, konstitusi zat uji dalam air untuk injeksi yang diukur saksama hingga volume yang tertera pada etiket. Identifikasi
1. Reaksi Spesifik
Pereaksi Fe: Larutkan 5 g FeCl3 dalam 50 ml HCl
0,1 N. Pipet 2,5 ml lalu masukkan ke dalam labu tentukur 100 ml. Encerkan dengan HCl 0,01 N sampai tanda.
Larutkan zat uji ke dalam air hingga mengandung 1 mg per ml. Ke dalam 5 ml larutan ini tambahkan 2 ml NaOH 1N dan panaskan dalam tangas air selama 10 menit. Dinginkan dalam air es selama 3 menit, tambahkan 2 ml HCl 1,2 N, campur dan tambahkan 5 ml pereaksi Fe violet.
- Larutkan 0,1 g zat ke dalam 2 ml air. Tambahkan 1 ml larutan α-naftol dan 2 ml campuran larutan NaClO dengan air (1:1) merah.
- Larutkan 10 mg zat ke dalam 5 ml air dan tambahkan 1 ml HCl 1M. Panaskan di waterbath selama 2 menit. Tambahkan 2 ml larutan α-naftol dalam NaOH 1M. Panaskan di water bath selama 1 menit kuning.
Kromatografi Cair Kinerja Tinggi (KCKT)
Kolom: Supelcosil ABZ alkylamide column (250
mm × 4.6 mm, 5 m)
Suhu Kolom: 45o
Detektor : UV 205 nm
Fase Gerak: Larutan Na Sulfat,
disodium-1-octanesulfat, asetonitril, dapar fosfat dalam air.
Laju Alir: 1,0 ml/min Injeksi : 20 l
Gambar 20. Kromatogram Hasil KCKT Streptomisin Sulfat
Reaksi Spesifik
4 mg zat dimasukkan dalam 2 ml air, tambahkan 0,5 ml HCl 0,1 N, panaskan dalam tangas air selama 20 menit. Angkat tabung dari tangas, tambahkan 1,0 ml larutan α-naftol dalam NaOH 1 N (1 dalam 200). Panaskan lagi selama 10 menit, dinginkan sebentar dalam tangas es dan tambahkan air hingga 25 ml merah.
Kromatografi Lapis Tipis
- Larutan uji: 10 mg serbuk dilarutkan dalam 10 ml pelarut
- Larutan baku: Larutkan dihydrostreptomycin sulfate dalam 5 ml air
- Fase diam: silica gel
- Fase gerak: 70 g/L larutan potassium dihydrogen phosphate
- Volume totolan: 10 μl - Jarak elusi: 2/3 pelat
- Deteksi: semprot menggunakan 2 g/L larutan 1,3-dihydroxynaphthalene dalam ethanol 96 % dan 460 g/L larutan asam sulfat; kemudian dipanaskan pada 150° selama 5-10 menit
- Hasil: Larutan uji mempunyai spot dengan posisi , warna dan ukuran yang sesuai dengan larutan baku.
Spektrofotometri Inframerah
Gambar21. Spektrum Serapan Inframerah Dihidrostreptomisin Sulfat
Kromatografi Cair
Gambar22. Kromatogram Dihidrostreptomisin Sulfat
Perbedaan Streptomisin dan Dihidrosreptomisin
200 mg zat + metanol 2 ml + 0.1 ml H2SO4. Panaskan sebentar. Streptomisin akan mengendap pada suhu kamar. Filtrat + asam pikrat → Kristal dengan titik leleh 283oC
Reaksi Benedict : Lar zat + NaOH + FeCl3 Violet tua Streptomisin
Ungu muda Dihidrostreptomisin
Reaksi Spesifik
Larutkan lebih kurang 10 mg zat dalam 1 ml air, + 1 ml lar ninhidrin P (1 dalam 500) dalam n-butanol dan 0.5 ml piridina. Panaskan di atas WB selama 5 menit dan + 10 ml air, terjadi warna lembayung (ungu) tua.
Kromatografi Lapis Tipis
Syarat hasil: harga RF bercak utama Larutan uji sesuai dengan harga RF bercak utama Larutan baku dan jika terdapat bercak lain selain bercak utama pada Larutan uji tidak lebih intensif dari bercak utama Enceran larutan baku
Spektrum Inframerah
Gambar 23. Spektrum Inframerah Kanamisin Sulfat
Kromatografi Cair Kinerja Tinggi (KCKT)
- System Agilent 1200 Series SL, binary pump - Fase gerak: 95% 0.2 mol/L TFA water, 5%
methanol
- Lajur alir 0.8 mL/menit - Volume injeksi: 20 μL
- Kolom ZORBAX StableBond SB-C18, 4.6 mm × 150 mm, μm, Agilent p/n 866953-902
Gambar 24. Analisis Kanamisin sulfat pada Agilent ZORBAX StableBond C18, 4.6 mm × 150 mm, 3.5
μm, column.
4) Neomisin Sulfat
Reaksi Spesifik
Larutkan lebih kurang 10 mg dalam 1 ml air + 5 ml H2SO4 15 N dan panaskan pada suhu 100oC
- Fase gerak: 170 mM TFA dalam air - Gradient: isocratic
- Lajur alir: 0.7 ml/min - Suhu: 30 °C
selama 100 menit, biarkan dingin, + 10 ml xilena, kocok selama 10 menit. Biarkan memisah dan enaptuangkan lapisan xilena, pada lapisan xilena + 10 ml p-bromoanilina. Kocok terjadi warna merah muda terang setelah dibiarkan. Lar 5 mg zat dalam 1 ml air + 1 ml lar ninhidrin
0.2% b/v dalam butanol + 0.5 ml piridina, panaskan di WB selama 5 menit akan menghasikan warna ungu. Biarkan selama 10 menit, terpisah menjadi 2 lapisan, lapisan bawah berwarna merah kekuningan.
Kromatografi Lapis Tipis
- Totolkan secara terpisah masing-masing 1 l larutan yang mengandung (1) zat uji 20 mg per ml dan (2) Neomisin Sulfat BPFI 20 mg per ml pada lempeng kromatografi silika gel, masukkan lempeng ke dalam bejana kromatografi berisi fase gerak campuran air-amonium hidroksida P-aseton P (71,5:8,5:20) yang dibuat segar dan biarkan merambat sampai lebih kurang tiga per empat tinggi lempeng. - Angkat lempeng, biarkan kering di udara dan
panaskan pada suhu 105 selama 1 jam. Semprot lempeng dengan larutan ninhidrin P dalam butanol P (1 dalam 100), panaskan pada suhu 105O selama 5 menit.
- Amati kromatogram: harga Rf bercak merah utama yang diperoleh dari Larutan uji sesuai dengan yang diperoleh dari Larutan baku.
Kromatografi Cair Kinerja Tinggi (KCKT)
- Kolom: ProntoSil 120-5 C18 AQ, 250 x 4.0 mm ID Order No. 25WF184PSJ
- Fase: ProntoSil 120-5 C18 AQ
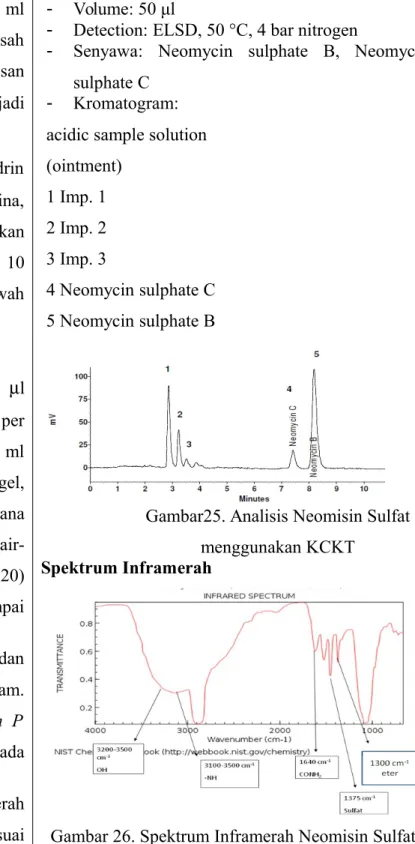
- Volume: 50 μl
- Detection: ELSD, 50 °C, 4 bar nitrogen
- Senyawa: Neomycin sulphate B, Neomycin sulphate C
- Kromatogram: acidic sample solution (ointment) 1 Imp. 1 2 Imp. 2 3 Imp. 3 4 Neomycin sulphate C 5 Neomycin sulphate B
Gambar25. Analisis Neomisin Sulfat menggunakan KCKT
Spektrum Inframerah
Gambar 26. Spektrum Inframerah Neomisin Sulfat.
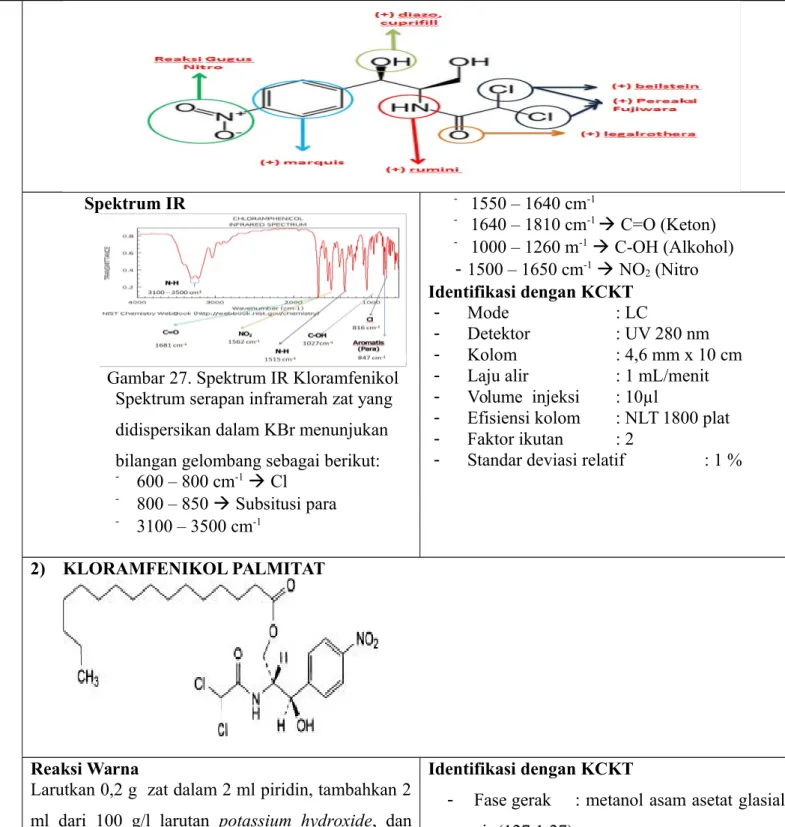
7. KLORAMFENIKOL
Spektrum IR
Gambar 27. Spektrum IR Kloramfenikol Spektrum serapan inframerah zat yang didispersikan dalam KBr menunjukan bilangan gelombang sebagai berikut: - 600 – 800 cm-1 Cl - 800 – 850 Subsitusi para - 3100 – 3500 cm-1 - 1550 – 1640 cm-1 - 1640 – 1810 cm-1 C=O (Keton) - 1000 – 1260 m-1 C-OH (Alkohol) - 1500 – 1650 cm-1 NO2 (Nitro Identifikasi dengan KCKT - Mode : LC - Detektor : UV 280 nm - Kolom : 4,6 mm x 10 cm
- Laju alir : 1 mL/menit - Volume injeksi : 10µl
- Efisiensi kolom : NLT 1800 plat - Faktor ikutan : 2
- Standar deviasi relatif : 1 %
2) KLORAMFENIKOL PALMITAT
Reaksi Warna
Larutkan 0,2 g zat dalam 2 ml piridin, tambahkan 2 ml dari 100 g/l larutan potassium hydroxide, dan panaskan dalam water bath warna merah
Spektrum UV
Dalam air 278 nm (A11=298a). Kloramfenikol Palmitat Alkohol —271 nm (A11=178a).
Identifikasi dengan KCKT
- Fase gerak : metanol asam asetat glasial dan air (127:1:27)
- Mode : LC
- Detektor : UV 280 nm - Kolom : 3,9 mm X 30 cm - Laju alir : 2 mL/menit - Volume injeksi : 10µL
- Efisiensi kolom : NLT 2400 plat - Kriteria penerimaan : 90-120%
Gambar 28. Spektrum UV Kloramfenikol Palmitat Gambar 29. Spektrum IR Kloramfenikol Palmitat
3) Kloramfenikol Sodium Suksinat
Reaksi Warna
- Larutkan 10 mg zat dalam 1 ml etanol + 3 ml dari 10 g/l larutan calcium chloride R dan 50 mg serbuk Zn panaskan water-bath selama 10 menit. Saring larutan dan dinginkan. Tambahkan 0.1 ml benzoyl chloride R dan kocok selama 1 menit, + 0.5 ml larutan ferric chloride dan 2 ml chloroform R dan kocok. lapisan atas berwarna merah violet dan ungu. - Larutkan 50 mg dalam 1 ml piridin, tambahkan
0.5 ml larutan sodium hydroxide dan 1,5 air. Panaskan dalam water bath selama 3 menit warna merah. Tambahkan 2 ml asam nitrat dan dinginkan dengan air mengalir. Tambahkan 1 ml 0.1 M silver nitrate Terbentuk presipitat putih.
KLT
Dengan menggunakan silika gel GF254 plate R. Fase gerak: dilute acetic acid R, metanol R, kloroform R (1:14:85 v/v/v).
Spektrum UV
Deteksi menggunakan Spektrofotometer UV dengan panjang gelombang 254 nm.
Identifikasi dengan KCKT
- Fase gerak : metanol dan 0,05 M monobasic ammonium phosphate dengan 10% asam phosphoric hingga ph 2,5±0,1 (2:3) - Mode : LC
- Detektor : UV 275 nm - Kolom : 4,6 mm X 10 cm - Laju alir: 1 mL/menit - Volume injeksi : 10 µL
- Efisiensi kolom : NLT 1750 plat teoritis - Faktor ikutan : NMT 1,2
4) Tiamfenikol Reaksi Warna
Zat ditambah H2O2 30 % dan 1 tetes FeCl30,5N, lalu tambahkan HNO3 dan larutan BaCl2 0,5N akan menghasilkan endapan BaSO4 bewarna putih
KLT
Menggunakan fase diam silika gel GF 254. Fase gerak: methanol R, ethyl acetate R (3:97 v/v).
Spektrum IR
Lakukan identifikasi dengan Spektrofotometri UV pada panjang gelombang 254 nm.
8. Golongan Sefalosporin
Sefiksin
ISOLASI
1. Tablet siprofloxacin digerus hingga halus.
2. Timbang tablet yang telah digerus, setelah itu larutkan kedalam metanol. 3. Kocok larutan tersebut dan kemudian disaring.
4. Uapkan di waterbath hingga kering. 5. Serbuk siap diidentifikasi.
Kromatografi Lapis Tipis
Plate: silika gel with (2.5 × 10 cm)
Fase Gerak: ethylacetat-acetone-methanol-water (5:2.5:2.5:1.5).
Kromatografi Cair Kinerja Tinggi
Sistem HAA
- Kolom : C8 Symmetry (250 × 4.6 mm i.d., 5 μm) dengan Symmetry C18 pre-column (20 mm). - Suhu Kolom : 30°C
- Fase Gerak : (A:B) = Buffer Fosfat (pH 3.8) : Asetonitril
- Laju alir : 1 mL/menit untuk 6.5 menit, kemudian meningkat secara linier pada 1.5 mL untuk 6,5 hingga 25 menit dan diamkan selama 3 menit (setimbangkan kembali dengan membuat laju alir pada1,5 mL/menit)
- Detektor : UV diode-array - Waktu Retensi : 4,8 menit