LAPORAN RESMI PRAKTIKUM ANALISIS SENYAWA KIMIA
PENENTUAN KADAR BESI (Fe) DALAM SAMPEL
DENGAN TEKNIK SPEKTROFOTOMETER UV-VIS
Disusun Oleh :
Nama : Fauzia Budi Mariska
NIM : 12312241038
Prodi : Pendidikan IPA A 2012
Kelompok : 2a
JURUSAN PENDIDIKAN ILMU PENGETAHUAN ALAM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS NEGERI YOGYAKARTA
A. Judul
Penentuan Kadar Besi (Fe) dalam Sampel dengan Teknik Spektrofotometer UV-VIS B. Tujuan
1. Menentukan kadar Fe (II) dalam sampel dengan menggunakan spektrofotometer UV-VIS
2. Dapat mengoperasikan alat spektrofotometer UV-VIS C. Dasar Teori
Besi
Besi adalah unsur dalam jadual berkala yang mempunyai simbol Fe dan nombor atom 26. Besi adalah kumpulan 8 dan kala (period) 4 logam (Poerwadio, 2004). Besi (Fe) merupakan logam transisi yang sangat berguna dan logam yang sangat reaktif. Dalam keadaan murni, besi tidak terlalu keras, tetapi jika ditambahkan dengan sedikit karbon dan logam lainnya maka akan terbentuk alloy baja yang kuat.
Besi adalah elemen kimiawi yang dapat ditemukan hampir disetiap tempat dibumi pada semua lapisan-lapisan geologis dan badan air. Besi dalam air tanah dapat berbentuk Fe(II) dan Fe(III) terlarut. Fe(II) terlarut dapat tergabung dengan zat organik membentuk suatu senyawa kompleks. Pada kadar 1-2 ppm besi dapat menyebabkan air berwarna kuning, terasa pahit, meninggalkan noda pada pakaian dan porselin. (Peni et al, 2009).
Besi secara farmakologi digunakan sebagai zat penambah darah bagi penderita anemia. Salah satu bentuk garam besi yang digunakan sebagai komponen zat aktif dalam sediaan penambah darah adalah besi (II) sulfat, yaitu besi bervalensi dua atau fero. Hal ini berkaitan dengan kondisi tubuh manusia yang lebih mudah menyerap besi dua daripada besi bervalensi tiga. Sifat kimia besi yang sangat dikenal adalah mudah teroksidasi oleh oksigen dari udara dan oksidator lainnya, sehingga besi umumnya dijumpai sebagai besi bervalensi tiga. Pada kondisi tertentu dimana kurang kontak dengan udara, besi berada sebagai besi bervalensi dua (Vogel, 1961).
Spektrofotometer UV-VIS
Spektrofotometri merupakan suatu metoda analisis yang didasarkan pada pengukuran serapan sinar monokromatis oleh suatu lajur larutan berwarna pada panjang gelombang spesifik dengan menggunakan monokromator prisma atau kisi difraksi dengan detektor fototube. Spektrofotometer adalah alat untuk mengukur transmitan atau absorban suatu sampel sebagai fungsi panjang gelombang. Sedangkan metode pengukuran dengan menggunakan spektrofotometer ini digunakan sering disebut dengan spektrofotometri.
Spektrofotometri dapat dianggap sebagai perluasan suatu pemeriksaan visual dengan studi yang lebih mendalam dari absorbsi energi. Absorbsi radiasi oleh suatu sampel diukur pada berbagai panjang gelombang dan dialirkan oleh suatu perkam untuk menghasilkan spektrum tertentu yang khas untuk komponen yang berbeda ( Hendayana et al, 1994).
Pada metode spektroskopi ultraviolet, cahaya yang diserap bukan cahaya tampak tapi cahaya ultraviolet. Dengan cara ini larutan tak berwarna dapat diukur, contoh aseton dan asetaldehid. Pada spektroskopi ini energy cahaya terserap digunakan untuk transisi electron. Karena energy cahaya UV lebih besar dari energy cahaya tampak maka energy UV dapat menyebabkan transisi electron s dan p. (Kimia Analitik Instrumen,1994: 4-5). Penentuan kadar besi berdasarkan pada pembentukan senyawa kompleks berwarna antara besi (II) dengan orto-penantrolin yang dapat menyerap sinar tampak secara maksimal pada panjang gelombang tertentu.
Penyerapan sinar UV-tampak oleh suatu molekul akan menyebabkan transisi di antara tingkat energi elektronik dari molekul. Atas dasar ini, spektroskopi UV-tampak juga dikenal sebagai spektroskopi (spektrometri) elektronik. Transisi ini dapat terjadi antarorbital ikatan (bonding) atau orbital anti ikatan (anti bonding). Panjang gelombang sinar yang diserap sebanding dengan perbedaan tingkat energi orbital (∆E). Untuk eksitasi elektron ikatan σ perlu energi yang tinggi dengan nilai λ = 120 -200 nm (UV hampa). Hal ini berarti pengukuran harus dilakukan dalam hampa sehingga sukar dilakukan. Di atas λ = 200 nm, daerah eksitasi elektron dari orbital p, d, ᴨ terutama sistem n terkonjugasi, pengukuran mudah dilakukan sehingga spektrometri UV tampak diukur pada λ ˃ 200 nm.
Penyerapan panjang gelombang nampak menyebabkan perpindahan elektron yang reversibel dan relatif rendah energinya dalam molekul. Pada umumnya zat berwarna mempunyai elektron-elektron yang mudah tereksitasi. Terutama senyawaan organik tertentu merupakan sumber warna yang berguna untuk zat warna. Molekul-molekul senyawaan-senyawaan organik yang tak mempunyai ikatan rangkap ataupun cincin benzena, tidak menyerap secara selektif dalam bagian nampak dari suatu spektrum, oleh karena itu senyawaan ini tak berwarna. Sebaliknya molekul dengan ikatan rangkap atau inti benzena dapat menyerap beberapa panjang gelombang nampak dan meneruskan cahaya berwarna. Elektron yang mudah dieksitasi oleh cahaya nampak biasanya terdapat dalam sebuah molekul yang beberapa atomnya dihubungkan oleh ikatan rangkap dan
tunggal secara berselang-seling. Gugus atom semacam itu disebut kromofor (pengemban warna).
D. Alat dan Bahan Alat
1. Spektronik-29 1 set 2. Labu takar 25 ml 6 buah 3. Gelas kimia 100 ml 1 buah 4. Botol semprot 250 ml 1 buah 5. Pipet ukur 1 ml 1 buah 6. Pipet ukur 10 ml 2 buah 7. Ball pipet 2 buah 8. Tissue
Bahan
1. Garam Fe(NH4OH)2SO4
2. Hidroksilamina-HCL 5% 3. Fenantrolin 0,1%
4. Natrium asetat 5% 5. Aquades
E. Prosedur Kerja
1. Pembuatan larutan blanko dan pengukuran serapannya
2. Preparasi deret standar
Menyiapkan alat dan bahan yang akan digunakan
Memasukkan 1 ml larutan hidroksilamina-HCL 5%, 5 ml 1,10 fenantrolin 0,1% dan 8 ml Natrium asetat 5% ke dalam labu takar 25 ml.
Mengencerkan larutan dengan menambahkan aquades hingga tanda batas
Menenghomogenkan larutan dengan mengkocok-kocok labu takar
Mengukur absorbansi larutan blanko dengan menggunakan spektroik-20 dengan panjang gelombang 510 nm.
Menyiapkan alat dan bahan yang akan digunakan
Memasukkan 1 ml larutan hidroksilamina-HCL 5%, 5 ml 1,10 fenantrolin 0,1% dan 8 ml Natrium asetat 5% ke dalam 5 buah labu takar 25 ml.
Mengencerkan larutan dengan menambahkan aquades hingga tanda batas
Menenghomogenkan larutan dengan mengkocok-kocok labu takar
Mengukur absorbansi larutan blanko dengan menggunakan spektroik-20 dengan panjang gelombang 510 nm.
Menambahkan garam Garam Fe(NH4OH)2SO4 sebanyak 0,25 ml ke dalam labu takar
1. 0,375 ml ke dalam labu takar 2, 0,5 ml ke dalam labu takar 3, 0,675 ke dalam labu takar 54, dan 0,75 ke dalam labu takar 5 untuk membuat deret standar Fe(II) 1 ppm,
F. Data Hasil Pengamatan
No. Sampel Panjang Gelombang (nm) Absorbansi (A)
1. Blanko 510 0,000 2. Larutan sampel 510 0,915 3. Larutan Fe(II) 1 ppm 510 0,311 4. Larutan Fe(II) 1,5 ppm 510 0,503 5. Larutan Fe(II) 2 ppm 510 0,707 6. Larutan Fe(II) 2,5 ppm 510 0,902 7. Larutan Fe(II) 3 ppm 510 1,037 G. Analisis Data
Pengukuran penambahan volume larutan 1. Larutan standar Fe (II) 1 ppm
V1.M1 = V2.M2
25 ml. 1 = V2 . 100
V2 = 0,25 ml
2. Larutan standar Fe (II) 1.5 ppm V1.M1 = V2.M2
25 ml. 1.5 = V2 . 100
V2 = 0,375 ml
3. Larutan standar Fe (II) 2 ppm V1.M1 = V2.M2
25 ml. 2 = V2 . 100
V2 = 0,5 ml
4. Larutan standar Fe (II) 2,5 ppm V1.M1 = V2.M2
25 ml. 2.5 = V2 . 100
V2 = 0,675 ml
5. Larutan standar Fe (II) 3 ppm V1.M1 = V2.M2
25 ml. 3 = V2 . 100
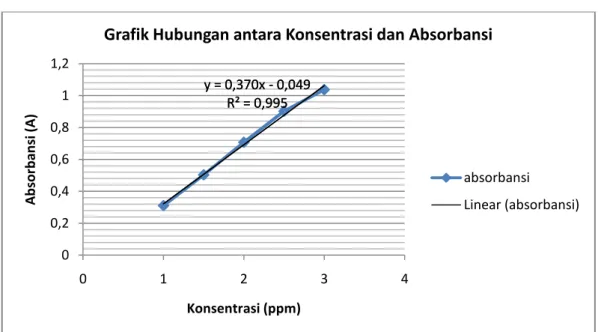
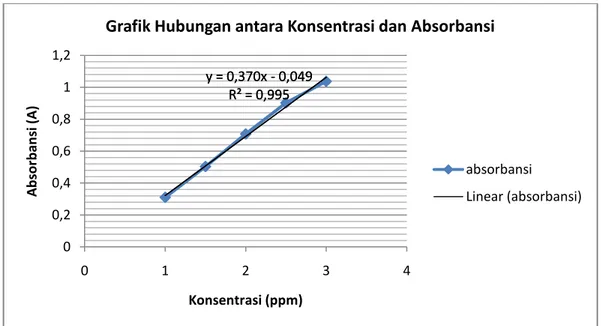
Kurva baku larutan
Mencari Kadar Fe (II) dalam Sampel Diketahui:
Asampel = 0,915 A
Y = 0,370 X - 0,049 Ditanya: Konsentrasi sampel (x) ? Jawab: Y = A Y = 0,370 X - 0,049 0,915= 0,370 X - 0,049 0,915 + 0,049 = 0,370 X 0,9644 = 0,370 X X = 2,6
Jadi, kadar Fe (II) dalam sampel sebesar 2,6 ppm
H. Pembahasan
Percobaan yang berjudul “Penentuan Kadar Besi (Fe) dalam Sampel dengan Teknik Spektrofotometer UV-VIS” yang dilakukan pada Hari Rabu, 4 November 2015 di Laboratorium Kimia Analisis, FMIPA, UNY ini bertujuan untuk menentukan kadar Fe (II) dalam sampel dengan menggunakan spektrofotometer UV-VIS dan untuk dapat mengoperasikan alat spektrofotometer UV-VIS. Pada percobaan ini praktikan menggunakan beberapa alat antara lain spektronik-29, 6 buah labu takar 25 ml, gelas kimia 100 ml, botol semprot 250 ml, pipet ukur 1 ml, pipet ukur, ball pipet dan tissue.
y = 0,370x - 0,049 R² = 0,995 y = 0,370x - 0,049 R² = 0,995 0 0,2 0,4 0,6 0,8 1 1,2 0 1 2 3 4 A b sor b an si (A) Konsentrasi (ppm)
Grafik Hubungan antara Konsentrasi dan Absorbansi
absorbansi Linear (absorbansi)
Dalam percobaan ini praktikan menggunakan beberapa jenis pipet ukur sebab dalam percobaan praktikan membutuhkan bahan-bahan dalam jumlah sedikit dan jumlah yang banyak, sehingga pipet ukur yang bermacam jenis dari yang bervolume kecil hingga yang bervolume besar dapat mempermudah praktikan dalam mengukur jumlah bahan yang akan digunakan. Selain itu praktikan juga menggunakan beberapa bahan antara lain garam Fe(NH4OH)2SO4, hidroksilamina-HCL 5%, fenantrolin 0,1%, natrium asetat 5%,
dan aquades. Aquades dalam percobaan ini digunakan untuk mengencerkan larutan. Percobaan penentuan kadar Fe ini praktikan lakukan dengan menggunakan deret larutan standar Fe(II) 1ppm, 1,5 ppm, 2 ppm, 2,5 ppm dan 3 ppm yang dibuat dengan melarutkan Fe(II) 100 ppm. Sebelum melakukan penentuan kadar pada beberapa deret larutan tersebut, praktikan membuat larutan blanko terlebih dahulu. Larutan blanko ini praktikan buat dengan memasukkan 1 mL larutan hidroksilamina-HCL 5%, 1-10-fenantrolin 0,1 % dan 8 mL natrium asetat ke dalam labu takar 25 mL, kemudian diencerkan dengan aquades hingga tanda batas, kemudian menghomogenkan larutan dengan cara mengocoknya. Larutan blanko merupakan larutan yang tidak mengandung analat untuk dianalisis (Basset 1994). Larutan blanko digunakan sebagai kontrol dalam suatu percobaan sebagai nilai 100% transmittans. Tujuan pembuatan larutan blanko ini adalah untuk mengetahui besarnya serapan oleh zat yang bukan analat.
Setelah membuat larutan blanko, praktikan membuat deret larutan standar Fe (II) dibuat dari pengenceran larutan baku Fe (II) 100 ppm. Sebelum membuat deret larutan, praktikan harus menghitung terlebih dahulu besar volume Fe (II) yang harus ditambahkan dalam larutan dengan menggunakan rumus pengenceran yaitu M1V1=M2V2. Berdasarkan
perhitungan yang telah praktikan lakukan, untuk membuat deret larutan Fe (II) 1 ppm; 1,5 ppm; 2 ppm; 2,5 ppm dan 3 ppm perlu ditambahkan 0,25 mL; 0,375 mL; 0,5 mL; 0,675 mL dan 0,75 mL larutan baku Fe (II) 100 ppm ke dalam 5 buah labu takar 25 mL. kemudian masing-masing menambahkan dengan 1 mL larutan hidroksilamina-HCL 5%, 1-10-fenantrolin 0,1 % dan 8 mL natrium asetat ke dalam labu takar 25 mL ke dalam masing-masing labu takar. Setelah semua larutan masuk dalam labu takar, praktikan melakukan pengenceran dengan menambahkan aquades hingga tanda batas, kemudian menghomogenkan larutan dengan mengocoknya. Ketika reagen direaksikan dengan larutan sampel akan menghasilkan kompleks berwarna orange, dimana warna orange yang dihasilkan berbeda-beda kepekatannya. Berdasarkan hasil pengamatan praktikan, larutan Fe (II) 1 ppm memiliki warna orange paling terang sedangkan larutan Fe (II) 3 ppm memiliki warna orange paling pekat. Berdasarkan hasil tersebut, praktikan dapat
menyimpulkan bahwa semakin tinggi konsentrasi Fe(II) maka warna larutan akan semakin pekat.
Penentuan besi (Fe) didasarkan pada reaksi pembentukan kompleks antara Fe(II) dengan pengompleks 1,10-fenantrolin. Senyawa kompleks Fe(II) – 1,10-fenantrolin akan terbentuk pada pH 2-9. Menurut Vogel (1961), untuk regensia o-Fenantrolina yang bereaksi dengan besi, terjadi pewarnaan merah yang disebabkan oleh adanya kation kompleks [Fe(C18H8N2)3]2+ dalam larutan yang sedikit asam. Besi (III) tak mempunyai
efek, dan harus direduksi dulu menjadi keadan bivalen dengan hidroksilamina hidroklorida jika regensia hendak dipakai untuk menguji besi dalam suatu senyawa. Reaksi yang terjadi adalah sebagai berikut:
Fe2+(aq) + 3 C12H2N2(aq) → [(C12H2N2)3Fe]2+(aq) (kompleks merah jingga)
Setelah semua larutan yang diperlukan telah dibuat, praktikan melakukan pengukuran terhadap besar absorbansi masing-masing larutan, yaitu larutan blanko, larutan sampel, dan semua deret larutan yang telah dibuat. Pengukuran besar absorbansi ini dilakukan dengan menggunakn spetrofometri UV-VIS. Spektrofotometri yang digunakan tepatnya adalah spektrofotometri cahaya tampak, karena logam besi mempunyai panjang gelombang lebih dari 400nm, sehingga jika menggunakan spktrofotometri UV, logam besi dalam sampel tidak terdeteksi. Pengukuran yang dilakukan praktikan ialah pertama praktikan menghidupkan alat spektrofotometri dan menunggu hingga cahaya pada indicator spektrofotometri berwatrna hijau. Kemudian menentukan besar panjang gelombang yang akan digunakan. Dalam percobaan ini, praktikan menggunakan panjang gelombang sebesar 510 nm. Selanjutnya praktikan memasukkan larutan blanko ke dalam kuvet, kemudian memasukkan ke dalam alat dan mengukur absorbansinya. Setelah itu, memasukkan larutan sampel dan deret larutan ke dalam kuvet, dan mengukur absorbansinya secara bergantian. Dalam melakukan pengukuran absorbansi larutan sampel dan deret larutan, sebe;um pengukuran harus dilakukan pengukuran absorbansi terhadap larutan blanko terlebih dahulu. Hal ini dilakukan untuk mengkaliberasi alat. Kemudian melihat angka yang ditunjukkan pada indicator alat, apabila angka telah berhenti maka pengukuran telah selesai. Maka, raktikan telah mnedapatkan hasil pengukuran absorbansi dan membaca hasil pengukuran yang tertera pada layar minotor spetrofometer.
Metoda spektrofotometri uv-vis adalah salah satu metoda analisis kimia untuk menentukan unsur logam, baik secara kualitatif maupun secara kuantitatif. Analisis
secara kualitatif berdasarkan pada panjang gelombang yang ditunjukkan oleh puncak spektrum (190 nm s/d 900 nm), sedangkan analisis secara kuantitatif berdasarkan pada penurunan intensitas cahaya yang diserap oleh suatu media. Pembentukan warna dilakukan dengan cara menambahkan bahan pengompleks yang selektif terhadap unsur yang ditentukan (Fatimah, 2009). Spektrofotometer adalah alat untuk mengukur transmitan atau absorban suatu sampel sebagai fungsi panjang gelombang. Syarat analisis menggunakan visibel adalah cuplikan yang dianalisis bersifat stabil membentuk kompleks dan larutan berwarna. Oleh karena itu, dalam pennetuan kadar besi dalam air, perlu ditambahakan hidroksilamin-HCl 5% untuk mereduksi Fe3+ menjadi Fe2+.
Berdasarkan pengukuran absorbansi, praktikan mendapatkan hasil bahwa absorbansi deret larutan Fe (II) 1 ppm 0,311 A; Fe (II) 1,5 ppm 0,503 A; Fe (II) 2 ppm 0,707 A; Fe (II) 2,5 ppm 0,902 A; dan Fe (II) 3 ppm 1,037 A, sedangkan larutan sampel memiliki absorbansi sebesar 0,915 A. Berdasarkan hasil tersebut, praktikan dapat menyimpulkan bahwa semakin tinggi konsentrasi larutan Fe (II) maka absorbansinya semakin besar. Berdasarkan hasil perolehan absorbansi tersebut, dibuat kurva baku standar untuk memudahkan perhitungan kadar Fe (II) dalam sampel menggunakan perbandingan regresi linier sebagia berikut:
Berdasarkan grafik tersebut, terlihat garis lurus yang menujukkan bahwa semakin tinggi konsentrasi larutan, maka semakin besar pula besar absoransi larutan, sehingga dapat dikatakan bahwa konsentrasi larutan berbanding lurus dengan besar absorbansi. Hal ini disebabkan karena pada konsentrasi yang tinggi, jarak antar partikel zat menjadi sangat rapat, yang akan mempengaruhi distribusi muatan, dan mengubah cara molekul melakukan serapan. y = 0,370x - 0,049 R² = 0,995 y = 0,370x - 0,049 R² = 0,995 0 0,2 0,4 0,6 0,8 1 1,2 0 1 2 3 4 A b sor b an si (A) Konsentrasi (ppm)
Grafik Hubungan antara Konsentrasi dan Absorbansi
absorbansi Linear (absorbansi)
Dari grafik tersebut diperoleh nilai persamaan garis yaitu y = 0,370 x - 0,049. Persamaan garis tersebut digunakan untuk menghitung kadar besi dalam sample. Dari persamaan garis tersebut y menyatakan absorbansi sampel, sedangkan x menyatakan kadar Fe yang dikandungnya. Berdasarkan hasil perhitungan menggunakan persaaman garis tersebut, maka didapatkan hasil bahwa besarnya kadar Fe (II) pada sampel sebesar 2,6 ppm.
I. Kesimpulan
Berdasarkan percobaan yang telah praktikan lakukan dapat diambil kesimpulan yaitu :
1. Kadar Fe (II) dalam larutan sampel yang dihitung dengan metode spektrofotometri yaitu sebesar 2,6 ppm.
2. Cara mengoperasikan alat spektrofotometer UV-VIS yaitu :
- Menghidupkan alat spektrofometer dan menunggu hingga cahaya indicator spektrofotometer berwarna hijau.
- Mengatur panjang gelombang yang akan digunakan
- Menuangkan larutan blanko, sampel, dan deret larutan standar ke dalam kuvet secara bergantian
- Mengukur absorbansi larutan dengan memasukkan kuvet ke dalam alat. Pengukuran dilakukan secara bergantian, pertama mengkaliberasi alat dengan melakukan pengukuran terhadap larutan blanko, kemudian memasukkan larutan yang akan di ukur besar absorbansinya setiap pengukuran larutan harus didahului dengan pengukuran larutan blanko terlebih dahulu hingga menunjukkan angka absorbansi larutan blanko sebesar 0,000 A.
- Melihat angka pengukuran pada layar monitor spektrofotometer
- Apabila angka penghitungan telah berhenti, maka hal ini menunjukkan pengukuran telah selesai
- Membaca hasil pengeukuran absorbanssi yang tertera pada layar monitor spektrofometer.
J. Daftar Pustaka
Fatimah S, Iis Haryati dan Agus Jamaludin. Pengaruh Uranium Terhadap Analisis Thorium Menggunakan Spektrofotometer UV-Vis. Seminar Nasional V, ISSN 1978-0176. SDM Teknologi Nuklir Yogyakarta, 5 November 2009.
Hendayana, S., Kadarohman, A., Sumarna, A., dan Supriatna, A., 1994. Kimia Analitik Instrumen, edisi ke-1. Semarang: IKIP Press
Maryati, dkk. 2015. Diktat Petunjuk Praktikum Analisis Senyawa Kimia. Yogyakarta: FMIPA UNY
Peni. P dan Riyanti. A. 2009. Pemeriksaan Kadar Besi (Fe) Dalam Air Sumur, Air PDAM dan Air Instalasi Migas didesa Kampung Baru Cepu Secara Spektrofotometri. Jurnal Kimia dan Teknologi. ISSN 0216-163X.
Poerwadio, Andreas Djatmikodan Ali Masduqi. 2004. Penurunan Kadar Besi oleh Media Zeolit Alam Ponorogo secara Kontinyu. Jurnal Purifikasi. Vol.5. No.4 : 169-174.
Tim kimia analitik instrumen. (2009). Penuntun Praktikum Kimia Analitik Instrumen. Bandung : Jurusan Pendidikan Kimia FPMIPA Universitas Pendidikan Indonesia. Vogel. 1961. Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro. Jakarta: PT
Kalman Media Pustaka.
LAMPIRAN