Makalah Termodinamika Pemicu 4:
Kesetimbangan Fasa Uap-Cair
Kelompok 3
Nahida Rani
(1106013555)
Nuri Liswanti Pertiwi
(1106015421)
Rizqi Pandu Sudarmawan
(0906557045)
Sony Ikhwanuddin
(1106052902)
Sulaeman A.S.
(0906557051)
Departemen Teknik Kimia
Fakultas Teknik Universitas Indonesia
Depok 2013
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 2
Makalah Termodinamika Pemicu 4: Kesetimbangan Fasa Uap-Cair
2013
a) k i P P T T i i , 1,2,...,
Mengapa ketiga kesamaan tersebut harus dipenuhi sistem pada kesetimbangan fasa? Jawab:
Kesetimbangan adalah suatu keadaan yang sifatnya statis, dimana tidak ada perubahan keadaan secara makroskopis di dalam sistem. Hal ini berarti semua kecenderungan atau potensi sistem untuk berubah adalah nol. Dalam suatu kesetimbangan liquid-vapor, saat keadaan setimbang tercapai, maka suhu tekanan, dan komposisi fasa mencapai harga akhir yang selanjutnya akan tetap. Pada kenyataannya, dalam skala makroskopis, pertukaran molekul dari satu fasa ke fasa lainnya terus terjadi. Namun, karena kecepatan rata-rata pertukaran itu sama maka dapat dianggap tidak ada perpindahan molekul.
Persamaan Tα = Tβ menggambarkan suhu kedua fasa pada saat kesetimbangan adalah sama, sehingga tidak ada perpindahan kalor yang terjadi. Persamaan Pα = Pβ menandakan bahwa tekanan kedua fasa adalah sama, sehingga tidak ada fasa yang berekspansi ataupun berkondensasi, yang nantinya dapat menghasilkan perubahan kerja sebesar PV. Sementara itu, persamaan µi
α = µi
β
menyatakan bahwa potensial kimia kedua fasa sama, sehingga tidak terjadi perpindahan massa. Ketiga persamaan ini harus dipenuhi dalam sistem yang sudah setimbang, karena tidak terpenuhinya salah satu persamaan ini akan menyebabkan terjadinya perubahan makroskopis di dalam sistem yang menyebabkan keadaan sistem tak lagi statis.
b) Apa yang dapat anda jelaskan mengenai konsep potensial kimia dan fugasitas sebagai dasar perhitungan kesetimbangan fasa cair-uap? Mengapa diperlukan model termodinamika yang abstrak yaitu persamaan-persamaan matematika yang diturunkan dari hukum pertama dan hukum kedua termodinamika dalam mendefinisikan nilai ? Bagaimana kelompok anda menjelaskan persamaan di bawah ini :
atau Jawab:
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 3
Pada kondisi kesetimbangan, potensial kimia dari setiap komponen adalah sama di setiap fasenya ( ). Potensial kimia merupakan suatu besaran dari kecenderungan terlepas dari suatu komponen. Jika potensial kimia dari suatu komponen tidak sama di dalam setiap fasenya atau terdapat perbedaan potensial kimia, maka akan terjadi kecenderungan bagi komponen tersebut untuk mengalami perpindahan massa dari yang memiliki potensial kimia yang lebih tinggi ke potensial kimia yang lebih rendah dari komponen tersebut. Perpindahan massa ini akan berlangsung sampai potensial kimia di kedua fasa dari komponen tersebut, sama besarnya.
̅ ...(1)
Dimana dalam hal ini menandakan bahwa potensial kimia sama dengan energi Gibbs molar parsial. Oleh karena itu, pendefinisian nilai potensial kimia yang diturunkan dari hukum pertama dan kedua termodinamika berasal dari nilai G yang diturunkan dari variabel-variabel kanoniknya, yaitu suhu, tekanan, dan komposisi. Dari penurunan G, secara tidak langsung mendefinisikan untuk sifat-sifat molar parsialnya yang berhubungan dengan potensial kimianya. Dari persamaan
( )
...(2)
didapatkan entropi dan volume parsialnya. Dari sini akan didapat pula turunan dari entalpinya. Sehingga, bila kita membalikkan persamaan dengan mengacu pada hukum pertama dan kedua termodinamika yang berhubungan dengan nilai suhu, tekanan, komposisi, volume, fraksi mol, entalpi, dan entropi, kita akan mendapatkan nilai turunan dari potensial kimia.
Potensial kimia merupakan besaran intensif, sehingga nilainya tergantung pada proporsi relatif dari komponen yang ada dan bukan pada jumlah dari komponen. Jika di dalam suatu fasa terdapat N komponen pada T dan P tertentu, potensial kimia ditentukan oleh fraksi mol dari komponennya, bukan dari nilai mol masing-masing komponennya. Namun, karena jumlah fraksi mol adalah satu, paling banyak N-1 dari fraksi mol dapat menjadi independen.
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 4
Makalah Termodinamika Pemicu 4: Kesetimbangan Fasa Uap-Cair
2013
Potensial kimia memainkan satu peranan alamiah dalam perumusan kriteria untuk kesetimbangan fase dan reaksi kimia. Namun, untuk digunakan dalam penyelesaian masalah-masalah praktis, potensial kimia mempunyai kekurangan-kekurangan:
1. Sebagai turunan dari G, potensial kimia berhubungan dengan besaran-besaran primitif U dan S. Karena termodinamika hanya memberikan petunjuk-petujuk untuk menemukan perubahan pada U dan S, harga-harga mutlak yang pasti untuk tidak diketahui.
2. Selagi tekanan suatu fase mencapai nol, potensial kimia semua zat di dalam fase itu mencapai - . Hal ini tampak (untuk gas ideal) dari
i(T) ...(3)
3. Selagi konsentrasi suatu zat tertentu i, di dalam suatu fase mencapai nol , mencapai - . Sifat ini diperlihatkan juga pada persamaan (3).
Potensial kimia menunjukkan karakteristik yang kurang menguntungkan pada larutan dan pada praktek yang terjadi di kenyataannya. Akan menjadi lebih mudah bila digunakan suatu potensial pengganti, yaitu suatu besaran yang tetap memakai atribut penting potensial kimia, tetapi tidak menggambarkan satupun kekurangan-kekurangan yang dinyatakan diatas. Lewis mengemukakan sebuah konsep yang dikenal sebagai konsep fugasitas. Berdasarkan konsep ini, kesamaan potensial kimia dapat diartikan sebagai kesamaan fugasitas tanpa mengurangi arti atau karakteristik yang terkandung di dalamnya. Fugasitas (fi) merupakan ukuran
kecenderungan suatu gas untuk keluar atau mengembang, yang dinyatakan dalam fungsi tekanan. Fugasitas dapat diartikan pula sebagai tekanan yang diperlukan pada temperatur tertentu untuk membuat sifat-sifat gas non-ideal memenuhi persamaan untuk gas ideal (lim P
0) atau dengan kata lain menginformasikan keidealan suatu gas (tekanan terkoreksi). Oleh karena itu, besaran fugasitas muncul akibat besaran potensial kimia yang tidak sesuai bila digunakan dalam kesetimbangan fasa cair-uap.
Konsep fugasitas didasarkan pada persamaan untuk keadaan gas-ideal: P RT T i( ) ln ...(4)
Dimana subskrip ig menandakan potensial kimia (energi gibbs molar parsial) untuk gas ideal. Pada fluida nyata, persamaan (4) menjadi :
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 5 1 ln ) (T RT f Gi i ...(5) P f RT G G ig i i i ln ...(6) Pada persamaaan (6), ig i i G G
merupakan residual Gibbs energy, GiR . Perbandingan antara
fugasitas (fi) dengan tekanan (P) disebut koefisien fugasitas (ϕi).
P fi
i
...(7) Sehingga persamaan (6) dapat ditulis menjadi :
i R
i RT
G ln
...(8) Syarat kesetimbangan fasa cair-uap jika ditulis dalam persamaan fugasitas atau koefisien fugasitas adalah :
f L = f V atau
V
L
...(9)
dimana L menunjukkan cair (liquid) dan V menunjukkan uap (vapor). Dari persamaan tersebut dapat terlihat bahwa di dalam kesetimbangan, khususnya kesetimbangan fasa cair-uap, nilai tekanan dan suhu pada fasa cair dan uap saat mengalami kesetimbangan haruslah sama, begitu pula dengan nilai fugasitas dari masing-masing fase tersebut. Sehingga koefisien fugasitas dari cair dan uap pun akan sama pula karena koefisien fugasitas merupakan perbandingan fugasitas dengan tekanannya.
c) Dapatkah anda menjelaskan tentang aturan fasa Gibbs untuk kesetimbangan fasa cair-uap fluida campuran? Apa yang dimaksud daerah dua fasa dan daerah satu fasa? Bagaimana pula anda menentukan nilai titik gelembung dan titik embun dalam kesetimbangan fasa tersebut?
Jawab:
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 6
Makalah Termodinamika Pemicu 4: Kesetimbangan Fasa Uap-Cair
2013
Pada tahun 1876, Gibbs menurunkan hubungan sederhana antara jumlah fasa setimbang, jumlah komponen, dan jumlah besaran intensif bebas yang dapat melukiskan keadaan sistem secara lengkap. Menurut Gibbs,
C P
F ... (10)
di mana, F = derajat kebebasan C = jumlah komponen P = jumlah fasa
γ = jumlah besaran intensif yang mempengaruhi sistem (P, T)2
Derajat kebebasan suatu sistem adalah bilangan terkecil yang menunjukkan jumlah variabel bebas (suhu, tekanan, konsentrasi komponen – komponen) yang harus diketahui untuk menggambarkan keadaan sistem. Untuk zat murni, diperlukan hanya dua variabel untuk menyatakan keadaan, yaitu P dan T, atau P dan V, atau T dan V. Variabel ketiga dapat ditentukan dengan menggunakan persamaan gas ideal. Sehingga, sistem yang terdiri dari satu gas atau cairan ideal mempunyai derajat kebebasan dua (F = 2).
Contoh:
a. Kesetimbangan cair (air) dengan uap air C = 1, P = 2 (cair dan uap), maka F = 1
Hanya satu variabel dapat diubah bebas, jika dipilih tekanan tertentu maka suhu kesetimbangan akan tertentu atau sebaliknya, jika dipilih suhu tertentu maka tekanan kesetimbangan akan tertentu.
b. Campuran biner (methanol – air) dalam kesetimbangan uap-cair C = 2 (methanol = 1, air = 1), P = 2 (cair dan uap), maka F = 2 Phase Region
a. Daerah 1 fasa: pada daerah tersebut hanya terdapat 1 fasa zat dalam kesetimbangan. Pada VLE, daerah tersebut adalah daerah subcooled liquid dan daerah superheated
vapor.
b. Daerah 2 fasa: pada daerah tersebut terdapat 2 fasa zat dalam kesetimbangan. Pada VLE, daerah tersebut berada di antara garis cairan jenuh dan garis uap jenuh; dimana saturated liquid dan saturated vapor berada dalam kesetimbangan.
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 7
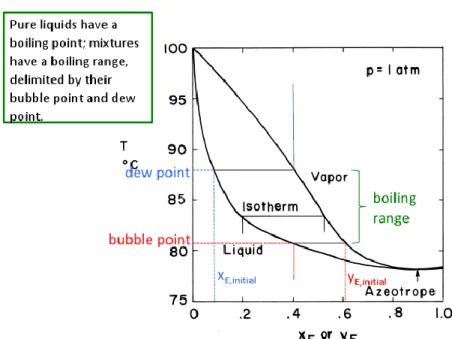
Titik Gelembung (Bubble Point) dan Titik Embun (Dew Point)
Gambar 1. Temperature composition diagram for ethanol-water (Sumber: Separation Process Engineering, Third Edition by Philip C. Wankat)
Titik gelembung (bubble point) adalah titik di mana cairan jenuh berada di ambang penguapan. Penurunan tekanan yang amat kecil akan menghasilkan gelembung uap. Pada temperatur bubble point, molekul cairan memiliki cukup energi kinetik untuk melepaskan diri dari permukaan cair menuju fase gas.
Titik embun (dew point) adalah titik di mana fase cairan hampir tidak terlihat, hanya tetesan/embun (dew) yang tertinggal. berada di ambang penguapan. Ketika embun telah teruapkan, pada titik tersebut hanya uap jenuh yang tertingggal, penurunan tekanan berikutnya akan menghasilkan uap superjenuh. Pada temperatur dew point, molekul uap memiliki cukup energi kinetik untuk berkondensasi.
Bubble Point Calculation (1)
Digunakan untuk multi component mixture Metode Trial and error method
Diketahui komposisi subcooled liquid dan Ptotal Tujuan Tbubble point dan (yi)bubble point
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 8
Makalah Termodinamika Pemicu 4: Kesetimbangan Fasa Uap-Cair
2013
Bubble Point Calculation (2)
Digunakan untuk multi component mixture Metode relative volatility method
Dew Point Calculation
Digunakan untuk multi component mixture Metode Trial and error method
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 9
d) Apa guna perhitungan flash dalam kesetimbangan uap-cair? Jawab:
Teorema Duhem menyatakan bahwa keadaan keseimbangan sebuah sistem PVT tertutup, yang terbentuk dari jumlah awal tertentu zat kimia yang dicampurkan, ditentukan sepenuhnya oleh dua sifat sistem sembarang, asalkan dua sifat ini merupakan variabel bebas pada keseimbangan. Suhu dan tekanan memenuhi syarat sebagai sifat seperti itu, untuk semua sistem yang terdiri dari lebih satu komponen. Maka, menurut teorema Duhem, secara prinsip kita dapat menghitung komposisi fase-fase keseimbangan pada T dan P tertentu, jika kita tahu seluruh fraksi mol z1, z2, …,zm dari m komponen. Komputasi jenis ini apabila dikerjakan untuk sebuah VLE disebut perhitungan kilat (flash calculation). Istilah ini berasal dari keadaan ketika cairan pada tekanan lebih besar tekanan bubble point akan berkilat (flashes) atau terevaporasi sebagian ketika tekanan diturunkan, menghasilkan sistem dua fasa (uap-cair) dalam kesetimbangan. Kegunaannya adalah dapat digunakan untuk menghitung harga jumlah mol cairan (L), jumlah mol uap (V), komposisi cairan {xi}dan komposisi uap {yi} pada t dan P tertentu dengan mengetahui seluruh fraksi mol komponen.
Nilai xi dan yi yang dihasilkan dari sebuah perhitungan kilat pasti
memenuhi kriteria keseimbangan seperti yang dinyatakan oleh persamaan (11).
… (11) Nilai–nilai itu juga harus memenuhi syarat-syarat keseimbangan material tertentu, yang diturunkan sebagai berikut:
Pada T dan P tertentu, satu mol campuran dengan komposisi z1, z2, . . . , zN, akan
dipisahkan menjadi L mol cairan dengan komposisi x1, x2, . . . , xN, dan V mol uap
dengan komposisi y1, y2, . . . , yN. Suatu keseimbangan mol menyeluruh
menyaratkan bahwa
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 11
dan kesetimbangan mol komponen yaitu:
… (13) Eliminasi L pada persamaan (12) dan (13) menghasilkan
Dengan mensubstitusikan persamaan (11) ke persamaan di atas, akan diperoleh
… (14) Karena ∑ maka diperoleh
… (15) Dengan analog yang sama, eliminasi V pada persamaan (15) menghasilkan
Dengan mensubstitusikan persamaan (12) ke persamaan di atas, akan diperoleh
… (16) Karena ∑ maka diperoleh
… (17) e) Gambar di bawah ini merupakan Diagram P-x-y asetonitril(1) dan
nitrometana(2) pada 75oC, garis putus-putus menunjukkan hasil perhitungan diagram fasa yang didasarkan pada asumsi bahwa sistem bersifat ideal sehingga hukum Raoult dapat digunakan. Dapatkah anda menyatakan karakteristik sistem ideal/hukum Raoult dari gambar tersebut? Hubungkanlah dengan hukum Raoult dan perhatikanlah adakah hubungan yang linier antara besaran-besaran hukum tersebut?
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 12
Makalah Termodinamika Pemicu 4: Kesetimbangan Fasa Uap-Cair
2013
Jawab:
Dari diagram yang diberikan, kita dapat mengetahui karakteristik dari campuran asetonitril dan nitrometana. Garis yang dilambangkan dengan P-x1 adalah garis saturated liquid (dew line), yaitu garis dimana uap pertama kali terbentuk. Daerah di atas garis P-x1 adalah daerah cairan subcooled. Sementara itu, garis yang dilambangkan dengan P-y1 adalah garis saturated vapor (bubble line), yaitu garis dimana cairan pertama kali terbentuk. Daerah di bawah garis P-y1 adalah daerah uap superheated.
Hukum Raoult menyatakan bahwa pada kesetimbangan uap-cair campuran ideal, kecenderungan komponen i untuk berpindah dari fasa cair ke fasa uap yang dinyatakan sebagai tekanan uap jenuh (Pisat) dikalikan dengan fraksi molnya pada
fasa cair (xi) adalah sama dengan kecenderungannya untuk berpindah dari fasa
uap ke fasa cair yang dinyatakan sebagai tekanan parsial komponen i (P) pada fasa uap. Suatu sistem yang memenuhi Hukum Raoult akan memiliki plot antara tekanan dew point dan komposisi yang lurus, seperti pada gambar di bawah:
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 13
Gambar 2. Plot tekanan vs konsentrasi pada campuran yang memenuhi Hukum Raoult
(sumber:
http://chemed.chem.wisc.edu/chempaths/index.php?option=com_awiki&view=c hemprime&Itemid=850&article=File:Graphs_Comparing_Vapor_Pressure_and_
Mole_Fraction.jpg)
Plot yang digambarkan oleh Gambar 1 sesuai dengan garis putus-putus pada gambar yang diberikan, yang merupakan perhitungan yang dilakukan dengan asumsi sistem memenuhi Hukum Raoult. Namun, pada kenyataannya, plot antara tekanan dew point dan komposisi pada gambar tidak berbentuk lurus seperti yang digambarkan oleh garis putus-putus pada gambar. Oleh karena itu, sistem dapat dikatakan tidak memenuhi Hukum Raoult.
Jika suatu sistem dikatakan mengikuti Hukum Raoult, maka hubungan antara besaran-besaran di dalam sistem dapat digambarkan dengan persamaan berikut:
…(18)
Dari persamaan di atas, dapat diketahui bahwa hubungan antar besaran dalam sistem adalah linear. Hubungan linear ini juga dapat dilihat dari garis pada grafik
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 14
Makalah Termodinamika Pemicu 4: Kesetimbangan Fasa Uap-Cair
2013
antara tekanan dan komposisi pada campuran yang memenuhi hukum Raoult yang berbentuk garis linear.
f) Elpiji adalah nama dagang yang digunakan oleh PERTAMINA untuk Liquified Petroleum Gases (LPG). Diketahui komposisi cairan yang berada pada kesetimbangan dengan uap cair Elpiji didalam tabung adalah 30%-mol C3H8 dan 70%-mol n-C4H10 pada suhu 25°. Pada kondisi ini, tentukanlah tekanan gas Elpiji didalam tabung dalam kPa. Sistem propana(1)/n-butana(2) mengikuti hukum Raoult. Tekanan uap jenuh masing-masing komponen diberikan oleh persamaan Antoine sebagai berikut:
Log10(psat)=b-0.05223 a/(t+273.1), dengan satuan p dalam mmHg dan t dalam °C. Fluida a b Propana 19037 7.217 n-butana 23450 7.395 Jawab: Ditanya :
Berdasarkan data yang diberikan di atas, maka tentukan tekanan gas Elpiji di dalam tabung dengan menggunakan satuan kPa.
Jawab:
Dari referensi yang di dapat, diketahui bahwa tekanan normal isi tabung gas saat pemakaian sekitar 6 bar atau 600 kPa dengan komponen utamanya merupakan gas propana (C3H8) dan butana (C4H10) kurang lebih 97%, serta sisanya adalah pentana yang dicairkan. Setelah dilakukan pengujian untuk mengetahui tekanan maksimum yang dapat ditahan di dalam tabung, data yang diperoleh menyebutkan bahwa tabung gas elpiji dapat menahan tekanan hingga 110 bar (11000 kPa) untuk tabung 3 kg dan 12 kg atau 80 bar (8000 kPa) untuk tabung 50 kg. (http://gaselpiji.com/uji-tabung.html)
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 15
Dalam menjawab pertanyaan pada soal ini, terlebih dahulu dibuat asumsi. Asumsi :
Fluida yang terdapat di dalam tabung adalah hanya propana dan n-butana.
Di dalam kesetimbangan, temperatur dan tekanan di dalam tabung gas Elpiji pada tiap komponen fluida adalah sama.
Permisalan penulisan : i=1 propana i=2 n-butana
Fraksi mol (xi) masing-masing komponen : x1 = 0,3
x2 = 0,7 Penyelesaian :
1. Menentukan tekanan jenuh (P saturated) pada masing-masing fluida dengan menggunakan persamaan Antoine yang diberikan, yaitu :
Log10 (Psat )=b-0.05223 a/(t+273.1)
dengan satuan p dalam mmHg dan t dalam °C (t = 25°C), serta nilai a dan b masing-masing fluida dari data pada tabel yang diberikan di soal.
P saturated propana ( )
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 16
Makalah Termodinamika Pemicu 4: Kesetimbangan Fasa Uap-Cair
2013
P saturated n-butana ( ) 2. Menentukan tekanan gas Elpiji di dalam tabung
Dengan menggunakan persamaan 10.6 pada buku Introduction to Chemical Engineering Thermodynamics karangan J.M. Smith, H.C.Van Ness dan M.M. Abbott, tekanan di dalam tabung dapat diperoleh dengan cara sebagai berikut:
∑
Jad, tekanan gas Elpiji di dalam tabung dengan suhu 25°C adalah 483.869 kPa. Dari hasil yang diperoleh, bila dikaitkan dengan referensi yang didapat, maka besaran tekanan pada kondisi dalam keadaan normal.
g) Sistem Benzena(1)/Toluena(2)/Etilbenzena(3) adalah fluida-fluida aromatik yang bersifat non-polar sehingga dapat diasumsikan mengikuti hukum Raoult. Tekanan uap masing-masing fluida murni dapat dihitung dengan persamaan Antoine berikut (Tekanan uap jenuh Psat dalam kPa dan suhu T dalam oC) :
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 17
Komposisi keseluruhan adalah z1=0,41 ; z2=0,34 ; z3=0,25. Jelaskan cara anda menentukkan harga jumlah mol cairan L, jumlah mol uap V, komposisi cairan {xi} dan komposisi uap {yi} jika suhu sistem 100oC dan tekanan sistem sama dengan separuh dari jumlah P titik didih dan P titik embun.
Jawab: Ditanya :
Berdasarkan data yang tersedia, jelaskan dan tentukan nilai :
L = …? V = …? xi = …? yi = …? Jawab : Asumsi :
sistem dalam keadaan kesetimbangan cair-uap
sistem mengikuti hukum Raoult Data yang diketahui :
Suhu Sistem (T) = 100oC
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 18
Makalah Termodinamika Pemicu 4: Kesetimbangan Fasa Uap-Cair
2013
Tekanan Jenuh (Psat) masing-masing senyawa dalam fungsi T
Komposisi keseluruhan (z) masing-masing senyawa, yaitu : z1=0,41 ; z2=0,34 ; z3=0,25.
P titik didih = P buble dan P titik embun = P dew P sistem = 0,5 (P dew + P bubl)
Penyelesaian :
1. Menghitung tekanan jenuh masing-masing senyawa untuk T = 100oC
2. Menghitung tekanan titik didih (P bubl ) sistem, dengan {zi} = {xi}, maka
3. Menghitung tekanan titik embun (P dew) sistem, dengan {zi}={yi}
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 19
4. Menghitung Psistem menggunakan persamaan yang diberikan di soal: P sistem = 0,5 (P dew + P bubl)
5. Menghitung jumlah uap (V) menggunakan flash calculation : Syarat flash calculation :
Dari perhitungan di atas maka syarat flash calculation terpenuhi, maka jumlah uap (V) dapat dihitung menggunakan persamaan berikut :
∑
Menghitung masing-masing nilai K :
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 20
Makalah Termodinamika Pemicu 4: Kesetimbangan Fasa Uap-Cair
2013
Untuk menentukkan V, menggunakan metode trial dengan Ms.excel diperoleh hasil sbb: V trial 0.4811 1.000239 0.4812 1.000218 0.4813 1.000198 0.4814 1.000177 0.4815 1.000157 0.4816 1.000136 0.4817 1.000116 0.4818 1.000096 0.4819 1.000075 0.482 1.000055 0.4821 1.000034 0.4822 1.000014 0.4823 0.999994 0.4824 0.999973
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 21
Menentukkan nilai L dengan persamaan : mol
Mencari persamaan yang menghubungkan yi , Ki, zi, dan V:
Subtitusi persamaan ke persamaan
Sedangkan Subtitusi persamaan ke
Sehingga diperoleh persamaan akhir untuk menentukkan yi:
Menentukkan komposisi uap masing-masing senyawa:
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 22
Makalah Termodinamika Pemicu 4: Kesetimbangan Fasa Uap-Cair
2013
Menentukkan komposisi cairan masing-masing senyawa menggunakan persamaan berikut :
K e l o m p o k 3 - D e p a r t e m e n T e k n i k K i m i a Page 23
Daftar Pustaka
Anonim. 2010. Raoult’s Law. Diakses dari
http://chemed.chem.wisc.edu/chempaths/GenChem-Textbook/Ideal-Solutions-Raoult-s-Law-850.html pada 9 April 2013
Anonim. Kesetimbangan Uap Cair.Bandung : ITB
Haris, Ahmad.2011. Uji Tabung. Diakses dari http://gaselpiji.com/uji-tabung.html pada tanggal 9 April 2013.
Smith, J.M., Ness, H.C.V., Abbott, M.M. 2001. Introduction To Chemical Engineering Thermodynamics. Edisi 6. USA: McGraw-Hill Companies, Inc.