IV. HASIL DAN PEMBAHASAN
4.1 Komposisi Kimia Ubi Kayu
Ubi kayu yang dipergunakan dalam penelitian ini adalah ubi kayu varietas Darul Hidayah yang diperoleh dari Daerah Sukabumi, Jawa Barat. Ubi kayu sebelum dipergunakan sebagai substrat fermentasi terlebih dahulu dijadikan tepung dengan ukuran 40 mesh kemudian dianalisis komposisi kimianya, yang meliputi kadar air, abu, lemak, protein dan karbohidrat. Hasil analisis komposisi kimia tepung ubi kayu disajikan pada Tabel 5.
Tabel 5 Hasil analisis komposisi tepung kimia ubi kayu. Komposisi (% bb) Parameter
Tepunga Tepung gaplekb 1. Kadar air 2. Kadar abu 3. Kadar lemak 4. Kadar protein 5. Serat kasar 6. Selulosa 7. Hemiselulosa 8. Lignin 9. Pati 8,65 ± 0,10 2,55 ± 0,14 6,54 ± 0,02 1,81 ± 0,03 2,69 ± 0,04 0,36 ± 0,01 1,88± 0,03 0,02 ± 0,01 62,54 ± 0,00 13,10 ± 0,07 2,26 ± 0,52 0,27 ± 0,04 2,07 ± 0,61
Data : rerata ± standar deviasi (n = 2) a
Analisis proksimat (2009),bRichana et al. (1990).
Kandungan air dalam bahan berpengaruh terhadap kesegaran dan daya simpan. Kandungan air ini dipengaruhi oleh varietas, umur tanam, unsur hara tanah dan iklim. Kandungan air dalam ubi kayu segar sekitar 60,30 % (Padonou et al. 2005). Berdasarkan hasil pengukuran kadar air bahan baku tepung ubi kayu yang dipergunakan mengandung sekitar 8,65 ± 0,10 % (bb), sedangkan menurut Richana et al. (2004) yaitu sekitar 13,10 ± 0,07 %.
Kadar abu dalam bahan berkaitan dengan kandungan mineral-mineral anorganik sisa pembakaran bahan organik pada suhu sekitar 550 oC (Apriyantono et al. 1988). Berdasarkan hasil pengamatan, kadar abu pada bahan adalah 2,55 ± 0,14 % (bb). Kadar abu ini tidak jauh berbeda dengan yang dikemukakan oleh Richana et al. (2004) yaitu sekitar 2,26 ± 0,52 %.
Kadar lemak dan protein pada bahan masing-masing sebesar 6,54 ± 0,02 % (bb) dan 1,81 ± 0,03 % (bb). Kadar lemak pada bahan yang dipergunakan konsentrasinya lebih tinggi dibandingkan dengan kadar lemak yang dilaporkan oleh Richana et al. (2004) yaitu sekitar 0,27 ± 0,04 %, sedangkan menurut Padonou et al. (2005), kadar lemak tepung ubi kayu sekitar 0,56 % (bb). Kandungan lemak dan protein dalam bahan berpengaruh terhadap karakteristik gelatinisasi dan kekentalan bahan pada saat diolah. Lemak pada bahan yang mengandung pati dapat mengganggu proses gelatinisasi karena dapat membentuk kompleks dengan amilosa sehingga menghambat keluarnya amilosa dari granula pati, sedangkan protein dapat menyebabkan kekentalan pati menurun (Mohamed 2003).
Karbohidrat terdiri dari fraksi pati dan serat kasar. Kedua fraksi ini merupakan bagian penting yang akan dipergunakan sebagai substrat fermentasi. Fraksi serat kasar terutama terdiri dari selulosa, hemiselulosa dan lignin. Pati dan selulosa merupakan homopolimer glukosa yang jika dihidrolisis akan menghasilkan glukosa, sedangkan hemiselulosa akan menghasilkan campuran gula yang terdiri dari glukosa, xilosa, galaktosa, arabinopiranosa, arabinofuranosa dan manosa. Glukosa, manosa dan galaktosa merupakan gula dari golongan heksosa, sedangkan xylosa dan arabinosa merupakan gula dari golongan pentosa (Demirbas 2005; Irawadi 1990). Dari hasil analisis komposisi kimia menunjukkan bahwa ubi kayu yang dipergunakan sebagai bahan dalam penelitian ini mengandung karbohidrat 80,45 ± 0,23 % (bb) dengan kandungan pati 62,35 ± 0,00 % dan serat kasar 2,69 ± 0,04 % (bb). Fraksi serat kasar mengandung selulosa 0,36 ± 0,01 % (bb), hemiselulosa 1,88 ± 0,03 % (bb) dan lignin 0,02 ± 0,01 % (bb). Menurut Richana et al. (2004), kadar karbohidrat dalam tepung ubi kayu adalah 82,30 ± 0,31 %. Perbedaan dalam komposisi karbohidrat ubi kayu dapat disebabkan oleh adanya perbedaan varietas, umur panen dan musim panen. Wargiono et al. (2006) menyatakan bahwa hasil ubi segar dan pati ubi kayu dengan umur panen 8 bulan dapat mencapai 16,19 ton/ha dengan hasil pati 2,31 ton/ha, sedangkan pada umur panen 18 bulan dapat mencapai 45,25 ton/ha dengan hasil pati 9,19 ton/ha.
Serat kasar (crude fiber) merupakan bagian dari karbohidrat yang tidak dapat dihidrolisis oleh asam dan basa kuat. Asam dan basa kuat yang biasa dipergunakan untuk analisa kadar serat kasar adalah H2SO4 1,25 % dan NaOH 1,25 %. Selulosa
dihidrolisis disebut bagian kristalin. Selulosa mempunyai sifat mengembang (sweeling) jika direaksikan dengan hidroksi logam alkali, garam-garam dalam larutan basa kuat dan senyawa amina. Dari sekian senyawa itu, NaOH paling lazim dipergunakan untuk mengembangkan ikatan selulosa (Irawadi 1990)
Kandungan karbohidrat yang cukup tinggi menunjukkan ubi kayu mempunyai potensi sebagai sumber glukosa dalam substrat fermentasi. Kadar lignin dalam ubi kayu ini relatif kecil. Kandungan serat kasar dapat menurunkan efisiensi hidrolisis sehingga meningkatkan dosis enzim yang diperlukan, sedangkan kandungan lignin yang tinggi dapat menghambat proses hidrolisis karena membentuk kompleks dengan selulosa dan hemiselulosa.
4.2 Kultivasi dan Produksi Enzim
Kurva pertumbuhan sangat penting dipergunakan untuk menggambarkan karakteristik pertumbuhan mikroba, sehingga memudahkan proses kultivasi dalam suatu media. Pertumbuhan mikroba dipengaruhi oleh beberapa faktor seperti suhu, pH, aktivitas air, adanya oksigen dan ketersediaan nutrisi makanan.
Gambar 5 Inokulum T. viride dan A. niger pada media PDA
Hari ke-2 Hari ke-4 Hari ke-7
4.2.1 Kultivasi Trichoderma viride
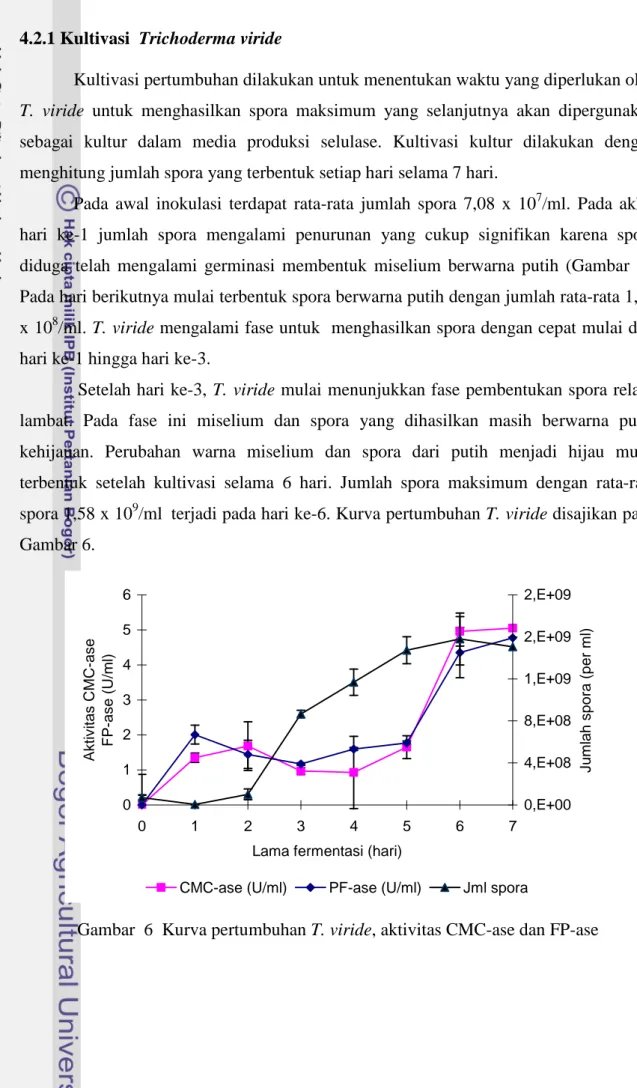
Kultivasi pertumbuhan dilakukan untuk menentukan waktu yang diperlukan oleh T. viride untuk menghasilkan spora maksimum yang selanjutnya akan dipergunakan sebagai kultur dalam media produksi selulase. Kultivasi kultur dilakukan dengan menghitung jumlah spora yang terbentuk setiap hari selama 7 hari.
Pada awal inokulasi terdapat rata-rata jumlah spora 7,08 x 107/ml. Pada akhir hari ke-1 jumlah spora mengalami penurunan yang cukup signifikan karena spora diduga telah mengalami germinasi membentuk miselium berwarna putih (Gambar 5). Pada hari berikutnya mulai terbentuk spora berwarna putih dengan jumlah rata-rata 1,02 x 108/ml. T. viride mengalami fase untuk menghasilkan spora dengan cepat mulai dari hari ke-1 hingga hari ke-3.
Setelah hari ke-3, T. viride mulai menunjukkan fase pembentukan spora relatif lambat. Pada fase ini miselium dan spora yang dihasilkan masih berwarna putih kehijauan. Perubahan warna miselium dan spora dari putih menjadi hijau mulai terbentuk setelah kultivasi selama 6 hari. Jumlah spora maksimum dengan rata-rata spora 1,58 x 109/ml terjadi pada hari ke-6. Kurva pertumbuhan T. viride disajikan pada Gambar 6. 0 1 2 3 4 5 6 0 1 2 3 4 5 6 7
Lama fermentasi (hari)
A k ti v it a s C M C -a s e F P -a s e (U /m l) 0,E+00 4,E+08 8,E+08 1,E+09 2,E+09 2,E+09 J u m la h s p o ra (p e r m l)
CMC-ase (U/ml) PF-ase (U/ml) Jml spora
4.2.2 Produksi enzim selulase
Pada penelitian ini produksi enzim selulase menggunakan Media Andreoti yang dimodifikasi (Jenie 1990). Modifikasi dilakukan dengan mengganti selulosa murni sebagai bahan penginduksi selulase menggunakan onggok ubi kayu. Onggok dapat dipergunakan sebagai bahan penginduksi selulase karena mengandung serat kasar terutama selulosa yang dapat dipergunakan sebagai sumber karbon untuk pertumbuhan mikroba. Selain itu, selulosa juga merupakan senyawa penginduksi sintesis enzim selulase. Kandungan serat kasar onggok rata-rata 6,58 ± 0,08 % (b/b). Konsentrasi onggok yang dipergunakan dalam penelitian ini adalah 10 g/L. Menurut Richana et al. (2004), kadar serat kasar onggok adalah 9,7 % yang terdiri dari lignin 1,3 %, xilan 5,8 % dan selulosa 2,61 %.
Penentuan pengaruh lama fermentasi yang menghasilkan aktivitas paling tinggi dilakukan dengan mengukur besarnya aktivitas enzim kasar setiap hari selama 1 minggu. Pengukuran antivitas enzim ini meliputi CMC-ase dan FP-ase. Dari hasil analisis keragaman diperoleh bahwa lama fermentasi memberi pengaruh nyata terhadap besarnya aktivitas CMC-ase dan FP-ase (p-value<0,05) (Lampiran 5)
Pada Gambar 5 menunjukkan bahwa pada awal fermentasi terjadi penurunan aktivitas CMC-ase sampai hari ke-4. Setelah itu aktivitas enzim CMC-ase cenderung mengalami peningkatan dan aktivitas maksimal sebesar 5,05 ± 0,42 U/ml diperoleh setelah fermentasi selama 7 hari atau 1 minggu, namun berdasarkan uji lanjut Duncan, aktivitas CMC-ase ini tidak berbeda nyata pada fermentasi selama 6 hari.
Hal serupa juga ditunjukkan pada besarnya aktivitas FP-ase, dimana pada awal fermentasi juga terjadi penurunan aktivitas sampai hari ke-3 dan pada hari berikutnya mengalami peningkatan. Aktivitas maksimal sebesar 4,77 ± 0,72 U/ml juga diperoleh setelah fermentasi selama 7 hari, namun berdasarkan uji lanjut Duncan, aktivitas FP-ase ini tidak berbeda nyata pada fermentasi selama 6 hari. Jenie (1990) memproduksi selulase kasar dari T. reesei selama 9 hari menggunakan substrat onggok diperoleh besarnya aktivitas CMC-ase 12,7 U/ml dan FP-ase sebesar 0,88 U/ml.
Terjadinya peningkatan aktivitas enzim selulase (CMC-ase dan FP-ase) menunjukkan T. viride telah melakukan degradasi terhadap fraksi selulosa yang terdapat pada substarat untuk menghasilkan glukosa yang akan dipergunakan untuk metabolisme
sel. Suhartono (1992) menjelaskan bahwa sintesis enzim ekstraseluler dalam jumlah terbesar secara normal terjadi pada saat sebelum sporulasi, yaitu pada akhir fase eksponensial dan awal fase stasioner. Keadaan tersebut diduga karena pada masa transisi fase eksponensial diikuti dengan penurunan jumlah sumber karbon dalam medium, sehingga sintesis enzim selulase mulai meningkat.
Terjadinya peningkatan aktivitas enzim pada proses fermentasi diduga disebabkan oleh adanya perubahan pH dari pH awal 4,0 menjadi 3,28 pada hari ke-7 Enari (1983) menyebutkan bahwa pH optimal untuk pertumbuhan Trichoderma sekitar 4,0, sedangkan untuk produksi selulase mendekati 3,0. Selama produksi enzim, pH harus dipertahankan dalam kisaran 3,0-4,0 karena inaktivasi enzim akan terjadi jika pH berada dibawah 2,0. Penurunan pH yang terjadi pada produksi selulase berhubungan langsung dengan adanya konsumsi karbohidrat yang terdapat pada onggok. Pola perubahan pH selama fermentasi untuk produksi enzim selulase disajikan pada Lampiran 5.
4.2.3 Kultivasi Aspergillus niger dan produksi amiloglukosidase
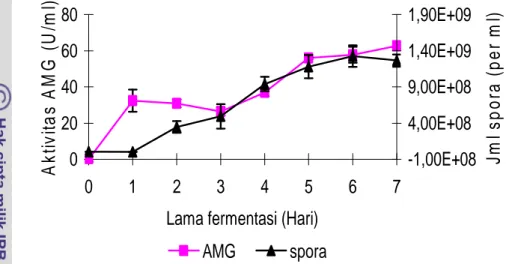
Kultivasi kultur A. niger juga dilakukan selama 7 hari dengan melakukan perhitungan jumlah spora yang terbentuk setiap hari. Pada awal inokulasi terdapat rata-rata jumlah spora 3,47 x 106/ml. Pada akhir hari ke-1 spora mengalami penurunan karena diduga spora mengalami germinasi membentuk miselium berwarna hitam (Gambar 5). Pada hari berikutnya mulai terbentuk spora dengan jumlah rata-rata 3,45 x 108/ml. Mikroba menghasilkan spora dengan cepat mulai hari ke-1 hingga hari ke-4 dengan spora berwarna hitam. Setelah hari ke-4 laju pembentukan spora relatif lambat dan jumlah spora maksimum mulai terjadi pada hari ke-6 dengan jumlah rata-rata spora 1,33 x 109/ml. Kurva pertumbuhan A. niger disajikan pada Gambar 7.
Pada pengukuran aktivitas enzim kasar amiloglukosidase menunjukkan bahwa variasi lama fermentasi berpengaruh nyata terhadap aktivitas enzim (p-value<0,05), dimana pada awal fermentasi terjadi penurunan aktivitas enzim sampai pada hari ke-3 dan selanjutnya mengalami peningkatan sampai hari ke-7. Aktivitas maksimal sebesar 62,77 ± 4,49 U/ml diperoleh pada lama fermentasi 7 hari dan berdasarkan uji lanjut
Duncan, aktivitas ini berbeda nyata dengan semua perlakuan lama fermentasi (Lampiran 5). 0 20 40 60 80 0 1 2 3 4 5 6 7
Lama fermentasi (Hari)
A k ti v it a s A M G (U /m l) -1,00E+08 4,00E+08 9,00E+08 1,40E+09 1,90E+09 J m l s p o ra (p e r m l) AMG spora
Gambar 7 Kurva pertumbuhan A. niger dan aktivitas glukoamilase
Dari Gambar 7 terlihat bahwa aktivitas enzim glukoamilase pada fermentasi hari ke-1 sampai hari ke-3 mengalami penurunan dari 32,41 U/ml -26,47 U/ml, hal ini dapat disebabkan enzim dalam masa penyesuaian, sedangkan pada hari ke-4 sampai hari ke-7 aktivitas enzim semakin meningkat. Ini menunjukkan semakin lama difermentasi aktivitas glukoamilase semakin besar dalam menghidrolisis pati menjadi monomer glukosa.
Perbedaan aktivitas enzim dengan variasi waktu fermentasi dapat disebabkan meningkatnya aktivitas glukoamilase I pada kompleks glukoamilase A. niger pada kondisi waktu fermentasi yang lebih lama. Hal ini dapat pula disebabkan oleh adanya perubahan pH selama fermentasi (Kombong 2004)
Enzim glukoamilase I merupakan komponen kompleks glukoamilase yang aktif menghidrolisis ikatan α-1,6 glikosidik pada rantai cabang pati dan glukoamilase II aktif menghidrolisis ikatan α-1,4 glikosidik pada rantai lurus pati menjadi monomer glukosa.
Selama proses fermentasi terjadi penurunan pH awal dari 4,0 sampai 2,68 pada hari ke-3. Penurunan pH berhubungan dengan konsumsi karbohidrat oleh mikroba. Bila karbohidrat atau glukosa telah habis dikonsumsi, aktivitas glukoamilase dan pH akan meningkat kembali. Meningkatnya pH berhubungan dengan dihasilkannya senyawa amoniak atau dengan dikonsumsinya asam yang terbentuk dalam siklus pertumbuhan
segera setelah semua karbohidrat dikonsumsi. Perubahan pH selama fermentasi produksi enzim glukoamilase dapat dilihat pada Lampiran 5.
4. 3 Proses Hidrolisis dan Karakteristik Hidrolisat
Proses pembuatan hidrolisat dilakukan dengan menghidrolisis fraksi pati dan serat yang terkandung pada bahan. Hidrolisis dilakukan dengan tujuan untuk menyediakan glukosa yang akan dipergunakan sebagai substrat S. cerevisiae dalam proses fermentasi. Pada dasarnya prinsip hidrolisis adalah memutuskan rantai polimer bahan menjadi unit-unit monomer yang lebih sederhana. Pemutusan rantai polimer tersebut dapat dilakukan dengan berbagai metode, misalnya secara enzimatis, kimiawi ataupun kombinasi keduanya. Hidrolisis secara enzimatis memiliki perbedaan mendasar dibandingkan hidrolisis secara kimiawi dan fisik dalam hal spesifitas pemutusan rantai polimer bahan. Hidrolisis secara kimiawi dan fisik akan memutus rantai polimer secara acak, sedangkan hidrolisis enzimatis akan memutus rantai polimer secara spesifik pada percabangan tertentu.
Dalam penelitian ini, pembuatan hidrolisat dilakukan dengan 2 cara yaitu hidrolisis menggunakan asam dan enzim. Asam yang dipergunakan adalah H2SO40,4 M dengan waktu hidrolisis 10 menit pada suhu 121oC, tekanan 1 atm. Penggunaan H2SO4 0,4 M diharapkan hanya menghidrolisis fraksi pati tanpa menghidrolisis fraksi seratnya.
Hidrolisis enzimatik mempunyai beberapa keuntungan, yaitu menghasilkan produk yang lebih spesifik sesuai dengan yang diinginkan, kondisi proses dapat dikontrol dan lebih sedikit menghasilkan produk samping. Enzim yang dipergunakan meliputi α-amilase, amiloglukosidase komersial (AMG), selulase komersial dan selulase kasar dari T. viride. Enzim α-amilase dan AMG dipergunakan untuk menghidrolisis fraksi pati menjadi glukosa, sedangkan selulase komersial dan selulase kasar dipergunakan untuk menghidrolisis fraksi serat atau selulosa menjadi glukosa atau gula-gula sederhana lainnya yang merupakan monosakarida.
Proses hidrolisis secara enzimatik meliputi proses likuifikasi dan sakarifikasi. Pada tahap ini tepung dikonversi menjadi gula melalui proses pemecahan gula kompleks. Pada tahap likuifikasi dilakukan penambahan enzim α-amilase untuk memotong ikatan α-1,4 glikosida pati menjadi dekstrin. Proses ini dilakukan pada suhu
90 oC selama 1 jam. Dosis enzim yang dipergunakan dalam penelitian ini adalah 1 ml/kg pati (Budiyanto et al. 2005 ). Likuifikasi merupakan proses pencairan pati yang telah mengalami gelatinisasi. Gelatinisasi dapat dilakukan dengan melakukan pemanasan pati di dalam air sehingga granula pati mulai mengembang sehingga kekentalannya meningkat (Thomas dan Atwell 1997). Adanya proses gelatinisasi menyebabkan ikatan-ikatan antar molekul pati lebih lemah sehingga kerja enzim dapat lebih mudah.
Tahap sakarifikasi dilakukan pada suhu 50 oC selama 48 jam. Enzim yang ditambahkan pada tahap ini adalah AMG yang berfungsi untuk memutuskan rantai pati menjadi molekul-molekul glukosa pada bagian non pereduksi, baik pada ikatan α-1,4 maupun α-1,6 glikosida dan menghasilkan unit-unit glukosa. Dosis AMG yang dipergunakan sebesar 1,2 ml/kg pati (Budiyanto et al. 2005 ). Beberapa perlakuan hidrolisis pada tahap sakarifikasi ditambahkan enzim selulase baik yang komersial maupun filtrat enzim selulase kasar. Enzim selulase yang ditambahkan pada tahap sakarifikasi ini diharapkan dapat menghidrolisis fraksi serat terutama selulosa yang mempunyai ikatan β-1,4 glikosida untuk menghasilkan glukosa. Karakteristik hasil hidrolisis asam dan enzim disajikan pada Tabel 6.
Tabel 6 Karakteristik hasil hidrolisis asam dan enzim
Hidrolisis Total gula
(% b/v) Gula reduksi (% b/v) DE (%) Asam (H2SO40,4 M) α-amilase, AMG
α-amilase, AMG, selulase kasar α-amilase, AMG, selulase komersial
38,93 ± 8,09 34,93 ± 10,28 35,59 ± 11,32 36,62 ± 22,23 22,04 ± 4,31 19,50 ± 3,65 21,11 ± 1,94 26,43 ± 2,60 56,63 55,82 59,32 72,17 AMG : Amiloglukosidase komersial, Data : Rerata ± standar deviasi (n = 3)
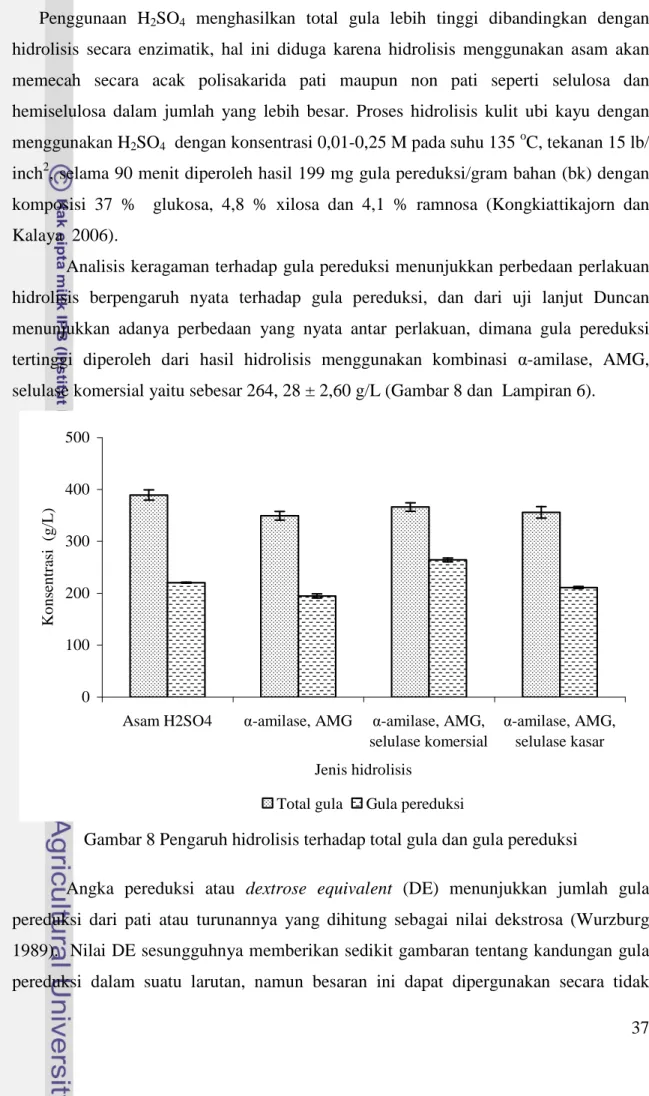
Hasil analisis keragaman menunjukkan bahwa perlakuan jenis hidrolisis tepung ubi kayu berpengaruh nyata terhadap total gula yang dihasilkan (Lampiran 6). Hasil uji lanjut Duncan menunjukkan adanya perbedaan yang nyata antara hidrolisis asam dengan hidrolisis yang hanya menggunakan enzim amilolitik (α-amilase, AMG), namun perlakuan asam ini tidak bebeda nyata dengan perlakuan hidrolisis yang menggunakan enzim amilolitik dan selulase. Total gula tertinggi diperoleh dari hasil hidrolisis asam yaitu sebesar 389,25 ± 8,09 g/L.
Penggunaan H2SO4 menghasilkan total gula lebih tinggi dibandingkan dengan hidrolisis secara enzimatik, hal ini diduga karena hidrolisis menggunakan asam akan memecah secara acak polisakarida pati maupun non pati seperti selulosa dan hemiselulosa dalam jumlah yang lebih besar. Proses hidrolisis kulit ubi kayu dengan menggunakan H2SO4 dengan konsentrasi 0,01-0,25 M pada suhu 135oC, tekanan 15 lb/ inch2, selama 90 menit diperoleh hasil 199 mg gula pereduksi/gram bahan (bk) dengan komposisi 37 % glukosa, 4,8 % xilosa dan 4,1 % ramnosa (Kongkiattikajorn dan Kalaya 2006).
Analisis keragaman terhadap gula pereduksi menunjukkan perbedaan perlakuan hidrolisis berpengaruh nyata terhadap gula pereduksi, dan dari uji lanjut Duncan menunjukkan adanya perbedaan yang nyata antar perlakuan, dimana gula pereduksi tertinggi diperoleh dari hasil hidrolisis menggunakan kombinasi α-amilase, AMG, selulase komersial yaitu sebesar 264, 28 ± 2,60 g/L (Gambar 8 dan Lampiran 6).
0 100 200 300 400 500
Asam H2SO4 α-amilase, AMG α-amilase, AMG, selulase komersial α-amilase, AMG, selulase kasar Jenis hidrolisis K o n sen tra si (g /L )
Total gula Gula pereduksi
Gambar 8 Pengaruh hidrolisis terhadap total gula dan gula pereduksi
Angka pereduksi atau dextrose equivalent (DE) menunjukkan jumlah gula pereduksi dari pati atau turunannya yang dihitung sebagai nilai dekstrosa (Wurzburg 1989). Nilai DE sesungguhnya memberikan sedikit gambaran tentang kandungan gula
langsung untuk mengukur jenis dan kuantitas gula-gula yang ada di dalam larutan atau spektrum gula (Tjokroadikoesoemo 1986).
Pada hidrolisis secara enzimatik, terlihat bahwa adanya penambahan enzim selulase komersial dan enzim kasar dapat meningkatkan kandungan gula pereduksi yang ada pada bahan jika dibandingkan dengan perlakuan yang hanya menggunakan enzim α-amilase, AMG. Angka pereduksi tertinggi 72,166 % diperoleh dari proses sakarifikasi dengan AMG yang ditambahkan selulase komersial 15 Unit/g serat kasar, diikuti oleh proses sakarifikasi dengan AMG yang ditambahkan selulase kasar sebesar 59,315 % dan hidrolisis tanpa penambahan enzim selulase sebesar 57,154 %. Adanya peningkatan konsentrasi gula pereduksi dengan penambahan enzim selulase jika dibandingkan dengan hanya menggunakan enzim amilolitik diduga enzim selulase mampu menghidrolisis selulosa pada fraksi serat untuk menghasilkan lebih banyak glukosa. Selain itu, diduga enzim selulase mampu melonggarkan dan menghidrolisis ikatan-ikatan pada serat sehingga kinerja enzim AMG dapat lebih maksimal untuk menghidrolisis fraksi pati menghasilkan glukosa.
Peningkatan konsentrasi gula pereduksi dapat disebabkan oleh serangan selulase secara sinergis antara endoglukonase, selobiohidrolase dan β-glukosidase. Pada tahap awal endoglukonase menghidrolisis ikatan 1,4 secara acak dan bekerja pada bagian amorf dari serat selulosa. Selanjutnya selobiohidrolase menghidrolisis ujung rantai selulosa menghasilkan selobiosa, dimana selobiosa ini dihidrolisis oleh β-glukosidase menjadi glukosa ( Dewi 2002; Reezey et al. 1996)
Menurut Sriroth et al. (2000), untuk meningkatkan hasil hidrolisis singkong yang mengandung fraksi pati dan serat dapat dilakukan dengan menggunakan campuran enzim selulase, xilanase, β,D-glukosidase, amilase, AMG dan pektinase. Dengan adanya campuran enzim akan dapat meningkatkan efisiensi ekstraksi pati dengan meregangkan atau menghidrolisis struktur polisakarida yang mengikat pati. Penggunaan selulase 15 U/g substrat dan pektinase 122,5 U/g substrat untuk menghidrolisis tepung ubi kayu selama 1 jam dapat meningkatkan perolehan pati 40 %.
Obalua (2007), melaporkan bahwa hidrolisis onggok ubi kayu dengan menggunakan selulase dan pektinase pada suhu 28 oC selama 1 jam, diikuti dengan hidrolisis α-amilase pada suhu 100oC selama 2 jam dam kemudian dihidrolisis dengan
Peningkatan konsentrasi gula pereduksi disebabkan oleh adanya sinergi antara selulase, α-amilase, AMG dan adanya penambahan pektinase dapat mengurangi kekentalan substrat sehingga kinerja enzim lebih efektif.
Srinorakutara et al. (2004) menyatakan bahwa hidrolisis onggok ubi kayu dengan menggunakan H2SO4 0,6 M pada suhu 120 oC selama 30 menit menghasilkan gula pereduksi maksimum 6,09 % (b/v). Hidrolisis dengan menggunakan enzim α-amilase dan AMG menghasilkan konsentrasi gula pereduksi 4,23 % (b/v). Hidrolisis dengan kombinasi enzim selulase, α-amilase dan AMG menghasilkan konsentrasi gula pereduksi 4,74 % (b/v). Hidrolisis dengan menggunakan enzim pektinase, selulase, α-amilase dan AMG menghasilkan 4,98 % (b/v) gula pereduksi.
4.4 Proses Fermentasi
Pembuatan etanol pada umumnya dilakukan melalui proses fermentasi. Fermentasi merupakan proses untuk mengkonversi glukosa menjadi etanol dan CO2. Fermentasi etanol adalah perubahan 1 mol gula menjadi 2 mol etanol dan 2 mol CO2. Pada proses fermentasi etanol, khamir terutama akan memetabolisme glukosa dan fruktosa membentuk asam piruvat melalui tahapan reaksi pada jalur Embden-Meyerhof-Parnas (EMP), sedangkan asam piruvat yang dihasilkan akan didekarboksilasi menjadi asetaldehida yang kemudian mengalami dehidrogenasi menjadi etanol.
Khamir yang sering digunakan dalam fermentasi etanol adalah S. cerevisiae, karena jenis ini dapat berproduksi tinggi, toleran terhadap etanol yang cukup tinggi (12-18% v/v), tahan terhadap kadar gula yang tinggi dan tetap aktif melakukan fermentasi pada suhu 4-32oC (Harrisson dan Graham 1970).
Proses produksi etanol ini dilakukan melalui fermentasi secara batch atau nir sinambung dengan tujuh perlakuan alternatif tahapan proses produksi. Proses fermentasi menggunakan erlenmeyer 1000 ml dengan volume substrat 500 ml. Kondisi fermentasi dilakukan pada suhu ruang, dimana pada 24 jam awal dilakukan proses agitasi dengan kecepatan 150 rpm. Proses ini bertujuan untuk mempermudah difusi oksigen ke dalam medium sehingga kontak antara substrat dan inokulum makin banyak dan homogen. Menurut Hollaender (1981), agitasi dapat memperlancar difusi oksigen sehingga kadar oksigen terlarut dalam medium akan cukup mendukung untuk
pertumbuhan sel secara aerobik. Setelah jam ke-24 agitasi dihentikan untuk memperoleh kondisi anaerob, sehingga proses produksi etanol dapat berjalan lebih optimal. Substrat diatur pH awalnya sampai mencapai 5,0 dengan menggunakan HCl 1N.
Proses fermentasi dilakukan selama 96 jam dan diamati perubahan total gula dan pH secara periodik. Pada akhir fermentasi dianalisis kandungan serat kasar sisa, total gula sisa dan kadar etanol yang dihasilkan. Etanol yang dihasilkan akan dihitung efisiensi fermentasinya berdasarkan jumlah substrat yang dikonsumsi oleh khamir untuk menghasilkan etanol secara teorits. Perhitungan didasarkan pada metabolisme glukosa menjadi etanol melalui jalur EMP. Secara sederhana proses fermentasi alkohol dari bahan baku glukosa terlihat pada persamaan reaksi berikut:
C6H12O6 2C2H5OH + 2CO2+ 2 ATP + 5 Kkal
Dari reaksi diatas, secara teoritis 100 % karbohidrat diubah menjadi 51,1% etanol dan 48,9 % menjadi CO2. Efisiensi fermentasi merupakan persentase perbandingan antara konsentrasi etanol yang diperoleh (aktual) dengan konsentrasi etanol secara teoritis. Yield atau rendemen produk adalah persentase etanol yang terbentuk per substrat tepung ubi kayu yang dipergunakan. Efisiensi pemanfaatan substrat (ds/s) merupakan perbandingan jumlah substrat glukosa yang dikonsumsi dengan substrat awal yang tersedia.
Perlakuan pertama (P1), proses hidrolisis dilakukan dengan menggunakan asam yaitu H2SO4 0,4 M selama10 menit. Hasil hidrolisis berupa hidrolisat glukosa yang masih bercampur dengan serat. Hidrolisat kemudian didetoksifikasi dan dinetralisasi dengan cara menambahkan NH4OH 10 % hingga pH mencapai 10,0 dan dibiarkan selama 30 menit, setelah itu diatur pH-nya menjadi 5,0 dengan menambahkan HCl 1 N (Alriksson et al. 2005) . Hidrolisat ini kemudian ditambahkan kultur T. viride (1,58 x 109/ml) sebanyak 10 % dari volume substrat dan diinkubasi selama 48 jam. Setelah inkubasi dilakukan proses fermentasi dengan menambahkan kultur S. cerevisiae sebanyak 10 % dari volume substrat. Penambahan kultur T. viride dimaksudkan untuk menghidrolisis fraksi serat yang terdapat pada hidrolisat terlebih dahulu untuk menghasilkan glukosa, kemudian glukosa yang terbentuk dimanfaatkan oleh S.
cerevisiae untuk memproduksi etanol. Perubahan total gula dan pH substrat selama fermentasi disajikan pada Gambar 9.
0,00 1,00 2,00 3,00 4,00 5,00 6,00 0 6 12 18 24 36 48 72 96
Lama fermentasi (Jam)
p H 0 100 200 300 400 500 T o ta l G u la (g /L ) pH Total gula
Gambar 9 Perubahan pH dan total gula selama fermentasi P1
Perlakuan kedua (P2), proses hidrolisis dan netralisasi dilakukan sama halnya seperti pada perlakuan P1, hanya saja hidrolisat asam yang masih mengandung serat setelah dinetaralisasi dan diatur pH-nya sampai 5,0 kemudian ditambahkan kultur campuran T. viride (1,58 x 109/ml) dan S. cerevisiae secara simultan dengan perbandingan 1:1 yaitu masing-masing 10 % dari volume substrat. Penambahan kultur campuran ini dimaksudkan agar T. viride dapat menghidrolisis serat dan hasilnya langsung dimanfaatkan oleh S. cerevisiae untuk memproduksi etanol.
0,00 1,00 2,00 3,00 4,00 5,00 6,00 0 6 12 18 24 36 48 72 96
Lama fermentasi (Jam)
p H 0 100 200 300 400 500 T o ta l G u la (g /L ) pH Total gula
Selama proses fermentasi pada perlakuan P2 (Gambar 10) terjadi penurunan konsentrasi total gula dan pH. Penurunan konsentrasi total gula terjadi dari 383,08 ± 3,70 g/L menjadi 277,94 ± 17,29 g/L, sedangkan penurunan pH awal terjadi dari 5,01 ± 0,01 menjadi 4,27 ± 0,02. Penurunan total gula dan pH terjadi secara cepat pada awal fermentasi sampai jam ke-24 (Gambar 14). Pada fase ini diduga mikroba lebih banyak mengkonsumsi substrat untuk menghasilkan etanol dibandingkan dengan waktu setelah jam ke-24 sampai jam ke-96. Selama proses fermentasi diperoleh etanol dengan konsentrasi 3,92 ± 0,31 % (b/v) dan rendemen 15,99 % (v/b). Efisiensi fermentasi dan penggunaan substrat masing-masing 49,48 % dan 40,49 %.
Perlakuan ketiga (P3) menggunakan proses SFS, dimana pada tahap awal dilakukan proses hidrolisis enzimatik melalui proses likuifikasi menggunakan enzim α-amilase. Enzim ini hanya berfungsi untuk mencairkan pati yang telah tergelatinisasi dan hanya menghidrolisis fraksi amilosa yang mempunyai ikatan pada pati α-1,4 glikosidik, sedangkan fraksi amilopektin yang juga mempunyai ikatan α-1,6 glikosidik dan fraksi serat terutama selulosa yang mempunyai ikatan β-1,4 glikosidik tidak akan terhidrolisis. Setelah likuifikasi dilakukan proses sakarifikasi dan fermentasi secara simultan dengan menambahkan kultur campuran A. niger (1,33 x 109/ml), T. viride (1,58 x 109/ml) dan S. cerevisiae dengan perbandingan 1:1:1 yaitu masing-masing 10 % dari volume substrat. Pemberian kultur campuran dilakukan dengan menambahkan supernatan dan miselium yang telah diproduksi selama 7 hari ( Kovacs et al. 2009).
0,00 1,00 2,00 3,00 4,00 5,00 6,00 0 6 12 18 24 36 48 72 96
Lama fermentasi (Jam)
p H 0 50 100 150 200 250 300 350 400 T o ta l G u la (g /L ) pH Total gula
Penambahan kultur A. niger dimaksudkan agar enzim AMG yang dihasilkan oleh A. niger akan langsung menghidrolisis fraksi amilopektin untuk menghasilkan glukosa, begitu juga dengan penambahan T. viride diharapkan enzim selulase yang dihasilkan akan mampu menghidrolisis fraksi selulosa pada fraksi serat kasar untuk menghasilkan glukosa. Glukosa yang dihasilkan dari kultur campuran ini secara simultan dimanfaatkan oleh S. cerevisiae untuk memproduksi etanol.
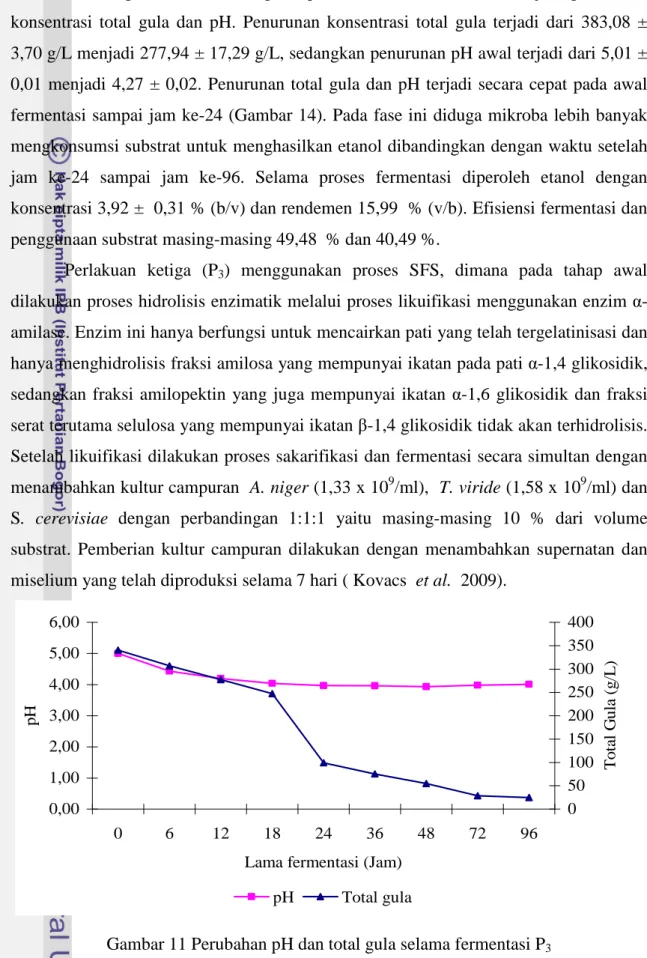
Selama proses fermentasi pada perlakuan P3 terjadi penurunan konsentrasi total gula dari 340,29 ± 10,49 g/L menjadi 24,81 ± 7,09 g/L dan penurunan pH awal dari 5,01 ± 0,01 menjadi 3,93 ± 0,10 terjadi sampai jam ke-48. Setelah jam ke-48, terjadi peningkatan pH akhir fermentasi menjadi 4,01 ± 0,170. Penurunan konsentrasi total gula secara cepat terjadi mulai jam ke-18 sampai jam ke-24, setelah itu, penurunan konsentrasi total gula relatif lambat (Gambar 11). Selama proses fermentasi diperoleh etanol dengan konsentrasi 7,41 ± 1,79 % (b/v) dan rendemen 32,76 % (v/b). Efisiensi fermentasi dan penggunaan substrat masing-masing 46,05 % dan 92,709 %.
Perlakuan keempat (P4), Proses hidrolisis dilakukan secara enzimatik melalui proses likuifikasi dengan enzim α-amilase dan proses sakarifikasi menggunakan campuran enzim AMG dan filtrat enzim selulase kasar dari hasil produksi menggunakan kultur T.viride. Setelah proses sakarifikasi dilakukan fermentasi dengan penambahan S. cerevisiae 10 % dari volume substrat.
0,00 1,00 2,00 3,00 4,00 5,00 6,00 0 6 12 18 24 36 48 72 96
Lama fermentasi (Jam)
p H 0 50 100 150 200 250 300 350 400 T o ta l G u la (g /L ) pH Total gula
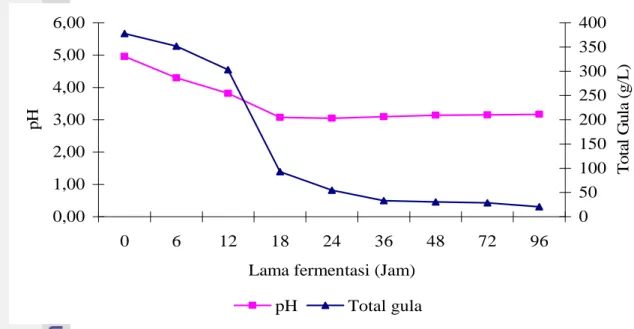
Perubahan total gula dan pH juga terjadi pada perlakuan P4. Pada Gambar 12 terlihat bahwa selama proses fermentasi terjadi penurunan konsentrasi total gula dari 377,74 ± 4,67 g/L menjadi 20,69 ± 2,78 g/L. Penurunan pH awal dari 4,96 ± 0,05 menjadi 3,05 ± 0,39 terjadi sampai jam ke-24. Setelah itu, terjadi peningkatan pH akhir fermentasi menjadi 3,17 ± 0,42. Penurunan konsentrasi total gula secara cepat terjadi mulai jam ke-6 sampai jam ke-24, setelah melewati jam ke-24 penurunan konsentrasi total gula relatif lambat. Penurunan pH awal terjadi sangat cepat dari awal fermentasi sampai jam ke-18. Setelah melewati jam ke-18 pH substrat relatif konstan. Dengan menggunakan perlakuan ini, konsentrasi etanol yang diperoleh sebesar 9,29 ± 1,76 % (b/v) dengan rendemen 34,77 % (v/b). Efisiensi fermentasi dan penggunaan substrat masing-masing 51,03 % dan 94,52 %.
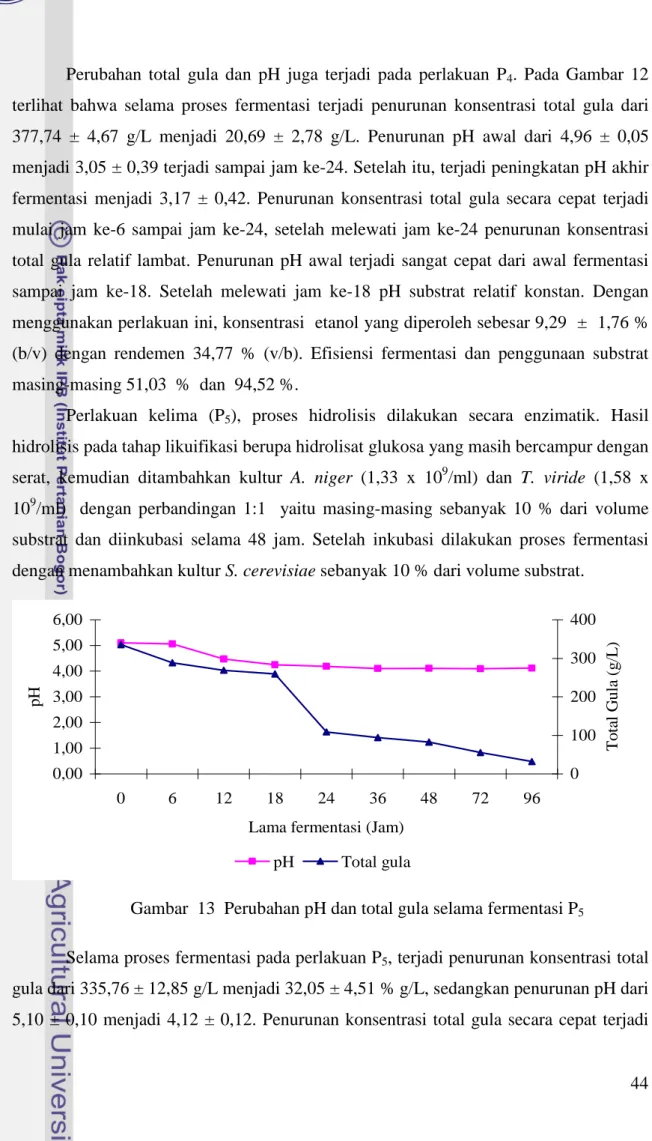
Perlakuan kelima (P5), proses hidrolisis dilakukan secara enzimatik. Hasil hidrolisis pada tahap likuifikasi berupa hidrolisat glukosa yang masih bercampur dengan serat, kemudian ditambahkan kultur A. niger (1,33 x 109/ml) dan T. viride (1,58 x 109/ml) dengan perbandingan 1:1 yaitu masing-masing sebanyak 10 % dari volume substrat dan diinkubasi selama 48 jam. Setelah inkubasi dilakukan proses fermentasi dengan menambahkan kultur S. cerevisiae sebanyak 10 % dari volume substrat.
0,00 1,00 2,00 3,00 4,00 5,00 6,00 0 6 12 18 24 36 48 72 96
Lama fermentasi (Jam)
p H 0 100 200 300 400 T o ta l G u la (g /L ) pH Total gula
Gambar 13 Perubahan pH dan total gula selama fermentasi P5
Selama proses fermentasi pada perlakuan P5, terjadi penurunan konsentrasi total gula dari 335,76 ± 12,85 g/L menjadi 32,05 ± 4,51 % g/L, sedangkan penurunan pH dari 5,10 ± 0,10 menjadi 4,12 ± 0,12. Penurunan konsentrasi total gula secara cepat terjadi
mulai dari jam ke-18 sampai jam ke-24 dan penurunan pH terjadi pada jam ke-6 sampai jam ke-18 (Gambar 13). Konsentrasi etanol yang dihasilkan dari perlakuan ini sebesar 6,38 ± 0,66 % (b/v) dengan rendemen 28,21 % (v/b). Efisiensi fermentasi dan penggunaan substrat masing-masing 41,18 % dan 90,45 %.
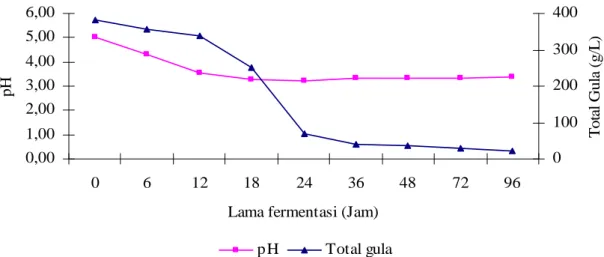
Perlakuan keenam (P6) pada dasarnya dilakukan dengan cara yang sama dengan perlakuan P4. Perbedaan hanya terjadi pada proses sakarifikasi, dimana perlakuan P6 menggunakan campuran AMG dengan selulase komersial.
0,00 1,00 2,00 3,00 4,00 5,00 6,00 0 6 12 18 24 36 48 72 96
Lama fermentasi (Jam)
p H 0 100 200 300 400 T o ta l G u la (g /L ) p H Total gula
Gambar 14 Perubahan pH dan total gula selama fermentasi P6
Penurunan total gula selama proses fermentasi P6terjadi dari konsentrasi 380,21 ± 17,03 g/L menjadi 22,75 ± 0,69 g/L dan penurunan pH terjadi dari 5,01 ± 0,09 menjadi 3,40 ± 0,65. Penurunan konsentrasi total gula secara cepat terjadi mulai pada jam ke-12 sampai jam ke 24, sedangkan penurunan pH terjadi mulai awal sampai jam ke-18 (Gambar 14). Konsentrasi etanol yang dihasilkan dari proses fermentasi ini 8,92 ± 0,56 % (b/v) dengan rendemen 33,36% (v/b). Efisiensi fermentasi dan penggunaan substrat masing-masing 48,80 % dan 94,210 %.
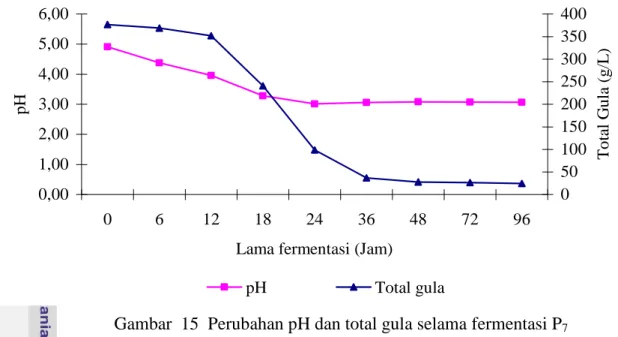
Perlakuan kontrol (P7), proses hidrolisis dilakukan secara enzimatik melalui proses likuifikasi dengan enzim α-amilase dan proses sakarifikasi menggunakan enzim AMG. Hasil hidrolisat yang masih mengandung serat kemudian difermentasi selama 96 jam dengan menambahkan S. cerevisiae sebanyak 10 % dari volume substrat. Selama proses fermentasi pada perlakuan kontrol terjadi penurunan konsentrasi total gula dari 376,91 ± 15,17 g/L menjadi 24,11 ± 1,42 g/L, sedangkan penurunan pH terjadi mulai
secara cepat mulai jam ke-12 sampai jam ke- 36 , sedangkan penurunan pH mulai terjadi dari awal fermentasi sampai jam ke-24. Konsentrasi etanol yang dihasilkan dari perlakuan ini 5,34 ± 0,63 % (b/v) dengan rendemen 20,05 % (v/b). Efisiensi fermentasi dan penggunaan substrat masing-masing 30,05 % dan 93,603 %.
0,00 1,00 2,00 3,00 4,00 5,00 6,00 0 6 12 18 24 36 48 72 96
Lama fermentasi (Jam)
p H 0 50 100 150 200 250 300 350 400 T o ta l G u la (g /L ) pH Total gula
Gambar 15 Perubahan pH dan total gula selama fermentasi P7
Diskusi
Pada semua perlakuan menunjukkan adanya korelasi searah antara penurunan total gula dengan pH yaitu penurunan konsentrasi total gula diikuti dengan penurunan pH substrat. Hal ini berkaitan dengan adanya konsumsi glukosa melalui proses glikolisis dan akumulasi senyawa asam-asam organik yang terbentuk selama proses fermentasi. Senyawa asam-asam organik dapat berupa asam asetat, laktat dan asam piruvat. Asam piruvat merupakan senyawa yang terbentuk selama proses glikolisis pada siklus EMP. Selama proses glikolisis, setiap satu mol glukosa akan dipecah menjadi dua mol asam piruvat dan melepaskan dua mol ion H+. Adanya ion H+ini diduga dapat menurunkan pH larutan fermentasi. Secara keseluruhan proses glikolisis dapat dilihat dari persamaan reaksi berikut ini:
Glukosa + 2 ADP + 2 NAD++ 2 Pi 2 Piruvat + 2 ATP + 2 NADH + 2 H+
Asam piruvat yang terbentuk kemudian dirubah menjadi asetaldehid dan CO2 oleh enzim piruvat dekarboksilase yang selanjutnya dirubah menjadi alkohol oleh enzim alkohol dehidrogenase. Adanya penumpukan asam diduga karena S. cerevisiae kurang
mampu untuk mengubah asam piruvat menjadi etanol sehingga terjadi penumpukan asam.
Penurunan pH selama proses fermentasi dapat juga disebabkan oleh adanya proses ionisasi H+ dan penggunaan (NH4)2SO4 sebagai sumber nitrogen untuk pertumbuhan sel. (NH4)2SO4 jika berada di dalam larutan akan terionisasi menjadi ion NH4+ dan SO42-. Dalam proses pembentukan massa sel, mikroba akan mengkonsumsi NH4+ untuk membentuk R-NH3+. Pembentukan R-NH3+ oleh NH4+ yang semakin banyak akan meningkatkan pelepasan ion H+ ke dalam larutan substrat, sehiggan pH menjadi semakin menurun.
Pada fermentasi menggunakan substrat hidrolisat asam, laju fermentasi lebih lambat dari pada fermentasi menggunakan substrat hidrolisat enzim. Hal ini dilihat dari laju konsumsi glukosa yang berlangsung secara lambat pada tahap awal dan mulai menurun secara cepat setelah jam ke-18 (P1dan P2). Lambatnya laju fermentasi diduga disebabkan oleh adanya senyawa-senyawa penghambat yang terbentuk selama proses hidrolisis asam seperti senyawa furfural, HMF, asam karboksilat dan komponen-komponen fenol (Mussatto dan Roberto 2004). Fase awal yang lambat menunjukkan mikroorganisme memerlukan fase adaptasi (lag phase) yang lebih lama. Kondisi ini diduga disebabkan oleh adanya proses sintesis enzim atau koenzim baru oleh mikroorganisme untuk menguraikan furfural ( Boyer et al. 1992). Palvist dan Hagerdal (2000b) menyatakan bahwa adanya fase adaptasi berkaitan dengan adanya sintesis enzim baru untuk merubah furfural menjadi furfural alkohol, dan proses ini melibatkan enzim alkoholdehidrogenase (ADH) yang sebenarnya berfungsi untuk merubah asetaldehid menjadi etanol. Sanchez dan Bautista (1988) menyatakan bahwa HMF pada konsentrasi 2 g/L akan memperpanjang waktu lag fase pada kultivasi mikroba.
Taherzadeh et al. (1999) melaporkan bahwa furfural dapat menyebabkan lambatnya laju pertumbuhan spesifik dan laju produksi etanol baik pada kondisi anaerob maupun aerob pada sistem kultivasi dan fermentasi menggunakan kultur S. cerevisiae CBS 8066 secara batch. Pada konsentrasi furfural 4 g/L dapat menurunkan laju pembentukan CO2 sekitar 35 %. Penurunan laju pembentukan CO2 ini terjadi secara cepat pada fase awal kultivasi dan fermentasi. Laju pertumbuhan spesifik mikroba menurun dari 0,4 sampai 0,03 ± 0,02 /jam, sedangkan laju produktivitas etanol menurun
produktivitas akan segera meningkat setelah furfural dikonversi menjadi furfural alkohol dengan laju konversi 0,6 ± 0,03 g (furfural)/ g (biomassa) jam.
Kondisi fermentasi menggunakan hidrolisat enzim menunjukkan pola penurunan konsentrasi total gula dan pH yang berbeda dengan fermentasi menggunakan hidrolisat asam. Pada fermentasi hidrolisat enzim, laju fermentasi yang ditandai dengan laju penurunan konsentrasi gula terjadi lebih cepat pada fase-fase awal sampai memasuki jam ke-24 dan umumnya setelah jam ke-24 laju penurunan konsentrasi gula relatif lambat. Hal ini diduga disebabkan oleh adanya akumulasi etanol, asam yang cukup tinggi dan semakin terbatasnya konsentrasi substrat. Etanol dapat menghambat proses fermentasi dengan mekanisme penghambatan produk, sedangkan asam dapat menurunkan pH substrat sehingga khamir tidak dapat tumbuh dengan optimal (You et al. 2003; Pampulha dan Dias 1989) . Clark dan Mackie (1984) melaporkan bahwa pada konsentrasi etanol 1-2 % (b/v) sudah cukup menghambat pertumbuhan dan pada konsentrasi etanol 10 % (b/v) laju pertumbuhan hampir berhenti.
Berdasarkan hasil produksi etanol dari masing-masing perlakuan, setelah dilakukan analisis ragam diperoleh bahwa perlakuan jenis proses fermentasi berpengaruh nyata terhadap konsentrasi etanol yang dihasilkan (p-value < 0,05) dan dari uji lanjut Duncan terlihat bahwa konsentrasi etanol tertinggi diperoleh dari perlakuan P4 yaitu 9,29 ± 1,76 % (b/v), namun konsentrasi etanol yang dihasilkan tidak berbeda nyata dengan konsentrasi etanol dari perlakuan P6(Lampiran 10).
0 20 40 60 80 100 P1 P2 P3 P4 P5 P6 P7 Perlakuan R e n d e m e n (% v /b ) E f. p e m a n fa a ta n s u b s tr a t (% ) K o n s e n tr a s i e ta n o l (% b /v )
Rendemen efisiensi substrat konsentrasi etanol
Gambar 16 Pengaruh jenis perlakuan fermentasi terhadap konsentrasi etanol, rendemen dan efisiensi substrat
Rendemen pembuatan etanol dari tepung ubi kayu tertinggi juga diperoleh dari perlakuan P4 yaitu sebesar 34,77 % (v/b). Hal ini berarti untuk menghasilkan 1 liter etanol dibutuhkan sekitar 2,88 Kg tepung ubi kayu (Lampiran 9). Nurdyastuti (2005) melaporkan bahwa konversi bahan baku pati ubi kayu menjadi bioetanol menghasilkan rendemen sekitar 16, 67 %. Hal ini diduga disebabkan oleh adanya penambahan enzim selulase pada perlakuan P4 dan P6 mampu melonggarkan dan menghidrolisis ikatan-ikatan selulosa, sehingga S. cerevisiae lebih mudah memanfaatkan glukosa hasil hidrolisis untuk menghasilkan etanol. Zhang dan Lynd (2004); Reezey et al. (1996) melaporkan bahwa selulase dapat menghidrolisis selulosa dengan adanya sinergisme 3 komponen enzim selulase yang terdiri dari endoglukonase, selobiohidrolase dan β-glukosidase.
Efisiensi pemanfaatan substrat pada proses P3 dan P5 yang menggunakan kultur campuran memberikan nilai yang relatif tinggi yaitu masing-masing 92,71 % dan 90,45 %, namun memberikan konsentrasi etanol yang lebih rendah dibandingkan dengan proses P4dan P6 yang hanya menggunakan kultur tunggal S. cerevisiae. Hal ini diduga disebabkan oleh semakin banyaknya mikroba yang dipergunakan, maka semakin besar jumlah kubutuhan glukosa sebagai sumber karbon yang diperlukan untuk pembentukan biomassa sel. Adanya efisiensi pemanfaatan substrat (ds/s) yang tinggi, sedangkan efisiensi fermentasi yang relatif kecil dapat juga disebabkan oleh konsentrasi total gula dalam substrat tidak sepenuhnya terkonversi menjadi etanol, melainkan dipergunakan untuk pertumbuhan sel mikroba, atau asam piruvat yang terbentuk pada proses glikolisis belum mampu sepenuhnya dirubah menjadi etanol oleh S. cerevisiae. Adanya penumpukan asam piruvat ini ditandai dengan adanya penurunan pH selama proses fermentasi.
Secara umum hasil-hasil fermentasi dari hidrolisat enzimatik menghasilkan konsentrasi etanol yang lebih tinggi dibandingkan dengan konsentrasi etanol dari hidrolisat asam. Hal ini diduga disebabkan oleh adanya senyawa-senyawa inhibitor sebagai hasil samping dari proses hidrolisis asam yang menggunakan suhu dan tekanan yang relatif tinggi yaitu sekitar 121 oC dan 15 Psi. Pada suhu dan tekanan yang tinggi komponen-komponen gula hasil hidrolisis akan terdegradasi lebih lanjut. Gula-gula dari golongan pentosa seperti xilosa dan arabinosa didegradasi menjadi furfural, sedangkan
2003). Hidroksimetil furfural akan dapat terus bereaksi untuk membentuk asam-asam organik seperti asam levulinat dan asam format yang dapat berpengaruh terhadap penurunan pH substrat. Furfural dan HMF dapat bersifat toksik bagi mikrooganisme fermentatif baik pada kapang, khamir maupun bakteri (Chandel et al. 2007; Horvarth et al. 2003). Furfural juga dilaporkan bersifat lebih toksik dari pada HMF dalam metabolisme S. cerevisiae. Konsentrasi furfural 1 g/L dapat menurunkan laju metabolisme CO2 dan menurunkan laju pertumbuhan sel pada fase awal pertumbuhan (Purwadi 2006; Taherzadeh et al. 2000; Modig 2002).
Dari Gambar 16 dapat diketahui bahwa penggunakan kultur campuran T. viride, A. niger dan S. cerevisiae terhadap hidrolisat enzimatik pada perlakuan P3 dan P5 menghasilkan konsentrasi etanol dan rendemen yang lebih tinggi dibandingkan dengan perlakuan kontrol (P7). Penggunaan proses SFS pada perlakuan P3 dapat meningkatkan hasil etanol 38,26 % terhadap kontrol (P7), sedangkan dengan menggunakan kultur campuran yang ditambahkan secara bertahap (P5) ada kecenderungan meningkatkan hasil fermentasi hingga 19,056 % terhadap kontrol. Hal sebaliknya terjadi pada penggunakan kultur campuran T. viride dan S. cerevisiae pada hidrolisat asam (P1dan P2) yang menunjukkan hasil produksi etanol yang relatif lebih kecil dari pada perlakuan kontrol, namun mempunyai rendemen yang lebih besar dari pada kontrol. Hal ini disebabkan oleh masih banyaknya sisa substrat yang tidak bisa dikonversi oleh mikroba menjadi etanol dan kemungkinan adanya senyawa-senyawa inhibitor sebagai hasil samping dari proses hidrolisis asam yang menyebabkan proses konversi menjadi lambat. Keadaan ini dapat dilihat dari penurunan total gula yang terjadi secara cepat pada masa-masa akhir proses fermentasi.
Penggunaan kultur campuran Fusarium oxisporum dan S. cerevisiae melalui proses SFS untuk memproduksi etanol dengan menggunakan substrat hidrolisat sorgum menghasilkan 33,2 g/L etanol dengan efisiensi fermentasi 68,60 % dari etanol teoritis (Christakopoulus et al . 1993). Produksi etanol selama 48 jam menggunakan kultur campuran khamir amilolitik S. diastaticus dan S. cerevisiae pada substrat pati mampu meningkatkan rendemen 48 % dibandingkan dengan menggunakan kultur tunggal S. diastaticus dengan efisiensi fermentasi 93 % dari etanol teoritis (Verma 2000).
sakarifikasi dan rendemen etanol yang dihasilkan akan lebih tinggi. Selain itu, efek penghambatan selobiosa dan glukosa pada enzim dapat diminimalkan dengan mengurangi konsentrasi gula pada media (Koesnandar 2001). Konsentrasi glukosa yang terlalu tinggi dapat menyebabkan depresi pada sistem metabolisme mitokondria dan sintesis enzim sel atau sering disebut dengan glucose effect (Petrik et al. 1982). Gaur (2006) menyatakan bahwa pertumbuhan biomassa S. cerevisiae mengalami peningkatan sampai konsentrasi glukosa 20 % (b/v) dan pada konsentrasi 25 % (b/v) biomassa sel mengalami penurunan sekitar 30 %. Menurut Ballesteros et al. (2004), proses SFS dapat lebih banyak menghasilkan rendemen etanol dibandingkan dengan proses hidrolisis dan fermentasi secara terpisah serta lebih sedikit membutuhkan enzim untuk hidrolisis. Resiko kemungkinan terjadinya kontaminasi dalam proses SFS lebih rendah dibandingkan dengan hidrolisis dan fermentasi terpisah karena adanya etanol yang langsung dihasilkan dari proses SFS (Ohgren et al. 2006).
Penggunaan enzim selulase baik filtrat kasar maupun komersial yang ditambahkan secara simultan pada tahap sakarifikasi ternyata dapat meningkatkan produksi etanol. Penggunaan filtrat enzim selulase kasar pada perlakuan P4 dapat meningkatkan konsentrasi etanol dari 5,36 ± 0,63 % (b/v) menjadi 9,29 ±1,76 % (b/v) atau meningkat 73,45 % terhadap kontrol, sedangkan dengan penambahan selulase komersial konsentrasi etanol meningkat dari 5,36 ± 0,63 % (b/v) menjadi 8,92 ±0,73% (b/v) atau meningkat 66,42 % terhadap kontrol.
Sree et al. (2000) menyebutkan bahwa pada proses produksi etanol pada suhu 30oC selama 48 jam menggunakan S. cerevisiae US3dengan konsentrasi glukosa yang berbeda-beda, diperoleh konsentrasi etanol tertinggi 9,30 % (b/v) dari substrat glukosa 20 %, sedangkan pada konsentrasi glukosa 15 % dan 25 % diperoleh konsentrasi etanol masing-masing sebesar 7,25 % (b/v) dan 8,3 % (b/v). Pada kondisi fermentasi yang sama, Gaur (2006) melaporkan bahwa kondisi terbaik untuk produksi etanol dari substrat molases dilakukan pada konsentrasi glukosa 20 % dengan konsentrasi etanol 9,15 % (b/v).
Berdasarkan analisis ragam pengaruh perlakuan proses fermentasi terhadap konsentrasi serat kasar sisa, diperoleh bahwa perlakuan jenis proses fermentasi berpengaruh nyata terhadap konsentrasi serat kasar sisa (p-value < 0,05). Dari uji lanjut
ditambahkan T. viride dan S. cerevisiae secara bertahap memberikan konsentrasi serat kasar terkecil yaitu 0,50 ± 0,03 % (b/v). Perlakuan ini berbeda nyata dengan semua perlakuan yang lainnya (Gambar 17, Lampiran 11).
Konsentrasi serat kasar sisa tertinggi dihasilkan dari perlakuan P7 yaitu 1,04 ± 0,04 % (b/v). Hal ini disebabkan oleh perlakuan P7 dalam proses hidrolisis dan fermentasinya hanya menggunakan enzim-enzim amilolitik tanpa penambahan enzim dan mikroba-mikroba selulolitik. Adanya penambahan enzim selulase kasar (P4) dan komersial (P6) memberikan pengaruh nyata terhadap penurunan kadar serat kasar sisa hidrolisis dan fermentasi. Ini diduga serat kasar telah dapat didegradasi oleh enzim selulolitik untuk meningkatkan konsentrasi glukosa sebagai substrat fermentasi (Gambar 17).
Penggunaan kultur campuran melalui proses SFS pada perlakuan P3 menghasilkan konsentrasi serat kasar sisa yang tidak berbeda nyata dengan kontrol pada proses P7. Hal ini diduga mikroba selulolitik belum mampu menghasilkan selulase secara maksimal karena kondisi fermentasinya berubah dari kondisi aerob menjadi anaerobik melalui proses agitasi setelah fermentasi selama 24 jam. Jenie (1990) melaporkan bahwa untuk sintesis selulase diperlukan kondisi. Aktivitas enzim selulase T. reesei QM9414 sangat dipengaruhi oleh intensitas agitasi. Aktivitas maksimum dari enzim-enzim FP-ase, CMC-ase dan beta glukosidase diperoleh dibawah kondisi yang berbeda, yaitu masing-masing pada kecepatan agitasi 200, 300 dan 400 rpm. Agitasi intensif menyebabkan terjadinya reduksi semua komponen selulase. Pada perlakuan P5, dimana penambahan kultur campuran dilakukan secara bertahap menunjukkan konsentrasi serat kasar sisa berbeda nyata dengan kontrol P7. Hal ini diduga pada proses sakarifikasi yang dilakukan selama 48 jam dan disertai proses agitasi, menyebabkan T. viride mampu menghasilkan selulase karena kondisi bersifat aerob. Pada proses fermentasi, ketika terjadi perubahan kondisi aerob menjadi anaerob setelah fermentasi 24 jam, enzim kasar selulase mampu menghidrolisis selulosa menjadi glukosa.
0.00 0.50 1.00 1.50 2.00 2.50 3.00 P1 P2 P3 P4 P5 P6 P7 Perlakuan K o n s e n tr a s i s e ra t k a s a r (% b /v ) T o t. g u la (1 0 x % b /v )
Serat kasar sisa Tot. gula sisa
Gambar 17 Pengaruh perlakuan jenis fermentasi terhadap konsentrasi serat kasar sisa dan total gula sisa
Pada Gambar 17 terlihat bahwa perlakuan hidrolisis asam (P1 dan P2) mempunyai konsentrasi serat kasar sisa relatif rendah yaitu masing-masing 0,50 ± 0,03 % (b/v) dan 0,77 ± 0,04 % (b/v), namun mempunyai konsentrasi total gula sisa tertinggi. Ini menunjukkan bahwa substrat fermentasi belum dimanfaatkan secara maksimal yang diduga disebabkan oleh adanya senyawa-senyawa inhibitor pada proses fermentasi sebagai hasil dari hidrolisis asam. Adanya hidrolisis asam memungkinkan terjadinya pemecahan secara acak terhadap fraksi-fraksi serat seperti hemiselulosa. Dalam konsentrasi yang tidak terlalu tinggi hemiselulosa lebih mudah terhidrolisis dari pada selulosa.
Untuk mengurangi terbentuknya senyawa-senyawa penghambat yang terbentuk pada hidrolisis asam karena adanya perbedaan karakteristik hidrolisis antara hemiselulosa dengan selulosa, maka dapat dilakukan hidrolisis asam secara bertahap yaitu : pertama, tahap yang melibatkan asam encer untuk menghidrolisis gula dari golongan pentosa yang terdapat pada fraksi hemiselulosa. Tahapan ini biasanya menggunakan 1 % H2SO4 pada suhu 80-120 oC selama 30-240 menit. Tahap kedua menggunakan asam dengan konsentrasi yang lebih tinggi untuk menghidrolisis gula yang berasal dari golongan heksosa seperti selulosa menjadi glukosa, biasanya dilakukan dengan konsentrasi H2SO45-20 % dengan suhu mendekati 180 oC. Dengan menggunakan hidolisis bertahap ini, maka diperoleh kondisi optimum untuk memaksimalkan hasil glukosa dan miminimumkan hasil samping yang tidak diinginkan
Taherzadeh dan Karimi (2007) juga melaporkan bahwa hidrolisis limbah lignoselulosik pada tahap awal dapat menggunakan H2SO40,1-1 % selama 5 menit pada suhu 180 oC atau 30-90 menit pada suhu 120 oC akan dapat menghidrolisis fraksi hemiselulosa dan hanya akan melonggarkan ikatan-ikatan selulosa. Pada tahap kedua hidrolisis fraksi selulosa dapat dilakukan pada suhu yang lebih tinggi yaitu 230 oC Hidrolisis bahan-bahan berlignoselulosik juga dapat dilakukan dengan menggunakan H2SO4 0,75 % pada suhu awal 50oC dan kemudian ditingkatkan sampai suhu 190 oC menyebabkan 80 % hemiselulosa terhidrolisis (Chandel et al. 2007).