BAB 2
TINJAUAN PUSTAKA
2. 1. Alumina dan aluminium
2.1.1 Aluminium
Aluminium adalah logam yang ringan dan cukup penting dalam kehidupan manusia. Aluminium merupakan unsur kimia golongan IIIA dalam sistim periodik unsur, dengan nomor atom 13 dan berat atom 26,98 gram per mol (sma). Di dalam udara bebas aluminium mudah teroksidasi membentuk lapisan tipis oksida (Al2O3) yang tahan terhadap korosi. Aluminium juga bersifat amfoter yang mampu bereaksi dengan larutan asam maupun basa. (Anton J. Hartono, 1992)
Aluminium merupakan logam ringan yang mempunyai ketahanan korosi yang baik dan hantaran listrik yang baik dan sifat – sifat yang baik lainnya sebagai sifat logam. (Surdia, T. 2005)
2.1.2 Sejarah Aluminium
Aluminium ditemukan kira-kira sekitar 160 tahun yang lalu dan mulai diproduksi skala industri sekitar 90 tahun yang lalu. Berikut sejarah perkembangan tentang penemuan aluminium :
I. Pada tahun 1782, seorang ilmuwan Prancis bernama Lavoiser telah menduga bahwa aluminium merupakan logam yang terkandung di dalam alumina,
II. Pada tahun 1807, ahli kimia Inggris bernama Humphrey Davy berhasil memisahkan alumina secara elektrokimia logam dan yang diperoleh dari pengujian tersebut adalah aluminium,
III. Pada tahun 1821, biji sumber aluminium ditemukan di Prancis Selatan, tepatnya di kota Lesbaux, yang dinamakan bauksit,
IV. Pada tahun 1825, ahli kimia Denmark, Orsted berhasil memisahkan aluminium murni dengan cara memanaskan aluminium chloride dengan kalium amalgam dan kemudian memisahkan merkuri dengan cara destilasi,
V. Pada tahun 1886, mahasiswa Oberlin College di Ohio, Amerika Serikat bernama Charles Martin – Hall menemukan dengan cara melarutkan alumina (Al2O3) dalam lelehan kliorit (Na3AlF6) pada temperatur 960 OC dalam bentuk kotak yang dilapisi logam karbon dan kemudian melewatkan arus listrik melalui ruang tersebut. Cara ini dikenal dengan proses Hall – Heroult, karena ini terjadi pada tahun yang sama dengan seorang Prancis yang bernama Paul Heroult,
VI. Pada tahun 1888, ahli kimia Jerman Karlf Josef Bayern menemukan cara memperoleh alumina dari bauksit secara pelarutan kimia. Sampai saat ini cara Bayer masih digunakan untuk memproduksi alumina dari bauksit secara industry dan disebut dengan proses Bayer. (Davis, Jr, 1993)
2.1.3. Bahan Baku Aluminium
1. Alumina
Alumina diperoleh dari bauksit melalui beberapa proses Bayer. Bauksit merupakan bahan baku Al yang terdiri dari Al2O3 (aluminium oksida) dan memiliki kemurnian yang berbeda seperti besi oksida, aluminium silica dan titanium oksida. Aluminium oksida (Al2O3) atau alumina biasanya beruba Kristal ion. Tetapi ion oksida (O-2) dipolarosasi oleh ion aluminium sehingga sebagian ikatannya bersifat kovalen. Aluminium oksida meleleh pada 2035oC. Zat ini tidak larut dalam air, stabil dan keras. Aluminium oksida adalah amfoter. Zat ini melarut dengan lambat dalam asam encer maupun basa encer.
Al2O3 (s) + 6 H+ (aq) 2 Al3+(aq) + 3 H2O(l)
Al2O3 (s) + 2 OH- (aq) + 3 H2O 2 Al(OH)4-
2. Anoda
Anoda adalah elektroda bermuatan listrik positif. Jenis anoda yang dipakai adalah jenis anoda prebaked, anoda yang digunakan di seksi reduksi dibuat di gedung karbon dengan bahan kokas dan hard pitch.
3. Katoda
Katoda adalah elektroda bermuatan listrik negatif. Ditinjau dari bahan bakunya dan prose pembuatannya, katoda dibagi atas 4 jenis, yaitu :
a. Blok katoda Amorphous, bahan bakunya antrasit, dipanggang pada suhu ± 1.200oC
b. Blok katoda semi graphitic, bahan bakunya grafit, dipanggang pada suhu ± 1.200oC
c. Blok katoda semi graphitic, bahan bakunya yang mengalami proses pemanasan sampai suhu ± 2.300oC
d. Blok katoda graphitic, bahan bakunya kokas mengalami proses grafitasi suhu ± 3.000o (Jody, B. J., dkk, 1992)
B. Bahan baku penunjang a. Kriolit
Kriolit dapat mengandung CaF2 dan AlF3 yang dapat membentuk kriolit Na3AlF6. Sifat-sifat kriolit adalah :
1) Konduktivitas listrik baik.
2) Memiliki berat jenis yang rendah. 3) Temperatur kristalisasi primer rendah. 4) Stabil dalam keadaan cair.
5) Dapat melarutkan alumina dalam jumlah besar.
Untuk memperbaiki sifat- sifat kriolit tersebut, bath biasanya ditambah dengan beberapa bahan tambahan seperti fluorida, alkil metal, AlF3 dan CaF2.
b. Soda Abu (Na2CO3)
Soda abu berfungsi memperkuat struktur katoda dan dinding samping agar sulit tererosi. Lapisan dinding samping dengan Na2CO3 dilakukan pada tahap transisi untuk membantu proses pembentukan kerak samping. Selain mencegah erosi oleh bath, soda abu berfungsi sebagai isolasi termal.
c. Aluminium Florida (AlF3)
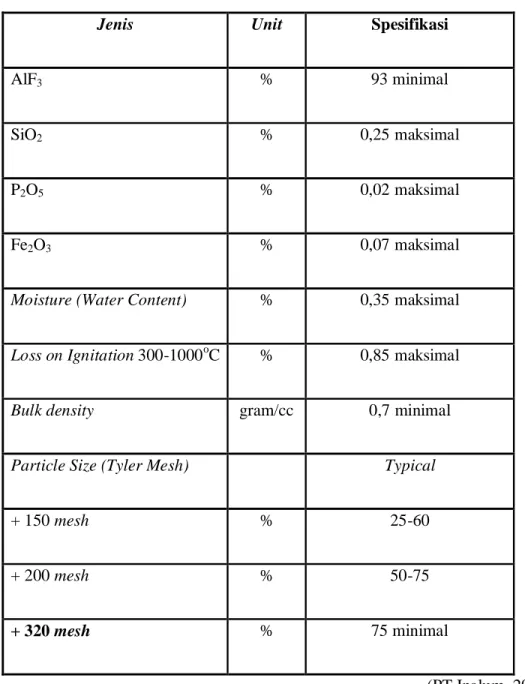
Aluminium florida berfungsi menjaga keasaman bath dan merupakan bahan yang dituangkan secara manual jika kelebihan AlF3 kurang didalam bath. Spesifikasi AlF3 yang digunakan oleh PT INALUM adalah:
Tabel 2.1. Spesifikasi AlF3
Jenis Unit Spesifikasi
AlF3 % 93 minimal
SiO2 % 0,25 maksimal
P2O5 % 0,02 maksimal
Fe2O3 % 0,07 maksimal
Moisture (Water Content) % 0,35 maksimal
Loss on Ignitation 300-1000oC % 0,85 maksimal
Bulk density gram/cc 0,7 minimal
Particle Size (Tyler Mesh) Typical
+ 150 mesh % 25-60
+ 200 mesh % 50-75
+ 320 mesh % 75 minimal
2.1.4. Kegunaan Aluminium
Dilihat dari segi kuantitas dan kualitas, kegunaan aluminium dapat mengatasi kegunaan logam lain kecuali besi. Karena itu aluminium sangat penting dalam kehidupan sehari – hari dan berpengaruh terhadap perkembangan ekonomi dunia, dikarenakan aluminium diprediksi akan menjadi komoditi ekspor dunia.
Aluminium murni mempunyai kekuatan tegangan yang rendah, tetapi mempunyai kemampuan untuk membentuk alloy bersama dengan banyak unsur seperti tembaga, seng, magnesium, mangan dan silikon. Pada saat ini hampir semua bahan yang dianggap aluminium adalah sebenarnya sejenis alloy aluminium bukan aluminium murni.
Apabila digabung secara proses termomekanikal, alloy aluminium menunjukkan peningkatan kekuatan dari segi sifat mekanikal. Alloy aluminium membentuk komponen penting dalam pesawat udara dan roket, ini dikarenakan kekuatan yang meningkat.
Sebagian dari kegunaan – kegunaan aluminium yaitu :
1) Pengankutan (kendaraan, kapal terbang, kendaraan landasan, kapal laut, dsb)
2) Pembungkus (tin aluminium, keranjang aluminium, dsb)
3) Perawatan air
4) Pembinaan (tingkap, pintu, dwai binaan, dsb)
6) Talian penghantaran elektrik (berat pengalir aluminium adalah setengah dari berat tembaga dengan kekonduksian yang sama dan lebih murah)
7) Jendela
8) Aluminium murni
9) Serbuk aluminium, yang mempunyai bentuk perak yang biasa digunakan dalam cat. Serpihan aluminium juga dimasukkan dalam cat alas, terutama kayu cat.
2.1.5 Proses Elektrolisis Aluminium
Aluminium terutama masih sekedar menjadi bahan penelitian di laboratorium sampai tahun 1886, ketika Charles Hall di Amerika Serikat (lulusan Oberlin College yang berusia 21 tahun) dan Paul Heroult (berkebangsaan Perancis, berusia sama) secara sendiri-sendiri menemukan proses yang efisien untuk memproduksikannya. Pada tahun 1990-an produksi aluminium di seluruh dunia yang menggunakan proses Hall-Heroult mencapai 1,5 × 107 ton metrik.
Proses Hall-Heroult melibatkan pengendapan aluminium secara katodik, dari lelehan kriolit (Na3AlF6) yang mengandung Al2O3 terlarut, dalam sel elektrolisis. Setiap sel terdiri dari kotak baja persegi panjang yang panjangnya sekitar 6 m, lebar 2 m, dan tinggi 1 m, yang berfungsi sebagai katode, dan grafit pejal sebagai anode yang mencuat melewati atap sel hingga ke bak lelehan kriolit. Arus yangh sangat besar (50.000 sampai 100.000 A) dilewatkan dalam sel, dan sebanyak 100 sel seperti ini disusun secara seri.
Lelehan kriolit, yang berdisosiasi sempurna menjadi ion-ion Na+ dan AlF63-, merupakan pelarut yang baik untuk aluminium oksida, menghasilkan distribusi
kesetimbangan dari ion-ion seperti Al3+, AlF2+, . . . , AlF63-, dan O2- dalam elektrolit. Kriolit meleleh pada suhu 1000°C, tetapi titik lelehnya turun dengan adanya aluminium oksida terlarut, sehingga suhu sel operasi hanya 950°C. Dibandingkan dengan titik leleh Al2O3 murni (2050°C), suhu tersebut merupakan suhu yang rendah, dan inilah sebabnya proses Hall-Heroult bias berhasil. Lelehan aluminium memiliki kerapatan yang sedikit lebih besar daripada lelehennya pada suhu 950°C sehingga materi ini mengumpul di dasar sel, untuk selanjutnya disadap secara berkala. Oksigen merupakan produk anode yang utama, tetapi zat ini bereaksi dengan electrode grafit menghasilkan karbon dioksida. (David W. Oxtoby, 2003)
Untuk memperoleh aluminium murni mencakup empat tahap :
1. Penyiapan bauksit (pelumatan, pencucian, pengeringan, penggerusan)
2. Penjernihan bauksit menjadi tanah tawas murni (oksid aluminium Al2O3) melalui cara Bayer
3. Penyerapan zat asam (reduksi) tanah tawas hingga menjadi aluminium mentah melalui elektrolisa lebur dengan kliorit sebagai bahan pelarut (Na3AlF6)
4. Peleburan alih wujud menjadi aluminium murni (99,5 – 99,8 %).
2.2 Alumina
Adapun pembagian dari alumina berdasarkan ukuran partikelnya adalah :
I. Alumina sandy ( - Al2O3)
Alumina sandy banyak ditemukan di Amerika, yang berbentuk serbuk yang diproduksi pada pembakaran yang lebih rendah dari alumina floury. Alumina sandy yang terbentuk digunakan pada tungku peleburan karena sifat dari alumina tersebut yang bergerak bebas dan tidak dipengaruhi oleh gaya dari luar.
II. Alumina floury (α – Al2O3)
Alumina floury banyak ditemukan di Eropa, dimana alumina jenis ini diperoleh melalui proses Bayer, selanjutnya diproses lagi untuk memperoleh aluminium cair. Proses yang digunakan adalah Hall – Heroult, prinsip yang dipakai melalui reduksi alumina. Reduksi dilakukan secara elektrolisa terhadap alumina yang dilarutkan dalam larutan elektrolit cair dan dialirkan arus listrik. Dengan mengalirkan arus listrik tersebut pada kedua elektroda (anoda dan katoda) maka akan terjadi proses elektrolisa, sehingga terbentuk endapan aluminium cair pada katoda. (Grjotheim, 1998)
Tabel 2.2. Spesifikasi Alumina yang digunakan di PT INALUM
Item Satuan Spesifikasi
Loss on Ignition (300-10000C) % 1,00 maksimal
SiO2 % 0,03 maksimal Fe2O3 % 0,03 maksimal TiO2 % 0,005 maksimal Na2O % 0,600 maksimal CaO % 0,060 maksimal Al2O3 % 98,40 minimal
Spesific Surface Area M2/g 40-80
Particle Size
+ 100 mesh % 12,0 maksimal
+ 150 mesh % 25 minimal
- 325 mesh % 12,0 maksimal
Angle of Refuse Deg 30-34
Al didapat dalam keadaan cair dengan elektrolisa, umumnya mencapai kemurnian 99,85% berat. Dengan mengelektrolisa kembali dapat dicapai kemurnian 99,99%, yaitu dicapai bahan dengan angka sembilannya empat.
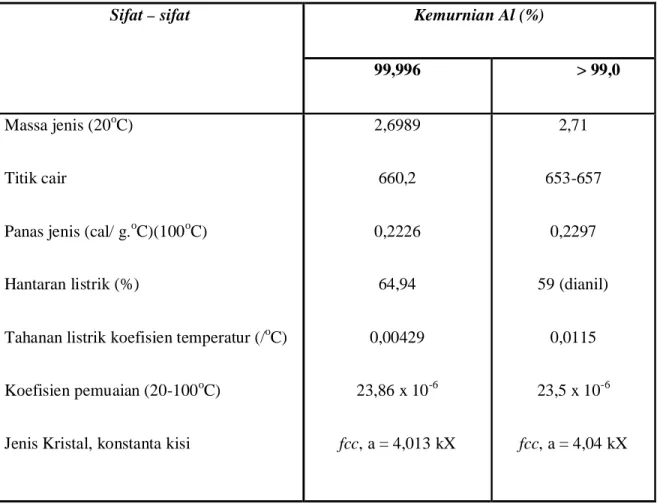
Tabel 2.3. Sifat-sifat fisik aluminium
Sifat – sifat Kemurnian Al (%)
99,996 > 99,0
Massa jenis (20oC)
Titik cair
Panas jenis (cal/ g.oC)(100oC)
Hantaran listrik (%)
Tahanan listrik koefisien temperatur (/oC)
Koefisien pemuaian (20-100oC)
Jenis Kristal, konstanta kisi
2,6989 660,2 0,2226 64,94 0,00429 23,86 x 10-6 fcc, a = 4,013 kX 2,71 653-657 0,2297 59 (dianil) 0,0115 23,5 x 10-6 fcc, a = 4,04 kX
Catatan : fcc : face centered cubic = kubus bersifat muka
Tabel di atas menunjukkan sifat-sifat fisik Al. Ketahanan korosi berubah sesuai dengan kemurnian Al, yang pada umumnya untuk kemurnian 99,0% atau di atasnya dapat dipergunakan di udara tahan dalam waktu bertahun-tahun.
2. 3. Besi
Besi merupakan logam industri terpenting sudah dikenal sejak zaman purba. Besi merupakan unsur terbanyak keempat dalam litosfer bumi (setelah oksigen, silicon, aluminium). Kegunaan besi terpenting ialah pembuatan baja (alloy). Besi yang murni adalah logam berwarna putih-perak, yang kukuh dan liat. Besi melebur pada temperatur 1535oC. Zat-zat pencemar ini memegang peranan penting dalam kekuatan struktur besi.
Sifat besi yang mudah mengalami korosi pada berbagai keadaan, sifat elektrokimia besi menjadi bahan kajian sejak lama. Terlihat bahwa oksidasi lebih mudah terjadi oelh adanya gugus yang mengendapkan produknya. Ion ferri mudah tereduksi ke ferro, tetapi dalam keadaan alkali justru ferro berubah menjadi ferri. Agar Fe(OH)3 tidak mengendap, suasananya harus asam.
Reaksi besi dan oksidasi rumit karena didorong dengan adanya kelembaban. Produk karatnya non – stoikiometri dan sifatnya dapat protektif maupun tidak. Besi dapat larut dalam asam mineral encer. Bila asam non – oksidator (tidak ada udara) terbentuk ferro sedangkan bila ada udara atau asam nitrat dan kromat memasifkan besi.
Ion ferro dan ferri dalam larutan mudah saling diubah dengan reaksi redoks ferro hidroksida yang baru diendapkan berwarna putih dengan adanya udara menjadi hijau atau hitam, kemudian membentuk ferri hidroksida merah coklat. Amoniak hanya mengendapkan besi sebagian karena terbentuk kompleks amina.
tetapi besi tidak bernilai dekoratif, tetap terkena korosi, ia hanya dipakai secara terbatas termasuk electroforming pada cetakan karet, gelas, plastik, pada alloy nikelnya dan sebagainya.
2.4. Silika
Silika terdapat luas di alam, seperti pasir, kuarsa, batu api. Kristal silika tidak berwarna atau merupakan bubuk putih, bau dan tidak berasa, silica tidak larut dalam air dan asam, kecuali hidrogen florida. Dan larut di dalam larutan alkali, dimana akhirnya dipisahkan yang halus dan yang tidak terbentuk. Senyawa SiO2 adalah yang paling melimpah dari senyawaan dalam kerak bumi.
Asal mula silika adalah dapat dibuat dari larutan silika (air kaca), dengan asam, kemudian dicuci dan dengan pembakaran. Bunga api silica dibuat dari pasir, menguap pada temperatur 3.000oC dengan menggunakan pancaran energy listrik. Bubuk silica digunakan untuk pembuatan gelas, keramik, alat pengelasan, saringan air, mikroskop, kertas, komponen dari beton pengisi kosmetik insektisida.
Silikon dan oksigen merupakan penyusun sebagian besar kerak bumi, dengan oksigen meliputi 47% dan silikon 28% dari massanya. Ikatan silikon oksigen kuat dan bersifat ionic parsial. Ikatan ini membentuk dasar untuk golongan mineral yang disebut silikat, yang merupakan golongan terbesar dari batuan, lempung, pasir dan tanah pada kerak bumi. Silikat menyediakan berbagai macam bahan bangunan seperti batu bata, semen, beton dan kaca. (David W. Oxtoby, 2003)
2.5. Pengaruh Pengotor Besi dan Silika dalam Produk Aluminium
Aluminium batangan (ingot) yang diproduksi sangat ditentukan oleh unsur – unsur kimia yang terkadung di dalam aluminium itu sendiri. Aluminium yang dihasilkan
masih banyak mengandung zat-zat pengotor dalam jumlah yang kecil, seperti besi (Fe), silikon (Si), dan pengotor lainnya. Ini dipengaruhi atas bahan baku yang digunakan untuk menghasilkan aluminium. Disamping adanya pengaruh bahan baku, pengotor besi dan silikon juga berasal dari prosesnya sendiri, dimana besi dan silikon dalam aluminium yang dihasilkan dalam sel elektrolisa (pot), dapat bertambah apabila kondisi di dalam pot kurang baik, sehingga ada pengikisan atau ikut larutnya dinding pot pada saat proses elektrolisa berlangsung.
Jika kadar besi dalam aluminium cair yang akan dicetak masih terlalu tinggi, maka aluminium yang dihasilkan akan lebih mudah terkorosi dan mudah berubah menjadi warna kuning. Sebaliknya, jika kadar silicon di dalam aluminium terlalu tinggi, maka akan menyebabkan aluminium batangan (ingot) yang dihasilkan akan menjadi keras, rapuh dan susah ditempah. Itulah beberapa pengaruh ketika kadar besi dan silikon di dalam aluminium berlebih atau tidak sesuai dengan standar yang ada.
2.6. Faktor – Faktor yang Mempengaruhi Kualitas Aluminium Batangan (Ingot) dan Cara Penanggulangannya
Faktor yang mempengaruhi kualitas ingot antara lain adalah :
1. Kadar Fe dan Si
Kadar Fe dan Si dapat berpengaruh terhadap kualitas produk, karena merupakan faktor utama penentu mutu grade yang dihasilkan. Kemurnian dari aluminium ingot yang dihasilkan dilihat dari kadar besi (Fe) dan silikon (Si). Maka kadar zat pengotor yang terkandung dalam aluminium cair harus dijaga
2. Flux Treatment
Pemberian flux pada aluminium cair di furnace (dapur) harus sesuai dengan jumlah molten aluminium sehingga pemisahan oksida – oksida yang terkandung dalam molten tersebut dapat terpisah secara sempurna, agar aluminium ingot yang dihasilkan lebih murni
2.7. Standar Pengendalian Grade Produk
Pengendalian grade produk dilakukan agar ada kesesuaian antara kadar Fe dan Si terhadap produk, sehingga produk yang dihasilkan bisa mencapai target yang telah ditetapkan di PT INALUM. Standar pengendalian grade produk berpatokan pada Quality Standard of Aluminium Ingot (QSAI). QSAI merupakan variabel – variabel yang ditetapkan agar produk yang dihasilkan tidak menyimpang dari jadwal operasi pencetakan.
Tabel 2.4. Standar Kualitas Aluminium Batangan (Ingot)
Grade/ Tingkat Komposisi Kimia (%)
PT Inalum Class Al Fe Si
S 1 – A - 99,92 min 0,04 maks 0,04 maks
S 1 – B - 99,90 min 0,06 maks 0,04 maks
S 1 Special class 1 99,90 min 0,07 maks 0,05 maks
S 2 Special class 2 99,85 min 0,12 maks 0,08 maks
G 1 Class 1 99,70 min 0,20 maks 0,15 maks
G 2 Class 2 99,50 min 0,40 maks 0,25 maks
G 3 Class 3 99,00 min 0,80 maks 0,50 maks
Catatan : min = minimal : maks = maksimal
Aluminium (ingot) yang dihasilkan PT INALUM sekarang ini adalah grade S1 – B dan G1, yaitu dengan kemurnian aluminium, S1 – B 99,90 % dan G1 99,70 %.
Apabila masih tetap tidak sesuai dengan standarisasi di PT INALUM, maka dapat dilakukan dengan beberapa cara :
pengambilan sampel dan dibawa ke Smelter Quality Assurance (SQA) untuk dianalisa kembali. Apabila hasil dari Test Product Metal (TPM) menyatakan kadar Fe dan Si di dalam molten masih tinggi dari standar yang diinginkan, maka dilakukan pengurangan atau penambahan molten.
b. Pengurangan dan penambahan aluminium cair (molten)
Pengurangan molten yang berkadar Fe dan Si yang tinggi kemudian ditambahkan molten yang memiliki kadar Fe dan Si yang rendah. Sehingga akan dicapai keseimbangan di antara keduanya. Apabila pengurangan dan penambahan molten tidak dapat menurunkan kadar Fe dan Si sesuai dengan yang diinginkan, maka dapat dilakukan cara berikutnya, yaitu pencetakan sebagian molten.
c. Pencetakan sebagian molten
Dicetak sebagian molten yang berkadar Fe dan Si tinggi sebanyak 1/3 bagian dari banyaknya molten yang tersedia di dapur. Jika 1/3 bagian yang telah dicetak, maka molten yang tersisa di dalam dapur ditambahkan molten yang berkadar Fe dan Si yang rendah. Apabila masih tidak dapat memenuhi standar yang ada, maka dilakukan perubahan grade. Misalnya dari grade S1 – B menjadi grade G1.
Dalam pengambilan sampel produk dapat dilakukan dalam 3 tahap, yaitu :
- Sampel yang pertama diambil pada awal pencetakan , yaitu setelah mencetak 30 ton.
- Sampel yang kedua diambil pada pertengahan pencetakan, yaitu setelah mencetak 15 ton.