PEM ELEKTROLISER
I. TUJUAN PERCOBAAN1. Menentukan tegangan dekomposisi air
2. Menentukan laju produksi hidrogen pada berbagai jenis elektrolizer 3. Menentukan efesiensi energi dan efesiensi faraday
4. Mengamati berbagai pengaruh lingkungan terhadap efisiensi elektrolizer
II. INTISARI PERCOBAAN
Oksigen adalah unsur ketiga terbanyak yang ditemukan berlimpah di matahari, dan memainkan peranan dalam siklus karbon-nitrogen, yakni proses yang diduga menjadi sumber energi di matahari dan bintang-bintang. Sedangkan hidrogen adalah elemen paling sederhana dari senyawa kimia. Sebuah atom hidrogen terdiri dari hanya satu proton dan satu elektron. Hidrogen juga merupakan elemen yang paling banyak terdapat di alam.
Pada percobaan ini kita akan menggunakan sebuah elektroliser untuk memisahkan hydrogen dan oksigen dari air. Komponen utama sebuah elektroliser, adalah elektrolit dan elekroda. Yang membedakan satu jenis elektroliser dengan yang lainnya adalah elektrolitnya. Pada praktikum ini bahan elektrolit yang kita gunakan adalah Elektroliser PEM (polymer Elektrolite Membrane) adalah jenis elektrolit yang menggunakan polimer sebagai elektrolitenya yang dipadu dengan elektroda-elektrodanya dengan cara yang ringkas.
III. TEORI DASAR
Oksigen adalah unsur ketiga terbanyak yang ditemukan berlimpah di matahari, dan memainkan peranan dalam siklus karbon-nitrogen, yakni proses yang diduga menjadi sumber energi di matahari dan bintang-bintang.. Oksigen merupakan unsur gas, menyusun 21% volume atmosfer dan diperoleh dengan pencairan dan penyulingan bertingkat. Sekitar dua pertiga tubuh manusia dan sembilan persepuluh air adalah oksigen. Oksigen tidak berbau, tidak berasa dan tidak berwarna. Dalam bentuk cair dan padat, oksigen berwarna biru pucat dan merupakan paramagnetik yang kuat.
Hidrogen adalah unsur yang terbanyak dari semua unsur di alam semesta. Elemen-elemen yang berat pada awalnya dibentuk dari atom-atom hidrogen atau dari elemen-elemen yang mulanya terbuat dari atom-atom hidrogen. Hidrogen diperkirakan membentuk komposisi lebih dari 90% atom-atom di alam semesta (sama dengan tiga perempat massa alam semesta). Unsur ini ditemukan di bintang-bintang dan memainkan peranan yang penting dalam memberikan sumber energi jagat raya melalui reaksi proton-proton dan siklus karbon-nitrogen. Proses fusi atom-atom hidrogen menjadi helium di matahari menghasilkan jumlah energi yang sangat besar. Hidrogen merupakan unsur kimia yang melimpah diudara,sehingga kita dapat mengunakannya sebagai bahan bakar alternative. Untuk memisahkan biasanya digunakan panas, sebuah proses yang dikenal sebagai reforming. Cara lain yang digunakan adalah dengan mengalirkan arus listrik ke dalam air. Cara tersebut dinamakan elektrolisa. Bahkan di alam sendiri, dalam kondisi tertentu algae dan bakteri telah memproduksi hidrogen dengan memanfaatkan energi surya.
Adapun metode yang kita gunakan adalah elektrolisis dimana pada metode ini hydrogen dan oksigen diperoleh dengan memisahkannya dari molekul air. Dalam sel, reaksi oksidasi reduksi berlangsung dengan spontan, dan energi kimia yang menyertai reaksi kimia diubah menjadi energi listrik. Bila potensial diberikan pada sel dalam arah kebalikan dengan arah potensial sel, reaksi sel yang berkaitan dengan negatif potensial sel akan diinduksi. Dengan kata lain, reaksi yang tidak berlangsung spontan kini diinduksi dengan energi listrik. Proses ini disebut elektrolisis. Pada sebuah elektroliser sederhana, larutan elektrolit diletakan didalam sebuah bejana kedalam bejana dicelupkan dua buah elektroda yang masing-masing dihubungkan dengan kutub positif(anoda) dan kutub negative(katoda),sebuah baterai. Bila diberikan suatu
potensial listrik,ion-ion didalam elektrolit akan bermigrasi kearah elektroda yang polarisasinya berlawanan dengan muatan tersebut.Apabila digunakan air sebagai elektrolit ,meskipun jumlahnya sangat kecil ,air akan terdisosiasi menjadi ion hydrogen dan ion hidroksil.
Ion hidroksil akan menuju anoda dan membentuk oksigen(oksidasi)
dan ion hidrogen menuju katoda kemudian membentuk gas hidrogen (reduksi).
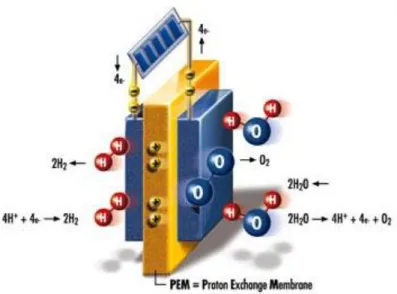
Komponen utama sebuah elektrolizer adalah elektrolit dan elektroda. Elektrilozer PEM (Polimer Electrolite Membrane) adalah jenis elektrolizer yang menggunakan membrane polymer sebagai elektrolitenya dipadu dengan elektroda-elektrodanya dengan dua cara yang ringkas. Apabila tegangan DC lebih besar daripada tekanan dekomposisi air diberikan pada elektroda-elektroda, PEM elektrolizer akan memisahkan air murni menjadi hidrogen dan oksigen. Tegangan dekomposisi air menurut perhitungan teoritis adalah 1,23V, tegangan ini akan menjadi lebih besar apabila terjadi resistansi yang disebabkan oleh berbagai factor ,seperti proses elektrokimia biasa, PEM elektrolizer bekerja berdasarkan proses reduksi-oksidasi yang terjadi pada elektroda, ketika tegangan DC diberikan pada elektroda air akan teroksidasi dianoda membentuk oksigen, proton dan electron bebas. Hidrogen terkumpul secara langsung dianoda,sedangkan proton bermigrasi melalui membrane lektrolite polimer dari anoda ke katoda untuk kemudian tereduksi menjadi hydrogen dengan mengikat electron yang disuplai rangkaian eksternal.
Gambar PEM Elektroliser
Reaksi anoda : Reaksi katoda : Reaksi total :
Terlihat bahwa satu atom hidrogen memberikan kontribusi satu electron terhadap arus yang mengalir,sehingga hubungan antara arus yang mengalir dengan volume hidrogen yang dihasilkan dapat ditentukan dengan menghitung energi listrik yang digunakan dengan jumlah hidrogen yang dihasilkan. Hubungan ini telah dirumuskan dengan hukum faraday I.
Dimana:
V : volume gas yang dihasilkan secara teoritis( R : konstanta gas umum = 8,314 j/ol.K
F : konstanta faraday=96485 C/mol T : temperature (
I : arus(A) T : waktu(sekon)
Z : jumlah electron untuk membebaskan 1 molekul
Efisiensi faraday pada sebuah eketrolizer adalah rasio volume gas hydrogen yang dihasilkan terhadap olume terhadap gas yang seharusnya dihasilkan menurut perhitungan teoritis yang dinyatakan dengan HK.I faraday.
Pengecasan baterai timbal adalah contoh elektrolisis.
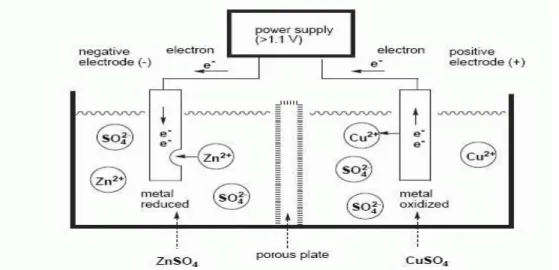
Reaksi total sel Daniell adalah
Zn + Cu2+(aq) –> Zn2+(aq) + Cu (10.36)
Andaikan potensial lebih tinggi dari 1,1 V diberikan pada sel dengan arah kebalikan dari potensial yang dihasilkan sel, reaksi sebaliknya akan berlangsung. Jadi, zink akan mengendap dan tembaga akan mulai larut.
Zn2+(aq) + Cu –> Zn + Cu2+(aq) (10.37)
Gambar. dibawah menunjukkan representasi skematik reaksi kimia yang terjadi bila potensial balik diberikan pada sel Daniell. Bandingkan dengan Gambar 10.2.
Gambar Electrolisis. Reaksi kebalikan dengan yang terjadi pada sel Daniell akan berlangsung. Zink mengendap sementara tembaga akan melarut.
Hukum elektrolisis Faraday :
1. Jumlah zat yang dihasilkan di elektroda sebanding dengan jumlah arus listrik yang melalui sel. 2. Bila sejumlah tertentu arus listrik melalui sel, jumlah mol zat yang berubah di elektroda adalah konstan tidak bergantung jenis zat. Misalnya, kuantitas listrik yang diperlukan untuk mengendapkan 1 mol logam monovalen adalah 96485 C(Coulomb) tidak bergantung pada jenis logamnya.
C (Coulomb) adalah satuan muatan listrik, dan 1 C adalah muatan yang dihasilkan bila arus 1 A (Ampere) mengalir selama 1 s. Tetapan fundamental listrik adalah konstanta Faraday F, 9,65 x104 C, yang didefinisikan sebgai kuantitas listrik yang dibawa oleh 1 mol elektron. Dimungkinkan untuk menghitung kuantitas mol perubahan kimia yang disebabkan oleh aliran arus listrik yang tetap mengalir untuk rentang waktu tertentu.
PEM elektroliser akan memisahkan air murni menjadi oksigen dan hydrogen, jika tegangan DC yang lebih besar dari tegangan dekomposisi air diberikan pada elektrodanya. Tegangan dekomposisi air menurut perhitungan teoritis adalah 1,23 V. Tegangan ini akan menjadi lebih besar apabila terjadi resistansi transisi yang disebabkan oleh berbagai faktor, PEM elektroliser bekerja berdasarkan proses reduksi oksidasi yang terjadi pada elektroda. Sehingga dapat terlihat bahwa satu atom hidrogen memberikan kontribusi satu elektron terhadap arus yang mengalir sehingga hubungan antara arus yang mengalir dengan volume hidrogen yang dihasilkan dapat ditentukan dengan menghitung energi listrik yang digunakan dan jumlah hidrogen yang dihasilkan.
V. KERANGKA PEMIKIRAN
4.1 Latar Belakang
Air mengandung hydrogen dan juga oksigen, melalui percobaan ini kita akan mencoba untuk memisahkan unsur-unsur tersebut. Setiap air mempunyai persentase banyaknya hydrogen dan juga oksigen yang berbeda, tergantung dari jenis air tersebut. Pada air yang digunakan pada percobaan ini diperkirakan persentase kandungan oksigennya lebih banyak dari air biasa karena telah melewati tujuh level filtrasi. Kita akan menggunakan sebuah PEM elektroliser untuk memisahkan unsur-unsur tersebut dari air.
4.2 Identifikasi Masalah
Pada percobaan ini kita akan menentukan tegangan dekomposisi air, menentukan laju produksi hydrogen pada berbagai jenis elektrolizer, menentukan efesiensi energi dan efesiensi faraday, dan mengamati berbagai pengaruh lingkungan terhadap efisiensi elektrolizer. Semua tujuan tersebut akan dapat kita peroleh dengan menggunakkan data yang didapat dari percobaan ini.
VI. METODE EKSPERIMEN
5.1 Metoda Percobaan
Pada percobaan ini kita akan menggunakan sebuah elektroliser untuk memisahkan hydrogen dan oksigen dari air. Dengan cara Menaikan tegangan dari 0 sampai maksimum 2V dengan interval 0,1 V, lalu mencatat setiap nilai tegangan catat nilai arus yang terukur dan amati tangki hydrogen, apakah tegangan tersebut sudah mulai dihasilkan hydrogen.
5.2 Alat-alat Percobaan 1. PEM elektrolizer 2. Sumber daya variable 3. Dua buah multimeter 4. Tangki air
5. Tangki hydrogen 6. Stopwatch
7. Kabel-kabel penghubung
VII. PROSEDUR PERCOBAAN
7.1 Menentukan tegangan dekomposisi air
2. Megisi tangki air dengan air berkadar oksigen tinggi
3. Mengisi tangki tangki hydrogen dengan air berkadar oksigen tinggi
4. Menaikan tegangan dari 0 sampai maksimum 2V dengan interval 0,1 V, Untuk setiap nilai tegangan catat nilai arus yang terukur dan amati tangki hydrogen ,apakah tegangan tersebut sudah mulai dihasilkan hydrogen, berikan tanda pada tegangan berapa hydrogen mulai terlihat
5. Beri tenggang waktu sekitar 20 detik untuk setiap pengukuran 7.2 Menentukan efisiensi energy dan efisiensi faraday elektrolizer PEM
1. Menyusun rangkaian seperti gambar diatas
2. Mengisi tangki hydrogen dengan air sampai penuh, sebelumnya buang semua kotoran yang tersisa
3. Memberikan tegangan elektroda sedikit diatas tegangan dekomposisi air(missal 1,6 V). Putuskan untuk sementara,siapkan stopwatch
DAFTAR PUSTAKA
Krane, Kenneth S. 1992. Fisika Modern. Jakarta : UI-Presshttp://www.chem-is-try.org/materi_kimia/kimia_dasar/oksidasi_dan_reduksi1/elektrolisis/ http://www.chem-is-try.org/tabel_periodik/oksigen/