i
KEMAMPUAN PERKEMBANGAN EMBRIO SAPI BALI HASIL KRIOPRESERVASI DENGAN PENGGUNAAN
KRIOPROTEKTAN ETILEN GLIKOL
ASRI PUSFITA
I111 13 060
FAKULTAS PETERNAKAN
UNIVERSITAS HASANUDDIN
MAKASSAR
2017
SKRIPSI
ii
KEMAMPUAN PERKEMBANGAN EMBRIO SAPI BALI HASIL KRIOPRESERVASI DENGAN PENGGUNAAN
KRIOPROTEKTAN ETILEN GLIKOL
ASRI PUSFITA
I111 13 060
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana
pada Fakultas Peternakan Universitas Hasanuddin
FAKULTAS PETERNAKAN
UNIVERSITAS HASANUDDIN
MAKASSAR
2017
SKRIPSI
iii
PERNYATAAN KEASLIAN
1. Yang bertanda tangan dibawah ini:
Nama : Asri Pusfita
NIM : I111 13 060
Menyatakan dengan sebenarnya bahwa: a. Karya skripsi yang saya tulis adalah asli
b. Apabila sebagian atau seluruhnya dari karya skripsi, terutama dalam Bab Hasil dan Pembahasan tidak asli atau plagiasi maka bersedia dibatalkan dikarenakan sanksi akademik yang berlaku
2. Demikian pernyataan keaslian ini dibuat untuk dapat dipergunakan sepenuhnya. Makassar. Agustus 2017
TTD
iv
HALAMAN PENGESAHAN
Judul Penelitian : Kemampuan Perkembangan Embrio Sapi Bali Hasil Kriopreservasi dengan Penggunaan Krioprotektan Etilen Glikol
Nama : Asri Pusfita
No. Pokok : I11113 060
Program Studi : Peternakan
Fakultas : Peternakan
Skripsi ini telah diperiksa dan disetujui oleh :
Pembimbing Utama
Prof. Dr. Ir. Herry Sonjaya DEA. DES NIP. 19570129 198003 1 001
Dekan Fakultas Peternakan
Prof. Dr. Ir. H. Sudirman Baco, M.Sc NIP. 19641231 198903 1 025
Pembimbing Anggota
Prof. Dr. Ir. Ambo Ako, M.Sc NIP. 196412311989031026
Ketua Program Studi Peternakan
Prof. Dr. drh. Hj. Ratmawati Malaka, M.Sc. NIP. 19640712198911 2 002
v
ABSTRAK
ASRI PUSFITA (I111 13 060). Kemampuan Perkembangan Embrio Sapi Bali Hasil Kriopreservasi dengan Penggunaan Krioprotektan Etilen Glikol. Dibawah bimbingan HERRY SONJAYA sebagai pembimbing utama dan AMBO AKO
sebagai pembimbing anggota.
Selama proses pembekuan embrio terjadi cekaman dingin yang dapat menyebabkan terjadinya kerusakan sel embryo dan dampaknya menyebabkan embrio mati. Oleh karena itu penelitian ini bertujuan untuk mengetahui pengaruh penggunaan krioprotektan Etilen Glikol selama pembekuan terhadap tingkat pemulihan setelah kriopreservasi dan perkembangan embrio sapi Bali setelah kultur kembali. Prosedur penelitian dimulai dari pengambilan ovarium di RPH, dilanjutkan dengan koleksi dan seleksi oosit. Oosit kemudian dimaturasi selama 24 jam, difertilisasi 5-6 jam, dan dikultur 48 jam. Setelah menjadi embrio dilakukan kriopreservasi dengan Etilen Glikol selama 48 jam. Embrio beku kemudian dithawing dan dikultur kembali selama 24 jam untuk melihat viabilitas. Penelitian ini menggunakan Rancangan Acak lengkap (RAL) dengan 4 perlakuan yaitu penambahan krioprotektan Etilen Glikol 0%, 10%, 20%, dan 30% dengan 4 kali ulangan. Hasil penelitian menunjukkan bahwa perlakuan Etilen Glikol berpengaruh sangat nyata terhadap tingkat pemulihan dan perkembangan embrio setelah kultur kembali. Tingkat pemulihan embrio setelah kriopreservasi dan jumlah embrio hidup setelah kultur kembali (viabilitas) sangat nyata lebih rendah pada kontrol dibanding yang diberi perlakuan Etilen Glikol. Namun ketiga perlakuan menghasilkan hasil yang sama. Dapat disimpulkan bahwa Etilen Glikol dapat mencegah kerusakan embrio setelah kriopreservasi.
Kata Kunci: Embrio Sapi Bali, Etilen Gikol, Recovery, viabilitas .
vi ABSTRACT
ASRI PUSFITA (I111 13 060) The ability of Embryo Development of Bali cows Cryopreserved using Ethylene Glycol as Cryprotectant. Guided by HERRY SONJAYA as the primary supervisor and AMBO AKO as supervisor members.
During the process of freezing the embryo occurs cold stress that can cause damage to embryo cells and its impact causes the embryo to die. There fore, this study aimed to determine the effect of ethylene glycol cryoprotectant during the freezing on recovery rate after cryopreservation and the embryo development of Bali Cow’s after re-culture. Procedure of this study started from, collection of ovarian from slaughtered house, continued with the collected and selected of the oocytes. Those oocytes were maturated for 24 hours, fertilized 5-6 hours, and cultured 48 hours. The embryos were cryopreserved using ethylene glycol for 48 hours. Freezed embryos were thawed and re-cultured for 24 hours to determine their viability. This study was designed using Completely Randomized Design (CRD) with four treatments addition of Ethylene Glycol of 0%, 10%, 20%, and 30% with four replication. The results of this study slowed that treatment of Ethylene Glycol had significant effect on recovery and development of embryos after cultured. Recovery rate of the embryos after cryopreservation and the number of embryos life (viability) after re-cultured had significantly lower in control group in comparison to those embryos treated with Ethylene Glycol, however the last three treated groups resulted in similar viabilities. It can be concluded that Ethylene Glycol could prevent embryo damage after cryopreservation.
vii
KATA PENGANTAR
Bismillahirahmanirahim…..
Assalamualaikum warahmatullahi wabarakatuh
Puji syukur kita panjatkan kehadirat Allah SWT, karena rahmat dan hidayah-Nya sehingga Tugas Akhir/Skripsi ini dapat diselesaikan dengan tepat waktu. Skripsi dengan judul “Kemampuan Perkembangan Embrio Sapi Bali Hasil Kriopreservasi dengan Penggunaan Krioprotektan Etilen Glikol” Sebagai Salah Satu Syarat untuk memperoleh Gelar Sarjana pada Fakultas Peternakan Universitas Hasanuddin, Makassar.
Ucapan terima kasih dan penghargaan setinggi-tingginya penulis hanturkan dengan rasa hormat kepada:
1. Prof. Dr. Ir. H. Herry Sonjaya DEA. DES selaku Pembimbing Utama, dan Prof. Dr. Ir. Ambo Ako, M.Sc selaku Pembimbing Anggota, atas segala bantuan dan keikhlasannya untuk memberikan bimbingan, nasehat dan saran-saran sejak awal penelitian sampai selesainya skripsi ini.
2. Secara khusus penulis mengucapkan terima kasih yang sebesar-besarnya dengan segenap cinta dan hormat kepada ayahanda Misrianto dan ibunda Sukini atas segala doa, motivasi dan kasih sayang serta materi yang diberikan kepada penulis dan saudara-saudara saya Suhariadi, ST, Tri Hengki SulakSono, Indra Sarwanto, dan Dirga Budi Setiawan yang senantiasa membantu, memberi candatawa dan memberikan motivasi untuk selalu lebih semangat.
viii Bugiwati, M.Sc., dan Dr. Muh. Ihsan A. Dagong, S.Pt, M.Si selaku dosen pembahas yang telah memberikan saran-saran dan masukan untuk perbaikan skripsi ini.
4. Dr. Aslina Asnawi, S.Pt. M.Si selaku Penasehat Akademik yang telah memberikan bantuan dan motivasi kepada penulis.
5. Prof. Dr. Ir. H. Sudirman Baco, M.Sc selaku Dekan Fakultas Peternakan dan seluruh Staf Pengawai Fakultas Peternakan, terima kasih atas segala bantuan kepada penulis selama menjadi mahasiswa.
6. Prof. Dr. drh. Hj. Ratmawati Malaka, M.Sc selaku Ketua Program Studi Peternakan, terima kasih atas segala bantuan kepada penulis
7. Dr. Hasbi, S.Pt. M.Si selaku pembimbing Laboratorium penulis melaksanakan penelitian.
8. Semua dosen-dosen Fakultas Peternakan Universitas Hasanuddin yang telah memberikan ilmunya kepada penulis.
9. Sahabat-sahabat “PETERNAKAN B” hayu Fitryani, Hilma Utami Putri, Andi Musdalifa Bakri, Hamdana Darsan, Arda Runita, Syahidah, Nursanti, Saharia, Nurhikmawati, Nita Kurnia Puti, Asri Puspita, Andi Irma Eka Lestari, Khasrima Mulya Utari, Sari Putri, Abeng Daisuri, Ummy Kalsum, Nurhasnah, Tri Wahyuni, Indah Sari Nur Utami, Nabila Chaerunnisa, Ahmad syakir, Dwi Suprapto, Abd. Rahman, Insan Putra Pratama, Wahyu, Gede Suamba, Aprianto Mandala Putra, Fulki Alen, Muhammad Nurhidayat, Misbahuddin, Muh. Kasim, Ardianto, Sofyan Basri, Jamal Heri, Haidil Kunang, Amir Mirzad terima kasih yang setinggi-tingginya serta penghargaan yang sebesar-besarnya atas segala cinta, pengorbanan,
ix bantuan, pengertian, candatawa serta kebersamaan selama ini, waktu yang dilalui sungguh merupakan pengalaman hidup yang berharga dan tak mungkin untuk terlupakan dan terima kasih telah memberiku sedikit tempat dihatimu untuk menjadikanku sahabat dan teriring dengan doa semoga rekan dan sahabatku sukses selalu.
10. Yaumul Firman, SP., Besse Gusna, S,Pt., Ulvianti Diansari, SH., Siti Rahmini, Nursanti, Siti Nur Arni, dan Nurhasanah, terima kasih atas motivasi dan segala kebaikan serta bantuan yang kalian berikan kepada penulis.
11. Kepada sahabat ”TEAM PKL” Andi Nurul Airin Arif, Arda Runita, dan Sari Putri, terima kasih atas kerja samanya, segala kebaikan serta bantuan yang kalian barikan kepada penulis selama penelitian.
12. Kepada sahabat “ TEAM PENELITIAN” Dewi Sartika, Hilma Utami Putri, Hikmayani Iskandar, Andi Nurul airin Arif, Nawawi, dan M. Nasrullah, terima kasih atas segala kebaikan serta bantuan yang kalian berikan kepada penulis selama penelitian.
13. Sahabat-Sahabat “HIMAJATI-MAKASSAR’’ terima kasih atas motivasi dan candatawa selama penulis menjadi anggota HIMAJATI.
14. Teman-teman HIMAPROTEK UH, terima kasih atas ilmu, pembelajaran, nasehat-nasehat kebersamaan, kebaikan, amanah yang kalian berikan selama penulis berorganisasi.
15. Terima kasih sebesar-besarnya kepada Mama Caya, Dg, Sai, Aming dan ibu Salma atas bantuannya kepada penulis.
x kasih atas motivasi dan segala kebaikan serta bantuan yang kalian berikan kepada penulis.
17. Teman-teman “ KKN Desa Pattalasang” Nadia Anggraeni f, Ratih Sagita W, A. Purwanti, Nurul Hidayah, Nurul Muhlisah, NurWalyana Sawal, Fatun Munir, Saldi, Ismail, Rista, Elma Nabila, dan Nurul Riska dan teman-teman sekecamatan Pattalasang Kabupaten Gowa.
28. Jajaran Pemerintahan Desa Pattalasang Kecamatan Pattalasang Kabupaten Gowa, terima kasih telah memberi banyak bantuan penulis pada saat KKN. 21. Semua Pihak yang tidak dapat penulis sebut satu persatu, terima kasih
banyak atas segala bantuannya.
Penulis menyadari bahwa penyusunan skripsi ini masih terdapat kekurangan dan kesalahan. Penulis mengharapkan kritikan dan saran yang bersifat membangun demi kesempurnaan skripsi ini.
Makassar, Agustus 2017
xi
DAFTAR ISI
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
PERNYATAAN KEASLIAN ... iii
HALAMAN PENGESAHAN ... iv
ABSTRAK ... v
ABSTRACT ... vi
KATA PENGANTAR ... vii
DAFTAR ISI ... xii
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
PENDAHULUAN ... 1 TINJAUAN PUSTAKA Folikulogenesis ... 3 Oogenesis ... 4 Spermatogenesis ... 6 Fertilisasi in Vitro ... 8
Produksi Embrio in Vitro ... 9
Kriopreservasi ... 11
Krioprotektan Etilen Glikol ... 13
METODE PENELITIAN Waktu dan Tempat ... 16
Materi Penelitian ... 16
Rancangan Penelitian ... 16
Prosedur Penelitian ... 17
Parameter yang Diamati ... 20
Analisa Data ... 21 Halaman
xii
HASIL DAN PEMBAHASAN
Proses Maturasi Oosit Sampai Fertilisasi ... 22 Perkembangan Embrio Hasil Kriopreservasi dan Viabilitas Embrio... 25
KESIMPULAN DAN SARAN
Kesimpulan ... 28 Saran ... 28
DAFTAR PUSTAKA ... 29
xiii
DAFTAR TABEL
No. Teks
1. Total dan Persentase Oosit Sebelum dan sesudah maturasi, dan Total Produksi
Embrio pada kelompok Perlakuan ... 24 2. Embrio yang Pulih setelah Kriopreservasi dengan Etilen Glikol dan Embrio
Hidup setelah Kultur kembali ... 25 Halaman
xiv
DAFTAR GAMBAR
No. Teks Halaman
1. Proses Oogenesis ... 5
2. Proses Spermatogenesis ... 7
3. Diagram Alir Prosedur Penelitian ... 17
4. Proses Perubahan Oosit ... 22
xv
DAFTAR LAMPIRAN
No. Teks
1. Komposisi Media Maturaso Oosit Secara In Vitro. ... 33
2. Komposisi Media Fertilisasi Secara In Vitro. ... 33
3. Komposisi Media Kultur Secara In Vitro. ... 33
4. Data Jumlah Embrio Terhadap Kriopreservasi dengan Krioprotektan EG Secara In Vitro ... 35
5. Data Jumlah Embrio Terhadap Kriopreservasi dengan Krioprotektan EG Secara In Vitro Hasil Transformasi Arcsin ... 36
6. Analisis Ragam Recoverry Embrio In Vitro. ... 37
7. Analisis Ragam viabilitas Embrio In Vitro ... 38
8. Dokumentasi ... 39
1
PENDAHULUAN
Teknologi kriopreservasi gamet banyak dikembangkan pada berbagai spesies hewan dan manusia. Teknik kriopreservasi gamet merupakan suatu cara untuk menyimpan gamet dalam bentuk beku yang bertujuan untuk menyimpan, pemeliharaan, menjamin dan mempertahankan kelangsungan hidup sel gamet (Djuwita, 2001). Penggunaan teknik kriopreservasi gamet dapat juga digunakan juga untuk penyimpanan embrio hasil fertilisasi in vitro serta kelebihan embrio hasil produksi in vivo. Teknologi ini juga memungkinkan penyimpanan embrio dalam jangka waktu yang relatif lama sehingga bisa dimanfaatkan dalam waktu kapan saja dan dimana saja.
Beberapa faktor yang mempengaruhi daya hidup embrio beku diantaranya teknik pembekuan, jenis pengencer, dan konsentrasi krioprotektan yang digunakan. Embrio beku yang berkualitas tinggi, membutuhkan medium yang mampu mempertahankan kualitas embrio selama proses pendinginan, pembekuan, maupun saat thawing. Penggunaan bahan pengencer umumnya diikuti dengan penambahan zat krioprotektan untuk melindungi embrio dari efek yang mematikan yaitu terjadinya proses kristalisasi cairan baik intraseluler maupun extraseluler selama proses pembekuan.
Krioprotektan dapat melindungi sel pada saat kriopreservasi embrio. Proses kristalisasi pada masa pembekuan tergantung dari jenis dan konsentrasi krioprotektan yang dipakai. Dari beberapa penelitian tentang kriopreservasi embrio, diketahui ada bermacam-macam krioprotektan yang dapat dipergunakan untuk kriopreservasi
2 embrio, namun demikian telah diketahui bahwa etilen glikol (EG) merupakan krioprotektan yang mudah didapatkan ditoko kimia dan harga untuk EG juga relative murah. Menurut Gordon (1994), EG mempunyai efek toksik yang lebih rendah dibandingkan krioprotektan yang lain. Kemampuan hidup post thawing dari embrio yang dibekukan dapat menggunakan krioprotektan EG. Oleh karena itu, perlu mengevaluasi akhir kriopreservasi dari EG pada embrio sapi Bali in vitro. Penelitian ini dilakukan untuk mengetahui pengaruh penambahan Etilen Glikol sebagai krioprotektan selama proses pembekuan dalam mempertahankan viabilitas embrio sapi Bali.
Selama proses pembekuan embrio terjadi cekaman dingin yang dapat menyebabkan terjadinya kristalisasi cairan intraseluler maupun extraseluler dan dampaknya menyebabkan embrio mengkerut atau mati. Untuk mencegah proses kristalisasi pada saat kriopreservasi diperlukan krioprotektan seperti EG sehingga embrio bisa hidup kembali pada saat pencairan kembali. Informasi tentang konsentrasi penambahan EG untuk pembekuan embrio sapi Bali sangat terbatas. Oleh karena itu perlu penelitian pengaruh EG dalam mempertahankan daya hidup embrio sapi Bali selama pembekuan.
Tujuan dari penelitian ini adalah untuk mengetahui pengaruh penggunaan krioprotektan Etilen Glikol selama pembekuan terhadap tingkat pemulihan setelah kriopreservasi dan perkembangan embrio sapi Bali setelah kultur kembali.
Kegunaan penelitian adalah sebagai salah satu sumber informasi sebagai data awal bagi peneliti selanjutnya untuk pembekuan embrio sapi Bali.
3
TINJAUAN PUSTAKA
Folikulogenesis
Folikulogenesis adalah proses pematangan folikel pada korteks ovarium yang tersusun dari sel somatik padat dan mengandung oosit imatur. Proses ini menggambarkan perubahan dari folikel primordial kecil menjadi folikel preovulasi besar. Peran utama pematangan folikel adalah untuk mendukung oogenesis yang pada akhirnya menghasilkan oosit (Speroff et al., 2010). Sejak lahir, pada ovarium terdapat sejumlah folikel primordial imatur yang mengandung oosit primer yang juga imatur. Folikel primordial mengalami perubahan karakter histologis dan fisiologis dimana akan terbentuk baik folikel tersier maupun folikel antral. Proses ini bergantung pada berbagai jenis hormon yang menyebabkan kecepatan folikulogenesis dan oogenesis yang berakhir adanya ovulasi atau sebaliknya atresia folikel.
Berdasarkan perubahan morfologisnya, folikel diklasifikasikan dalam 3 kelompok yaitu folikel primer, folikel sekunder dan folikel tersier atau
Degraaf. Folikel primer terdiri dari oosit yang dikelilingi oleh selapis sel epitel sedangkan sel teka belum terbentuk, sebagian besar folikel primer tersebut akan mengalami regresi atau tetap tidak berkembang sama sekali. Lapisan sel-sel yang mengelilingi folikel primer disebut stratum granulosum atau lapisan granulosa. Telur berada pada satu sisi folikel dalam gundukan sel-sel granulosa yang disebut kumulus oophorus dan lapisan sel granulose yang langsung menyelubungi sel telur disebut korona radiata (Partodiharjo, 1980). Tingkat kedua adalah folikel sekunder yang mengandung oosit dalam volume maksimal dan letaknya eksentrik atau agak ke pinggir seperti pada folikel primer. Sel-sel granulose terdiri dari 6-12 lapis sel.Pada
4 folikel sekunder ovum sudah dilengkapi zona pelusida yang bergerak menuju korteks (Yatim, 1994). Stadium terakhir adalah perkembangan folikel tersier, yang juga disebut folikel de graaf. Sel-sel folikel yang melengkapi oogonia akan membentuk antrum atau membentuk ruangan yang berisi cairan. Ruangan ini dikelilingi oleh sel-sel yang disebut membran granulosa.
Pengelompokan folikel berdasarkan ukuran diameternya terbagi menjadi tiga kelompok yaitu dilakukan oleh tiga kelompok folikel tersebut adalah folikel ukuran kecil (2-3 mm), folikel ukuran sedang (3,1 – 5 mm), folikel ukuran besar (>5 mm) (Crozet et al., 1995).
Oogenesis
Oogenesis adalah proses pembentukan sel telur (ovum) di dalam ovarium. Oogenesis dimulai dengan pembentukan bakal sel-sel telur yang disebut oogonia. Pertumbuhan oosit antara lain berupa peningkatan diameter oosit, pertambahan ukuran dari organel-organel, dan disertai dengan perubahan atau perkembangan pada inti dan sitoplasma (Telfer dan Sharpley, 2008).
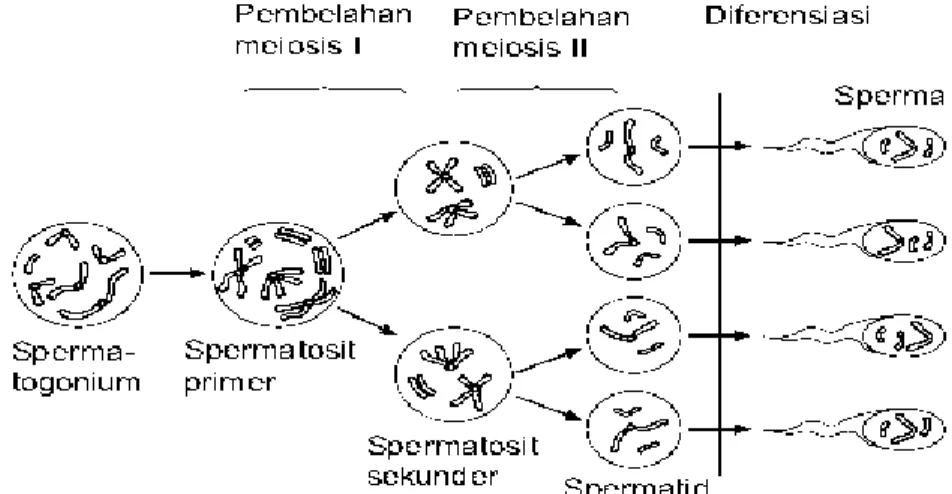
Proses oogenesis Gambar 1 terdiri dari beberapa tahap yaitu oogonium mengalami pembelahan mitosis berubah menjadi oosit primer. Oosit primer melakukan meiosis (tahap I), yang menghasilkan dua sel anak yang ukurannya tidak sama. Sel anak yang lebih besar adalah oosit sekunder yang bersifat haploid (n). Ukurannya lebih besar dari yang lain karena berisi lebih banyak sitoplasma dari oosit primer yang lain. Sel anak yang lebih kecil disebut badan kutub (polar body) pertama yang kemudian membelah lagi (Sonjaya et al., 2016).
5 Gambar 1. Proses Oogenesis (Telfer dan Sharpley, 2008).
Setelah folikel matang maka folikel akan pecah dan oosit sekunder ditangkap fimbrie lalu menuju ke tuba fallopi. Apabila oosit sekunder dibuahi oleh sel sperma (fertilisasi), maka akan mengalami pembelahan meiosis yang kedua, begitu pula dengan badan polar pertama membelah menjadi dua badan polar kedua yang akhirnya mengalami degenerasi. Selama pembelahan meiosis kedua, oosit sekunder menjadi bersifat haploid (n) dengan 30 kromosom dan selanjutnya disebut dengan oosit (Campbell et al., 2000).
Perkembangan oosit terdiri dari tiga tahap yaitu proliferasi, pertumbuhan, dan pematangan. Pada tahap proliferasi terjadi proses mitosis oogonium menjadi beberapa oogonia yang terjadi pada saat pralahir atau sesaat setelah lahir kemudian oogonia berdiferensiasi menjadi oosit primer. Inti oosit pada tahap ini disebut Germinal Vesicle (GV) yang ditandai dengan adanya membran inti yang utuh dan nucleus yang
6 jelas. Selanjutnya oosit akan memasuki tahap pertumbuhan dan pematangan yang berlangsung bersamaan dengan proses perkembangan folikel (Campbell et al., 2000).
Pada sapi proses maturasi inti secara in vivo membutuhkan waktu selama ± 24 jam (Gordon, 1994). Pematangan ini meliputi berbagai perubahan kronologi tahapan meiosis (Gordon, 2003). Proses pematangan inti berhubungan dengan aktivitas sintesis RNA, ditandai dengan perubahan inti dari fase diploten ke metaphase II. Membran inti akan mengadakan penyatuan dengan vesicle membentuk Germinal Vesicle (GV) dan kemudian akan mengalami pelepasan membran inti membentuk
Germinal Vesicle Break Down (GVBD). Setelah GVBD terjadi, kromosom dibungkus oleh mikrotubulus dan mikrofilamen yang sangat mempengaruhi keberhasilan pembelahan meiosis. Oosit yang telah mengalami GVBD selanjutnya akan mencapai tahap metaphase I (MI). Pada oosit sapi, metaphase I terjadi setelah 12-14 jam inkubasi dan diikuti oleh tahap anaphase (AI) dan telophase (TI) yang berlangsung relatife singkat (14-18 jam) setelah masa inkubasi (Chohan, and Hunter, 2003). Tahap metaphase II (MII) akan terjadi dan ditandai dengan terbentuknya badan kutub I dan oosit yang sudah matang siap untuk difertilisasi (Pawshe, et al., 1994).
Spermatogenesis
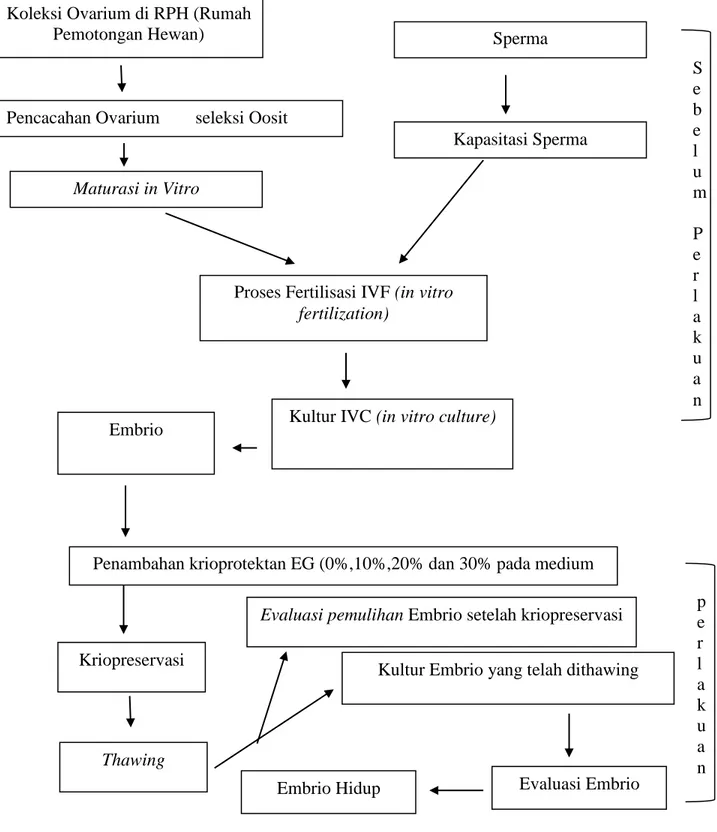
Spermatogenesis adalah proses pertumbuhan dan perubahan dari spermatogonia sampai spermatozoa yang meliputi tiga fase. Fase pertama meliputi spermatositogenesis, yaitu spermatogonium membelah secara mitosis menghasilkan generasi sel baru yang nantinya akan menghasilkan spermatosit primer. Fase kedua meliputi meiosis I, yaitu spermatosit primer mengalami dua kali pembelahan secara
7 berurutan dengan mereduksi sampai setengah jumlah kromosom dan jumlah DNA per sel, menghasilkan spermatosit sekunder, spermatosit sekunder mengalami meiosis II menghasilkan spermatid. Fase ketiga meliputi spermiogenesis, yaitu spermatid mengalami proses sitodiferensiasi, menghasilkan spermatozoa (Junqueira et al., 2007).
Hasil akhir spermatogenesis gambar 2 adalah spermatozoa dewasa. Strukturnya menyerupai kecebong kecil dengan panjang 0,06 mm. Spermatozoa terdiri atas empat bagian yaitu kepala, leher, tubuh dan ekor. Salah satu bagian yang penting daristruktur spermatozoa adalah akrosom. Akrosom adalah bagian dari kepala spermatozoa yang berasal dari nukleus yang mengalami kondensasi dan elongasi. Akrosom mengandung enzim hidrolitik seperti hyalurinidase, neuraminidase danprotease. Enzim-enzim ini berfungsi untuk menembus corona radiata dan zona pellucida di sekeliling sel telur. Proses pengeluaran enzim ini disebut reaksi akrosom,yang juga menandai langkah pertama terjadinya fertilisasi. Pada bagian leher banyak mitokondria yang tersusun spiral (Junqueira et al., 2007).
8 Mitokondria beragregasi pada bagian proximal flagellum, sehingga bagian ini tampak menebal. Pengumpulan mitokondria pada leher spermatozoa sangat penting dalam pergerakan sel dan konsumsi energi yang tinggi. Ekor atau disebut juga dengan flagellum spermatozoa terdiri dari beberapa mikrotubuli yang dilingkupi oleh membran sel yang memanjang. Ekor sperma yang memanjang dapat dibagi menjadi tiga bagian (tengah, utama dan ujung), menyebabkan gerak maju spermatozoa dengan gelombang dua kali yang dimulai didaerah implantasi ekor kepala dan berjalan kearah distal (Shier et al., 2003).
Fertilisasi In Vitro
Fertilisasi in vitro (FIV) adalah pembuahan sel telur oleh spermatozoa di luar uterus yang direkayasa oleh manusia (Sukra, 2000). Teknik ini terdiri dari beberapa langkah yaitu koleksi oosit, maturasi oosit, koleksi spermatozoa, kapasitasi spermatozoa, fertilisasi dan pembiakan embrio secara in vitro (Susilowati et al., 1998; Fibrianto et al., 2000).
Dalam usaha pengembangbiakan ternak, masalah infertilitas merupakan faktor penghambat yang perlu diatasi dengan beberapa cara diantaranya dengan inseminasi buatan, FIV dan transfer embrio. Terapi yang akan dilakukan harus berdasarkan pertimbangan ekonomis, sehingga teknik terapi ini dapat dipakai untuk meningkatkan kapasitasi reproduksi bibit ternak unggul dan mengatasi pemborosan sel-sel gamet yang melimpah. Selain itu teknik FIV dan transfer embrio pada hewan dapat dipakai sebagai uji biologis (Supriatna dan Pasaribu, 1992).
FIV sangat bermanfaat dalam mempelajari proses fertilisasi dan membantu pengembangan metode praktis untuk pencangkokan embrio dari induk unggul ke
9 induk yang kurang unggul. Fungsi induk yang kurang baik dapat sebagai tempat perkembangan anak yang berpotensi tinggi. Perkembangan pengetahuan semacam ini sangat membantu penelitian di bidang genetika dan fisiologi (Salisbury dan VanDenmark, 1985). Keberhasilan fertilisasi in vitro akan menghasilkan embrio dengan kualitas tinggi dan dalam jumlah yang besar. Hal tersebut menurut Saito, et al. (1994), tergantung pada pemilihan kondisi kultur yang optimal pada maturasi oosit sampai sel telur mengalami meiosis pada metafase II.
Teknologi FIV sangat menguntungkan, antara lain dalam peningkatan mutu genetik, pembekuan embrio sehingga dapat diperdagangkan dari suatu negara ke negara lain, dan pengembangan teknologi perekayasaan, seperti penentuan jenis kelamin embrio (embryo sexing), penyayatan embrio menjadi dua atau lebih (embryo splitting) (Sukra, 2000).
Salah satu penerapan dari teknik fertilisasi in vitro pada mencit adalah untuk mendapatkan jumlah yang banyak dari tingkat pembelahan awal embrio yang berkembang secara lebih bersamaan. Kegunaan lain adalah untuk menghasilkan keturunan dari mencit tanpa melalui perkawinan dan dapat menghasilkan keturunan yang banyak pada saat bersamaan (Hogan et al., 1986).
Produksi Embrio In Vitro
Produksi embrio in vitro adalah proses produksi untuk menghasilkan atau pengembangbiakan sel telur dan spermatozoa menjadi zigot dan berkembang menjadi embrio diluar tubuh ternak (Ball dan Peters, 2007).
Masuknya sperma ke dalam sel telur menyebabkan terjadinya rangkaian perubahan yang cepat yaitu penyelesaian pembelahan meiosis, penyatuan pronukleus
10 jantan dan betina serta gerakan kompleks dari zat-zat dalam sitoplasma telur, laju konsumsi oksigen dan sintesis protein dalam telur spesies tertentu meningkat. Segera setelah fertilisasi, di dalam embrio mulai ada sel-sel yang memisahkan diri dan terjadi pembelahan sel yang berturut-turut (Villee et al., 1988, Salisbury dan Vandemark, 1985). Dalam tingkat ini embrio mengalami pembelahan menjadi sel-sel yang ukurannya berangsur-angsur mengecil sampai ukurun tertentu. Tiap sel yang terbentuk disebut blastomer (Sagi, 1999).
Pembelahan sel embrio terjadi secara mitosis, sehingga setiap sel embrio mengandung kromosom diploid (2n) yang setengahnya berasal dari spermatozoa dan setengahnya lagi berasal dari ovum. Pembelahan dimulai dari inti dan diteruskan ke sitoplasma. Ovum yang telah dibuahi mengalami pembelahan pertama membentuk embrio 2 sel. Embrio 2 sel segera membelah lagi menjadi embrio 4 sel. Pembelahan terus berlanjut hingga embrio menjadi 8 sel, 16 sel, 32 sel (Toelihere, 1979; Salisbury dan Vandemark, 1985).
Pada tingkatan embrio 16 sampai 32 sel, sel-sel berkumpul menjadi satu kelompok di dalam zona pelusida. Isi sel di dalam zona pelusida berbentuk seperti bola yang padat. Embrio tersebut dikenal sebagai morula. Cairan mulai menumpuk di dalam ruang-ruang interseluler dan terbentuk suatu rongga bagian dalam yang disebut blastocoele. Rongga tersebut semakin lama semakin besar dan berisi cairan. Embrio tahap ini disebut blastosis ( Toelihere, 1979).
Embriogenesis adalah proses pembentukan dan perkembangan embrio. Proses ini merupakan tahapan perkembangan sel setelah mengalami pembuahan atau fertilisasi. Embriogenesis meliputi pembelahan sel dan pengaturan di tingkat sel. Sel
11 pada embriogenesis disebut sebagai sel embriogenik (Alberio et al., 2001). Perkembangan embrio terjadi mulai dari proses fertilisasi antara oosit dengan spermatozoa. Oosit yang diperoleh dari hasil ovulasi secara alami atau melalui maturasi secara in vitro adalah dalam kondisi matang (siap untuk dibuahi) (Jones, 2007).
Menurut Meo et al. (2005), tahapan pertumbuhan dan perkembangan embrio dibedakan menjadi 2 tahap yaitu :
1. Fase Fertilisasi adalah pertemuan antara sel sperma dengan sel ovum dan akan menghasilkan zigot.
2. Fase Embrionik yaitu fase pertumbuhan dan perkembangan makhluk hidup selama masa embrio yang diawali dengan peristiwa fertilisasi sampai dengan terbentuknya janin di dalam tubuh induk betina.
Secara umum, sel embriogenik tumbuh dan berkembang melalui beberapa fase, antara lain (Alberio et al., 2001) :
1. Sel tunggal (yang telah dibuahi) 2. Blastomer 3. Blastula 4. Gastrula 5. Neurula 6. Embrio / Janin Kriopreservasi
Teknik kriopreservasi merupakan suatu teknik penyimpanan sel hewan, tumbuhan ataupun materi genetika lain (termasuk semen) dalam keadaan beku melalui reduksi aktivitas metabolisme tanpa mempengaruhi organel-organel di dalam
12 sel sehingga fungsi fisiologis, biologis, dan morfologis tetap ada (Watson, 2000). Teknik kriopreservasi merupakan teknik penyimpanan yang dilakukan pada suhu yang sangat rendah (-196 0C) dalam nitrogen cair (Boediono, 2003). Teknik kriopreservasi pada berbagai sel, jaringan, dan organ telah banyak dilakukan, demikian juga dengan kriopreservasi embrio (Rimayanti, 2005).
Kerusakan sel yang terjadi pada saat kriopreservasi embrio adalah terbentuknya kristal es baik ekstraseluler maupun intraseluler. Hal ini disebabkan oleh elektrolit yang menumpuk akan merusak dinding sel sehingga pada waktu pencairan kembali permeabilitas membran plasma akan menurun dan sel akan mati. Pembentukan kristal es kemungkinan berkaitan dengan perubahan tekanan osmotik dalam fraksi yang tidak mengalami pembekuan (Watson, 2000).
Proses kriopreservasi oosit pada mamalia sampai saat ini dilakukan dengan dua cara yang berbeda yaitu pembekuan lambat (slow rate freezing) dan vitrifikasi (rapid freezing). Slow rate freezing merupakan cara penyimpanan oosit dalam keadaan beku pada temperatur rendah dengan meminimalkan pembentukan kristal es intraselular, sedangkan vitrifikasi tanpa adanya pembentukan kristal es sebagai penyebab utama kerusakan intraselular (Lieberman et al., 2002).
Menurut Toelihere (1979), setiap teknik kriopreservasi mempunyai kelebihan dan kekurangan. Kelebihan dari kriopreservasi secara umum adalah:
1) Bahan atau materi dapat disimpan dalam waktu tidak terbatas. 2) Dapat dikoleksi setiap saat.
3) Dapat digunakan kapan saja bila dibutuhkan.
13 5) Tidak perlu mengimpor atau memelihara pejantan-pejantan unggul.
6) Tidak membutuhkan ruangan yang besar karena tabung nitrogen cair cukup memadai untuk menyimpan bahan dalam ragam dan jumlah yang banyak. 7) Tidak menyebabkan perubahan material genetik yang disimpan.
Sementara itu, kekurangannya adalah: 1) Biaya pelaksanaan cukup mahal.
2) Memerlukan tenaga yang terampil dan berpengalaman. 3) Nitrogen cair perlu tersedia secara kontinyu.
Krioprotektan Etilen Glikol
Krioprotektan ialah zat kimia nonelektrolit yang berperan dalam mengurangi pengaruh mematikan selama pembekuan baik berupa pengaruh larutan maupun adanya pembentukan kristal es sehingga viabilitas sel dapat dipertahankan (Chen et al., 2005). Penambahan krioprotektan bertujuan untuk memelihara keutuhan membran dan meningkatkan potensial osmotik media sehingga cairan di dalam sel mengalir keluar dan terjadi dehidrasi. Kemampuan proteksi krioprotektan terhadap membran sel merupakan indikasi dari interaksi yang berjalan baik antara krioprotektan dan membran sel. Interaksi ini dapat mengurangi kerusakan membran sel pada saat terjadi perubahan keadaan dari relatif cair ke struktur relatif padat dan juga pada saat kembali ke struktur yang relatif cair selama proses pencairan (Kostaman dan Setioko, 2011).
Penggunaan krioprotektan baik pada saat pra-pembekuan dan pasca thawing (pencairan kembali) yang bertahap juga melibatkan proses pembekuan bertahap dengan menekankan pentingnya proses seeding. Proses seeding dimaksudkan untuk
14 menginisiasi pembentukan kristal es sebagai inti es dengan menurunkan temperatur sebagian larutan agar dehidrasi terjadi dan menekan pelepasan energi panas yang berlebihan dari fusi kristal es. Inisiasi secara mendadak ini dilakukan pada temperatur sedikit di bawah titik beku larutan, sehingga dapat mencegah membesarnya derajat supercooling atau memperpendek selang supercooling. Tanpa perlakuan seeding, inti es akan terbentuk secara spontan pada temperatur -10 oC sampai -15 oC (fenomena supercooling) yang disertai dengan pelepasan fusi panas, sehingga temperatur hampir mencapai titik bekunya kembali. Kondisi ini akan menimbulkan suatu fluktuasi temperatur yang cukup besar (Kostaman dan Setioko, 2011).
Etilen Glikol (EG) merupakan cairan jenuh, tidak berwarna, tidak berbau, dan larut sempurna dalam air dan merupakan salah satu bahan kimia sebagai bahan baku yang jumlahnya belum mencukupi kebutuhan industri di Indonesia. EG berfungsi sebagai bahan industri antara lain adalah sebagai bahan baku tambahan pembuatan tinta, kosmetik, pembuatan cat, dan bahan anti beku (Kusumadewi, 2005).
Menurut laporan Gordon (1994), EG efektif digunakan sebagai krioprotektan untuk kriopreservansi embrio dan diaplikasikan pula pada kriopreservasi oosit. Berat molekul EG yang rendah (62,07) memberikan efek yang menguntungkan berupa permeabilitas yang lebih tinggi. Beberapa peneliti juga mengatakan bahwa kelebihan EG sebagai krioprotektan adalah karena toksisitasnya yang rendah.
Penelitian Hochi et al. (1996), menunjukkan bahwa tingkat fertilisasi in vitro embrio sapi dalam larutan EG (Etilen Glikol) 40% menunjukkan tingkat poliploid yang cukup tinggi yaitu 44,9%. bahwa proses vitrifikasi mengakibatkan perubahan
15 beberapa struktur oosit seperti zona pelusida, membrane plasma dan butir-butir korteks yang berperan didalam proses pencegahan polispermi.
Penggunaan konsentrasi EG 30% dan waktu pemaparan 5 menit cukup memadai untuk vitrifikasi sel telur domba (Djuwita et al. 2001), sel telur dan embrio mencit, EG mempunyai kemampuan masuk dan keluar sel yang lebih cepat dibandingkan dengan gliserol. (Mohamad et al., 2000).
Diungkapkan oleh Nowshari et al. (1994), bahwa waktu pemaparan, konsentrasi krioprotektan dan prosedur pencairan kembali mempengaruhi kemampuan fertilitas dari embrio dan perkembangan sampai pada tahap blastosis.
Menurut Voelkel dan Hu (1992), EG memiliki permeabilitas terhadap sel embrio yang lebih baik daripada gliserol, viabilitas embrio beku lebih tinggi dibekukan dengan larutan EG (70%) dari pada dengan gliserol (30%), karena berat molekul etilen glikol lebih kecil dibandingkan dengan gliserol. Sedangkan menurut Szell et al. (1989), bahwa permeabilitas embrio domba dan sapi terhadap EG dan propilen glikol lebih baik daripada terhadap gliserol. Toksisitas etilen glikol lebih kecil jika dibandingkan dengan gliserol sehingga mempengaruhi ketahanan hidup embrio yang lebih tinggi
16
METODE PENELITIAN Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret hingga April 2017, di Laboratorium Fertilisasi dan Produksi In Vitro Embrio, Pusat Kegiatan Penelitian, Universitas Hasanuddin, Makassar.
Materi Penelitian
Alat yang digunakan adalah incubator, mikroskop (ZEISS, image A2 : Axio Cam HRc), Syringe (10 ml), scalpel, petri dish, gelas kimia, labu enlemeyer, freezer, timbangan analitik, kaca objek, kaca penutup, pipet tetes, mikropipet, cawan petri dan gunting bedah.
Bahan yang digunakan adalah ovarium sapi Bali yang diperoleh dari Rumah Potong Hewan (RPH) Tamangapa, Kota Makassar, provinsi Sulawesi Selatan. Bahan-bahan yang digunakan antara lain medium transportasi ovarium, medium in vitro fertilization (IVF), medium in vitro culture (IVC), medium in vitro maturation
(IVM), alcohol 70 % tissue, mineral oil (Sigma Chemical Co. St. Louis MO, USA), Kcl 0,7% enzim hyaluronidase (Sigma, USA) 0,25%, dan krioprotektan Etilen Glikol.
Rancangan Penelitian
Rancangan penelitian menggunakan metode eksperimental laboratorium berdasarkan Rancangan Acak lengkap (RAL) yaitu dengan 4 perlakuan dan 4 kali ulangan sebagai perlakuan adalah sebagai berikut:
A. Kontrol 0% Etilen Glikol + 100% phosphate buffered saline (PBS) B. 10% Etilen Glikol + 90% phosphate buffered saline (PBS)
C. 20% Etilen Glikol + 80% phosphate buffered saline (PBS) D. 30% Etilen Glikol + 70% phosphate buffered saline (PBS)
17
Prosedur Penelitian
Secara garis besar prosedur penelitian disajikan pada Gambar 3.
Gambar 3: Diagram Alir Prosedur Penelitian Koleksi Ovarium di RPH (Rumah
Pemotongan Hewan)
Pencacahan Ovarium seleksi Oosit
Proses Fertilisasi IVF (in vitro fertilization)
Embrio
Kriopreservasi
Thawing
Kultur IVC (in vitro culture)
Kultur Embrio yang telah dithawing
Embrio Hidup
Sperma Beku
Kapasitasi Sperma
Maturasi in Vitro
Penambahan krioprotektan EG (0%,10%,20% dan 30% pada medium kriopreservasi
Evaluasi pemulihan Embrio setelah kriopreservasi
S e b e l u m P e r l a k u a n p e r l a k u a n Evaluasi Embrio
18 Prosedur penelitian yaitu sebagai berikut:
1. Koleksi oosit.
Ovarium sapi segar dikumpulkan di rumah potong hewan dan dibawa ke laboratorium menggunakan larutan NaCl 0,9%. Koleksi oosit dilakukan dengan menyayat/mencacah folikel yang ada di permukaan ovarium hingga oosit keluar dengan media PBS (Phosphate Buffered Serum). Selanjutnya oosit diseleksi menggunakan mikroskop. Kemudian ditampung dalam petri dish yang berisi media phosphate buffered saline (PBS).
2. Seleksi dengan Koleksi
Oosit hasil koleksi dicuci dalam medium koleksi yang terdiri atas PBS(Phosphate Buffered Serum) ditambah 10% Serum masing-masing dua kali, selanjutnya dilakukan seleksi berdasarkan grade A, grade B, dan grade C. maturasi dalam tissue culture medium (TCM) ditambahkan FBS (Fetal Bovine Serum) 10%, 10 IU/ml pregnant mare serum gonadotrophin (PMSG), 10 IU/mlhuman chorionic gonadotrophin (HCG) dan 50 μg/ml Gentamycin.
3. Pematangan oosit in vitro.
Oosit yang terseleksi dan telah melalui dua kali pencucian dengan beberapa media, pematangan oosit dilakukan dalam medium maturasi (tissue culture medium (TCM) ditambahkan FBS (Fetal Bovine Serum) 10%, 10 IU/ml pregnant mare serum gonadotrophin (PMSG), 10 IU/mlhuman chorionic gonadotrophin
(HCG) dan 50 μg/ml Gentamycin), dengan membuat empat tetesan (drop) pada
petri dish (50 μL/drop) dan ditutup dengan mineral oil 9 agar tidak terjadi
19 4. Fertilisasi
Setelah pematangan inti Oosit, kemudian disiapkan medium fertilisasi (Suzuku et al., 2000). Spermatozoa disiapkan dalam bentuk drop dalam cawan petri dan ditutup dengan mineral oil (agar tidak terjadi penguapan).. Oosit yang telah dicuci dalam medium fertilisasi sebanyak dua kali kemudian dipindahkan kedalam drop spermatozoa dan diinkubasi selama 5-6 jam dalam inkubator CO2 5%, suhu 380C.
5. Kultur
Zigot hasil fertilisasi kemudian dipindahkan dalam drop 50 μl medium kultur yang ditambahkan 5 mg/ml BSA, 2,5% FBS dan ditutup mineral oil, selanjutnya dikultur dalam inkubator 5% CO2, suhu 38,8° C selama 48 jam (Meo et al., 2005). Hasil kultur ini memproduksi embrio yang siap untuk dibekukan ( kriopreservasi).
6. Kriopreservasi
Pembekuan embrio dilakukan setelah kultur 48 jam. Kemudian embrio yang sudah membelah dilakukan pembekuan dengan media kriopreservasi yang ditambahkan Etilen Glikol dengan konsentrasi 0% (kontrol), 10%, 20%, dan 30%. Kemudian selanjutnya dibekukan dalam nitrogen cair selama 48 jam.
7. Thawing dan Kultur
Setelah dikriopresrvasi selama 48 jam kemudian dilakukan pencairan kembali (thawing) selama 20 detik dalam air hangat dengan suhu 37oC. Selanjutnya dilakukan pengamatan dan dilakukan kultur kembali dengan media kultur selama 24 jam di dalam inkubator CO2 5% dengan suhu 38,5oC.
20 8. Evaluasi
Setelah kultur kembali dengan media kultur selama 24 jam dilakukan evaluasi embrio.
Parameter yang diamati
Parameter yang diamati pada penelitian ini adalah sebagai berikut: 1. Recovery embrio
Recovery embrio adalah kemampuan embrio kembali dalam keadaan semula setelah kriopreservasi. Pengamatan yang dilakukan yaitu dengan pengamatan embrio setelah thawing yang dilihat menggunakan mikroskop dengan melihat setiap embrio yang masih hidup ditunjukkan dengan bentuk sel sama dengan sebelum kriopreservasi (Gambar 5A) dan dilakukan perhitungan dengan menghitung jumlah embrio yang masih hidup dari jumlah embrio yang dikriopreservasi disetiap perlakuan
x 100 2. Viabilitas embrio
Viabilitas embrio adalah kemampuan perkembangan embrio selama dikultur setelah dibekukan. Pengamatan terhadap viabilitas embrio dilakukan setelah embrio dikultur selama 24 jam yang ditunjukkan dengan sel yang membelah pada saat dikultur. Penilaian kelangsungan hidup didasarkan pada keadaan morfologis tahapan perkembangan embrio
21
Analisis Data
Data perkembangan embrio sebelum dianalisis terlebih dahulu dilakukan Transformasi Arcsin untuk penyebaran data secara distribusi normal, selanjutnya data di analisis ragam menggunakan model matematis sebagai berikut:
Yij = μ + ᴛi + ɛij
Keterangan :
Yij= Hasil pengamatan dari tingkat perkembangan embrio dengan konsentrasi Etilen Glikol ke-i dengan ulangan ke-j
μ = Rata-rata pengamatan
ᴛi = Pengaruh konsentrasi Etilen Glikol ke-i
ɛ = Pengaruh galat percobaan dari perlakuan ke-i dan ulangan ke-j
Untuk mengetahui perbedaan antar perlakuan dilakukan uji beda nyata jujur (list significant diferent).
22
HASIL DAN PEMBAHASAN
Proses Maturasi Oosit sampai Fertilisasi
Data hasil pengamatan oosit sapi bali mulai dari sebelum maturasi hingga sebelum fertilisasi dapat dilihat pada Gambar 4.
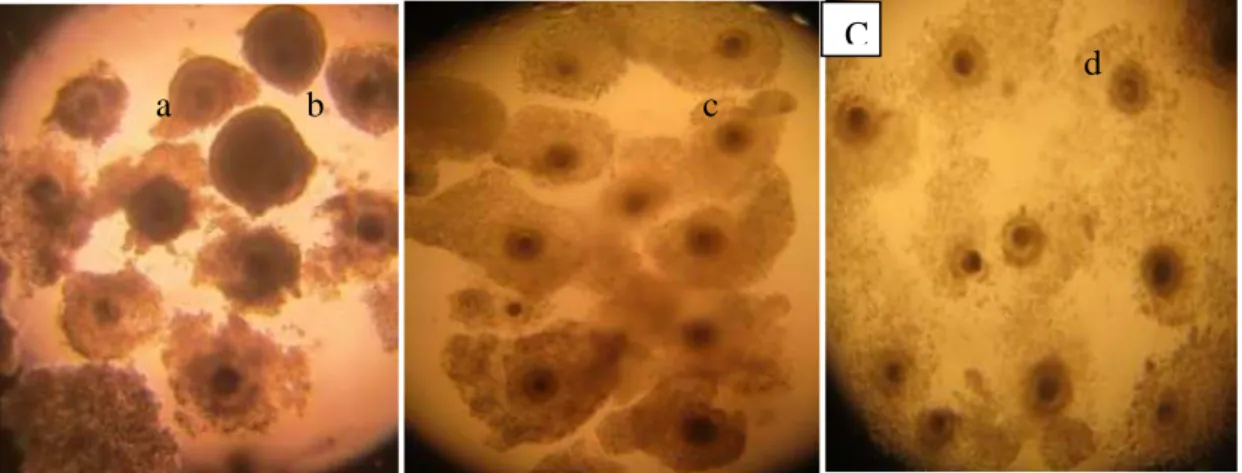
d a b c
Gambar 4. Proses perubahan oosit A Sebelum Maturasi, B Setelah Maturasi, dan C Sebelum Fertilissi inti sel oosit (a); sel-sel kumulus oophorus masih menyatu (b); sel-sel kumulus sudah terlihat mekar dari bentuk semula (c); sel-sel kumulus di kurangi (d).
Oosit sebelum maturasi (4A) mempunyai ciri berikut: inti oosit kelihatan jelas (4a), sel-sel kumulus yang mengelilingi masih terlihat mengumpul dengan warna yang agak gelap (4b). Oosit yang akan dimaturasi diseleksi dahulu agar dapat termaturasi dengan baik. Gambar 4B adalah gambar oosit setelah maturasi. Perbedaan antara sebelum maturasi dan setelah maturasi yaitu terlihat sangat jelas bentuk sel-sel kumulusnya. Oosit setelah maturasi sel kumulusnya tampak sudah mekar/ merenggang dari bentuk mulanya (Gambar 4Bc)
Maturasi dapat terjadi secara in vivo maupun in vitro. Maturasi secara in vitro dilakukan agar diperoleh oosit primer yang berkembang menjadi oosit sekunder. Oosit sekunder tersebut akan melakukan proses pembelahan meiosis
23 dengan normaldan sempurna, sehingga dihasilkan sel telur yang siap dibuahi oleh spermatozoa dan dapat berkembang menjadi embrio dengan kualitas yang baik. Proses maturasi oosit primer perlu dilakukan sebelum terjadinya fertilisasi oleh spermatozoa dengan tujuan
untuk meningkatkan angka keberhasilan fertilisasi (Fatchiyah et al., 2000).
Gambar 4C yaitu oosit sebelum proses fertilisasi yang dicirikan oleh sel-sel kumulus yang mengelilingi berkurang dibanding setelah maturasi. Apabila banyak sel-sel kumulus yang mengelilingi maka menyebabkan sperma sulit untuk menuju inti sel oosit, yang mengakibatkan oosit tdak terfertilisasi.
Setelah proses fertilisasi terbentuk zigot dan dikultur selama 24 jam hingga terbentuk embrio terlihat dalam Gambar 5.
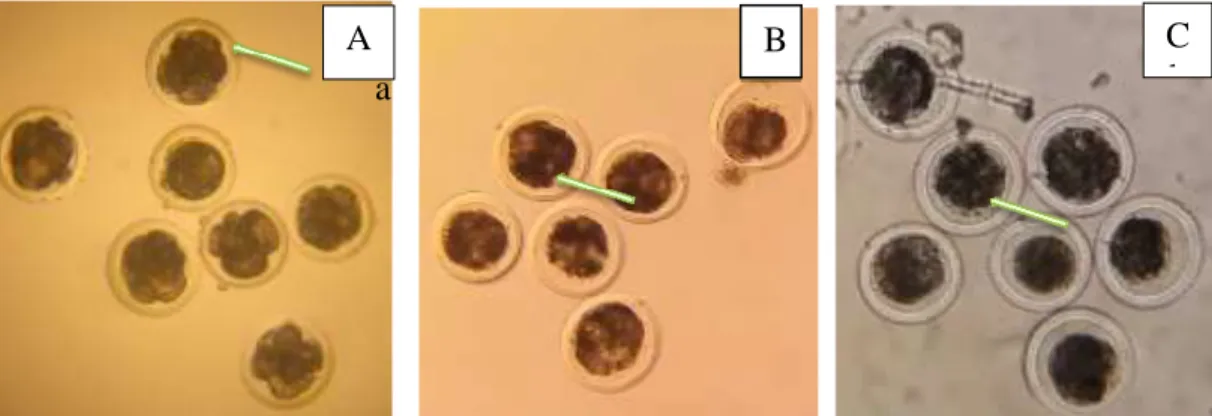
a
Gambar 5. Perkembangan embrio yang dicirikan dengan pembelahan embrio menjadi beberapa sel setelah kultur 48 jam sebelum kriopreservasi (A) dan kultur kembali selama 24 jam setelah kriopreservasi 48 jam (B).
Gambar 5Aa,b menunjukkan embrio sebelum kriopreservasi morfologinya cukup jelas, dimana sel-sel embrio nampak dengan jelas sekat-sekat antara sel yang satu dengan sel yang lainya. setelah di kriopreservasi Gambar 5Bc sekat-sekat pembelahan tidak terlalu jelas seperti gambar 5Aa dan embrio yang dikultur kembali selama 24 jam setelah kriopreservasi bentuk embrio tidak begitu jelas (Gambar 5Cd).
C h a si l a n a li si s r a g a m ( L a m p ir a n 5 ) p e A e rr E E D B
24 Metode kultur in vitro embrio pada umumnya menggunakan media yang telah diketahui komposisinya. Penambahan serum dalam media kultur dapat membantu pertumbuhan embrio sampai tahap morulla dan blastosis secara in vitro (Kaiin dan Tappa, 1994).
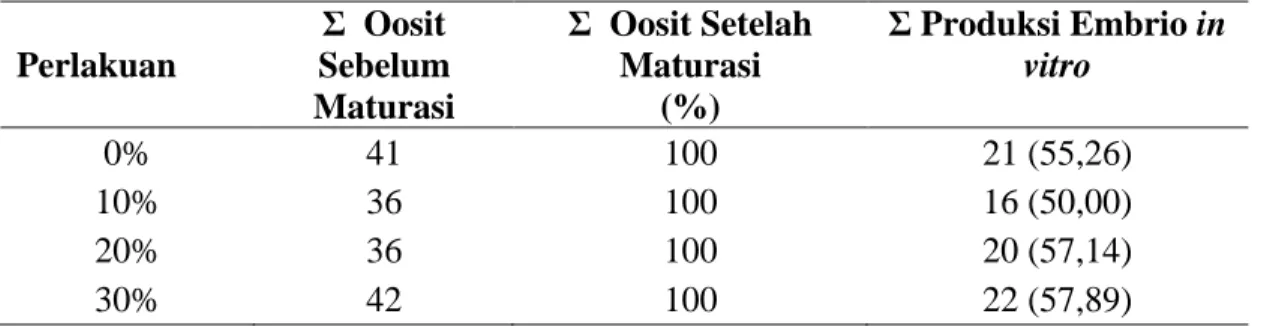
Data hasil pengamatan oosit mulai dari maturasi hingga terbentuknya embrio sebelum dan sesudah kriopreservasi dapat dilihat pada Tabel 1.
Tabel 1. Total dan Persentase Oosit Sebelum dan sesudah maturasi, dan Total Produksi Embrio pada kelompok Perlakuan
Perlakuan Σ Oosit Sebelum Maturasi Σ Oosit Setelah Maturasi (%) Σ Produksi Embrio in vitro 0% 41 100 21 (55,26) 10% 36 100 16 (50,00) 20% 36 100 20 (57,14) 30% 42 100 22 (57,89)
Keterangan: Angka dalam kurung adalah persentase
Tabel 1 merupakan data sebelum kriopreseravasi, untuk menghasilkan embrio yang akan diberi perlakuan. Daya hidup oosit dari sebelum maturasi dan setelah maturasi menunjukkan angka yang tinggi yaitu 100%. Hal ini karena oosit yang digunakan oosit kualitas baik. Peranan sel kumulus oophorus dalam maturasi oosit sangat mendukung pematangan oosit (Fatchiyah et al., 2000). Kumulus oophorus berperan sebagai penghubung antara sel-sel stratum granulosum dengan oosit dan memungkinkan pemindahan molekul dari populasi sel-sel granulosa ke oosit (Putro, 1993).
Oosit yang matang dilakukan pembuahan dengan spernma kemudian dikultur selama 24 jam menghasilkan tingkat embrio yang dihasilkan sekitar 50% - 57,89%. Hal ini disebabkan pada proses fertilisasi terdapat oosit yang tidak dibuahi oleh sel spermatozoa, sel spermatozoa kurang bagus kualitasnya. Tingkat fertilisasi
25 spermatozoa pada oosit sapi yang memiliki sel-sel kumulus lengkap 78% dan kejadian polispermi sebesar 8%. (Bilodeau dan Panich, 2002).
Perkembangan Embrio Hasil Kriopreservasi dan Viabilitas Embrio
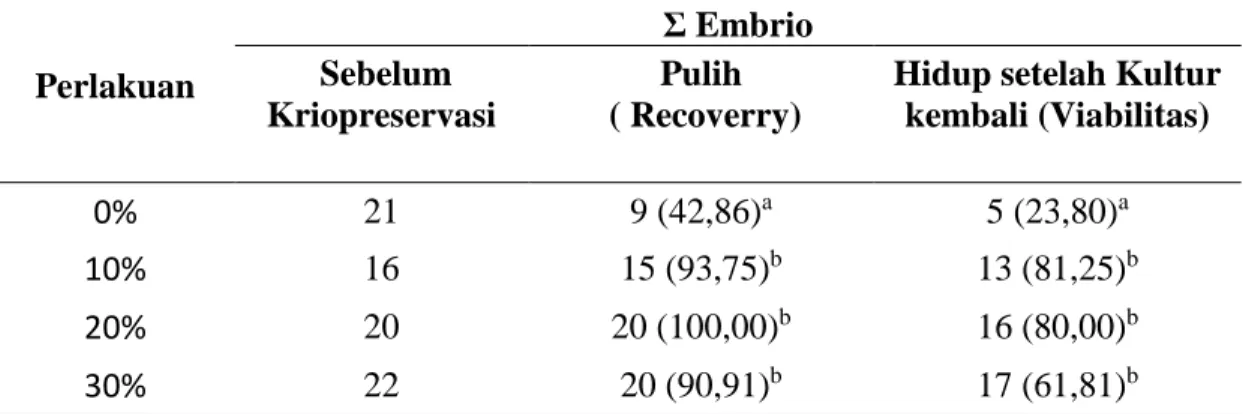
Data hasil pengamatan embrio yang pulih setelah kriopreservasi dengan Etilen Glikol dan embrio hidup setelah kultur dapat dilihat pada Tabel 2.
Tabel 2. Embrio yang Pulih setelah Kriopreservasi dengan Etilen Glikol dan Embrio Hidup setelah Kultur kembali
Perlakuan Σ Embrio Sebelum Kriopreservasi Pulih ( Recoverry)
Hidup setelah Kultur kembali (Viabilitas)
0% 21 9 (42,86)a 5 (23,80)a
10% 16 15 (93,75)b 13 (81,25)b
20% 20 20 (100,00)b 16 (80,00)b
30% 22 20 (90,91)b 17 (61,81)b
Keterangan: Angka dalam kurung adalah persentase
Berdasarkan hasil analisis ragam (Lampiran 5) perlakuan penambahan krioprotektan Etilen Glikol (EG) berpengaruh nyata terhadap tingkat pemulihan embrio (recovery rate) setelah kriopreservasi (P< 002) dan terhadap perkembangan embrio setelah dikultur kembali (viabilitas) (P< 035). Hasil uji lanjutan (BNT) menunjukkan bahwa tingkat pemulihan embrio pada kontrol (krioprotektan Etilen Glikol 0%) sangat nyata (P< 0,01) lebih rendah dibandingkan dengan tingkat pemulihan embrio pada konsentrasi EG 10%, 20% dan 30%. Hal ini disebabkn pengaruh penambahan krioprotektan EG yaitu mampu memelihara keutuhan membran dan meningkatkan potensi osmotik pada media. Hal ini sesuai dengan laporan Gordon (1994), yang menyatakan EG efektif digunakan sebagai
26 krioprotektan untuk kriopreservasi embrio dan diaplikasikan pula pada kriopreservasi oosit. Berat molekul EG yang rendah (62,07) memberikan efek yang menguntungkan berupa permeabilitas yang lebih tinggi.
Krioprotektan dapat melindungi sel selama proses kriopreservasi. Derajat proteksi dari bahan krioprotektan terhadap proses kristalisasi pada masa pembekuan tergantung dari jenis dan konsentrasi krioprotektan yang dipakai serta lama paparan (Kasai, 2002).
Penggunaan konsentrasi EG 30% dan waktu pemaparan 5 menit cukup memadai untuk kriopreservasi sel telur domba (Djuwita et al. 2001), sel telur dan embrio mencit, EG mempunyai kemampuan masuk dan keluar sel yang lebih cepat dibandingkan dengan gliserol. (Mohamad et al., 2000).
Tingkat perkembangan embrio setelah dikultur kembali (viabilitas) pada konsentrasi penggunaan krioprotektan Etilen Glikol 0% sangat nyata (P< 0,01) lebih rendah dibandingkan dengan tingkat pemulihan embrio pada konsentrasi 10%, 20% dan 30%. Hal ini mungkin disebabkan oleh dampak residu Etilen Glikol pada saat kriopreservasi yang mungkin menyebabkan perlukaan pada sel akibat efek toksik dari konsentrasi krioprotektan dan stress karena perubahan suhu yang ekstrim. Menurut Lane et al. (1999), salah satu alasan kecenderungan penurunan nilai viabilitas selama 24 jam kultur in vitro setelah kriopreservasi disebabkan karena embrio mamalia pada setiap tahap perkembangan yang berbeda, memiliki mekanisme tersendiri dan kemampuan yang relatif berbeda dalam menyerap krioprotektan, serta mencapai tingkat dehidrasi sempurna selama proses penyerapan larutan.
27 Kecenderungan penurunan daya hidup zigot setelah kriopreservasi dapat disebabkan pula oleh kerusakan fisik akibat pembentukan kristal es selama pembekuan, efek toksik krioprotektan dan stress osmotik selama pengeluaran krioprotektan (Nowshari dan Brem 2001).
Pada dosis EG 30% tingkat viabilitas embrio setelah di kultur kembali cenderung menurun disbanding dosis 10 dan 20 %, hal ini diuga disebabkan toksisitas krioprotektan (Kasai, 1996). Faktor lain penyebab tidak berkembangnya embrio mungkin disebabkan konsentrasi glukosa dalam medium kultur in vitro yang kurang sesuai untuk setiap tahap perkembangan embrio (Kasai, 1996). Pada umumnya embrio yang dihasilkan melalui fertilisasi in vitro atau mulai dikultur pada tahap zigot dalam medium kultur akan mengalami hambatan perkembangan embrio tahap awal (Djuwita et al., 2000).
28
PENUTUP
Kesimpulan
1. Penambahan krioprotektan Etilen Glikol pada medium kriopeservasi dengan konsentrasi 10 sampai 30% dapat mempertahankan tingkat pulih embrio dan tingkat perkembangan embrio setelah dikultur kembali yang lebih tinggi dibandingkan dengan kontrol
2. Penggunaan Etilen Glikol untuk krioprervasi cukup dengan dosis 10%.
Saran
Sebaiknya dosis untuk penggunaan kriprotektan Etilen Glikol dalam penggunaanys untuk kriopreservasi embrio disarankan tidak lebih dari 10%.
29
DAFTAR PUSTAKA
Alberio, R., V. Zakhartchenko, J. Motlik, and E. Wolf E. 2001. Mammalian oocyte activation: Lessons from the sperm and implication for nuclear transfer. Int. J. Dev. Biol. 45:797-809.
Ball, P. J. H., and A. R. Peters. 2007. Reproduction In Cattle Third Edition. Blacwell Publishing Ltd. UK.
Boediono, A, K. Mohamad, Y. Rusiyantono, I. Djuwita, dan Y. Sukra. 2003. Kloning embrio dengan pembuatan kembar identik melalui rekayasa embrio dan pembekuan dngan metode vitrifikasi. Lab. Embriologi FKH IPB.
Bilodeau-Goeseels, S., and P. Panich. 2002. Effects of oocyte quality on development and transcriptional activity in early bovine embryos. Anim. Reprod. Sci. 71:143-155.
Campbell, N.A., J. B. Reece, and L. G. Mitchel. 2000. Biologi. Erlangga. Jakarta. Chen, S.U., Y.R. Lien, H.F. Chen, L.J. Chang, Y.Y. Tsai and Y.S. Yang. 2005.
Observational clinical follow-up of oocyte cryopreservation using a slow-freezing method with 1,2-propanediol plus sucrose followed by ICSI. Human Reprod. 20: 1975 – 1980.
Chohan, K. R., and Hunter A. G. 2003. Meiotic competence of bovine fetal oocytes following in vitro maturation.Anim. Reprod. Sci. 76:43-51.
Crozet, N., Ali A., and M. P. Dubos. 1995. Developmental competence of goat oocytes from follicles of different size categories following maturation, fertilization and culture in vitro. Reprod. Fertil. 103(2):293-298.
Djuwita, I., L. Amalia, Widjiati, dan K. Mohamad. 2000. Efek Konsentrasi Glukosa dalam Medium Dengan dan Tanpa Fosfat terhadap Perkembangan Embrio Preimplantasi Mencit secara In vitro. Media Veteriner. 7 (1): 9-12.
Djuwita, I . 2001. Kajian Morfologis dan fungsi Biologis Oosit Domba setelah Kriopreservasi dengan Metode Vitrifikasi. Disertasi. Sekolah pasca sarjana institute pertanian Bogor. Bogor. Hal 104.
Fatchiyah, F.G. Ciptadi, M.S. Djati dan S. Wahyuningsih. 2000. Penambahan FB dan EGS pada Media Kultur Maturasi In Vitro (IVM) Oosit Kambing Lokal PE. Natural. J. 4 (3): 52-55.
30 Fibrianto, Y.H., D.L. Kusindarta dan S. Soebagyo. 2000. Penggunaan Serum Inaktivasi dari Rumah Potong Hewan pada Media Fertilisasi In Vitro. Mediagama. 2: 1-6.
Gordon, I. 1994. Laboratory Production of Cattle Embryos. Cab international. Cambridge.
Gordon, I. R. 2003. Laboratory Production of Cattle Embryos.CABI Publishing; Wallingford UK.
Hochi, S., K. Kimura, K. Ito, and M. Hirabayashi. 1996. Effect of nuclear stages during invitro maturation on the survival of bovine oocytes following vitrification. Theriogenology. 46:345. (Abstr).
Hogan, B., C. Frank and L. Elizabeth. 1986. Manipulating The Mouse Embryo A Laboratory Manual. Cold Spring Harbor Laboratory. USA.
Jones, K.T. 2007. Intracellular calcium in the fertilization and development of mammalian eggs.Proc. Aust. Phys. Soc. 38:35-41
Junqueira L. C., J, Carneiro, O. K. Robert. 2007. Histologi Dasar edisi ke-8. Jakarta (ID): EGC.
Kaiin, E.M. dan B. Tappa. 1994. perkembangan embrio in vitro mencapai hatched blastosis pada kondisi media yang berbeda. Prosiding Seminar Hasil Penelitian Bioteknologi II. Puslitbang Bioteknologi LIPI. Bogor.
Kasai, M. 1996. Simple and Efficient Methods for Vitrification of Mammalian Embryos. Animal Reproduction Sciences 42 : 67-75.
Kasai, M. 2002. Advances in the cryopreservation of mammalian oocytes and embryos: Development of ultrarapid vitrification. Rev.1:1-9.http:www/blackwellsynergy.com/links/doi/10.1046/j.1445781.2002.00004. Kostaman, T. dan A.R. Setioko. 2011. Perkembangan penelitian teknik kriopreservasi
untuk penyimpanan semen unggas. Balai Penelitian Ternak, Bogor. Hal 145-152.
Kusumadewi, I. 2005. Prarancangan Pabrik Etilen Glikol dari Etilen Oksida dan Air dengan Proses Hidrosi non Katalistik Kapasitas 110.000Ton/tahun. Hal 1-21 Lane M, BD. Bavister, Lyons EA, and Forest KT. 1999. Container-less vitrification
of mammalian oocytes and embryos. Nat Biot17:1234-1236
Liebermann, J., F. Nawroth and F. Isachenko. 2002. Potential importance of vitrification in reproductive medicine. Biol. Reprod. 67: 71-80.
31 Meo, S.C., W. Yamazaki, C.L.V. Leal, J.A. de Oliveira, and J.M. Garcia. 2005. Use
of strontium for bovine oocyte activation. Theriogenology.63:2089-2102. Mohamad, K., E. Rumiyati, F. Sari, N. Liyanah, dan I. Djuwita. 2000. Kriopreservasi
oosit pronukleus dan embrio mencit dengan metode vitrifikasi. Abstrak Seminar Nasional Biologi XVI. Bandung
Nowshari, M.A., P.L. Nayudu, and J.K. Hodges. 1994. Effect of Cryoprotectant Concentration, Equili bration Time and Thawing Procedure on Survival and Development of Rapid Frozen Thawed Mature Mouse Oocytes. Theriogenology. 42 : 1193-1204.
Nowshari MA, and Brem G. 2001. Effect of freezing rate and exposure time to cryoprotectan on the development of mouse pronuclear stage embryos. Hum Reprod 16:2368-2373.
Partodihardjo, S. 1980. Ilmu Reproduksi Hewan. Mutiara. Jakarta.
Pawshe, C. H., K. B. C. Appa Rao, S. K. Jain, and S. M. Totey. 1994. Biochemical studies on goat oocytes timing of nuclear progresian, effect of protein inhibitor and pattern of polypeptide synthesis during in vitro maturation. Theriogenology. 42(2):307-320.
Putro, P.P. 1993. Petunjuk Laboratorium Fertilisasi In Vitro. Pusat Antar Universitas Bioteknologi. UGM. Yogyakarta.
Rimayanti. 2005. Pengaruh Proses Vitrifikasi dengan Krioprotektan Etilen Glikol Terhadap Daya Hidup Oosit Sapi. Department of Reproduction and Obstetric , Faculty of Veterinary Medicine, Airlangga University. 28- 31.
Sagi, M. 1999. Embriologi Perbandingan pada Vertebrata. Fajar Offset. Yogyakarta. Saito, N., K. Imal, and M. Tomizawa. 1994. Effect of sugars-addition on the survival
of vitrified bovine blastocist produced in vitro . Theriogenology 41:1053-1060 .
Salisbury, G.W. dan N.L. VanDemark. 1985. Fisiologi Reproduksi dan Inseminasi Buatan Pada Sapi (diterjemahkan oleh R. Djanuar). UGM Press. Yogyakarta. Shier, D., J. Butler, and R. Lewis. 2003. Hole’s Essential of Human Anatomy and
Physiology. 8thed. New York, USA: McGraw Hill. 498-508.
Sonjaya, H., M. Amin, Hasbi, L. Rahim. 2016. Pengaruh waktu maturasi oosit terhadap keberhasilan produksi embrio sapi bali secara in vitro. Seminar Nasional Biotek 4. Universtas Gadjah Mada.
Speroff, L. Fritz, M. A. Lippincot Williams, and Wilkin. 2010. Clinical Gynecologic Endocrinology and Infertility. USA: 749-857
32
Sukra,Y. 2000. Wawasan Ilmu Pengetahuan Embrio Benih Masa Depan. Direktorat Jendral Pendidikan Tinggi Departemen Pendidikan Nasional. Jakarta.
Supriatna, I. dan F.H. Pasaribu. 1992. In Vitro Fertilisasi, Transfer Embrio dan Pembekuan Embrio. Depdikbud. Dirjen. Pend. Tinggi, Pusat Antar Universitas Biotek. IPB. Bogor.
Susilowati, T., S.B. Sumitro, M.S. Djati, G. Ciptadi. and B. Permono. 1998. Optimalisasi Maturasi Oosit secara In Vitro dengan Kombinasi Konsentrasi Serum dan Hormon pada TCM 199. Natural. J. 2 (1): 16-23.
Suzuki,K., B. Erikson, H. Shimizu, I. Nagai, H. Rodhiguez Martinez. 2000. Effect of hyaluron on monospermic penetration of porcine oocyte fertilized in vitro int Androl. 23:13-21.
Szell, A., J . N . Shelton, and K. Szel. 1989. Osmotic characteristics sheep and cattle embryos. Cryobiology; 26: 297 -301 .
Telfer, D. J., and R. S. Sharpley. 2008. Tourisme and Development in The Development in The USA and Canada by Routledge, 270 Madison Ave, New York.
Toelihere, M.R. 1979. Fisiologi Reproduksi Pada Ternak. penerbit Angkasa. Bandung.
Villee, C.A., F.W. Warren and D.B. Robert. 1988. Zoologi Umum (diterjemahkan oleh Nawangsari Sugiri). Jilid 1. Erlangga. Jakarta.
Voelkel, S.A. and Y . X . Hu. 1992. Use of ethylene glycol as a cryoprotectant for bovine embryos allowing direct transfer of frozen-thawed embryos to recipient females. Theriogenology. 37: 687-697.
Watson, P.F. 2000. The causes of reduced fertility with cryopreserved semen. Anim. Reprod. Sci. 60 – 61: 481 – 492.
33
Lampiran 1. Komposisi Media Maturasi Oosit Secara In Vitro
No Nama Bahan Volume
1 TCM-199 1800 µl
2 Serum FBS (fetal bovine serum) 200 µl
3 PMSG (pregnant mare serum gonadotropin) 20 µl 4 hCG (human chorionic gonadotropin) 20 µl
5 Gentamycin 4 µl
Lampiran 2. Komposisi Media Fertilisasi Secara In Vitro
No Nama Bahan Volume
1 Ultra pure water 50 ml
2 NaCl (natrium/sodium chloride) 0,2629 gram
3 KCL (kalium chloride) 0,0447 gram
4 NaHCo3 (natrium bicarbonate) 0,1050 gram
5 NaH2PO4 (natrium dihydrogen phosphate monohydrate) 0,0030 gram 6 MgSO4 7H2O (magnesium sulfat-heptahydrate) 0,0061 gram
7 Sodium lactate 60% syrup 0,095 ml
8 Hepes 0,1191 gram
9 CaCl2 2H2O (calcium chloride_dihydrate) 0,0588 gram
10 Sodium pyruvate 0,0110 gram
11 Caffeine anhydrous 0,0194 gram
12 BSA (fatty acid free) fraksi V 0,2500 gram
13 Gentamycin 10 µl
Lampiran 3. Komposisi Media Kultur Secara In Vitro A-solution
Nama Bahan Volume
NaCl 2.1763 g 4.3526 g 6.7031 g
KCl 0.0750 g 0.1500 g 0.2311 g
Na-pyruvate 0.0143 g 0.2086 g 0.0440 g
naHCO2 0.7145 g 1.4293 g 2.2011 g
Phenol red 0.6578 g 1.3157 g 2.0262 g
Ultra Pure Water Up to 250 mL
34 B. Solution Bahan Jumlah Hemicalcium laetate 0.2998 g 0.5996 g 0.7495 g 1.499 g
Ultra Pure Water 100 ml 200 ml 250 ml 500 ml
CR1aa medium
Bahan Jumlah Keterangan
A-Solution 76 ml -
B-Solution 20 ml -
BME Essensial amino acids 2 ml Sigma ; BME amino acids solution 50xB6766
MEM Non Essensial amino acids 1 ml Sigma ;MEM non- essensial amino acids 100x m7145
L-Glutamic Acids 0,0146 g Sigma ;G-1251 Bovine Serum Albumin 0,3 g Sigma ; A-7030 Antibiotik (penicillin-streptomycin) 1 ml/ 100 ml Sigma ; P4333-100 ml Penicillin ; 10 000 IU Streptomycin ; 10 mg/ml ++ FBS 10% 10 ml Gibco FBS ; 26140-079
35
Lampiran 4. Data Jumlah Embrio Terhadap Kriopreservasi dengan Krioprotektan EG Secara in vitro (%)
Perlakuan Ulangan Jumlah embrio
Recocerry rate Viabilitas
0% 1 0 0 2 333,32 16,67 3 66,66 33,33 4 71,42 42,86 10% 1 100 66,66 2 100 66,66 3 100 100 4 85,71 87,71 20% 1 100 66,66 2 100 80 3 100 75 4 100 87,5 30% 1 80 60 2 83,37 66,66 3 100 100 4 100 81,5
36
Lampiran 5. Data Jumlah Embrio Terhadap Kriopreservasi dengan Krioprotektan EG Secara in vitro Hasil Transformasi Arcsin
Perlakuan Ulangan jumlah embrio
Recocerry rat Viabilitas
0% 1 0 0 2 35,24 24,04 3 54,70 35,24 4 57,67 40,86 10% 1 90,00 54,70 2 90,00 54,70 3 90,00 90,00 4 67,78 67,78 20% 1 90,00 54,70 2 90,00 63,44 3 90,00 60 4 90,00 69,30 30% 1 63,44 50,77 2 65,88 54,70 3 90,00 90,00 4 90,00 64,52
37
Lampiran 6. Analisis Ragam Recoverry Embrio In vitro
Tests of Between-Subjects Effects
Dependent Variable: Pulih
Source
Type III Sum of
Squares df Mean Square F Sig.
Corrected Model 6956.027a 3 2318.676 8.895 .002 Intercept 83334.699 1 83334.699 319.700 .000 Perlakuan 6956.027 3 2318.676 8.895 .002 Error 3127.987 12 260.666 Total 93418.713 16 Corrected Total 10084.014 15
a. R Squared = .690 (Adjusted R Squared = .612)
Multiple Comparisons
Dependent Variable: Pulih LSD
(I) Perlakuan (J) Perlakuan
Mean Difference
(I-J) Std. Error Sig.
95% Confidence Interval Lower Bound Upper Bound
1.00 2.00 -47.5425* 11.41634 .001 -72.4166 -22.6684 3.00 -53.0975* 11.41634 .001 -77.9716 -28.2234 4.00 -40.4275* 11.41634 .004 -65.3016 -15.5534 2.00 1.00 47.5425* 11.41634 .001 22.6684 72.4166 3.00 -5.5550 11.41634 .635 -30.4291 19.3191 4.00 7.1150 11.41634 .545 -17.7591 31.9891 3.00 1.00 53.0975* 11.41634 .001 28.2234 77.9716 2.00 5.5550 11.41634 .635 -19.3191 30.4291 4.00 12.6700 11.41634 .289 -12.2041 37.5441 4.00 1.00 40.4275* 11.41634 .004 15.5534 65.3016 2.00 -7.1150 11.41634 .545 -31.9891 17.7591 3.00 -12.6700 11.41634 .289 -37.5441 12.2041
Based on observed means.
The error term is Mean Square(Error) = 260.666. *. The mean difference is significant at the .05 level.
38 Tests of Between-Subjects Effects
Dependent Variable: Viabilitas01
Source
Type III Sum of
Squares df Mean Square F Sig.
Corrected Model 4737.292a 3 1579.097 6.622 .007 Intercept 47846.094 1 47846.094 200.656 .000 Perlakuan 4737.292 3 1579.097 6.622 .007 Error 2861.385 12 238.449 Total 55444.770 16 Corrected Total 7598.676 15
a. R Squared = .623 (Adjusted R Squared = .529)
Multiple Comparisons
Dependent Variable: Viabilitas01 LSD
(I) Perlakuan (J) Perlakuan
Mean Difference
(I-J) Std. Error Sig.
95% Confidence Interval Lower Bound Upper Bound
1.00 2.00 -41.7600* 10.91899 .002 -65.5504 -17.9696 3.00 -36.8750* 10.91899 .005 -60.6654 -13.0846 4.00 -39.9625* 10.91899 .003 -63.7529 -16.1721 2.00 1.00 41.7600* 10.91899 .002 17.9696 65.5504 3.00 4.8850 10.91899 .663 -18.9054 28.6754 4.00 1.7975 10.91899 .872 -21.9929 25.5879 3.00 1.00 36.8750* 10.91899 .005 13.0846 60.6654 2.00 -4.8850 10.91899 .663 -28.6754 18.9054 4.00 -3.0875 10.91899 .782 -26.8779 20.7029 4.00 1.00 39.9625* 10.91899 .003 16.1721 63.7529 2.00 -1.7975 10.91899 .872 -25.5879 21.9929 3.00 3.0875 10.91899 .782 -20.7029 26.8779
Based on observed means.
The error term is Mean Square(Error) = 238.449. *. The mean difference is significant at the .05 level.
39
Lampiran 8. Dokumentasi Penelitian
Ovarium sapi bali Oosit setelah di fertilisasi
Embrio umur 48 jam Kriopreservasi embrio dengan straw
Proses pengamatan oosit Mikropipet dan tip
40
Timbangan analitik Stirrer
Centrifuge Kontainer penyimpanan sperma beku
Pipet yang dimodifikasi Bunsen untuk memodifikasi pipet
41
Oven untuk sterilisasi kering Inkubator
Bahan untuk fiksasi Bahan untuk pewarnaan