REGISTRASI ALAT KESEHATAN
ELEKTROMEDIK DI INDONESIA
DIREKTORAT PENILAIAN ALAT KESEHATAN
1 Maret 2016
4/14/2016
Directorate of
Medical Device and Health Household Health Product Evaluation
Head Of Sub Directorate Medical Devices Evaluation of A & B Class Dra. Rully Makarawo, Apt
Head of Sub Directorate Medical Devices Evaluation of C & D Class
Lupi Trilaksono, SF., MM., Apt
Head of Sub Directorate Diagnostic Product and Special Access of Medical
Devices
Drs Masrul, Apt
Head of Sub Directorate Household Health Product
and domestic Product
Dra. Lili Sa’diah, Apt
Head of Section Medical Devices of A Class
Jojor Simanjuntak, M. Si., Apt
Head of Section Medical Devices of B Class
Nurhidayat, S. Si., Apt
Head of Section Medical Devices of C Class
Eva Silvia, MKM
Head of Section Medical Devices of D Class &
Radiological Product Eva Zahra, S. Farm., Apt
Head of Section Diagnostic Product Nuning Lestin Bintari, M.
Si., Apt
Head of Section Special Access of Medical
Devices
Drg. Edi Setiawan, MKM
Head of Section Domestic Product Ismiyati, S. Si., Apt., M. Si
Head of Section Household Health Product Hasnil Randa Sari, S. Si., Apt Head of Sub
Division of Administration
Onne Widowaty, Apt
Director of Medical Devices and Household
Health Product Evaluation Drg. Arianti Anaya, MKM
Dasar Hukum
1. UU Kesehatan No. 36 tahun 2009 tentang Kesehatan
2. Peraturan Pemerintah No. 72 tahun 1998 tentang Pengamanan Sediaan Farmasi dan Alat Kesehatan
3. Peraturan Pemerintah No. 64 tahun 2000 tentang Perizinan Pemanfaatan Tenaga Nuklir
4. Permenkes No. 1189/MENKES/PER/VIII/2010 Tentang Produksi Alat Kesehatan dan PKRT
5. Permenkes No. 1191/MENKES/PER/VIII/2010 Tentang Penyaluran Alat Kesehatan
6. Permenkes No. 1190/MENKES/PER/VIII/2010 Tentang Izin Edar Alat Kesehatan dan PKRT
Dalam rangka memberi pengamanan dari penggunaan yang tidak
tepat dan melindungi masyarakat dari peredaran Alat Kesehatan
dan PKRT yang tidak memenuhi persyaratan mutu, keamanan, dan
kemanfaatan perlu dilakukan penilaian sebelum diedarkan
AMANAT UU N
O
. 36
TTG
KESEHATAN
Setiap orang yang dengan sengaja
memproduksi atau mengedarkan sediaan
farmasi dan/atau alat kesehatan yang tidak
memenuhi standar dan/atau syarat
keamanan, khasiat atau kemanfaatan, dan
mutu dipidana dengan pidana penjara
paling lama 10 (sepuluh) tahun dan denda
paling banyak Rp 1.000.000.000,00
(satu miliar rupiah)
UU Kesehatan 36 Th 2009 :
Sediaan farmasi dan alat
kesehatan hanya dapat
diedarkan setelah mendapat
izin edar.
PP 72/ 1998
Alat Kesehatan
yang diproduksi
dan/ diedarkan
harus memenuhi
persyaratan
mutu, keamanan
dan
kemanfaatan.
Pengendalian Alkes
Core Regulatori Alkes dan
PKRT
Penilaian Alkes dan PKRT
Keamanan Mutu dan Manfaat
Kelas
A&B Kelas C&D IVD PKRT
ONLINE REGALKES
“alat kesehatan” adalah instrumen, aparatus,
implementasi, mesin, alat, implan, in vitro reagen
dan kalibrator, perangkat lunak, material atau
artikel lainnya yang sama atau terkait:
(a) yang dimaksudkan oleh pemilik produk yang
akan digunakan, sendiri atau dalam kombinasi,
bagi manusia untuk satu atau lebih dari tujuan
tertentu :
(i) diagnosis, pencegahan, pemantauan,
perawatan atau pengentasan penyakit,
(ii) diagnosis, pemantauan, pengobatan,
pengurangan atau kompensasi untuk cedera,
(iii) penyelidikan, penggantian, modifikasi, atau
dukungan anatomi atau proses fisiologis,
LANJUTAN
(iv) mendukung atau mempertahankan
hidup,
(v) pengendalian konsepsi,
(vi) desinfeksi alat kesehatan,
(vii) memberikan informasi untuk tujuan
medis atau diagnosis dengan cara
pemeriksaan in vitro spesimen yang berasal
dari tubuh manusia, dan
LANJUTAN
dan
(b) yang tidak mencapai aksi utama
yang dimaksud dalam atau pada
tubuh manusia secara farmakologis,
imunologi atau metabolik, tetapi
dapat dibantu dalam mencapai
fungsinya dengan cara seperti itu.
A
B
C
D
PERS
YARA
TAN
REGU
LASI
KELAS ALKES (TINGKAT RESIKO)
1. Peralatan Kimia klinik Toksikologi Klinik 2. Peralatan Hematologi dan Patologi 3. Peralatan Imunologi dan Mikrobiologi 4. Peralatan Anestesi 5. Peralatan Kardiologi 6. Peralatan Gigi 7. Peralatan THT 8. Peralatan GU 9. Peralatan RSUP 10. Peralatan Neurology 11. Peralatan Obgyn 12. Peralatan Mata 13. Peralatan Orthopedi
14. Peralatan Kesehatan Fisik 15. Peralatan Radiologi
16. Peralatan Bedah
INSW
Alur Registrasi Online Alat Kesehatan dan PKRT
- Pembayaran e-payment - Upload bukti bayar
- Bukti bayar bawa ke loket
Memberikan tanda terima tetap
Evaluasi Kelas 1: 45 hari Evaluasi Kelas 2: 90 hari Evaluasi Kelas 3: 120 hari TD di pendaftar: 30 hari Evaluasi TD : 45 hari
PERMOHONAN BARU IZIN EDAR
ALAT KESEHATAN
1.
Persyaratan Permohonan Baru Izin Edar Alkes
FORM A. DATA ADMINISTRASI FORM D. PETUNJUK PENGGUNAAN FORM C. INFORMASI SPESIFIKASI DAN JAMINAN MUTU FORM B. INFORMASI PRODUK FORM E. POST MARKET EVALUATION 1. Sertifikat produksi 2. IPAK 3. LoA 4. CFS 5. Sertifikasi Kesesuaian terhadap Standar 6. Ringkasan Executive Summary 7. Standar dan Bukti Kesesuaian Standar 8. Surat Pernyataan Paten Merek/Surat Pelepasan Keagenan 9. Surat Pernyataan Keaslian Data 1. Uraian Alat 2. Deskripsi dan Fitur Alat Kesehatan 3. Tujuan Penggunaan 4. Indikasi 5. Petunjuk Penggunaan 6. Kontra Indikasi (jika ada) 7. Peringatan (jika ada) 8. Perhatian (jika ada) 9. Potensi Efek yang Tidak Diinginkan (jika ada) 10. Alternatif Terapi (jika ada) 11. Material 12. Informasi Pabrik (jika ada) 13. Proses Produksi 1. Contoh penandaan 2. Contoh penandaan pada alat dan kemasannya 3. IFU 4. Lot numbering System 5. Daftar aksesoris 1. Spesifikasi produk jadi 2. Informasi tambahan karakteristik alat 3. validasi steril 4. Studi Pre-klinis 5. Validasi piranti lunak 6. Hasil penelitian untuk alat yang mengandung material biologi 7. Bukti klinis (D) 8. Analisa resiko dari alat (D) 9. Hasil analisa resiko (D) 10. spesifikasi dan atau persyaratan bahan baku (D) 11. spesifikasi kemasan (produk diagnostik) 12. data hasil
analisis dan atau uji klinis
13. CoA produk jadi
1. Prosedur dan Form
Penanganan Komplain dan
Ijin Produksi
→ Mencantumkan jenis produk yang didaftar, masih berlaku
IPAK
→
Mencantumkan jenis alat kesehatan yang boleh
disalurkan sesuai kemampuan sarana
CFS (Certificate of Free Sale)
→ Jika tidak ada masa berlaku,
dianggap berlaku 5 tahun
Alkes :
→ Dikeluarkan oleh Ministry of Health
atau Department of Health atau FDA
sesuai peraturan negara setempat
→ Nama dan alamat pabrik/ legal
manufacturer nama dan tipe/ukuran
produk yang didaftar
→ Tidak dijual di negara pabrik : CFS
dari negara GHTF (IMDRF), dengan
mencantumkan manufacturing site
serta Nama dan alamat pabrik/ legal
manufacturer nama dan tipe/ukuran
produk yang didaftar
Bukan Alkes :
→ Surat Keterangan bukan Alkes dari
instansi berwenang (MOH atau FDA)
→ CFS dari Kementerian Perdagangan
atau Chamber of Commerce atau
LOA (Letter of Authorization)
Produk Impor :
→ Penunjukan minimal 2 tahun,
→ Legalisasi KBRI
→ Perusahaan yg merupakan
perusahaan cabang dr Principal (ex :
JnJ UK ke JnJ indonesia), maka masa
berlaku LoA dianggap 5 tahun dari
tanggal pembuatan LoA
→ Masa berlaku LoA > 5 tahun →
notifikasi, tanpa legalisasi KBRI
→
Principal hanya bisa menunjuk 1
distributor utk jenis alat dan merk yg
sama
→utk menghindari keagenan
ganda (double agent)
Produk Dalam Negeri :
→ Perjanjian Kerjasama yang
dilegalisasi oleh notaris
ISO 9001, ISO 13485, dan
CE bernomor
→ Dikeluarkan oleh : Notified Body
→ Nama dan alamat pabrik yang tercantum harus sama dengan yang tercantum pada CFS
→ Scope produk yang didaftar harus tercantum pada sertifikat
Executive Summary
Informasi lengkap mengenai
alat, sejarah pemasaran,tujuan
penggunaan dan indikasi,
keamanan/kinerja alat
Standar yang Digunakan
dan Bukti Kesesuaian
Standar
Dalam Negeri :
→ standar-standar yang
digunakan dalam pembuatan
alkes (SNI, ISO, CE, Farmakope,
ASTM)
→ Lampiran dokumen yang
digunakan
Impor :
→ Declaration of conformity
Surat Pernyataan Paten
Merek/ Pelepasan
Keagenan
→ Kesediaan penyalur untuk
melepaskan keagenan produk yang didaftarkan apabila ada pihak yang lebih berhak.
→ Bermaterai Rp. 6.000,-, ditandatangani oleh pimpinan perusahaan sesuai IPAK
→ Mencantumkan nama produk yang didaftar, maksimal 5 produk dalam 1 surat
Sertifikat Merek :
→ Dikeluarkan oleh Ditjen HAKI → Masih berlaku
→ Jika merek masih berupa
permohonan daftar, lampirkan surat pernyataan merek dan bersedia melepas merek jika ada yg lebih berhak,
bermaterai 6000
Jika merek milik orang lain :
Surat Pernyataan Keaslian Data
→Pernyataan bahwa data dan dokumen yang diisi dan
dilampirkan adalah benar dan sesuai asli
→ Bermaterai 6000, ditandatangani oleh pimpinan
perusahaan sesuai IPAK/sertifikat produksi
Uraian Alat
→ cara penggunaan, indikasi, material produk, kadaluarsa
Deskripsi dan Fitur Alat Kesehatan
Gambaran umum dari alat kesehatan
Tujuan Penggunaan
→ IFU/insert produk
Indikasi
→ kondisi dimana alat kesehatan dapat mendiagnosa, merawat, mencegah, atau meringankan
Petunjuk Penggunaan
→ Prosedur, metode, frekuensi, durasi, jumlah dan cara penyiapan yang harus diikuti untuk keamanan
Kontra Indikasi (jika ada)
→ Uraian umum dari penyakit atau kondisi dan populasi pasien yang tidak boleh menggunakan alat tersebut
Peringatan (jika ada)
→ Bahaya yang mungkin dapat terjadi
Perhatian (jika ada)
→ Hal-hal yang perlu diperhatikan untuk menjamin keamanan dan kemanfaatan alat dalam penggunaan
Potensi Efek yang Tidak Diinginkan
(jika ada)
→ efek samping yang ditimbulkan pada penggunaan alat kesehatan secara normal
Alternatif Terapi (jika ada)
→ Cara alternatif untuk mendiagnosa, merawat, mengobati atau meringankan penyakit yang merupakan tujuan
penggunaan alat tersebut
Material
→ Material penyusun alat kesehatan
Informasi Pabrik (jika ada)
→ Informasi mengenai legal manufacturer, pabrik tempat produksi
Proses Produksi
→ Meliputi : metode dan prosedur pembuatan yang memadai
Karakteristik fungsional dan
spesifikasi kinerja teknis alat
→ Spesifikasi teknis produk jadi
Informasi tambahan karakteristik
alat
→ Informasi tambahan produk
Studi Pre Klinis
→ uji biokompatbilitas
Hasil pengujian validasi piranti
lunak
Software validation report (hanya untuk open software)
→ Laporan hasil uji yang menunjukkan bahwa software bekerja sebagaimana yang dimaksudkan
Bukti klinis
→ Produk innovator : hasil uji klinis terpublikasi untuk produk yang didaftarkan
→ Produk me too : hasil studi literatur atau hasil uji klinis dari pabrik.
Analisa resiko dari alat
→ Berupa ringkasandari analisa resiko, berdasarkan standar yang diakui dan harus disesuaikan dengan tingkat kerumitan dan tingkat resiko alat
CoA produk jadi
→ Mencakup parameter yang diuji
terhadap alat kesehatan yang dihasilkan, spesifikasinya serta hasil uji yang jelas dan mencantumkan nilai spesifik tertentu. → IEC 60601 dari notified body, jika
pabrik meakukan uji kelistrikan sendiri harus melampirkan ISO 17025
→ Hasil uji fungsi alat/Performance test dari pabrikan
→ Sertifkat BAPETEN, jika alat merupakan alkes radiologi
Penandaan
→ Desain kemasan dengan mencantumkan : nama dan alamat pabrik,
nama dan alamat distributor, penempatan nomor registrasi
Contoh penandaan pada alat dan kemasannya
→ Penjelasan terhadap simbol-simbol yang terdapat pada kemasan/label
dan penjelasannya seperti batch no, serial nomor, dll
.
Petunjuk penggunaan, materi pelatihan & petunjuk
pemasangan dan pemeliharaan
→ Package insert/instruction for use
Kode produksi dan artinya
→ Kode produksi (lot/batch/serial number) dan arti kode tersebut dari
pabrik pembuat.
Asesoris (jika alat mempunyai asesoris)
→ cantumkan daftar asesoris, lampirkan data dukung /katalog produk,
pisahkan antara sparepart dan asesoris
→ untuk sparepart dibuat suratketerangan yang terpisah
Prosedur yang digunakan dan sistem pencatatan, penanganan
komplain, dll
→ Prosedur dan Form Komplain dan Recall
MATRIKS PERSYARATAN IZIN EDAR ALAT
KESEHATAN ELEKTROMEDIK
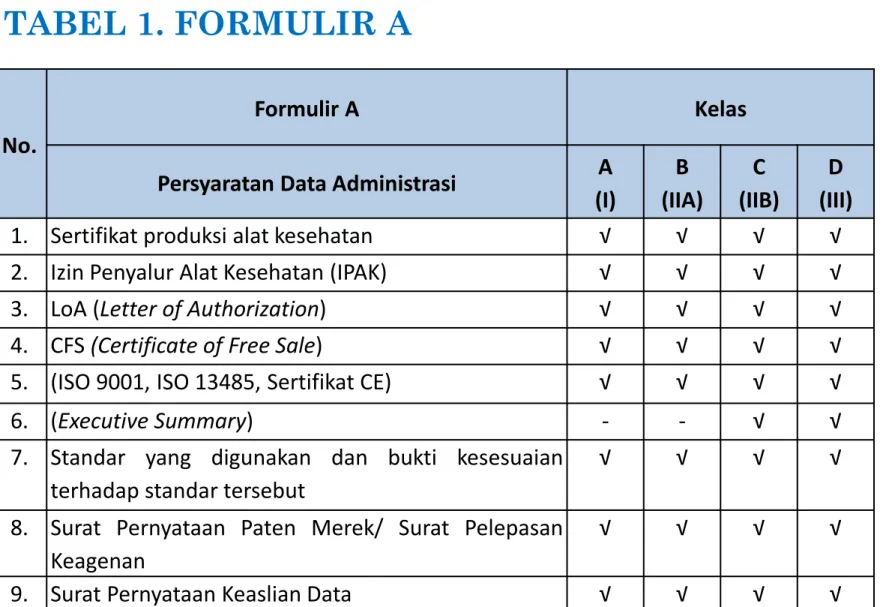
TABEL 1. FORMULIR A
No.
Formulir A Kelas
Persyaratan Data Administrasi A
(I) B (IIA) C (IIB) D (III)
1. Sertifikat produksi alat kesehatan √ √ √ √ 2. Izin Penyalur Alat Kesehatan (IPAK) √ √ √ √
3. LoA (Letter of Authorization) √ √ √ √
4. CFS (Certificate of Free Sale) √ √ √ √
5. (ISO 9001, ISO 13485, Sertifikat CE) √ √ √ √
6. (Executive Summary) - - √ √
7. Standar yang digunakan dan bukti kesesuaian terhadap standar tersebut
√ √ √ √
8. Surat Pernyataan Paten Merek/ Surat Pelepasan Keagenan
√ √ √ √
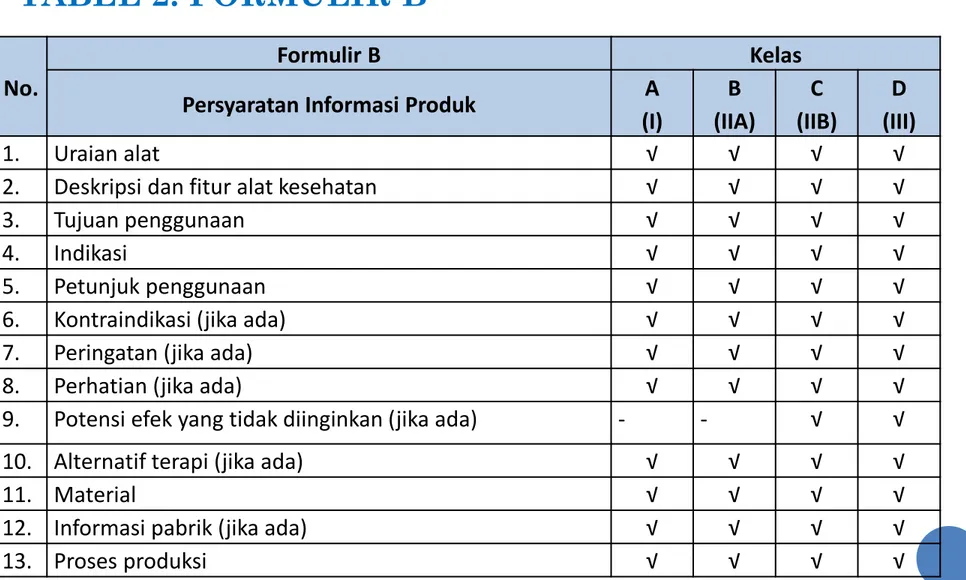
No.
Formulir B Kelas
Persyaratan Informasi Produk A
(I) B (IIA) C (IIB) D (III) 1. Uraian alat √ √ √ √
2. Deskripsi dan fitur alat kesehatan √ √ √ √
3. Tujuan penggunaan √ √ √ √
4. Indikasi √ √ √ √
5. Petunjuk penggunaan √ √ √ √
6. Kontraindikasi (jika ada) √ √ √ √
7. Peringatan (jika ada) √ √ √ √
8. Perhatian (jika ada) √ √ √ √
9. Potensi efek yang tidak diinginkan (jika ada) - - √ √
10. Alternatif terapi (jika ada) √ √ √ √
11. Material √ √ √ √
12. Informasi pabrik (jika ada) √ √ √ √
13. Proses produksi √ √ √ √
MATRIKS PERSYARATAN IZIN EDAR ALAT
KESEHATAN ELEKTROMEDIK
MATRIKS PERSYARATAN IZIN EDAR ALAT
KESEHATAN ELEKTROMEDIK
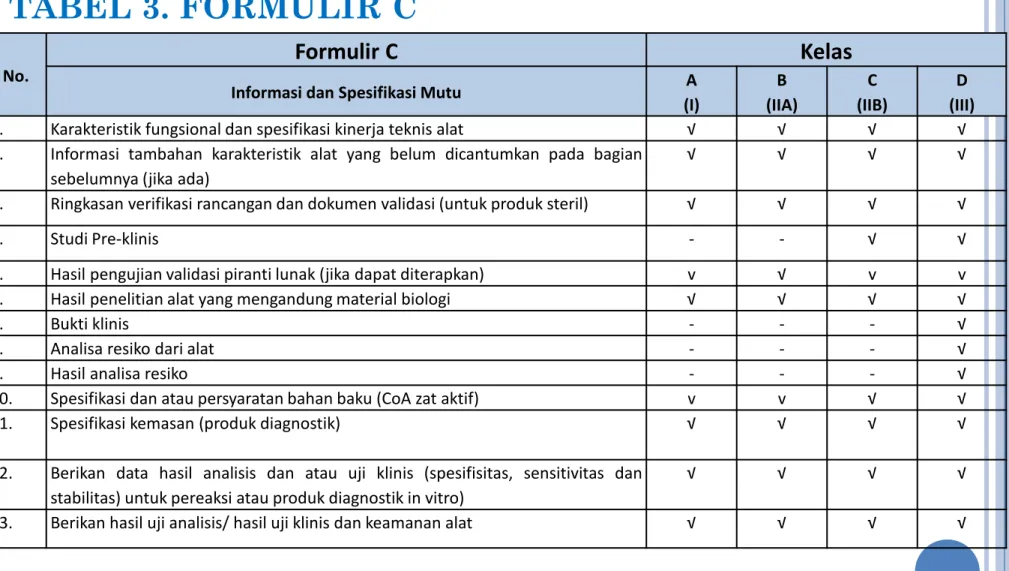
TABEL 3. FORMULIR C
No.
Formulir C Kelas
Informasi dan Spesifikasi Mutu A (I) B (IIA) C (IIB) D (III)
1. Karakteristik fungsional dan spesifikasi kinerja teknis alat √ √ √ √ 2. Informasi tambahan karakteristik alat yang belum dicantumkan pada bagian
sebelumnya (jika ada)
√ √ √ √ 3. Ringkasan verifikasi rancangan dan dokumen validasi (untuk produk steril) √ √ √ √ 4. Studi Pre-klinis - - √ √ 5. Hasil pengujian validasi piranti lunak (jika dapat diterapkan) v √ v v 6. Hasil penelitian alat yang mengandung material biologi √ √ √ √ 7. Bukti klinis - - - √ 8. Analisa resiko dari alat - - - √ 9. Hasil analisa resiko - - - √ 10. Spesifikasi dan atau persyaratan bahan baku (CoA zat aktif) v v √ √ 11. Spesifikasi kemasan (produk diagnostik) √ √ √ √ 12. Berikan data hasil analisis dan atau uji klinis (spesifisitas, sensitivitas dan
stabilitas) untuk pereaksi atau produk diagnostik in vitro)
√ √ √ √ 13. Berikan hasil uji analisis/ hasil uji klinis dan keamanan alat √ √ √ √
MATRIKS PERSYARATAN IZIN EDAR ALAT
KESEHATAN ELEKTROMEDIK
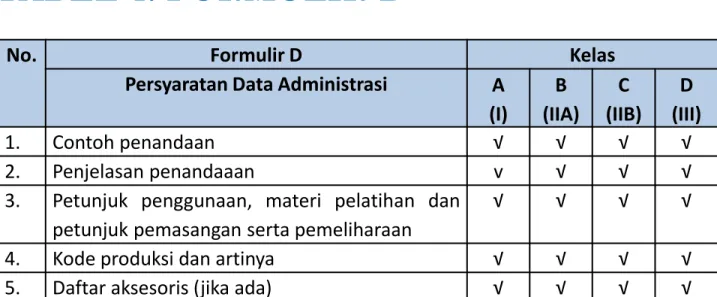
TABEL 4. FORMULIR D
No. Formulir D Kelas
Persyaratan Data Administrasi A (I) B (IIA) C (IIB) D (III) 1. Contoh penandaan √ √ √ √ 2. Penjelasan penandaaan v √ √ √ 3. Petunjuk penggunaan, materi pelatihan dan
petunjuk pemasangan serta pemeliharaan
√ √ √ √ 4. Kode produksi dan artinya √ √ √ √ 5. Daftar aksesoris (jika ada) √ √ √ √
MATRIKS PERSYARATAN IZIN EDAR ALAT
KESEHATAN ELEKTROMEDIK
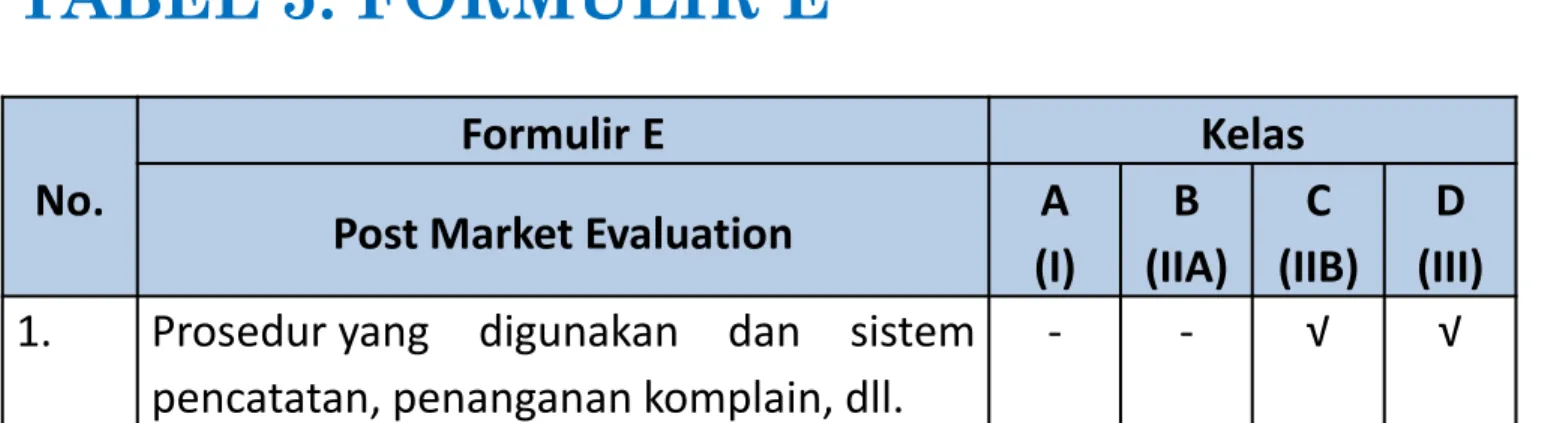
TABEL 5. FORMULIR E
No.
Formulir E Kelas
Post Market Evaluation A
(I) B (IIA) C (IIB) D (III)
1. Prosedur yang digunakan dan sistem pencatatan, penanganan komplain, dll.
PERPANJANGAN DAN PERUBAHAN IZIN EDAR
ALAT KESEHATAN
Ketentuan Umum
1. Dilakukan secara sistem online dengan memilih menu
perpanjangan/perubahan
2. Perpanjangan izin edar sudah harus dilakukan 6 bulan sebelum
masa berlaku izin edar habis
3. Perubahan izin edar yang diperbolehkan adalah ukuran, kemasan,
penandaan, NPWP, nama prinsipal/pemberi penunjukan tanpa
merubah pabrik
4. Masa berlaku LoA minimal 2 tahun dan maksimal 5 tahun
5. Masa berlaku perubahan izin edar sesuai izin edar lama
6. Izin edar yang telah habis masa berlakunya tidak dapat diajukan
sebagai perpanjangan dan pemohon harus mengajukan permohonan
baru
7. Perubahan izin edar yang diberlakukan sebagai daftar baru, antara
lain:
a. Perubahan nama produk
b. Perubahan alamat pabrik
c. Perubahan alamat distributor
d. Perubahan spesifikasi alat
e. Perubahan/penambahan bahan baku/formula
f. Pengambilalihan pabrik/akuisisi
Persyaratan Perpanjangan
Izin Edar Alat Kesehatan
No Persyaratan Impor
(AKL) Lokal (AKD)
1 Surat permohonan √ √
2 Izin edar lama + lampiran (jika ada) √ √ 3 Penandaan Lama dengan stempel Kemkes √ √ 4 Surat Kuasa terbaru sebagai sole agent/sole distributor yang
dilegalisasi KBRI
•Harus mencantumkan nama dagang & nama jenis produk yang diizinkan diageni
•Masa berlaku minimal 2 tahun
•Bisa berasal dari: pabrik asal/prinsipal atau representatif/kantor perwakilan, lengkapi dengan surat keterangan
hubungan/kerjasama/penunjukan antara pabrik asal atau prinsipal dengan representatif
•Distributor agreement diperlukan jika LoA kurang 2 tahun/tidak ada masa berlaku
•Jika LoA tidak ada masa berlaku maka izin edar diberikan 5 tahun Istilah yang diterima dalam surat penunjukan:
•Sole agent, exclusive distributor, sole distributor
•Representative (perwakilan/cabang), distributor, dan Non Exclusive distributor harus dilengkapi surat kuasa mendaftar dari
prinsipal/pabrik dan menyebutkan nama produk
Persyaratan Perpanjangan
Izin Edar Alat Kesehatan
No Persyaratan Impor
(AKL) Lokal (AKD) 5 Izin penyalur alat kesehatan √ √
6 Sertifikat Produksi - √
7 Certificate of Free Sale. Menerangkan telah beredar di negara asal
pabrik √ -
8 Surat pernyataan tidak ada Perubahan data izin edar, materai 6000. √ √ 9 Penandaan baru sesuai persyaratan rangkap 2 berwarna √ √ 10 Surat pernyataan telah memberikan laporan produksi dan/atau
distribusi secara berkala ke kementerian Kesehatan, bermaterai Rp. 6000
√ √
11 Laporan Kejadian tidak diinginkan (adverse event) terhadap penggunaan alat selama diperedaran dan penanganan yang telah dilakukan
√ √
12 Surat pernyataan setuju memenuhi persyaratan keamanan mutu dan manfaat dan bersedia ditolak apabila dokumen/data yang diupload adalah tidak sesuai asli dan atau berkas tidak memenuhi
persyaratan. Surat pernyataan ditanda tangani oleh
direktur/penanggung jawab teknis yang tercantum pada sertifikat produksi bermaterai Rp. 6000.
Persyaratan Perubahan Izin Edar Alat Kesehatan
(kemasan, Ukuran, Penandaan dan NPWP)
No Persyaratan Impor
(AKL) Lokal (AKD)
1 Surat permohonan perubahan izin edar alat kesehatan √ √ 2 Izin edar lama lengkap dengan lampiran (jika ada) √ √ 3 Penandaan lama yang telah disetujui dan disahkan
kementerian Kesehatan
√ √
4 Izin penyalur alat kesehatan yang dikeluarkan oleh Menteri kesehatan Cq-Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan dan masih berlaku (Ket. Lain IPAK= diatas)
√ √
5 Sertifikat produksi alat kesehatan yang dikeluarkan oleh Menteri kesehatan Cq-Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan dan masih berlaku (Ket. Lain Sertifikat produksi=diatas)
- √
6 Certificate of Free Sale (CFS) jika ada perubahan ukuran a.Menerangkan bahwa nama dan tipe alat kesehatan telah diproduksi/didaftar (nama pabrik) dan beredar di negara asal pabrik/legal manufacturer
b.Dikeluarkan oleh kementerian kesehatan setempat atau instansi berwenang di negara asal
c.Masih berlaku
Persyaratan Perubahan Izin Edar Alat Kesehatan
(kemasan, Ukuran, Penandaan dan NPWP)
No Persyaratan Impor
(AKL) Lokal (AKD)
7 Surat pernyataan tidak ada perubahan selain perubahan yang dimaksud dalam surat permohonan bermaterai Rp. 6000.
√ √
8 Penandaan baru sesuai persyaratan rangkap 2 berwarna √ √ 9 Surat pernyataan telah memberikan laporan produksi
dan/atau distribusi secara berkala ke kementerian Kesehatan, bermaterai Rp. 6000
√ √
10 Laporan Kejadian tidak diinginkan (adverse event) terhadap penggunaan alat selama diperedaran dan penanganan yang telah dilakukan
√ √
11 Surat pernyataan setuju memenuhi persyaratan keamanan mutu dan manfaat dan bersedia ditolak apabila
dokumen/data yang diupload adalah tidak sesuai asli dan atau berkas tidak memenuhi persyaratan. Surat pernyataan ditanda tangani oleh direktur/penanggung jawab teknis yang tercantum pada sertifikat produksi bermaterai Rp. 6000.