Sintesis Bahan Multiferoik BiFeO3 dengan Metode Kopresipitasi
Nurul Fitriyah a, Darmintoa, Malik Anjelh Baqiyaa
a
Jurusan Fisika , Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember , Surabaya 60111 Indonesia
email : beauty.safitri@gmail.com Abstrak
Metode kopresipitasi sederhana dilakukan untuk mensintesis serbuk multiferoik BiFeO3 berukuran nano. eksperimen dilakukan dengan mengontrol pH level dan lama
pemanasan dari temperatur kalsinasi. Metodologi percobaan adalah dengan menyiapkan pasir besi yang dilarutkan dalam larutan HCl 12 M, kemudian dicampur dengan larutan Bi dan ditambahkan larutan NH4OH secara perlahan sampai memperoleh endapan
BiFeO3 berwarna coklat. Karakteristik dari serbuk BiFeO3 diamati dengan
XRD,DTA-TGA dan SEM. Kelebihan sedikit Bi kontent memegang peranan penting selama proses sintesis. Fasa BiFeO3 dapat disintesis menggunakan metode kopresipitasi dengan bahan
dasar pasir besi. ukuran butir dari serbuk BiFeO3 sekitar 14 Amstrong hingga 2012,01
angstrong (1,4 nm- 201nm) yang diperoleh dari penggunaan rumus Scherer. Kata kunci: metode kopresipitasi , BiFeO3,XRD,DTA,SEM
I . PENDAHULUAN
Bahan multiferoik belakangan ini
menjadi topik penelitian para ahli yang intensif. Salah satu kajian tentang bahan magnetik adalah menghasilkan bahan multiferoik, yang pemanfaatannya sangat diharapkan dalam dunia industri, misalnya pemanfaatan untuk sebuah memori serta digunakan untuk filter, osilator dan lain-lain. Selain memiliki aplikasi potensial untuk bahan-bahan yang berbasis magneto dielektrik , bahan multiferoik sangat menarik untuk dikaji, baik dari ilmu pengetahuan maupun teknologi(Hua et al,2010).
Sejauh ini ada sejumlah senyawa yang menunjukan sifat multiferoik. Pertama kali bahan multiferoik ditemukan adalah berupa bahan feromagnetik Ni3B7O13I (Nickel Iodone
Baracite) (Hill et al,2004). Selanjutnya ditemukan bahan multiferoik seperti (1-x)Pb(Fe1/3W1/3)O xPb(Mg1/2W1/2)O3,
Pb(CoW)O7, BiFeO3, YMnO3 dan
RMn2O5 (Hill et al, 2004) serta RMn2O5
(Hill et al, 2004). Penelitian tentang bahan multiferoik akhir-akhir ini serta
terfokus untuk aplikasi dalam rangkaian elektronika(Hua et al,2010).
Fasa tunggal BiFeO3 yang
diperoleh dari sintesis akan menjadi bahan yang memiliki keunggulan lebih dalam aplikasi di bidang bahan kedepan (Wang et al, 2003). Penggunaan BiFeO3
tidak lepas dari beberapa permasalahan diantaranya bagaimana mensintesis bahan
multiferoik BiFeO3 dengan sedikit
pengotor dan merupakan fasa tunggal yang berukuran nanopartikel (Kumar et al,2000). Sintesis fasa tunggal multiferoik BiFeO3 dapat mengalami kegagalan
karena adanya impuritas -impuritas dalam sampel yang semakin meningkat. Banyaknya impuritas ini disebabkan oleh beberapa hal, pertama saat evaporasi atom Bi akan mudah terbentuk jika suhu dalam pembuatan senyawa dari garam bismuth semakin rendah sehingga senywa Bi2O3 akan terbentuk kembali di
akhir proses (Clark et all,2009 and Ederer et all,2005).
Penelitian tugas akhir ini dilakukan untuk mengkaji lebih jauh lagi tentang
bahan multiferoik BiFeO3. Berdasarkan
latar belakang diatas penelitian ini bertujuan untuk mensintesis dan mengkarakterisasi bahan multiferoik
BiFeO3 menggunakan metode
kopresipitasi.
II. TINJAUAN PUSTAKA 2.1 Pasir Besi di Indonesia
Di Indonesia, pasir besi adalah salah satu material tambang yang banyak digunakan dan mudah ditambang. Pasir besi biasanya ditambang di pesisir pantai dan sungai-sungai di bawah gunung berapi. Melimpahnya kandungan pasir di Indonesia membuat bahan pasir sangat murah, bahkan di Indonesia dikenal sebagai negara pengekspor pasir. Gambar 2.1 merupakan salah satu tempat penambangan pasir besi di Kabupaten Lumajang jawa Timur Indonesia.
Pemanfaatan pasir residu dari proses pemisahannya sebagai bahan bangunan tidak mengurangi nilai kekuatan beton secara signifikan , namun justru menambah keunggulan beton dari proses ini yaitu beton bersifat lebih tahan korosi karena memiliki laju korosi yang rendah.
Tabel 2.1 Kandungan Fasa Magnetit di Pantai Bambang, Lumajang
(Sumber: Fitriyah, 2010)
2.2 Material Magnet
2.2.1. Hematite (Fe2O3)
Fe2O3 termasuk dalam besi oksida.
Mineral ini mempunyai warna abu-abu (grey shade), putih dan coklat. Mineral ini struktur kristalnya isometrik.Fasa-fasa pada (Fe2O3) (www.wikipedia.com)
antara lain :
Fasa alpha
α-Fe2O3 memiliki struktur
rhombohedral. Itu terjadi secara alami sebagai mineral hematit yang merupakan hasil utama dari penambangan, dan memiliki sifat antiferomagnetic hingga mencapai suhu kritis 950 K. Itu mudah dibuat menggunakan thermal decomposition dan presipitasi pada fasa cair. Sifat magnetiknya bergantung pada beberapa factor yaitu tekanan, ukuran partikel, dan intensitas medan magnetik.
Fasa beta
β-Fe2O3 memiliki struktur kristal
FCC, bersifat metastabil, pada suhu 500oC berubah menjadi fasa alpha. Dapat dibuat dengan mereduksi hematite dengan menggunakan karbon, pyrolysis dari larutan besi (III) klorida, atau thermal decompotition dari besi (III) sulfat.
Fasa Gamma
γ- Fe2O3 memiliki struktur kristal
kubik, bersifat metastabil, berubah menjadi fasa alpha pada temperatur yang tinggi. Di alam berbentuk sebagai maghemite. Bersifat ferrimagnetik, dan pada ukuran partikel yang ultra halus yang lebih kecil daripada 10 nm bersifat superparamagnetik.
Fasa Epsilon
ε- Fe2O3 memiliki struktur kristal
rhombik, menunjukkan sifat antara fasa alpha dan gamma, sehingga tidak dapat dibuat dari bentuk murni; itu selalu merupakan campuran antara fasa alpha dan fasa gamma. Bahan dengan perbandingan fasa epsilon yang tinggi dapat dibuat dengan thermal transformation dari fasa gamma. Fasa epsilon bersifat metastabil, berubah menjadi fasa alpha pada suhu antara 500 -750oC.
Fasa lainnya
No. Kandungan Alami (%)
1 Fe2O3 13.628
2 Fe3O4 33.878
Pada tekanan yang tinggi, membentuk amorf .
Tabel 2.2 Distribusi Momen Magnetik Spin pada Ion Fe2+ dan Fe3+ dalam Satu
Unit Sel Fe3O4
Gambar 2.1 Struktur Kristal Hematit Struktur kristal hematit (Fe2O3)
ditunjukkan seperti Gambar 2.3 di atas. Berdasarkan Gambar 2.2 struktur Kristal hematit sama dengan struktur kristal corundum yaitu Trigonal R dengan space group R-3c dan tergolong dalam sistem kristal hexagonal.
2.2.2. Bahan Ferimagnet
Bahan Ferimagnet merupakan bahan magnetit dengan sifat kemagnetan berada di antara bahan feromagnet dan antiferomagnet. Material ini memiliki struktur spinel seperti pada MgAl2O4.
Ferimagnet memiliki interaksi lemah terhadap medan magnet
. Hal ini disebabkan karena pada bahan ferimagnet memiliki momen magnetik yang berlawanan tetapi besarnya tidak sama, sehingga sifat magnetnya merupakan resultan momen magnetnya.
( sumber:Callister,1989)
2.3 Multiferoik BiFeO3
Multiferoik merupakan bahan yang menarik karena memiliki sifat magnet dan listrik sekaligus. Penambahan atom dopan ke dalam bahan multiferoik sangat berpengaruh pada sifat fisis yang dimiliki bahan tersebut, diantaranya adalah konstanta dielektrik. Diagram pada Gambar 2.2 di bawah ini menunjukkan kombinasi bahan feroelektrik dan feromagnet akan membentuk bahan multiferoik. Bahan multiferoik akan memiliki sifat listrik dan sifat magnet sekaligus.
Sifat magnetik terjadi karena adanya interaksi pertukaran antara dipol magnetik, yang berasal dari kulit orbital berisi elektron. Sifat elektrik terjadi akibat adanya dipol listrik lokal. Sifat elastis merupakan sifat hasil perpindahan atom karena strain. Terjadinya simultan magnet dan listrik sangat menarik karena menggabungkan sifat yang bisa dimanfaatkan untuk penyimpanan informasi, pengolahan, dan transmisi. Hal ini memungkinkan kedua medan magnet dan medan listrik untuk berinteraksi
Kation Ukuran Kisi Oktahedral Ukuran Kisi Tetrahedra l Momen Magnet Total Fe3+ Fe3+ _ Saling menghilangkan
dengan magnet dan listrik (Schmid,1994).
2.3.1 Preparasi dan Karakterisasi
Multiferoik BiFeO3
Gambar 2.2 di bawah ini
merupakan bentuk pola difraksi multiferoik BiFeO3 (De-Chang et al
,2009) yang dihasilkan dari sintesis dengan metode sol-gel. Pola difraksi ini merupakan bentuk pola difraksi dengan variasi suhu kalsinasi dari 450-700 oC. Terlihat dengan jelas puncak – puncak multiferoik BiFeO3 mulai terbentuk pada
rentang 20 derajat hingga 80 derajat (2θ).
Gambar 2.2 Pola difraksi sinar-X (XRD) bahan multiferoik BiFeO3 dengan variasi
suhu kalsinasi dengan metode sol-gel (sumber : De-Chang et al ,2009)
2.3.2 Struktur Kristal BiFeO3
Bismut ferit memiliki struktur perovskite rhombohedral terdistorsi dengan grup ruang R3c. Ion – ion Bi dan O secara bersama membentuk bangunan cubic close packing dengan ion Fe menempati posisi interstisial oktahedron.
Telah banyak penelitian yang
mengungkapkan bentuk kristal perovskite baik dalam bentuk kubik
maupun pseudo kubik. Namun , seiiring berjalannya waktu menuntut kesimetrisan dalam pengukuran sehingga ditemukan kesulitan untuk menetapkan secara pasti
struktur kristal dari bahan berstruktur perovskite karena semua hasil pengukuran dari sebuah eksperiment itu relatif dan bergantung pada keakuratan teknik photograp X-Ray , dan terjadilah distorsi struktur kristal yang besar kecilnya tergantung ukuran pada senyawa tersebut(Garcia et al ,1992) .
Distorsi yang lebih dikenal dan memungkinkan untuk terjadinya distorsi ini yaitu menjadi stuktur rhombohedral dengan space group R 3 c. Bentuk strukturnya ditunjukkan pada Gambar 2.3 . Ukuran atom yang bertindak sebagai kation akan mempengaruhi bentuk distorsi Kristal.
Gambar 2.3 Unit sel perovskite rhombohedral R3c.Bola berwarna biru
menunjukkan kation , bola kuning sebagai kation dan bola merah sebgai
atom oksigen (sumber : Levy, 2005)
2.3.3 Diagram Fasa Bi2O3-Fe2O3
Diagram fasa Bi2O3-Fe2O3 dapat
dijadikan sebagai acuan/referensi dalam melakukan sintesis multiferoik BiFeO3.
Gambar 2.12 merupakan diagram fasa Bi2O3-Fe2O3 , berdasarkan diagram
tersebut fasa α-BiFeO3 terbentuk pada
saat konsentrasi Bi2O3 50% dan Fe2O3
β-BiFeO3 terbentuk pada suhu sinter di atas
825 0C dan di bawah 9250 C (Palai et al,2008).
Diagram fasa binary pseudo antara serbuk Bi2O3 dengan serbuk Fe2O3 juga
diungkapkan dalam penelitian yang dilakukan oleh Jua et al(2010) dengan
mengembangkannya dan membandingkan antara hasil eksperimen
dengan referensi yang sudah ada , diagram fasa tesebut ditunjukkan pada Gambar 2.13
Gambar 2.14 Diagram fasa multiferoik BiFeO3
(sumber: Palai et al,2008)
III . METODOLOGI
Bahan utama yang digunakan dalam sintesa multiferoik BiFeO3 adalah
pasir besi dari Lumajang sebagai raw material pembuatan Fe2O3 , FeCl3.6H2O,
serbuk Bi2O3 Aldrich 99,9% , larutan HCl
37% dan NH4OH 80% dipakai dalam
sintesa dengan metode kopresipitasi. Aquades DM digunakan sebagai bahan pencuci dalam proses kopresipitasi .Peralatan yang digunakan dalam penelitian ini antara lain adalah saringan, magnet permanen, gelas beker ukuran 50, 100, 250 dan500 ml; gelas ukur 5,10 dan 100 ml, pipet,pipet ukur 1 ml,labu ukur 100 ml, spatula logam dan kaca, corong, cawan keramik, mortar, aluminium foil, thermometer, kertas saring, timbangan
analitik, furnace dan magnetik stirrer.
Sedangkan untuk karakterisasi fasa
dipakai difraktometer sinar-X (XRD), dan SEM untuk mengamati morfologi ukuran parikelnya dan DTA untuk mengetahui sifat feroelektrik dengan menganalisis grafik heat flow.
Proses tahapan sintesis dengan metode kopresipitasi akan dipaparkan dalam penjelasan dibawah ini. Pertama larutan hasil reaksi dari proses pelarutan pasir besi dengan HCl dicampur dengan larutan Bi2O3 yang telah larut dalam HCl
( berdasarkan stoikiometri perbandingan mol Fe:Bi adalah 1:1). Larutan hasil pencampuran distirer selama 45 – 1 jam dengan kecepatan 700 rpm kemudian ditambahkan HCl secara perlahan hingga pH = 1. Larutan hasil reaksi ditambahkan NH4OH pekat secara perlahan dengan
volume tertentu hingga mencapai pH endapan yang diinginkan misalkan pH=9. Larutan distirer selama 30 menit pada suhu 50 C dengan kecepatan 600-700 rpm. Endapan yang terbentuk berwarna coklat. Warna endapan setiap sampel bergantung pH nya. Larutan hasil reaksi dicuci hingga mencapai pH = 7 dan setelah pH netral endapan disaring dan dikeringkan secara alami.
IV . HASIL DAN PEMBAHASAN Pada penelitian sebelumnya telah
dilaporkan masing-masing keunggulan dari teknik preparasi diatas. Untuk mendapatkan fasa tunggal BiFeO3 harus
meninjau beberapa aspek antara lain parameter-parameter langsung dalam proses sintesis seperti halnya pH, kecepatan pemanasan ( rapid sintering), kecepatan pendinginan (cooling rate), variasi suhu sintering atau kalsinasi ,konsentrasi dan variasi holding time. Dari beberapa metode diatas, metode kopresipitasi merupakan metode yang sangat sederhana dan mudah dilakukan
pada suhu ruang. Impuritas dalam setiap percobaan tidak dapat dihindari karena transformasi fasa kinetik pada sistem Bi2O3-Fe2O3 sangat memungkinkan
munculnya impuritas selama proses(Felicia et al, 2010).
4.2. Analisis Termal (Thermal Analysis)
Analisis termal dilakukan untuk mengetahui karakteristik termal dari
sampel secara fisis berdasarkan
termodinakmiknya baik meliputi reaksi ekso dan reaksi endo yang dialami. Deferensial Thermal analyzer digunakan untuk uji termal pada sampel.
Penentuan suhu pemanasan didasarkan pada hasil uji DTA-TGA seperti ditunjukkan pada Gambar 4.2. Berdasarkan hasil analisis pola difraksi pada serbuk BiFeO3 yang disintesis
dengan metode kopresipitasi,
disimpulkan bahwa fasa BiFeO3 belum
terbentuk sehingga perlu diberikan heat treatment . Dari Gambar 4.1 terlihat
bahwa pada suhu 7500 C terjadi
penurunan masa .
Gambar 4.1 Kurva DTA-TGA serbuk BiFeO3_9
Gambar 4.2 menunjukkan kurva analisis termal pada sampel yang disintesis dari bahan dasar pasir besi dengan pH pengendapan sama dengan 10. Kurva yang berwarna merah
menunjukkan Differential Scanning
Calorimetry(DSC) dan kurva yang
berwarna hitam adalah Thermogravimetry. Kurva DSC memberikan informasi tentang aliran panas (heat flow) yang terjadi pada serbuk serta kaitannya dengan reaksi eksoterm dan endoterm.
4.3. Pengaruh Variasi pH (Effect of
pH)
Pada Gambar 4.2 dapat diketahui bahwa pada serbuk BiFeO3(8) terkandung 4 fasa antara lain fasa Hematit (Fe2O3) dengan
PDF No 01-1053, fasa Bismoclite (BiOCl) dengan PDF No 06-0249, fasa Bismuth Iron Oxide (Bi3.43Fe0.57O6)
dengan PDF No 43-0184, dan fasa Bismuth Oxide (Bi2O3). Fasa BiFeO3
belum terbentuk pada serbuk diatas, hal ini sesuai dengan diagram fasa Bi2O3
-Fe2O3 bahwa temperatur curie
ferroelektrik tinggi terjadi pada suhu Tc=830 0C (Felicia et al, 2010) sehingga
Gambar 4.2 Perbandingan pola difraksi Sinar-X serbuk BFO
dengan variasi pH
Seperti pada Gambar 4.2 terlihat sebagian besar posisi 2 theta untuk masing-masing sampel berada pada 2 theta yang sama ,ini menunjukkan bahwa fasa yang muncul dominan sama. Namun perbedaannya adalah intensitas dan ukuran partikel yang terbentuk(sub bab 4.4). Pengaruh pH pada serbuk dapat dihubungkan dengan evolusi dan
reaktifitas permukaan partikel serbuk (Hua et al,2010).
Dengan analisis termal dari hasil DTA-DTG ditentukan suhu pemanasan serbuk BiFeO3 sebesar 750oC. Semua sampel
yang dipreparasi dengan variasi pH yang berbeda diberikan perlakuan panas pada suhu yang sama dan holding time yang sama pula. Seperti halnya pada serbuk sebelum dipanaskan , pola difraksi dari sampel yang telah diberikan perlakuan panas selanjutnya disearch-match untuk mengetahui fasa yang terkandung.
Gambar 4.3 Perbandingan Pola difraksi Sinar-X serbuk BiFeO3 sampel 6,7,8 dan
9 dipanaskan pada T=750 oC selama 1 jam
Hasil analisis search-macth pada Gambar
4.3 menunjukkan bahwa Fasa BiFeO3
sudah mulai terbentuk di semua sampel namun jumlah kompsisinya berbeda. Fasa yang teridentifikasi selain BiFeO3 antara
lain Bi2O3 , Fe2O3 dan fasa sekunder
BFO yaitu Bi2Fe4O9. Ketiga impuritas ini
lazim muncul pada setiap sintesis
multiferoik BiFeO3 dengan metode
apapun, dan sulit dihindari ( Hua et al,2010;Yuan et al,2006).
4.4. Pengaruh Waktu Pemanasan (
Effects of Holding Time ) terhadap
Komposisi Fasa BiFeO3
Carvalho dan Tavares pada tahun 2008 melakukan penelitian tentang
kestabilan termodinamik multiferoik BiFeO3 yang disintesis dengan metode
sol-gel mengemukakan bahwa fasa
BiFeO3 mengalami dekomposisi fasa
selama holding time berlangsung sehingga komposisinya akan berubah. Berdasarkan hasil penelitiannya
komposisi BiFeO3 akan menurun dan
komposisi Bi2Fe4O9 akan meningkat
seiring semakin besar holding time. Serbuk BiFeO3 yang dipreparasi
menggunakan metode kopresipitasi dan diberi perlakuan panas pada suhu 750o C dengan variasi holding time 1 jam , 3 jam dan 5 jam menunjukkan perubahan jumlah komposisi fasa BiFeO3 dan
impuritasnya. Gambar 4.4 merupakan pola difraksi dari sampel 6 yang disintesis dari pasir besi dan dipanaskan 750oC dengan variasi holding time.
Gambar 4.4 Pola XRD BIFeO3_6 yang
disintesis
dari pasir besi dipanaskan 750oC dengan variasi holding time
Kenaikan jumlah komposisi impuritas dalam hal ini Bi2O3 disebabkan
oleh beberapa hal, diantaranya: Pertama, evaporasi komponen Bi terjadi sangat mudah terbentuk diawal sintesis karena suhu dekomposisi garam bismuth sangat
rendah sehingga komponen Bi2O3
muncul kembali di akhir produksi sebagai impuritas . Kedua , elektron valensi dari ion Fe yang dipengaruhi oleh oksigen dan
atmosfer sehingga dengan mudahnya bereaksi menimbulkan muatan Fe2+ yang akan membentuk Fe2O3. Ketiga , area
syinthesis fasa BiFeO3 berdasarkan
diagram fasa sangat beda tipis sekali dari pint thermodinamik , dimana ada dua impuritas Bi2Fe4O9 dan Bi25FeO39 yang
biasanya merupakan fasa subtitusi sebelum membentuk fasa BiFeO3( Hua et
al, 2010).
Gambar 4.5 Grafik hungan antara holding time
dengan komposisi fasa BiFeO3 pada
sampel 6 dipanaskan 750 C
Ada perbedaan antara sampel 6 dan sampel 7 terkait pola grafik hubungan holding time dengan komposisi fasa BiFeO3. Pada Gambar 4.5 pada sampel 6
seiiring bertambahnya holding time komposisi fasa BiFeO3 meningkat dan
Bi2Fe4O9 menurun.
Gambar 4.6 Grafik hungan antara holding timedengan komposisi fasa BiFeO3 pada sampel 7(FeCl3.6H2O)
dipanaskan 750 C
Sedangkan Gambar 4.6 untuk sampel 7 komposisi BFO meningkat namun turun pada saat holding 5 jam. Jika kedua grafik ini dibandingkan dengan hasil penelitian yang dilakukan Calvaharo dan Tevares bisa dikatakan sesuai karena rentang range holding time yang dilakukan oleh Calvaharo sangat besar, sehingga penurunan komposisi secara signifikan dapat teramati dengan jelas. Beda halnya dengan ekperimen ini yang hanya mengambil rentang holding time yang sangat kecil.
4.6. Identifikasi Ukuran Partikel
BiFeO3
4.6.1. Analisis Hasil Scanning
Electron Microscope (SEM)
Partikel BiFeO3 bersifat aglomerasi
sehingga kristalnya menggumpal. Ukuran yang teramati berkisar 10 µm Jika material yang bersifat isolator dikarakterisasi dengan SEM, maka hasilnya akan kabur dan mungkin akan hitam. Hal ini dapat dilakukan dengan melapisi isolator tersebut dengan logam.
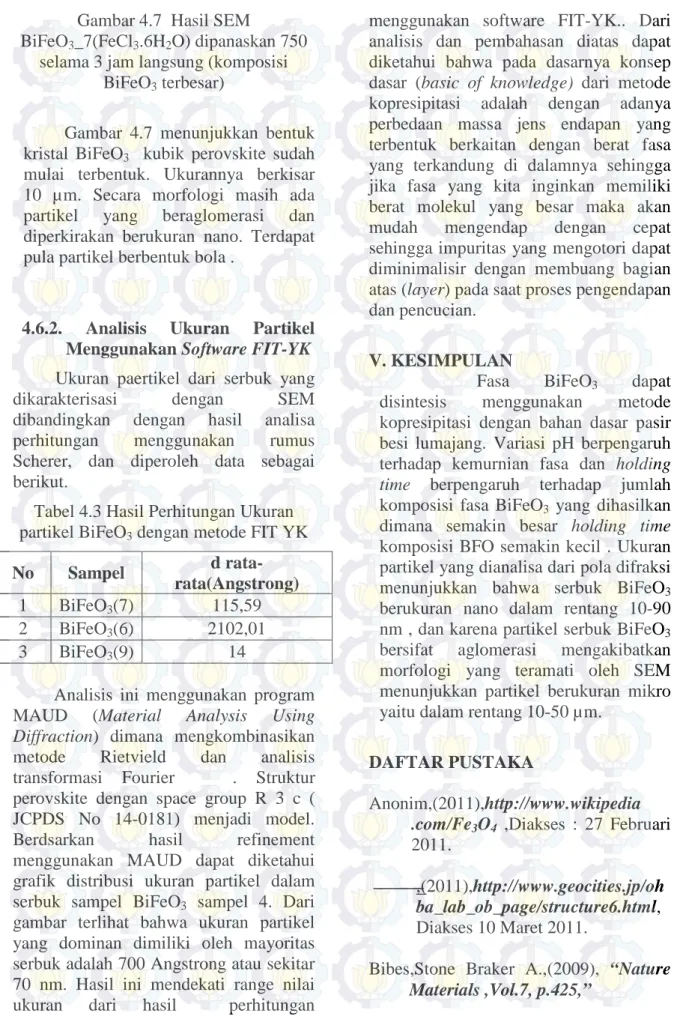
Gambar 4.7 Hasil SEM
BiFeO3_7(FeCl3.6H2O) dipanaskan 750
selama 3 jam langsung (komposisi BiFeO3 terbesar)
Gambar 4.7 menunjukkan bentuk kristal BiFeO3 kubik perovskite sudah
mulai terbentuk. Ukurannya berkisar 10 µm. Secara morfologi masih ada partikel yang beraglomerasi dan diperkirakan berukuran nano. Terdapat pula partikel berbentuk bola .
4.6.2. Analisis Ukuran Partikel Menggunakan Software FIT-YK
Ukuran paertikel dari serbuk yang dikarakterisasi dengan SEM dibandingkan dengan hasil analisa perhitungan menggunakan rumus Scherer, dan diperoleh data sebagai berikut.
Tabel 4.3 Hasil Perhitungan Ukuran partikel BiFeO3 dengan metode FIT YK
No Sampel d
rata-rata(Angstrong)
1 BiFeO3(7) 115,59
2 BiFeO3(6) 2102,01
3 BiFeO3(9) 14
Analisis ini menggunakan program MAUD (Material Analysis Using Diffraction) dimana mengkombinasikan metode Rietvield dan analisis transformasi Fourier . Struktur perovskite dengan space group R 3 c ( JCPDS No 14-0181) menjadi model. Berdsarkan hasil refinement menggunakan MAUD dapat diketahui grafik distribusi ukuran partikel dalam serbuk sampel BiFeO3 sampel 4. Dari
gambar terlihat bahwa ukuran partikel yang dominan dimiliki oleh mayoritas serbuk adalah 700 Angstrong atau sekitar 70 nm. Hasil ini mendekati range nilai ukuran dari hasil perhitungan
menggunakan software FIT-YK.. Dari analisis dan pembahasan diatas dapat diketahui bahwa pada dasarnya konsep dasar (basic of knowledge) dari metode kopresipitasi adalah dengan adanya perbedaan massa jens endapan yang terbentuk berkaitan dengan berat fasa yang terkandung di dalamnya sehingga jika fasa yang kita inginkan memiliki berat molekul yang besar maka akan mudah mengendap dengan cepat sehingga impuritas yang mengotori dapat diminimalisir dengan membuang bagian atas (layer) pada saat proses pengendapan dan pencucian.
V. KESIMPULAN
Fasa BiFeO3 dapat
disintesis menggunakan metode kopresipitasi dengan bahan dasar pasir besi lumajang. Variasi pH berpengaruh terhadap kemurnian fasa dan holding time berpengaruh terhadap jumlah komposisi fasa BiFeO3 yang dihasilkan
dimana semakin besar holding time komposisi BFO semakin kecil . Ukuran partikel yang dianalisa dari pola difraksi
menunjukkan bahwa serbuk BiFeO3
berukuran nano dalam rentang 10-90 nm , dan karena partikel serbuk BiFeO3
bersifat aglomerasi mengakibatkan morfologi yang teramati oleh SEM menunjukkan partikel berukuran mikro yaitu dalam rentang 10-50 µm.
DAFTAR PUSTAKA
Anonim,(2011),http://www.wikipedia .com/Fe3O4 ,Diakses : 27 Februari 2011.
,(2011),http://www.geocities.jp/oh ba_lab_ob_page/structure6.html, Diakses 10 Maret 2011.
Bibes,Stone Braker A.,(2009), “Nature Materials ,Vol.7, p.425,”
( http : // physics.aps.org / articles/ v2/20 diakses:7 Maret 2011)
Callister, William J.,(1989),” Material
Science and Engineering”,Addison-Wesley
publishing company , Inc.
Carvalho, P.B. Tavares,(2008),"Synthesis and
Thermodynamic Stability of Multiferroic BiFeO3",Materials Letters 62 (2008) 3984–3986
Clark S.J., J. Robertson, (2009), “Applied Physics Letter”,Vol. 94,rev.022902.
Day , Jr, R.A. Underwood,A.L.,
(1989),”Analisis Kimia Kuantitatif”, Erlangga : Jakarta.
De-Chang Jia et al ,(2009), “Structure And Multiferroic Properties Of BiFeO3 Powders”, Journal of the
European Ceramic Society,Vol.29,p.3099–3103.
Dunlop J.D, (1971), “Magnetic
Properties of Fine-particles
Hematite”, Ann. Géophysics
,Vol.27, p. 269–293.
Ederer, N.A. Spaldin,(2005), “Physics”. Rev. B 71 224103.
Felicia et al,(2010), “Preparation and Properties of (1-x) BiFeO3 -xBaTiO3 Ceramics”, journal of alloy and coumpound506.862-867.
Fitriyah,N,(2010),” Karakterisasi Kandungan Magnetik (Fe2O3/Fe3O4) Pada Pasir Besi
(Irond Sand) Lumajang dan Pengaruhnya Terhadap Mutu
Beton Bertulang”, Fisika
ITS,Surabaya
Garcia et al,(1992),”Neutron-difraction Study of RNiO3 (R=La,Pr,Nd,Sm)-Electronically Induced Structural-Changes Across The Metal-Insulator Transition”,Physical Review B-CondensedMatter,Vol.46,p.4414– 4425.
Hill A., Nicola,(2004), “First Principles
Study of Multiferroic
Magnetoelectric Manganites”, University of California Santa Barbara, Materials Department: California.
Howard et al. ,(2000), “Neutron Powder
Diffraction Study Of Rhombohedral Rare-Earth
Aluminates And The Rhombohedral Cubic Phase Transition”, Journal of Physics-Condensed Matter, Vol.12,p.49– 365.
Hua et al.,(2010),”Factors Controlling Pure-phase Multiferroic BiFeO3 Powders Synthesized by Chemical
Co-precipitation”, Journal of
Alloys and Compounds Vol.509,p.2192–2197.
Hur .N. et all,(2004),”Electric Polarization Reversal And Memory In A Multiferroic Material Induced By Magnetic Fields “,Nature ,Vol.429, p.392-395.
Iida, K. Takayanagi, T. Nakanishi, T. Osaka, (2007), “Journal of Colloid and Interface Science”, Vol.314, p.274–280.
Jua et al.,(2010), “Phase Equilibrium of Bi2O3–Fe2O3 Pseudo-Binary System and Growth of BiFeO3
Single Crystal”, Journal of Crystal Growth, Vol.10,p.1016.
Khomskii D. ,(2009), “Classifying
Multiferroics: Mechanisms and Effects”,Physics Vol.2, p.20.
Kimura et al.,(2003),”Magnetic Control Ferroelectric Polarization”, Nature ,Vol.426,p.55 .
Kumar M.M , V.R. Palkar, K. Srinivas, S.V. Suryanarayana, (2000),” Applied Physics Letter”, Vol.76, p. 2764–2766
Lanculescu et al,(2008), “Journal
Optoelectronics Advance Mater”,vol 10.p 1805-1809
Levy Mark,(2005),”Crystal Structure and Defect Property Predictions in Ceramic Materials”, Department of Materials Imperial College of Science,Technology and Medicine : London.
Palai et al.,( 2008), “ Physics”,Rev.B-7,Vol. 014110.
Selbach et al,(2007), “American Ceramics Society”,90,3430-3434
Schmid.H,(1994), “Chemical Physics; Materials Science Taylor & Francis Ferroelectrics”,Vol.162, Issue 1 1994 , p. xix – xxv.
Spaldin N.A,Fiebig ,(2005),”The Renaissance of Magnetoelectric Multiferroics”, Science ,Vol.309, p.391.
Wang et al.,(2003),”Epitaxial BiFeO3 Multiferroic Thin Film Heterostructures”, Science Vol .299, p. 1719-1722
Wang P.Y, L. Zhou,M.F. Zhang, X.Y. Chen, J.-M. Liu, Z.G. Liu, “Applied Physics Letter”, Vol.84,p. 1731– 1733.
Xian-Zhi Chen et al,(2011)," Large-scale Growth and Shape Evolution of Bismuth Ferrite Particles with a Hydrothermal Method",Materials Chemistry and Physics 126 (2011) 560–567
Yuan et al ,(2006), “Preparation and Multi-properties of Insulated Single-phase BiFeO3 ceramics”, Solid State Communications . Vol.138 ,p.76–81.