1
Prosiding Tugas Akhir Semester Genap 2011/2012
SINTESIS PARTIKEL NANO CaO DENGAN METODE KOPRESIPITASI DAN
KARAKTERISASINYA
Sari Rahmawati*, Dr. Didik Prasetyoko, M.Sc.,1 Dra. Ratna Ediati, MS, PhD.2
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember Surabaya
ABSTRAK
Pengaruh pelarut air dan organik terhadap ukuran partikel dan morfologi dari CaO yang disintesis dengan metode kopresipitasi menggunakan asam oksalat serta kalsium asetat sebagai prekursor telah diamati pada penelitian ini. Ukuran nano pada oksida kalsium diperoleh melalui dekomposisi termal dengan suhu 800 °C dari kalsium oksalat bermedia air dan organik. Fasa pada sampel dikonfirmasi melalui XRD dengan perangkat lunak rietica, dan diperoleh data bahwa CaO yang dipreparasi dengan pelarut etilen glikol memiliki kristalinitas yang paling rendah dibandingkan dengan pelarut air, polietilen glikol 400, dietilen glikol dan gliserol. Untuk menganalisis gugus yang terdapat pada permukaan oksida, sampel dianalisis menggunakan spektroskopi FTIR. Berdasarkan spektra FTIR diketahui bahwa pada sampel CaO masih terdapat gugus CO dari CaCO3 dan OH dari Ca(OH)2. Analisis SEM menunjukkan morfologi yang berbeda untuk CaO yang dihasilkan pada pelarut air dan organik. Melalui persamaan Scherrer dan analisis rietica diketahui pelarut yang paling baik adalah dietilen glikol yang menghasilkan ukuran partikel CaO sebesar 72,13 nm dengan %berat CaO sebesar 93,34.
Kata Kunci: CaO, partikel nano, kopresipitasi, asam oksalat
I. PENDAHULUAN
Beberapa tahun terakhir ini partikel nano mendapatkan banyak perhatian dari peneliti di seluruh dunia, yang terlihat dari banyaknya tulisan ilmiah dan artikel yang dipublikasikan pada jurnal ilmu pengetahuan baik di dalam maupun di luar negeri. Partikel nano dapat terjadi secara alamiah ataupun sintesis. Sintesis partikel nano merupakan pembuatan partikel dengan ukuran yang kurang dari 100 nm dan sekaligus mengubah sifat atau fungsinya (Rahman, 2008). Partikel
*Corresponding author e-mail : [email protected]
1
Alamat sekarang : Jur Kimia, Fak MIPA
Institut Teknologi Sepuluh Nopember, Surabaya
nano banyak diteliti karena dapat diaplikasikan dalam berbagai bidang kehidupan seperti: bahan untuk mereduksi polusi, katalis, penarget sel kanker, biosensor, dan baterai.
Kalsium oksida (CaO) merupakan material anorganik yang penting, karena dapat digunakan sebagai katalis untuk reaksi transesterifikasi karena memiliki banyak keuntungan yaitu memiliki aktivitas yang tinggi, tahan lama, biaya murah, serta memiliki kekuatan basa yang tinggi (Liu, dkk., 2008). CaO bersifat sedikit larut dalam metanol dibandingkan dengan oksida atau hidroksida logam alkali tanah yang lain seperti SrO dan Ba(OH)2 yang terlarut secara penuh dalam media reaksi (Granados dkk, 2007). Kebanyakan katalis CaO yang digunakan dalam reaksi transesterifikasi masih berukuran mikro, seperti yang dilaporkan oleh Xin (2009), yang menggunakan kristal CaO dengan diameter berukuran 4-8 µm untuk reaksi transesterifikasi. Oleh sebab itu, sintesis CaO
2 berukuran nano sangat diperlukan dalam upaya mendapatkan katalis CaO dengan aktivitas yang lebih tinggi.
Beberapa literatur menyebutkan bahwa terdapat dua metode utama yang menjelaskan tentang preparasi nano-CaO, diantaranya adalah dekomposisi termal, sol-gel. Melalui metode sol-gel diperoleh partikel nano berukuran sekitar 4 nm, akan tetapi memerlukan biaya yang tinggi serta proses yang sangat komplikasi dan memakan banyak waktu, sehingga sangat sulit untuk mengaplikasikan metode sol-gel pada industri. metode dekomposisi termal memiliki beberapa keuntungan seperti proses yang sederhana, biaya murah, kemudahan memperoleh produk dengan kemurnian tinggi. Akan tetapi pada metode dekomposisi termal, CaO seringkali dihasilkan melalui kalsinasi CaCO3 secara langsung dengan suhu tinggi (Tang, dkk., 2007). Metode kopresipitasi merupakan suatu metode sintesis bottom up yang dapat digunakan dalam pembuatan partikel nano. Kelebihan metode kopresipitasi dibandingkan dengan metode yang lain adalah metode kopresipitasi memiliki proses yang sederhana dan dapat menghasilkan partikel yang berukuran butir sangat kecil. Melalui metode kopresipitasi, Bhargava dkk (2007) menggunakan asam oksalat dan amonium hidroksida sebagai agen pengendap untuk menghasilkan MgO dengan ukuran partikel nano. Selanjutnya, Taufiq dkk. (2010) telah mensintesis CaO yang dicampur dengan MgO dan ZnO melalui metode kopresipitasi untuk memperoleh katalis dengan luas permukaan yang lebih besar. Agen pengendap berupa asam oksalat telah berhasil dipakai dalam sintesis katalis campuran oksida CaO dan ZnO berukuran nano yang kemudian digunakan sebagai katalis dalam memproduksi biodiesel dari refined palm oil
(Yulianti, 2011). Keberadaan agen pengendap pada metode kopresipitasi sangat mempengaruhi ukuran partikel dari material yang akan disintesis.
Pelarut sangat berpengaruh pada ukuran partikel padatan hasil sintesis seperti yang dilaporkan oleh Kanade dkk. (2005). Zhang dkk. (2002) dan Kwon dkk. (2002) juga mengamati pentingnya pelarut dalam mengontrol morfologi material. Oleh karena itu perlu diamati pengaruh jenis pelarut
terhadap pembentukan suatu material. Dalam penelitian ini dipilih pelarut air, gliserol, etilen glikol, dietilen glikol, dan polietilen glikol 400 dalam sintesis CaO. CaO yang diharapkan adalah partikel CaO dalam ukuran nano.
II. EKSPERIMEN
2.1 Sintesis Partikel Nano CaO
Partikel nano CaO disintesis dengan menyiapkan terlebih dahulu Ca(CH3COO)2H2O yang dilarutkan dalam akua demineralisasi sehingga dihasilkan larutan kalsium asetat 0,1 M dengan volume sebanyak 100 mL. Endapan kalsium oksalat diperoleh dengan penambahan secara perlahan-lahan 50 mL larutan asam oksalat 0,15 M disertai pengadukan dengan kecepatan 150 rpm selama 12 jam pada temperatur kamar. Eksperimen yang sama dilakukan dengan variasi pelarut etilen glikol, dietilen glikol, polietilen glikol 400 dan gliserol sebagai pelarut Ca(CH3COO)2H2O. Produk padat diperoleh dengan sentrifus, diikuti pencucian berturut-turut dengan akua demineralisasi lalu dengan aseton serta dikeringkan dalam oven pada 120 oC selama satu malam. Padatan yang telah kering kemudian dikalsinasi dalam furnace pada temperatur 800 oC selama 6 jam.
2.2 Karakterisasi Hasil Sintesis 2.2.1 Difraksi Sinar-X
Karakterisasi menggunakan teknik difraksi sinar-X (XRD) dilakukan untuk mengidentifikasi fase kristal dan analisis terbentuk atau tidaknya material nano CaO dari sampel yang telah disintesis. Untuk keperluan karakterisasi XRD, sampel CaO dibentuk menjadi serbuk. Sebanyak ± 0,2 g sampel ditempatkan pada suatu cetakan (sample holder) kemudian disinari dengan sumber radiasi Cu Kα ( = 1,54056) dengan rentang sudut 2 sebesar 5-90o, dan kecepatan scan 0,020o.
2.2.2 SEM (Scanning Electron Microscopy) Morfologi dan ukuran partikel dari sampel padat dianalisis menggunakan
Scanning Electron Microscopy (SEM).
Sampel yang akan dianalisis dengan SEM terlebih dahulu dipreparasi dengan menambahkan etanol kemudian digetarkan dengan ultrasonik yang bertujuan untuk
3 mengurangi aglomerasi pada sampel yang akan dianalisis. Setelah dilakukan preparasi, sampel dimasukkan dalam sample holder
kemudian dilakukan perbesaran gambar SEM antara 5000-40.000 kali.
2.2.3 Spektrofotometri Inframerah
Spektrum inframerah direkam menggunakan spektrofotometer Fourier Transform Infrared (FTIR), yang dilakukan dengan mencampurkan sampel kedalam pelet KBr dengan komposisi sampel 1% terhadap total campuran. Kemudian dilakukan karakterisasi pada bilangan gelombang antara 4000 cm-1 sampai 400 cm-1.
2.2.4 Penghalusan Difraktogram (Refinement)
Analisis Rietveld merupakan salah satu analisis lanjut untuk mengetahui karakter fisis dari material secara kuantitatif berdasarkan data difraksi sinar-X dengan menggunakan program komputer berupa
software Rietica. Pada penelitian ini, untuk CaO dibuat model dari ICSD nomor 75785, CaCO3 dari ICSD nomor 16710. Setelah dilakukan pemilihan model, selanjutnya dilakukan pencocokan pola difraksi terukur dengan pola difraksi terhitung dengan cara mengubah/memperhalus (refining) parameter–parameter dalam model terhitung. Analisis ini disebut proses Refinement. Dari proses refinement, akan diperoleh parameter– parameter keluaran (output) yang selanjutnya akan digunakan dalam analisis lanjutan. Parameter–parameter yang direfine adalah dengan Background (Bo, B1, B2, B3, B4, B5), Sample displacement, Phase scale, Lattice parameter, Size, U parameter,
Asymetry parameter, Overall thermal,
Preferred orientation. Dengan memanfaatkan
parameter keluaran Rietica tersebut maka dapat menganalisis komposisi fasa dari sampel.
III. HASIL DAN PEMBAHASAN 3.1 Sintesis Partikel Nano CaO
Sintesis partikel nano CaO dilakukan melalui metode kopresipitasi sesuai dengan metode yang dilakukan oleh Kanade dkk. (2006). Pada penelitian Kanade dkk. (2006) digunakan larutan Zn(CH3COO)2 0,1 M sebagai prekursor dan asam oksalat 0,15 M sebagai agen pengendap untuk menghasilkan
partikel nano ZnO. Pada penelitian ini untuk menghasilkan partikel nano CaO digunakan larutan Ca(CH3COO)2 0,1 M sebagai prekursor dengan agen pengengap yang sama dengan yang digunakan oleh Kanade dkk. (2006) yaitu berupa larutan asam oksalat dengan konsentrasi 0,15 M. Penggunaan konsentrasi dan agen pengendap yang sama ini dimaksudkan untuk memperoleh CaO dengan ukuran yang kecil.
Disamping itu, untuk menghasilkan partikel nano CaO dengan ukuran sekecil mungkin, pada penelitian ini digunakan beberapa pelarut yang berbeda yaitu pelarut air, etilen glikol (EG), dietilen glikol (DEG), polietilen glikol 400 (PEG), dan gliserol. Penggunaan pelarut air dan etilen glikol telah dilaporkan oleh Kanade dkk. (2006) dapat menghasilkan partikel nano ZnO dengan ukuran yang cukup kecil (25-14 nm). Sedangkan pemilihan pelarut polietilen glikol didasarkan pada penelitian Adam dan Wong (2011) yang menggunakan polietilen glikol sebagai medium untuk mensintesis partikel nano CaO dengan metode mikroemulsi. Pada penelitian ini, polietilen glikol tersebut diuji apakah dapat menghasilkan partikel nano bila digunakan sebagai pelarut pada metode kopresipitasi. Adapun penggunaan dietilen glikol sebagai pelarut dimaksudkan untuk mendapatkan korelasi antara etilen glikol dan polietilen glikol dalam hal kemampuannya untuk menghasilkan partikel berukuran nano, seperti yang dikemukakan oleh Iijima dan Kamiya (2009) bahwa reagen partikel nano seperti garam logam dan logam kompleks dapat larut dalam media pelarut poliol (etilen glikol, dietilen glikol, trietilen glikol) yang memiliki sifat polar. Pelarut lain berupa gliserol dipilih berdasarkan sintesis partikel nano NiO dengan metode presipitasi yang dilakukan oleh Li dkk. (2005). Pada sintesis tersebut gliserol berhasil digunakan sebagai pelarut untuk menghasilksan NiO berukuran 12 hingga 30 nm.
Sintesis dimulai dengan membuat larutan kalsium asetat dengan cara melarutkan padatan kalsium asetat ke dalam akua demineralisasi hingga diperoleh larutan kalsium asetat dengan konsentrasi 0,1 M. Kemudian ke dalam larutan tersebut ditambahkan asam oksalat tetes demi tetes sambil diaduk menggunakan magnetik stirer dengan kecepatan 160 rpm selama 12 jam
4 hingga diperoleh larutan yang keruh. Perubahan larutan dari jernih menjadi keruh menunjukkan bahwa larutan telah jenuh serta merupakan indikasi bahwa telah terbentuk kalsium oksalat. Reaksi yang terjadi pada kopresipitasi ini ditunjukkan oleh Kanade dkk. (2006) sebagai berikut:
Ca(CH3COO)2(l) + H2C2O4(l) → CaC2O4(s)
+ 2CH3COOH(l) (4.1)
Hasil yang diperoleh kemudian disaring dengan menggunakan kertas saring. Setelah dilakukan penyaringan ternyata masih didapatkan filtrat yang keruh. Filtrat yang masih keruh ini menandakan bahwa masih ada partikel-partikel berukuran kecil yang lolos dari penyaringan dan kembali masuk ke dalam filtrat. Oleh sebab itu, untuk memisahkan filtrat dengan endapan kalsium oksalat yang memiliki ukuran partikel kecil maka digunakan alat sentrifus (Yulianti, 2011). Endapan yang diperoleh kemudian dicuci dengan akua demineralisasi dan dicuci kembali dengan aseton sehingga diperoleh endapan berwarna putih. Perlakuan ini dilakukan untuk mengurangi sisa asam oksalat yang tidak bereaksi (Kanade dkk., 2006). Endapan putih kemudian dikeringkan dalam oven selama 12 jam pada suhu 120 °C. Selanjutnya, padatan dikalsinasi pada suhu 800 °C selama 6 jam untuk menghilangkan ion oksalat dan juga senyawa organik yang masih tersisa sehingga diperoleh padatan CaO. Suhu kalsinasi tersebut juga digunakan oleh Cho dkk. (2009) untuk mensintesis CaO dari prekursor berupa kalsium asetat. Pemilihan suhu kalsinasi tersebut didasarkan pada hasil analisis DTA-TGA yang dilakukan oleh Cho dkk. (2009) bahwa CaCO3 terdekomposisi pada suhu 450 °C dan CaO dihasilkan pada suhu 600-720 °C. Reaksi dekomposisi dari padatan kalsium oksalat menjadi padatan kalsium oksida dituliskan dalam persamaan berikut ini (Kanade dkk., 2006; West, 1984) :
CaC2O4 (s) CaCO3 (s) + CO (g) (4.2) CaCO3 (s) CaO (s) + CO2 (g) (4.3) Prosedur tersebut kemudian diulangi lagi untuk mensintesis CaO dengan pelarut yang berbeda, dimana larutan kalsium asetat dibuat
dengan cara melarutkan padatan kalsium asetat ke dalam etilen glikol hingga diperoleh larutan kalsium asetat 0,1 M. Presedur tersebut diulangi pula pada penggunaan pelarut dietilen glikol, polietilen glikol 400, dan gliserol. Pada persamaan reaksi 4.1 terjadi pada pelarut air, dan media pelarut organik menghasilkan jumlah kalsium oksalat yang sama. Reaksi pada media air lebih cepat dibandingkan dengan reaksi pada media organik yang disebabkan karena kepolaran dan konstanta dielektrik yang tinggi pada air. Polaritas dan tekanan uap jenuh dari pelarut dapat mempengaruhi hasil reaksi dibawah kondisi termal, dimana pelarut organik yang kurang polar akan sangat berperan dalam mengontrol nukleasi bila dibandingkan dengan pelarut air yang lebih polar (Kanade dkk., 2006).
3.2 Karakterisasi
3.2.1 Difraksi Sinar-X (XRD)
Analisis dengan XRD dilakukan untuk mengetahui struktur serta kristalinitas dari sampel CaO. Pola difraksi sinar-x dimonitor pada 2θ = 5-90°. Perbandingan pola XRD dari sampel CaO dengan variasi pelarut berupa air, etilen glikol, dietilen glikol, polietilen serta gliserol ditunjukkan pada Gambar 4.1. Pada CaO murni, puncak muncul pada 2θ = 32,2°; 37,3°; 53,8°; 64,1° dan 67,3° (Taufiq dkk, 2010).
Pada kelima sampel CaO yang disintesis terlihat memiliki puncak yang cenderung sama mengindikasikan bahwa kelima sampel tersebut memiliki fasa yang sama. Selain itu juga terdapat fasa CaCO3 pada 2θ = 29,5° yang juga muncul pada CaO sintesis. Adanya pola difraksi CaCO3 tersebut menandakan bahwa pada CaO hasil sintesis masih terdapat sedikit pengotor yang disebabkan kondisi sampel yang terbuka saat dikarakterisasi XRD sehingga memungkinkan terbentuknya CaCO3 melalui penyerapan CO2 dari atmosfer selama analisis XRD (Umdu, 2008). Agrinier dkk. (2001) mengungkapkan bahwa CaO dapat bereaksi dengan CO2 secara lambat pada suhu kamar membentuk CaCO3. Reaksi tersebut dapat dituliskan pada persamaan berikut ini :
5 Agrinier dkk. (2001) juga menyebutkan bahwa ukuran partikel CaO sangat mempengaruhi kapasitas penyerapan CO2, dimana semakin kecil ukuran CaO maka akan semakin besar daya absorpsinya terhadap CO2 dikarenakan luas permukaan yang lebih besar.
Gambar 3.1 Gambar pola difraksi sampel CaO sintesis.
Pada difraktogram Gambar 3.1 terlihat bahwa fasa CaO pada pelarut gliserol dibandingkan dengan etilen glikol mengalami penurunan intensitas. Sedangkan intensitas pada fasa CaO yang disintesis dengan pelarut air lebih tinggi dibandingkan dengan intensitas CaO yang disintesis dengan pelarut PEG dan EG, namun tidak lebih tinggi dibandingkan dengan intensitas CaO yang di sintesis dengan pelarut gliserol dan DEG. Intensitas pada pola difraksi XRD berhubungan dengan tingkat kristalinitas dimana umumnya semakin tinggi kristalinitas maka akan semakin besar ukuran partikelnya (HORIBA Scientific, 2010). Pada sampel yang disintesis dengan pelarut organik EG dan PEG memiki intensitas yang lebih rendah dibandingkan dengan intensitas yang dimiliki oleh sampel CaO dengan media pelarut air. Melalui hasil tersebut dapat diketahui bahwa sampel CaO yang disintesis dengan pelarut organik EG dan PEG memiliki ukuran partikel yang lebih kecil dibandingkan
dengan sampel CaO yang disintesis dengan pelarut air, gliserol dan DEG.
Pelarut organik PEG memiliki fasa CaO dengan puncak yang lebih rendah dibandingkan dengan media pelarut DEG dan gliserol. Sedangkan pelarut EG memiliki fasa CaO dengan puncak yang paling rendah, hal ini mengindikasikan bahwa pelarut etilen glikol memiliki kemampuan mendispersi yang paling baik diantara keempat pelarut lainnya. Pelarut PEG dan DEG memiliki puncak dengan intensitas yang hampir sama dengan selisih yang sangat tipis, menunjukkan bahwa baik pelarut PEG dan DEG memiliki kemampuan mendispersi yang hampir sama. Park dan Oh (2009) mengungkapkan bahwa sampel CaCO3 sebagai prekursor CaO yang dipreparasi menggunakan aditif berupa polimer seperti etilen glikol, polietilen glikol dan propilen glikol memiliki puncak dengan intensitas yang lebih rendah dan broad bila dibandingakan dengan sampel CaCO3 yang dipreparasi tanpa menggunakan aditif polimer. Hasil tersebut sesuai dengan hasil analisis XRD pada sampel yang disintesis pada penelitian ini. CaO yang disintesis dengan pelarut gliserol dan DEG juga memiliki puncak yang lebih broad
dibandingkan dengan puncak dari CaO yang disintesis dengan air. Trung, dkk. (2009) mengungkapkan bahwa kristal berukuran nano dapat menyebabkan pelebaran puncak dan overlap pada difraktogram. Sehingga dapat diketahui bahwa sampel yang disintesis dengan pelarut organik dapat menghasilkan pelebaran puncak pada difraktogram, dimana puncak yang melebar dapat mengindikasikan ukuran partikel yang semakin kecil.
Tabel 3.1 Hubungan kristalinitas sampel CaO sintesis pada variasi pelarut. Media pelarut 2θ (°) Tinggi puncak, I % Kristalinitas Air 37,44 2725 90 Gliserol 37,36 3025* 100 EG 37,36 2440 81 DEG 37,38 2809 93 PEG 37,36 2673 88
6 Hubungan kristalinitas sampel CaO dengan variasi media pelarut ditunjukkan pada Tabel 3.1. Hubungan kristalinitas tersebut dihitung berdasarkan intensitas puncak difraksi dari sampel CaO yang disintesis dengan media gliserol pada 2θ = 37,36° dimana sampel tersebut memiliki intensitas tertinggi (kristalinitas dianggap 100%) sehingga digunakan sebagai standar pembanding (*). Tabel 3.1 menunjukkan bahwa sampel CaO yang disintesis dengan media gliserol memiliki intensitas yang paling tinggi yaitu 100 diikuti dengan CaO yang disintesis dengan media dietilen glikol, air, polietilen glikol 400 dan CaO yang disintesis menggunakan media etilen glikol memiliki % kristalinitas terendah yaitu sebesar 81. Hasil tersebut sesuai dengan hasil sintesis partikel nano ZnO yang dilakukan oleh Kanade dkk. (2006) yaitu kristalinitas yang lebih rendah diperoleh saat digunakan media pelarut etilen glikol. Hasil analisis XRD yang dilakukan Lee dan Lee (2002) memperlihatkan partikel nano TiO2 yang disintesis menggunakan media etilen glikol dengan jumlah lebih besar dapat menghasilkan puncak dengan intensitas yang lebih rendah dibandingkan dengan penggunaan sedikit etilen glikol.
Kristalinitas dapat menunjukkan perkiraan ukuran partikel dari suatu sampel, semakin kristalin umumnya akan semakin besar ukuran partikelnya. Melalui hasil perhitungan % kristalinitas tersebut tampak bahwa penggunaan media pelarut yang berbeda akan dihasilkan kristalinitas yang berbeda pula. Penggunaan bahan organik sebagai pelarut dapat memperkecil kristalinitas yang dapat memperbesar kemungkinan terbentuknya partikel nano dengan ukuran yang lebih kecil. Hal ini disebabkan pelarut organik memiliki kemampuan mendispersi yang lebih baik dibandingkan dengan air (Kanade dkk., 2006).
3.2.2 Penghalusan Rietveld dengan perangkat lunak Rietica
Perangkat lunak rietica digunakan dalam penghalusan rietveld untuk mengetahui fasa-fasa yang terkandung dalam sampel yang dianalisis. Melalui hasil penghalusan dengan rietica kelima sampel CaO sintesis sesuai dengan puncak-puncak yang dimodelkan
oleh data ICSD no. 75785 untuk senyawa CaO, dan ICSD no. 16710 untuk CaCO3. Kecocokan dari hasil pengukuran tersebut menunjukkan bahwa pada kelima sampel yang diuji mengandung dua fasa yaitu CaO dan CaCO3. Setelah dilakukan penghalusan menggunakan rietica akan diketahui tingkat kesesuaian antara data terhitung dan terukur. Hasil penghalusan berupa nilai-nilai Rwp (R-weighted pattern) antara 22,295-23,561%, dan GoF (goodness of fit) antara 1,507-1,588% ditampilkan pada Tabel 3.2. Plot selisih antara pola terhitung dan terukur berfluktuasi tidak terlalu signifikan. Hasil tersebut menandakan bahwa proses
refinement acceptable karena memiliki nilai GoF kurang dari 4% yang menunjukkan adanya kecocokan antara stuktur oksida hasil sintesis dengan struktur oksida acuan. Tabel 3.2 Tingkat kesesuaian (figures of
merit) sampel CaO sintesis pada variasi pelarut.
Media pelarut GOF Rwp Air 1,573 23,561 Gliserol 1,588 23,496 EG 1,507 22,384 DEG 1,567 22,990 PEG 1,509 22,295 Komposisi fasa sampel CaO dapat diketahui dengan melakukan perhitungan menggunakan perangkat lunak rietica. Data perbandingan komposisi dua fasa yang diperoleh untuk kelima sampel CaO ditampilkan pada Tabel 3.3. Secara garis besar kelima sampel memiliki perbandingan komposisi fasa yang sama, dimana fasa CaO terdapat sebesar 89,27-93,56 %berat dan terdapat fasa CaCO3 dengan jumlah sebesar 6,44-10,73 %berat (Tabel 3.3). Adanya fasa CaCO3 yang teramati dapat disebabkan kondisi yang terbuka saat analisis XRD sehingga ada kemungkinan sampel CaO mengalami kontak dengan udara, seperti analisis yang dilakukan oleh Umdu (2008) yang menyatakan bahwa sampel CaO dapat berubah fasa menjadi CaCO3 bila mengalami kontak dengan udara selama analisis XRD. Selain itu, fasa CaCO3 yang muncul dapat pula disebabkan kalsinasi pada suhu 800 °C belum dapat membuat CaCO3 terdekomposisi
7 secara keseluruhan membentuk CaO (Park dan Oh, 2009).
Tabel 3.3 Perbandingan komposisi fasa dan ukuran kristal dari sampel CaO sintesis pada variasi pelarut. Media pelarut Komposisi fasa (% molar) Ukuran Partikel CaO CaCO3 Air 93,56 6,44 92,66 nm Gliserol 92,26 7,74 84,20 nm EG 90,14 9,86 67,59 nm DEG 93,34 6,66 72,13 nm PEG 89,27 10,73 72,12 nm Tabel 3.3 juga menunjukkan ukuran partikel dari sampel CaO yang dihitung dengan menggunakan persamaan Scherrer. Hasil tersebut serupa dengan sintesis partikel nano yang dilakukan oleh Trung dkk. (2003) dimana partikel nano TiO2 berukuran 50 nm dihasilkan tanpa pelarut organik, 10-15 nm pada media PEG. Gliserol dan dietilen glikol tampak sebagai pelarut organik yang dapat menghasilkan ukuran partikel kecil meskipun memiliki intensitas yang tinggi, dikarenakan pelarut tersebut memiliki puncak difraktogram yang broad. Hal ini disebabkan gliserol berperan dalam menghasilkan viskositas yang tinggi dan menstabilkan larutan campuran yang dapat menghalangi agregasi pada partikel kalsium dan menunjang pembentukkan kalsium nano dengan yield yang tinggi (Li dkk., 2005). Peranan gliserol dalam menghasilkan ukuran partikel nano dapat dijelaskan sebagai berikut: Ca2+ mula-mula berinteraksi dengan gliserol membentuk Ca-gliserol yang kemudian berubah menjadi endapan setelah dilakukan penambahan larutan asam oksalat. Selama kalsinasi, gliserol yang masih tersisa dipermukaan endapan mulai terdekomposisi menjadi H2, CO dan CO2 selanjutnya Ca kemudian menjadi CaCO3 yang akhirnya terdekomposisi pada suhu 800 °C membentuk CaO berukuran nano. Tahapan ini sama seperti hasil sintesis yang dilakukan oleh Li dkk. (2005) untuk menghasilkan partikel nano Ni/NiO pada media gliserol. Selain terjadi pada pelarut gliserol, tahapan reaksi serupa juga berlaku pada pelarut organik etilen glikol, dietilen glikol, dan polietilen glikol dimana pada pelarut glikol
memiliki kemampuan dalam menstabilkan permukaan partikel pada suhu yang tinggi dan menunjang formasi kristal CaO dengan dispersivitas yang baik sehingga arah pertumbuhan kristal CaO terkontrol dan dapat dihasilkan ukuran partikel yang lebih kecil dibandingkan dengan pelarut air (Kanade dkk., 2006).
Polaritas dapat pula mempengaruhi pembentukan partikel nano. Bila ditinjau dari kepolarannya maka urutan pelarut dari kopolaran tinggi ke rendah adalah sebagai berikut:
Air >Gliserol >Etilen Glikol >Dietilen Glikol >Polietilen Glikol
Umumnya, semakin polar pelarut maka ukuran partikel kristal yang dihasilkan juga akan semakin tinggi, hal ini berkaitan dengan kemampuan mendispersi. Pelarut semi polar memiliki kemampuan mendispersi yang lebih baik karena dapat mencegah terjadinya aglomerasi yang dapat menyebabkan terjadinya sintering saat kalsinasi, dimana sintering tersebut dapat memperbesar ukuran partikel.
3.2.3 Spektroskopi Inframerah
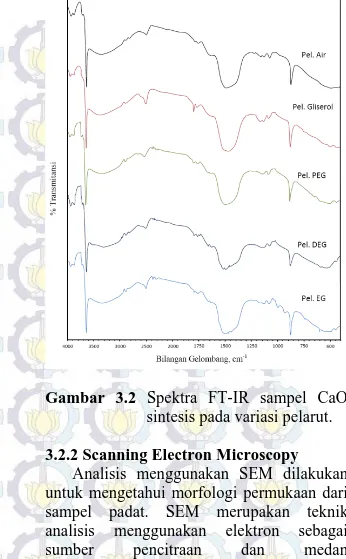
Spektroskopi inframerah dilakukan dengan tujuan untuk mengidentifikasi gugus fungsi yang terdapat dalam suatu senyawa. Analisis FTIR dilakukan pada panjang gelombang 4000-400 cm-1. Gambar 3.3. menunjukkan adanya puncak yang muncul pada kelima sampel yang secara umum hampir sama. Pada kelima sampel yang dianalisis menunjukkan adanya pita OH di daerah sekitar 3600 cm-1, pita CH di 2300-2900 cm-1, pita CO di daerah sekitar 1400 cm-1, 1700 cm-1, dan 875 cm-1, serta pita CaO pada daerah sekitar 400 cm-1. Pita dari gugus OH muncul sangat tajam di bilangan gelombang 3643,53 cm-1 pada sampel yang disintesis dengan media air, gliserol, polietilen glikol, sedangkan sampel dengan media dietilen glikol dan etilen glikol muncul pada bilangan gelombang 3641,6 cm-1. Gugus OH dengan puncak yang tajam merupakan karakteristik dari CaO standar (Ruiz dkk, 2009), sehingga kemunculan gugus OH tersebut menunjukkan adanya kecocokan puncak antara kelima sampel yang dianalisis dengan CaO standar. Akan tetapi kemunculan gugus OH tersebut pada daerah 3643,53 cm-1 hingga 3641,6 cm-1 tidak dapat
8 begitu saja memastikan bahwa sampel yang dianalisis benar-benar merupakan CaO karena Ca(OH)2 juga memiliki karakteristik puncak yang tajam didaerah 3643 cm-1 seperti hasil analisis yang dilakukan oleh Granados dkk, (2007) yang mendapati adanya gugus OH dari Ca(OH)2 sehingga ada kemungkinan bahwa puncak tersebut menunjukkan keberadaan air yang teradsorb pada permukaan CaO dimana CaO sangat mudah menyerap uap air dari udara. Oleh sebab itu maka perlu ditemukannya ciri khas puncak yang meyakinkan bahwa sampel benar-benar mengandung CaO.
Puncak yang sangat lebar pada daerah sekitar 400 cm-1 dapat dijadikan acuan untuk memastikan kehadiran CaO pada sampel, hal ini dikarenakan diantara spektrum CaO standar, CaCO3 standar dan Ca(OH)2 standar nampak hanya CaO standar yang memiliki puncak yang melebar pada panjang gelombang tersebut sebab puncak di daerah sekitar 400-500 cm-1 berhubungan dengan ikatan Ca-O dengan vibrasi ulur.
Pita dengan puncak di daerah sekitar 1700 cm-1 menunjukkaan adanya gugus C=O (karbonil) yang disebabkan oleh ikatan C=O stretching, dimana pada sampel dengan media pelarut air, gliserol dan polietilen glikol muncul puncak di panjang gelombang 1793,80 cm-1 dan muncul dengan puncak yang lemah pada sampel yang disintesis dengan media pelarut etilen glikol dan dietilen glikol. Ikatan O-C-O stretching dari karbonat muncul pada semua sampel di bilangan gelombang 1400 cm-1. Sedangkan vibrasi tekuk C-O dari gugus karbonat muncul pada bilangan gelombang 870 cm-1, dimana pada kelima sampel yang di sintesis gugus tersebut muncul pada bilangan gelombang yang hampir sama yaitu di daerah 875,68 cm-1 (air, PEG), 877,61 cm-1 (gliserol, DEG, EG). Puncak di sekitar 870 cm-1 merupakan karakteristik puncak yang biasanya muncul pada CaCO3 dan Ca(OH)2 (Ruiz dkk., 2009). Hal ini menunjukkan bahwa sampel mengandung senyawa lain selain CaO yang mengindikasikan sampel hasil sintesis belum murni.
Gambar 3.2 Spektra FT-IR sampel CaO sintesis pada variasi pelarut. 3.2.2 Scanning Electron Microscopy
Analisis menggunakan SEM dilakukan untuk mengetahui morfologi permukaan dari sampel padat. SEM merupakan teknik analisis menggunakan elektron sebagai sumber pencitraan dan medan elektromaknetik sebagai lensanya. SEM dari sampel CaO dengan variasi pelarut diilustrasikan pada Gambar 3.3. Perbesaran 20.000 kali pada gambar SEM dilakukan untuk mengetahui bentuk morfologi dari sampel secara global.
Morfologi dari CaO yang disintesis menggunakan pelarut air ditunjukkan pada Gambar 3.3 (a). Pada gambar SEM dengan perbesaran 20.000 kali terlihat kumpulan partikel berbentuk bulat dengan ukuran yang tidak homogen dengan ukuran diameter berkisar antara 65-290 nm. Pada CaO yang disintesis dengan pelarut etilen glikol, gambar SEM dengan perbesaran 20.000 kali menunjukkan kumpulan partikel berbentuk bunga karang yang lebih homogen bila dibandingkan dengan CaO yang disintesis dengan pelarut air. Pada gambaran SEM tersebut terlihat morfologi dari CaO yang berbentuk bulatan pipih yang saling sambung menyambung hingga memanjang seperti tali dengan diameter antara 72-110 nm. Kumpulan partikel berbentuk bunga karang
9 pada CaO yang disintesis dengan pelarut dietilen glikol hampir serupa dengan gambar SEM pada CaO yang disintesis dengan pelarut etilen glikol, akan tetapi pada sampel CaO yang disintesis dengan pelarut dietilen glikol tersebut didapatkan pula bentuk partikel berupa kubus berukuran besar dan kecil. Partikel berbentuk kubus tersebut serupa dengan morfologi dari CaO murni yang dianalisis oleh Taufiq dkk, 2010. Namun, ukuran partikel berbentuk kubus pada sampel CaO yang disintesis dengan pelarut dietilen glikol ini memiliki ukuran yang jauh lebih kecil (sekitar 0,3-2,5 µm) bila dibandingkan dengan CaO murni yang dianalisis oleh Taufiq dkk, 2010, yaitu sebesar 2-10 µm.
Pada CaO yang disintesis dengan pelarut polietilen glikol, gambar SEM yang dihasilkan serupa dengan CaO yang disintesis dengan pelarut etilen glikol dan dietilen glikol. Pada Gambar 3.3 (d) terlihat kumpulan partikel menyerupai bunga karang yang terdiri dari bulatan pipih yang saling sambung menyambung hingga memanjang seperti tali dengan diameter 50-210 nm. CaO yang disintesis dengan pelarut gliserol memiliki bentuk yang berbeda dengan CaO yang disintesis dengan pelarut air, etilen glikol, dietilen glikol, dan polietilen glikol. Seperti yang terlihat pada Gambar 3.3 (d), morfologi dari CaO sintesis pada media gliserol terlihat lebih homogen dibandingkan dengan keempat hasil sintesis CaO yang lain. Morfologi dari CaO memiliki bentuk tidak beraturan dan tepian yang tidak rapi dengan diameter antara 90-200 nm.
Ukuran-ukuran partikel yang diperoleh dari analisis morfologi SEM tersebut memiliki perbedaan dengan ukuran partikel yang diperoleh dari perhitungan Scherrer. Hal ini disebabkan ukuran-ukuran yang diperoleh dari SEM diukur secara kasat mata sehingga ukuran yang dihasilkan menjadi kurang akurat. Sedangkan penentuan ukuran partikel melalui perhitungan Scherrer diperoleh dari data XRD yang memiliki ketelitian yang lebih baik dalam menganalisis ketebalan kristal.
Pada Gambar 3.3, CaO yang disintesis dengan gliserol nampak memiliki ukuran partikel yang paling besar dibandingkan dengan sampel lainnya pada gambar SEM, sedangkan menurut perhitungan Scherrer,
CaO yang disintesis dengan media gliserol memiliki ukuran partikel yang kecil. Hal ini menunjukkan bahwa bentuk morfologi yang tampak tersebut tidak dapat mewakili ukuran partikel CaO yang sebenarnya karena ada kemungkinan bahwa pada partikel yang tersusun seperti bongkahan besar tersebut terdiri dari partikel-partikel dengan ukuran yang lebih kecil lagi.
Gambar 3.3 SEM CaO yang disintesis dengan pelarut air (a), Etilen glikol (b) Dietilen glikol (c), Polietilen glikol (d), Gliserol (e).
Aglomerasi terjadi pada seluruh sampel terutama pada sampel yang disintesis dengan media air, hal ini disebabkan karena pelarut air memiliki kemampuan mendispersi yang kurang baik bila dibandingkan dengan pelarut organik. Pada media pelarut air, reaksi dispersi lebih homogen dibandingakan dengan pelarut organik menjadikan
pertumbuhan inti kristal akan kurang terlindungi yang dapat mendorong
pertumbuhan kristal CaO mengarah ke ukuran yang lebih besar (Kanade dkk., 2006). Etilen glikol, dietilen glikol, dan polietilen glikol berperan sebagai surfaktan yang dapat menstabilan permukaan partikel pada temperatur yang tinggi serta menghasilkan
10 formasi kristal CaO monodispersi dengan kemampuan dispersi yang baik. Gliserol dapat menghasilkan kerekatan dan kestabilan tinggi pada larutan campuran yang dapat mencegah terjadinya agregasi pada partikel kalsium dan menghasilkan formasi partikel nano kalsium dengan yield yang tinggi (Li dkk., 2005). Ukuran partikel lebih kecil dan morfologi yang berbeda menunjukkan bahwa pelarut organik memiliki peranan dalam mengontrol nukleasi dan orientasi dari kristal (Kanade, 2006).
3.3 Hasil Keseluruhan
Penggunaan pelarut berupa air, gliserol, etilen glikol, dietilen glikol dan polietilen glikol 400 dalam mensintesis CaO melalui metode kopresipitasi telah berhasil membentuk partikel CaO berukuran nano. Hal tersebut menunjukkan bahwa metode kopresipitasi merupakan metode yang cukup baik digunakan sebagai metode dalam mensintesis partikel nano. Kehadiran pelarut dalam sintesis partikel nano juga sangat penting dalam mengontrol morfologi dan ukuran partikel, hal ini terlihat pada analisis SEM yang menunjukkan morfologi yang berbeda dengan penggunaan pelarut yang berbeda serta ukuran partikel yang dihasilkan bervariasi dengan penggunaan pelarut yang berbeda. Melalui perhitungan dengan persamaan Scherrer terlihat bahwa penggunaan pelarut organik dapat membentuk ukuran partikel yang lebih kecil dibandingkan dengan pelarut air. Selain itu, penggunaan pelarut juga mempengaruhi rendemen fasa CaO yang terbentuk. Melalui analisis menggunakan rietica diperoleh hasil dimana pelarut air menghasilkan rendemen fasa CaO yang paling banyak. Hubungan antara ukuran partikel dengan %berat fasa CaO dapat dilihat pada gambar 3.4.
Bila ditinjau dari kepolarannya maka urutan pelarut dengan kepolaran tinggi ke rendah adalah sebagai berikut:
Air >Gliserol >Etilen Glikol >Dietilen Glikol >Polietilen Glikol
Pada gambar 3.4 terlihat bahwa penggunaan pelarut air yang memiliki kepolaran tinggi dapat menghasilkan rendemen fasa CaO paling besar, akan tetapi ukuran partikel yang dihasilkan cukup besar yaitu mendekati batas ukuran partikel nano (mendekati 100 nm). Sedangkan pelarut etilen glikol mampu
menghasilkan ukuran partikel yang paling kecil dibandingkan pelarut lain, akan tetapi rendemen fasa CaO yang dihasilkan cukup kecil.
Gambar 3.4 Hubungan ukuran partikel dengan %berat fasa CaO pada media pelarut air, gliserol, etilen glikol, dietilen glikol, dan polietilen glikol.
Pelarut yang baik untuk penelitian ini adalah pelarut yang dapat menghasilkan ukuran partikel kecil dengan rendemen fasa CaO yang besar. Dari kelima pelarut yang diuji nampak bahwa pelarut dietilen glikol memiliki dua kriteria tersebut, hal ini menunjukkan bahwa pelarut dietilen glikol adalah pelarut yang sangat baik digunakan dalam sintesis partikel nano CaO. Pelarut dengan kepolaran tinggi seperti air akan melarutkan secara sempurna kalsium asetat yang bersifat polar, hal ini dapat mengakibatkan kristal CaO yang terbentuk adalah kristal sejati yang memiliki ukuran partikel yang besar. Penggunaan pelarut dengan kepolaran yang sangat rendah dapat menyebabkan aglomerasi karena banyak partikel dari kalsium asetat yang sukar larut sehingga mengakibatkan ukuran partikel CaO yang dihasilkan juga akan besar. Pelarut dietilen glikol memiliki kepolaran sedang sehingga mampu menghasilkan koloid yang dapat menyebabkan terbentuknya partikel berukuran kecil-kecil.
IV. KESIMPULAN
Partikel nano CaO telah berhasil disintesis menggunakan metode kopresipitasi dengan prekursor kalsium asetat dalam media
11 pelarut air, etilen glikol, dietilen glikol, polietilen glikol, dan gliserol. Hasil XRD menunjukkan bahwa CaO yang dipreparasi dengan pelarut etilen glikol memiliki kristalinitas yang paling rendah dibandingkan dengan pelarut air, polietilen glikol, dietilen glikol dan gliserol. Berdasarkan spektra FTIR diketahui bahwa pada sampel CaO masih terdapat gugus CO dari CaCO3 dan OH dari Ca(OH)2. Hasil analisis dengan SEM menunjukkan bahwa penggunaan pelarut yang berbeda telah menghasilkan morfologi yang berbeda pula. Dari perhitungan Scherrer dan analisis rietica diperoleh pelarut yang paling baik adalah pelarut dietilen glikol yang menghasilkan partikel nano CaO sebesar 72,13 nm dengan %berat CaO sebesar 93,34.
V. UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada Dr. Didik Prasetyoko, M.Sc., Dra. Ratna Ediati, MS, PhD atas bimbingannya sampai terselesainya penelitian ini. Orang tua yang tiada henti mendukung dan mendoakan anak-anaknya. Pak Hamzah Fansuri selaku koordinator TA serta semua pihak yang terlibat dalam pembuatan makalah ini
VI. DAFTAR PUSTAKA
Adam, F., dan Wong, M. S., (2011), The Synthesis of Organic Carbonates Over Nanocrystalline CaO Prepared Via Microemulsion Technique,
Catalysis Communications, 13, 87– 90.
Agrinier, P., Deutsch, A., Scharer, U., Martinez, I., (2001), Fast Back-Reactions of Shock-Released CO2 from Carbonates: An experimental approach, Geochimica et CosmochimicaActa, 65, 2615–2632. Bhargava, A., Alarco, J. A., Mackinnon, D.R., Page, D., Ilyushechkin, A., (2007), Synthesis and Characterisation of Nanoscale Magnesium Oxide Powders and Their Application in Thick Films of Bi2Sr2CaCu2O8, Materials Letters,
34, 133–142
Cho, Y.B., Seo, G., Chang, D.R., (2009), Transesterification of tributyrin with methanol over calcium oxide catalysts prepared from various
precursors, Fuel Processing Technology, 90, 1252–1258.
Granados, M,L., Poves, M.D.Z., Alonzo, D.M., Marizcal, R., Galisteo, F.C., Moreno-Tost, R., Santamaria, J., dan Fierro, J.L.G., (2007), Biodiesel from Sunflower Oil Using Activated Calcium Oxide, Applied Catalysis B, Enviromental, 73, 317-326.
HORIBA Scientific, (2010), A Guidebook to Particle size analysis, HORIBA Instruments, Inc, USA.
Iijima, M., dan Kamiya, H., (2009), Surface Modification for Improving the Stability of Nanoparticles in Liquid Media, KONA Powder and Particle J, 27, 119-129.
Kanade, K.G., Kale, B.B., Aiyer, R.C., Das, B.K., (2005), Effect of solvents on the synthesis of nano-size zinc oxide and its properties, Materials Research Bulletin, 41, 590–600. Kwon, Y.J., Kim, K.H., Lim, C.S., Shim,
K.B., (2002), Characterization of ZnO nanopowders synthesized by the polymerized complex method via an organochemical route, J.Ceram, Pro Res,3, 146-149.
Lee, S.J., dan Lee, C.H., (2002), Fabrication of Nano-Sized TiO2 Powder Via an Ethylene Glycol Entrapment Route,
Materials Letters, 56, 705– 708. Li, Y., Cai, M., Rogers, J., Xu, Y., dan Shen,
W., (2006), Glycerol-Mediated Synthesis of Ni and Ni/NiO Core-Shell Nanoparticles, Materials Letters, 60, 750–753.
Liu, X., He, H., Wang, Y., Zhu, S., Piao, X., (2008), Transesterification of Soybean Oil to Biodiesel Using CaO as a Solid Base Catalyst, Fuel, 87, 216–221.
Park, J.H., dan Oh, S.G., (2009), Preparation of CaO as OLED getter material through control of crystal growth of CaCO3 by block copolymers in aqueous solution, Materials Research Bulletin, 44, 110–118. Rahman, R., (2008), Pengaruh Proses
Pengeringan, Anil, dan Hidrotermal Terhadap Kristallinitas Nanopartikel TiO2 Hasil Proses Sol-Gel, FT, Departemen Metalurgi dan Material, Universitas Indonesia.
12 Ruiz, M.G., Hernández, J., Baños, L.,
Montes, J.N., dan García, M.E.R., (2009), Characterization of Calcium Carbonate, Calcium Oxide, and Calcium Hydroxide as Starting Point to the Improvement of Lime for Their Use in Construction, J. of Materials in Civil Engineering, 694-698.
Taufiq, Y.Y.H., Lee, H.V., Hussein., Yunus, R., (2010), Calcium-Based Mixed Oxide Catalysts For Methanolysis of Jatropha Curcas Oil to Biodiesel,
Biomass and Bioenergy,35, 827-834. Trung, T., Cho, W.J., Ha, C.S., (2003), Preparation of TiO2 nanoparticles in glycerol-containing solutions,
Materials Letters,57, 2746–2750. Umdu, E.S., (2008), Methyl Ester Production
From Vegetable Oils on Heterogeneous basic Catalysts, Engineering and Sciences of İzmir Institute of Technology.
West, Anthoni R., (1989), Solid State Chemistry and Its Application, John Wiley & Sons, New York.
Xin, B.H., Zhen S.X., Hua, L.X., Yong, L.S., (2009), Synthesis of Porous CaO Microsphere and Its Aplication in Catalyzing Transesterification Reaction for Biodiesel, Trans Nonferrous Met. Soc,19, 674-677. Yulianti, C. H., (2011), Sintesis Katalis
Nanopartikel Campuran Oksida CaO dan ZnO dan Aktivitasnya pada Transesterifikasi Refines Palm Oil untuk Produksi Biodiesel, Fakultas MIPA, Jurusan Kimia, ITS, Surabaya.
Zhang, J., Sun, L., Yin, J., Su, H., Liao, C., Yan, C., (2002), Control of ZnO Morphology via a Simple Solution Route. Chem. Mater,14, 4172.