Percobaan 6
DISTRIBUSI ZAT TERLARUT ANTARA DUA JENIS PELARUT YANG BERCAMPUR
Candra Tri Kurnianingsih
Lab. Kimia Fisika Jurusan Kimia Universitas Negeri Semarang Gedung D8 Lt 2 Sekaran Gunungpati Semarang, Indonesia kode pos
50229
candratri95@yahoo.co.id, 089667721333
ABSTRAK
Tujuan dari percobaan distribusi zat terlarut antara dua jenis pelarut yang tidak bercampur adalah menentukan koefisien distribusi zat terlarut dalam dua jenis pelarut yang tidak bercampur. Metode yang digunakan dalam percobaan ini adalah metode pemisahan non kontinyu cair-cair yang berbeda polarisabilitas. Percobaan ini menggunakan prinsip Hukum Nerst. Jika ke dalam system dua fasa cair yang tidak saling bercampur dimasukkan solute yang tidak dapat larut dalam kedua pelarut tersebut, maka akan terjadi pembagian kelarutan karena perbedaan kepolaran antara air (polar) dan eter (non polar) dan menghasilkan dua lapisan berupa lapisan air di bawah dan lapisan eter di atas berdasarkan densitas yang dimiliki oleh kedua cairan. Konsentrasi asam asetat pada 1M, 0.8M, 0.6M, 0.4M, dan 0.2M yaitu 0,6366M, 0,4399M, 0,4804M, 0,272M, dan 0,1587M. KD asam asetat dalam pelarut eter dan air pada masing-masing variasi konsentrasi yaitu 0,578; 0,782; 0,233; 0,438; dan 0,226 dengan KD rata-rata adalah 0,452 yang berarti perbandingan asam asetat di fase organik dengan asam asetat di fase air adalah sekitar 45,2%.
Kata kunci : Distribusi; Koefisien distribusi; Pemisahan; Titrasi.
ABSTRACT
The purpose of the experiment distribution of dissolved substances between two types solvents not mixed is to determine the distribution coefficient of the solute in the two types of solvents which do not mix. The method used in this experiment is a method of non-continuous separation of liquid-liquid different polarizability. This experiment uses the principle Nerst Law. If in a system of two liquid phases which are not intermingled included solute insoluble in both the solvent, there will be a division of solubility due to differences in polarity between water (polar) and ether (non-polar) and produces two layers form a layer of water below and the ether layer above is based on the density of which is owned by the two liquids. Concentration of acetic acid at 1M, 0.8M, 0.6M, 0.4M, and 0.2M is 0,6366M, 0,4399M, 0,4804M, 0,272M, and 0,1587M.
KD of acetic acid in ether and H2O is 0,578; 0,782; 0,233; 0,438; and 0,226 which the
average of KD is 0,452 that means ratio acetic acid in organic with acetic acid in H2O
is around 45,2%.
Keywords : Coefficient distribution; Distribution; Separation, Titration.
PENDAHULUAN
Tujuan dari percobaan distribusi zat terlarut antara dua jenis pelarut yang tidak bercampur adalah menentukan koefisien distribusi zat terlarut dalam dua jenis pelarut yang tidak bercampur. Metode yang digunakan dalam percobaan ini adalah metode pemisahan non kontinyu cair-cair yang berbeda polarisabilitas.
Ekstraksi campuran merupakan suatu teknik untuk memisahkan suatu zat kimia yang terlarut dalam air dengan cara pemindahan zat kimia tersebut ke fase non polar. Pada umumnya ekstraksi menggunakan pelarut air dan pelarut non polar karena kedua jenis pelarut tersebut tidak dapat saling campur karena berbeda kepolaran. Namun zat yang akan didapatkan harus memenuhi syarat dapat larut ke dalam kedua pelarut tersebut. Perbedaan kepolaran dapat memisahkan zat kimia yang diinginkan. Dengan metode ekstraksi ini juga dapat digunakan untuk menentukan koefisien distribusi suatu zat terlarut di dalam kedua jenis pelarut.
Ekstraksi meliputi distribusi zat terlarut diantara dua pelarut yang tidak dapat bercampur. Pelarut umum yang biasa dipakai adalah air dan pelarut organic lain seperti CHCl3, eter, atau pentane. Menurut Arsyad (2001), ekstraksi akan lebih efisien apabila
dilakukan berulangkali dengan jumalah pelarut yang lebih kecil daripada jumlah pelarut banyak tetapi ekstraksinya hanya dilakukan satu kali.
Hukum distribusi dapat dirumuskan apabila suatu zat terlarut terdistribusi antara dua pelarut yang tidak dapat bercampur, maka pada suatu temperature yang konstan untuk setiap spesi molekul terdapat angka banding distribusi yang konstan antara kedua pelarut. Menurut Syehla (1990), harga angka banding berubah dengan sifat dasar kedua pelarut, sifat dasar zat terlarut, dan temperature.
Menurut Soebagio (2002), berdasarkan hukum distribusi Nerst, apabila ke dalam kedua pelarut yang tidak saling bercampur dimasukkan solut yang dapat larut dalam kedua pelarut tersebut maka akan terjadi pembagian kelarutan. Kedua pelarut tersebut umumnya pelarut organik dan air. Solute akan terdistribusi dengan sendirinya ke dalam dua pelarut tersebut setelah di kocok dan dibiarkan terpisah. Perbandingan konsentrasi solut di dalam kedua pelarut tersebut tetap, dan merupakan suatu tetapan pada suhu tetap.
Tetapan tersebut disebut tetapan distribusi atau koefisien distribusi. Koefisien distribusi dinyatakan dengan berbagai rumus sebagai berikut :
KD = C2/C1 atau KD = Co/Ca Keterangan :
KD = koefisien distribusi
C2 = konsentrasi zat terlarut dalam pelarut organik
C1 = konsentrasi zat terlarut dalam pelarut air
Rumus koefisien distribusi tersebut menunjukkan bahwa jika harga KD besar,
solute secara kuantitatif akan cenderung terdistribusi lebih banyak ke dalam pelarut organic, sedangkan jika harga KD kecil, solute secara kuantitatif akan cenderung
terdistribusi lebih sedikit ke dalam pelarut organic. Rumus tersebut hanya berlaku apabila solute tidak terionisasi dalam salah satu pelarut, solute tidak berasosiasi dalam salah satu pelarut, dan zat terlarut tidak dapat bereaksi dengan salah satu pelarut atau adanya reaksi- reaksi lain.
Hukum distribusi banyak dipakai dalam proses ekstraksi, analisis dan penentuan tetapan kesetimbangan. Penggunaan ekstraksi dalam laboratorium dipakai untuk mengambil zat-zat terlarut dalam air dengan menggunakan pelarut-pelarut organic yang tidak bercampur seperti eter, CHCl3, CCl4, dan benzene, sedangkan dalam industry dipakai untuk
menghilangkan zat-zat yang tidak disukai dalam hasil seperti minyak tanah dan minyak goreng.
METODE
Metode yang digunakan dalam percobaan ini adalah metode pemisahan non kontinyu cair-cair yang berbeda polarisabilitas.
Alat
Alat-alat yang digunakan dalam percobaan ini yaitu corong pisah 250mL 1 buah, erlenmeyer 100mL 4 buah, erlenmeyer 200mL 2 buah, buret, klem, statif, pipet volume 10mL 2 buah, ballpipet 1 buah, pipet tetes 2 buah, beakerglass 100mL 1 buah, termometer, botol semprot, spatula, pengaduk dan corong kaca.
Bahan
Bahan-bahan yang digunakan dalam percobaan ini adalah aquades, NaOH 0,5M 150mL, asam oksalat 0,25M 50mL, eter 60mL, asam asetat dengan konsentrasi 1M; 0,8M; 0,6M; 0,4M dan 0,2M, dan indikator fenoftalein.
Cara Kerja
Persiapan percobaan diawali dengan membuat larutan asam asetat, NaOH, dan asam oksalat serta melakukan standarisasi larutan. Pertama-tama membuat masing-masing 50mL larutan asam asetat yang konsentrasinya 1, 0.8, 0.6, 0.4, dan 0.2 M dari pengenceran asam asetat 1 M. Mengambil masing-masing 10mL dan dimasukkan ke dalam corong pemisah. Mengambil 10mL dari sisa larutan lalu memasukkannya ke dalam Erlenmeyer dan menitrasinya dengan larutan standar NaOH 0,5 M. Konsentrasi mula-mula asam asetat dapat diketahui dari hasil titrasi yang dilakukan.
Langkah selanjutnya adalah menambahkan 10mL eter pada larutan asam asetat dalam corong pemisah, lalu mengkocoknya dengan kuat selama 30 detik dan mendiamkannya selama 30 detik lalu mengkocoknya kembali selama 30 detik dan mendiamkannya kembali selama 3-5 menit supaya mencapai kondisi seimbang. Selanjutnya memisahkan larutan air. Pemisahan dilakukan dengan mengambil 10mL larutan fasa bawah dan melakukan titrasi sebanyak dua kali dengan NaOH 0,5 M dengan menambahkan 2 tetes indicator PP.
Konsentrasi asam asetat dalam air pada kondisi seimbang dapat ditentukan, sehingga konsentrasi asam asetat dalam eter pada kondisi seimbang juga dapat ditentukan dengan menghitung konsentrasi awal dan dalam air pasa kondisi seimbang. Langkah selanjutnya adalah melakukan percobaan yang sama untuk semua variasi konsentrasi asam asetat.
HASIL DAN PEMBAHASAN Data Hasil Percobaan
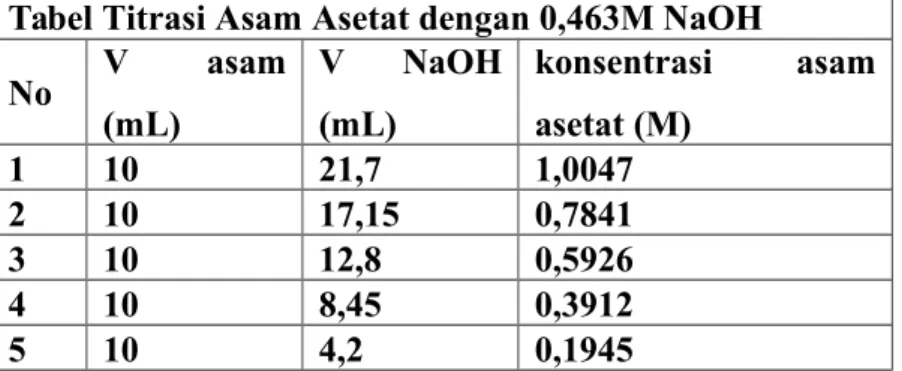
Tabel Titrasi Asam Asetat dengan 0,463M NaOH
No V asam (mL) V NaOH (mL) konsentrasi asam asetat (M) 1 10 21,7 1,0047 2 10 17,15 0,7841 3 10 12,8 0,5926 4 10 8,45 0,3912 5 10 4,2 0,1945
Tabel 1. Konsentrasi asam asetat
Titrasi Asam Asetat Fase Air dengan 0,463M NaOH No
V asam fase
1 4 5,5 0,6366
2 4 3,8 0,4399
3 4 4,15 0,4804
4 4 2,35 0,272
5 3,5 1,2 0,1587
Tabel 2. Konsentrasi fase air
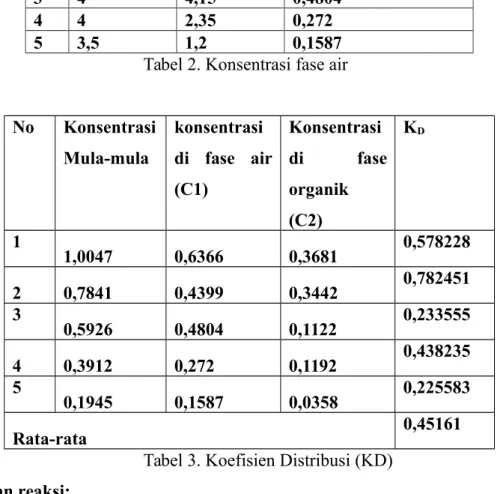
No Konsentrasi Mula-mula konsentrasi di fase air (C1) Konsentrasi di fase organik (C2) KD 1 1,0047 0,6366 0,3681 0,578228 2 0,7841 0,4399 0,3442 0,782451 3 0,5926 0,4804 0,1122 0,233555 4 0,3912 0,272 0,1192 0,438235 5 0,1945 0,1587 0,0358 0,225583 Rata-rata 0,45161
Tabel 3. Koefisien Distribusi (KD) Persamaan reaksi:
CH3COOH (aq) + NaOH (aq) CH3COONa (aq) + H2O (l) Pembahasan
Percobaan distribusi zat terlarut antara dua jenis pelarut yang tidak bercampur bertujuan untuk menentukan koefisien distribusi zat terlarut dalam dua jenis pelarut yang tidak bercampur. Metode yang digunakan dalam percobaan ini adalah metode pemisahan non kontinyu cair-cair yang berbeda polarisabilitas. Pemisahan non kontinyu sangat baik dilakukan untuk suatu zat terlarut yang memiliki perbandingan distribusi besar. Kelebihan metode ini adalah karena murah dan mudah yaitu cukup dengan menambahkan suatu pelarut non polar.
Percobaan ini menggunakan prinsip Hukum Nerst. Jika ke dalam system dua fasa cair yang tidak saling bercampur dimasukkan solute yang tidak dapat larut dalam kedua pelarut tersebut, maka akan terjadi pembagian kelarutan karena perbedaan kepolaran antara air (polar) dan eter (non polar) dan menghasilkan dua lapisan berupa lapisan air di bawah dan lapisan eter di atas berdasarkan densitas yang dimiliki oleh kedua cairan.
Percobaan ini diawali dengan menyiapkan larutan asam oksalat sebagai larutan standar primer untuk menstandarisasi larutan NaOH. Larutan NaOH perlu distandarisasi dengan larutan standar primer karena bersifat higroskopis yaitu mudah mengikat molekul air yang berada pada udara bebas. Selanjutnya menitrasi 5mL 0,25M larutan asam oksalat dengan larutan NaOH. Hasil titrasi pertama ditandai dengan warna merah muda yang muncul dan tidak hilang lagi, setelah mencapai volume NaOH 5,5mL dan pada titrasi kedua volume NaOH 5,3mL. Perhitungan konsentrasi NaOH yang dilakukan sebagai larutan standar sekunder didapatkan nilai konsentrasi 0,463M.
Selanjutnya adalah membuat larutan asam asetat 0,1M sebanyak 150mL. Asam asetat berperan sebagai zat terlarut karena asam asetat dapat larut dalam air dan juga mudah larut dalam pelarut organik sehingga senyawa ini mudah dipindahkan ke fase organik. Pelarut organik yang digunakan pada percobaan ini adalah dietil eter.
Selanjutnya melakukan pengenceran dari larutan asetat 0,1M yang masing-masing menjadi 50mL larutan dengan konsentrasi 0,8M, 0,6M, 0,4M, dan 0,2M. Sebelum dipisahkan menuju pelarut organik, terlebih dahulu masing-masing larutan dengan konsentrasi tersebut dititrasi dengan larutan standar NaOH untuk mengetahui konsentrasi masing-masing larutan mula-mula. Larutan pertama memerlukan NaOH sebanyak 21,8mL dan 21,6mL. Larutan kedua memerlukan NaOH sebanyak 17,1mL dan 17,2mL. Larutan ketiga memerlukan NaOH sebanyak 12,9mL dan 12,7mL. Larutan keempat memerlukan NaOH sebanyak 8,4mL dan 8,5mL. Larutan kelima memerlukan NaOH sebanyak 4,1mL dan 4,3mL. Perhitungan konsentrasi yang dilakukan, didapatkan konsentrasi pada larutan pertama 1,0047M, larutan kedua 0,7841M, larutan ketiga 0,5926M, larutan keempat 0,39122M, dan larutan kelima 0,1945M.
Selajutnya adalah mengambil 10mL larutan asam asetat 1,0047M kemudian dimasukkan ke dalam corong pemisah kemudian ditambah dengan 10mL eter. Kemudian corong pemisah dikocok dengan kuat selama 30 detik dan mendiamkannya selama 30 detik lalu mengkocoknya kembali selama 30 detik dan mendiamkannya kembali selama 3-5 menit supaya mencapai kondisi seimbang. Pada saat melakukan pengkocokan larutan menjadi dingin karena terjadinya penurunan temperature. Pada saat dikocok, juga diselingi dengan membuka tutup corong pisah 5 detik sekali agar gas akibat eter yang mudah menguap yang berada di dalam corong dapat keluar sehingga tidak meletup keras dan corong pemisah akan meledak. Setelah itu mengambil lapisan air yang berada
dibawah dengan cara membuka kran corong pemisah. Larutan yang diambil adalah fasa bawah karena dicurigai terdapat asam asetat dalam air karena adanya perbedaan massa jenis pelarut organic dengan air. Massa jenis air (0.99) lebih besar dari massa jenis eter (0,66). Secara teknik, faktor pengkocokan sangat penting dan mempengaruhi proses distribusi suatu larutan organic pada pelarut organic dan air yang tidak saling campur. Pengkocokan berfungsi untuk memperbesar luas permukaan untuk membantu proses distribusi asam asestat pada kedua fasa. Selain itu, temperature juga mempengaruhi proses ekstraksi karena ekstraksi harus dilakukan pada temperature konstan.
Larutan pada fasa bawah selanjutnya dititrasi dengan NaOH untuk mengetahui konsentrasi asam asetat pada fase air. Titrasi ini merupakan jenis titrasi asam basa dimana asamnya yaitu asam asetat yang bertindak sebagai titrat sedangkan basa yaitu NaOH yang bertindak sebagai titran. Langkah titrasi tersebut diulangi untuk masing-masing konsentrasi larutan. Setelah dilakukan perhitungan, konsentrasi asam asetat pada larutan pertama sampai kelima berturut-turut yaitu 0,6366M, 0,4399M, 0,4804M, 0,272M, dan 0,1587M. Persamaan reaksi yang terjadi:
CH3COOH (aq) + NaOH (aq) CH3COONa (aq) + H2O (l)
Selanjutnya adalah menentukan koefisien distribusi cara dengan membandingkan konsentrasi asam asetat dalam fase organik dengan konsentrasi asam asetat dalam fase air. Perhitungan yang dilakukan, didapatkan harga KD pada masing-masing variasi konsentrasi yaitu 0,578; 0,782; 0,233; 0,438; dan 0,226 dengan KD rata-rata adalah 0,452.
Perbedaan nilai KD yang didapatkan terjadi karena beberapa faktor, yaitu:
Hasil titrasi yang dilakukan didapatkan warna larutan yang terlalu merah pada erlenmeyer.
Kurang tepatnya volume yang diambil pada tiap penuangan larutan karena alat yang digunakan kurang berfungsi dengan maksimal.
Selisih waktu pengocokan pada corong pemisah antara pengocokan pertama sampai kelima tidak tepat sama.
Pengocokan pada corong pemisah tidak dilakukan pada temperatur yang tepat sama.
KESIMPULAN
Berdasarkan percobaan yang dilakukan, dapat disimpulkan bahwa:
Dua pelarut yang memiliki sifat kepolaran dan masa jenis yang berbeda tidak dapat bercampur satu sama lain.
Jumlah zat terlarut yang terdistribusi ke dalam dua pelarut yang tidak bercampur dapat ditentukan dengan menghitung konsentrasi zat terlarut yang terdapat di kedua pelarut.
Konsentrasi asam asetat yang terdistribusi pada air lebih besar daripada yang ada di dalam eter karena sifat polar dan non polar.
Semakin besar KD berarti semakin banyak zat terlarut yang berpindah ke pelarut organik.
Konsentrasi asam asetat pada 1M, 0.8M, 0.6M, 0.4M, dan 0.2M berturut-turut yaitu 0,6366M, 0,4399M, 0,4804M, 0,272M, dan 0,1587M.
KD asam asetat dalam pelarut eter dan air pada masing-masing variasi konsentrasi yaitu 0,578; 0,782; 0,233; 0,438; dan 0,226 dengan KD rata-rata adalah 0,452 yang berarti perbandingan asam asetat di fase organik dengan asam asetat di fase air adalah sekitar 45,2%.
SARAN
Pastikan semua alat dan bahan yang digunakan dalam kondisi baik.
Teknik pengocokan larutan pada corong pemisah usahakan sama dalam hal temperature, waktu, maupun tingkat pengocokannya.
Setiap melakukan pemindahan larutan, pastikan larutan tersebut berpindah semuanya sehingga tidak ada larutan tang tertinggal karena akan berpengaruh pada hasil volume percobaannya.
DAFTAR PUSTAKA
Arsyad, M.N. 2001. Kamus Kimia Arti dan Penjelasan Istilah. Gramedia: Jakarta. Soebagio, dkk. 2000. Kimia Analitik II (JICA). Universitas Negeri Malang. Malang. Svehla, G. 1985. VOGEL : Buku Teks Analisis Anorganik Kualitatif Makro dan