103
V. PENGARUH FRAGMENTASI BUATAN TERHADAP
PERKEMBANGAN OOSIT SPONS Aptos aaptos
PENDAHULUAN
Latar Belakang
Fragmentasi spons merupakan cara yang digunakan untuk mempercepat perbanyakan koloni spons di alam. Perbanyakan ini memiliki banyak tujuan antara lain untuk rehabilitasi habitat mengingat pentingnya peran spons di perairan dan untuk menyediakan bahan contoh terhadap eksplorasi kandungan bahan bioaktif spons. Selain itu juga dapat digunakan untuk menyediakan stok koloni yang cukup bagi pengembangan dan pemanfaatan secara langsung spons untuk berbagai kegiatan seperti farmasi, ikan hias (ornamental) dan industri toiletries.
Spons Aaptos aaptos yang digunakan pada penelitian ini cenderung lebih digunakan untuk bahan obat-obatan setelah diketahui mengandung aptamine dan alkaloid. Aktivitas penghambatan kandungan yang dimiliki spons Aa adalah terhadap a-adrenoreceptor (Munro et al., 1999). Selain itu, senyawa alkaloid lain yang didapatkan dari spons Aa memiliki aktivitas sebagai antikanker, anti- HIV dan anti-mikroba (Nakamura et al., 1987). Mengingat manfaat yang sangat banyak ini maka tidak menutup kemungkinan spons ini nantinya akan dieksploitasi secara besar-besaran untuk kepentingan farmasi. Penemuan-penemuan terhadap kandungan farmaka tersebut masih dilakukan di negara lain dan belum di Indonesia. Dengan potensi lahan dan iklim yang sangat sesuai, maka Indonesia merupakan tempat terbaik bagi pengembangan spons Aa di alam.
Upaya untuk memperbanyak stok spons Aa adalah melalui metode-metode fragmentasi yang dilakukan. Seperti yang sudah dilakukan sebelumnya di Pulau Pari, penelitian dengan menggunakan metode rak horisontal dan vertikal memiliki tingkat keberhasilan yang tinggi baik ditinjau dari sintasan maupun dari laju
104 pertumbuhan spesifiknya. Selain itu berdasarkan hasil penelitian yang diperoleh sebelumnya seperti yang tertera pada Bab III, bahwa perlukaan terhadap tubuh spons sampai berjumlah 4 buah luka tidak mempengaruhi sintasan dan laju pertumbuhannya. Demikian pula yang terjadi dengan perkembangan gametnya tidak berbeda nyata dengan spons yang tidak difragmentasi.
Beberapa kendala yang dihadapi pada saat fragmentasi dilakukan pertama kali adalah adanya predator, cuaca dan tingginya kekeruhan perairan. Predator terhadap fragmen spons Aa adalah ikan Pomacentridae yang mematuk-matuk fragmen spons pada saat pertama kali diletakkan. Kondisi ini sangat mengkhawatirkan karena habisnya tubuh spons dan terlepasnya tubuh dari tali yang digunakan untuk mengikat spons. Terparah adalah terbentuknya nekrosis baru yang menyebabkan spons mati, membusuk dan terlepas dari tali fragmentasi. Kekeruhan perairan juga merupakan faktor penghambat pada saat fragmentasi dilakukan karena tubuh spons yang terluka sangat rentan ditempeli oleh organisme mikro yang menempel (fouling) dan sedimen sehingga saluran air pada spons akan tertutup dan menyebabkan tidak adanya sirkulasi air yang bagus sehingga menyebabkan matinya spons. Cuaca yang tidak mendukung pada saat-saat tertentu menyebabkan tidak dapat dilakukan pengontrolan terhadap spons yang difragmentasi. Kondisi ini menyebabkan tertutupnya spons dengan makroalga dan dapat menyebabkan kematian karena keberadaan makroalga dapat menghambat penetrasi cahaya matahari masuk sehingga fotosintesis oleh organisme simbion yang hidup pada spons tidak dapat dilakukan.
Ketiga kendala tersebut dapat diatasi dengan melakukan fragmentasi spons di kolam terkontrol secara in vitro karena beberapa aspek yang mendukung pertumbuhan dan perkembangan spons dapat dikendalikan. Penting untuk melakukan penelitian fragmentasi spons Aa di kolam terkontrol agar spons dapat hidup secara maksimal dan selanjutnya setelah beberapa waktu dapat dipindahkan kembali ke habitat asal di alam untuk menjamin pertumbuhannya.
105 Tujuan
Penelitian ini bertujuan untuk :
1. Mengkaji pengaruh fragmentasi terhadap perkembangan oosit spons Aa yang di pelihara di alam dan di kolam dan sebagai pembandingnya juga dikaji terhadap spons Aa yang tidak difragmentasi di alam
2. Mengkaji pengaruh pemindahan spons dari habitat alaminya di Pulau Pari ke kolam terkontrol di Ancol dan melakukan fragmentasi terhadap spons tersebut. Pengaruh ini diukur dampaknya terhadap sintasan, laju pertumbuhan spesifik, dan perkembangan oosit spons Aa
106 METODE PENELITIAN
Waktu dan Lokasi Penelitian
Penelitian untuk melakukan fragmentasi terhadap spons Aaptos aaptos dilakukan di Pulau Pari, Kepulauan Seribu, Jakarta pada kedalaman 7 meter dan di kolam percobaan Pusat Studi Ilmu Kelautan Ancol, DKI Jakarta. Pengukuran terhadap laju pertumbuhan spesifik dilakukan setiap bulan. Pengambilan sample histologis dilakukan pada spons yang tidak di fragmentasi, yang difragmentasi di alam dan yang difragmentasi di kolam percobaan. Waktu penelitian dilaksanakan dari bulan Juni 2007 sampai dengan April 2008. Penelitian fragmentasi dilakukan baik di habitat alam di Pulau Pari maupun di kolam percobaan dilakukan mulai bulan Juni 2007 sampai Februari 2008 dan analisis histologis dilakukan mulai bulan Januari sampai April 2008. Perawatan spons yang tidak dan yang telah difragmentasi dilakukan di Pulau Pari dan di Pusat Studi Ilmu Kelautan Ancol, DKI Jakarta. Sedangkan pengawetan dan pengamatan sampel spons jenis Aaptos aaptos dilakukan di Laboratorium Histologi Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Fragmentasi dilakukan di kolam percobaan adalah untuk mengamankan fragmen spons dari gangguan predator seperti ikan Pomacentridae yang mematuk fragmen spons pada saat pertama kali diletakkan dan dapat menyebabkan kematian. Sampel spons Aaptos aaptos yang digunakan untuk fragmentasi di kolam berasal dari Pulau Pari Gugusan Pulau Seribu DKI Jakarta.
Prosedur Penelitian
Fragmentasi Buatan
Spons Aaptos aaptos dipelihara di habitat buatan berupa kolam besar dengan panjang 5 m, lebar 1,5 m dan tinggi 1,5 m dengan ketinggian air dari dasar kolam 1 meter dan kolam kecil yang panjangnya 3 m, lebar 1,5 m dan tinggi 1,5 m dengan ketinggian air dari dasar kolam 1 meter. Air kolam berasal dari air laut
107 yang sudah disaring oleh Seaworld, Ancol dan dialirkan dengan pompa berkapasitas besar ke Pusat Studi Ilmu Kelautan Ancol, Jakarta. Pemeliharaan spons Aaptos aaptos berlangsung selama 8 bulan dari Juni 2007 sampai dengan Februari 2008. Tahap pemeliharaan, spons memperoleh asupan makanan dari air kolam dan pemberian pakan buatan selama 3 bulan, namun pemberian pakan buatan ini dihentikan karena memicu tumbuhnya makroalga dan dikhawatirkan akan mengganggu pertumbuhan spons karena makroalga tersebut menghalangi cahaya matahari sehingga dapat menghambat berlangsungnya proses fotosintesis organisme simbion pada spons. Selain itu dilakukan pembersihan kolam dengan cara membersihkan lumut dan alga yang dapat mengganggu pertumbuhan spons serta dilakukan pergantian air secara periodik setiap 2 minggu sekali. Gambar 33 adalah gambar kolam pemeliharaan spons Aaptos aaptos.
Persiapan kolam dibuat untuk pengairan, arus, suhu dan salinitas dan dilakukan selama dua bulan sebelum spons dipindahkan dari alam ke kolam. Suhu dan salinitas dikolam berkisar antara 29-31°C dan salinitas 29 – 35 %o. Kondisi air pada sistem tertutup berputar selama 24 jam terus menerus dengan pergantian air laut baru dilakukan setiap tiga hari sekali. Pergantian air laut pada kolam dilakukan dengan cara memasukan air laut baru sepertiga dari volume kolam. Sebelum air laut yang baru dimasukan ke kolam, terlebih dahulu diendapkankan selama tiga hari pada bak penampungan dengan aerasi selama 24 jam.
Spons yang dimasukan ke kolam diaklimatisasi terlebih dahulu selama kurang lebih satu jam. Spons masih berada dalam plastik tetapi bagian atas dibuka untuk mengisi udara yang baru dan menyamakan suhu yang didalam plastik dengan yang ada dikolam. Setelah suhu dalam plastik sama dengan yang ada dikolam maka spons diletakan dikeranjang selama satu malam untuk adaptasi di kolam (Gambar 34). Selama aklimatisasi tersebut, spons tempatkan di lokasi yang berarus yang disemprotkan oleh pipa paralon yang telah disambungkan dengan pompa air. Pagi hari (sehari setelah diletakkan di kolam) spons ditaruh didasar kolam (Gambar 34) dengan melakukan pengamatan sebelumnya dan memastikan bahwa spons tidak stress dan sudah dapat beradaptasi pada sistem tertutup.
108 Pemeliharaan spons dilakukan selama satu bulan sebelum difragmentasi. Pemotongan spons dilakukan menjadi dua fragmen dan dilakukan pada sore hari. Setelah pemotongan, spons diamati tiap minggunya dengan melakukan pengukuran tinggi dan lebar. Parameter pertumbuhan yang diukur adalah panjang lingkar horisontal (plh) yang searah dengan tali polyetilen dan panjang lingkar vertikal (plv) yang berpotongan dengan tali polyetilen, untuk selanjutnya parameter pertumbuhan disebut sebagai plv dan plh (Gambar 6).
Sumber : koleksi Pribadi
Gambar 33. Kolam pemeliharaan spons Aa
(A) (B) Sumber : Koleksi Pribadi
Gambar 34. Spons Aa di habitat buatan; (A) Aa di dalam keranjang adaptasi, (B) Aa di dasar kolam dalam keranjang
109 Perkembangan Gamet
Sebagai perbandingan untuk mengetahui perkembangan gamet spons hasil fragmentasi di kolam maka dilakukan juga pengambilan sample histologis di Pulau Pari terhadap spons yang tidak difragmentasi dan yang di fragmentasi. Pengambilan sampel histologis spons hasil fragmentasi di alam dilakukan mulai tanggal 6 Desember 2007 (setelah 177 hari fragmentasi spons dilakukan) sampai 4 Januari 2008 dan 10 Februari 2008 (setelah 241 hari fragmentasi dilakukan) sampai 8 Maret 2008. Sampel spons hasil fragmentasi yang diambil dari alam adalah yang telah berumur 177 hari (selama 1 fase bulan ) dan 241 hari setelah di fragmentasi (selama 1 fase bulan).
Pengambilan sampel histologis pada spons yang sudah difragmentasi dikolam juga dilakukan setiap fase bulan. Spons yang difragmentasi di kolam merupakan spons yang telah difragmentasi di alam kemudian dipindahkan ke kolam. Pengambilan spons yang sudah difragmentasi di alam untuk dipindahkan di kolam karena berdasarkan uji coba sebelumnya, spons yang belum difragmentasi di alam pada saat dipindahkan ke kolam percobaan mengalami kematian. Hal ini diduga karena kondisi kolam tidak mampu memelihara spons yang berukuran besar. Sebelum difragmentasi di kolam, spons diaklimatisasi terlebih dahulu selama 30 hari. Pengambilan sample histologis dilakukan setelah 6 bulan spons difragmentasi. Pengawetan, pembuatan preparat histologi dan pengamatan sampel spons Aaptos aaptos di lakukan di Laboratorium Histologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Perkembangan gamet hasil fragmentasi baik di alam dan di kolam dikaji secara histologis dengan menggunakan pewarnaan Hematoksilin- Eosin. Pengambilan sampel spons di alam baik yang tidak difragmentasi, maupun yang difragmentasi serta sample spons di kolam dilakukan setiap fase bulan. Sample spons yang tidak difragmentasi di alam diambil pada kedalaman 6-7 meter dengan ukuran (2x2x2) cm3 (Gambar 35). Pengambilan sampel spons yang difragmentasi di alam dilakukan pada kedalaman 7 meter. Jumlah sample yang diambil
masing-110 masing adalah 10 untuk di alam maupun di kolam. Spons yang diambil dipotong dengan pisau stainless stell dan dimasukkan ke dalam plastik sampel. Sampel kemudian difiksasi dalam campuran formalin 40% dan air laut dengan perbandingan 1:9 dalam wadah plastik sampai sampel terendam. Kemudian contoh disimpan dalam keadaan dingin dengan menggunakan cool box. Setelah difiksasi selama satu minggu sampel spons tersebut kemudian didesilfikasi dengan menggunakan HF (hydroflouric acid) (Ilan dan Loya, 1988) dalam larutan Formaldehid, hydroflouric acid, Asetic acid dan Aquades selama sekitar 24 jam dan selanjutnya disimpan dalam alkohol 70% untuk sementara waktu sebelum dilakukan pembuatan preparat histologik.
Sumber : Koleksi Pribadi
Gambar 35. Pengambilan sampel spons. (A) pemotongan spons menjadi dua bagian dan (B) pemotongan spons untuk sampel awetan.
Analisis data
Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup (sintasan) spons dapat diketahui dengan membandingkan antara jumlah fragmen spons yang hidup pada akhir penelitian (Nt) dengan jumlah fragmen awal (N0). Rumus yang digunakan untuk mengetahui tingkat kelangsungan hidup spons adalah persamaan (1)
111 Laju pertumbuhan spesifik
Pengukuran laju pertumbuhan spesifik spons yang difragmentasi dilakukan dengan menggunakan rumus yang sama dengan persamaan (2).
Analisis data histologi
Tingkat kematangan gamet didasarkan pada keberadaan dan perkembangan gamet (oosit dan spermatosit atau kantong sperma) spons pada setiap fase bulan, yaitu pada fase bulan mati, bulan sperempat, bulan purnama dan bulan tigaperempat. Kematangan gamet spons Aaptos aaptos yang tidak difragmentasi di alam, yang difragmentasi di alam dan di kolam dianalisis secara desktriptif dengan cara mengamati karakter jaringan gamet secara histologik pada preparat
dan gambar hasil fotomikrografi. Pengukuran panjang dan lebar telur dilakukan terhadap telur yang diamati. Panjang telur diukur pada bagian telur
yang paling panjang, sedangkan lebar telur diukur pada bagian terlebar garis yang tegak lurus garis panjang.
Data perbandingan perkembangan gamet spons yang tidak difragmentasi di alam, yang difragmentasi di alam dan yang difragmentasi di kolam dianalisis ragam secara statistik yaitu dengan Analisis Varian (ANOVA) klasifikasi satu arah dengan selang kepercayaan 95%.
Densitas oosit spons dihitung dengan mengunakan rumus Abercombie (1941) yaitu yang disarankan oleh Elvin (1976) dalam Corriero et al (1996), seperti pada persamaan (7).
112 HASIL DAN PEMBAHASAN
Ukuran fragmen spons pertama kali menghasilkan oosit
Proses fragmentasi di alam telah banyak dilakukan walaupun dari beberapa jenis spons memiliki pertumbuhan yang lambat dengan tingkat kematian yang tinggi. Secara umum faktor lingkungan memiliki peranan penting dalam meningkatkan laju pertumbuhan spesifik seperti halnya yang telah dilakukan di laboratorium, banyak spons yang mengalami kematian karena hewan ini memiliki tingkat sensitifitas yang tinggi terhadap perubahan kondisi lingkungan yang baru.
Fragmentasi buatan merupakan salah satu cara reproduksi aseksual yang dilakukan dengan jalan memotong induk spons serta menempatkan fragmen tersebut pada substrat buatan di kedalaman dan lokasi tertentu. Fragmentasi yang dilakukan menyebabkan spons mengalami luka dan kehilangan sebagian jaringannya. Fragmentasi dapat menyebabkan fungsi reproduksi menurun. Penurunan fungsi reproduksi merupakan respon umum yang terjadi, karena pada spons yang terfragmentasi sumberdaya yang tersisa akan dialokasikan secara bertingkat mulai dari fungsi pemeliharaan, perbaikan, pertumbuhan, dan reproduksi.
Aktifitas reproduksi seksual pada spons jenis Aaptos aaptos yang difragmentasi di alam, terdeteksi pada pengamatan histologi sampel tanggal 10 Februari 2008 dan memiliki ukuran rata-rata vertikal 11,70 cm dengan standar deviasi 1,25 dan ukuran horisontalnya 11,83 cm dengan standar deviasi 0,26. Sampel pada stasiun lainnya mulai bereproduksi setelah mencapai ukuran rata-rata vertikal 13,28 cm dengan standar deviasi 0,82 dan rata-rata ukuran horisontal 12,26 cm dengan standar deviasi 0,37. Sampel spons hasil fragmentasi 6 Desember 2007 tidak satupun sampel yang terdeteksi sedang melakukan reproduksi seksual. Hal tersebut karena pertumbuhan spons belum mencapai
113 ukuran minimum untuk dapat bereproduksi secara seksual sehingga sumberdaya yang dimiliki masih digunakan untuk proses pertumbuhan. Ukuran minimum spons dapat bereproduksi secara seksual pada Tethya serica panjangnya kira-kira 10 cm, Hippospongia lachne diameternya kira-kira 14 cm. Spesies Mycale sp. hanya yang volume bersihnya lebih dari 200 ml mengalami oogenesis, sedangkan spesimen yang kecil memperlihatkan spermatogenesis. Sebaliknya pada Suberitas ficus, oogenesis sering terjadi hanya pada spesimen yang ukurannya tidak lebih dari kira-kira 5 cm (Sara, 1992).
Umur spons diduga berkorelasi dengan ukurannya, dan merupakan salah satu faktor internal yang dapat mengontrol reproduksi pada spons. Umur minimum spons untuk dapat bereproduksi secara seksual berbeda-beda. Penelitian di Pulau Pari ini umur spons Aa pertama kali bereproduksi seksual setelah dilakukan fragmentasi buatan adalah setelah mencapai umur 241 hari (fase bulan ¾ sampai bulan mati) pada ukuran vertikal 11,70 cm dan ukuran horisontal 11,83 cm. Sedangkan pada pengambilan sample 177 hari setelah fragmentasi pada fase bulan purnama sampai bulan ¾ tidak ditemukan spons Aa melakukan reproduksi seksual.
Ukuran fragmen spons Aaptos aaptos setelah mencapai umur 177 dan 241 hari disajikan pada Tabel 10.
Tabel 10. Ukuran rata-rata fragmen spons Aa setelah 177 dan 241 hari
Keterangan : ukuran fragmen awal 3 cm
Stasiun Ukuran fragmen Rata-rata±SD (cm)
177 Hari 241 Hari
Barat (ST1) Ukuran vertikal 11,05 ± 1,11 11,70 ± 1,25 Ukuran horisontal 10,73 ± 0,22 11,83 ± 0,26 Selatan (ST2) Ukuran vertikal 12,44 ± 0,75 13,28 ± 0,82 Ukuran horisontal 11,25 ± 0,35 12,26 ± 0,37
114 Ukuran fragmen ini berhubungan dengan kapasitas energi yang tersimpan untuk beradaptasi pada lingkungannya yang baru tetapi hubungan tersebut tidak selalu linier karena berdasarkan hasil uji coba yang dilakukan bahwa spons yang memiliki ukuran besar mengalami tingkat kematian yang cepat dari pada spons yang memiliki ukuran yang kecil. Hal ini dimungkinkan oleh kebutuhan faktor lingkungan yang kurang mendukung seperti halnya makanan, oksigen, intensitas cahaya dan ruang tumbuh yang terbatas. Kemudian adanya proses metabolisme dan pertumbuhan yang lambat dimungkinkan oleh penurunan biomasa dari alga simbion (cyanobakteria) dalam sel atau jaringan spons. Penurunan biomasa algae simbion (cyanobakteria) tersebut ditandai oleh perubahan warna pada saat proses adaptasi. Menurut Wilkinson (1981) bahwa hasil simbiosis cyanobakteria melalui proses fotosintesis dalam sel dan jaringan spons akan ditranslokasikan sebagai sumber makanan untuk peningkatan biomasa dan laju metabolismenya.
Tingkat Kelangsungan Hidup (Sintasan)
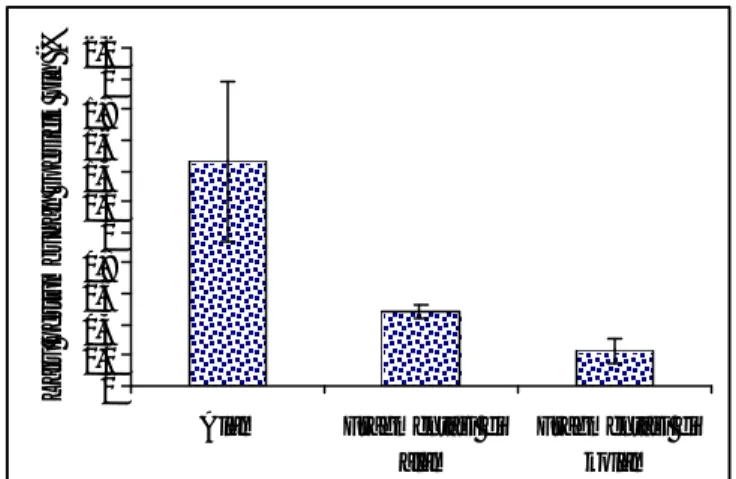
Tingkat kelangsungan hidup (sintasan) fragmen spons Aaptos aaptos ialah jumlah individu dari fragmen spons Aaptos aaptos yang masih bertahan hidup sampai akhir pengamatan dilakukan. Tingkat kelangsungan hidup spons yang difragmentasi dianalisis secara deskriptif. Hasil penelitian menunjukkan bahwa tingkat kelangsungan hidup fragmen spons Aaptos aaptos setelah 6 bulan pengamatan pada fragmen spons yang difragmentasi di alam lebih rendah (70 %) dibanding dengan fragmen spons yang tidak di fragmentasi di alam dan yang difragmentasi di kolam (100% dan 90%). Fragmen spons yang difragmentasikan di kolam memiliki tingkat kelangsungan hidup yang lebih baik dibanding fragmen spons yang difragmentasi di alam. Kondisi ini ditunjukkan pada Gambar 36 yang menunjukkan hasil pengukuran baik di alam maupun di kolam selama pengamatan.
115 Gambar 36. Tingkat Kelangsungan Hidup (sintasan) spons Aa yang tidak
difragmentasi dan difragmentasi di alam, dan yang difragmentasi di kolam
Tingkat kelangsungan hidup (sintasan) fragmen spons yang difragmentasi di alam lebih rendah diduga dipengaruhi oleh kekeruhan yang tinggi dibandingkan dengan yang di kolam. Tingginya kekeruhan akan mempengaruhi kecerahan perairan yang memberikan dampak negatif pada fragmen spons Aaptos aaptos karena penetrasi cahaya matahari ke dalam perairan berkurang sehingga proses fotosintesis tidak berjalan dengan optimal. Hal ini menyebabkan terhambat atau terhentinya proses pertumbuhan serta menurunkan tingkat kelangsungan hidup fragmen spons yang difragmentasikan (Rani dan Haris, 2005). Akibat dari kekeruhan tersebut juga berdampak pada laju sedimentasi, sehingga lendir yang disekresi spons ditempeli oleh organisme penempel (fouling) dan sedimen yang dapat menutupi ostia dan menyebabkan air yang segar dari lingkungan sekitarnya tidak dapat masuk ke dalam tubuh spons. Tubuh spons yang kekurangan sirkulasi air tersebut memutih dan jaringannya mati sehingga sangat mudah terlepas dari tali.
Selain itu juga adanya ikan Pomacentridae yang menggigit tubuh spons pada saat pertama kali diletakkan pada fragmentasi di alam menyebabkan
0 20 40 60 80 100 120
Alam Fragmentasi di alam Fragmentasi di kolam
Perlakuan
116 bertambahnya luka pada permukaan tubuh spons sehingga sangat mudah terlepas dari tali.
Faktor lain yang diduga mempengaruhi rendahnya tingkat kelangsungan hidup fragmen spons adalah adanya kontak fragmen spons dengan amonia hasil buangan spons pada saat terjadinya stress akibat pemotongan. Kondisi tersebut mengakibatkan air yang masuk melalui ostia spons adalah air yang sudah terkontaminasi dan merupakan buangan dari sisa metabolismenya sendiri sehingga keadaan fragmen makin melemah. Mulai dari proses pemotongan hingga pengamatan pertama terlihat fragmen spons peka terhadap setiap perlakuan yang diberikan, ini terlihat dari banyaknya lendir yang dihasilkan, warnanya yang memucat, menyusutnya oskulum serta keluarnya ammonia.
Pertumbuhan Fragmen
Laju pertumbuhan spesifik spons Aa dengan perlakuan yang tidak difragmentasikan (kontrol) di alam, difragmentasi di alam, dan difragmentasi di kolam yang diukur selama 6 bulan disajikan pada Tabel 11. Sedangkan laju pertumbuhan spesifik baik plh maupun plv ditunjukkan pada Gambar 37 dan 38. Gambar 37 menunjukkan bahwa rata-rata laju pertumbuhan spesifik plh tertinggi terdapat pada spons Aa yang tidak difragmentasi di alam (kontrol) sebesar 1,46% dan spons yang difragmentasi di alam sebesar 0,48% sedangkan rata-rata laju pertumbuhan spesifik plh terendah terdapat pada spons Aa yang di fragmentasikan di kolam sebesar 0,22% (Lampiran 14).
117 Tabel 11. Laju pertumbuhan sepsifik spons Aa yang tidak difragmentasi di alam, yang difragmentasi di alam, dan yang difragmentasi di
kolam selama 6 bulan
Perlakuan Pertum buhan Waktu (Bulan) Rata-rata ±SD (%) B0±SD (cm) B1±SD (cm) B2±SD (cm) B3±SD (cm) B4±SD (cm) B5±SD (cm) B6±SD (cm) Alami tidak di Fragmentasi plh 8.15±1.76 8.76±1.37 10.00±0.98 10.61±1.01 11.21±1.40 11.31±1.60 11.40±1.04 1,46±0,52 plv 7.55±1.68 8.11±1.44 8.45±1.20 8.80±0.78 9.14±1.02 9.49±1.08 9.50±0.36 1,41±0,65 Fragmentasi di Alam plh 8.71±0.19 8.98±0,25 9.26±0.24 9.56±0.35 9.87±0.34 10.18±0.37 10.59±0.43 0,48±0,04 plv 7.39±0.38 7.84±0.39 8.29±0.47 8.62±0.22 8.94±0.56 9.07±0.56 9.20±0.68 0,76±0,07 Fragmentasi di Kolam plh 2.93±0.61 3.06±0,60 3.18±0.51 3.30±0.71 3.42±0,72 3.54±0.72 3.66±0.62 0,22±0,08 plv 2.24±0.43 2.29±0.45 2.36±0.47 2.42±0.57 2.48±0.57 2.54±0.58 2.60±0.42 0, 08±0,04 Keterangan : plh : panjang lingkar horisontal
118 Data diolah berdasarkan Lampiran 14
Gambar 37. Laju pertumbuhan spesif ik rata-rata plh pada fragmen spons Aa yang tidak difragmentasi, yang difragmentasi di alam dan kolam
Sedangkan pertumbuhan plv (Gambar 38) menunjukkan bahwa rata-rata laju pertumbuhan spesifik tertinggi terdapat pada spons Aa yang tidak difragmentas i (kontrol) sebesar 1,41% dan spons yang difragmentasi di alam sebesar 0,76%, dan rata-rata laju pertumbuhan spesifik plv terendah terdapat spons Aa yang di fragmentasikan di kolam sebesar 0,08%.
Data diolah berdasarkan Lampiran 14
Gambar 38. Laju pertumbuhan spesifik rata-rata plv pada fragmen spons Aa tidak difragmentasi, yang difragmentasi di alam dan kolam
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 1,8 2 2,2 Alam Fragmentasi di alam Fragmentasi di kolam
Laju pertumbuhan spesifik plv (%)
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 1,8 2 2,2 Alam Fragmentasi di alam Fragmentasi di kolam
119 Tingginya rata-rata laju pertumbuhan spesifik spons Aa yang tidak difragmentasi (kontrol) jika dibandingkan dengan spons yang difragmentasi di alam dan kolam baik pada pertumbuhan plh maupun plv (Gambar 37 dan 38) dimungkinkan oleh bentuk morfologinya yang sempurna. Terbentuknya sistem saluran air (ostia dan oskula) dan tidak adanya jaringan yang rusak akibat luka yang digoreskan pada spons non transplan (kontrol), akan membantu spons tersebut dalam meminimalisasi proses adaptasi akibat perubahan lingkungannya sehingga energi yang tersimpan tidak lagi digunakan untuk proses adaptasi/memperbaiki jaringannya yang rusak akan tetapi di alokasikan untuk pertumbuhan dan proses metabolismenya.
Salah satu proses adaptasi yang dilakukan spons diantaranya adalah sekresi lendir, produksi senyawa kimia dan kontraksi antar sel. Sekresi lendir dan produksi senyawa kimia tersebut merupakan bentuk pertahanan dirinya dari predator, organisme fouling dan faktor lingkungan yang kurang menguntungkan agar dapat bertahan hidup dan tumbuh. Sedangkan kontraksi antar sel pada spons sangat berperan dalam mengatur sistem pembukaan dan penutupan diameter ostia dan oskulanya agar dapat menyaring makanan dan melakukan pembuangan zat sisa hasil proses metabolismenya.
Spons yang difragmentasi memiliki perbedaan dengan spons yang tidak difragmentasi yaitu adanya luka/sayatan spons saat proses fragmentasi. Luka yang disayatkankan akan berpengaruh terhadap kerusakan jaringan sehingga energi yang tersimpan dapat digunakan dalam memperbaiki jaringannya yang rusak dan proses pertumbuhan dapat berlangsung seiring dengan perbaikan jaringan. Kemudian luka pada spons yang difragmentasi secara umum berada pada lapisan terluar (lapisan pinacoderm). Hilangnya lapisan ini dapat menyebabkan lamanya proses penempelan pada spons karena lapisan tersebut terdiri dari sel-sel yang dapat mengekresikan bahan-bahan untuk melekatkan spons pada substrat dan semakin cepat proses penempelan pada substrat maka akan membantu spons dalam proses pertumbuhannya.
120 Hasil uji beda nyata dengan taraf (a)=0,05 menunjukkan bahwa rata-rata laju pertumbuhan spesifik plh dan plv pada spons Aa yang tidak di fragmentasikan (kontrol) dengan spons yang difragmentasikan di alam belum menunjukkan perbedaan yang nyata terhadap respon pertumbuhannya (P>0,05). Hal ini menunjukkan bahwa proses fragmentasi buatan yang dilakukan di alam tidak mengalami perubahan terhadap respon pertumbuhan yang terjadi dan faktor lingkungan yang baik pada stasiun penelitian dapat berpengaruh terhadap spons yang difragmentasi untuk kembali pada keadaan yang semula (pertumbuhan yang sama) dengan spons yang tidak difragmentasi.
Kondisi sebaliknya terjadi pada spons yang difragmentasikan pada kolam buatan yang memerlukan penanganan khusus untuk mempertahankan hidupnya pada kondisi lingkungan yang sangat berbeda dengan habitat aslinya. Proses adaptasi yang dilakukan pada hewan ini (Aa) belum menunjukkan pertumbuhan yang optimal sehingga didapatkan hasil rata-rata laju pertumbuhan spesifik yang lebih rendah dari spons yang tidak difragmentasi (kontrol) dan yang difragmentasi di alam (Gambar 37 dan 38).
Hasil uji beda nyata dengan taraf (a)=0,05 antara spons yang difragmentasikan dikolam dengan spons yang di alam baik yang difragmentasi maupun yang tidak menunjukkan perbedaan yang nyata (P<0,05) baik pada pertumbuhan plh maupun plv. Perbedaan tersebut disebabkan oleh adanya perubahan faktor lingkungan pada saat proses adaptasi sehingga terjadi penurunan produktifitas lingkungan yang menyebabkan terganggunya proses metabolisme dan pertumbuhan pada spons Aa di kolam. Selain itu faktor ukuran dari fragmen spons dikolam dapat berperan terhadap tingkat kematian dan respon pertumbuhannya.
Perkembangan Gamet Spons yang difragmentasi di kolam
Penelitian ini juga belum dapat mengidentifikasi gamet jantan dengan jelas karena tidak ditemukan spermatosit didalam jaringan histologis yang diamati, sama seperti penelitian terdahulu. Seperti yang sudah dijelaskan sebelumnya
121 bahwa kesulitan dalam mengidentifikasi spermatosit atau spermatozoa spons disebabkan antara lain oleh ukurannya yang sangat kecil dan keberadaannya hanya terlihat pada saat akan memijah. Terjadinya proses spermatogenesis sebelum proses oogenesis dan pendeknya siklus spermatogenesis juga dapat menyulitkan dalam penentuan individu jantan (Sidri et al., 2005).
Tingkat Kematangan Gamet dan Ukuran Oosit
Seluruh spons pada penelitian ini yang dipindahkan ke kolam dan difragmentasi mengalami penurunaan fungsi reproduksi. Oosit yang didapatkan dari tiap fase bulan tidak mengalami perkembangan. Oosit yang didapat masih berada pada tahap I baik pada fase bulan baru/mati, fase ¼, bulan purnama, maupun fase bulan ¾ . Begitu pula dengan ukuran oositnya yang rata-rata kecil. Pemotongan fragmen menyebabkan spons mengalami luka dan kehilangan sebagian jaringannya. Penurunan fungsi reproduksi merupakan respon umum yang terjadi karena pada spons yang terfragmentasi, karena sumberdaya yang tersisa akan dialokasikan secara bertingkat mulai dari fungsi pemeliharaan, perbaikan, pertumbuhan, dan reproduksi.
Variasi dan perubahan kondisi lingkungan akibat pemindahan ke lokasi yang baru juga dapat menyebabkan penurunan fungsi reproduksi. Hal tersebut disebabkan oleh fungsi pengaturan untuk beradaptasi memerlukan energi yang besar. Menghasilkan oosit spons diperlukan energi yang besar dan energi ini tidak cukup tersedia apabila spons dalam keadaan terluka. Tidak adanya perkembangan oosit tiap fase bulan disebabkan oleh pemotongan spons tiap pengambilan sampel. Adanya pemotongan menyebabkan spons lebih mengutamakan untuk mempertahankan tubuhnya terlebih dahulu dibandingkan meningkatkan fungsi reproduksinya, sehingga pada penelitian ini fungsi reproduksi spons terganggu.
Pengamatan preparat histologi terhadap oosit spons yang hidup pada habitat buatan/kolam percobaan hanya ditemukan menyebar pada lapisan mesohyl
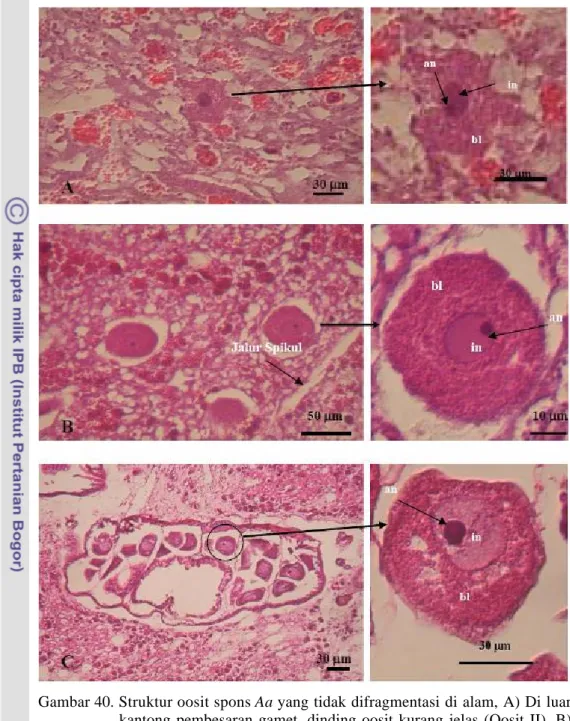
122 dengan ukuran yang kecil (Gambar 39A dan 39B). Sedangkan pada oosit spons yang tidak difragmentasi dan yang difragmentasi di alam menunjukkan bahwa oosit ditemukan berada dalam kantong maupun menyebar di luar kantong pada lapisan mesohyl. Oosit yang berada di dalam kantong dan di luar kantong dapat dilihat pada Gambar 39.
Oosit teridentifikasi pada lapisan mesohyl dengan bentuk bulat hingga lonjong. Butiran oosit ditemukan pada suatu kantong (cyst) gamet dan menyebar di luar kantong. Oosit yang berada di luar kantong menyebar pada lapisan mesohyl, pada lapisan ini juga ditemukan choanocyte chamber. Oosit yang berada di luar kantong adalah oosit yang belum mencapai ukuran yang maksimum (Gambar 39A, 39B, 39C dan 39E). Oosit pada tahap ini masih bergerak aktif pada lapisan mesohyl, mengumpulkan cadangan makanan melalui fagositosis terhadap nurse cell yang mengelilinginya.
Perkembangan selanjutnya adalah oosit matang akan bermigrasi menuju kantong pembesaran gamet. Gambar 39D dan 39F juga menunjukan adanya oosit yang berada dalam kantong pembesaran gamet, oosit yang dilihat dalam kantong merupakan oosit yang telah matang. Keberadaan oosit dalam kantong pembesaran gamet ini dapat melindungi oosit dari predator, kerusakan akibat turbulensi dan dehidrasi (Fromont, 1994). Oosit dalam kantong pembesaran gamet berada di pinggir pada bagian yang berlekuk- lekuk. Kantong (cyst) gamet yang terdapat pada lapisan mesohyl ini berbentuk bulat hingga lonjong yang bagian dalamnya berlekuk- lekuk. Kantong ini diduga digunakan dalam proses perkembangan dan pembesaran gamet. Namun fungsi dari bagian kantong yang berlekuk- lekuk ini belum diketahui dengan pasti. Ilan dan Loya (1990) menjelaskan bahwa pada spons jenis Niphates sp dan Chalinula sp. proses reproduksi betinanya terjadi dalam suatu kantong yang terisolasi yang disebut sebagai ’brood chamber’ atau ’nurserie chamber’.
123 Gambar 39. Struktur mikromorfologis oosit Aa, A) Oosit spons yang difragmentasi di kolam menyebar di luar kantong pembesaran gamet, B) Struktur oosit spons yang difragmentasi di kolam, C) Oosit spons yang tidak difragmentasi menyebar di luar kantong pembesaran gamet. D) Oosit spons yang tidak difragmentasi dalam kantong pembesaran gamet, E) Oosit spons yang difragmentasi di luar kantong pembesaran gamet; cc: choanocyte chamber, F) Oosit spons yang di fragmentasi di dalam kantong pembesaran gamet (241 hari setelah fragmentasi, pewarnaan Hematoksilin- Eosin).
Tahap perkembangan gamet betina pada spons Aaptos aaptos di kolam hanya ditemukan satu tahap perkembangan. Tahapan perkembangan gamet betina tersebut disajikan pada Gambar 39A dan 39B.
50 µm C Oosit 200 µm D Oosit 50 µm F Oosit 200 µm E Oosit cc Mikrosimbion 40 µm 5 µm in dt bl Oosit A B
124 Pengamatan histologi spons pada sample di kolam hanya menunjukkan perkembangan gamet betina pada TKG I (Gambar 39A dan 39B). Tahap ini oosit telah memiliki butiran lemak dan inti oosit serta telah dilengkapi dengan dinding oosit. Tahap ini oosit yang ditemukan ukurannya masih sangat kecil dan oosit masih mengumpulkan cadangan makanan. Ukuran panjang oosit pada TKG I berkisar antara 9,90 – 28.82 µm dengan rata-rata 16,02 µm. Ukuran lebar oosit TKG I berkisar antara 7,26-25,74 µm dengan rata-rata 13,88 µm.
Tahap perkembangan gamet betina pada spons Aaptos aaptos dikelompokan menjadi empat tahap perkembangan. Tahapan perkembangan gamet betina tersebut disajikan pada Gambar 40.
Sebagian besar oosit spons Aaptos aaptos terdiri dari lapisan lemak. Butiran-butiran lemak ini merupakan salah satu bahan yang mengisi kuning oosit (yolk). Butiran lemak tersebut akan semakin memadat seiring dengan berkembangnya oosit. Sel somatik yang bertugas menyediakan sumber kuning oosit selama proses oogenesis disebut nurse cell atau trophocytes. Oosit Aaptos aaptos yang teramati dalam kantong memiliki dinding yang cukup tebal dan terpisah antara satu oosit dengan oosit lainnya, dimana pada masing-masing oosit terdapat inti dan anak inti.
Penelitian terhadap fragmen di alam baik yang tidak difragmentasi dan yang difragmentasi menunjukkan bahwa oosit terletak dalam kantong gamet dan adanya butiran lemak yang merupakan komponen terbesar pada oosit selain inti dan anak inti. Oosit tersebut juga memperlihatkan adanya lapisan yang cukup tebal yang memisahkan antara satu oosit dengan yang lainnya (Gambar 40A). Oosit Aaptos aaptos yang berada di luar kantong juga terlihat adanya inti, anak inti, dan butiran butiran lemak walaupun tidak sepadat butiran lemak pada oosit yang berada dalam kantong pembesaran gamet. Oosit yang berada di luar kantong pembesaran gamet keberadaannya terlihat dengan jelas baik yang belum memiliki dinding yang memisahkan oosit dengan jaringan lain di mesohyl (Gambar 40B) maupun yang yang telah memiliki dinding. (Gambar 40C).
Tahapan oogenesis diidentifikasi berdasarkan ukuran dan bentuk dari sel oosit. Penentuan tahap oosit pada penelitian kali ini berdasarkan karakteristik oosit pada spons ordo Haplosclerida (Fromont, 1994) dimana oosit yang sudah
125 matang akan berada dalam kantong dan oosit yang belum matang berada di luar kantong. Oosit yang teramati berada di luar kantong dan menyebar pada lapisan mesohyl dengan inti dan anak inti yang sudah terlihat jelas walaupun ukurannya masih sangat kecil. Butiran lemak juga mulai terlihat walaupun belum terbentuk dinding yang membatasi oosit tersebut. Berdasarkan ciri-cirinya oosit tersebut dapat dikategorikan pada tahap perkembangan oosit II (Gambar 40A). Pada tahap oosit II ukuran panjang oosit pada spons alami berkisar antara 23,76 - 59,40 µm dengan nilai rata-ratanya 34,99 µm dan standar deviasi 8,52, sedangkan ukuran lebar oosit antara 12,10 - 45,10 µm dan rata-ratanya 26,14 µm dengan standar deviasi 7,18.
Oosit pada tahap perkembangan gamet III teramati berada di luar kantong pembesaran gamet dan telah memiliki dinding oosit (Gambar 40B). Tahap ini memiliki kisaran ukuran panjang dan lebar oosit adalah 44-71,72 µm dan 34,98-57,86 µm, sedangkan nilai rata-rata panjang dan lebarnya adalah 56,91 µm dan 43,74 µm. Oosit IV juga ditemukan pada sampel alami di ST2 dan telah bermigrasi pada kantong pembesaran gamet. Oosit pada tahap ini memiliki ukuran panjang dan lebar yang berkisar antara 49,5-88 µm dan 36,52-69,96 µm serta rata-rata panjang dan lebar sebesar 66,83 µm dan 49,54 µm.
Oosit-oosit yang teramati tersebut juga telah terbentuk suatu dinding jelas yang memisahkan antar satu oosit dengan oosit yang lain dalam satu kantong (Gambar 40C). Berdasarkan ciri-cirinya, oosit tersebut dapat dikategorikan pada tahap perkembangan oosit IV. Oosit pada Aaptos aaptos alami memiliki ukuran panjang yang berkisar antara 51,92 - 91,96 µm dengan rata-rata panjangnya 68,41 µm dan standar deviasi 8,64. Ukuran lebar oosit berkisar antara 37,40 - 74,80 µm dan rata-ratanya 53,47 µm serta standar deviasi 7,93. Oosit yang teramati terlihat bahwa butiran-butiran lemak sudah padat dengan inti dan anak inti yang terlihat jelas dan bergeser ke pinggir.
126 Gambar 40. Struktur oosit spons Aa yang tidak difragmentasi di alam, A) Di luar kantong pembesaran gamet, dinding oosit kurang jelas (Oosit II), B) Di luar kantong pembesaran gamet, dinding oosit jelas (Oosit III), C) Dalam kantong pembesaran gamet (Oosit IV); bl: Butiran lemak, in: Inti oosit, an: Anak Inti (Pewarnaan Hematoksilin- Eosin)
Tabel 12 menyajikan karakteristik perkembangan oosit spons Neofibularia nolitangere berdasarkan Hoppe dan Reichert (1987). Tabel 13 menyajikan karakteristik perkembangan oosit pada spons Aaptos aaptos yang tidak
127 difragmentasi dan spons yang difragmentasi di Gugusan Pulau Pari, Kepulauan Seribu, DKI Jakarta dan yang difragmentasi di kolam.
Tabel 12. Karakteristik tahap perkembangan gamet betina Neofibularia nolitangere (Hoppe dan Reichert, 1987)
Tabel 13. Karakteristik tahap perkembangan oosit Aa yang tidak difragmentasi, yang difragmentasi di alam dan di kolam
Tahap Karakteristik
I
Pada tahap ini dinding oosit belum terlihat jelas dan batas antara oosit belum jelas, mempunyai ukuran sekitar 10 µm, inti dan anak inti belum terlihat.
II
Pada tahap ini terlihat bahwa oosit sudah bermigrasi ke dalam kantong pembesaran gamet. Kantong pembesaran masih berukuran kecil sekitar 150 µm dengan batas luar yang jelas yang dapat membedakannya dengan bagian lainnya yang terdapat dalam lapisan mesohyl. Ukuran oosit sekitar 25 µm, dengan inti yang sudah kelihatan, demikian juga dengan butiran-butiran lemak yang berada disekelilingnya.
III
Oosit semakin besar dan berbentuk agak berlekuk, ukuran oosit sekitar 50 µm. Pada tahap ini butiran-butiran lemak mulai memadat. Inti semakin besar dan berwarna agak gelap.
IV
Pada tahap ini oosit semakin besar karena akumulasi kuning oosit dan bentuknya membulat. Ukuran oosit sekitar 65 µm, inti dan anak inti yang bergeser ke pinggir. Ukuran kantong pembesaran gamet sekitar 450 – 550 µm.
Tahap Karakteristik
I Hari pertama perkembangan oosit berbentuk telur dengan diameter 14 µm. Diameter nukleus atau inti adalah 7 µm
II
Hari ke 7 perkembangan oosit semakin besar dan memiliki diameter 25 µm. Diameter nukleus atau inti 14 µm. Pada tahap ini, nurse sel (diameter 7 µm) ditemukan berkembang dan menyebar pada mesohyl
III
Pada hari ke 23 baik oosit maupun nurse sel mengalami peningkatan diameter menjadi masing-masing 45 dan 9 µm. Pada tahap ini nurse sel memiliki diameter 12 µm dan cenderung berada disekitar oosit matang. Oosit dikelilingi oleh lapisan tipis follicle. Nukleus atau inti berukuran 14 µm dan memiliki nukleolus atau anak inti dengan diameter 4,5 µm
IV Pada hari ke 30 sebelum pelepasan oosit-nurse sel, oosit atau telur menjadi kuat dan sangat matang
128 Densitas Oosit Spons
Densitas oosit spons yang difragmentasi di kolam ditemukan sangat banyak dibandingkan dengan densitas spons yang di alam baik yang difragmentasi maupun yang tidak difragmentasi. Fase bulan baru/mati oosit spons ditemukan berkisar antara 152-760 oosit/mm3 dengan rata-rata 304 oosit/mm3. Pada fase bulan ¼ densitas oosit berkisar antara 450-3.233 oosit/mm3 dengan rata-rata 1.010 oosit/mm3. Densitas oosit pada fase bulan purnama berkisar antara 892-1.700 oosit/mm3 dengan rata-rata 1.305 oosit/mm3, sedangkan pada fase bulan ¾ densitas oosit berkisar antara 46-800 oosit/mm3 dengan rata-rata 396 oosit/mm3 (Lampiran 15). Gambar 41 menyajikan grafik densitas oosit spons Aaptos aaptos yang difragmentasi di kolam pada setiap fase bulan.
Diolah berdasarkan lampiran 15
Gambar 41. Densitas oosit spons Aa yang difragmentasi di kolam pada setiap fase bulan; hanya ditemukan oosit tahap I
Densitas tertinggi terdapat pada fase bulan purnama, kemudian diikuti oleh fase ¼ dan fase ¾ , sedangkan densitas paling rendah terdapat pada fase bulan mati/baru. Pemijahan spons di alam diketahui berhubungan erat dengan fase bulan. Hoppe dan Reichert (1987) juga menjelaskan bahwa pemijahan spons jenis Neofibularia nolitangere pada daerah tropis berhubungan erat dengan fase bulan. Seperti yang sudah dijelaskan pada Bab IV berdasarkan hasil penelitian terhadap
Baru/Mati Fase ¼ Purnama Fase ¾ 0 500 1000 1500 2000 Fase bulan Densitas (telur/mm3)
129 pemijahan in situ menunjukkan bahwa suhu air akibat dari penambahan kolom air pada saat terjadinya pasang merupakan salah satu pemicu terjadinya pemijahan pada spons. Isyarat perubahan suhu air di kolam percobaan adalah sebagai akibat dari perubahan pola pasang surut tidak ada sehingga densitas oosit yang tinggi pada bulan purnama diduga karena mengikuti pola di alam, dimana pada setiap fase bulan purnama frekuensi pemijahan tertinggi terjadi pada fase ini. Selain itu, pengaruh dari cahaya bula n juga diduga sebagai pemicu karena pada fase ini cahaya bulan bersinar paling terang dan kedalaman kolam masih memungkinkan cahaya untuk sampai ke dasar kolam sehingga spons dapat memproduksi oosit spons lebih banyak walaupun hanya pada tahap I dan tidak dipijahkan.
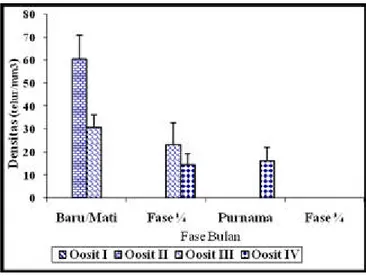
Densitas oosit spons Aaptos aaptos yang tidak difragmentasi di alam dan berasal dari sample yang diambil pada fase bulan purnama rata-rata 16 oosit/mm3 dan merupakan oosit tahap IV. Sampel spons yang diambil pada fase bulan baru/mati rata-rata densitas oositnya adalah 37 oosit/mm3 dan 38 oosit/mm3dan merupakan oosit tahap I dan II. Densitas oosit pada fase bulan ¼ ditemukan bervariasi berada pada tahap II, III, dan IV yaitu masing-masing 22 oosit/mm3, 25 oosit/mm3, dan 10 oosit/mm3 (Gambar 42).
Diolah dari lampiran 16
130 Penelitian terhadap sampel spons Aa yang difragmentasi di alam pada fase bulan purnama menunjukkan bahwa ditemukan oosit yang berada pada tahap IV dengan densitas rata-rata 18 oosit/mm3, sedangkan pada fase bulan mati ditemukan oosit yang berada pada tahap II dan III dengan densitas oosit rata-rata 60 oosit/mm3 dan 30 oosit/mm3 (Gambar 43). Fase bulan seperempat ¼ menghasilkan oosit yang berada pada tahap III dan IV dengan densitas masing-masing adalah sebesar 25 oosit/mm3 dan 15 oosit/mm3. Sama halnya dengan spons yang tidak difragmentasi di alam, maka pada pengamatan ini juga tidak ditemukan oosit pada fase bulan ¾. Hasil ini mengindikasikan bahwa awal oogenesis diduga terjadi pada awal bulan mati setelah bulan ¾ dan akhir perkembangan oosit berada pada fase bulan purnama sekaligus terjadi pemijahan dan berakhir satu hari setelah bulan purnama. Sehingga lamanya oogenesis diperkirakan terjadi sekitar 3 minggu dan terdapat waktu istirahat sekitar satu minggu mulai dari awal sampai akhir bulan ¾.
Diolah dari lampiran 17
Gambar 43. Densitas oosit pada spons Aa yang difragmentasi
Oosit spons yang difragmentasi di alam teridentifikasi pada sampel fase bulan mati hingga bulan purnama, dan diduga ukuran fragmen pada pengambilan
131 sampel ini telah mencapai ukuran untuk bereproduksi secara seksual yaitu sekitar 20 cm. (Gambar 43).
Oosit yang belum matang (oosit II dan III) memiliki densitas yang lebih banyak dibandingkan oosit IV (oosit matang). Keberadaan oosit di luar kantong pembesaran gamet memiliki resiko yang lebih tinggi terhadap kelangsungan perkembangan oosit dibandingkan dengan oosit yang berada dalam kantong pembesaran gamet. Hal tersebut merupakan penyebab oosit yang sudah matang masuk ke dalam kantong pembesaran gamet dengan tujuan untuk menjamin kelangsungan hidupnya.
Pengaruh Fase Bulan Terhadap Ukuran Oosit Spons
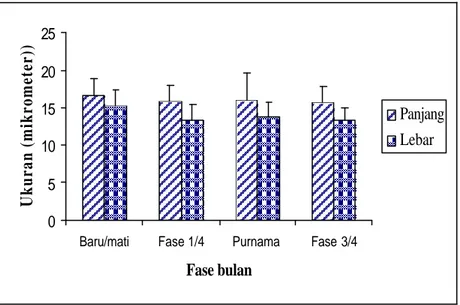
Ukuran panjang oosit spons yang difragmentasi di kolam pada fase bulan mati/baru berkisar antara 11.44-25.52 µm dengan ukuran rata-rata 16.25 µm, sedangkan lebar oosit berkisar antara 10.12-23.10 µm dengan rata-rata 14.76 µm. Fase bulan ¼, ukuran panjang oosit berkisar antara 9.90-25.30 µm dengan rata-rata 15.84 µm dan lebar oosit berkisar antara 7.26-21.56 µm dengan rata-rata-rata-rata 13.42 µm. Panjang oosit pada fase bulan purnama berkisar antara 11.22-28.82 µm dengan rata-rata 16.28 µm, sedangkan lebar oosit berkisar antara 9.46-25.74 µm dengan rata-rata ukuran 14.09 µm. Fase bulan ¾, panjang oosit berkisar antara 10.56-23.54 µm dengan rata-rata 15.71 µm dan lebar oosit berkisar antara 8.80-19.80 µm dengan rata-rata 13.29 µm (Gambar 44 dan Lampiran 18).
Menurut Fromont (1988) pada spons jenis Xestospongia testudinari pada tahap awal perkembangan oositnya, oosit mempunyai inti dan anak inti yang terlihat jelas dengan diameter oosit awal sekitar 7 µm. Berdasarkan ukuran oosit yang didapatkan pada masing-masing fase bulan, dapat dinyatakan bahwa oosit yang didapat pada penelitian ini dikategorikan pada oosit tahap I. Gambar 40 berikut menyajikan grafik ukuran rata-rata oosit pada setiap fase bulan.
132
0
5
10
15
20
25
Baru/mati Fase 1/4 Purnama Fase 3/4
Fase bulan
Ukuran (mikrometer))
Panjang
Lebar
Diolah berdasarkan Lampiran 18
Gambar 44. Ukuran rata-rata oosit spons Aa yang difragmentasi di kolam pada setiap fase bulan
Berdasarkan hasil analisis ragam dapat diketahui bahwa fase bulan berbeda nyata terhadap ukuran oosit spons yang di alam pada selang kepercayaan 95%. Artinya, pada penelitian ini fase bulan berpengaruh terhadap ukuran oosit spons. Sedangkan spons yang dipelihara di kolam menunjukkan bahwa fase bulan tidak berpengaruh nyata terhadap ukuran oosit spons. Pemijahan spons di alam berhubungan erat dengan fase bulan. Hoppe dan Reichert (1987) juga menjelaskan bahwa pemijahan spons jenis Neofibularia nolitangere pada daerah tropis berhubungan erat dengan fase bulan. Isyarat perubahan suhu air dari perubahan pola pasang surut diduga bertindak sebagai isyarat penguat ketika akan berlangsung pemijahan. Selain itu, pengaruh dari cahaya bulan juga diduga sebagai pemicu karena pada fase ini cahaya bulan bersinar paling terang dan kedalaman yang rendah memungkinkan cahaya bulan sampai ke dasar kolam.
Sel tubuh spons yang berperan dalam regenerasi dan rekontruksi bagian tubuh spons yang terluka adalah archaeocyte. Archaeocyte merupakan sel yang mempunyai kemampuan untuk mengubah bentuknya menjadi beberapa tipe sel
133 sesuai yang dibutuhkan oleh spons. Spons yang terfragmentasi memiliki archaeocyte yang akan mengubah bentuknya untuk menggantikan jaringan yang hilang. Hal tersebut dapat menggangu proses reproduksi seksual pada spons yang terfragmentasi pada waktu awalnya. Grafik ukuran rata-rata oosit spons Aaptos aaptos yang tidak difragmentasi dan yang difragmentasi di alam disajikan pada Gambar 45 dan 46.
Diolah dari lampiran 19
Gambar 45. Ukuran rata-rata oosit Aa yang tidak difragmentasi di alam
Diolah dari Lampiran 20
134 Gambar 45 menunjukkan bahwa spons Aaptos aaptos yang tidak difragmentasi memiliki rata-rata ukuran panjang dan lebar oosit lebih kecil dibandingkan dengan oosit yang difragmentasi (Gambar 46) pada tahap oosit II dan III. Hasil analisis ragam perlakuan spons yang tidak difragmentasi dan yang difragmentasi di alam, dapat diketahui bahwa ukuran panjang oosit pada spons yang tidak difragmentasi dan yang difragmentasi tidak berbeda nyata, sedangkan pada ukuran lebarnya oosit spons yang tidak difragmentasi dan yang difragmentasi berbeda nyata pada selang kepercayaan 95%.
Oosit spons yang difragmentasi mempunyai densitas yang lebih banyak dibandingkan dengan spons yang tidak difragmentasi. Densitas yang lebih banyak inilah yang menyebabkan ukuran oosit spons yang difragmentasi lebih kecil dibandingkan oosit spons yang tidak difragmentasi. Spons yang densitasnya banyak tingkat persaingan untuk mendapatkan cadangan makanan lebih tinggi pula sehingga cadangan makanan yang diperoleh masing-masing oosit tidak akan sebanyak cadangan makanan yang diperoleh tiap oosit pada densitas yang lebih kecil. Dengan demikian ukuran oosit akan berbeda pada densitas yang berbeda.
Fragmentasi merupakan salah satu reproduksi aseksual pada spons yang hidup alami, sehingga fragmentasi buatan yang dilakukan di alam tidak memberikan pengaruh terhadap reproduksi seksualnya. Spons hasil fragmentasi, walaupun reproduksi seksual spons terganggu pada awal perkembangannya tetapi setelah spons mencapai ukuran tertentu dan dapat melakukan reproduksi secara seksual maka spons akan melakukannya dan sama seperti pada spons yang hidup di alam dan tidak difragmentasi. Berdasarkan data yang diperoleh keterkaitan antara densitas dan ukuran oosit pada spons ditemukan pada kedua sampel spons baik yang berasal spons yang tidak difragmentasi maupun spons yang difragmentasi.
135 KESIMPULAN
Spons Aaptos aaptos yang difragmentasi mulai bereproduksi secara seksual kembali setelah mencapai ukuran vertikal rata-rata 11,70 cm dan ukuran horisontal rata-rata 11,83 cm Pada spons yang tidak difragmentasi dan yang difragmentasi di alam ukuran rata-rata oosit berkembang dan memiliki tahap perkembangan lengkap dari tahap I sampai tahap IV, sedangkan oosit spons Aaptos aaptos yang difragmentasi pada pada kolam percobaan tidak mengalami perkembangan selama penelitian, semua spons masih berada pada tahap oosit I. Kondisi ini diduga disebabkan karena kurangnya asupan pakan yang mendukung kehidupan dan pertumbuhan spons sehingga untuk pemeliharaan spons setelah mencapai umur 6 bulan, fragmen spons Aa segera dikembalikan lagi ke habitat asal di alam untuk mempercepat pertumbuhan dan perkembangannya.
Proses fragmentasi terhadap spons Aa baik di alam maupun di kolam dapat dilakukan pada saat fase bulan tigaperempat (¾) yaitu saat dimana tidak dihasilkannya telur atau oosit spons sehingga pelaksanaan fragmentasi buatan tidak mengganggu kelangsungan hidup spons melalui reproduksi seksualnya. Fase bulan mati merupakan awal perkembangan oosit spons kemudian dilanjutkan perkembangannya pada fase bulan seperempat (¼) dan akhirnya dikeluarkan pada fase bulan purnama setelah mengalami fertilisasi secara internal oleh spermatozoa.
Tidak ditemukannya sperma pada tiga tahap penelitian yang telah dilakukan baik melalui pengamatan spawning in situ maupun melalui analisis histologis jaringan spons menunjukkan indikasi bahwa spons Aaptos aaptos memiliki kecenderungan lebih banyak melakukan reproduksi secara aseksual melalui fragmentasi dibandingkan dengan seksual.