Halaman: 28-35
© 2001 Jurusan Biologi FMIPA UNS Surakarta
Pengaruh Aflatoksin B
1terhadap Pertumbuhan dan Perkembangan
Embryo dan Skeleton Fetus Mencit (
Mus musculus
L.)
Effects of Aflatoxin B1 on Growth and Development of Embryos and Skeletal
Fetuses of Mice (Mus musculus L.)
TETRI WIDIYANI 1 dan MAMMED SAGI2 1 Jurusan Biologi FMIPA UNS Surakarta
2 Fakultas Biologi UGM Yogyakarta
Diterima: 10 Juni 2001. Disetujui: 31 Agustus 2001
ABSTRACT
Aflatoxin B1 (AFB1) is a mycotoxin vastly contaminates in agriculture foodstuffs. AFB1 has teratogenic effects because it can penetrate placental barrier easily from maternal to fetal tissues. AFB1 can be activated to become epoxide compound. Epoxide is very dangerous, it can react with nucleic acid and form DNA or RNA adducts. The aim of this research was to examine the effects of AFB1 on growth and development of embryos and skeletal fetuses in pregnant mice during organogenesis period. Thirty pregnant mice were divided randomly into 5 groups with 6 replications. AFB1 was dissolved in propylene glycol and administrated orally on days 6-15 of gestation. The treatment dosages were 0 (placebo), 2.25, 3, and 4.5 mg/kg body weight. Another group of animals was used as control. At day 18 of gestation, all pregnant mice were sacrificed and caesarian sectioned to remove the fetuses. Fetuses were examined for intrauterine mortality; growth retardation; morphological malformations; skeletal growth and development (ossification); and skeletal malformations. AFB1 treatment with highest dosage (4.5 mg/kg body weight) caused a significant increase in the number of intrauterine mortality; fetuses growth retardation; skeletal growth retardation; and in the incidence of morphological and skeletal malformation such as hemorrhage, clubfoot, curved body, intercostal fusion and vertebral flexion (lordosis and kyphosis). These results indicate that maternal exposure to AFB1 during organogenesis period influences the growth and development of embryos and skeletal fetuses. Key words: aflatoxin B1, mice, embryos, fetuses, skeletal.
PENDAHULUAN
Aflatoksin merupakan salah satu jenis mikotoksin yang dihasilkan terutama oleh jamur Aspergillus flavus. Jamur penghasil aflatoksin ini biasanya tumbuh pada substrat berupa bahan pangan dan pakan komoditas pertanian serta hasil olahannya. Di negara-negara beriklim tropis, kontaminasi bahan pangan dan pakan oleh jamur penghasil aflatoksin merupakan masalah lingkungan yang sering terjadi.
Pada mulanya dikenal 4 jenis aflatoksin, yaitu aflatoksin B1, B2, G1 dan G2, tetapi kemudian ditemukan sekitar 13 jenis aflatoksin (Banwart, 1979). Di antara aflatoksin itu, yang paling toksis dan paling banyak terdapat di alam adalah aflatoksin B1 (AFB1). AFB1 sangat terkenal sebagai agensia karsinogenik yang merupakan salah satu
penyebab utama karsinoma hepatoseluler (Stuver, 1998). Selain itu AFB1 juga bersifat toksik, mutagenik dan teratogenik sehingga sangat berbahaya bagi manusia dan hewan.
Di pasaran, bahan pangan dan pakan yang terkontaminasi AFB1 masih banyak beredar bahkan dalam kadar yang relatif tinggi (Muhilal, 1986; Wiryatun dkk., 1988; Rahayu & Sardjono, 1989). Di Indonesia, Pemerintah masih belum menetapkan kebijaksanaan mengenai batas kadar aman AFB1 dalam bahan pangan dan pakan. USFDA (United States Food and Drug Administration) menetapkan batas kadar aman AFB1 di bawah 20 ppb (Saad, 1998).
Aflatoksin bersifat stabil terhadap pemanasan. Pada suhu pemasakan normal (sekitar 1000C) aflatoksin belum mengalami peruraian. Menurut Kapti (1986), titik lebur aflatoksin relatif cukup
WIDIYANI dan SAGI - Aflatoksin B1 pada Mus musculus 29
tinggi yaitu di atas 2500C oleh karena itu bahan pangan yang terkontaminasi aflatoksin masih tetap berbahaya untuk dikonsumsi meskipun telah diolah dengan jalan pemanasan/pemasakan.
Efek teratogenesis AFB1 dimungkinkan terjadi karena AFB1 mempunyai berat molekul relatif rendah yaitu 312 dalton. Senyawa dengan berat molekul kurang dari 600 dalton dapat melewati barrier plasenta sehingga akan kontak dengan jaringan fetus (Davis, 1977; Denning et al. 1990). Di dalam tubuh, AFB1 mengalami metabolisme yang meliputi mekanisme aktivasi dan deaktivasi (detoksifikasi). Organ yang berperan dalam fungsi metabolisme dan ekskresi pada fetus masih belum berkembang secara sempurna sehingga masuknya senyawa asing dalam tubuh akan membahayakan bagi fetus tersebut.
Jaringan konseptal intrauterus justru terdapat enzim lipoksigenase yang diketahui berperan dalam bioaktivasi AFB1 menjadi senyawa epoksida AFB1. Terbentuknya senyawa epoksida ini menimbulkan dampak yang luas berkaitan dengan efek toksik, karsinogenik, mutagenik, dan teratogenik dari AFB1. Senyawa epoksida mempunyai kemampuan bereaksi dengan asam nukleat membentuk DNA/ RNA-adduct yang menyebabkan terganggunya proses pengekspresian gen. Selain itu senyawa epoksida juga dapat berikatan dengan komponen protein sel yang akan menyebabkan terganggunya fungsi fisiologis sel dan selanjutnya berakibat pada terjadinya kematian sel (Datta & Kulkarni, 1994; Eaton & Gallagher, 1994; Heish & Heish, 1993).
Berdasarkan pada pernyataan bahwa AFB1 mempunyai efek teratogenesis, maka perlu dilaku-kan penelitian untuk mengkaji pengaruh pemberian AFB1 pada mencit (Mus musculus L.) bunting selama masa organogenesis terhadap pertumbuhan dan perkembangan embrio dan skeleton fetus.
BAHAN DAN METODE
Tiga puluh ekor mencit betina dewasa yang berada dalam stadium proestrus dikelompokkan secara acak menjadi 5. Masing-masing kelompok yang terdiri dari 6 ekor mencit sebagai ulangan, dikandangkan bersama seekor pejantan fertil untuk dikawinkan. Pada hari berikutnya mencit-mencit betina diperiksa apakah terdapat vaginal plug, jika hasilnya positif maka pada hari itu ditentukan sebagai hari ke-1 kebuntingan.
AFB1 murni buatan SIGMA dilarutkan dalam propilen glikol dan diberikan pada hewan uji secara oral. Peringkat dosis AFB1 adalah 0 (plasebo); 2,25; 3; dan 4,5 mg/kg BB dalam 0,2 ml propilen
glikol, sedang sisanya sebagai kelompok kontrol. Perlakuan diberikan pada mencit bunting hari ke-6 sampai dengan hari ke-15.
Pada hari ke-18 umur kebuntingan, mencit dikorbankan dan dilakukan bedah cesar untuk mengambil fetus dari uterus. Fetus diamati, meliputi pengamatan morfometri fetus dan pengamatan histologis - histokimia skeleton. Pengamatan morfometri terdiri dari penghitungan jumlah kematian intrauterus, pengukuran berat badan dan panjang fetus dan pengamatan terhadap kelainan morfologi (malformasi). Pertumbuhan dan perkembangan skeleton fetus secara umum dapat diamati setelah diwarnai dengan Alizarin Red S menurut metode C. Arnott (Kaufman, 1992).
Jumlah kematian intrauterus, jumlah fetus yang mengalami malformasi, dan jumlah fetus yang skeletonnya mengalami kelainan perkembangan dianalisis dengan uji Chi-square. Rerata berat badan dan panjang fetus serta rerata jumlah komponen tulang yang mengalami osifikasi dianalisis varian (ANAVA) pola satu arah menggunakan Rancangan Acak Lengkap (RAL). Jika ANAVA menunjukkan hasil yang signifikan dilanjutkan uji DMRT (Duncan’s Multiple Range Test).
HASIL DAN PEMBAHASAN Pertumbuhan dan Perkembangan Fetus
Hasil penelitian yang diperoleh tentang pengamatan morfometri fetus dari mencit bunting yang diberi AFB1 disajikan pada Tabel 1. Dari Tabel tersebut dapat diketahui mengenai jumlah induk, jumlah fetus total, rerata jumlah fetus dari tiap induk, jumlah dan frekuensi fetus hidup, serta jumlah dan frekuensi kematian intrauterus. Pada penelitian ini kematian intrauterus yang terjadi terdiri dari resorpsi dan kematian fetus. Selain itu dalam Tabel 1 tersebut juga disajikan rerata berat badan fetus, rerata panjang fetus serta jumlah dan frekuensi fetus yang mengalami malformasi.
Dari Tabel 1 terlihat bahwa pemberian AFB1 cenderung menyebabkan penurunan jumlah fetus yang hidup dan peningkatan jumlah kematian intrauterus. Pada kelompok kontrol dan plasebo 100% fetus dalam keadaan hidup. Kematian intrauterus mulai terjadi pada dosis terendah (2,25 mg/kg BB). Seiring dengan peningkatan dosis AFB1 yang diberikan maka kematian intrauterus cenderung mengalami peningkatan pula. Pada dosis tertinggi (4,5 mg/kg BB), terjadi kematian fetus yang relatif cukup tinggi (di atas 10%).
Halaman: 28-35
© 2001 Jurusan Biologi FMIPA UNS Surakarta Tabel 1. Pengamatan morfometri fetus hari ke-18 kebuntingan dari induk mencit yang diberi AFB1 pada dosis berbeda.
Kontrol Plasebo 2,25 mg/kg BB 3 mg/kg BB 4,5 mg/kg BB
1 Jumlah Induk 6 6 6 6 6
2 Jumlah Fetus Total 67 66 60 57 55
3 Jumlah Fetus dari Tiap Induk 11,17 11 10 9,5 9,17 (Rerata ± SD) ± 0,98 ± 1,1 ± 0,89 ± 0,84 ± 0,75 4 Jumlah dan Frekuensi Fetus Hidup 67 (100%) 66 (100%) 56 (93,33%) 51 (89,47) 44 (80%) 5 Jumlah dan Frekuensi Kematian Intrauterus 0 (0%) 0 (0%) 4 (6,67%) 6 (10,53%) 11 (19,99%)
a. Jumlah dan Frekuensi Resorpsi 0 (0%) 0 (0%) 1 (1,67%) 2 (3,51%) 3 (5,45%) b. Jumlah dan Frekuensi Kematian Fetus 0 (0%) 0 (0%) 3 (5%) 4 (7,02%) 8 (14,54%) 6 Berat Badan Fetus (g) 1,64 a 1,57 a 1,44 b 1,39 b 1,37 b
(Rerata ± SD) ± 0,12 ± 0,1 ± 0,05 ± 0,12 0,07 7 Panjang Fetus (mm) 25,24 a 24,42 ab 23,9 b 23,54 b 20,98 c
(Rerata ± SD) ± 0,81 ± 0,75 ± 1,04 ± 0,96 ± 0,8 8 Jumlah dan Frekuensi Malformasi 0 (0%) 0 (0%) 7 (11,67%) 12 (21,06%) 20 (36,36%)
Kelompok Perlakuan No. Parameter yang Diamati
Keterangan: Huruf yang sama di belakang angka dalam satu baris menunjukkan tidak ada beda nyata di antaranya. Hasil analisis statistik dengan uji Chi-square
adalah X2
hitung > X2tabel, berarti ada hubungan antara pemberian AFB1 dengan jumlah terjadinya kematian intrauterus. Maka terbukti bahwa AFB1 yang diberikan pada mencit bunting selama masa organogenesis menyebabkan terjadinya kematian intrauterus. Hal ini menunjukkan bahwa AFB1 bersifat toksik terhadap embrio dan fetus sehingga dikatakan AFB1 mempunyaiefek embriotoksik dan fetotoksik.
Pada tahap embrional, sel secara intensif mengalami diferensiasi, gerakan morfogenesis dan organisasi. Selama periode ini terjadi proses organogenesis sebagian besar organ tubuh. Embrio sangat rentan terhadap efek teratogen sehingga setiap gangguan dalam diferensiasi sel selalu mengakibatkan kelainan bawaan. Kelainan ini bervariasi mulai dari kecacatan struktural (malformasi), hambatan pertumbuhan, penurunan fungsi organ sampai kematian. Pada manusia dapat juga menimbulkan keguguran sedang pada Rodensia menimbulkan resorpsi (Wilson, 1973).
Pada penelitian ini dilakukan pengukuran berat badan dan panjang fetus karena kedua parameter ini cukup sensitif. Secara umum, dari data pengamatan di Tabel 1 menunjukkan bahwa sejalan dengan peningkatan dosis AFB1 yang diberikan, maka cenderung mengalami penurunan baik untuk ukuran berat badan maupun ukuran panjang fetus (Gambar 1). Analisis statistik dengan ANAVA untuk parameter berat badan fetus menunjukkan hasil bahwa ada perbedaan yang sangat bermakna
(p<0.01) di antara kelima kelompok uji tersebut. Analisis lanjutan antar kelompok dengan uji DMRT menunjukkan bahwa kelompok kontrol tidak berbeda dengan kelompok plasebo tetapi kelompok kontrol dan plasebo berbeda secara bermakna dengan kelompok perlakuan AFB1. Meskipun pada kelompok perlakuan AFB1 mengalami penurunan berat badan seiring dengan peningkatan dosis yang diberikan, tetapi di antara kelompok perlakuan yang diberi AFB1 tersebut tidak berbeda nyata (ditunjukkan dengan huruf yang sama pada Tabel 1). Hal ini menunjukkan bahwa berapapun besar dosis AFB1 yang diberikan (dalam kisaran 2,25- 4,5 mg/kg BB) tidak menimbulkan efek yang berbeda.
Untuk parameter panjang fetus hasil analisis statistik dengan ANAVA sama seperti pada parameter berat badan, yaitu ada perbedaan yang sangat bermakna (p<0.01) di antara kelima kelompok uji tersebut. Hasil analisis lanjutan dengan uji DMRT menunjukkan bahwa pada kelompok perlakuan AFB1 dosis 2,25 mg/kg BB dan 3 mg/kg BB telah mulai terjadi penurunan panjang fetus jika dibandingkan dengan kelompok kontrol. Akan tetapi penurunan panjang fetus tersebut kurang bermakna karena kelompok tersebut tidak berbeda dengan kelompok plasebo. Pada kelompok dosis perlakuan tertinggi (4,5 mg/kg BB) barulah terjadi penurunan panjang fetus yang cukup bermakna. Dengan demikian dapat
WIDIYANI dan SAGI - Aflatoksin B1 pada Mus musculus 31
dikatakan bahwa pemberian AFB1 pada dosis 4,5 mg/kg BB dapat mempengaruhi panjang fetus.
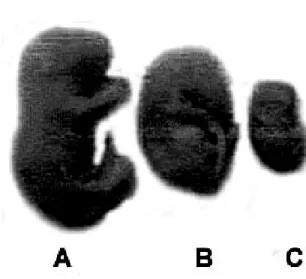
Gambar 1. Morfologi Fetus Normal dan Fetus yang Terhambat Pertumbuhannya: (A) Fetus normal dari kelompok kontrol, (B) Fetus yang terhambat pertumbuhannya dari kelompok perlakuan AFB1 dosis 2,25 mg/kg BB, (C) Fetus yang terhambat pertumbuhannya dari kelompok perlakuan AFB1 dosis 3 mg/kg BB, (D) Fetus yang terhambat pertumbuhannya dari kelompok perlakuan AFB1 dosis 4,5 mg/kg BB.
Menurut Wilson (1973), penurunan berat badan dan panjang tubuh fetus merupakan bentuk teringan dari efek suatu senyawa yang bersifat teratogenik. Penurunan berat badan dan panjang ini merupakan indikator terjadinya hambatan pertumbuhan akibat gangguan terhadap proses-proses yang mendasari pertumbuhan (pembelahan sel, metabolisme dan sintesis).
Gangguan pertumbuhan yang terjadi akibat pemberian AFB1 kemungkinan diawali oleh terbentuknya ikatan antara epoksida hasil bioaktivasi AFB1 dengan asam nukleat membentuk DNA atau RNA adduct. Hal ini menyebabkan proses replikasi dan transkripsi DNA menjadi terganggu. Proses pertumbuhan berkaitan erat dengan pembelahan sel (mitosis dan meiosis). Pembelahan sel selalu didahului oleh replikasi dan transkripsi DNA. Jika DNA terganggu, maka proses replikasi dan transkripsi akan terganggu pula dan sebagai akibatnya terjadi hambatan pertumbuhan.
Pengamatan terhadap morfologi fetus membuktikan bahwa AFB1 bersifat teratogenik karena dapat menimbulkan malformasi. Suatu penelitian yang dilakukan oleh Ryan et al. (1990) menyimpulkan bahwa terjadinya penurunan berat badan karena pengaruh teratogen akan selau diikuti oleh terjadinya malformasi. Hal tersebut juga berlaku dalam penelitian ini. Malformasi yang terjadi adalah hemoragi atau perdarahan bawah kulit, tungkai bengkok dan tubuh bongkok (fleksi).
Data jumlah fetus yang mengalami malformasi yang terdapat pada Tabel 1 menunjukkan bahwa
malformasi sudah terjadi pada perlakuan AFB1 dosis terendah (2,25 mg/kg BB) dan frekuensinya relatif tinggi karena lebih dari 10%. Fetus yang mengalami malformasi terus meningkat jumlahnya seiring dengan peningkatan dosis AFB1 yang diberikan. Pada dosis tertinggi (4,5 mg/kg BB) bahkan jumlahnya relatif sangat tinggi mencapai 36,36%. Hasil analisis statistik dengan uji Chi-square adalah X2
hitung > X2tabel, berarti ada hubungan antara pemberian AFB1 terhadap terjadinya malformasi.
Jenis malformasi yang banyak terjadi pada penelitian ini adalah hemoragi. Hemoragi atau perdarahan sebenarnya adalah suatu peristiwa keluarnya darah dari sistem kardiovaskuler yang disertai dengan penimbunan di dalam ruangan tubuh atau di dalam jaringan tubuh (Price & Wilson, 1984). Ada beberapa mekanisme yang memungkinkan untuk terjadinya perdarahan. Salah satu di antaranya adalah akibat ketidakseimbangan osmotik karena adanya gangguan tekanan dan viskositas cairan pada bagian fetus yang berbeda yaitu antara plasma darah dan ruang ekstrakapiler atau antara cairan ekstraembrionik dan intraembrionik. Menurut Wilson (1973), pada keadaan normal embrio berkembang dalam cairan amnion yang isotonis terhadap cairan tubuh. Adanya senyawa-senyawa asing dalam jaringan dapat mengganggu keseimbangan osmotik tersebut.
Jenis malformasi yang lain adalah tungkai bengkok. Malformasi ini berkaitan erat dengan proses pertumbuhan dan perkembangan tulang panjang penyusun tungkai yang kurang sempurna.
Tungkai bengkok dapat terjadi karena ada perbedaan kecepatan pertumbuhan tulang tersebut.
Pertumbuhan tulang pada salah satu sisi lebih
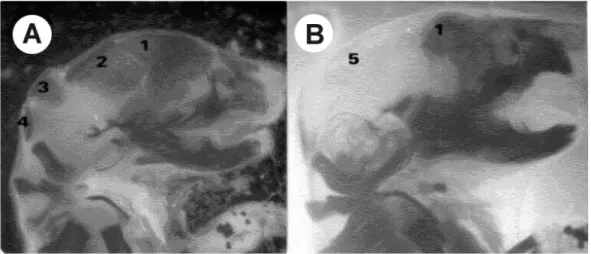
Gambar 2. Fotomikrograf Cranium Fetus: (A) Fetus kelompok kontrol, (B) Fetus kelompok perlakuan AFB1 dosis 4,5 mg/kg BB. Keterangan: 1. Os frontal, 2. Os Parietal, 3. Os Interparietal, 4. Os Supraoccipital, 5. Os frontal, os parietal dan os supraoccipital belum mengalami osifikasi. Pewarna: Alizarin Red S. Warna merah (gelap): tulang; warna transparan: kartilago.
lambat daripada sisi yang lain akibatnya ukuran tulang penyusun tungkai tersebut menjadi tidak sama dan akan membelok ke arah yang lebih pendek.
Malformasi berupa tubuh bongkok juga berkaitan dengan proses pertumbuhan dan perkembangan tulang. Kemungkinan penyebabnya adalah terjadi fleksi lordosis atau kifosis pada columna vertebralis terutama pada vertebrae thoracalis, vertebrae lumbalis atau vertebrae sacralis.
Pertumbuhan dan Perkembangan Skeleton
Terjadinya malformasi berupa tungkai bengkok dan badan bongkok sebenarnya berkaitan dengan proses pertumbuhan dan perkembangan tulang. Hal ini menunjukkan bahwa AFB1 secara khusus juga mempengaruhi pertumbuhan dan perkembangan sistem skeletal fetus. Menurut Anderson & Conning (1988), pengamatan pertumbuhan dan perkembangan skeleton dapat menggunakan tolok ukur berupa (1) jumlah komponen skeleton dan tingkat osifikasinya, (2) ada tidaknya atau sempurna tidaknya osifikasi dan (3) ada tidaknya kelainan dalam pembentukan skeleton.
Pada penelitian ini dilakukan pengamatan meliputi skeleton aksial (cranium, vertebrae, sternum, dan costae) dan skeleton appendicular (cingulum pectorales, cingulum pelvicales dan ekstremitas). Ditinjau dari tingkat osifikasinya maka terjadi keterlambatan osifikasi pada komponen tulang penyusun cranium, vertebrae
caudalis, sternum, metacarpal, dan metatarsal fetus dari induk yang diberi perlakuan AFB1. Keterlambatan osifikasi dapat diketahui dengan menghitung jumlah komponen tulang penyusunnya setelah diwarnai Alizarin Red S. Komponen tulang akan menghasilkan warna merah, sedangkan jika masih bersifat kartilago akan berwarna transparan.
Pada kelompok perlakuan dosis 4,5 mg/kg BB beberapa fetus mengalami keterlambatan osifikasi cranium. Komponen tulang yang mengalami keterlambatan osifikasi meliputi os frontal, os parietal, os interparietal, dan os supraoccipital (Gambar 2). Keterlambatan osifikasi tulang penyusun cranium akan membahayakan bagi kehidupan fetus selanjutnya. Hal ini berkaitan dengan fungsi cranium sebagai pelindung organ syaraf terbesar yaitu otak. Apabila pembentukan cranium tidak sempurna dimungkinkan terjadinya kecacatan berupa exencephaly yang menyebabkan otak terdedah keluar.
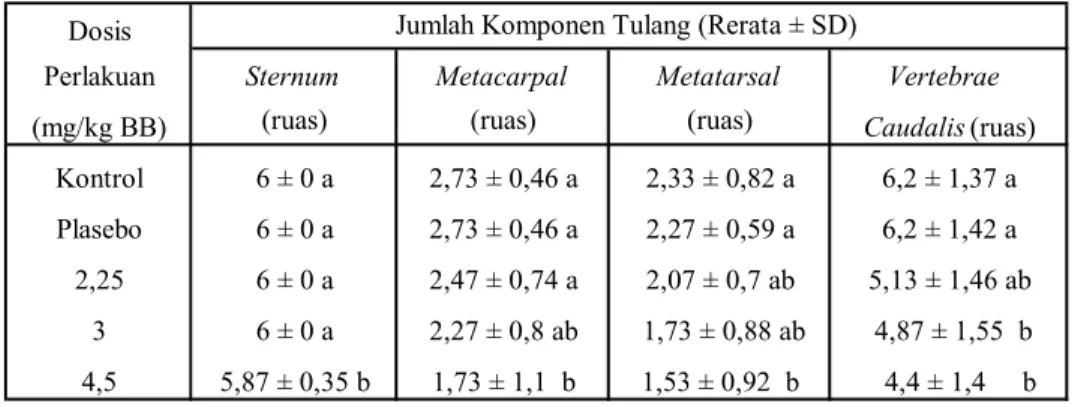
Rerata jumlah komponen tulang penyusun vertebrae caudalis, sternum, metacarpal, dan metatarsal disajikan pada Tabel 2. Dari tabel tersebut dapat diketahui bahwa sejalan dengan peningkatan dosis AFB1 yang diberikan, maka jumlah komponen tulang cenderung menurun. Analisis statistik dengan ANAVA untuk rerata jumlah komponen tulang penyusun metatarsal dan vertebrae caudalis menunjukkan perbedaan yang bermakna (p<0,05), untuk metacarpal menunjukkan perbedaan yang sangat bermakna
WIDIYANI dan SAGI - Aflatoksin B1 pada Mus musculus 33
(p<0,01) sedangkan untuk sternum tidak ada perbedaan yang bermakna (p>0,05).
Tabel 2. Rerata jumlah komponen tulang sternum, metacarpal, metatarsal, dan vertebrae caudalis fetus dari induk yang diberi AFB1.
Dosis
Perlakuan Sternum Metacarpal Metatarsal Vertebrae
(mg/kg BB) (ruas) (ruas) (ruas) Caudalis(ruas)
Kontrol 6 ± 0 a 2,73 ± 0,46 a 2,33 ± 0,82 a 6,2 ± 1,37 a Plasebo 6 ± 0 a 2,73 ± 0,46 a 2,27 ± 0,59 a 6,2 ± 1,42 a 2,25 6 ± 0 a 2,47 ± 0,74 a 2,07 ± 0,7 ab 5,13 ± 1,46 ab
3 6 ± 0 a 2,27 ± 0,8 ab 1,73 ± 0,88 ab 4,87 ± 1,55 b 4,5 5,87 ± 0,35 b 1,73 ± 1,1 b 1,53 ± 0,92 b 4,4 ± 1,4 b
Jumlah Komponen Tulang (Rerata ± SD)
Keterangan: Huruf yang sama di belakang angka dalam satu kolom menunjuk kan tidak ada beda nyata di antaranya. Analisis statistik lanjutan dengan DMRT
menunjukkan bahwa pengaruh AFB1 terhadap osifikasi umumnya tampak nyata pada pemberian AFB1 dosis tertinggi (4,5 mg/kg BB) yaitu untuk sternum, metacarpal dan metatarsal (pada Tabel 2 ditunjukkan oleh huruf yang berbeda terhadap kelompok kontrol dan plasebo). Sedangkan untuk vertebrae caudalis efek yang nyata sudah ditunjukkan pada dosis yang lebih rendah (3 mg/kg BB).
Kelainan perkembangan skeleton juga dapat diamati pada fetus dari kelompok perlakuan dosis tertinggi (4,5 mg/kg BB). Kelainan skeleton yang terjadi berupa fusi costae. Pada penelitian ini ada 2 jenis fusi yaitu fusi terjadi pada costae nomor 12-13, sedang lainnya terjadi pada costae nomor 11-12. Fusi costae nomor 12-13 hanya terjadi di bagian pangkal (proksimal), sedangkan pada costae nomor 11-12 fusi meluas sampai ke bagian distal (ujung). Di samping fusi costae terjadi pula kelainan skeleton berupa fleksi lordosis dan kifosis
pada vertebrae cervicales dan vertebrae thoracales. Kelainan vertebrae ini mewujudkan malformasi eksternal berupa tubuh bongkok (Gambar 3).
Pertumbuhan dan perkembangan costae dan vertebrae terjadi secara bersamaan sehingga gangguan terhadap perkembangan awal vertebrae seringkali diikuti dengan kelainan pada costae. Kelainan vertebrae dapat disebabkan oleh 3 kemungkinan yaitu gangguan terhadap somit, gangguan terhadap chorda dorsalis atau gangguan terhadap diferensiasi sklerotom (Theiler, 1988). Gangguan terhadap migrasi sel-sel mesenkim pada waktu pembentukan vertebrae juga menyebabkan kelainan terutama terhadap struktur centrum vertebrae (Stazi et al., 1992). Sternum berkembang paling akhir di antara skeleton aksial yang lain. Hal ini disebabkan karena diduga sternum merupakan penggabungan bagian ventral dari costae kanan dan kiri (Carlson, 1988).
Gambar 3. Struktur morfologi dan skeleton fetus yang mengalami malformasi tubuh bongkok: (A) Fetus normal dari kelompok kontrol, (B) Fetus bertubuh bongkok dari kelompok perlakuan AFB1 dosis 4,5 mg/kg BB. Tanda panah (→) menunjukkan fleksi vertebrae (lordosis-kifosis).
Tabel 3. Jumlah fetus yang mengalami kelainan skeleton dari induk mencit yang diberi AFB1. Dosis Jumlah Fetus Jumlah Fetus yang Mengalami Frekuensi Fetus Perlakuan yang Mengalami Kelainan
(mg/kg BB) Skeleton (%) Kontrol 15 0 0 Plasebo 15 0 0 2,25 15 4 26,67 3 15 6 40 4,5 15 10 66,67 Kelainan Skeleton yang Diamati
Pertumbuhan dan perkembangan vertebrae kemungkinan berkaitan dengan pengekspresian gen Hoxc8+. Gen ini berfungsi mengendalikan ciri
segmental embrio. Wilayah kerja protein HOXC8+ adalah sepanjang sumbu anterioposterior vertebrae thoracalis dan vertebrae lumbalis (Le Mouellic, 1992 in Kalthoff, 1996). Sedangkan pertumbuhan dan perkembangan tulang penyusun ekstremitas berkaitan dengan pengekspresian gen Wnt-1, Hoxd-13 dan Msx-1 (Zakany et al., 1994). Diduga aktivitas pengekspresian gen tersebut terganggu oleh adanya senyawa epoksida AFB1 yang membentuk DNA-adduct sehingga pertumbuhan dan perkembangan sistem skeletal terhambat atau mengalami kelainan.
Fetus-fetus yang mengalami kelainan skeleton akibat pemberian AFB1 relatif cukup tinggi jumlahnya (di atas 20%). Data mengenai jumlah dan frekuensi fetus yang mengalami kelainan skeleton disajikan pada Tabel 3. Dari Tabel tersebut dapat diketahui bahwa jumlah dan frekuensi fetus yang mengalami kelainan skeleton cenderung meningkat sejalan dengan peningkatan dosis AFB1 yang diberikan. Analisis statistik dengan uji Chi-square membuktikan bahwa ada hubungan antara pemberian AFB1 dengan terjadinya kelainan skeleton.
KESIMPULAN
Berdasarkan hasil penelitian ini, maka dapat disimpulkan bahwa AFB1 dosis 4,5 mg/kg BB yang diberikan pada mencit bunting selama masa organogenesis dapat menghambat pertumbuhan dan perkembangan fetus mencit, menyebabkan kematian intrauterus dan menimbulkan malformasi berupa hemoragi, tungkai bengkok dan tubuh
bongkok. AFB1 dosis 4,5 mg/kg BB juga menghambat pertumbuhan dan perkembangan skeleton yang ditandai oleh terhambatnya osifikasi komponen tulang cranium, metacarpal, metatarsal, sternum dan vertebrae caudalis fetus, dan terjadinya kelainan skeleton fetus berupa fusi costae dan fleksi lordosis-kifosis vertebrae cervicales dan vertebrae thoracales.
UCAPAN TERIMA KASIH
Ucapan terima kasih penulis sampaikan kepada Dr. Wiryatun Lestariana, Apt. yang telah berkenan memberikan bantuan bahan aflatoksin dan telah memberikan banyak masukan dalam pelaksanaan penelitian ini. Demikian juga kepada Kepala dan Staf Laboratorium Histologi – Embriologi Hewan Fakultas Biologi UGM (Sdr. Nur Chasanah dan Bp. Abadi) serta Kepala dan Staf UPHP UGM (terutama Bp. Suroso) atas penyediaan fasilitas dan kerjasama yang baik selama berlangsungnya penelitian ini.
DAFTAR PUSTAKA
Anderson, D. & D.M. Conning. 1988. Experimental Toxicology The Basic Principles. London: Royal Society of Chemistry.
Banwart, G.J. 1979. Basic Food Microbiology. Westport Connecticut: AVI Publishing Company, Inc.
Carlson, B.M. 1988. Patten’s Foundation of Embryology. 4th ed. New Delhi: Tata McGraw-Hill Publishing Company LTD.
Datta, K. & A.P. Kulkarni. 1994. Oxidatif metabolism of aflatoxin B1 lipoxygenase purified from human term placenta and intrauterine conceptal tissues. J. Teratol. 50 (4): 311-317.
WIDIYANI dan SAGI - Aflatoksin B1 pada Mus musculus 35
Davies, D.M. 1977. Textbook of Adverse Drug Reaction.
New York: Oxford University Press.
Denning, D.W., R. Allen, A.P. Wilkinson, & M.R.A. Morgan. 1990. Transplacental transfer of aflatoxins in humans. Carcinogenesis 11: 1033-1035.
Eaton, L.D. & E.P. Gallagher. 1994. Mechanism of carcinogenesis. Annual Review Pharmacology Toxicology 34: 135-172.
Heish, L.L. & T.T. Heish. 1993. Detection of aflatoxin B1-DNA adduct in human placenta and cord blood.
Cancer Res. 53: 1278-1280.
Kalthoff, K. 1996. Analysis of Biological Development.
New York: McGraw-Hill Inc.
Kapti, R.K. 1986. Toksin dalam Mikrobia Pangan.
Lanjuran (Proceedings) Seminar Keamanan Pangan dalam Pengolahan dan Penyajian. PAU Pangan dan Gizi UGM, Yogyakarta. hal: 197-203.
Kaufman, M.H. 1992. The Atlas of Mouse Development. San Diego: Academic Press Harcourt Brace and Company.
Muhilal. 1986. Cemaran Aflatoksin pada Hasil Olahan Kacang Tanah dan Kedelai. Lanjuran (Proceedings) Seminar Keamanan Pangan dalam Pengolahan dan
Penyajian. PAU Pangan dan Gizi UGM,
Yogyakarta. hal: 204-209.
Price, S.A. & L.M. Wilson. 1984. Clinical Concepts of Diseases Processes. New York: McGraw-Hill Inc. Rahayu, K. & Sardjono. 1989. Deteksi Mikotoksin pada
Produk Kecap Komersial. Yogyakarta: PAU Pangan dan Gizi UGM.
Ryan, L.M., P.J. Catalano, C.A. Kimmel, & G.L. Kimmel. 1990. Relationship between fetal weight and malformation in developmental studies. Teratol.
44:215-223.
Saad, N. 1998. Aflatoxins: Occurrence and Health Risk.
CU Toxic Plant Pages, www.usda.gov/gipsa/newsinfo/back/b-aflatox.htm.
Stazi, A.V., C. Macri, C. Ricciardi, & A. Mantovani. 1992. Significance of the minor alteration of the axial skeleton in rat foetuses. A Short Review.
Conggres Anatomy 23: 91-104.
Stuver, S.O. 1998. Toward global control of liver cancer. Seminars in Cancer Biology 8 (4): 299-306. Theiler, K. 1988. Vertebral Malformation. Berlin:
Springer-Verlag.
Wilson, J.G. 1973. Environment and Birth Defects. New York: Academic Press.
Wiryatun, L., S. Anggraheni, Maliyah M., & P. Hastuti. 1988. Cemaran Aflatoksin pada Bahan Makanan yang Beredar di Yogyakarta. Laporan Penelitian Proyek Peningkatan Pengembangan Perguruan Tinggi UGM 5(9).
Zakany, J., M. Lemaistre & D. Duboule. 1994. Ectopic expression of Wnt-1 induces abnormalities in growth and skeletal patterning of the limbs. In: Zagris, N., A.M. Duprat & A. Durston (ed.). Organization of The Early Vertebrate Embryo. New York: Plenum Press-NATO Scientific Affairs Division.