PERUBAHAN SENYAWA HIDROKARBON SELAMA
PROSES BIOREMEDIASI TANAH TERCEMAR MINYAK
BUMI MENGGUNAKAN KROMATOGRAFI GAS
SPEKTROFOTOMETRI MASSA
AWAN KARLIAWAN
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
ABSTRAK
AWAN KARLIAWAN. Perubahan Senyawa Hidrokarbon Selama Proses Bioremediasi Tanah Tercemar Minyak Bumi Menggunakan Kromatografi Gas Spektrofotometri Massa. Dibimbing oleh CHARLENA dan ROZA ADRIANY.
Penanggulangan pencemaran yang disebabkan tumpahnya minyak bumi dapat menggunakan mikrooganisme pendegradasi minyak. Pada penelitian ini perubahan senyawa hidrokarbon hasil degradasi oleh bakteri T2M diteliti dengan menggunakan Kromatografi Gas Spektrofotometri Massa (GCMS). Tanah yang telah dicampur dengan minyak bumi sebanyak 5 % (b/b) ditambahkan isolat bakteri T2M. Perubahan senyawa hidrokarbon dan total petroleum hidrokarbon (TPH) diteliti setiap 2 minggu. Pengukuran TPH dilakukan dengan menggunakan metode gravimetri dengan menggunakan pelarut
n-heksana. Preparasi untuk GCMS dilakukan dengan ekstraksi soxhlet. Ekstraksi
dilakukan selama 4 jam dengan menggunakan pelarut aseton:n-heksan (1:1) sebanyak
300 ml. Ekstrak sampel dikeringkan dengan rotarievaporator dan diukur menggunakan GCMS. Hasil penelitian menunjukkan bahwa penurunan TPH paling besar terjadi pada tanah yang tidak disterilkan dan ditambahkan isolat bakteri T2M dengan TPH akhir sebesar 0.28 % dan persen degradasi sebesar 93.30%. Tanah yang tidak ditambahkan bakteri memiliki nilai TPH akhir sebesar 2.11% dan persen degradasi 52.37%. Tanah yang disterilkan dan ditambahkan bakteri memiliki nilai TPH akhir sebesar 0.37 % dan persen degradasi sebesar 90.17%, sedangkan yang tidak ditambahkan bakteri sebesar 1.37 % serta persen degradasi sebesar 74.54%. Perubahan senyawa hidrokarbon selama proses degradasi terjadi pada hidrokarbon rantai panjang menjadi hidrokarbon dengan rantai karbon yang lebih pendek. Hal ini dapat dilihat dari berkurangnya persen area sampel pada data kromatogram. Tanah yang tidak disterilkan dan ditambahkan bakteri menunjukkan perubahan yang paling besar dengan tidak terdeteksinya senyawa hidrokarbon rantai panjang pada akhir perlakuan.
ABSTRACT
AWAN KARLIAWAN. Change of hydrocarbon Compounds During Bioremediation Processes of Soils Polluted by Crude Oil Using Gas Chromatography Mass Spectrophotometry. Supervised by CHARLENA and ROZA ADRIANY.
Pollution handling that caused by crude oil contamination can use crude oil degrading microorganism. In this reseach change of hydrocarbon compounds degraded by bacteria were investigated with gas chromatography mass spectrophotometry (GCMS). The soils mixed with 5 % (b/b) crude oil was added with T2M bacteria isolated. The change of hydrocarbon compounds and total petroleum hydrocarbon (TPH) were
measured every two weeks. TPH mesurement worked by gravimetry method with
n-hexane solvent. Preparation for GCMS worked by soxhlet extraction. Extraction finished
for 4 hours with 300 ml aseton:n-hexane (1:1) solvent. The extract dried by
rotaryevaporator and measured with GCMS. The result of this reseach show that the biggest TPH decrease happened in nonsterilized soils and added bacteria with finally TPH 0.28 % and 93.3 % degradation. Soils were not added by bacteria had finally TPH 0.37 % and 90.17 % degradation. The soils were sterilized and added by bacteria had finally TPH 0.37 % and 90.17 % degradation, even the soils were sterilized and were not added by bacteria had finally TPH 1.37 % and 74.54 % degradation. The change hydrocarbon compounds during degradation process happened to long chain hydrocarbon became shorter hydrocarbon chain. This is showed by the decrease of percent area on chromathograme. The soils were not sterilized and added by bacteria showed the biggest changing because long chain hydrocarbon at the finally measurement were not detected.
PERUBAHAN SENYAWA HIDROKARBON SELAMA
PROSES BIOREMEDIASI TANAH TERCEMAR MINYAK
BUMI DENGAN MENGGUNAKAN KROMATOGRAFI GAS
SPEKTROFOTOMETRI MASSA
AWAN KARLIAWAN
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
Judul : Perubahan Senyawa Hidrokarbon Selama Proses Bioremediasi Tanah Tercemar Minyak Bumi Dengan Menggunakan Kromatografi Gas Spektrofotometri Massa Nama : Awan Karliawan
NIM : G44204016
Menyetujui,
Pembimbing I Pembimbing II
Dra. Charlena, MS
NIP 1967122219940302002 Dra. Roza Adriany, MS NIP 330005228
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. drh. Hasim, DEA NIP 196103281986011002
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas ridho, rahmat, dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2008 ini ialah Perubahan Struktur Hidrokarbon Selama Proses Bioremediasi Tanah Tercemar Minyak Bumi Dengan Menggunakan Kromatografi Gas Spektrofotometri Massa.
Terima kasih penulis ucapkan kepada ibu Dra. Charlena, MS dan ibu Dra. Roza Andriany, MS selaku pembimbing atas bimbingan, dorongan, semangat, dan ilmu yang diberikan kepada peneliti selama penelitian dan penyusunan karya ilmiah ini. Terima kasih tak terhingga juga disampaikan kepada kedua orang serta seluruh keluarga yang memberikan dorongan semangat, bantuan materi, kesabaran, dan kasih sayang kepada penulis.
Terima kasih tak lupa penulis ucapkan kepada Randy, Ibu Rika, Bapak Syawal, Bapak Mulyadi, Bapak Sabur, Bapak Eman, Ibu Yeni, Bapak Rafi atas segala fasilitas dan kemudahan yang telah diberikan. Terima kasih penulis sampaikan kepada Rahmat, Nita, Ihsan, Dewi, Romi, Andre, Dedy, yang telah memberikan semangat dan dorongan kepada penulis, semoga Allah senantiasa membalas kebaikan semuanya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2009
RIWAYAT HIDUP
Penulis dilahirkan di Ciamis pada tanggal 23 Desember 1985 dari ayah Dayat Hidayat dan ibu Idah Jubaidah. Penulis merupakan putra kesembilan dari sebelas bersaudara.
Tahun 2004 penulis lulus dari MAN Cipasung Tasikmalaya dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum mata kuliah Kimia TPB pada tahun ajaran 2006/2007 dan asisten praktikum mata kuliah Kimia Anorganik 2 pada tahun ajaran 2007/2008. Tahun 2007 penulis melaksanakan praktik lapangan di Badan Tenaga Nuklir Nasional (Batan). Selain itu, pada tahun 2006 penulis aktif sebagai pengurus Ikatan Mahasiswa Kimia (Imasika) di Departemen Kewirausahaan.
DAFTAR ISI
Halaman
DAFTAR TABEL... vii
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN... vi
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Produk dan Limbah Minyak Bumi... 1
Mikroorganisme Pendegradasi Hidrokarbon Minyak Bumi ... 2
Faktor-Faktor Pendukung Biodegradasi ... 3
Bioremediasi... 4
Kromatografi Gas Spektofotometri Massa (GCMS) ... 5
BAHAN DAN METODE Alat dan Bahan ... 6
Prosedur ... 6
HASIL DAN PEMBAHASAN pH ... 7
Kadar Air... 8
Suhu... 8
Total petroleum hidrokarbon (TPH)... 8
Perubahan Senyawa Hidrokarbon ... 10
SIMPULAN DAN SARAN Simpulan... 13
Saran... 13
DAFTAR PUSTAKA ... 13
DAFTAR TABEL
1 Daftar pembagian kode sampel... 7
2 Nilai luas area senyawa hidrokarbon yang terdeteksi pada tanah A... 11
3 Nilai luas area senyawa hidrokarbon yang terdeteksi pada tanah B ... 11
4 Nilai luas area senyawa hidrokarbon yang terdeteksi pada tanah C ... 12
5 Nilai luas area senyawa hidrokarbon yang terdeteksi pada tanah D... 12
6 Daftar senyawa hidrokarbon yang tidak terdeteksi di akhir pengukuran... 12
DAFTAR GAMBAR
Halaman 1 Jalur oksidasi n-alkana melalui oksidasi bertahap gugus metil terakhir ... 22 Jalur degradasi hidrokarbon alifatik melalui oksidasi subterminal 2 3 Skema konfigurasi alat GCMS ... 5
4 Bagan alat kromatografi gas ... 5
5 Kurva perbandingan pH tanah ... 8
6 Kurva nilai TPH tanah A selama 4 bulan ... 9
7 Kurva nilai TPH tanah B selama 4 bulan ... 9
8 Kurva nilai perbandingan persen degradasi ... 9
9 Kurva nilai TPH tanah C selama 4 bulan ... 10
10 Kurva nilai TPH tanah D selama 4 bulan ... 10
DAFTAR LAMPIRAN
Halaman 1 Bagan alir penelitian ... 152 Penentuan kadar air... 16
3 Penentuan nilai pH... 17
4 Penentuan nilai suhu ... 18
5 Penentuan nilai TPH ... 19
6 Perubahan luas area hidrokarbon tanah A selama 4 bulan... 20
7 Perubahan luas area hidrokarbon tanah B selama 4 bulan... 21
8 Perubahan luas area hidrokarbon tanah C selama 4 bulan... 22
9 Perubahan luas area hidrokarbon tanah D selama 4 bulan... 23
PENDAHULUAN
Hidrokarbon minyak bumi merupakan kontaminan yang paling luas yang mencemari lingkungan. Kecelakaan tumpahan minyak yang terjadi sering mengakibatkan kerusakan lingkungan yang serius (Prince et. al. 2003). Oleh karena itu, pemerintah melalui PP no 85 Tahun 1999 menyatakan bahwa tumpahan minyak bumi termasuk limbah berbahaya dan beracun (B3). Dalam pengaturan tersebut ditegaskan bahwa setiap produsen yang menghasilkan limbah B3 hanya diizinkan menyimpan limbah tersebut paling lama 90 hari sebelum diolah dan perlu dilakukan perlakuan tertentu sehingga tidak mencemari lingkungan sekitarnya (Sumastri 2004).
Penanganan kondisi lingkungan yang tercemari minyak bumi dapat dilakukan melalui metode fisika, kimia, dan hayati. Penanganan secara kimia dan fisika merupakan cara penanganan cemaran minyak bumi yang membutuhkan waktu yang relatif singkat, tetapi metode ini dapat menyebabkan kerusakan lingkungan. Metode fisika yang dapat digunakan ialah dengan mengambil kembali minyak bumi yang tumpah dengan oil skimmer. Metode ini dapat dilakukan jika minyak bumi yang tumpah belum menyebar kemana-mana. Jika minyak bumi telah mengendap dan menyebar sulit dilakukan dengan metode ini (Prince et.al. 2003). Penanganan dengan metode kimia ialah dengan mencari bahan kimia yang mempunyai kemampuan mendispersi minyak, tetapi pemakaian senyawa kimia hanya bersifat memindahkan masalah. Di satu pihak perlakuan dispersan dapat mendispersi minyak bumi sehingga menurunkan tingkat pencemaran, tetapi di lain pihak penggunaan dispersan telah dilaporkan bersifat sangat toksik pada biota laut (Fahruddin 2004). Alternatif yang terakhir dalam menanggulangi dampak pencemaran lingkungan oleh minyak bumi ialah dengan menggunakan jasa makhluk hidup yang lebih dikenal dengan bioremediasi. Bioremediasi merupakan teknologi dengan memanfaatkan mikroorganisme untuk mengatasi masalah pencemaran lingkungan. Pendegradasi hidrokarbon yang telah dilaporkan di antaranya ialah bakteri, jamur, dan fungi (Atlas 1992). Penggunaan bakteri untuk mendegradasi hidrokarbon minyak bumi memiliki kelebihan, yaitu murah, efektif, dan aman bagi lingkungan (Sumastri 2004).
Penelitian yang dilakukan Ni’mah (2005) menunjukkan bahwa bakteri dengan kode isolat
T2M memiliki kemampuan degradasi hidrokarbon tertinggi dibandingkan degradasi yang dilakukan oleh bakteri dengan kode isolat A11 dan BTi. Parameter yang digunakan pada penelitian tersebut ialah total petroleum hidrokarbon (TPH) dan pH. Senyawa hidrokarbon hasil degradasi hidrokarbon oleh bakteri tersebut belum diteliti lebih lanjut. Oleh karena itu, perubahan senyawa hidrokarbon hasil degradasi bakteri perlu diteliti agar dapat diketahui sejauh mana bakteri dapat mendegradasi senyawa hidrokarbon yang terdapat dalam tanah tercemari minyak bumi
Penelitian ini bertujuan menentukan perubahan senyawa hidrokarbon selama proses bioremediasi minyak bumi dengan menggunakan GCMS. Instrumen tersebut dapat memberikan data yang akurat mengenai komposisi senyawa yang terdapat dalam sampel.
TINJAUAN PUSTAKA
Produk dan Limbah Minyak Bumi Minyak bumi maupun produknya merupakan campuran senyawa organik yang terdiri atas senyawa hidrokarbon dan non hidrokarbon. Senyawa hidrokarbon merupakan komponen terbesar dari minyak bumi (lebih dari 90%), sedangkan sisanya berupa senyawa non hidrokarbon. Senyawa hidrokarbon merupakan senyawa organik yang terdiri atas karbon dan hidrogen. Senyawa ini dapat digolongkan dalam tiga kategori, yaitu: (1) hidrokarbon alifatik (alkana, alkena, dan alkuna), (2) hidrokarbon alisiklik (siklo alkana, siklo alkena, siklo alkuna), (3) hidrokarbon aromatik (senyawa aromatik tersubstitusi maupun tidak) (Udiharto 1996).
Alkana merupakan hidrokarbon rantai lurus yang memiliki ikatan kimia tunggal diantara atom karbon. Alkana dapat berupa rantai lurus, rantai bercabang, atau struktur cincin. Salah satu sifat yang paling penting dari alkana yaitu bersifat volatil dan dapat dibiodegradasi. Umumnya volatilitas alkana akan semakin berkurang seiring bertambah panjangnya rantai.
Sikloalkana merupakan rantai hidrokarbon yang dihubungkan oleh ikatan karbon membentuk sebuah cincin. Rantai tunggal sikloalkana sedikit volatil meskipun tingkat volalilitas menurun seiring bertambahnya ukuran dan jumlah rantai, sikloalkana dapat
didegradasi tetapi lebih lambat dibandingkan dengan alkana.
Senyawa aromatik merupakan senyawa yang relatif sulit mengalami biodegradasi (Atlas dan Bartha 1972). Senyawa aromatik mengandung sekurang-kurangnya satu cincin benzena. Senyawa benzena, toluena, etilbenzena, dan xilena dapat dikeluarkan dari tanah dengan menggunakan teknik ekstraksi.
Selama kegiatan industri perminyakan yaitu mulai dari pengeboran, produksi, transportasi minyak bumi, pengilangan dan transportasi produk minyak umumnya terjadi tumpahan maupun ceceran minyak bumi dan produk-produknya yang terjadi di lingkungan lahan maupun perairan. Dalam kondisi normal limbah yang terbuang ke lingkungan tidak terlalu besar tetapi apabila terjadi kecelakaan akan berakibat lain seperti yang terjadi di beberapa tempat di dunia.
Mikroorganisme Pendegradasi Hidrokarbon Minyak Bumi
Mikroorganisme pendegradasi minyak bumi cukup banyak jenisnya dan dapat ditemukan di berbagai tempat yang sesuai, yaitu lingkungan yang mengandung cukup limbah minyak bumi. Sejauh ini telah ditemukan 22 genera bakteri yang hidup di lingkungan minyak bumi. Isolat yang mendominasi di lingkungan tersebut terdiri atas beberapa genera, yaitu Alcaligenes, Arthrobacter, Acenitobacter, Nocardia, Achromobacter, Bacillus, Flavobacterium, dan Pseudomonas. Disamping itu juga ditemukan sejumlah khamir pendegradasi minyak bumi, yaitu dari genera
Aureobacterium, Candida, Rhodotorula,
Sporobolomyces yang diisolasi dari laut serta
Trichoderma dan Mortierella yang diisolasi dari tanah (Udiharto 1996).
Berdasarkan hasil penelitian-penelitian sebelumnya yang dirangkum oleh Citroreksoko (1996), diketahui bahwa kemampuan biodegradasi terhadap beberapa senyawa berbeda-beda. Berikut adalah beberapa kecenderungan yang terjadi pada degradasi hidrokarbon:
(a) Hidrokarbon alifatik pada umumnya mudah didegradasi dibandingkan dengan senyawa aromatik.
(b) Hidrokarbon alifatik rantai lurus pada umumnya lebih mudah terdegradasi daripada hidrokarbon rantai bercabang. Adanya cabang dalam
molekul hidrokarbon mengganggu kegiatan biodegradasi.
(c) Hidrokarbon jenuh lebih mudah terdegradasi daripada hidrokarbon tidak jenuh. Adanya ikatan ganda atau rangkap tiga antarkarbon akan mengganggu degradasi.
(d) Hidrokarbon rantai panjang lebih mudah didegradasi daripada hidrokarbon rantai pendek. Hidrokarbon dengan panjang rantai kurang dari sembilan karbon sukar didegradasi karena senyawa ini bersifat toksik bagi bakteri pendegradasi hidrokarbon.
Beberapa mikroorganisme tertentu (metanotrop) dapat mendegradasi hidrokarbon rantai pendek. Panjang rantai optimum untuk didegradasi adalah antara 10 sampai dengan 20 karbon.
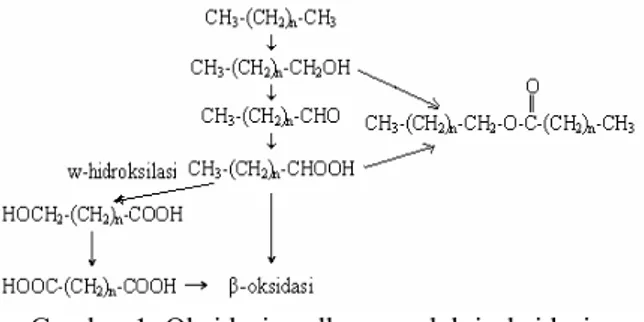
Proses degradasi yang terjadi pada alkana dapat terjadi melalui insersi oksigen pada gugus metil terminal maupun gugus metil subterminal, selanjutnya diikuti dengan pemecahan molekul antara rantai karbon kedua dan ketiga (pemecah β) (Pritchard et al.
1993). Menurut Morgan dan Watkinson (1994) metabolisme awal dari degradasi n-alkana adalah dengan mempergunakan enzim hidroksilase (monooksidase) yang mengubah
n-alkana menjadi 1-alkanol.
Gambar 1 Oksidasi n-alkana melalui oksidasi bertahap gugus metil terakhir.
Gambar 2 Degradasi hidrokarbon alifatik melalui oksidasi subterminal (Cookson 1995).
Dalam oksidasi lebih lanjut terhadap alkohol primer akan terbentuk aldehid, kemudian asam organik dan akhirnya dihasilkan asam lemak dan asetil-CoA yang berasal dari potongan dua karbon rantai karbon alkana. Kegiatan ini membuat rantai karbon alkana akan berkurang dari Cn menjadi
Cn-2. Kegiatan ini akan berlangsung sampai
semua hidrokarbon teroksidasi. Apabila suatu senyawa organik telah terdegradasi sampai ke bentuk asamnya, reaksi degradasi selanjutnya akan berlangsung melalui pemisahan dua unit karbon secara berkesinambungan. Reaksi tersebut merupakan reaksi yang umum pada metabolisme sel hidup dan dikenal dengan beta oksidasi (Cookson 1995).
Molekul alkana dengan rantai bercabang memiliki reaksi pemecahan β yang terhambat oleh adanya cabang tersebut sehingga sukar didegradasi secara biologis. Pristan (2,6,10,14-tetrametil pentadekana) merupakan alkana rantai bercabang yang sangat tahan terhadap biodegradasi. Meskipun sulit didegradasi ternyata ada juga yang dapat mengoksidasi alkana yang bercabang (Pritchard et αl. 1993).
Degradasi alkana siklik diawali dengan konversi senyawa tersebut menjadi sikloalkana melalui reaksi dengan enzim hidroksilase, yang dilanjutkan dengan pemasukan molekul oksigen lain ke dalam cincin sikloalkana sehingga membentuk asam karboksilat dan bisa digunakan dalam metabolisme sel (Pritchard et al. 1993).
Degradasi hidrokarbon aromatik juga diawali dengan insersi molekul oksigen dengan bantuan enzim monooksigenase dan dioksigenase yang menghasilkan senyawa dihidrogen awal. Melalui serangkaian reaksi oksigenase maka cincin kedua dan seterusnya dari senyawa dihidrogen akan terbuka. Proses tersebut menghasilkan asam dikarboksilat dan semi aldehid bagi metabolisme intermediet sel
Pritchard et al. 1993). (
Faktor-Faktor Pendukung Biodegradasi Biodegradasi secara garis besar didefinisikan sebagai pemecahan senyawa organik oleh mikroorganisme membentuk biomassa dan senyawa yang lebih sederhana yang akhirnya menjadi air, karbondioksida atau metana (Walter dan Crawford 1997). Keberhasilan proses degradasi banyak ditentukan oleh aktivitas enzim. Untuk itu perlu mikroorganisme yang berpotensi menghasilkan enzim pendegradasi hidrokarbon, kemudian aktivitasnya dioptimisasikan dengan pengaturan kondisi
dan penambahan suplemen yang sesuai antara lain oksigen, kandungan air, pH, suhu, nutrien yang tersedia, dan ada tidaknya material toksik (Udiharto 1996). Beberapa faktor yang mempengaruhi degradasi hidrokarbon ialah: (a) Oksigen
Keberadaan oksigen merupakan faktor pembatas laju degradasi hidrokarbon dan juga dibutuhkan untuk pertumbuhan bakteri aerob. Kebutuhan akan oksigen digunakan untuk mengkatabolisme senyawa hidrokarbon dengan cara mengoksidasi substrat dengan katalis enzim oksidase. Ketersediaan oksigen ditanah tergantung pada kecepatan konsumsi oleh mikroorganisme tanah, tipe tanah dan kehadiran substrat lain yang juga bereaksi dengan oksigen.
(b) Kelembapan
Kelembapan merupakan salah satu faktor penting dalam bioremediasi. Kelembapan tanah dapat mempengaruhi keberadaan kontaminan, transfer gas dan tingkat toksisitas dari kontaminan. Kelembapan sangat penting untuk hidup, tumbuh, dan aktivitas metabolik mikroorganisme. Tanpa air mikroorganisme tidak dapat hidup dalam limbah minyak. Mikroorganisme akan hidup aktif di daerah antara minyak dengan air. Selama bioremediasi, jika kandungan air terlalu tinggi akan berakibat sulitnya oksigen untuk masuk kedalam tanah (Fletcher 1992).
(c) pH
Tingkat keasaman (pH) merupakan salah satu faktor yang mempengaruhi laju pertumbuhan mikroorganisme. Kemampuan mikroorganisme dalam membangun sel, transportasi melalui membran sel, dan keseimbangan reaksi katalis (Cookson 1996). Kebanyakan bakteri dapat tumbuh dengan baik pada kisaran pH netral (pH 6,5-7,5). Sebagai contoh, P. aeruginosa mampu tumbuh optimum pada kisaran pH 6,6-7,0 dan mampu bertahan pada kisaran pH 5,6-8,0. Sedangkan bakteri tanah Rhizobium mampu bertahan pada kisaran pH 3,4-11 (Flecher 1992). Tingkat keasaman (pH) dapat berubah selama pertumbuhan mikroorganisme. Peningkatan pH dapat terjadi jika adanya proses reduksi nitrat membentuk ammonia atau gas nitrogen juga dengan penambahan urea sebagai nutrien. Sedangkan penurunan pH terjadi apabila terbentuknya asam-asam organik sebagai hasil proses fermentasi (Tanner 1997).
(d) Suhu
Dalam suatu proses degradasi, suhu akan berpengaruh terhadap sifat fisik dan kimia komponen-komponen minyak, kecepatan
degradasi oleh mikroorganisme, dan komposisi komunitas mikroorganisme. Suhu yang optimal untuk degradasi hidrokarbon adalah 30-40°C. Pada temperatur yang rendah, viskositas dari minyak meningkat sehingga penguapan rantai pendek alkana terkurangi dan kelarutan air menurun sehingga menunda terjadinya biodegradasi (Leahy dan Colwell 1990).
(e) Nutrisi
Mikroorganisme membutuhkan nutrisi sebagai sumber karbon, energi dan keseimbangan metabolisme sel. Dalam penanganan limbah minyak bumi biasanya penambahan nutrisi antara lain sumber nitrogen dan fosfor, sehingga proses degradasi oleh mikroorganisme berlangsung lebih cepat dan pertumbuhannya meningkat. Rosenberg & Ron (1998) menyatakan bahwa secara teoritis jumlah nitrogen dan fosfor yang harus ditambahkan untuk mengkonversi 1 gram hidrokarbon menjadi material adalah 150 mg untuk nitrogen dan 30 mg untuk fosfat. Kebutuhan nitrogen dan fosfor untuk menghasilkan pertumbuhan mikroorganisme dapat dipenuhi dari penambahan kedua nutrien tadi dalam bentuk campurannya dengan garam lain seperti ammonium sulfat, ammonium nitrat, dan kalsium sulfat. Penggunaan garam ammonium dari asam kuat akan mengakibatkan penurunan pH larutan, untuk menghindari hal tersebut maka sebagai sumber nitrogen dapat menggunakan urea.
Bioremediasi
Bioremediasi merupakan bagian dari bioteknologi lingkungan yang memanfaatkan proses alami dengan menggunakan aktivitas biodegradasi mikroorganisme yang dapat memulihkan lahan tanah, air dan sedimen dari kontaminasi terutama senyawa organik. Mikroorganisme telah digunakan untuk menghilangkan bahan organik dan bahan kimia beracun lainnya dari limbah domestik dan keluaran industri selama beberapa tahun terakhir. Hal yang baru dari bioremediasi adalah penanganan cepat pada pengolahan limbah suatu industri sejak beberapa dekade ini, dan penerimaannya sebagai suatu metoda yang efektif dan ekonomis sebagai alternatif untuk membersihkan tanah, permukaan air, dan kontaminasi air tanah dengan kandungan sejumlah bahan beracun, seperti rekalsitran dan kimia. Bioremediasi menjadi pilihan teknologi untuk pemulihan (remediasi) dari berbagai lingkungan yang terkontaminasi, khususnya lahan yang terkontaminasi
hidrokarbon dari minyak bumi (Cookson 1995).
Metode ini sangat menguntungkan, alami, murah, lebih fleksibel, dan mudah untuk digandakan skalanya untuk menangani limbah dalam jumlah yang besar (Danielson 1994). Bioremediasi dapat dilaksanakan pada lingkungan terjadinya pencemaran tanpa menimbulkan kerusakan serta dapat mengurangi mengurangi limbah secara permanen dan dapat digabungkan dengan teknik penanganan secara fisik dan kimia. Namun bioremediasi juga memiliki batasan, beberapa senyawa kimia tidak dapat untuk didegradasi seperti logam berat dan beberapa senyawa klor. Dalam beberapa kasus, metabolisme bakteri dapat memproduksi senyawa metabolit yang beracun.
Cookson (1995) menyatakan bahwa reaksi-reaksi biologis dasar yang penting dalam proses bioremediasi adalah metabolisme sel. Dalam rangka biodegradsi senyawa polutan, metabolisme diartikan sebagai kecenderungan reaksi redoks oleh mikroorganisme. Semua reaksi yang menghasilkan energi pada prinsipnya adalah serangkaian reaksi reduksi dan oksidasi. Reaksi reduksi, yaitu reaksi yang membutuhkan akseptor elektron, merupakan reaksi-reaksi penyusun metabolisme. Bila pada kondisi lingkungan tertentu terdapat beberapa akseptor elektron potensial yang bisa dimanfaatkan, maka yang digunakan sebagai akseptor elektron adalah senyawa yang akan menghasilkan energi potensial yang paling besar.
Berdasarkan ketersediaan oksigen, metabolisme mikroorganisme dibedakan menjadi 2 macam, yaitu aerob dan anaerob. Mikroorganisme aerob dan reaksi aerob terjadi bila pada suatu lingkungan tersedia cukup oksigen molekuler yang bertindak sebagai akseptor elektron. Reaksi tersebut dikenal sebagai respirasi. Tipe yang kedua, yaitu reaksi anaerob, menggunakan oksida organik atau pun anorganik sebagai akseptor elektron. Hampir sama dengan respirasi aerob, selama respirasi anaerob berlangsung, substrat dioksidasi menjadi CO2 melalui pemindahan
H+ secara berantai. Hasil akhir yang diperoleh
merupakan campuran dari produk yang lebih teroksidasi atau pun lebih tereduksi dibandingkan substrat awalnya. Tergantung pada jenis mikroorganismenya, produk akhir tersebut berupa asam, alkohol, keton, dan gas-gas.
Kromatografi gas spektrometri massa (GCMS) merupakan instrumen analisis hasil kombinasi antara kromatografi gas dan spektrometri massa, kromatografi gas memiliki kemampuan yang sangat baik dalam hal pemisahan dan analisis kuantitatif komponen sedangkan spektrometri massa memiliki kemampuan yang tinggi dalam hal identifikasi atau analisis kualitatif. Lebih dari 20 tahun GCMS telah diperkenalkan untuk analisis sehingga alat ini semakin populer digunakan dalam analisis di bidang kimia, ilmu kedokteran, farmasi, dan lingkungan. Di bidang lingkungan, GC dapat digunakan untuk analisis pestisida (Harvey 2000).
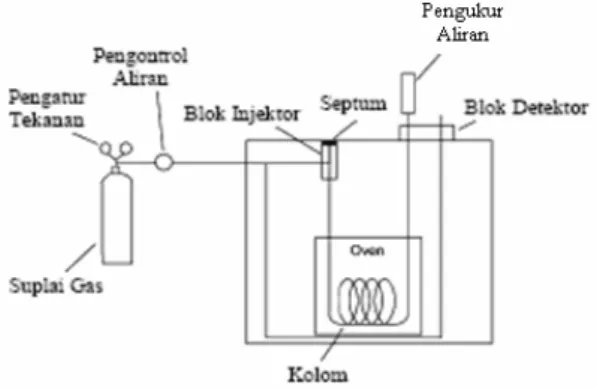
Saat ini bentuk dasar dari GCMS sudah banyak mengalami perubahan dan perkembangan kearah bentuk yang lebih disederhanakan. Bahkan bukan itu saja, pengoprasian dari GCMS semakin dipermudah, sehingga data mentah yang dihasilkan dapat diproses dengan cepat dan mudah dilihat hasilnya. Secara umum GCMS memiliki tiga konfigurasi utama, yaitu GC, Konektor, dan MS. Gambar 3 menunjukkan skema alat kromatografi GCMS.
Gambar 3 Skema konfigurasi alat GCMS Prinsip kerja GCMS
Kromatografi didasarkan pada perbedaan kepolaran dan massa molekul sampel yang dapat diuapkan. Sampel yang berupa cairan atau gas dapat langsung diinjeksikan ke dalam injektor, jika sampel dalam bentuk padatan maka harus dilarutkan pada pelarut yang dapat diuapkan. Aliran gas yang mengalir akan membawa sampel yang teruapkan untuk masuk ke dalam kolom. Komponen-komponen yang ada pada sampel akan dipisahkan berdasarkan partisi diantara fase gerak (gas pembawa) dan fase diam (kolom). Hasilnya adalah berupa molekul gas yang kemudian akan diionisasikan pada spektrometer massa sehingga melokul gas itu akan mengalami fragmentasi yang berupa ion-ion positif. Ion akan memiliki rasio yang spesifik antara massa dan muatannya (m/z).
Gambar 4 Bagan alat Kromatografi Gas Sejak tahun 1960, GCMS digunakan secara luas dalam kimia organik. Sejak saat itu terjadi kenaikan penggunaan yang sangat besar dari metode ini. Ada dua alasan utama terjadinya hal tersebut. Pertama adalah telah ditemukannya alat yang dapat menguapkan hampir semua senyawa organik dan mengionkan uap. Kedua, fragmen yang dihasilkan dari ion molekul dapat dihubungkan dengan struktur molekulnya. Instrumen alat ini adalah gabungan dari alat GC dan MS, hal ini berarti sampel yang akan diperiksa diidentifikasi dahulu dengan alat GC (kromatografi gas) kemudian diidentifikasi dengan alat MS (spektrometri massa). GC dan MS merupakan kombinasi kekuatan yang simultan untuk memisahkan dan mengidentifikasi komponen-komponen campuran. Gambar 4 menunjukkan bagan alat kromatografi gas.
Adapun kegunaan alat GCMS adalah:
(a) Untuk menentukan berat molekul dengan sangat teliti sampai 4 angka di belakang desimal. Untuk menentukan sampai 4 angka di belakang desimal contohnya adalah sebagai berikut: misalnya ada senyawa-senyawa: CO massa molekulnya 28; N2 massa
molekulnya 28; H2C=CH2 massa
molekul 28. Kalau dihitung massa masing-masing dengan teliti, maka masing-masing massa molekulnya akan berbeda.
(b) Spektroskopi massa dapat digunakan untuk mengetahui rumus molekul tanpa melalui analisa unsur. Misalnya C4H10O, biasanya memakai cara
kualitatif atau kuantitatif, mula-mula diketahui rumus empiris dulu
(CxHyOz)n, kemudian baru ditentukan
bobot molekulnya. Sekarang karena adanya komputer pada alat GCMS dapat langsung diketahui rumus molekulnya.
(c) Bila senyawa dimasukkan dalam
spektroskopi massa, maka senyawa itu akan ditembaki oleh elektron dan molekul akan mengalami reaksi fragmentasi. Molekul akan pecah karena tembakan elektron dalam spektrometer. Pecahnya molekul itu tergantung pada gugus fungsi yang ada dalam molekul itu, jadi melalui suatu corak tertentu, tidak secara random. Sebelum ini hanya spektrometri IR, resonansi magnit inti yang bisa mengetahui gugus fungsi. Dengan adanya fragmentasi kita juga bisa mengenali senyawa tersebut, sehingga bisa mendapatkan cara tambahan untuk mengetahui apakah senyawa tersebut termasuk golongan alkohol, amin, karboksilat, aldehid dan lain sebagainya.
GCMS hanya dapat digunakan untuk mendeteksi senyawa-senyawa yang mudah menguap. Glukosa, sukrosa, sakarosa bersifat tidak menguap, sehingga tidak dapat dideteksi dengan alat GCMS. Kriteria menguap adalah pada:
(a) Kondisi vakum tinggi, tekanan rendah.
(b) Dapat dipanaskan.
(c) Uap yang diperlukan tidak banyak. Pada umumnya senyawa-senyawa dengan BM kurang dari 1000 dapat diuapkan, bisa ditentukan massa molekulnya dengan cara spektroskopi massa. Analisis GCMS dengan predikat pemisahan yang high resolution serta MS yang sensitif sangat diperlukan dalam bidang aplikasi, antara lain bidang lingkungan, arkeologi, kesehatan, forensik, ilmu antariksa, kimia, biokimia dan lain sebagainya.
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan ialah pH meter,
rotaryevaporator, soxhlet dan GCMS Agilent Tecnology model 19091S-433.
Bahan-bahan yang digunakan ialah tanah yang tidak tercemar minyak di sekitar ladang minyak Minas PT. Chevron Pasifik Indonesia, minyak bumi dari tempat yang sama dengan tanah, n-heksana, natrium sulfat, silika gel 60 (230-400 mesh), kultur bakteri T2M yang merupakan koleksi Laboratorium Bioteknologi Hutan dan Lingkungan PPB-IPB, agar nutrien cm-3B (Oxoid), dan kaldu nutrien (Oxoid).
Prosedur
Penelitian in terdiri atas tiga tahap. Tahap yang pertama ialah peremajaan isolat bakteri. Tahap kedua ialah pengukuran hasil degradasi dengan parameter TPH. Tahap ketiga ialah penentuan perubahan senyawa hidrokarbon hasil degradasi dengan GCMS.
Peremajaan Isolat Bakteri
Peremajaan dilakukan pada media kaldu nutrien (NB) steril. Sebanyak 50 ml media dimasukan ke dalam labu erlenmeyer 100 ml lalu ditutup dengan sumbat kapas dan plastik tahan panas. Media kemudian disterilisasi dalam autoklaf pada suhu 121 ºC, tekanan 1 atm selama 15 menit. Bakteri dari media agar miring selanjutnya dipindahkan ke media kaldu nutrien dengan menggunakan ose secara aseptik dan diinokulasi di atas shaker sampai rapat optisnya (OD) >0.6 (Ni’mah 2005).
Preparasi Tanah
Preparasi dilakukan dengan mengayak tanah kering dan dimasukan dalam kantong plastik masing-masing 1 kg. Sebagian tanah disterilkan dan sebagian lagi tidak disterilkan. Masing–masing tanah dicampur dengan minyak bumi 5% dari bobot tanah. Semua tanah didiamkan selama 3 hari lalu dimasukan kultur bakteri T2M yang sebelumnya telah diinokulasi. Semua sampel tanah ditempatkan di dalam rumah kaca. Setiap 2 minggu tanah yang berisi bakteri diberi nutrisi berupa urea dan SP36 sebagai sumber nitrogen dan fosfor.
Tabel 1 Pembagian kode sampel tanah Kode
sampel Keterangan
A Tanah steril + bakteri T2M
B Tanah steril
C Tanah non steril + bakteri
T2M
D Tanah non steril
Pembagian kode sampel dapat dilihat pada Tabel 1. Analisis yang dilakukan adalah: pH, kadar air, suhu, TPH, dan perubahan senyawa yang dilakukan setiap 2 minggu. Analisis pH
Nilai pH masing–masing tanah diukur menggunakan pH meter yang telah sebelumnya dikalibrasi dengan bufer pH 4 dan 7, dengan perbandingan tanah dan air akuades 1:5.
Analisis Kadar Air
Sebanyak 5 gram contoh tanah ditimbang dalam pinggan porselen yang telah diketahui bobotnya. Contoh tersebut dikeringkan dalam oven pada suhu 105 ºC selama 3 jam. Setelah itu pinggan diangkat dan dimasukan dalam desikator. Setelah dingin, bobot pinggan ditimbang dan dimasukan kembali dalam oven sampai bobotnya konstan (Amaliah 2007).
Analisis Suhu
Suhu tanah diukur dengan termometer pada pagi dan siang hari.
Pengukuran TPH
Nilai TPH diukur menggunakan metode gravimetri. Sebanyak 10 gram sampel dioven pada suhu 40 ºC selama 10 menit kemudian dibungkus dengan kertas saring. Timbel yang telah dibuat tersebut dimasukan dalam soxhlet dan diekstrak dengan pelarut n-heksana selama 4 jam. Ekstrak yang diperoleh dihilangkan airnya dengan Na2SO4 anhidrat
sebanyak 10 gram kemudian dihilangkan lemak/grease dengan 10 gram silika gel. Ekstrak yang diperoleh kemudian dipekatkan dengan rotav hingga kering. Labu yang telah kering dipanaskan dalam oven pada suhu 70 ºC selama 10 menit kemudian didinginkan dalam desikator dan ditimbang (Amaliah 2007).
Preparasi Pengukuran Struktur Dengan GCMS
Preparasi dilakukan dengan metode ekstraksi soxhlet. Sebanyak 10 gram sampel diaduk dengan 10 gram Na2SO4. Campuran
tersebut keudian dibungkus dengan kertas saring dan diekstrak dengan campuran pelarut aseton-n-heksan (1:1) sebanyak 300 ml. Ekstraksi dilakukan sebanyak 4 kali dan dipekatkan dengan roarievaporator. Ekstrak dan labu dicuci kembali dengan pelarut awal kemudian dimasukan dalam tabung kecil. Ekstrak tersebut kemudian diinjek 1 µl dalam alat GCMS (US EPA 1996).
Kondisi alat GCMS yang digunakan ialah sebagai berikut: pada oven suhu awal 35ºC dan suhu maksimum : 325 ºC. Pada fase gerak digunakan mode split dengan suhu awal 250ºC, tekanan 1.30 psi, rasio split 100:1, aliran split 55.5 mL/min, total aliran: 59.1mL/min. Jenis gas yang digunakan ialah helium. Kolom yang digunakan ialah model Agilent nomor 19091S-433 HP-5MS 5% penil metil siloksana dengan Suhu maksimum: 325 º C dengan panjang: 30.0 m, diameter: 250.00 um, ketebalan lapisan 0.25 um. Volume injeksi sebesar 0.20 mikroliter dan ukuran syringe 10.0 mikroliter.
HASIL DAN PEMBAHASAN
pH
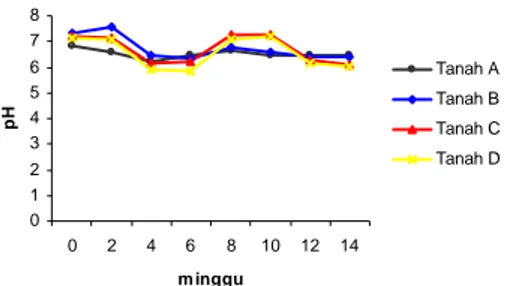
Tingkat keasaman (pH) merupakan salah satu faktor penting dalam proses degradasi hidrokarbon. Keberhasilan degradasi dapat dicapai jika pH media degradasi sesuai dengan kondisi optimum mikroorganisme pendegradasi hidrokarbon. Berdasarkan pengukuran yang dilakukan setiap 2 minggu, pH yang terukur menunjukan kisaran pH antara 5.35-7.91 (Lampiran 2). Penentuan kondisi pH optimum untuk degradasi hidrokarbon oleh bakteri telah diteliti sebelumnya oleh Dibble dan Bartha (1979) yang menunjukan bahwa kondisi optimum yang dibutuhkan berkisar antara 5.0-7.8. Sedangkan untuk kondisi optimum untuk bakteri dengan kode isolat T2M berada pada pH 6.8 (Ni’mah 2005). Gambar 5 menunjukkan nilai pH yang terukur pada setiap tanah selama 4 bulan.
0 1 2 3 4 5 6 7 8 0 2 4 6 8 10 12 14 m inggu pH Tanah A Tanah B Tanah C Tanah D
Gambar 5 Perbandingan nilai pH tanah A, B, C, dan D.
Penurunan pH yang terjadi selama proses degradasi disebabkan karena adanya produk antara yang dihasilkan. Menurut Morgan dan Watkinson (1994) metabolisme awal dari
degradasi n-alkana adalah dengan
mempergunakan enzim hidroksilase (monooksidase) yang mengubah n-alkana menjadi 1-alkanol. Adanya penambahan jumlah senyawa alkohol dan asam karboksilat dapat menurunkan pH tanah. Pada Gambar 5 ditunjukan perubahan pH yang terjadi selama proses degradasi. Penurunan pH akan terus terjadi selama proses degradasi berlangsung karena adanya produk-produk degradasi hidrokarbon yang bersifat asam. Jika pH terlalu asam maka akan menganggu proses degradasi menjadi lebih lambat. Untuk membuat kondisi pH tetap optimum untuk degradasi hidrokarbon maka ditambahkan urea sebagai nutrisi untuk bakteri sekaligus membuat kondisi pH naik kembali. Seperti yang terjadi pada minggu ke-6 semua sampel tanah mengalami kenaikan pH yang dapat dikarenakan oleh penambahan urea. Penambahan urea pada mingu sebelumnya tidak dapat menaikan pH karena hasil degradasi berupa asam-asam organik lebih besar pengaruhnya terhadap pH. Dengan mengkondisikan pH tetap optimum untuk kehidupan bakteri diharapkan degradasi hidrokarbon berlangsung optimal.
Kadar Air
Kelembaban tanah sangat berpengaruh terhadap proses degradasi karena keberadaan air sangat diperlukan oleh aktivitas mikroorganisme. Bakteri yang digunakan ialah bakteri aerob yaitu bakteri yang membutuhkan oksigen. Oksigen yang diperlukan bakteri bisa diperoleh dari udara melalui proses pengadukan juga dari air. Berdasarkan pengukuran yang dilakukan setiap 2 minggu, kadar air yang terukur berkisar antara 3.11-10.98 % (Lampiran 3).
Kadar air yang terukur bervariasi dikarenakan setiap 2 minggu dilakukan penambahan air secara teratur dan adanya penguapan. Menurut Dibble dan Bartha (1979) kadar air yang dibutuhkan bakteri untuk metabolisme dalam mendegradasi hidrokarbon berkisar antara 30%-90%. Nilai kadar air yang terukur berada pada kisaran 3.11-10.98 % dikarenakan pengukuran dilakukan setelah seminggu ditambahkan air. Penambahan air yang dilakukan cukup mendekati nilai optimum yang dibutuhkan bakteri. Kekurangan air selama proses degradasi dapat menyebabkan terhambatnya proses degradasi. Hal ini dapat disebabkan karena banyaknya bakteri yang mati karena tidak mampu beradaptasi dengan kondisi yang kurang air. Bakteri T2M merupakan bakteri yang membutuhkan air selama proses degradasi. Oleh karena itu kondisi kadar air tetap dijaga dengan penambahan air secara teratur.
Suhu
Nilai suhu tanah sangat berpengaruh terhadap proses degradasi. Berdasarkan pengukuran yang dilakukan setiap 2 minggu, nilai suhu yang terukur berkisar antara 33ºC-35ºC. (Lampiran 4). Menurut Leahy dan Colwell (1990) suhu yang tepat dapat meningkatkan metabolisme bakteri dalam mendegradasi hidrokarbon, khususnya suhu yang berkisar antara 30ºC-40ºC. Suhu yang lebih tinggi dapat meningkatkan toksisitas hidrokarbon terhadap bakteri. Demikian pula jika suhu terlalu rendah maka volatilitas hidrokarbon menurun dan dapat menghambat proses degradasi. Oleh karena itu, semua sampel ditempatkan dalam rumah kaca agar suhu yang terjadi tetap dalam keadaan optimum untuk kehidupan bakteri.
TPH
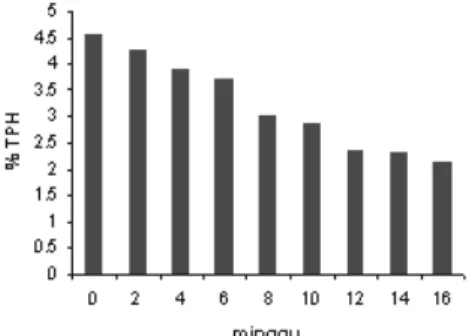
Salah satu parameter keberhasilan degradasi hidrokarbon minyak bumi ialah berkurangnya nilai TPH sampai batas aman yang telah ditentukan. Batas aman menurut lembaga lingkungan ialah dibawah 1%. Hasil pengukuran yang dilakukan setiap 2 minggu menunjukkan nilai TPH awal sebesar 4.03, 5.33, 4.20, dan 4.58 % (b/b) berturut-turut untuk tanah A, B, C, dan D. (Lampiran 5). Minyak bumi yang ditambahkan pada setiap sampel sebesar 5% sedangkan nilai TPH yang terukur tidak persis sama dengan kadar minyak bumi yang ditambahkan. Hal ini dapat disebabkan karena proses pencampuran antara
tanah dan minyak bumi dilakukan dengan manual yaitu dengan pengadukan biasa. Pengambilan sampel tanah yang tidak merata juga dapat menyebabkan nilai TPH yang terukur tidak sama dengan jumlah kadar minyak bumi awal.
Tanah A yang ditambahkan bakteri T2M dan disterilkan terlebih dahulu, memiliki penurunan TPH setiap 2 minggu yang cukup berarti dari minggu pertama sampai minggu ke-16. Pada minggu awal proses degdradasi terlihat penurunan yang lebih besar dibandingkan yang terjadi pada minggu berikutnya. Hal ini dapat dikarenakan pada minyak bumi terdapat hidrokarbon yang memiliki rantai karbon yang panjang. Citroreksoko (1996) menungkapkan bahwa hidrokarbon yang memiliki rantai panjang lebih mudah degradasi dibandingkan hidrokarbon rantai pendek. Perubahan nilai TPH pada 2 minggu pertama cukup besar yaitu sebesar 1.4 %. Minggu terakhir pengukuran menunjukkan nilai yang cukup kecil yaitu sebesar 0.37 %. Walaupun tanah A telah disterilkan terlebih dahulu, tetapi bakeri T2M mampu mendegradasi hidrokarbon minyak bumi sampai batas aman. Waktu yang diperoleh untuk sampai batas ini ialah 12 minggu. Gambar 6 di bawah ini menunjukkan nilai TPH yang terukur pada tanah A selama 4 bulan.
Gambar 6 Nilai TPH tanah A selama 4 bulan Tanah B merupakan tanah steril yang tidak ditambahkan bakteri dan berfungsi sebagai kontrol. Nilai TPH untuk tanah B pada minggu pertama terukur sebesar 5.33% kemudian turun pada minggu-minggu berikutnya. Pada minggu ke-2 nilai TPH yang terukur sebesar 4.12 %. Penurunan ini dapat terjadi karena proses penguapan terhadap hidrokarbon yang mudah menguap yang memiliki rantai karbon yang pendek. Penurunan tersebut juga dapat disebabkan oleh bakteri yang masuk kedalam sampel tanah dan medegradasi senyawa hidrokarbon yang ada. Akan tetapi, pada minggu ke-4 sampai minggu ke-10 terlihat penurunan yang kecil. Hal ini dapat disebabkan karena
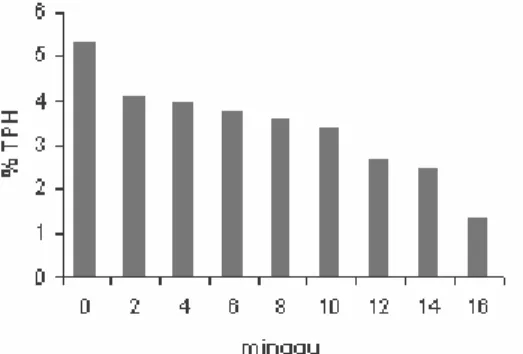
penguapan tidak terjadi pada hidrokarbon rantai panjang dan juga bakteri yang masuk tidak mampu mendegradsi hidrokarbon rantai panjang. Pada minggu terakhir yaitu minggu ke-16 nilai TPH yang terukur sebesar 1.37. Nilai TPH akhir untuk tanah B belum mencapai batas aman karena sebelumnya tidak ditambahkan bakteri pendegradasi hidrokarbon. Gambar 7 memperlihatkan nilai TPH yang terukur selama 4 bulan.
Gambar 7 Nilai TPH tanah B selama 4 bulan Perbandingan nilai TPH untuk semua tanah dapat dinyatakan dalam persen degradasi. Persen degradasi diperoleh dari nilai TPH akhir dikurangi TPH awal dan dibagi nilai TPH awal. Nilai ini menunjukkan seberapa besar hidrokarbon terurai oleh bakteri. Persen degradasi yang terjadi pada tanah A sebesar 90.17 % sedangkan untuk tanah B sebagi kontrol sebesar 74.54 %. Persen degradasi untuk tanah C sebesar 93.30 % sedangkan untuk tanah D sebagai kontrol sebesar 52.37 %. Berdasarkan data tersebut proses deradasi lebih optimal pada tanah yang tidak steril. Gambar 8 menunjukkan nilai persen degradasi untuk semua tanah.
0 20 40 60 80 100
Tanah A Tanah B Tanah C Tanah D
pe rs e n de g ra d a s i ( % b/ b )
Gambar 8 Nilai perbandingan persen degradasi untuk semua tanah Tanah C merupakan tanah yang tidak disterilkan dan ditambahkan bakteri. Nilai TPH untuk tanah C dapat dilihat penurunannya pada Gambar 9. Nilai TPH awal untuk tanah ini sebesar 4.20 % sedikit lebih besar dibandingkan yang terukur pada tanah A. Seperti yang lainnya pada minggu
ke-2 terjadi penurunan TPH yang cukup besar yaitu sebesar 1.21 %. Hal ini dapat dipengaruhi oleh menguapnya hidrokarbon volatil juga masih banyaknya hidrokarbon rantai panjang. Hasil degrdasi mikroorganisme pada tanah C menunjukan nilai degradasi yang lebih baik dibandingkan tanah A. Pada minggu ke-6 nilai TPH untuk tanah ini sebesar 1.38 % dan mulai mendekati batas aman. Kemudian pada minggu ke-10 nilai TPH tanah tersebut sebesar 0.64 % yang merupakan nilai yang telah memenuhi syarat aman bagi lingkungan. Sedangkan nilai pengukuran TPH terakhir pada minggu ke-16 sebesar 0.28 %. Perubahan nilai TPH pada tanah yang tidak disterilkan dahulu ini paling besar diantara tanah yang lainya. Perubahan ini disebabkan dalam tanah tersebut masih mengandung bakteri secara alami sehingga dapat meningkatkan proses degradasi hidrokarbon.
Gambar 9 Nilai TPH tanah C selama 4 bulan Nilai TPH untuk tanah D dapat dilihat pada Gambar 10. Untuk tanah yang tidak diberi bakteri ini memiliki nilai TPH awal sebesar 4.58 % dan pada minggu ke-16 nilainya turun menjadi 2.11%. Walaupun tanah D tidak disterilkan dahulu akan tetapi nilai TPH akhir lebih besar dibandingkan tanah B yang disterilkan terlebih dahulu. Hal ini dapat dikarenakan bakteri alam yang telah ada pada tanah tersebut bukan merupakan bakteri yang mampu mendegradasi hidrokarbon secara optimal.
Gambar 10 Nilai TPH tanah D selama 4 bulan
Perubahan Senyawa Hidrokarbon
Penentuan perubahan senyawa hidrokarbon selama proses degradasi oleh bakteri, ditentukan dengan membandingkan % area masing-masing senyawa hidrokarbon setiap 2 minggu. Berdasarkan data yang diperoleh dari kromatogram GCMS diketahui bahwa senyawa hidrokarbon yang terdapat pada minyak bumi terdiri dari 3 jenis, yaitu alifatik, alsiklik, dan aromatik. Penentuan senyawa hidrokarbon ini berdasarkan data yang terdapat pada CAS Number yang digunakan sebagai library pengidentifikasi sampel. Data library yang digunakan pada penentuan senyawa ini ialah Wiley7 Nist 05.L, dari hasil identifikasi tersebut dipilih sampel yang memiliki kemiripan ≥ 90.
Berdasarkan data yang diperoleh, senyawa hidrokarbon yang memiliki kemiripan ≥ 90 diketahui lebih banyak hidrokarbon alifatik dibandingkan hidrokarbon siklik dan aromatik. Oleh karena itu perubahan senyawa hidrokarbon ini difokuskan pada hidrokarbon alifatik.
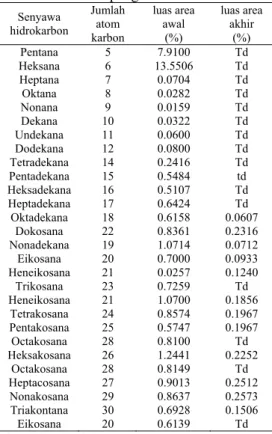
Senyawa hidrokarbon alifatik yang terdeteksi pada awal pengukuran tanah A sebanyak 28 senyawa. Senyawa tersebut memiliki panjang rantai dari C-5 sampai C-30. Pada minggu terakhir hanya terdapat 12 senyawa saja. Sisa senyawa yang tidak terdeteksi diakhir pengukuran merupakan senyawa yang telah didegradasi oleh bakteri.
Data yang diperoleh dari CMS menunjukan senyawa hidrokarbon rantai panjang banyak yang hilang, jika pun ada % area senyawa tersebut telah berkurang jika dibandingkan awal pengukuran. Contohnya pentakosana (C-25) memiliki luas area pada minggu pertama sebesar 0.57. Pada minggu ke-16 senyawa tersebut memiliki % area sebesar 0.19. Perubahan % area senyawa hidrokarbon setiap 2 minggu pada tanah A dapat dilihat pada Lampiran 6. Berdasarkan data tersebut, terlihat perubahan persen area masing-masing senyawa setiap 2 minggu. Beberapa senyawa yang terdeteksi di awal pengukuran pada miggu berikutnya tidak terdeteksi. Hal ini dapat dikarenakan terdegradasinya senyawa tersebut menjadi senyawa yang memiliki rantai karbon lebih pendek. Pada saat bersamaan ada pula senyawa yang menunjukan kenaikan persen area. Hal ini dikarenakan banyaknya senyawa hidrokarbon yang terdapat dalam minyak bumi. Akan tetapi, sebagian besar senyawa berkurang kadarnya pada akhir pengukuran yang dikuatkan pula dengan data total
petroleum hidrokarbon (TPH). Tabel 2 menunjukkan nilai luas area senyawa hidrokarbon yang terdeteksi pada tanah A. Tabel 2 Nilai luas area senyawa hidrokarbon
yang terdeteksi pada tanah A di awal dan akhir pengukuran
Senyawa hidrokarbon Jumlah atom karbon luas area awal (%) luas area akhir (%) Pentana 5 7.9100 Td Heksana 6 13.5506 Td Heptana 7 0.0704 Td Oktana 8 0.0282 Td Nonana 9 0.0159 Td Dekana 10 0.0322 Td Undekana 11 0.0600 Td Dodekana 12 0.0800 Td Tetradekana 14 0.2416 Td Pentadekana 15 0.5484 td Heksadekana 16 0.5107 Td Heptadekana 17 0.6424 Td Oktadekana 18 0.6158 0.0607 Dokosana 22 0.8361 0.2316 Nonadekana 19 1.0714 0.0712 Eikosana 20 0.7000 0.0933 Heneikosana 21 0.0257 0.1240 Trikosana 23 0.7259 Td Heneikosana 21 1.0700 0.1856 Tetrakosana 24 0.8574 0.1967 Pentakosana 25 0.5747 0.1967 Octakosana 28 0.8100 Td Heksakosana 26 1.2441 0.2252 Octakosana 28 0.8149 Td Heptacosana 27 0.9013 0.2512 Nonakosana 29 0.8637 0.2573 Triakontana 30 0.6928 0.1506 Eikosana 20 0.6139 Td Td = tidak terdeteksi
Menurut Atlas dan Bartha (1998) dalam proses biodegradasi rantai alkana dioksidasi membentuk alkohol, aldehida dan asam lemak. Setelah terbentuk asam lemak proses katabolisme terjasi secara sekuen ß oksidasi. Rantai panjang dari asam lemak dikonversi oleh acyl coenzyme A yang merupakan enzim membentuk asetil coenzyme A dan rantai pendek asam lemak yang telah berkurang dua unit gugus karbonnya yang berlangsung secara berulang-ulang. Asetil
coenzyme A diubah membentuk CO2 melalui
siklus tricarboxylic acid. Senyawa
hidrokarbon yang terdeteksi pada tanah B di awal dan akhir pengukuran dapat dilihat pada Tabel 3. Berdasarkan data tersebut terdapat 16 senyawa hidrokarbon yang terdiri dari C-11 sampai C-27. Tanah B ini merupakan kontrol terhadap tanah A karena tidak ditambahkan bakteri.
Tabel 3 Nilai luas area senyawa hidrokarbon yang terdeteksi pada tanah B di awal dan akhir pengukuran
Senyawa hidrokarbon Jumlah atom karbon luas area awal (%) luas area akhir (%) Dodekana 12 0.1560 Td Tridekana 13 0.3866 Td Tetradekana 14 0.6457 Td Pentadekana 15 0.8137 Td Pentadekana 15 0.9360 Td Heksadekana 16 0.9914 0.2588 Heptadekana 17 0.9685 0.5027 Oktadekana 18 1.0582 0.6398 Eikosana 20 1.0771 Td Heneicosana 21 1.1294 1.0336 Tricosana 23 1.1202 0.9502 Heneikosana 21 1.3933 1.0336 Tetrakosana 24 1.2803 1.0221 Dotriacontana 32 1.3707 Td Heptacosana 27 1.3942 1.0414 Eikosana 20 0.6132 Td Td = tidak terdeteksi
Pada Tabel 3 terdapat beberapa senyawa hidrokarbon rantai panjang yang masih ada di akhir pengukuran. Terdapat 12 senyawa hidrokarbon yang terdapat pada tanah tersebut. Hal ini menunjukan tidak terjadinya degradasi. Persen area masing-masing senyawa setiap 2 minggu dapat dilihat pada Lampiran 7. Walaupun tanah B tidak ditambahkan bakteri, perubahan luas area terjadi pada tanah ini. Akan tetapi perubahan luas area ini tidak terlalu signifikan. Sebagai contoh hidrokarbon rantai panjang pada minggu ke-16 masih memiliki persen area yang cukup besar. Sebagai contoh tetrakosana dan oktakosana pada minggu ke-16 memiliki luas area 1.022 dan 0.74 %.
Perubahan senyawa hidrokarbon yang paling besar terjadi pada tanah C. Tanah yang tidak disterikan sebelumnya ini hampir tidak memiliki hidrokarbon rantai panjang pada pengukuran minggu kedelapan. Perubahan senyawa ini diperjelas dengan rendahnya nilai TPH tanah tersebut sebesar 0.28% (Gambar 8). Hal ini menunjukan degradasi yang berhasil terhadap minyak bumi. Perubahan persen area senyawa pada tanah C dapat dilihat pada Lampiran 8. Berdasarkan data tersebut, hampir semua senyawa mumiliki persen area yang berkurang pada minggu berikutnya. Hal ini dapat disebabkan oleh degradasi yang dilakukan oleh bakteri. Terdapat sekitar 27 senyawa hidrokarbon alifatik pada awal pengukuran tetapi tidak ada satupun hidrokarbon tersebut pada akhir pengukuran. Tabel 4 menunjukkan nilai luas area senyawa hidrokarbon yang terdeteksi pada tanah C.
Tabel 4 Nilai luas area senyawa hidrokarbon yang terdeteksi pada tanah C di awal dan akhir pengukuran
Senyawa hidrokarbon Jumlah atom karbon Luas area awal (%) Luas area akhir (%) Undekana 11 0.0268 Td Dodekana 12 0.1238 Td Tetradekana 14 0.3120 Td Pentadekana 15 0.5578 Td Heksadekana 16 0.7352 Td Heptadekana 17 0.8626 Td Oktadekana 18 0.9489 Td Undekana 11 0.0386 Td Dokosana 22 1.1736 Td Nonadekana 19 1.0192 Td Eikosana 20 1.0495 Td Heneikosana 21 1.4020 Td Trikosana 23 1.1736 Td Eikosana 20 1.1141 Td Tetrakosana 24 1.2924 Td Dotriakontana 32 1.4015 Td Pentakosana 25 0.7122 Td Hexakosana 26 1.4015 Td Octakosana 28 1.2661 Td Heptakosana 27 1.4218 Td Nonakosana 29 1.2468 Td Triakontana 30 0.8921 Td Eikosana 20 0.7201 0.092 Td = tidak terdeteksi
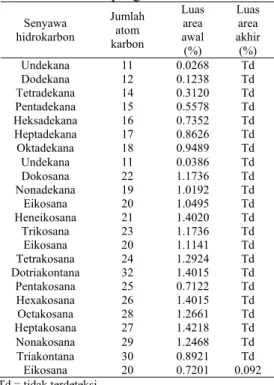
Tabel 5 Nilai luas area senyawa hidrokarbon yang terdeteksi pada tanah D di awal dan akhir pengukuran
Senyawa hidrokarbon Jumlah atom karbon Luas area awal (%) Luas area akhir (%) Undekana 11 0.0317 Td Dodekana 12 0.1082 Td Tridekana 13 0.2532 Td Tetradekana 14 0.4659 0.0253 Pentadekana 15 0.5731 0.1061 Hexadekana 16 0.6726 0.2598 Heptadekana 17 0.7524 0.4087 Oktadekana 18 0.7525 0.4725 Eikosana 20 0.8877 0.5679 Trikosana 23 0.9906 0.6108 Nonadekana 19 0.8516 0.6242 Heneikosana 21 0.0298 0.6242 Heneikosana 21 0.9389 0.6242 Dokosana 22 1.2350 0.6008 Tetrakosana 24 1.1494 0.5762 Hexakosana 26 1.2493 0.5460 Heptakosana 27 1.2600 0.4932 Octakosana 28 1.1271 0.4033 Pentakosana 25 0.1026 Td Nonakosana 29 1.1595 Td Triakontana 30 0.8097 0.2225 Eikosana 20 0.6816 Td Td = tidak terdeteksi
Tanah D merupakan kontrol untuk tanah C. Pada awal pengukuran memiliki 23 senyawa hidrokarbon alifatik sedangkan pada akhir pengukuran memiliki 15 senyawa hidrokarbon. Perubahan persen area masing-masing senyawa tersebut setiap 2 minggu
dapat dilihat pada lampiran 9. Tabel 5 menunjukkan nilai luas area senyawa hidrokarbon yang terdeteksi pada tanah D.
Senyawa hidrokarbon yang hilang pada akhir perlakuan dapat dilihat pada Tabel 6. Hilangnya senyawa-senyawa tersebut dapat disebabkan oleh degradasi yang dilakukan oleh bakteri. Pada tanah A ada 16 senyawa yang hilang. Senyawa yang paling banyak merupakan hidrokarbon alifatik. Senyawa yang hilang pada tanah B tidak terlalu banyak. Senyawa tersebut diantaranya tridekana, pentadekana dan eikosana. Pada tanah C yang merupakan tanah paling maksimal dalam degradasi hidrokarbon, ditemukan banyak senyawa hidrokarbon yang hilang. Dimulai dengan hidrokarbon C-11 sampai C-30 hilang diakhir perlakuan. Hal ini dapat dikarenakan tanah C tidak disterilkan dahulu. Oleh karena itu bakteri yang ada sebelumnya pada tanah ikut mendegradasi hidrokarbon. Senyawa yang hilang pada tanah D tidak terlalu banyak diantaranya pentakosana dan nonakosana. Senyawa yang hilang pada akhir perlakuan dapat dikatakan sebagai hidrokarbon yang paling mudah didegradasi oleh bakteri. Senyawa hidrokarbon yang masih ada pada akhir perlakuan dapat dikatakan sebagai hidrokarbon yang paling sulit didegradasi oleh bakteri.
Tabel 6 Daftar senyawa yang tidak terdeteksi pada setiap tanah di akhir pengukuran
Tanah A Tanah B Tanah C Tanah D
Heptana Dodekana Undekana Undekana
Oktana Tridekana Dodekana Dodekana
Nonana Tetradekana Tridekana Tridekana
Dekana Pentadekana Tetradekana Heneikosana
Undekana Eikosana Pentadekana Pentakosana
Dodekana Heneikosana Hexadekana Nonakosana
Tridekana Dotriakontana Heptadekana Eikosana
Tetradekana Oktadekana Pentadekana Dokosana Eikosana Nonadekana Heneikosana Eikosana Dotriakontana Heneikosana Octakosana Trikosana Heksakosana Heneikosana Triakontana Tetrakosana Etilbenzena Dotriakontana Pentakosana Hexakosana Octakosana Heptakosana Nonakosana Triakontana
SIMPULAN DAN SARAN
Simpulan
Penurunan TPH terjadi pada setiap tanah dan paling besar terjadi pada tanah nonsteril yang ditambahkan bakteri dengan nilai TPH akhir sebesar 0.28 %. Persen degradasi untuk tanah steril sebesar 90.17 % sedangkan untuk tanah nonsteril sebesar 93.30 %. Perubahan senyawa hidrokarbon yang terjadi karena degradasi oleh bakteri terjadi pada hidrokarbon rantai panjang menjadi hidrokarbon yang lebih pendek.
Saran
Diperlukan satu jenis hidrokarbon rantai panjang pada proses degradasi agar terlihat dengan jelas perubahan senyawanya.
DAFTAR PUSTAKA
Amaliah. 2007. Bioremediasi Lahan Tambang Minyak Bumi Dengan Menggunakan Surfaktan [skripsi] Bogor. Fakultas Matematika dan Ilmu Pengetahuan alam, Universitas Pakuan.
Atlas R.M dan Bartha R. 1993. Microbial Ecology: Fundamental and Applications . California: The Benjamin/Cummings Redwood City.
Atlas, R. M. 1992. Stimulated petroleum biodegradation. Crit. Rev. Microbiol.
5:371-386.
Atlas, R. M., and R. Bartha. 1972. Biodegradation of petroleum in seawater at low temperatures. Can. J. Microbial.
18:1851-1855
Citroreksoko. 1990. Microbial Degradation Of Hydrocarbons In The Environment.
Microbiological Reviews, Okt.1998, Vol. 6 Hal. 202-216.
Cookson, J.T. 1995. Bioremediation Engineering : Design and Application. McGraw-Hill Inc., Toronto.
Danielson, M. 1994. Production of lactones and peroxisomal beta-Oxidation in yeasts.
Critical. Reviews in Biotechnology, 16(4): 301-329.
Dibble, J.T., and R. Bartha. 1979. Effect of Environmental Parameters on The Biodegradation of Oil Sludge. Applied Environ. Microbiol. 37:729-739.
Fahruddin. 2004. Dampak tumpahan minyak pada biota laut. www.kompas.co/kompas-cetak/0403/17/ilpeng/918248.html [20 mei 2008].
Fletcher 1992. Biodegradation of polyphenols with immobilized Candida tropicalis under metabolic induction. FEMS Microbiology Letters, 223: 215-219.
Hadi S.N. 2006. Degradasi Minyak Bumi via “Tangan” Mikroorganisme. Bogor: Program Sarjana Departemen Biokimia
IPB.
http://www.che-mis-try.org/?sect=artikel&ext=64. [14 april 2008].
Harvey D. 2000. Modern Analytical
Chemistry. USA: McGraww-Hill.
Leahy Joseph G. And Colwell Rita R. 1990. Microbial Degradation Of Hydrocarbons In The Environment. Microbiological Reviews, Sept. 1990, Vol. 3 Hal. 305-315. Morgan, P. dan R.J. Watkinson. 1994.
Biodegradation of Component Petroleum. C. Railedge (ed). Biochemistry of Microbial Degradation. Belanda: Kluwer Academic Publishers.
Ni’mah U. 2005. Kinerja Tiga Isolat Mikrob Pendegradasi Minyak Bumi dan Pengaruh Penambahan Dua Sumber Nitrogen pada Isolat terbaik. [skripsi]. Bogor. Fakultas Matematika dan Ilmu Pengetahuan alam, IPB.
Pritchard et al. 1993. Bioremediation. An overview [ulas balik]. Pure Appl Chem.
73:1163-1172.
http://www.iupac.org/publications/pac/200 1/pdf/7307x1163.pdf [20mei 2008]. Prijambada dan Widada 2006. Mitigasi Dan
Bioremediasi Lahan Tambang Minyak di Dalam: Seminar Nasional PKRLT Fakultas Pertanian UGM, Sabtu 11 Feb 2006.
Prince RC, Lessard RR, Clark JR. 2003. Bioremediation of marine oil spills. Oil &Gas Sci Technol 58: 463-468.
Rosenberg, E. dan E.Z. Ron. 1998. Bioremediation of Petroleum Contamination. Dalam R. L. Crawford dan D. L. Crawford (ed.) Bioremediation Principles and Applications. Cambridge Press, Cambridge.
Sumastri. 2004. Bioremediasi Minyak Bumi Secara Pengomposan Menggunakan Kultur Bakteri Hasil Seleksi. http://www.che-mis-try.org/?sect=artikel&ext=64. [14 april 2008].
Tanner. 1997. Degradation of long-chain alkanes by polyethylene-degrading fungus,
Penicillium simplicissimum YK. Enzyme and Microbial Technology, 30: 828-831. Udiharto M. 1992. Pemanfaatan Bioteknologi
Untuk Penanggulangan Polutan Minyak Bumi Dan Fenol Dalam Air Terproduksi
Dari Industri Perminyakan. Di dalam: Diskusi Ilmiah IX. Prosiding Diskusi Ilmiah IX Hasil Penelitian LEMIGAS. Jakarta, 11-13 Februari 1992. Jakarta: PPPTMBG Lemigas. hlm 314-329.
Udiharto M. 1996. Aktivitas mikrob dalam degradasi minyak bumi. Di dalam: Peranan Bioremediasi dalam Pengelolaan Lingkungan. Prosiding Pelatihan dan Lokakarya; Cibinong, 24-28 Juni 1996. Jakarta: PPPTMBG Lemigas. hlm 24-39. [USEPA] United State Environmental
Protection Agency. 1996. A Citizen’s Guide to Bioremediation. United State Environmental Protection Agency. http:www.epa.gov.
Walter dan Crawford 1997. Catabolism ofhydroxyacids and biotechnological production of lactones by Yarrowia lipolytica. Applied Microbiology and Biotechnology, 61: 393-404.
Lampiran 1Bagan alir penelitian
Tanah
Steril Non steril
Penambahan minyak Bumi
Penambahan Bakteri
Penentuan pH, Suhu, kadar air, setiap 2 minggu Pemberian nutrien setiap 2 minggu Preparasi GCMS setiap 2 minggu Penentuan perubahan senyawa Pengayakan A B C D A B C D A C B D
Lampiran 2 Nilai pH selama 4 bulan
Nilai pH selama 4 bulan
Tanah pH Tanah pH
Minggu Ke-0 Minggu Ke-10
A 6.56 A 6.83
B 6.08 B 6.23
C 6.92 C 6.62
D 6.5 D 6.47
Minggu Ke-2 Minggu Ke-12
A 6.44 A 7.33
B 6.07 B 6.47
C 5.95 C 6.8
D 6.25 D 6.38
Minggu Ke-4 Minggu Ke-14
A 7.54 A 7.22
B 6.09 B 6.17
C 7.6 C 7.26
D 6.38 D 6.3
Minggu Ke-6 Minggu Ke-16
A 7.37 A 7.11 B 6.17 B 5.9 C 7.47 C 7.1 D 6.26 D 6.14 Minggu Ke-8 A 6.46 B 5.35 C 6.54 D 5.75
Lampiran 3 Nilai kadar air selama 4 bulan
Nilai kadar air selama 4 bulan
Tanah Bobot labu kosong (g) Bobot kering (g) tanah (g) Bobot Kadar air (%)
Minggu Ke-0 A 16.4867 21.138 5.0025 7.02049 B 14.5231 19.1634 5.0025 7.24038 C 16.4832 21.0611 5.0005 8.451155 D 15.8751 20.5448 5.0036 6.673195 Minggu Ke-2 A 16.2625 20.8141 5.0272 9.460535 B 27.628 32.2365 5.0161 8.125835 C 16.0681 20.7621 5.193 9.6090 D 14.0531 19.0641 5.609 10.66144 Minggu Ke-4 A 15.8747 20.4649 5.038 8.888448 B 14.5243 19.1905 5.0217 7.079276 C 14.528 19.0501 5.012 9.774541 D 18.9299 23.436 5.017 10.18338 Minggu Ke-6 A 16.2625 20.8141 5.0272 9.460535 B 27.1228 31.6065 5.0161 10.61382 C 16.1281 20.7621 5.193 10.76449 D 14.0331 19.0641 5.609 10.30487 Minggu Ke-8 A 19.0162 23.5349 5.0587 10.67468 B 26.2283 30.9455 5.0321 6.257825 C 16.4869 21.0945 5.0061 7.960288 D 16.0476 20.6328 5.0373 8.975046 Minggu Ke-10 A 15.8715 20.353 5.0353 10.99835 B 16.2586 21.0662 5.0647 5.076313 C 18.9254 23.727 5.072 5.33123 D 26.2266 31.0609 5.0935 5.088839 Minggu Ke-12 A 27.0612 36.804 10.085 3.393158 B 16.1704 25.7958 10.0972 4.672582 C 19.2258 28.6377 10.0967 6.782414 D 25.226 34.8258 10.0333 4.320612 Minggu Ke-14 A 27.061 31.7979 5.1546 8.103442 B 17.1607 21.781 5.0896 9.220764 C 24.9922 29.6235 5.0434 8.171075 D 16.485 21.1103 5.093 9.183193 Minggu Ke-16 A 15.6218 20.1984 5.0447 9.279045 B 16.0173 20.5609 5.058 10.17003 C 25.8983 30.4958 5.0165 8.352437 D 24.7194 29.2107 5.037 10.83383
Lampiran 4 Nilai suhu tanah selama 4 bulan
Nilai suhu tanah selama 4 bulan
Tanah Suhu ºC Tanah Suhu ºC
Minggu Ke-0 Minggu Ke-10
A 33 A 35 B 33 B 35 C 35 C 34 D 33 D 35
Minggu Ke-2 Minggu Ke-12
A 34 A 34 B 33 B 34 C 33 C 33 D 34 D 34
Minggu Ke-4 Minggu Ke-14
A 34 A 33
B 34 B 34
C 33 C 35 D 35 D 35
Minggu Ke-6 Minggu Ke-16
A 31 A 33 B 30 B 35 C 30 C 33 D 30 D 33 Minggu Ke-8 A 33 B 33 C 33 D 34
Lampiran 5 Nilai TPH tanah selama 4 bulan
Nilai TPH tanah selama 4 bulan
Tanah Bobot tanah (g) Bobot Labu Kosong (g) bobot labu kering (g) TPH (%) Minggu Ke-0 A 10.0073 109.0936 109.497 4.031057 B 10.0486 105.0322 105.5681 5.333081 C 10.082 109.0936 109.517 4.199564 D 10.0009 111.0096 111.4674 4.577588 Minggu Ke-2 A 108.467 108.728 10.0302 2.602142 B 108.2169 108.6308 10.0325 4.125592 C 110.0087 110.3078 10.0102 2.987952 D 108.6564 109.0835 10.001 4.270573 Minggu Ke-4 A 111.2446 111.418 10.0913 1.718312 B 110.1336 110.5302 10.0034 3.964652 C 110.1336 110.4121 10.1452 2.745141 D 109.6761 110.0703 10.0942 3.905213 Minggu Ke-6 A 111.2379 111.3658 10.01055 1.277652 B 107.2065 107.5793 10.0087 3.724759 C 109.0203 109.1588 10.0208 1.382125 D 104.2425 104.6198 10.0679 3.747554 Minggu Ke-8 A 108.1481 108.2517 10.012 1.034758 B 104.8915 105.2535 10.0301 3.609136 C 109.7561 109.8663 10.0408 1.097522 D 104.5716 104.8748 10.0386 3.020341 Minggu Ke-10 A 104.6985 104.7922 10.0031 0.93671 B 109.3312 109.6705 10.0015 3.392491 C 107.8346 107.8999 10.0512 0.649674 D 108.4464 108.7337 10.0503 2.858621 Minggu Ke-12 A 109.2165 109.2912 10.0309 0.744699 B 108.1481 108.4189 10.0117 2.704835 C 104.9915 105.0221 10.0005 0.305985 D 108.4358 108.6725 10.0491 2.355435 Minggu Ke-14 A 109.3312 109.3725 10.1133 0.408373 B 109.2959 109.5458 10.0595 2.484219 C 104.5716 104.6015 10.0721 0.29686 D 104.6916 104.9214 10.0072 2.296347 Minggu Ke-16 A 107.8346 107.8717 10.0438 0.369382 B 104.2925 104.4324 10.2122 1.36993 C 108.8445 108.8727 10.0104 0.281707 D 104.2325 104.4469 10.1703 2.108099
Lampiran 6 Perubahan luas area senyawa yang terdeteksi pada tanah Aselama 4 bulan Luas area/minggu
Senyawa Waktu retensi
0 2 4 6 8 14 16 Dekana 19.0853 0.0322 td td 0.0297 td td td Undekana 24.3391 0.0600 td td 0.0784 0.0633 td td Dodekana 29.2889 0.0800 td td 0.0894 0.0654 td td Tridekana 33.9230 td 0.2929 0.2569 0.1255 0.0986 td td Tetradekana 38.3105 0.2416 0.3326 0.3066 0.0562 0.1045 td td Pentadekana 42.4391 0.5484 0.4290 0.5295 0.0867 0.2388 td td Heksadekana 46.3460 0.5107 0.5126 0.7661 0.1434 0.4262 0.0724 td Heptadekana 50.0513 0.6424 0.5796 1.0159 0.2622 0.5713 0.1476 td Octadekana 53.5746 0.6158 0.8281 1.0862 0.3194 0.6330 0.1809 0.0607 Dokosana 74.2575 0.8361 0.7368 1.5328 0.6401 0.0424 td 0.2316 Nonadekana 68.9497 1.0714 0.7780 1.2553 0.4207 0.7205 0.2594 0.0712 Eikosana 60.1355 0.7000 0.6582 1.3230 0.7400 0.7365 0.2947 0.0933 Heneikosana 73.2942 0.0257 0.6960 1.4371 0.5544 0.7600 td 0.1240 Trikosana 66.1338 0.7259 0.7800 1.6542 0.5500 td 0.0442 td Heneikosana 68.9500 1.0700 0.7000 1.4400 0.5500 td td 0.1674 Tetrakosana 71.6519 0.8574 0.7914 1.7048 0.8659 td 0.6606 0.1856 Pentakosana 83.0119 0.5747 td 1.6989 td 0.7473 0.8347 0.1967 Oktakosana 81.5120 0.8100 td 0.7100 0.4800 td td td Heksakosana 76.7636 1.2441 td td 1.1200 td 0.9241 0.2252 Oktakosana 81.5117 0.8149 td 0.7128 0.4766 td td td Heptakosana 79.1788 0.9013 td 1.9172 td td 1.024 0.2512 Nonakosana 83.7678 0.8637 td td 0.9716 0.7834 1.2505 0.2573 Triakontana 85.9471 0.6928 td 1.8967 td 0.7775 td 0.1506 Eikosana 88.0612 0.6139 td 1.9200 1.1157 td td td td = tidak terdeteksi
Lampiran 7 Perubahan luas area senyawa yang terdeteksi pada tanah B selama 4 bulan Luas area/minggu
Senyawa Waktu retensi
0 2 4 6 8 14 16 Dodekana 29.2889 0.156 0.2902 td 0.0864 td 0.0184 td Tridekana 33.9230 0.3866 0.5406 0.4042 0.1070 0.0099 0.0270 td Tetradekana 38.3105 0.6457 0.6976 0.6548 td 0.0418 0.0397 td Pentadekana 42.4391 0.8137 0.9200 1.1053 0.0454 0.2703 0.1491 td Heksadekana 46.3460 0.9360 1.0577 1.5142 td 0.4557 0.3277 0.2588 Heptadekana 50.0513 0.9914 1.2344 1.8868 0.2443 0.6318 0.5132 0.5027 Octadekana 53.5746 0.9685 1.2151 1.9453 0.0286 0.6967 0.5958 0.6398 Dokosana 74.2575 td 1.6885 2.5510 0.0590 1.1748 0.8682 1.1300 Nonadekana 68.9497 1.0582 1.3239 td 0.0543 0.8087 0.7205 0.0262 Eikosana 60.1355 1.0771 1.3671 2.241 td 0.8447 td td Heneikosana 73.2942 1.1294 td td td td 0.8192 1.0336 Trikosana 66.1338 td 1.5423 2.4141 0.0817 0.0243 0.7620 0.9502 Heneikosana 68.9500 1.3933 td td td 1.0599 td td Tetrakosana 71.6519 1.2803 td td 0.1115 1.0720 1.0170 1.0221 Dotriakontana 76.7636 1.3707 td td td 1.1634 td td Pentakosana 83.0119 td 1.8824 td 0.6825 td 1.1019 0.0161 Oktakosana 81.5120 td td td td td td td Heksakosana 76.7636 td td 1.4657 0.2609 1.1634 td td Oktakosana 81.5117 td td 2.7145 td 0.9485 td 0.7469 Heptakosana 79.1788 1.3942 1.8435 2.6501 td 0.0041 td 1.0414 Nonakosana 83.7678 td 1.5169 1.9567 td 1.0337 0.9773 0.6077 Triakontana 85.9471 td td td td td 0.7638 td Eikosana 88.0612 0.6132 0.3070 0.6347 0.2304 0.5635 0.4183 td Dodekana 29.2889 0.1560 0.2902 td 0.0864 td 0.0184 td td = tidak terdeteksi
Lampiran 8 Perubahan luas area senyawa yang terdeteksi pada tanah C selama 4 bulan Luas area/minggu
Senyawa Waktu retensi 1
2 4 6 8 12 14 16 Dodekana 29.2889 0.1238 0.2785 td 0.1391 0.0555 td 0.0243 td Tridekana 33.9230 0.3120 0.5187 0.2785 0.2075 0.0722 td 0.0354 td Tetradekana 38.3105 0.5578 0.7027 0.2807 0.2348 td td 0.0241 td Pentadekana 42.4391 0.7352 0.9552 0.4331 0.4893 td td td td Heksadekana 46.3460 0.8626 1.1091 0.5859 0.9047 0.0554 0.0353 td td Heptadekana 50.0513 0.9489 1.2869 0.7323 1.2883 0.0925 0.0656 td td Oktadekana 53.5746 0.0386 td 0.7872 1.3295 0.1181 0.0287 td td td Dokosana 74.2575 1.1736 1.9582 1.5802 2.0703 0.4150 0.1579 0.1140 Nonadekana 68.9497 1.0192 td 0.9286 1.4992 0.2904 0.0642 0.0583 td td Eikosana 60.1355 1.0495 1.5522 0.9818 1.5657 0.179 0.0558 0.0295 Heneikosana 73.2942 1.4020 td 1.0635 0.1078 td 0.0722 td td Trikosana 66.1338 1.1736 1.7176 1.1892 td td td td td Heneikosana 68.9500 1.1141 1.8261 1.3015 1.8905 td 0.0660 td td Tetrakosana 71.6519 1.2924 1.8391 1.3750 1.9311 td 0.0685 0.0580 td Dotriakontana 76.7636 1.4015 1.9454 1.6461 2.1021 td 0.1331 0.1222 td td Pentakosana 83.0119 0.7122 1.1811 td td 0.365 td td Heksakosana 76.7636 1.4015 td td 2.1021 td 0.1636 0.1462 td td Oktakosana 81.5117 1.2661 1.6004 1.5130 1.8457 0.2396 0.2271 0.1262 td Heptakosana 79.1788 1.4218 1.8486 1.6510 2.0646 0.4896 td 0.1189 td Nonakosana 83.7678 1.2468 1.4819 1.5543 1.8551 td 0.3897 td td Triakontana 85.9471 0.8921 0.9315 0.9531 1.2847 0.3172 0.2271 0.1839 td Eikosana 88.0612 0.7201 0.5670 0.6706 1.0501 0.2396 0.1682 td td Dodekana 29.2889 0.1238 0.2785 td 0.1391 0.0555 td 0.0243 td Tridekana 33.9230 0.3120 0.5187 0.2785 0.2075 0.0722 td 0.0354 td = tidak terdeteksi
Lampiran 9 Perubahan luas area senyawa yang terdeteksi pada tanah D selama 4 bulan Luas area/minggu
Senyawa Waktu retensi 0
2 8 12 14 16 Tetradekana 38.3105 0.4659 0.0487 0.1408 0.0795 td 0.0253 Pentadekana 42.4391 0.5731 0.1590 0.2918 0.2922 0.1866 0.1061 Heksadekana 46.3460 0.6726 0.3138 0.4562 0.5640 0.4185 0.2598 Heptadekana 50.0513 0.7524 0.4473 0.5985 0.8032 0.6723 0.4087 Oktadekana 53.5746 0.7525 0.5019 0.6039 0.9038 0.7920 0.4725 Eikosana 60.1355 0.8877 0.6283 0.6828 1.1074 0.9716 0.5679 Trikosana 66.1338 0.9906 td 0.7311 1.1654 1.0588 0.6108 Nonadekana 68.9497 0.8516 0.5951 0.7931 1.0449 0.9288 0.6242 Heneikosana 68.9500 0.0298 0.7734 0.6954 1.2685 1.1468 0.6242 Heneikosana 73.2942 0.9389 0.6647 td td td td Dokosana 74.2575 1.2350 0.7076 0.6705 1.1291 1.249 0.6008 Tetrakosana 71.6519 1.1494 0.753 0.8107 1.2728 1.1451 0.5762 Dotriakontana 76.7636 td td td td td td Heksakosana 76.7636 1.2493 0.7278 0.9572 1.3250 1.1930 0.5460 Heptakosana 79.1788 1.26 0.7197 1.0000 1.3590 1.2752 0.4932 Oktakosana 81.5117 1.1271 0.4719 0.9618 1.1978 1.0465 0.4033 Pentakosana 83.0119 0.1026 0.7975 td 1.3841 td td Nonakosana 83.7678 1.1595 0.6294 1.0005 1.2091 1.0803 td Triakontana 85.9471 0.8097 0.3927 0.7552 0.8072 td 0.2225 td = tidak terdeteksi
Lampiran 10 Data kromatogram GCMS
Data kromatogram tanah A pada awal perlakuan
Data kromatogram tanah A pada akhir perlakuan
Data kromatogram tanah B pada akhir perlakuan
Data kromatogram tanah C pada awal perlakuan
Data kromatogram tanah D pada awal perlakuan