7 BAB II
TINJAUAN PUSTAKA
1.1.Tinjauan Umum Darah 1.1.1.Definisi Darah
Darah adalah jaringan tubuh yang yang berbeda dengan jaringan tubuh lain, berada dalam bentuk konsistensi cair, beredar dalam suatu sistem tertutup yang dinamakan sebagai pembuluh darah dan menjalankan fungsi transpor sebagai bahan serta fungsi homeostatis (Sadikin M, 2002). Darah diproduksi dalam sumsum tulang dan nodus limpa. Volume darah manusia sekitar 7% - 10% berat badan normal dan berjumlah sekitar 5 liter, jumlah ini berbeda tiap-tiap orang. Darah terdiri dari 2 komponen yaitu plasma darah dan butir-butir darah. Plasma darah adalah bagian cair darah yang sebagian besar terdiri atas air, elektrolit dan protein darah. Butir-butir darah (Blood corpuscles) terdiri atas 3 elemen yaitu eritrosit (sel darah merah), leukosit (sel darah putih), dan trombosit (butir pembeku/platelet). (Handayani W dan Haribowo A.S, 2008).
1.1.2.Fungsi Darah
Dalam keadaan fisiologis, darah selalu berada dalam pembuluh darah, sehingga dapat menjalankan fungsinya sebagai berikut:
1. Sebagai alat pengangkut yang meliputi hal-hal berikut ini: a. Mengangkut gas oksigen (O2) dan karbondioksida (CO2).
b. Mengangkut sisa-sisa atau ampas dari hasil metabolisme jaringan berupa urea, kreatinin dan asam urat.
c. Mengangkut sari makanan yang diserap melalui usus untuk disebarkan ke seluruh jaringan tubuh.
d. Mengangkut hasil-hasil metabolisme jaringan. 2. Mengatur keseimbangan cairan tubuh.
3. Mengatur panas tubuh.
4. Berperan serta dalam mengatur pH cairan tubuh. 5. Mempertahankan tubuh dari serangan penyakit infeksi.
6. Mencegah perdarahan (Handayani W. dan Haribowo A.S, 2008).
1.1.3.Komponen sel darah 1.1.3.1. Eritrosit
Sel darah darah merah (eritrosit) tidak memiliki inti sel, eritrosit mempunyai kandung protein hemoglobin, yang mengangkut sebagian besar oksigen dari paru ke seluruh sel tubuh. Sel eritrosit diproduksi di sumsum tulang (Corwin, EJ, 2007). Eritrosit terbentuk melalui beberapa tahapan yaitu pembelahan dan perubahan morfologi sel-sel berinti dimulai dari proeritoblas sampai ortokromatik eritroblas, kemudian membentuk eritrosit tidak berinti yang disebut retikulosit dan akhirnya menjadi eritrosit (Boedina SK, 1988).
Morfologi dari eritrosit dapat diamati dengan cara mikroskopis dengan pembuatan sediaan apus dengan pengecatan Wright Giemsa atau dengan pengecatan yang lain. Eritrosit memiliki bentuk bikonkav dengan
diameter 7-9 µm. Sediaan darah apus yang telah dilakukan pengecatan dengan Giemsa maka eritrosit yang normal akan tampak warna kemerah-merahan dengan tepi agak lebih gelap dan terlihat warna menjadi lebih pucat pada bagian tengah.
Apabila pada pemeriksaan darah tepi dengan eritrosit sebagian besar mempunyai diameter <7 µm disebut dengan istilah mikrositosis. Hal ini dapat dijumpai pada anemia difisiensi besi, thalasemia, dan anemia karena penyakit menahun. Sedangkan apabila eritrosit dengan diameter lebih dari 9 µm atau lebih besar dari ukuran normal maka disebut makrositosis, hal ini bisa dijumpai pada anemia megaloblastik. Eritrosit yang menunjukkan zone tengah yang lebih pucat dan lebar disebut juga sebagai eritrosit hipokrom, merupakan petunjuk bahwa kadar hemoglobin eritrosit itu rendah. Apabila sebaliknya dengan kondisi terdapat eritrosit muda yang ukurannya lebih besar dari pada eritrosit normal dan berwarna kebiru-biruan biasa disebut dengan polikromasi, hal ini bisa dijumpai pada retikulositosis (Boedina SK, 1988).
Menghitung jumlah eritrosit dapat dilakukan dengan cara manual dan automatik. Menghitung jumlah eritrosit dengan cara manual menggunakan volume yang kecil dan pengenceran yang tinggi memakan waktu dan ketelitiannya kurang, sehingga sekarang ini jarang digunakan. Sebelum ada cara automatik pemeriksaan manual masih sering dipakai namun hanya sedikit yang menunjukkan hasil yang teliti dan dapat dipercaya. Pada umumya pemeriksaan manual memberikan hasil yang meragukan (Writmann FK, 1989), oleh karena itu dibuatlah alat hitung automatik, dengan alat ini
maka penghitungan sel menjadi lebih mudah, cepat dan teliti bila dibandingkan dengan cara manual. Meskipun demikian pemeriksaan manual tetap masih dipertahankan karena sebagai metode rujukan (Wirawan. R dan Silman.E, 1992). Nilai normal eritrosit sekitar 4-5 x 106 per mm3 darah (M.Biomed C dan Lestari E, 2011).
Peningkatan jumlah eritrosit dijumpai pada polistemia vera, dehidrasi, dan hipoksia. Sedangkan penurunan jumlah eritrosit dapat dijumpai pada anemia, perdarahan, hemolisis dan malnutrisi (Uthman E, 2001).
Pemakaian antikoagulan Na2EDTA berlebih menyebabkan penurunan dan perubahan degeneratif eritrosit oleh Na2EDTA yang bersifat hiperosmolar, sehingga menyebabkan eritrosit mengerut dan dapat menyebabkan penurunan jumlah eritrosit karena tidak terhitung oleh alat automatik hematology analyzer (wirawan R, 2004).
1.1.3.2. Leukosit
Darah tepi mengandung leukosit yang jumlahnya berkisar 4500-11.000 sel/mm3 (Writmann FK, 1989).
Sel darah putih (leukosit) dibentuk disumsum tulang dari sel-sel progenitor. Pada proses diferensiasi selanjutnya, sel-sel progenitor menjadi golongan yang tidak bergranula yaitu, limfosit T dan B, monosit, dan magrofag, atau golongan yang bergranula yaitu, neutrofil, basofil, dan eosinofil. Peranan sel darah putih adalah untuk mengenali dan melawan
mikroorganisme pada reaksi imun dan untuk membantu proses peradangan dan penyembuhan (Corwin, EJ, 2007).
Hitung jumlah leukosit merupakan pemeriksaan yang digunakan untuk menunjukkan adanya infeksi dan dapat juga untuk mengikuti perkembangan dari suatu penyakit tertentu. Dua metode yang digunakan untuk menghitung jumalah leukosit yaitu metode manual atau mikroskopis dan automatik untuk metode elektronik (Wirawan. R dan Silman.E, 1992).
Leukositosis adalah peningkatan jumlah sel darah dalam sirkulasi. Hal ini merupakan respons normal terhadap infeksi atau proses peradangan. Sedangakan penurunan jumlah leukosit dibawah nilai normal adalah leukopenia, hal ini dapat disebabkan misalnya infeksi virus, penyakit atau kerusakan sumsum tulang, radiasi atau kemoterapi. Penyakit sistemik yang parah misalnya lupus eritrematosus, penyakit tiroid, dan sindrom cushing, dapat menyebabkan penurunan jumlah leukosit (Corwin, EJ, 2007).
Pemakaian antikoagulan EDTA berlebihan menyebabkan perubahan pada morfologi neutrofil, seperti pembengkakan, hilangnya lobus neutrofil dan sel mengalami disintegrasi yang dapat menyebabkan penurunan jumlah leukosit (Narayanan S, 2000).
1.1.3.3. Trombosit
Trombosit adalah fragmen dari megakariosit yang ditemukan didarah tepi yang berperan dalam pembekuan darah (M.Biomed C dan Lestari E, 2011).Trombosit disebut juga platelet atau keping darah. Sebenarnya,
trombosit tidak dapat dipandang sebagai sel utuh karena ia berasal dari sel raksasa yang berada di sumsum tulang, yang dinamakan megakariosit. Dalam pematangannya, megakariosit ini pecah menjadi 3000-4000 serpihan sel, yang dinamai sebagai trombosit. Trombosit berbentuk seperti cakram bikonveks (dalam keadaan inaktif) dengan diameter 2-3 m dan volume 8-10 fl (Firkin BG, 1994).
Umur trombosit setelah pecah dari sel asalnya dan masuk darah ialah antara 8 sampai 14 hari.Jumlah trombosit normal adalah antara 150.000-450.000/mm3 dengan rata-rata 250.000/mm3 (Sadikin MH, 2002).
Fungsi utama trombosit adalah pembentukan sumbatan mekanis selama respon hemostatik normal terhadap luka vaskular. Trombosit berfungsi penting pada usaha tubuh untuk mempertahankan jaringan bila terjadi luka. Trombosit ikut serta dalam usaha menutup luka, sehingga tubuh tidak mengalami kehilangan darah dan terlindung dari penyusupan benda atau sel asing. Trombosit melekat (adesi) pada permukaan asing terutama serat kolagen. Disamping melekat pada permukaan asing, trombosit akan melekat pada trombosit lain (agregasi). Selama proses perubahan bentuk trombosit yang menyebabkan trombosit akan melepaskan isinya. Masa agregasi trombosit akan melekat pada endotel, sehingga terbentuk sumbat trombosit yang dapat menutup luka pada pembuluh darah, sedangkan pembentukan sumbat trombosit yang stabil melalui pembentukan fibrin (Sadikin MH, 2002).
Hitung jumlah trombosit sangat penting untuk menunjang diagnosa gangguan perdarahan. Untuk menghitung jumlah trombosit, pungsi vena harus hati-hati tanpa menimbulkan trauma dan darah harus dihisap dengan cepat dan segera dicampur dengan antikoagulan dengan adekuat. Hindari pengocokan yang berlebihan karena akan menyebabkan perlekatan trombosit sehingga hasil penghitungan tidak tepat (Riswanto, 2013).
Peningkatan jumlah trombosit disebut trombositosis, misalnya dijumpai pada trombositemia idiopatik dan setelah splenektomi. Penurunan jumlah trombosit atau trombositopenia dapat dijumpai pada penyakit infeksi tertentu, misalnya demam berdarah dengue yang disebabkan oleh virus dengue, adalah penyakit yang dapat menurunkan jumlah trombosit darah sampai ke tingkat yang rendah. Akibatnya, penderita akan sangat rentan akan perdarahan yang sukar dihentikan. Trombositopenia dapat menyebabkan epistaksis, perdarahan pada saluran cerna.Perdarahan kecil di bawah kulit juga sering terjadi. Keadaan lain yang dapat menyebabkan trombositopenia ialah trombositopenia purpura, anemia aplastik, leukimia akut, dan kadang-kadang setelah kemoterapi dan terapis radiasi (Sadikin MH, 2002).
Pemberian antikoagulan Na2EDTA kurang dari yang dibutuhkan akan menyebabkan hitung jumlah trombosit menurun karena terjadi mikrotrombi di dalam penampung yang dapat menyumbat alat, sedangkan apabila dalam pemberian antikoagulan berlebih akan menyebabkan sel mengalami pembengkakkan kemudian disintegrasi, membentuk fragmen dalam ukuran yang sama dengan trombosit sehingga terhitung oleh alat
penghitung elektronik, sehingga berakibat peningkatan palsu jumlah hitung trombosit, bila disintegrasi membentuk fragmen yang berbeda dengan ukuran trombosit akan menyebabkan penurunan jumlah hitung trombosit (Wirawan R, 2004).
1.2.Metode Pemeriksaan Jumlah Hitung Sel Darah 1.2.1. Cara Manual
Cara menghitung jumlah eritrosit, leukosit dan trombosit dapat dilakukan dengan metoda manual menggunakan mikroskop. Keuntungan dari penghitungan manual adalah bahwa mesin penghitung automatik tidak dapat diandalkan dalam menghitung sel abnormal. Dalam hal ini diperlukan pemeriksaan manual terhadap apusan darah. Pemeriksaan secara mikroskopik akan memberikan informasi mengenai lekosit-lekosit yang abnormal dan variasi bentuk eritrosit. Pemeriksaan manual juga dapat memberikan informasi mengenai adanya jenis sel lain yang biasanya tidak dijumpai dalam darah tepi, misalnya sel plasma. Selain itu, adanya trombosit yang menggerombol (clumps) yang menyebabkan rendahnya jumlah trombosit pada pemeriksaan automatik dapat dikonfirmasi dengan pemeriksaan apusan darah (Sainssyiah, 2010). Keuntungan lain dari pemeriksaan manual yaitu harga cukup murah, dapat dilakukan di semua laboratorium termasuk laboratorium kecil yang tidak ada aliran listrik(Wirawan. R dan Silman.E, 1992).
Prinsip dari pemeriksaan hitung jumlah sel manual adalah dengan melakukan pengenceran darah dengan larutan tertentu. Jumlah sel darah
dalam volume pengenceran tersebut dihitung dengan menggunakan kamar hitung(improved Neubauer) Penghitungan jumlah sel yaitu dilakukan dengan membagi jumlah sel yang dihitung dengan volume sel yang dihitung dikalikan faktor pengenceran (Wirawan. R dan Silman.E, 1992).
1.2.2. Metode Automatik
Pemeriksaan hematologi merupakan pemeriksaan rutin yang dilakakukan dihampir semua pasien di laboratorium klinik. Pemeriksaan hitung jumlah sel darah dilakukan secara automatik menggunakan alat
hematology analyzer. Tes hitung jumlah sel darah cara automatik akurasinya jauh lebih baik dibandingkan perhitungan manual. Dalam pemeriksaan hitung jumlah sel secara automatik tidak akan mengalami kesulitan mengenai pengenceran sampel dan standarisasi alat. Cara ini meningkatkan kecepatan pemeriksaan dan ketelitian dibanding dengan cara manual (Writmann FK, 1989).
Prinsip pengukuran sel darah dengan menggunakan alat hitung automatik dapat berbeda-beda dari alat yang satu dengan yang lainnya. Beberapa metode yang sering digunakan dalam pemeriksaan hematologi adalah :
1. Metode impedansi elektrik
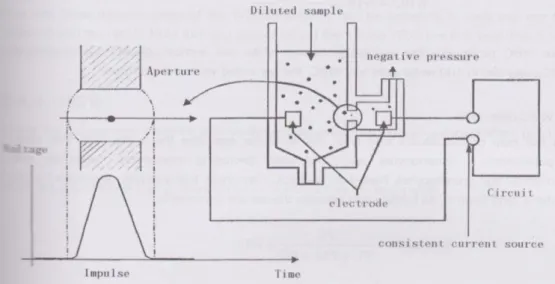
Metode impedansi elektrik adalah salah satu metode yang digunakan dalam menghitung jumlah dan mengukur sel darah, dimana sebelum pemeriksaan sampel diencerkan dengan menggunakan larutan yang mempunyai konduktivitas tertentu dan merupakan konduktor listrik yang
kurang baik kemudian sel darah dialirkan melalui lubang kecil yang disebut
orifice yang mempunyai ukuran tertentu. Pada saat yang sama, suatu arus listrik dialirkan melalui elektroda yang dipasang pada sisi luar dan sisi dalam orifice, karena sel darah adalah penghantar listrik yang buruk, sehingga jika sel darah masuk melalui orifice tadi arus listrik yang mengalir akan terganggu, gangguan ini menimbulkan suatu pulsa listrik. Jumlah pulsa listrik yang terukur persatuan waktu (frekuensi pulsa) dideteksi sebagai jumlah sel yang melalui celah tersebut. Sedangkan besarnya perubahan tegangan listrik (amplitudo) yang terjadi, merupakan ukuran volume dari masing-masing sel darah. Besarnya pulsa akan sesuai dengan besarnya jumlah dan besarnya sel darah yang lewat. Jika sel darah besar, maka pulsa yang ditimbulkan besar, sebaliknya jika sel darah kecil maka pulsapun kecil. Dengan demikian dapat mengenali jenis-jenis sel menurut ukuran dan menghitung jumlahnya (Mengko R., 2013).
Gambar 1. Metode impedansi dalam penghitungan jumlah sel dan ukuran (Mindray, 2010)
2. Metode flowcytometry
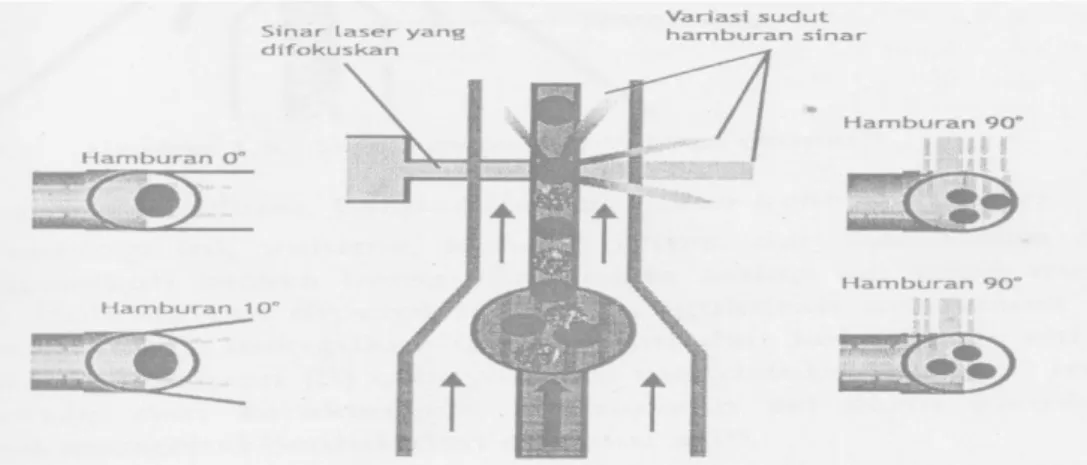
Flow cytometri adalah metode pengukuran (metri) jumlah dan sifat-sifat sel (cyto) yang dibungkus oleh aliran cairan (flow) melalui celah sempit. Ribuan sel dialirkan melalui celah tersebut sedemikian rupa sehingga sel dapat lewat satu per satu, kemudian dilakukan penghitungan jumlah sel dan ukurannya. Alat ini juga dapat memberikan informasi intraseluler, termasuk inti sel. Secara umum, metode flow cytometri adalah pemeriksaan di mana sel-sel dari sampel masuk dalam suatu flow chamber, dibungkus oleh cairan pembungkus, kemudian dialirkan melewati suatu celah atau lubang dengan ukuran kecil yang memungkinkan sel lewat satu demi satu, kemudian dilakukan pengukuran. Aliran yang keluar sel tersebut kemudian melewati medan listrik dan dipisahkan menjadi tetesan-tetesan sesuai dengan muatannya, kemudian ditampung ke dalam beberapa saluran pengumpul yang terpisah. Ini disebut cell sorting (Koeswardani R, et al, 2001).
Prinsip yang digunakan dalam metode ini adalah pendaran cahaya / (light scattering) yang terjadi ketika sel mengalir melewati celah dan berkas cahaya yang difouskan ke sensing area yang ada pada aperture tersebut. Apabila cahaya mengenai sel, maka cahaya akan dihamburkan, dipantulkan, atau dibiaskan kesemua arah. Kemudian hamburan cahaya yang mengenai sel akan ditangkap oleh detektor yang ada pada sudut-sudut tertentu sehingga menimbulkan pulsa. Pulsa cahaya yang berasal dari hamburan cahaya, intensitas warna, atau fluorensi, akan diubah menjadi pulsa listrik. Pulsa ini dipakai untuk menghitung jumlah, ukuran, maupun inti sel yang merupakan
ciri dari masing-masing sel. Hamburan cahaya dengan arah lurus (forward scettered light) mendeteksi volume dan ukuran sel. Sedangkan cayaha yang dihamburka dengan sudut 90 derajad menunjukkan informasi dari isi granula sitoplasma. Pada metode ini juga dapat dilakukan pewarnaan dengan cara menambahkan pewarna pada reagen. Sel yang telah diberi warna akan memberikan pendaran cahaya yang berbeda-beda, sehingga akan lebih banyak informasi untuk mendeteksi atau membedakan berbagai jenis sel (Mengko R., 2013).
Gambar 2. Ilustrasi sudut hamburan cahaya pada metode flowcytometry (Mengko R., 2013).
1.3.Faktor-fatktor yang Mempengaruhi Pemeriksaan Eritrosit, Leukosit dan Trombosit dalam Laboratorium
1.3.1. Pra Analitik
Keselahan pada proses pra analitik dalam pemeriksaan laboratorium dapat memberikan kontribusi sekitar 62% dari total keseluruhan pemeriksaan Laboratorium (Mengko R., 2013).
Proses pra analitik meliputi persiapan pasien, pengambilan / pengumpulan spesimen, pengiriman spesimen ke laboratorium, penanganan
spesimen dan termasuk dalam pemberian antikoagulan serta penyimpanan spesimen (Riswanto, 2010).
1. Persiapan Pasien
Ada beberapa sumber kesalahan yang kurang terkontrol dari proses pra analitik yang dapat mempengaruhi pemeriksaan laboratorium seperti aktivitas fisik, puasa, diet, stres, efek posisi, menstruasi, kehamilan, gaya hidup (konsumsi alkohol, rokok, kopi, obat), usia, jenis kelamin, pasca transfusi, pasca donasi, pasca operasi dan lainnya. Karena hal-hal tersebut memiliki pengaruh yang kuat terhadap beberapa pemeriksaan hematologi, maka pasien harus selalu dipertimbangkan sebelum pengambilan sampel (Riswanto, 2010).
2. Persiapan Pengumpulan Sampel
Spesimen yang akan diperiksa laboratorium haruslah memenuhi persyaratan yaitu volume mencukupi, kondisi baik/tidak lisis, dan segar/tidak kadaluwarsa, pemakaian antikoagulan atau pengawet yang tepat, ditampung dalam wadah yang memenuhi syarat, dan identitas benar sesuai dengan data paien (Riswanto, 2010).
3. Pengambilan Spesimen
Hal-hal yang harus diperhatikan pada pengambilan spesimen adalah : a. Tehnik atau cara pengambilan. Pengambilan spesimen harus dilakukan
dengan benar sesuai dengan standard operating procedure (SOP) yang ada.
1) Seluruh sampel harus masuk ke dalam wadah (sesuai kapasitas), jangan ada yang menempel pada bagian luar tabung untuk menghindari bahaya infeksi.
2) Wadah harus dapat ditutup rapat dan diletakkan dalam posisi berdiri untuk mencegah spesimen tumpah.
3) Darah harus segera dimasukkan dalam tabung setelah sampling. 4) Lepaskan jarum, alirkan darah lewat dinding tabung perlahan-lahan
agar tidak terjadi hemolisis.
5) Pastikan jenis antikoagulan dan volume darah yang ditambahkan tidak keliru.
6) Homogenisasi segera darah yang menggunakan antikoagulan dengan lembut perlahan-lahan. Jangan mengkocok tabung keras-keras agar tidak hemolisis.
b. Sumber-sumber kesalahan pada pengambilan spesimen darah : 1) Pemasangan turniquet terlalu lama
2) Pengambilan darah terlalu lama (tidak sekali tusuk kena) dapat menyebabkan trombosit menurun.
3) Pengambilan darah pada jalur infus dapat menyebabkan eritrosit, leukosit, dan trombosit menurun.
4) Homogenisasi darah dengan antikoagulan yang tidak sempurna atau keterlambatan homogenisasi menyebabkan terbentuknya bekuan darah (Riswanto, 2010).
4. Antikoagulan
Antikoagulan adalah zat yang digunakan untuk mencegah proses pembekuan darah dengan cara mengikat kalsium atau dengan menghambat pembentukan trombin yang diperlukan untuk mengkonversi fibrinogen menjadi fibrin dalam proses pembekuan (Riswanto, 2010). Jenis antikoagulan yang digunakan harus disesuaikan dengan jenis pemeriksaan yang diminta. Perbandingan volume darah dan antikoagulan harus sesuai dan tepat karena dapat mempengaruhi hasil pemeriksaan yang tidak sesuai dengan kenyataan (Wirawan. R dan Silman.E, 1992). Ada beberapa antikoagulan yg banyak digunakan utk pemeriksaan laboratorium, diantaranya ;
a. EDTA (Ethylene Diamine Tetra Acetatic Acid )
Antikoagulan EDTA dapat digunakan dalam dua bentuk yaitu berupa cair dan zat kering. Sampai saat ini EDTA dalam bentuk serbuk masih banyak digunakan di berbagai laboratorium dan untuk memudahkan pengukuran maka dibuat menjadi larutan 10% (Gandasubrata, 2010).
Antikoagulan EDTA umumnya tersedia dalam bentuk garam sodium (natrium) atau potassium (kalium), mencegah koagulasi dengan cara mengikat atau mengkhelasi kalsium. EDTA memiliki keunggulan dibanding dengan antikoagulan yang lain, yaitu tidak mempengaruhi sel-sel darah, sehingga ideal untuk pengujian hematologi, seperti pemeriksaan hemoglobin, hematokrit, KED, hitung lekosit, hitung trombosit, retikulosit, apusan darah, dan penentuan golongan darah
Ada tiga macam EDTA, yaitu dinatrium EDTA (Na2EDTA), dipotassium EDTA (K2EDTA) dan tripotassium EDTA (K3EDTA). Na2EDTA dan K2EDTA biasanya digunakan dalam bentuk kering, sedangkan K3EDTA biasanya digunakan dalam bentuk cair.
Na2EDTA biasanya digunakan dengan konsentrasi 1 - 1,5 mg/ml darah. Penggunaannya harus tepat karena apabila jumlah EDTA kurang, darah dapat mengalami koagulasi. Sebaliknya, bila EDTA kelebihan, eritrosit mengalami krenasi, trombosit membesar dan mengalami disintegrasi. Setelah darah dimasukkan ke dalam tabung, segera lakukan pencampuran/homogenisasi dengan cara membolak-balikkan tabung untuk menghindari penggumpalan trombosit dan pembentukan bekuan darah (Riswanto, 2013).
b. Sitrat
Trisodium sitrat dihidrat (Na3C6H5O7.2H2O) atau sitrat bekerja dengan mengikat atau menghelasi kalsium. Digunakan dalam bentuk cair sebagai trisodium sitrat dihidrat 3,2% (109 mmol/L). Antikoagulan ini digunakan untuk pengujian sistem pembekuan darah karena paling baik dalam memelihara faktor-faktor pembekuan darah dan mengembalikan kalsium kedalam spesimen selama proses pemeriksaan serta dapat dengan mudah mengembalikan efek pengikatan.
Penggunaan Natrium sitrat konsentrasi 3,8% digunakan untuk pemeriksaan erythrocyte sedimentation rate (ESR) atau KED/LED cara
Westergreen. Penggunaannya adalah 1 bagian sitrat + 4 bagian darah (Riswanto, 2013).
c. Heparin
Antikoagulan ini bersifat seperti antirombin, tidak mempengaruhi bentuk eritrosit dan leukosit. Heparin dapat dipakai sebagai larutan ataupun dalam bentuk kering dengan konsentrasi penggunaan adalah 1 mg heparin kering untuk 10 ml darah. (Gandasoebrata, 2010).
Antikoagulan ini merupakan asam mukopolisacharida yang bekerja dengan cara menghentikan pembentukan trombin dari prothrombin sehingga menghentikan pembentukan fibrin dari fibrinogen. Ada tiga macam heparin: ammonium heparin, lithium heparin dan sodium heparin. Dari ketiga macam heparin tersebut, lithium heparin paling banyak digunakan sebagai antikoagulan karena tidak mengganggu analisa beberapa macam ion dalam darah.
Heparin banyak digunakan pada analisa kimia darah, enzim, kultur sel, OFT (osmotic fragility test). Konsentrasi dalam penggunaan adalah 0.1 – 0.2 mg/ml darah. Heparin tidak dianjurkan untuk pemeriksaan apusan darah karena menyebabkan latar belakang biru (Riswanto, 2013).
d. Oksalat
Oksalat bekerja dengan mencegah pembekuan darah dengan cara mendapatkan kalisum dalam darah. Antikoagulan ini dapat dijumpai sebagai ammonium, lithium, kalium (potassium) dan natrium (sodium).
Natrium oksalat (Na2C2O4) 0,1 N digunakan untuk pengujian faktor pembekuan darah misalnya PPT (plasma prothrombin time) dengan perbandingan 9 bagian darah ditambah 1 bagian Na oksalat.
Kalium oksalat digunakan bersama dengan natrium fluorida untuk penentukan kadar glukosa darah, dimana fungsinya adalah sebagai antiglikolisis yang mencegah metabolisme glukosa oleh sel (Riswanto, 2013).
1.3.2. Analitik
Proses analitik adalah tahap pengerjaan sampel sehingga diperoleh hasil pemeriksaan (Depkes RI, 1999).
1. Bahan Pemeriksaan
Pemeriksaan jumlah eritrosit, leukosit dan trombosit dapat menggunakan darah vena maupun darah kapiler. Pemeriksaan dengan darah kapiler memberikan hasil lebih rendah dibandingkan darah vena. Pemeriksaan jumlah eritrosit, leukosit dan trombosit dengan darah kapiler menggunakan alat automatik diperlukan darah kapiler sebanyak 20 ul (Mindray, 2010) 2. Pemeliharaan dan Kalibrasi Alat
Alat pemeriksaan bila tidak dilakukan perawatan secara rutin maupun kalibrasi maka akan mempengaruhi hasil pemeriksaan jumlah eritrosit, leukosit dan trombosit menjadi lebih tinggi atau menjadi rendah.
Upaya untuk mengkoreksi alat hematology analyzer merupakan sebuah upaya yang baik karena kita tahu bahwa tidak semua alat luput dari kesalahan dan ketidaktelitian. Perlu adanya pemahaman untuk menilai dan
memilah kesalahan yang mungkin terjadi saat pengerjaan dengan metode hematology analyzer. Setiap laboratorium mengklaim bahwa hasilnya lebih akurat bahkan pakai darah kontrol dibandingkan laboratorium lain. Alasan ini bisa dipatahkan bila pra analitiknya buruk, misal darah tidak segera dicampur dengan antikoagulan, kelebihan antikoagulan, tidak segera diperiksa (dalam waktu 1 jam lebih bagus), tidak dikocok sebelum diperiksa dan botol yang digunakan dari plastik/polietilen.
Pemeriksaan darah lengkap umumnya telah menggunakan mesin penghitung automatik (hematology analyzer). Pemeriksaan dengan mesin penghitung automatik dapat memberikan hasil yang cepat. Namun, alat hitung automatik/analyzer memiliki keterbatasan ketika terdapat sel yang abnormal, misalnya banyak dijumpainya sel-sel yang belum matang pada leukemia, infeksi bakterial, sepsis, dan sebagainya. Dalam kasus jumlah sel yang sangat tinggi dimana alat tidak mampu menghitungnya, maka pemeriksaan manual menjadi pilihan untuk dilakukan (Sainssyiah, 2010).
Penyebab kesalahan pada hasil alat hitung automatik (hematology analyzer) :
a. Salah cara sampling
b. Salah penyimpanan spesimen dan waktu pemeriksaan ditunda terlalu lama sehingga terjadi perubahan morfologi sel darah.
c. Kesalahan tidak mengocok sampel secara homogen, terutama bila tidak memiliki alat pengocok automatik (rotator) maka dikhawatirkan tidak
sehomogen saat sampel darah diambil dari tubuh pasien. Ini merupakan kesalahan fatal yang sering terjadi pada saat pemeriksaan.
d. Kehabisan reagent lyse sehingga seluruh sel tidak dihancurkan saat pengukuran sel tertentu.
e. Kalibrasi dan kontrol tidak benar. Tidak melakukan kalibrasi secara berkala dan darah kontrol yang digunakan sudah mengalami expired date
tapi tetap dipakai karena menghemat biaya operasional.
f. Carry over, homogenisasi, volume kurang. Untuk alat jenis open tube
maka, penyebabnya salah saat pada memasukkan sampel pada jarum sampling alat, misal jarum tidak masuk penuh ujungnya pada darah atau darah terlalu sedikit dalam tabung atau botol lebar sehingga saat dimasukkan jarum tidak terendam seluruhnya. Untuk jenis close tube
kesalahan hampir sama juga, yaitu tidak memenuhi volume minimum yang diminta oleh alat. Untuk tipe close tube menggunakan cara predilute,
perlu dikocok dahulu saat pengenceran darah dengan diluent.
g. Alat atau reagen rusak. Alat dapat saja rusak bila suhu yang tidak sesuai (warning : temperature ambient abnormal) dan kondisi meja yang tidak baik. Reagensia yang digunakan jelek dan mungkin terkontaminasi oleh udara luar karena packing yang jelek (Sainssyiah, 2010).
Perawatan alat secara rutin perlu dilakukan dengan melakukan perawatan harian yaitu EZ cleanser yaitu untuk menghancurkan sisa bekuan atau sisa pembuangan darah yang tidak sempurnadan melakukan kalibrasi dengan menggunakan kalibrator komersial atau sampel darah segar. Kalibrasi
diperiksa secara teratur dengan menggunakan program pemantapan mutu yang biasa dilakukan setiap laboratorium, sesuai dengan persyaratan laboratorium yang baik, verifikasi yang mencakup quality control harian pada setiap shift dan juga pada setiap perubahan nomor lot reagen. Alat yang digunakan untuk penelitian ini sudah dilakukan pemeliharaan alat secara rutin dan kalibrasi.
3. Kualitas Reagen
Reagen (diluent, lyse, rinse) harus diperlakukan sesuai aturan yang diberikan pabrik pembuatnya termasuk cara penyimpanan, penggunaan dan expired nya.
Pemakaian reagen yang sudah rusak oleh karena sudah expired maupun salah dalam suhu penyimpanan akan menyebabkan penurunan jumlah eritrosit, leukosit dan trombosit. Hal ini dapat diatasi dengan pemakain reagen yang tidak expired dan penyimpanan reagen pada suhu yang sudah ditentukan pabrik pembuatnya yaitu pada suhu 15-300C (Cell-Dyn, 2007).
4. Pemeriksa
Faktor pemeriksa juga dapat berpengaruh terhadap hasil pemeriksaan jumlah eritrosit, leukosit dan trombosit, bila sampel tidak dicampur/dikocok dengan benar sebelum sampel diperiksa atau pada saat sampel dihisap oleh penghisap sampel tidak sampai dasar tabung sampel atau hanya pada permukaan tabung sampel, maka hasil pemeriksaan jumlah trombosit menjadi
rendah. Hal ini memerlukan pemeriksa yang berpengalaman dan terlatih (Cell-Dyn, 2007)
1.3.3. Pasca Analitik
Proses pasca analitik adalah tahap akhir pemeriksaan yang dikeluarkan untuk meyakinkan bahwa hasil pemeriksaan yang dikeluarkan benar-benar valid atau dapat dipertanggungjawabkan.
Kegiatan pencatatan dan pelaporan di laboratorium harus dilakukan dengan cermat dan teliti karena dapat mempengaruhi hasil pemeriksaan dan dapat mengakibatkan kesalahan dalam penyampaian hasil pemeriksaan (Depkes RI, 1999).
1.4.Kerangka teori
1.5.Kerangka konsep
Variable bebas (independent) Variable tergantung (dependent) Variasi Konsentrasi dan
Volume Antikoagulan EDTA
Faktor-faktor yang mempengaruhi pemeriksaan jumlah Eritrosit, Leukosit dan
Trombosit Variasi Antikoagulan : Antikoagulan EDTA 5% 1) 5 ul 2) 10 ul 3) 20 ul Antikoagulan EDTA 10% 1) 5 ul 2) 10 ul 3) 20 ul Antikoagulan EDTA 20% 1) 5 ul 2) 10 ul 3) 20 ul Jumlah Eritrosit Jumlah Leukosit Jumlah Trombosit Trombosit Pasca Analitik
Pra Analitik Analitik
Jumlah Eritrosit Jumlah Leukosit Jumlah Trombosit 1) Persiapan Pasien 2) Persiapan Pengumpulan Sampel 3) Pengambilan Sampel 4) Antikoagulan 1) Bahan Pemeriksaan
2) Pemeliharaan dan Kalibrasi Alat
3) Kualitas Reagen 4) Pemeriksa
1.6.Hipotesa
1.6.1. Hipotesis Mayor
Ada Perbedaan jumlah sel darah berdasarkan variasi konsentrasi dan volume antikoagulan Na2EDTA metode impedansi elektrik
1.6.2. Hipotesis Minor
a. Ada perbedaan jumlah eritrosit berdasarkan variasi konsentrasi dan volume antikoagulan Na2EDTA metode impedansi elektrik.
b. Ada perbedaan jumlah leukosit berdasarkan variasi konsentrasi dan volume antikoagulan Na2EDTA metode impedansi elektrik.
c. Ada perbedaan jumlah trombosit berdasarkan variasi konsentrasi dan volume antikoagulan Na2EDTA metode impedansi elektrik.