TINJAUAN PUSTAKA
Nilai Ekonomi Cendawan Botryodiplodia theobromae
B. theobromae dilaporkan telah menyebabkan berbagai penyakit
diantaranya mati ujung, busuk akar, busuk buah, bercak daun, dan sapu setan (Punithalingam 1980). Pada jeruk, B. theobromae menyebabkan kematian cabang, pada kakao dapat menyebabkan mati pucuk, busuk buah, dan kanker batang, pada karet menyebabkan mati pucuk, pada pisang dan manggis cendawan B.
theobromae dapat menyebabkan busuk buah.
Di pulau Jawa, cendawan B. theobromae mempunyai arti penting terutama di daerah dataran rendah. Jenis jeruk keprok (Citrus nobilis) dan jeruk besar (Citrus grandis) sering sangat menderita karena serangannya. Di Kabupaten Magetan sekitar 500 ha pertanaman jeruk besar yaitu 85% dari jumlah pohon telah terserang oleh cendawan ini dengan tingkat serangan ringan sampai sedang (22 - 37%) (Wiratno dan Nurbanah 1997). Serangan juga terjadi di Kamerun pada tahun 1985 pada kakao dan menjadi faktor pembatas produksi kakao (Mbenoun et
al. 2008). Pohon karet di Vietnam tahun 1921 terdeteksi terserang cendawan ini
dan menjadi wabah pertama pada tahun 1998 di daerah penanaman karet tradisional di Vietnam (Pha et al. 2010). B. theobromae telah diketahui menyerang pada pisang sejak 1931 dan mampu menyebabkan pembusukan cepat buah pisang di gudang (Goos et al. 1961). Di Brasil, cendawan ini dianggap sebagai masalah utama bagi pertanian karena hal ini terkait dengan beberapa penyakit buah-buahan tropis (Nunes et al. 2008).
Gejala Penyakit Blendok pada Berbagai Tanaman Gejala pada tanaman jeruk (penyakit kulit diplodia)
Cendawan B. theobromae menyerang kulit kayu seperti pada ranting jeruk keprok dan batang jeruk limau (Davis et al. 1987). Serangan ditandai dengan keluarnya blendok (gum) yang berwarna kuning emas dari batang atau cabang-cabang yang besar. Kadang-kadang serangan terbatas pada jalur yang sempit. Setelah beberapa lama kulit yang mengelupas dan luka menjadi sembuh namun sering penyakit berkembang terus sehingga meluas dan menyerang hingga masuk
ke dalam kulit kayu, merusak kambium, kemudian cabang digelang dan mati. Serangan patogen dengan gejala seperti ini disebut diplodia basah. Pada diplodia kering lebih berbahaya, karena gejala permulaan sulit diketahui. Infeksi baru diketahui jika daun telah menguning sehingga cabang yang sakit tidak dapat tertolong. Kulit mengering, dan jika dipotong, kulit dan kayu di bawahnya berwarna hitam kehijauan. Kulit yang sakit membentuk celah-celah kecil, dari dalamnya keluar massa spora yang semula berwarna putih, tetapi akhirnya berwarna hitam (Semangun 2007). B. theobromae tumbuh secara saprofit di kayu mati untuk meningkatkan potensi inokulum sebelum dapat menyebabkan kerusakan yang signifikan pada jaringan sehat (Davis et al. 1987).
Gejala pada tanaman kakao (penyakit botryodiplodia)
Cendawan B. theobromae berperan sebagai parasit lemah pada cabang dan ranting. Cendawan ini hanya dapat menginfeksi jaringan-jaringan yang lemah, atau menjadi patogen sekunder, atau menginfeksi melalui luka-luka karena serangga. Botryodiplodia dapat menyebabkan mati pucuk, busuk buah, dan kanker batang (Semangun 2000).
Gejala pada tanaman karet
Gejala awal ditandai dengan terbentuknya pustul secara sporadis dan kemudian mereka menyatu menjadi lesio luas pada batang karet. Infeksi berat menyebabkan perdarahan pada lateks, retak, kulit membusuk dan gumosis. Pada tanaman yang masih muda, infeksi awal pada tunas muda berupa lesio kecil berwarna cokelat gelap, menyebar cepat, kemudian kulit membusuk, bagian daun yang terinfeksi menjadi kuning karena kurangnya pasokan gizi dan air. Infeksi yang parah menyebabkan kematian pada ranting mulai dari ujung (mati pucuk) (Pha et al. 2010).
Gejala pada tanaman pisang (busuk buah)
Serangan Cendawan B. theobromae mengakibatkan buah yang mulai matang-peram mengalami pembusukan menjadi berwarna cokelat atau hitam. Spora cendawan sudah terdapat pada permukaan buah di lapangan sehingga
apabila buah mulai matang spora akan berkecambah dan mengadakan infeksi. Gejala mulai timbul pada tangkai buah kemudian meluas ke seluruh bagian buah. Gejala yang timbul yaitu buah menjadi lunak dan berair, serta mengeluarkan bau (aroma) yang khas. B. theobromae menyebabkan busuk ujung buah (tip rot), busuk telapak, dan busuk pangkal. Penyakit ini merusak buah pisang yang matang dalam pengangkutan atau simpanan (Semangun 2007).
Gejala pada tanaman manggis
Penyakit busuk buah manggis menunjukkan gejala awal berupa kerak atau burik pada buah muda. Burik berwarna cokelat, pecah-pecah, dan mengeluarkan getah berwarna kuning. Burik biasanya berawal dari ujung buah, lalu menjalar kearah sepal atau sebaliknya (AgroMedia 2009). Kulit tampak kehitaman dan mengkilat kemudian menjadi burik karena cendawan membentuk banyak piknidium yang menghasilkan konidium (Semangun 2007).
Pengendalian Penyakit B. theobromae
Bentuk kegiatan pengendalian penyakit B. theobromae dapat dilakukan dengan cara kultur teknis, mekanis dan kimia. Pengendalian secara kultur teknis yaitu dengan menjaga kebersihan kebun, memangkas ranting-ranting kering, dan memperbaiki drainase kebun. Pengendalian secara mekanis yaitu dengan memotong bagian cabang yang terinfeksi dan bekas potongannya diolesi parafin, membakar atau menimbun bekas pemangkasan, pemotongan dan pembongkaran. Pengendalian secara kimia yaitu dengan menjaga kebersihan alat pertanian seperti pisau, gunting pangkas maupun gergaji atau alat lainnya, sebelum dan setelah digunakan diolesi kapas yang dibasahi alkohol 70% atau 10% pemutih atau klorox, menyaput batang utama, cabang primer dan sekunder dengan fungisida yang ada (bahan aktif benomil atau Cu) atau dengan bubur California yang dapat dibuat sendiri. Penyaputan batang dilakukan paling sedikit dua kali setahun, yaitu pada awal dan akhir musim hujan. Bagian tanaman yang akan disaput, dibersihkan dari blendok dan kulit kering yang mengelupas dengan cara disikat (Wiratno dan Nurbanah 1997).
Taksonomi & Morfologi Cendawan B. theobromae Taksonomi Cendawan B. theobromae
Menurut Semangun (2007) penyakit kulit diplodia disebabkan oleh cendawan Botryodiplodia theobromae Pat., yang dulu banyak dikenal dengan
nama Diplodia natalensis P. Evans. Klasifikasi B. theobromae adalah
(Alexopoulos 1960) : Kingdom : Fungi Phylum : Deuteromycota Kelas : Deuteromycetes Ordo : Sphaeropsidales Famili : Sphaeropsidaceae Genus : Botryodiplodia
Spesies : Botryodiplodia theobromae
Morfologi Cendawan B. theobromae
Botryodiplodia theobromae (Pat.) merupakan sinonim dari Lasiodiplodia theobromae (Pat.) Griff. & Maubl. yang memiliki perkembangbiakan secara
aseksual dari genus Botryosphaeria rhodina (Berk. & MA Curtis) ARX (Mohali
2005). Lasiodiplodia theobromae adalah bentuk anamorf dari Botryosphaeria
rhodina (Berkeley & Curtis) von ARX dan sebagai cendawan yang memiliki kelas
deuteromycetes (Nunes 2008).
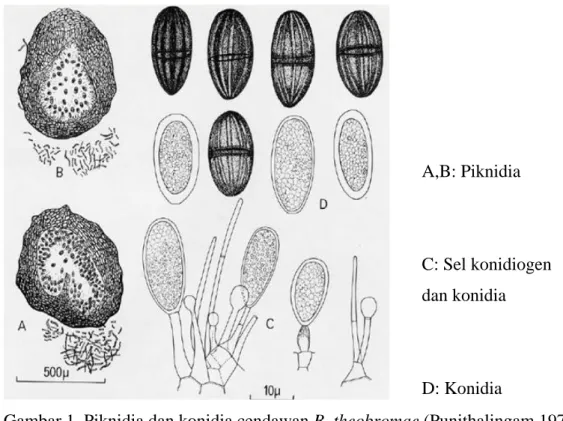
Punithalingam (1976) menyebutkan bahwa karakter morfologi cendawan
B. theobromae ditandai dengan pertumbuhan miselia dari isolat B. theobromae
seperti benang rambut halus atau kapas, miselium udara berlimpah. Koloni mula-mula berwarna sepia berubah menjadi abu-abu kemudian menjadi hitam. Piknidia sederhana, bergerombol, sering agregat, stromatik, ostiolate, lebar sampai dengan 5 mm. Konidia awalnya uniseluler, hialin, granulosa, subovoid sampai ellipsoid-ooblong, berdinding tebal, memotong seperti sekat; konidia matang uniseptate, coklat seperti warna kayu manis, berukuran 20-30 µm x 10-15 µm.
Pada jeruk B. theobromae membentuk piknidium yang tersebar, mula-mula tertutup, kelak pecah, hitam, berpapil, berukuran 150 - 180 µm. Konidium jorong, bersekat satu, tidak berkonstriksi, berwarna gelap, rata-rata berukuran 24
µm x 15 µm, eksosporanya mempunyai jalur-jalur (Semangun 2007). Berbeda dengan pada jeruk, pembentukan piknidium cendawan B. theobromae pada kakao memerlukan cahaya. Piknidium berukuran 135 - 230 µm x 95 - 155 µm. konidium (piknidiospora) mula-mula berwarna coklat muda dan tidak bersekat, tetapi menjelang dilepaskan coklat tua dengan satu sekat melintang, dengan dinding spora sekunder. Konidium berukuran 24 - 30 µm x 11.5 - 13.5 µm, keluar melalui lubang ostiol seperti masa lengket berwarna putih sampai coklat muda. (Semangun 2000). Botryodiplodia theobromae pada pisang memiliki konidia berbentuk elips, mula-mula hialin dan uniseluler kemudian menjadi coklat dan bersekat tunggal. Konidia berukuran 20-30 µm x 10-18 µm (Goos et al. 1961).
Gambar 1 Piknidia dan konidia cendawan B. theobromae (Punithalingam 1976). Pavlic et al. (2004) dalam penelitiannya menemukan ciri umum pada isolat
B. theobromae yang berasal dari Amerika Serikat, Amerika Selatan, Afrika
Selatan dan Asia memiliki konidia berukuran 18–30 x 10–15 µm.
Polymerase Chain Reaction (PCR)
Reaksi berantai polymerase (Polymerase Chain Reaction, PCR) adalah A,B: Piknidia
C: Sel konidiogen dan konidia
nukleotida tertentu secara in vitro. Metode PCR sangat sensitif. Sensitivitas tersebut membuatnya dapat digunakan untuk melipatgandakan satu molekul DNA. Dengan metode PCR, dapat diperoleh pelipatgandaan suatu fragmen DNA sebesar 200.000 kali setelah dilakukan 20 siklus reaksi selama 220 menit. Hal ini menunjukkan bahwa pelipatgandaan suatu fragmen DNA dapat dilakukan secara cepat. Kelebihan lain metode PCR adalah bahwa reaksi ini dapat dilakukan dengan menggunakan template DNA dalam jumlah sangat sedikit (Yuwono 2006).
Prosedur reaksi PCR terdiri dari tiga tahap yaitu denaturasi, annealing (penempelan primer) dan ekstensi (sintesis DNA). Reaksi PCR ditentukan oleh kondisi suhu, denaturasi template, primer, annealing (penempelan primer) dan ekstensi (sintesis DNA). Pada langkah pertama, denaturasi template DNA untai ganda pada suhu 90-95 °C. Kemudian suhu diturunkan hingga sekitar 55 °C, primer menempel ke ujung 5 pada template yang telah terpisah menjadi untai tunggal. Untuk langkah ekstensi, suhu dinaikkan menjadi 72 °C dan primer-target berfungsi sebagai titik awal untuk sintesis DNA baru. Waktu untuk setiap langkah biasanya 1-2 menit. Tiga langkah berurutan ini disebut sebagai satu siklus PCR. Pada siklus kedua, untai DNA yang baru disintesis dipisahkan dari untai asal oleh denaturasi dan masing-masing untai berfungsi lagi sebagai template dalam penempelan dan ekstensi. Secara teoritis, siklus PCR memungkinkan amplifikasi
2n kali lipat DNA target. Biasanya PCR dilakukan sebanyak 30-40 siklus. Namun
banyaknya siklus tergantung pada konsentrasi DNA target didalam campuran reaksi (Edel 1998).
Random Amplified Polymorphic DNA Polymerase Chain Reaction (RAPD-PCR)
Random Amplified Polymorphic DNA (RAPD) merupakan salah satu
teknik molekuler berupa penggunaan penanda tertentu untuk mempelajari keanekaragaman genetika. Dasar analisis RAPD adalah menggunakan mesin PCR yang mampu mengamplifikasi sekuen DNA secara in vitro. Teknik ini melibatkan penempelan primer tertentu yang dirancang sesuai dengan kebutuhan. Tiap primer dapat berbeda untuk menelaah keanekaragaman genetik kelompok yang berbeda. Penggunaan teknik RAPD memungkinkan untuk mendeteksi polimorfisme
fragmen DNA yang diseleksi dengan menggunakan satu primer arbitrasi, terutama karena amplifikasi DNA secara in vitro dapat dilakukan dengan baik dan cepat dengan adanya PCR. Penggunaan penanda RAPD relatif sederhana dan mudah dalam hal penyiapannya. Teknik RAPD memberikan hasil yang lebih cepat dibandingkan dengan teknik molekuler lainnya. Teknik ini juga mampu menghasilkan jumlah karakter yang relatif tidak terbatas, sehingga sangat membantu untuk keperluan analisis keanekaragaman organisme yang tidak diketahui latar belakang genomnya. Teknik RAPD sering digunakan untuk membedakan organisme tingkat tinggi (eucaryote). Namun demikian beberapa peneliti menggunakan teknik ini untuk membedakan organisme tingkat rendah (procaryote) atau melihat perbedaan organisme tingkat rendah melalui piranti organel sel seperti mitokondria (Suryanto 2003).
Menurut WSSP (2009) RAPD PCR memiliki keterbatasan diantaranya hampir semua penanda RAPD adalah dominan karena tidak mampu membedakan apakah suatu segmen DNA dari lokus yang heterozigot (1 salinan) atau homozigot (2 salinan). PCR adalah reaksi enzimatik, sehingga kualitas dan konsentrasi DNA template, konsentrasi komponen PCR, dan kondisi siklus PCR dapat sangat mempengaruhi hasil dari amplifikasi DNA. Ketidaksesuaian antara primer dan DNA template dapat berpengaruh terhadap total produk PCR serta penurunan dalam jumlah produk sehingga mengakibatkan hasil RAPD sulit diinterpretasikan.
Penggunaan RAPD-PCR dalam Analisis DNA Cendawan
Teknik RAPD-PCR memanfaatkan primer acak oligonukleotida pendek (dekamer) untuk mengamplifikasi DNA genom organisme. Prinsip teknik RAPD didasarkan pada kemampuan primer menempel pada DNA template. Primer yang didesain berupa primer tunggal pendek agar dapat menempel secara acak pada DNA genom organisme. Dengan demikian akan terdapat banyak pola fragmen DNA. Perbedaan ini dapat dilihat dengan adanya pola pita pada gel agarosa setelah diwarnai dengan pewarnaan DNA seperti seperti etidium bromide (Sambrook et al. 1989).
Saat ini pendekatan RAPD PCR banyak digunakan untuk menghasilkan molekul penanda yang berguna untuk taksonomi dan untuk karakterisasi populasi
cendawan. Keuntungan utama dari pendekatan ini adalah informasi terkait urutan DNA sebelumnya tidak diperlukan, sehingga setiap primer acak dapat diuji untuk mengamplifikasi DNA setiap cendawan. Primer RAPD dipilih secara empiris dan diuji eksperimental untuk menemukan pola pita RAPD yang polimorfik diantara taksa yang diteliti. Metode RAPD telah berhasil digunakan untuk membedakan dan mengidentifikasi cendawan pada tingkat intraspesifik dan tingkat interspesifik (Edel 1998).