Tahap berikutnya dengan menggunakan rancangan box-behken dengan 3 tingkat kode (-1,0,+1) untuk menjelaskan sifat permukaan respon di wilayah optimum. Sesuai dengan desain ini, total kombinasi perlakuan adalah 15 dengan 3 replikat (Lampiran 5). Hasil rancangan box-behken sesuai dengan persamaan polinomial orde kedua yaitu
j i j i ij k i ii k i i iX X X X Y i 1 2 1 0 (2) Analisis DataSemua percobaan dilakukan secara acak, dan nilai gugus karboksil atau karbonil diambil sebagai respon. Rancangan FF, box-behken dan analisis statistik data dilakukan dengan minitab (versi 16). Analisis statistik dari model dievaluasi dengan analisis varians (ANOVA). Kualitas persamaan model dinilai secara statistik dengan koefisien determinasi R2 dan signifikansi statistik ditentukan dengan nilai p (p-value).
4 HASIL DAN PEMBAHASAN
Penyaringan Faktor dan Pendugaan Daerah Optimum
Meskipun tujuan eksperimental akhir oksidasi onggok adalah optimasi, percobaan pertama yang harus dilakukan adalah penyaringan faktor karena ada banyak faktor potensial yang harus dipertimbangkan. Percobaan ini mengacu pada rencana eksperimental yang bertujuan menemukan faktor-faktor yang memiliki pengaruh signifikan untuk respon kadar gugus karboksil dan karbonil (Tabel 4).
Tabel 4 Output minitab dari hasil rancangan FF
Source Gugus karboksil Gugus karbonil
P Coef P Coef Constant 0.000 0.058 0.015 0.050 Faktor utama Suhu pH Waktu oksidasi Jumlah oksidator Jumlah katalis 0.090 0.369 0.031 0.149 0.239 -0.017 0.008 0.022 0.014 -0.011 0.015 0.384 0.015 0.384 0.015 -0.050 -0.015 -0.050 0.015 0.050 Anova parameter Regresi Lack-of-fit 0.069 0.001 - - 0.011 0.484 - -
Signifikansi statistik diuji pada taraf kepercayaan 95% (α = 0.05) dengan membandingkan nilai p. Dari pengolahan data, faktor yang berpengaruh signifikan dalam meningkatkan kadar gugus karboksil ditunjukkan dengan nilai p < 0.05 hanya waktu oksidasi (0.031). Begitu juga dengan kadar gugus karbonil, dipengaruhi oleh waktu oksidasi (0.015). Akan tetapi, faktor suhu dan jumlah katalis dengan nilai p yang sama turut berpengaruh signifikan untuk gugus karbonil. Sementara faktor yang tersisa dengan taraf kepercayaan < 95% dipertimbangkan tidak signifikan.
Ketika suatu titik optimum akan dicari melalui percobaan yang melibatkan beberapa faktor, seharusnya percobaan tersebut didesain sedemikian rupa agar level-level faktornya mencakup area respon yang mengandung titik optimum (Hadiyat 2013). Akan tetapi, level-level faktor yang telah ditentukan pada rancangan percobaan orde pertama dalam penelitian ini belum tentu berada di daerah optimum, sehingga titik optimum yang diperoleh dari percobaan lanjutan bisa saja jauh dari yang sebenarnya. Jadi, pendugaan daerah di sekitar titik optimum harus dilakukan.
Kalau rancangan percobaan memuat area titik respon optimum diantara level-level faktor yang diselidiki, persamaan akan mengandung lack-of-fit (Myers dan Montgomery diacu dalam Hadiyat 2013). Respon yang mengandung lack-of-fit adalah gugus karboksil dengan nilai p < 0.05. Keberadaan lack-of-lack-of-fit juga menunjukkan ketidakcocokan model regresi dari faktor-faktor bebas terhadap rancangan yang digunakan. Dari uji parameter regresi diperoleh nilai p > 0.05 untuk respon kadar karboksil. Dengan demikian, level-level faktor yang diajukan untuk gugus karboksil telah memuat daerah titik optimum, maka untuk model persamaan titik optimumnya, tidak dapat diwakili oleh rancangan percobaan orde pertama (fraksional faktorial). Langkah selanjutnya dapat langsung diterapkan, yaitu dengan memasukkan level-level faktor pada rancangan orde kedua untuk menduga titik optimum dan persamaan modelnya.
Dari hasil anova untuk respon gugus karbonil, nilai p menunjukkan bahwa persamaan tidak memberikan lack-of-fit, sehingga titik optimum tidak terdapat pada level-level faktor yang diajukan dari rancangan orde pertama. Meskipun rancangan percobaan FF dapat mewakili persamaan model regresinya (nilai p = 0.011), tetapi persamaan tersebut kurang berarti karena tidak dapat menduga daerah titik optimum respon. Berikut persamaan orde pertama kadar gugus karbonil setelah memasukkan dengan nilai koefisien faktor yang signifikan. ŷ = 0.050 – 0.050 X1 – 0.050 X3 + 0.050 X5 (3)
Solusi untuk melacak daerah di sekitar titik optimum respon adalah dengan menggeser (menambah atau mengurangi) level faktor yang diteliti ke arah sesuai dengan peningkatan respon kadar gugus karbonil (Xiaoyong et al. 2009; Hadiyat 2013). Proses ini disebut sebagai steepest ascent/descent, seperti yang dicontohkan pada Gambar 4. Setelah diperoleh level faktor yang menunjukkan respon optimum, percobaan dengan rancangan orde pertama diulangi kembali untuk penyaringan dan pendugaan daerah titik optimum.
Gambar 4 Pergeseran level faktor ke arah respon optimum “Diadaptasi dari Montgomery (1997)”
Proses steepest ascent/descent untuk menentukan respon optimum kadar gugus karbonil tidak dilanjutkan dalam penelitian ini. Adanya dugaan bahwa ikatan C2-C3 banyak terputus pada unit glikosida onggok berhubungan erat dengan pembentukan gugus karbonil, sehingga dapat merusak polimer dan mengurangi derajat polimerisasi. Lagi pula, gugus karboksil lebih banyak terbentuk dengan peluang oksidasi spesifik posisi C6 dan memberikan sifat yang lebih hidrofilik daripada gugus karbonil.
Pembentukan Gugus Karbonil dan Karboksil
Studi sebelumnya telah mengusulkan jalur reaksi berturutan dari oksidasi gugus hidroksil di posisi tertentu cincin glukosida membentuk gugus karbonil. Kemudian sebagian teroksidasi lanjut menjadi karboksil sehingga menghasilkan pati tapioka teroksidasi dengan dua gugus fungsi baru hasil oksidasi (Sangseethong et al. 2009). Atau dengan pendekatan katalitik dan bergantung pada jenis oksidator yang digunakan, jalur reaksi paralel yang menghasilkan gugus karboksil saja dari oksidasi selektif gugus hidroksil primer cincin glukosida polisakarida (de Nooy et al. 1997; Pagliaro 1998; Sorokin et al. 2004).
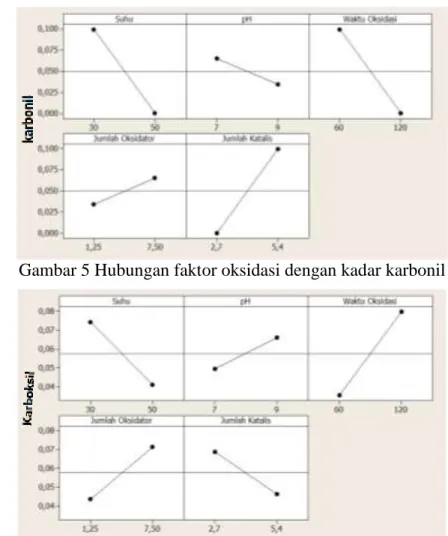
Jalur reaksi selama proses oksidasi dalam penelitian ini tidak diketahui secara pasti. Walau demikian, penjelasan dari hubungan pengaruh faktor-faktor oksidasi dengan pembentukan kedua gugus karbonil dan karboksil (Gambar 5 dan 6) dapat menuntun untuk menduga jalur reaksinya. Dua gambar tersebut jelas menunjukkan bahwa pola hubungan faktor jumlah oksidator dan suhu sama kedua gugus, tetapi tidak demikian halnya dengan faktor pH, jumlah katalis dan waktu oksidasi.
Gambar 5 Hubungan faktor oksidasi dengan kadar karbonil
Gambar 6 Hubungan faktor oksidasi dengan kadar karboksil
Jumlah oksidator sudah sewajarnya memberikan pengaruh yang sama terhadap peningkatan atau penurunan kadar setiap gugus karena merupakan faktor penting dalam reaksi kimia. Jumlah oksidator menunjukkan banyaknya molekul H2O2 yang digunakan saat oksidasi. Jumlah molekul yang lebih banyak memberikan peluang terjadinya reaksi lebih besar sehingga produk reaksinya dapat melimpah.
Meskipun bukan faktor yang berpengaruh signifikan terhadap respon, pH menunjukkan pola pengaruh yang berlawanan pada kedua gugus. Arah hasil reaksi dan jumlah gugus fungsional yang dibentuk dalam molekul onggok selama oksidasi peroksida bergantung pada pH reaksi. Hal tersebut menegaskan hasil penelitian sebelumnya yang dilaporkan oleh Sandhu et al. (2008) dan Sangseethong et al. (2010). Pembentukan gugus karbonil ditemukan lebih tinggi di bawah kondisi netral sementara jumlah gugus karboksil meningkat dengan bertambahnya pH.
Selama proses oksidasi, karbonil yang telah terbentuk sebelumnya bereaksi dengan air menghasilkan kesetimbangan dengan zat antara -diol, lalu teroksidasi lanjut lagi menghasilkan karboksil (Gambar 7). Adisi nukleofilik air ke gugus karbonil berjalan lambat di bawah kondisi netral, tetapi terkatalis pada suasana basa. Arah reaksi akan menuju –diol kalau pH basa dan pembentukan gugus karboksil akan semakin tinggi. Seperti halnya dalam penelitian ini jumlah gugus karboksil ditemukan tinggi dalam kondisi basa.
Gambar 7 Oksidasi karbonil terjadi melalui zat antara -diol
Reaksi terkatalis basa berlangsung lebih cepat karena air terkonversi menjadi ion hidroksida sebagai nukleofilik yang lebih baik. Walau demikian, level alkalinitas juga mempengaruhi jumlah gugus karboksil, seperti yang diamati oleh Sangseethong et al. (2009) pada oksidasi pati tapioka. Dalam rentang pH yang diteliti, pembentukan tertinggi gugus karboksil berada pada pH 8 dan 9. Ketika pH reaksi meningkat menjadi 10 dan 11, jumlahnya menurun.
Pada awalnya reaksi oksidasi pati dipicu oleh kehadiran katalis logam melalui inisiasi H2O2 menjadi radikal hidroksil. Radikal bebas ini sangat reaktif dan mudah bereaksi dengan ikatan C-H pati yang selanjutnya mengalami pembentukan gugus karbonil selama periode awal reaksi. Semakin banyak katalis yang digunakan, akan banyak ikatan C-H yang terputus oleh radikal bebas. Jika jumlah oksidator yang digunakan sedikit dan bukan dalam kondisi basa, tahap oksidasi lanjut karbonil menjadi karboksil tidak terjadi karena sebagian besar reagen oksidan telah dikonsumsi untuk pembentukan karbonil. Oleh sebab itu, kadar karbonil dipengaruhi signifikan oleh jumlah katalis yang digunakan.
Suhu memang hanya berpengaruh signifikan terhadap kadar karbonil, tetapi kedua gugus karbonil dan karboksil diproduksi selama proses oksidasi. Komposisi kedua produk bergantung pada suhu reaksi yang ditentukan oleh kendali kinetika atau kendali termodinamika. Sepertinya gugus karbonil tidak stabil di suhu tinggi, sehingga tidak terbentuk sama sekali dan atau tidak stabil sehingga semuanya berubah menjadi gugus karboksil, karena itu gugus karboksil masih terbentuk sedikit di suhu tersebut. Pada suhu rendah proporsi produk ditentukan oleh laju relatif pembentukan produk. Jika mengikuti jalur reaksi berturutan, semakin banyak karbonil terbentuk, maka semakin banyak juga yang menjadi karboksil. Karena itu, kedua gugus menunjukkan pola yang sama terhadap faktor suhu.
Satu-satunya faktor yang berpengaruh signifikan terhadap kedua gugus fungsi adalah waktu dan menghadirkan pola yang berbanding terbalik. Akan tetapi, jika waktu oksidasi diturunkan di bawah level rendah perlakuan, kadar gugus karbonil yang diperoleh akan lebih tinggi. Sangseethong et al. (2010) melaporkan oksidasi gugus hidroksil dalam molekul pati oleh peroksida hampir selesai dalam 30 menit pertama menghasilkan lebih banyak gugus karbonil. Oleh sebab itu, daerah yang mencakup titik optimasi tidak ada untuk kadar karbonil karena level waktu yang diberikan terlalu tinggi (60 dan 120 menit) sehingga sebagian besar telah berubah menjadi karboksil.
Hubungan antara faktor dan pembentukan kedua gugus fungsi hasil oksidasi belum sepenuhnya dimengerti. Akan tetapi, dari beberapa spekulasi diatas, diusulkan jalur berturutan dengan hanya gugus karboksil saja dihasilkan bukan kedua gugus, walaupun pada dasarnya melalui tahap pembentukan karbonil terlebih dahulu. Dukungan dari data kadar yang didominasi oleh gugus karboksil dalam penelitian ini membenarkan jalur tersebut (Lampiran 4).
Jalur reaksi yang diperoleh berbeda dari penelitian oksidasi H2O2 pada pati tapioka oleh Sangseethong et al. (2010). Penelitian tersebut melaporkan gugus karbonil lebih dominan. Perbedaan ini berhubungan erat dengan kondisi yang digunakan dalam reaksi. Ada kondisi reaksi yang mendukung kestabilan karboksil atau karbonil saja dan ada juga yang mendukung keduanya. Kondisi yang tidak terlalu drastis akan menghasilkan hasil yang baik.
Lokasi gugus hidroksil yang mengalami oksidasi dalam cincin glukosida onggok juga sangat sulit ditentukan. Akan tetapi, pemilihan kondisi yang relevan akan meningkatkan peluang terjadinya oksidasi pada posisi gugus hidroksil yang lebih reaktif.
Interaksi Antarfaktor Oksidasi
Tidak hanya hubungan antara satu faktor dan kedua gugus fungsi, tetapi interaksi antarfaktor juga menentukan kadar gugus dengan hubungan yang kompleks. Gambar 8 dan 9 menunjukkan hubungan interaksi antarfaktor terhadap kadar setiap gugus. Untuk perencanaan langkah selanjutnya, pemilihan level dari interaksi antarfaktor sangat berguna pada proses optimasi, memilih kondisi reaksi, mempercepat laju reaksi dan sebagai alternatif steepest ascent/descent untuk melacak daerah titik optimasi gugus karbonil. Secara singkat, kondisi reaksi dipengaruhi oleh interaksi antar faktor dan hubungannya dapat digunakan untuk memilih level sesuai dengan produk dan lokasi oksidasi yang diinginkan.
Gambar 8 Interaksi antarfaktor kadar karbonil
Dalam penelitan ini diinginkan karboksil sebagai produk dominan dan lokasi oksidasi pada gugus hidroksil primer unit glukosida onggok. Dengan demikian, faktor signifikan karbonil harus diperhitungkan karena pembentukan karboksil melalui jalur reaksi berturutan. Katalis yang banyak, waktu singkat dan suhu rendah akan mendukung pembentukan karbonil. Akan tetapi, hubungan faktor yang berbanding terbalik perlu juga diperhatikan, seperti waktu oksidasi.
Perlu diketahui, katalis mempengaruhi lokasi oksidasi. Jumlah katalis yang cukup, akan memberikan peluang besar bagi radikal bebas untuk menyerang ikatan C-H tempat hidroksil primer berada karena gugus hidroksil primer lebih reaktif dari sekunder. Dalam hal yang sama, pembentukan gugus karbonil bisa saja berkurang. Akan tetapi, Jika katalis berlebih, banyak ikatan C-H yang putus dan bisa menyerang ikatan C-H posisi gugus hidroksil sekunder.
Penetapan kondisi reaksi juga dapat mempengaruhi laju reaksi produk yang diinginkan. Faktor tidak signifikan dapat diatur untuk meningkatkan laju reaksi, tanpa harus khawatir terhadap hubungan berbanding terbalik karena tidak akan memberikan perbedaan nyata. Misalnya, agar laju reaksi mengarah ke produksi gugus karboksil, faktor gugus karbonil yang tidak signifikan dapat dibuat tetap sedemikian rupa sehingga relevan dengan kondisi pembentukan gugus karboksil, seperti pH pada kondisi basa.
Interaksi antarfaktor oksidasi dan pengaruhnya terhadap kondisi reaksi maupun proses optimum gugus karboksil akan dapat dipahami lebih jauh melalui pemberian perlakuan dalam rancangan percobaan. Dengan pendekatan tersebut dapat diperoleh pemahaman terhadap kondisi optimum dari suatu proses dibandingkan dengan hanya memperkirakan hasilnya.
Titik Optimum Faktor Oksidasi
Meskipun kondisi reaksi telah diatur dengan cermat, penelaahan mengenai respon tidak akan luput dari gangguan berbagi faktor yang memang tidak dapat dibuat persis sama bagi setiap obyek dalam percobaan. Karena itu, penentuan respon maksimum atau minimum kadar gugus karboksil jangan hanya terbatas pada level-level yang dicobakan saja (Lampiran 5). Nilai koefisien regresi model persamaan orde kedua (Tabel 5) dari metode permukaan respon dapat digunakan untuk mendeteksi titik optimum respon yang muncul diantara selang level yang dicobakan.
Tabel 5 Output minitab persamaan model orde kedua kadar karboksil Source P Coef Constant 0.000 0.107 Linear Suhu Jumlah katalis Waktu oksidasi 0.000 0.000 0.002 0.001 0.031 0.019 0.023 Square Suhu*Suhu Katalis*Katalis Waktu*Waktu 0.001 0.895 0.000 0.001 0.0006 0.0398 0.0305 Interaction Suhu x Katalis Suhu x Waktu Katalis x Waktu 0.006 0.002 0.017 0.246 -0.0242 0.0149 0.0056 Anova parameter Regresia 0.000 aR-Sq = 98.68% R-Sq(adj) = 96.31%
Penaksiran titik optimum respon dimulai dengan memeriksa signifikansi model. Tabel 5 menunjukkan bahwa model linear, square dan interaksi berpengaruh signifikan karena nilai p ketiganya kurang dari α = 0.05 yang didukung dengan nilai R2 = 98.68%. Jadi, model yang tepat untuk persamaan orde kedua kadar gugus karboksil adalah model kuadratik. Selain signifikansi model, tabel menunjukkan pula hasil uji kecocokan faktor dan variabel lainnnya terhadap model yang dikonversi ke dalam nilai p. Uji parameter model menunjukkan faktor suhu, jumlah katalis, waktu oksidasi memiliki pengaruh penting terhadap kadar gugus karboksil. Lagi pula, uji parameter regresi serentak membuktikan bahwa semua variabel memberikan sumbangan yang berarti terhadap model (p = 0.000). Hasil analisis memberikan model seperti berikut,
ŷ = 0.107 + 0.031 X1 + 0.019 X2 + 0.023 X3 + 0.0006 X12 + 0.0398 X22
+ 0.0305 X32 - 0.0224 X1X2 + 0.0149 X1X3 + 0.0056 X2X3 (4) Nilai-nilai koefisien regresi pada model orde kedua dapat disusun matriks sebagaimana berikut, 3 2 1 b 33 32 31 23 22 21 13 12 11 2 / 2 / 2 / 2 / 2 / 2 / B
β1, β2 dan β3 merupakan masing-masing koefisien dari suhu, jumlah katalis dan waktu oksidasi, sehingga matriks b dan B adalah
0233 , 0 0187 , 0 0299 , 0 b 03051 . 0 00278 . 0 00748 , 0 00278 . 0 03981 . 0 01214 , 0 00748 . 0 01214 . 0 00061 , 0 B (5)
Dari matriks (5) dimasukkan dalam persamaan matriks 𝑋o=(1
2) B
-1b (6)
Sehingga didapatkan matriks
1419 . 1 7091 . 0 8335 . 2 Xo
Xo disebut sebagai titik stasioner yang selanjutnya digunakan untuk mencari titik optimum pada persamaan berikut,
Xoi =Xi- X
Si (7) Dari perhitungan persamaan (7) diperoleh nilai aktual titik optimum yang bisa menghasilkan respon semaksimum mungkin kadar gugus karboksil, yaitu suhu 78.335 oC, jumlah katalis 4.301 ml dan waktu 83.613 menit.
Hubungan Antarfaktor Oksidasi yang Signifikan
Visualisasi permukaan respon kadar gugus karboksil digambarkan dalam bentuk kontur (Gambar 10). Kontur tersebut membantu untuk memahami hubungan antarfaktor signifikan selama proses oksidasi. Terlihat jelas dalam kontur bahwa interaksi antarfaktor erat hubungannya dengan pembentukan gugus karboksil maupun karbonil. Alur hijau gelap menunjukkan interaksi antar faktor yang menghasilkan jumlah kadar karboksil tertinggi dan sebaliknya pada alur biru gelap.
(a) (b)
(c)
Gambar 10 Hubungan antara faktor katalis dan waktu pada rentang suhu (a) 30 oC (b) 40 oC (c) 50 oC
Pada kontur tersebut terlihat perbedaan pembentukan gugus karboksil di setiap rentang suhu yang digunakan. Rentang suhu 30-40 oC kadar gugus karboksil sedikit dalam waktu singkat karena pada kisaran suhu tersebut mendukung kestabilan gugus karbonil dan juga ada pengaruh dari katalis. Akan tetapi, ketika suhu meningkat, banyak gugus karbonil telah terkonversi menjadi karboksil.
Morfologi dan Struktur Granula OT
Gambar granula onggok yang diperoleh melalui pemayaran SEM (Gambar 11) tidak hanya menampilkan perbedaan bentuk dan ukuran granula, tetapi juga menunjukkan perubahan yang terjadi dalam morfologi onggok sebelum dan setelah oksidasi. Analisis SEM menunjukkan hasil aktivitas H2O2 dalam mengubah struktur dan morfologi onggok.
(a) (b)
Gambar 11 Foto SEM (2000 x) dari onggok (a) original (b) teroksidasi H2O2 Granula pati onggok original memiliki bentuk bulat dengan ujung terpotong di satu sisi. Permukaan granula onggok original itu mulus tanpa retak atau celah apapun (Gambar 11a). Jika ada sedikit retak dan goresan terbentuk, paling mungkin terbentuk selama tahap preparasi sampel. Secara umum, pola yang sama ditemukan pada morfologi eksternal granula pati tepung tapioka, seperti yang diamati oleh Sangseethong et al. (2010).
Tanda-tanda kerusakan berupa permukaan kasar dan banyak kerutan muncul setelah onggok dioksidasi dengan peroksida. Keriput dapat diamati pada permukaan beberapa granula besar onggok, bahkan menjadi percahan dalam granula kecil (Gambar 11b). Lipatan tambahan tidak terlihat pada semua granula, tetapi muncul terutama pada granula besar.
Hasil yang sama diperoleh oleh Pietrzyk dan Fortuna (2005) yang menemukan retakan dan lipatan tambahan dalam tepung kentang, gandum dan jagung yang dioksidasi dengan peroksida. Di samping itu, Sangseethong et al. (2010) melaporkan dalam waktu oksidasi 120 dan 300 menit, permukaan granula tepung tapioka teroksidasi menjadi kasar dan muncul beberapa celah.
Perubahan morfologi onggok setelah oksidasi dapat dijelaskan dengan peninjauan struktur melalui spektrofotometer FTIR. Spektrum onggok original dan teroksidasi (Gambar 12) memperlihatkan jenis gugus fungsi yang dikandung berdasarkan serapan bilangan gelombangnya. Pencirian ini dapat membuktikan secara kualitatif keberhasilan proses oksidasi onggok.
Gambar 12 Spektrum FTIR onggok original (---) dan oksidasi (---) Jumlah satuan gugus fungsi antara kedua spektrum relatif sama, misalnya terdapat puncak serapan lebar pada bilangan gelombang 3437.15-3205.69 cm-1 yang merupakan pita serapan khas dari vibrasi ulur –OH dan serapan khas vibrasi ulur C-H muncul pada bilangan gelombang 2931.80 cm-1. Hasil yang serupa juga diperoleh oleh Kurniadi (2010) dan Mas’ud et al. (2013). Jadi, dengan tidak adanya perbedaan yang terlalu signifikan diantara keduanya menunjukkan tidak terjadi kerusakan yang fatal pada onggok teroksidasi.
Meskipun hasil interpretasi spektrum IR memperlihatkan secara keseluruhan tidak ada perbedaan serapan gugus antara OO dan OT, beberapa pita serapan menunjukkan secara detail perubahan ongggok setelah oksidasi pada spektrum OT. Pita serapan kuat dan lebih tajam pada bilangan gelombang 1639.49 cm-1 yang mengindikasikan bahwa gugus fungsi C=O lebih banyak daripada onggok original, serapan dengan intensitas kecil pada bilangan gelombang 1338.60 cm-1 menunjukkan vibrasi ulur C-O gugus fungsi karboksil dan menghilangnya bilangan gelombang 1056.99 cm-1 dari serapan vibrasi ulur C-O gugus hidroksil primer.
Proses Kopolimerisasi Grafting Hidrogel OT
OT digunakan sebagai kerangka utama pencangkokan dan perubahan sifat fisikokimianya mendukung proses dispersi pada saat grafting. Peningkatan stabilitas dispersi pati merupakan salah satu kunci karakteristik yang diinginkan dari onggok teroksidasi. Telah dipelajari bahwa gugus karboksil yang hadir dalam molekul pati akan menghambat retrogradasi, sehingga meningkatkan stabilitas viskositas pati. Air juga dapat membentuk ikatan hidrogen dengan elektron tidak berpasangan dalam gugus karboksil pada OT, sehingga meningkatkan kelarutannya. Karena itu, OT sangat mudah terdispersi merata dalam medium air dibandingkan dengan onggok original.
Sintesis hidrogel dilakukan melalui kopolimerisasi pencangkokan menggunakan metode simultan untuk AA-OT dan tidak simultan untuk AM-OT. Masing-masing grafting telah dioptimasi dengan metodenya dan cocok sehingga tidak ada perbedaan diantara keduanya, kecuali perbedaan urutan penambahan bahan. Di samping itu, dalam proses grafting yang perlu dicegah adalah pembentukan homopolimer. Dengan mengondisikan grafting dalam atmosfer gas nitrogen bertujuan menghilangkan oksigen pada sistem reaksi karena akan menyebabkan terbentuknya radikal peroksida yang dapat menghambat reaksi kopolimerisasi. Dengan demikian, pembentukan homopolimer dapat dihindari (Kurniadi 2010).
Radikal bebas pada tahap inisiasi dihasilkan dari dekomposisi APS dalam berbagai reaksi. Menurut Bhattacharaya et al. (2009), ada 2 cara pembentukan pusat aktif radikal oleh inisiator APS. Pertama, •OSO3− bereaksi dengan air membentuk •OH yang kemudian akan bereaksi membentuk radikal bebas pada substrat polimer. Alternatif kedua, •OSO3− langsung bereaksi membentuk radikal bebas pada substrat polimer. Pembentukan pusat aktif radikal secara keseluruhan menaikkan energi molekular pada onggok dan dapat meningkatkan kereaktifannya.
Tahap selanjutnya adalah propagasi dan terminasi. Radikal OT akan bereaksi dengan monomer. Monomer yang tercangkok ini selanjutnya akan terpolimerisasi membentuk polimer hidrogel. Monomer AA dan AM yang tidak tercangkok dapat mengalami inisiasi juga, kemudian bereaksi dengan monomer lainnya dan tumbuh menjadi rantai polimer PAA dan PAM. Tahap terminasi terjadi ketika radikal OT yang tercangkok oleh monomer bereaksi dengan penaut-silang MBA membentuk kopolimer bertautan penaut-silang (Lampiran 6).
Hidrogel yang terbentuk diendapkan menggunakan metanol dan aseton. Metanol berfungsi mengikat air yang ditambahkan selama proses sintesis. Penggunaan metanol juga dapat mengekstraksi homopolimer karena bersifat polar. Hidrogel kemudian direfluks dengan aseton untuk memisahkan kopolimer yang terbentuk dari homopolimernya. Memisahnya homopolimer dapat dilihat dari warna keruh pada aseton dan gel yang menjadi lebih kaku dan keras. Gel kemudian dikeringkan pada suhu 60 °C, dihaluskan menjadi granula dengan ukuran 80 mesh, lalu diuji daya serap dan karakteristiknya.
Swelling Hidrogel dalam Air
Rasio perbandingan berat hidrogel dalam keadaan menyerap air (swelling) terhadap berat keringnya merupakan parameter utama dari sebuah hidrogel khususnya sebagai bahan kandidat absorben. Keberhasilan grafting onggok dengan monomer juga dapat dilihat dari swelling (Tabel 6). Dengan membandingkan swelling antara hidrogel dari OO dan OT pada pengukuran daya serap air dapat membuktikan hipotesis yang diusulkan.
Tabel 6 Perbandingan daya serap air setiap hidrogel
No Jenis Monomer Ulangan
Hidrogel OOa Hidrogel OTa Daya Serap (g/g) Rerata Daya Serap (g/g) Rerata 1 AA 1 341.2604 336.2796 506.5877 580.7405 2 331.2987 654.8934 2 AM 1 39.5648 39.1562 40.3084 39.0143 2 38.7475 37.7201 3 AM saponifikasi 1 289.5280 296.2075 539.6334 538.3021 2 302.8870 536.9708
aberat kering 0.1 g; OO: onggok original, OT: onggok teroksidasi, AA: asam akrilat, AM: akrilamida.
Pengukuran daya serap air dilakukan terhadap hidrogel OO sebagai blangko, hidrogel OT-AA dan hidrogel OT-AM tanpa dan dengan saponifikasi menggunakan air distilasi selama 24 jam peremdaman.Hidrogel dengan monomer AA memiliki kinerja serap yang lebih baik dibandingkan dengan AM karena dari awal telah memiliki gugus karboksil lebih banyak sehingga sifatnya lebih hidrofilik. Dalam hal yang sama, daya serap air hidrogel dengan monomer AM meningkat dengan saponifikasi. Peningkatan ini berhubungan dengan bertambahnya muatan dalam sistem polimer akibat adanya konversi gugus fungsi amida (-COONH2) menjadi gugus karboksil (Willett dan Finkenstadt 2006; Teli dan Waghmare 2009).
Rerata daya serap air hidrogel OT lebih tinggi dua kali lipat daripada hidrogel OO. Hal yang menarik dapat diamati pada hidrogel dengan monemer AM sebelum dan setelah saponifikasi. Kedua hidrogel memberikan daya serap air yang hampir sama sebelum saponifikasi, tetapi setelah saponifikasi peningkatan swelling keduanya berbeda siginifikan. Perbedaan ini erat hubungannya dengan bertambahnya sifat hidrofilik dari hidrogel OT. Lanthong et al. (2006) melaporkan bahwa penyerapan hidrogel meningkat seiring dengan bertambahnya jumlah gugus fungsi yang bersifat hidrofilik dan ionik. Walau demikian, dengan mengabaikan perbedaannya, hasil ini telah menunjukkan bahwa semua hidrogel yang terbentuk dapat dikatakan polimer superabsorben karena mampu menyerap air hingga lebih dari 100 kali lipatnya (>10.000%) (Zhang et al. 2006).
Penelitian sebelumnya telah berhasil mensintesis superabsorben dengan swelling mencapai 1040.08 g/g untuk OO-AM (Mas’ud et al. 2013) dan 761.01 g/g untuk OO-AA (Fitriyanto 2013). Perbedaan swelling dengan hidrogel dalam penelitian ini tidak hanya berhubungan dengan pengaruh jumlah gugus hidrofiliknya. Akan tetapi, faktor lain seperti proses grafting, konsentrasi inisiator dan komposisi penaut silang turut mempengaruhi kapasitas serap hidrogel.
Daya serap air berkurang ketika konsentrasi APS lebih rendah dari 1.0% (%w) karena kekuatan gel bertambah akibat cabang dengan berat molekul rendah tercangkok pada pati. Demikian halnya, jika terlalu banyak titik silang akibat bertambahnya penaut silang MBA akan meningkatkan kekuatan gel dan mengurangi penyerapan air karena rantai yang kaku mengurangi tekanan osmosis gel sehingga air keluar (Lanthong et al. 2006). Oleh sebab itu, pengaruh inisiator dan penaut silang terhadap hidrogel OT perlu dikaji lebih lanjut.
Pengaruh Larutan NaCl terhadap Swelling Hidrogel
Karena hidrogel onggok dengan monomer AA dan AM semacam gel anionik, maka lingkungan sekitarnya termasuk konsentrasi ionik sangat mempengaruhi daya serapnya. Lampiran 7 menunjukkan perbandingan antara daya serap air setiap hidrogel OT dan hidrogel OO dengan swelling yang telah dioptimasi mencapai 761.01 g/g. Penurunan penyerapan air bergantung pada konsentrasi dari larutan NaCl seperti ditunjukkan pada Gambar 13. Terlihat dengan meningkatnya konsentrasi larutan NaCl, rasio daya serap air semua hidrogel relatif mengalami penurunan.
Gambar 13 Perbedaan daya serap air hidrogel dalam larutan NaCl. hidrogel OO-AA, hidrogel OT-AM, hidrogel OT-AA.
Hubungan kapasitas serap dengan konsentrasi garam dapat dijelaskan dengan persamaan berikut,
Q = k [garam]n (8) Persamaan yang diperoleh dari kurva kapasitas serap dalam larutan NaCl untuk hidrogel OO-AA adalah y = 29.229 X-0.34. Nilai n menunjukkan bahwa diatas konsentrasi 0.34 M, daya serap hidrogel sudah tidak berbeda signifikan dan nilai k merupakan daya serap air ketika konsentrasi NaCl 1 M. Selanjutnya, hidrogel OT-AA dan OT-AM memiliki persamaan masing-masing y = 52.919 X-0.173 dan y = 39.661 X-0.296, nilai n menunjukkan bahwa diatas konsentrasi 0.173 M untuk hidrogel OT-AA dan 0.296 M untuk hidrogel OT-AM daya serapnya sudah tidak berbeda signifikan, lebih baik dari hidrogel OO.
D ay a se ra p air ( g /g ) NaCl [M]
Hidrogel OT lebih toleran dalam larutan garam dibandingkan dengan hidrogel OO. Dari grafik terlihat daya serap air hidrogel dari OT cenderung konstan pada konsentrasi NaCl di atas nilai n dibandingkan dengan hidrogel OO masih terus menurun. Dari rata-rata perbedaan daya serap air di atas nilai n dalam larutan garam, hidrogel OT-AA dan hidrogel OT-AM masing-masing memiliki swelling 26 dan 12.5 kali lebih besar daripada hidogel OO-AA. Hal ini memperkuat bukti bahwa gugus fungsi hidrofilik hidrogel OT lebih banyak sehingga karakter toleran garamnya lebih baik daripada hidrogel OO.
Penjelasan berkurangnya daya serap air pada larutan garam berhubungan erat dengan penurunan tekanan osmosis. Ion-ion yang terikat pada jaringan hidrogel bersifat imobil yang dapat dianggap terpisah dari larutan luar dengan adanya membran. Jika hidrogel direndam dalam air, akan terjadi perbedaan tekanan osmosis dengan larutan luar, sehingga air terdifusi ke dalam jaringan dan hidrogel jadi mengembang. Kehadiran ion di sekitar larutan jaringan hidrogel akan menetralkan saling tolakan dari ion tetap pada jaringan itu sendiri, sehingga menurunkan perbedaan tekanan osmotik antara gel dan larutan luar (Kiatkamjornwong et al. 2000; Lanthong et al. 2006; Erizal 2010).
Pencirian Hidrogel OT
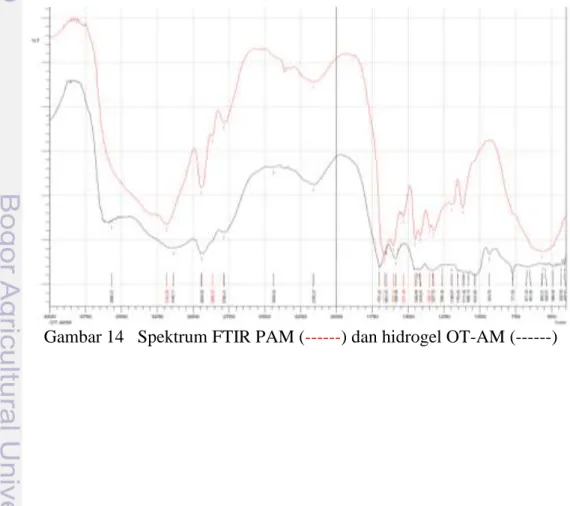
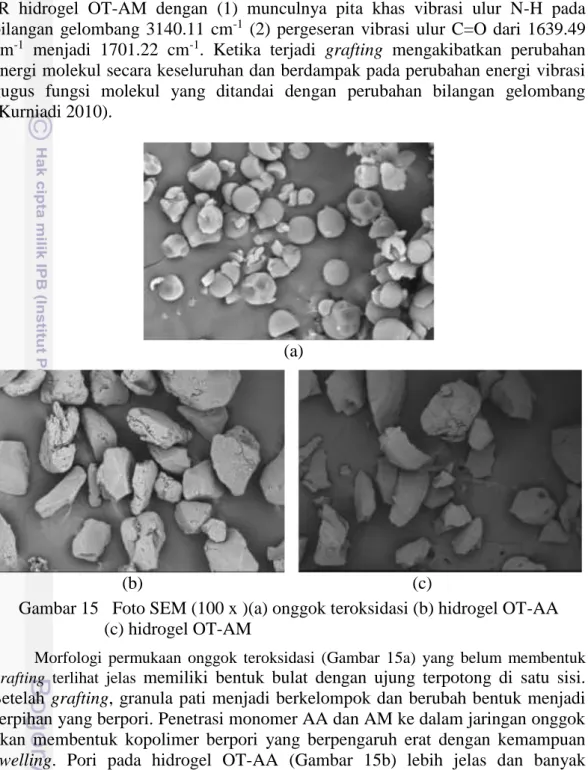
Analisis utama yang menyangkut keberhasilan proses grafting ini diamati pada Spektrum IR dan Foto SEM. Pada spektrum IR dicontohkan perbandingan antara hidrogel PAM dan hidrogel OT-AM (Gambar 14) dan perbandingan lainnya dapat dilihat di Lampiran 8. Analisis morfologi dari pemayaran SEM dilakukan pada onggok teroksidasi, hidrogel OT-AA dan OT-AM (Gambar 15).
Spektrum IR hidrogel OT hampir sama dengan spektrum IR PAM. Hal ini menunjukkan campuran AM lebih dominan dibandingkan dengan OT. Terjadinya pencangkokan dan penautan silang OT dengan AM dapat dilihat pada spekturm IR hidrogel OT-AM dengan (1) munculnya pita khas vibrasi ulur N-H pada bilangan gelombang 3140.11 cm-1 (2) pergeseran vibrasi ulur C=O dari 1639.49 cm-1 menjadi 1701.22 cm-1. Ketika terjadi grafting mengakibatkan perubahan energi molekul secara keseluruhan dan berdampak pada perubahan energi vibrasi gugus fungsi molekul yang ditandai dengan perubahan bilangan gelombang (Kurniadi 2010).
(a)
(b) (c)
Gambar 15 Foto SEM (100 x )(a) onggok teroksidasi (b) hidrogel OT-AA (c) hidrogel OT-AM
Morfologi permukaan onggok teroksidasi (Gambar 15a) yang belum membentuk
grafting terlihat jelas memiliki bentuk bulat dengan ujung terpotong di satu sisi.
Setelah grafting, granula pati menjadi berkelompok dan berubah bentuk menjadi serpihan yang berpori. Penetrasi monomer AA dan AM ke dalam jaringan onggok akan membentuk kopolimer berpori yang berpengaruh erat dengan kemampuan swelling. Pori pada hidrogel OT-AA (Gambar 15b) lebih jelas dan banyak daripada pori hidrogel OT-AM (Gambar 15c). Oleh sebab itu, daya serap air hidrogel OT-AA lebih tinggi dari pada hidrogel OT-AM.