Pemisahan Zirkonium(IV) dan Hafnium(IV) Secara Ekstraksi Pelarut Menggunakan Ekstraktan Senyawa Pirazolone Hasil Sintesis
Drs. Amiruddin, M.Si1) dan Dr. Ibnu Khaldun, M.Si1)
1)
Program Studi Pendidikan Kimia, FKIP Universitas Syiah Kuala
ABSTRAK
Beberapa senyawa pirazolon yang dinamakan dengan, 1-fenil-3-metil-4-benzoil-5-pirazolon (HPMBP), 4-Adipoilbis(1-fenil-3-metil-5-1-fenil-3-metil-4-benzoil-5-pirazolon) (H2AdBP) dan
N,N’-etilenbis(1-fenil-3-metil-4-benzoilpirazolonemin) (H2PE) telah berhasil
disintesis dan digunakan pada ekstraksi pelarut terhadap pemisahan zirkonium dan hafnium tetravalen dari larutan asam klorida. Ekstraksi dari zirkonium(IV) / hafnium(IV) memperlihatkan suatu mekanisme pertukaran ion:
MO2+(aq) + 2 HA (org) ⇄ MOA2(org) + 2H+(aq)
dimana M = Zr(IV) / Hf(IV) dan HA = HPMBP atau H2AdBP atau H2PE. Variasi
dari D ([MOA2] (org) / [MO2+](aq); angka perbandingan koefisien distribusi dari
spesies yang terekstraksi pada saat kesetimbangan) meningkat dengan naiknya konsentrasi asam dan konsentrasi ekstraktan secara linear dengan kemiringan garis 2. Tetapan kesetimbangan (Kex) kompleks yang terekstraksi mengikuti orde
H2AdBP>HPMBP>H2PE.
PENDAHULUAN
Zirkon (ZrSiO4) merupakan salah satu mineral strategis dan bernilai
ekonomis untuk kebutuhan industri teknologi maju. Mineral tersebut banyak terkandung di dalam pasir laut di Kepulauan Riau seperti Bangka, Belitung dan Singkep. Selain itu deposit zirkon juga terdapat di Kalimantan Barat dan Sulawesi Tengah.
Hingga saat ini, Indonesia belum mampu memanfaatkan potensi ekonomis dari pasir zirkon secara optimal khususnya pasir laut di Kepulauan Riau, kecuali dijual ke Singapura untuk reklamasi pantai dengan harga yang sangat murah yaitu 1,50 dollar AS/ton (Kasoep R, 2003). Padahal dengan perlakuan secara fisik saja beberapa mineral asosiasi zirkon dalam pasir laut seperti rutil, ilmenit, lekoksen dan bijih besi dapat dipisahkan, sehingga diperoleh kadar zirkon sekitar 65%. (Abdel-Rehim, 2005). Mineral-mineral asosiasi zirkon tersebut mempunyai harga yang cukup tinggi di pasar dunia, yakni: rutil 470-500 dollar AS/ton, ilmenit 85 -110 dollar AS/ton, lekoksen 350-380 dollar AS/ton. Apabila mineral zirkon dapat dibuat
menjadi Yttria stabilized zirconia (YSZ = Y2O3–ZrO2) atau scandia stabilized zirconia (ScSZ = Sc2O3–ZrO2 ) maka nilai jualnya sangat tinggi.
Ada tiga teknologi yang dapat diaplikasikan untuk mendapatkan ZrO2 murni
yaitu: (1) ekstraksi pelarut, (2) kristalisasi bertingkat dan (3) destilasi ekstraktif. Metode yang paling umum digunakan ialah ekstraksi pelarut, karena peralatan operasionalnya lebih sederhana. Meskipun demikian, metode ekstraksi pelarut memiliki beberapa keterbatasan, salah satu diantaranya yaitu ekstraktan yang digunakan sebagian larut dalam air sehingga kurang efektif bila digunakan berulang-ulang. Untuk mengatasi masalah ini diperlukan suatu ekstraktan yang sedikit larut dalam air namun mempunyai kemampuan besar untuk mengekstraksi ion-ion logam. Salah satu jenis ekstraktan yang dapat digunakan yaitu senyawa yang berasal dari pirazolon.
Sejak dua dekade terakhir ini, para ilmuwan telah banyak mensintesis jenis ligan baru yang lebih berdayaguna dan lebih selektif daripada ligan komersial yang biasa digunakan dalam industri. Ligan-ligan tersebut pada umumnya berbentuk sepit (chelate), seperti senyawa crown ether, calixarene dan pyrazolone. (Cote, G., 2000). Pada penelitian ini telah disintesis tiga buah senyawa pirazolon yaitu 1-fenil-3-metil-4-benzoil-5-pirazolon (HPMBP), 4-Adipoilbis(1-fenil-3-metil-5-pirazolon) (H2AdBP) dan N,N’-etilenbis(1-fenil-3-metil-4-benzoilpirazolonemin) (H2PE).
EKSPERIMEN 1. Bahan dan alat
Bahan-bahan yang digunakan adalah: 1-phenyl-3-methyl-5-pyrazolone,
adipoyl chloride, ethylendiamine, benzoyl chloride, 1,4-dioxane, Ca(OH)2, CaCO3,
HCl, chloroform, hexane, HNO3, NaOH, NaNO3, toluene, larutan bufer pH 4 dan pH
7, kertas indikator universal, KCl, air bebas mineral serta aseton, etanol teknis, ZrOCl2.8H2O, dan HfCl4.
Alat-alat yang digunakan adalah: seperangkat alat refluks, pengaduk magnetik, mikro buret 5 mL, tabung berdinding ganda yang dilengkapi termostat, pH meter, oven dan alat-alat gelas serta alat-alat penunjang lainnya (Spektrofotometri UV/Vis, FTIR, dan elementer analysis)
2. Prosedur Kerja
2.1 Sintesis senyawa HPMBP
Sintesis HPMBP dilakukan sesuai dengan prosedur yang telah dilakukan sebelumnya (Khaldun and Brunette, 1999) berdasarkan metode Jensen (1959). Direaksikan antara 1-phenyl-3-methyl-5-pyrazolone dan benzoyl chloride dengan katalis Ca(OH)2 dalam pelarut 1,4-dioxane dengan perbandingan mol (1:1:2). Reaksi
sintesis dilakukan di dalam alat refluks selama 3 jam pada suhu 1250C. Selanjutnya dibiarkan hingga suhu larutan menjadi normal. Untuk menghilangkan katalis Ca(OH)2 ditambahkan 250 mL larutan HCl 2M sambil dikocok kuat-kuat. Endapan
yang terbentuk disaring, dicuci dengan aquades hingga pH netral dan direkristalisasi dengan etanol. Rendemen ditimbang dan dikarakterisasi.
Untuk sintesis senyawa H2AdBP dilakukan dengan metode yang sama seperti
sintesis HPMBP tetapi senyawa benzoyl chloride diganti dengan adipoyl chloride dan hasil sintesis direkristalisasi menggunakan pelarut chloroform-hexane sesuai prosedur (Remya, et.al., 2005).
Senyawa H2PE disintesis dengan cara merefluks HPMBP hasil sintesis
dengan ethilendiamine dalam pelarut etanol sesuai prosedur (Uzoukwu, et.al., 1998).
2.2 Penentuan berat molekul ligan
Penentuan berat molekul ligan dilakukan secara titrasi dua fasa menggunakan alat tabung berdinding ganda. Dibuat dua buah larutan dalam fasa air dan dalam fasa organik. Fasa air dibuat dengan mencampurkan sejumlah larutan HNO3 0,01M dan
NaNO3 0,99M. Kekuatan ion dalam fasa air (Vaq) dipertahankan = 0,1 M. Fasa
organik (Vorg) dibuat dengan melarutkan 0,1368 g HPMBP ke dalam 50 mL toluene.
Sebanyak 35 mL fasa organik (Vorg) dan 30 mL fasa air (Vaq) dimasukkan ke
dalam sebuah tabung berdinding ganda (diameter 7 cm, dan tinggi 15 cm) yang dilengkapi termostate (suhu 25 0,1 oC) dan stirer magnetik. Larutan diaduk dengan kecepatan 300 rpm, sambil dititrasi dengan larutan standar NaOH 0,1N (titrisol) melalui mikro buret 5 mL. Dibuat grafik antara potensial (E) versus volume NaOH 0,1 N. Dari grafik tersebut ditentukan titik ekivalen ligan berdasarkan metode Gran (Rudan-Tasic and Klofutar, 1998).
2.3 Penentuan kemurnian senyawa hasil sintesis
Kemurnian senyawa HPMBP dianalisis dengan cara berturut-turut: uji titik leleh, FTIR, dan analisis elementer (penentuan %C, %H dan %N). Untuk ligan yang lain (H2AdBP dan H2PE) dilakukan dengan cara yang sama.
2.4 Ekstraksi ZrO2+/HfO2+
Ke dalam sebuah tabung berdinding ganda dimasukkan fasa air dan fasa organik dengan volume yang sama. Fasa air mengandung ion ZrO2+ dengan konsentrasi (1,0 – 5,0) x 10-4 mol.L-1 dan 1,0 mol.L-1 NaNO3. Fasa organik (CHCl3)
mengandung ligand (HPMBP, H2AdBP atau H2PE) dengan konsentrasi (0,05-0,10)
mol.L-1. Larutan diatur pH-nya dengan cara menambahkan larutan NaOH 0,1M atau HCl 0,1M dan diaduk menggunakan mechanical shaker selama 20 menit. Setelah kedua larutan terpisah diambil masing-masing 1 mL aliquot dan ditentukan konsentrasi ion logam secara spektrofotometri dengan metode alizarin sulfonat (Abbaspour, A. and Baramakeh, L., 2006).
Selain pengaruh pH ditentukan juga pengaruh konsentrasi ligan dan jenis ligan terhadap konstanta distribusi zirkonium dan hafnium (DM(IV)).
Data yang diperoleh akan diolah dan dibuat dalam bentuk grafik yaitu:
(1) log DM(IV) vs pH (untuk masing-masing jenis ligan dan jenis unsur )
(2) %E vs pH (untuk masing-masing jenis ligan dan jenis unsur) (3) log DM(IV) vs konsentrasi ligan (HPMBP, H2AdBP atau H2PE) pada
pH konstan.
HASIL DAN PEMBAHASAN
1. Penentuan berat molekul HPMBP dan H2AdBP secara titrasi dua fasa
Senyawa HPMBP dan H2AdBP bersifat asam lemah, karena memiliki gugus
hidroksil –OH. Atom H dari gugus –OH ini dapat bertindak sebagai proton dan dapat terdisosiasi dalam larutan air. Oleh karena itu, berat molekul senyawa HPMBP, H2AdBP dan H2PE dapat ditentukan dengan cara titrasi asam-basa.
HPMBP H2AdBP
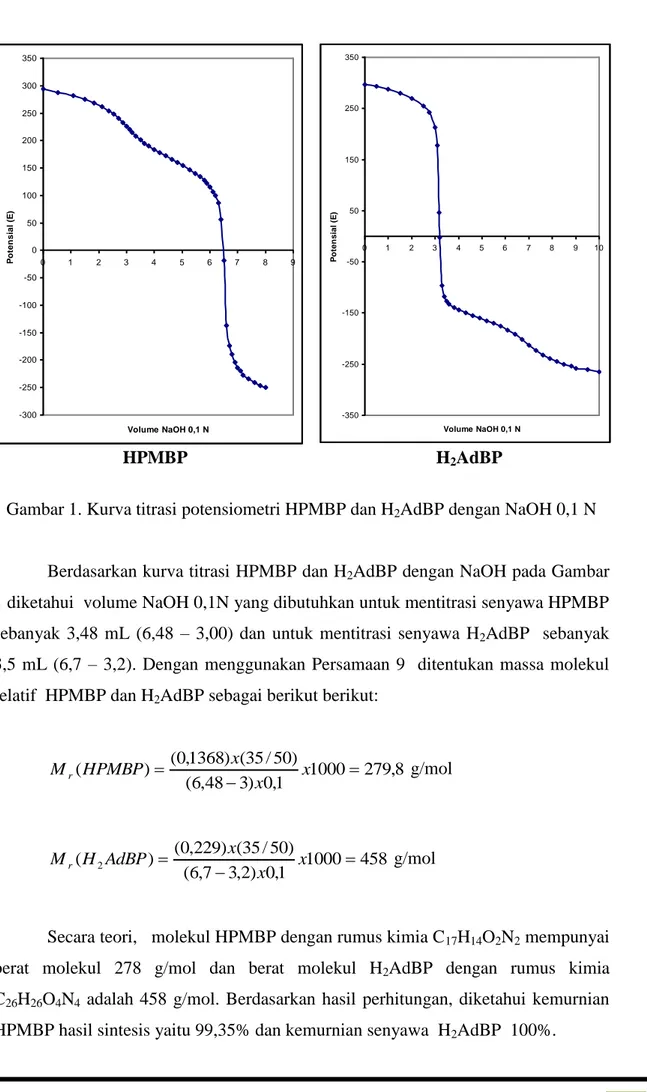
Gambar 1. Kurva titrasi potensiometri HPMBP dan H2AdBP dengan NaOH 0,1 N
Berdasarkan kurva titrasi HPMBP dan H2AdBP dengan NaOH pada Gambar
1 diketahui volume NaOH 0,1N yang dibutuhkan untuk mentitrasi senyawa HPMBP sebanyak 3,48 mL (6,48 – 3,00) dan untuk mentitrasi senyawa H2AdBP sebanyak
3,5 mL (6,7 – 3,2). Dengan menggunakan Persamaan 9 ditentukan massa molekul relatif HPMBP dan H2AdBP sebagai berikut berikut:
8 , 279 1000 1 , 0 ) 3 48 , 6 ( ) 50 / 35 ( ) 1368 , 0 ( ) ( x x x HPMBP Mr g/mol 458 1000 1 , 0 ) 2 , 3 7 , 6 ( ) 50 / 35 ( ) 229 , 0 ( ) ( 2 x x x AdBP H Mr g/mol
Secara teori, molekul HPMBP dengan rumus kimia C17H14O2N2 mempunyai
berat molekul 278 g/mol dan berat molekul H2AdBP dengan rumus kimia
C26H26O4N4 adalah 458 g/mol. Berdasarkan hasil perhitungan, diketahui kemurnian
HPMBP hasil sintesis yaitu 99,35% dan kemurnian senyawa H2AdBP 100%.
-300 -250 -200 -150 -100 -50 0 50 100 150 200 250 300 350 0 1 2 3 4 5 6 7 8 9 Volume NaOH 0,1 N P o te n s ia l (E ) -350 -250 -150 -50 50 150 250 350 0 1 2 3 4 5 6 7 8 9 10 Volume NaOH 0,1 N P o te n s ia l (E )
2. Analisis gugus fungsi dengan FT-IR
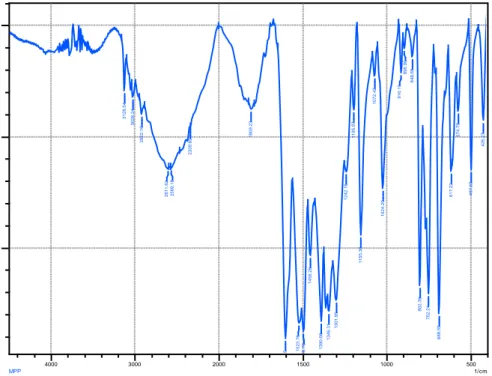
Spektrum FTIR senyawa H2AdBP dan senyawa H2PE diperlihatkan pada
Gambar 2 dan Gambar 3 berikut ini.
Gambar 2. Spektrum FT-IR senyawa H2AdBP
Data spektrum FT-IR fundamental untuk senyawa H2AdBP yaitu: IR (KBr) data (ν,
cm−1): 3409 (br, OH); 1602 (s, C=O); 1523,76 (s, fenil C=C); 1560 (s, cincin pyrazolone).
Gambar 3. Spektrum FTIR senyawa H2PE
500 1000 1500 2000 3000 4000 1/cm 50 75 100 %T 3 1 2 8 .5 4 3 0 2 8 .2 4 2 9 2 2 .1 6 2 6 1 1 .6 2 2 5 6 9 .1 8 2 3 3 9 .6 5 1 8 0 9 .2 3 1 6 0 2 .8 5 15 2 3 .7 6 1 4 9 6 .7 6 1 4 5 6 .2 6 1 3 9 0 .6 8 1 3 4 6 .3 1 1 3 0 1 .9 5 1 2 4 2 .1 6 1 1 9 5 .8 7 1 1 5 5 .3 6 1 0 7 2 .4 2 1 0 2 4 .2 0 9 1 6 .1 9 8 9 6 .9 0 8 4 8 .6 8 8 0 2 .3 9 7 5 2 .2 4 6 8 8 .5 9 6 1 7 .2 2 5 7 4 .7 9 4 9 7 .6 3 4 2 6 .2 7 MPP 500 1000 1500 2000 3000 4000 1/cm 0 25 50 75 100 %T 31 22 .7 5 30 32 .1 0 28 12 .2 1 16 25 .9 9 15 77 .7 7 1504 .4 8 14 29 .2 5 13 65 .6 0 13 30 .8 8 11 93 .9 4 11 47 .6 5 11 12 .9 3 10 16 .4 9 99 1. 41 85 2. 54 82 3. 60 78 5. 03 74 4. 52 68 0. 87 62 4. 94 57 6. 72 52 8. 50 48 7. 99 MNPP
Data spektrum FT-IR fundamental untuk senyawa H2PE yaitu: IR (KBr) data
(ν, cm−1): 3409 (br, OH); 1625 (s, C=O); 1577 (s, fenil C=C); 1504 (s, cincin pyrazolone).
3. Analisis elementer
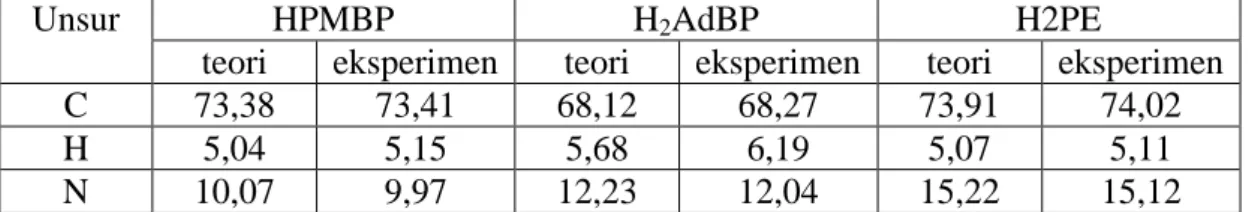
Berdasarkan data analisis elementer diketahui kemurnian (%) senyawa hasil sintesis seperti disajikan dalam Tabel 1 berikut ini.
Tabel 1. Data analisis elementer senyawa HPMBP, H2AdBP dan H2PE
Unsur HPMBP H2AdBP H2PE
teori eksperimen teori eksperimen teori eksperimen
C 73,38 73,41 68,12 68,27 73,91 74,02
H 5,04 5,15 5,68 6,19 5,07 5,11
N 10,07 9,97 12,23 12,04 15,22 15,12
4. Ekstraksi Zr(IV) dan Hf(IV) dengan berbagai jenis pirazolon
Pengaruh konsentrasi HPMBP, H2AdBP dan H2PE (0,01 – 0,03 M) dalam
kloroform pada ekstraksi Zr(IV) dan Hf(IV) telah dipelajari, konsentrasi ion logam dibuat tetap (1 x 10-3 M) dan konsentrasi asam klorida dibuat 0,2 M. Hasil yang diperoleh disajikan dalam Gambar 5.5. Dari Gambar 4 tersebut diperlihatkan dengan jelas bahwa ekstraksi ion-ion logam semakin meningkat dengan linear dengan meningkatnya konsentrasi ekstraktan pirazolon. Apabila dialurkan antara log D terhadap log [HX] diperoleh kemiringan garis (slope) sebesar 2,0. Hal ini mengindikasikan bahwa selama proses ekstraksi berlangsung, ada dua molekul ekstraktan yang membentuk kompleks dengan satu ion logam.
-2,0 -1,9 -1,8 -1,7 -1,6 -1,5 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 lo g D log HX H2AdP H2PE HPMBP -2,0 -1,9 -1,8 -1,7 -1,6 -1,5 -1,8 -1,6 -1,4 -1,2 -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 lo g D log [HX] H2ADP H2PE HPMBP
Gambar 4. Pengaruh konsentrasi HX (HPMBP, H2AdBP dan H2PE) pada ekstraksi
Zr(IV) dan Hf(IV) (1 x 10-3 M) dalam larutan HCl 0,1 M.
Ekstraksi Zr(IV) dan Hf(IV) dengan ekstraktan HPMBP, H2AdP dan H2PE
konsentrasi masing-masing (0,02 M) dalam kloroform sebagai fungsi konsentrasi ion hidrogen dan konsentrasi ion logam dibuat tetap (1 x 10-3 M). Hasil ekstraksi memperlihatkan bahwa pengaluran log D terhadap log [H+] memberikan kemiringan garis -2,0 ± 0,1 (Gambar 4). Hal ini memperlihatkan bahwa terjadi pelepasan dua proton dari molekul ligan ketika terjadi reaksi dengan ion-ion logam dalam fasa air.
-1,0 -0,9 -0,8 -0,7 -0,6 -0,5 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 lo g D log [H+] H2AdP H2PE HPMBP -1,0 -0,9 -0,8 -0,7 -0,6 -0,5 -1,6 -1,4 -1,2 -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 lo g D log [H+] H2AdP H2PE HPMBP
Gambar 5. Pengaruh konsentrasi H+ pada ekstraksi Zr(IV) dan Hf(IV) (1 x 10-3 M) dalam larutan HCl 0,1 M. [H2AdBP] = [H2PE] = [HPMBP] = 0,02 M
Zr(IV)
Hf(IV)
Berdasarkan Gambar 4 dan Gambar 5 tersebut dapat dituliskan reaksi ekstraksi pada saat tercapai kesetimbangan yaitu:
Kex,M(IV)
MO2aq + 2 H2Xorg ⇄ MO(HX)2,org + 2 Haq ... 1)
Tetapan kesetimbangan reaksi Kex,M(IV) dapat dituliskan sebagai berikut:
2 2 2 2 2 ) ( , ] ][ [ ] ][ ) ( [ X H MO H HX MO KexM IV ... 2)
Tabel 2. Faktor pemisahan Zr(IV) dan Hf(IV) berdasarkan perbedaan ekstraktan
Ekstraktan Jumlah gugus
– CH2-
Log Kex,Zr(IV) Log Kex,Hf(IV) S.F
(Zr/Hf)
HPMBP 0 2,19 ± 0,02 2,17 ± 0,03 1,04
H2PE 2 2,28 ± 0,02 2,25 ± 0,02 1,03
H2AdBP 4 1,78 ± 0,01 0,89 ± 0,02 2,05
Faktor pemisahan (S.F) antara dua logam dapat ditentukan berdasarkan perbandingan tetapan kesetimbangan. Dari Tabel 2 memperlihatkan bahwa selektifitas pemisahan antara ion Zr(IV) dan Hf(IV) mengikuti orde H2AdBP > H2PE > HPMBP.
KESIMPULAN
Senyawa turunan pirazolon telah berhasil disintesis dengan kemurnian tinggi berdasarkan data titrasi dua-fasa, analisis elementer dan spektrum FT-IR. Senyawa turunan pirazolone tersebut yaitu (1) 1-phenyl-3-methyl-4-benzoyl-5-pyrazolone (disingkat HPMBP), (2) 4-Adipoylbis(1-phenyl-3-methyl-5-pyrazolone) atau (disingkat H2AdBP) dan (3) N,N’-ethylenebis(1-phenyl-3-methyl-4-benzoylpyrazoloneimine) (disingkat H2PE). Berdasarkan data dari ekstraksi pelarut
untuk pemisahan Zr(IV) dan Hf(IV) menggunakan ekstraktan HPMBP, H2AdBP dan
H2PE, ekstraktan yang menghasilkan faktor pemisahan Zr/Hf terbesar yaitu bila
UCAPAN TERMAKASIH
Ucapan terimakasih disampaikan kepada Pemerintah Republik Indonesia melalui Direktorat Jenderal Pendidikan Tinggi Departemen Pendidikan Nasional yang telah sudi membiayai proyek Hibah Bersaing tahap I tahun 2009 dengan nomor kontrak: 802/H11/LK-APBN/A.01/2009 tanggal 11 Mei 2009.
DAFTAR PUSTAKA
Abbaspour, A. and Baramakeh, L., (2006), Application of principle component analysis–artificial neural network for simultaneous determination of zirconium and hafnium in real samples, Spectrochimica Acta Part A, 64: 477–482.
Abdel-Rehim, A.M., (2005), A new technique for extracting Zirconium form Egyptian zircon concentrate, Int. J. Miner. Process. 76: 234– 243.
Kasoep R, Keprihatinan lain dari ekspor pasir laut, Koran Kompas, 10 Desember
2003.
Khaldun, I. and Brunette J.P. (1999), Solvent extraction of some tervalent Lanthanoids with 1-phenyl-3-methyl-4-p-octylbenzoyl-5-pyrazolone, Research in Universitas Louis Pasteur, Strasbourg, Prance.
Remya, P.N., Pavithran, R. and Reddy, M.L.P., (2005), Effect of Polymethylene Chain Length of 4-Acylbis(1-phenyl-3-methyl-5-pyrazolones) on the Extraction of Vanadium(V): Synergistic Effect with Neutral Organophosphorus Extractants, Solvent Extraction and Ion Exchange, 23: 501–518.
Rudan-Tasic, D and Klofutar, C, (1998), Gran’s plots for end point detection in potentiometric titration of wine, Analusis, 26: 25-28.
Uzoukwu, Gloe, K., and Duddeck, H. (1998), 4-Acylpyrazoloneimine schiff bases and their metal complexes: synthesis and spectroscopic studies, Synth.