PENCEGAHAN DAN PENANGANAN GASTROPATI OAINS
Muhammad Begawan Bestari Endoscopy Center
Sub Bagian Gastroenterohepatologi Bagian Ilmu Penyakit Dalam
FK Unpad / RS Dr. Hasan Sadikin Bandung
Abstrak
Obat anti inflamasi non-steroid (OAINS) adalah obat yang paling sering diresepkan untuk nyeri kronis. Komplikasi gastrointestinal (GI) dari pengobatan OAINS merupakan penyebab utama morbiditas dan mortalitas. Pada sebagian besar pasien, gastropati yang diinduksi OAINS bersifat superfisial dan dapat sembuh spontan. Namun, ulkus peptikum dapat terjadi dan dapat menyebabkan perdarahan, perforasi, bahkan kematian. OAINS dapat menyebabkan kerusakan saluran pencernaan melalui kerusakan topikal dari mukosa penghalang, inhibisi sistemik sintesis prostaglandin atau kombinasi keduanya. Faktor risiko terjadinya komplikasi terkait OAINS meliputi usia> 65 tahun, riwayat adanya ulkus, penggunaan kortikosteroid atau antikoagulan bersamaan, penggunaan beberapa atau dosis tinggi OAINS. Risiko gastrointestinal distratifikasi ke dalam kelompok-kelompok berisiko rendah (yaitu tanpa faktor-faktor risiko), moderate (adanya satu atau dua faktor risiko) dan tinggi (faktor-faktor risiko multipel), riwayat komplikasi ulkus, atau penggunaan kortikosteroid atau antikoagulan secara bersamaan). Strategi terapeutik ideal dapat menyembuhkan ulkus yang terkait OAINS dan mencegah terjadinya lesi baru akibat OAINS serta komplikasinya pada pasien yang tidak dapat menghentikan terapi OAINS. Terdapat dua metoda yang digunakan untuk mencegah timbulnya ulserasi peptikum dan kerusakan mukosa pada pasien-pasien yang sedang menggunakan OAINS: (i) ko-terapi dengan PPI (proton pump inhibitior), H2RA (histamine-2-receptor antagonist) dosis-tinggi (2x), atau analog prostaglandin E1 sintetis, yaitu misoprostol; dan (ii) mengganti OAINS tradisional dengan inhibitor COX-2.Penekanan asam oleh PPI merupakan cara yang efektif untuk penyembuhan lesi gastroduodenal terkait OAINS dan merupakan terapi profilaksis yang paling efektif.
Kata kunci: OAINS, gastropati, ulkus, PPI, misoprostol, H2RA
PENDAHULUAN
Meski insidensi gastropati OAINS serius pada penelitian kohort telah menurun sebesar 67% sejak 1992(8), kekhawatiran lain mengenai potensial bahaya kardiovaskuler oleh inhibitor COX (cyclooxygenase)-2 dan OAINS lainnya telah membuat keputusan klinis lebih sulit lagi. Saat memilih suatu obat, seorang dokter sekarang harus menyeimbangkan tidak hanya potensi analgesik dan anti inflamasi terhadap toksisitas gastrointestinal, tapi juga harus menilai risiko kardiovaskuler untuk pasien. Faktor tambahan lainnya adalah aspirin dan OAINS yang mencakup Coxib, dapat mengurangi risiko kejadian atau kekambuhan adenoma kolon dan kanker kolorektal; sebagai akibatnya, risiko/manfaat untuk kejadian gastrointestinal dan kejadian kardiovaskuler bagi mereka yang sedang memakai aspirin dan OAINS dosis rendah pada suatu populasi yang secara teoritis sehat sekarang mengkonfrontasi kita.(9, 10)
FAKTOR RISIKO KOMPLIKASI YANG TERKAIT DENGAN OAINS
Faktor risiko komplikasi gastrointestinal yang terkait dengan OAINS telah diidentifikasi melalui suatu penelitian seri kasus-kontrol dan penelitian kohort yang membandingkan hasil akhir (akibat) bagi pasien-pasien yang memakai obat-obat ini dengan kelompok kontrol. Pada penelitian nested case-control yang didasarkan atas angka insidensi perawatan karena perdarahan gastrointestinal pada resipien Medicaid di atas usia 65 tahun di Tennessee didapatkan suatu peningkatan risiko bagi mereka yang berusia di atas 65 tahun (odds ratio 4,7), mereka yang memakai dosis OAINS lebih tinggi (odds ratio 8,0), mereka yang mempunyai riwayat relatif jangka pendek penggunaan OAINS (kurang dari 1 bulan; odds ratio 7,2), dan juga mereka yang secara bersamaan memakai kortikosteroid (odds ratio 4,4) atau antikoagulan (odds ratio 12,7).(11)
Pada suatu penelitian besar lainnya yang didasarkan atas temuan otopsi pada pasien-pasien yang mempunyai riwayat penggunaan OAINS, ulkus (tukak) lambung dan duodenum ditemukan lebih umum di antara pasien-pasien yang telah mengkonsumsi OAINS selama kurang dari 3 bulan.(12) Walaupun risiko komplikasi ulkus menurun sesudah beberapa bulan pertama penggunaan OAINS, hal tersebut tidak berkurang dengan terapi jangka panjang. Suatu penelitian kohort retrospektif, juga berdasarkan pada data2 dari pasien Medicaid, memperlihatkan peningkatan risiko keseluruhan yang sama untuk perdarahan gastrointestinal pada pasien-pasien yang sedang menggunakan OAINS, terutama untuk pasien-pasien yang berusia lebih dari 60 tahun.(13)
Data2 yang sama telah diperoleh dari penelitian-penelitian kohort besar lainnya.(14) Suatu penelitian besar prospektif multisenter pada pasien artritis reumatoid (N=2.747) memperlihatkan bahwa faktor-faktor risiko utama untuk kejadian gastrointestinal serius dan perawatan adalah umur, riwayat ulserasi sebelumnya yang terkait dengan OAINS dan komplikasinya, penggunaan kortikosteroid, dan debilitas. Insidensi keseluruhan, pada penelitian utama ini, untuk hospitalisasi pada kejadian gastrointestinal serius dan kematian selama terapi OAINS pada pasien-pasien artritis reumatoid yaitu 1,58%.(7)
Uji-klinik besar lain yang memakai kontrol, dirandom, double-blind dan prospektif pada lebih dari 8.000 pasien penderita artritis reumatoid mengidentifikasi penyakit kardiovaskuler sebagai suatu faktor risiko utama untuk komplikasi gastrointestinal bagian atas pada pemakaian OAINS (odds ratio:1,84). Pada penelitian yang sama ini, pasien-pasien yang berusia di atas 75 tahun (odds ratio:2,48), pasien-pasien-pasien-pasien yang mempunyai ulkus peptikum sebelumnya (odds ratio:2,29), dan perdarahan gastrointestinal sebelumnya (odds ratio: 2,56) juga terkait dengan peningkatan risiko.(15)
tinggi semua OAINS dan setiap dosis indomethacin, meclofenamate atau piroxicam meningkatkan risiko dispepsia sebesar 3 kali lipat. Sedangkan OAINS lainnya pada dosis rendah tidak meningkatkan risiko dispepsia.(17)
Pada kasus ibuprofen, hal ini dapat disebabkan oleh penggunaan dosis analgesik yang lebih rendah pada umumnya, terutama dalam hubungan dengan preparat ibuprofen yang tersedia secara bebas (over the counter/OTC). Nabumetone, meloxicam, dan etodolac bisa mempunyai beberapa derajat selektivitas COX-2 sedangkan sulindac, piroxicam, dan ketorolac mempunyai peningkatan toksisitas oleh karena waktu-paruh dalam plasma yang lama, sehingga mengakibatkan paparan mukosal yang lebih lama.(18)
Suatu penelitian sangat besar dari the Spanish National Health System memperlihatkan angka kematian 15,3 orang per 100.000 pengguna OAINS/aspirin. Temuan paling menarik pada penelitian Spanyol ini adalah angka kematian yang dilaporkan yang terkait dengan penggunaan OAINS hanya sepertiga dari angka kematian yang dikutip secara luas di AS.(19)
Penggunaan aspirin saja dalam dosis rendah, dengan tidak ada faktor-faktor risiko lainnya terkait dengan peningkatan risiko perdarahan gastrointestinal dan kematian akibat komplikasi gastrointestinal. Banyak penelitian pada pasien-pasien yang sedang menggunakan aspirin saja dalam dosis rendah memperlihatkan risiko relatif 2-4 untuk perdarahan gastrointestinal.(20, 21) Suatu meta-analisis terkini pada 14 RCT (randomized controlled trial), yang mencakup lebih dari 57.000 pasien yang sedang menggunakan aspirin dosis rendah (75-325 mg/hari), memperlihatkan risiko relatif 2,07 untuk perdarahan gastrointestinal yang signifikan.(20) Lebih jauh, persentase besar pasien-pasien yang sedang menggunakan aspirin dosis rendah adalah orang-orang yang berusia lanjut, mempunyai komorbiditas multipel dan penyakit kardiovaskuler, dan mungkin dianjurkan menggunakan antikoagulan, OAINS dan kortikosteroid, yang salah satu dari obat tersebut akan meningkatkan risiko relatif kejadian gastrointestinal sampai beberapa kali dibanding aspirin dosis rendah saja.(21) Penting untuk diingat bahwa para dokter sering tidak mengetahui bahwa pasien sedang mengobati sendiri dengan aspirin dosis rendah ketika mereka diberi resep OAINS untuk meringankan nyeri atau anti-inflamasi.
Sampai sekarang, analisis data mengenai peran infeksi Helicobacter pylori sebagai suatu faktor risiko untuk perdarahan gastrointestinal pada pengguna OAINS masih diliputi kegagalan, pada banyak penelitian, yang bertanggungjawab untuk berbagai pengaruh dari faktor-faktor risiko multipel dan terdapat bersama-sama. Karena itu, tidak mengherankan, beberapa penelitian menghasilkan hasil-hasil bertentangan.(22) Sampai sekarang, terdapat data-data yang memperlihatkan bahwa H.pylori meningkatkan, tidak mempunyai efek, dan mengurangi risiko ulkus pada pengguna OAINS.(23)
Suatu meta-analisis komprehensif pada 16 penelitian kasus-kontrol memperlihatkan bahwa risiko perdarahan ulkus peptikum meningkat sebesar faktor 1,79 oleh infeksi H.pylori, sebesar 4,85 oleh penggunaan OAINS dan sebesar 6,13 dalam keadaan ada infeksi H.pylori dan penggunaan OAINS, yang secara kuat menyatakan efek aditif.(24)
murah untuk pencegahan primer ulkus yang terkait dengan OAINS adalah eradikasi H.pylori pada pasien-pasien yang berusia di atas 50 tahun. Namun, banyak pasien menggunakan OAINS secara intermiten dan sering hanya untuk waktu singkat. Apakah suatu tes dan strategi pengobatan akan murah untuk kelompok besar ini masih belum diketahui.
Lebih jauh, juga telah terlihat bahwa eradikasi infeksi H.pylori saja tidak cukup untuk pencegahan sekunder perdarahan ulkus peptikum pada pengguna OAINS kronis.(29-31) Pada salah satu dari penelitian-penelitian ini, 400 pasien H.pylori positif dengan riwayat perdarahan gastrointestinal yang sedang menggunakan 80 mg aspirin (N=250), atau OAINS tradisional (N=150), diberi pengobatan dengan PPI (proton pump inhibitor) selama 8 minggu, dan kemudian diganti dengan aspirin 80 mg/hari, atau naproxen 500 mg b.i.d. Mereka kemudian dirandom untuk menerima 1 minggu terapi triple berbasis bismuth untuk eradikasi H.pylori yang diikuti dengan plasebo selama 6 bulan atau PPI (omeprazole 20 mg/hari) selama 6 bulan. Pada kelompok aspirin dosis rendah ini tidak terdapat perbedaan insidensi kekambuhan perdarahan di antara kelompok eradikasi H.pylori dan kelompok yang menggunakan PPI.
Pada pasien-pasien yang menerima naproxen, terapi PPI bersifat superior dibandingkan dengan eradikasi H.pylori dalam mencegah kekambuhan perdarahan (14,4% perbedaan absolut dalam peluang perdarahan, 95% CI: 4,4-24,4%, p=0,005).(28) RCT lain memperlihatkan bahwa sesudah eradikasi H.pylori, ko-terapi dengan PPI (lansoprazol 30 mg/hari) secara signifikan mengurangi risiko perdarahan kembali pada pasien-pasien berisiko tinggi yang sedang menggunakan aspirin dosis rendah ketika dibandingkan dengan pasien-pasien yang sedang menggunakan aspirin dan plasebo (1,6 vs 14,8%,p=0,008). Namun, di antara pasien-pasien yang mengalami perdarahan kembali pada kelompok plasebo, 2/3nya mengalami kegagalan mengeradikasi H.pylori atau telah menggunakan OAINS konkomitan.(29) Dengan menyingkirkan perancu-perancu ini, hanya 5% pasien yang memperoleh keberhasilan eradikasi H.pylori mengalami kekambuhan perdarahan ulkus dengan aspirin dosis rendah dalam 12 bulan.
Penelitian-penelitian skala besar, jangka panjang diperlukan untuk mengevaluasi manfaat sesungguhnya dari eradikasi H.pylori pada pengguna aspirin dosis rendah yang berisiko mengalami komplikasi ulkus. Mengapa efek eradikasi H.pylori harus berbeda di antara para pengguna OAINS dan pengguna aspirin dosis rendah? Satu penjelasan yang mungkin adalah bahwa aspirin dosis rendah tidak bersifat ulserogenik seperti OAINS. Dengan demikian, aspirin dosis rendah kemungkinan memprovokasi perdarahan pada ulkus H.pylori yang sudah ada sebelumnya. Dengan menyembuhkan infeksi tersebut akan menyembuhkan ulkus H.pylori sehingga dengan memulai lagi aspirin dosis rendah saja tidak cukup untuk menginduksi ulserasi kambuhan.
Kesimpulan
(i) Faktor risiko untuk komplikasi gastrointestinal yang terkait dengan OAINS mencakup kejadian gastrointestinal sebelumnya (terutama jika berkomplikasi), umur, penggunaan antikoagulan yang bersamaan, kortikosteroid, OAINS lain yang mencakup aspirin dosis rendah, terapi OAINS dosis tinggi, dan penyakit kardiovaskuler.
(ii) Aspirin dosis rendah terkait dengan risiko pasti adanya komplikasi gastrointestinal.
(iii) Infeksi H.pylori meningkatkan risiko komplikasi gastrointestinal yang terkait dengan OAINS.
sesudah eradikasi H.pylori bergantung kepada risiko gastrointestinal yang mendasari dari masing-masing pasien.
PERLINDUNGAN PADA MUKOSA
Dua metoda umumnya digunakan untuk mencegah timbulnya ulserasi peptikum dan kerusakan mukosa pada pasien-pasien yang sedang menggunakan OAINS: (i) ko-terapi dengan PPI, H2RA (histamine-2-receptor antagonist) dosis-tinggi (2x), atau analog prostaglandin E1 sintetis, yaitu misoprostol; dan (ii) mengganti OAINS tradisional dengan inhibitor COX-2.
Meskipun ko-terapi dengan H2RA dosis-standar dapat mencegah ulkus duodenum,(30, 32) senyawa tersebut belum terlihat mencegah ulserasi lambung yang terkait dengan OAINS. Pelapisan atau OAINS enteric coating dan ko-terapi dengan sucralfate belum terlihat efektif dalam mencegah ulserasi lambung atau duodenum yang terkait dengan OAINS.(33)
Misoprostol
Misoprostol merupakan senyawa pertama yang telah disetujui untuk pencegahan ulserasi yang terkait dengan OAINS. Penelitian-penelitian sebelumnya pada relawan normal memperlihatkan penurunan nyata insidensi ulkus gastroduodenal pada pasien-pasien yang menerima OAINS dalam kombinasi dengan misoprostol dibandingkan dengan pasien-pasien yang menerima OAINS dan plasebo.(34) RCT selanjutnya pada pasien-pasien yang menderita osteoartritis dan artritis reumatoid memperlihatkan bahwa misoprostol secara signifikan lebih baik dari plasebo, sucralfate, dan ranitidin dalan mencegah ulserasi yang terkait dengan OAINS.(35)
Suatu meta-analisis luas pada RCT yang mengevaluasi strategi pencegahan ulserasi lambung yang diinduksi oleh OAINS memperlihatkan bahwa misoprostol secara signifikan lebih efektif daripada H2RA.(36) Suatu meta-analisis yang lebih kini memperlihatkan bahwa ko-terapi dengan misoprostol menurunkan insidensi ulkus duodeni sebesar 53% dan ulkus lambung sebesar 74%, ketika dibandingkan dengan plasebo.(32) RCT lain yang membandingkan dosis standar misoprostol (200 mcg q.i.d.) dengan PPI lansoprazole (dalam dosis 15 dan 30 mg per hari) memperlihatkan bahwa 93% pasien yang menggunakan misoprostol terlindungi dari timbulnya ulkus lambung dibandingkan dengan 80 dan 82% pada dua kelompok lansoprazole, untuk masing2 dalam 12 minggu. Hasil tersebut tidak signifikan secara statistik.(37) Pasien-pasien yang bebas dari ulkus sesudah 12 minggu terapi berlanjut untuk 12 minggu selanjutnya pada regimen yang sama, dan pada akhir waktu terapi tersebut 43% diantaranya menggunakan plasebo, 83% menggunakan misoprostol, 83% menggunakan lansoprazole 30 mg, dan 89% menggunakan lansoprazole 15 mg masih berada dalam keadaan bebas ulkus.
Proton pump inhibitor
Proton pump inhibitor telah digunakan secara luas sebagai ko-terapi untuk mencegah ulkus peptikum yang diinduksi oleh OAINS. Dua RCT besar telah dilakukan pada pasien-pasien osteoartritis dan artritis reumatoid yang mengalami ulkus dengan diameter >3 mm atau >10 erosi dengan membandingkan omeprazole dengan plasebo, misoprostol, dan ranitidin pada pencegahan ulkus lambung dan duodenum.(38, 39) Pasien-pasien diobati selama 8 minggu dengan salah satu senyawa aktif tersebut. Pasien-pasien yang ulkusnya dianggap telah sembuh kemudian dirandom menjadi fase pemeliharaan 6 bulan(38) dimana mereka diobati dengan omeprazole 20 atau 40 mg per hari atau ranitidin 150 mg b.i.d. pada penelitian pertama dan omeprazole 20 mg per hari, misoprostol 200 mcg b.i.d. atau plasebo pada penelitian kedua.(39) Ko-terapi omeprazole menghasilkan penurunan signifikan jumlah total ulkus yang terkait dengan OAINS ketika dibandingkan dengan ranitidin (p=0,004). Omeprazole lebih efektif daripada misoprostol dalam pencegahan ulkus duodenale dan dalam mengurangi ulkus lambung pada penelitian kedua.(39) Kedua obat tersebut signifikan lebih baik daripada plasebo (p=0,001). Harus diperhatikan bahwa apa yang akan dianggap sebagai dosis efektif terendah dari misoprostol (400 mcg/hari) yang digunakan sebagai pembanding dalam penelitian ini dan bahwa sebagian besar dari efek keseluruhan omeprazol dalam penelitian pencegahan ulserasi yang terkait dengan OAINS adalah disebabkan oleh penurunan insidensi ulkus duodenum. Hal ini dapat disebabkan oleh kenyataan bahwa insidensi infeksi H.pylori tidak ditentukan sebelum inklusi pasien-pasien dalam penelitian-penelitian ini. Sesungguhnya, analisis post hoc memperlihatkan bahwa sebagian besar proteksi yang ditambahkan yang disebabkan oleh penggunaan omeprazol terjadi di antara pasien-pasien penderita infeksi H.pylori. Seperti telah disebutkan sebelumnya, lansoprazol pada dosis 15 atau 30 mg/hari dibandingkan dengan misoprostol 800 mcg/hari dan plasebo, sangat efektif (80 dan 82% untuk masing-masing) dalam mencegah ulkus lambung pada pasien-pasien H.pylori negatif yang sedang menggunakan OAINS.(37)
pantoprazol 20 dan 40 mg untuk masing-masing dan 93% untuk omeprazol 20 mg.(42) Dengan demikian, walaupun misoprostol dalam dosis penuh (200 mcg q.i.d) sangat efektif dalam mencegah ulkus yang terkait dengan OAINS dan komplikasinya,(37, 39) namun efek samping gastrointestinal, terutama kram dan diare, membatasi penggunaan senyawa ini. Lebih jauh, penelitian-penelitian PPI yang lebih kini yang telah disebutkan di atas telah memberikan hasil-hasil, yang sedikitnya efektif. Misoprostol dosis lebih rendah tidak terkait dengan efek-efek samping ini tetapi nampak tidak lebih efektif dibandingkan dengan terapi PPI dosis standar.(34, 35) Dengan semua alasan ini, PPI dianggap dominan pada profilaksis dan terapi kerusakan gastrointestinal bagian atas yang terkait dengan OAINS. Namun, perlu diingat bahwa sampai sekarang belum ada uji klinik yang dirandom, prospektif, dan terkontrol yang mengevaluasi efikasi PPI dalam mencegah kejadian komplikasi yang diakibatkan oleh ulkus yang terkait dengan OAINS. Meskipun demikian, ko-terapi dengan omeprazol efektif dalam mencegah kekambuhan perdarahan ulkus dalam suatu uji-klinik yang dirandom pada pengguna OAINS penderita infeksi H.pylori yang sebelumnya telah mengalami perdarahan ulkus.(31) Data-data dari penelitian observasional dan analisis sekunder pada suatu uji-klinik skala besar yang dirandom juga mengindikasikan bahwa PPI mengurangi risiko perdarahan ulkus yang terkait dengan OAINS.
H2RA dosis tinggi
Tinjauan sistematik telah memperlihatkan bahwa H2RA dosis ganda (misalnya famotidin 40 mg 2x sehari) tetapi bukannya H2RA dosis tunggal efektif dalam mengurangi risiko ulkus lambung endoskopik yang diinduksi oleh OAINS.(28, 32) Modeling ekonomik menyatakan bahwa ko-terapi dengan H2RA merupakan strategi yang murah untuk pencegahan perdarahan ulkus pada pengguna OAINS. Brown et al membandingkan 4 strategi, yaitu OAINS plus H2RA, OAINS plus PPI, OAINS plus misoprostol, dan OAINS selektif COX-2. Mereka memperlihatkan bahwa strategi optimal bergantung kepada “kemauan untuk membayar”, OAINS plus H2RA merupakan strategi yang paling murah.(43) Analisis ekonomi lainnya dari lima strategi yang disebutkan di atas, pada pasien-pasien yang mempunyai risiko gastrointestinal rendah sampai rata-rata juga menyatakan bahwa terdapat kasus untuk menganjurkan penggunaan H2RA pada semua pasien yang memerlukan OAINS.(44) Seperti halnya PPI, belum ada uji-klinik yang dirandom yang mengevaluasi efikasi H2RA pada pengguna OAINS kronis.
Inhibitor COX-2
OAINS menghambat enzim COX (cyclooxygenase), sehingga mengakibatkan penurunan signifikan produksi prostaglandin. COX terdapat sebagai dua isoenzim, yaitu COX-1 dan COX-2. COX-1 adalah suatu enzim konstitutif dan terdapat di banyak jaringan tubuh, yang mencakup lambung, dimana ia mempermudah produksi prostaglandin yang penting dalam perlindungan mukosa lambung. Sebaliknya, COX-2 merupakan enzim yang dapat diinduksi dan terkait dengan peradangan pada persendian. Saat ini telah diketahui bahwa inhibisi selektif COX-2 akan mengakibatkan penurunan peradangan pada jaringan muskuloskeletal dan, bersama-sama dengan COX-1, mengakibatkan penurunan insidensi kerusakan gastrointestinal.(45)
Pada RCT lain yang melibatkan 537 pasien penderita osteoartritis atau artritis reumatoid, celecoxib 200 mg b.i.d dibandingkan dengan naproxen 500 mg b.i.d. Sesudah 12 minggu, insidensi kumulatif ulserasi lambung dan duodenum untuk celecoxib yaitu 9% dan untuk naproxen 41%. Pada kelompok yang menerima celecoxib, kejadian ulkus secara signifikan terkait dengan sejumlah faktor: infeksi H.pylori, penggunaan aspirin secara bersamaan, dan riwayat ulkus.(48)
Pada suatu penelitian yang sama, 181 subjek berusia lanjut (65-75 tahun) dirandom untuk menerima naproxen 500 mg b.i.d., valdecoxib 40 mg b.i.d. (dosis supra-terapeutik) atau plasebo. Tingkat ulkus yaitu 18, 0, dan 3% untuk masing-masing.(49) Dalam suatu penelitian yang didesain untuk menentukan apakah inhibitor COX-2 saja adekuat untuk pencegahan kekambuhan perdarahan ulkus di antara sekelompok pasien yang berisiko sangat tinggi (yaitu mereka yang mengalami perdarahan gastrointestinal baru), 284 pasien dirandom untuk menerima celecoxib 200 mg b.i.d plus plasebo atau diklofenak 75 mg b.i.d plus omeprazol 20 mg per hari. Tingkat ulkus sesudah 6 bulan adalah 19 dan 26% untuk kelompok celecoxib/plasebo dan diklofenak/omeprazol, untuk masing-masing. Tingkat perdarahan kembali yaitu 4,9 dan 4,6%, untuk masing-masing, dalam perioda waktu yang sama. Tidak terdapat perbedaan yang signifikan antara tingkat kekambuhan ulkus dan perdarahan kembali pada kedua kelompok tersebut.Terlihat bahwa pada pasien-pasien yang berisiko sangat tinggi, inhibitor COX-2 yang diberikan atau kombinasi OAINS non-selektif dengan PPI tidak akan mengurangi risiko kekambuhan ulkus atau perdarahan kembali.(50)
Oleh karena gejala dispepsia jauh lebih sering timbul dibanding komplikasi ulkus akibat OAINS, model ekonomi menunjukkan bahwa dyspesia rate merupakan determinan utama dari efektifitas biaya (cost effectiveness) dalam mengobati artritis. Pada penelitian meta-analisis yang membandingkan dyspesia rate pada 2 kelompok artritis risiko tinggi dimana 1 kelompok mendapat Coxib dan kelompok lain mendapat terapi kombinasi OAINS dan PPI, kombinasi OAINS+PPI lebih unggul dalam mengurangi gejala dyspepsia dibanding terapi Coxib. Risiko relatif menurun 66% dan risiko absolut menurun 9%.(51)
Pada suatu uji-klinik double-blind yang dirandom untuk mengukur efikasi kombinasi PPI dan inhibitor COX-2 pada pasien-pasien yang berisiko sangat tinggi mengalami komplikasi gastrointestinal, didapat 441 pasien berturut-turut yang mengalami perdarahan ulkus yang terkait dengan OAINS non-selektif. Mereka diberi celecoxib 200 mg dua kali sehari sesudah konfirmasi penyembuhan ulkus dan tes negatif infeksi H.pylori. Pasien-pasien ditetapkan secara random untuk PPI (esomeprazol 20 mg dua kali sehari) atau plasebo. Aspirin dosis rendah diperbolehkan selama penelitian ini sesudah timbul risiko kardiovaskuler akibat inhibitor COX-2. Sesudah median follow-up 13 bulan, 8,9% dari kelompok celecoxib saja mengalami kekambuhan perdarahan ulkus dibandingkan dengan tidak satupun dari kelompok terapi kombinasi (p=0,0004).(52)
Uji-klinik besar lainnya (VIGOR) membandingkan hasil-hasil akhir untuk 8.076 pasien artritis reumatoid yang menggunakan 500 mg naproxen b.i.d atau 50 mg rofecoxib per hari. Pada penelitian ini, pengguna aspirin dosis rendah dikeluarkan dari penelitian. Pada 6 bulan, rofecoxib terkait dengan insidensi kejadian gastrointestinal yang signifikan lebih rendah (2,1 vs 4,5%, p<0,001), dan komplikasi gastrointestinal (0,6 vs 1,42%, p=0,005).(4) Namun, suatu uji-klinik selanjutnya pada pasien-pasien osteoartritis, yang membandingkan tingkat ulkus pada pasien yang menggunakan plasebo, aspirin dosis rendah, aspirin dosis rendah plus rofecoxib 50 mg per hari, dan ibuprofen 2.400 mg per hari memperlihatkan tidak ada perbedaan di antara kelompok-kelompok aspirin/rofecoxib dan ibuprofen sesudah 12 minggu, yang juga memperlihatkan eliminasi efek-efek bermanfaat dari inhibitor COX-2 dalam keadaan ada aspirin dosis rendah.(53) Lumiracoxib adalah suatu inhibitor COX-2 baru, yang baru-baru ini telah dievaluasi pada lebih dari 18.000 subjek, dan sekarang dipertimbangkan untuk disetujui di AS. Pada penelitian ini (TARGET), lumiracoxib dibandingkan dengan OAINS tradisional pada pasien-pasien penderita artritis. Sesudah 1 tahun, penurunan signifikan pada tingkat komplikasi ulkus terlihat untuk lumiracoxib di antara seluruh populasi penelitian (0,3 vs 0,9%) dan juga di antara subjek yang tidak mengkonsumsi aspirin (0,2 vs 0,9%).(54) Dua penelitian nested case-control oleh kelompok penyelidik yang sama memperlihatkan profil keamanan gastrointestinal yang signifikan lebih baik untuk coxib dibandingkan dengan OAINS tradisional pada perdarahan gastrointestinal bagian atas dan komplikasi-komplikasi lainnya. Pada kedua penelitian tersebut, penggunaan bersama-sama aspirin dosis rendah menegatifkan efek bermanfaat dari inhibitor COX-2.(55) Pada suatu penelitian pada 2.587 pasien penderita adenoma kolorektal yang dirandom untuk menerima rofecoxib 25 mg per hari atau plasebo selama 3 tahun, insidensi kejadian-kejadian gastrointestinal yang berkomplikasi dan telah dikonfirmasi (perdarahan, perforasi, dan ulkus simtomatik) secara signifikan lebih tinggi pada pasien-pasien yang menggunakan rofecoxib (0,88 vs 0,18 kejadian per 100 pasien-tahun; risiko relatif 4,9; 95% CI: 1,98-14,54).(56)
Etoricoxib adalah inhibitor COX-2 lainnya yang sekarang digunakan di Eropa. Dalam suatu laporan yang merangkum hasil-hasil dari 3 uji-klinik prospektif, dirandom dan double-blind, 34.701 pasien artritis diobati dengan etoricoxib 60 atau 90 mg atau diklofenak 150 mg per hari. Penelitian ini mencakup pasien-pasien yang sedang menggunakan aspirin dosis rendah dan/atau terapi PPI. Ditemukan bahwa keseluruhan insidensi kejadian gastrointestinal yang tidak berkomplikasi signifikan lebih kecil dengan etoricoxib dibandingkan dengan diklofenak (rasio hazard 0,69; 95% CI: 0,57-0,83) (p<0,001). Tidak ada perbedaan antara kelompok-kelompok untuk kejadian yang berkomplikasi (perdarahan, perforasi, dan obstruksi). Tidak ada perbedaan signifikan dalam hal efek pengobatan di antara kelompok-kelompok mengenai pasien-pasien yang sedang menggunakan PPI dan/atau aspirin dosis rendah.(57)
Dalam suatu tinjauan sistematik Cochrane mengenai keamanan gastrointestinal akibat inhibitor COX-2, inhibitor COX-2 mengakibatkan ulkus gastroduodenum yang signifikan lebih sedikit (risiko relatif 0,26; 95% CI: 0,23-0,30) dan komplikasi ulkus (risiko relatif 0,39; 95% CI: 0,31-0,50), dan juga penghentian obat yang lebih sedikit yang disebabkan oleh gejala-gejala gastrointestinal ketika dibandingkan dengan OAINS nonselektif.(58)
Risiko kardiovaskuler yang terkait dengan coxib dan OAINS
Laporan-laporan efek-samping kardiovaskuler dalam hubungan dengan inhibitor COX-2 telah membatasi manfaat OAINS. Pada uji-klinik APC, kejadian kardiovaskuler yang sama signifikan lebih tinggi untuk celecoxib hanya pada dosis yang sangat tinggi yaitu 400 mg b.i.d (rasio hazard 1,9, 95% CI: 1,0-3,3). Dosis celecoxib yang lebih rendah yaitu 200 mg .bi.d. terkait dengan derajat risiko yang signifikan lebih rendah (rasio hazard 1,5, 95% CI: 0,8-2,8).(60)
Bukti yang berkembang menyatakan bahwa coxib dan NSAID, dengan kekecualian naproxen dosis penuh, meningkatkan risiko kardiovaskuler. Pada suatu meta-analisis penelitian kasus-kontrol dan kohort, rofecoxib dosis tinggi (>25 mg/hari) terkait dengan dengan peningkatan kejadian kardiovaskuler. Celecoxib tidak meningkatkan kejadian kardiovaskuler, meskipun peningkatan risiko tidak dapat dikesampingkan dengan dosis >200 mg/hari. Diklofenak dan indometasin terkait dengan peningkatan risiko kardiovaskuler yang sama dengan pada rofecoxib.(61)
Pada suatu meta-analisis uji-klinik dirandom mengenai inhibitor COX-2, semua inhibitor COX-2 terkait dengan peningkatan risiko kardiovaskuler dibandingkan dengan plasebo (rate ratio 1,42; 95% CI: 1,13-1,78; p=0,003). Hal ini sebagian besar disebabkan oleh peningkatan risiko miokard infark dengan sedikit perbedaan pada akibat-akibat vaskuler lainnya. Peningkatan kejadian kardiovaskuler yang bergantung kepada dosis juga didapat pada celecoxib. Tidak terdapat perbedaan signifikan pada risiko kardiovaskuler antara inhibitor COX-2 dan NSAID nonselektif. Naproxen merupakan satu-satunya kekecualian yang mungkin karena obat ini tidak terkait dengan peningkatan kejadian kardiovaskuler (109).(62)
Kesimpulan
(i) Misoprostol, jika diberikan dalam dosis penuh (800 mcg/hari) sangat efektif dalam mencegah ulkus dan komplikasi-komplikasi ulkus pada pasien-pasien yang menggunakan OAINS. Sayangnya, kegunaannya terbatas oleh efek-efek samping terhadap gastrointestinal. Ketika diberikan dalam dosis yang lebih rendah, efektofotas dan profil efek-sampingnya sama seperti PPI.
(ii) PPI secara signifikan mengurangi ulkus lambung dan duodenum dan komplikasinya pada pasien-pasien yang menggunakan OAINS atau inhibitor COX-2.
(iii) Inhibitor COX-2 terkait dengan insidensi ulkus lambung dan duodenum yang signifikan lebih rendah ketika dibandingkan dengan OAINS tradisional. Namun, efek bermanfaat ini berkurang ketika pasien menggunakan aspirin dosis rendah secara bersamaan. Kegunaan obat2 ini juga telah berkurang karena kaitannya dengan miokard infark dan kejadian-kejadian kardiovaskuler trombotik lainnya. Dosis celecoxib terendah yang mungkin karena itu harus digunakan dalam rangka meminimalkan risiko kejadian kardiovaskuler.
STRATEGI-STRATEGI UNTUK PENCEGAHAN KOMPLIKASI ULKUS YANG TERKAIT DENGAN OAINS
Beberapa faktor risiko yang mencakup usia, komorbiditas, medikasi bersamaan, riwayat medis sebelumnya, dan infeksi H.pylori telah diperlihatkan pada beragam penelitian, yang disertai dengan derajat konsistensi besar, untuk meningkatkan risiko kerusakan gastrointestinal yang terkait dengan OAINS. Identifikasi faktor-faktor risiko ini bersama-sama dengan kemajuan strategi multipel protektif telah menjadikan konsep terapi yang diatur sesuai dengan risiko.(63) Suatu pendekatan pada stratifikasi risiko digambarkan pada Tabel 1.
Tabel 1. Stratifikasi risiko terjadinya gastropati OAINS
Risiko tinggi
1. Riwayat ulkus peptikum terkomplikasi 2. Multipel (>2 faktor risiko)
Risiko moderate (1 – 2 faktor risiko)
1 Usia > 65 tahun
2 Terapi OAINS dosis tinggi
3 Riwayat ulkus peptikum tidak terkomplikasi
4 Terapi kombinasi aspirin (termasuk dosis rendah), kortikosteroid atau antikoagulan
Risiko rendah
1. Tidak ada faktor risiko
H. pylori merupakan faktor independen tambahan yang perlu diperhitungkan terpisah
Risiko gastrointestinal distratifikasi ke dalam kelompok-kelompok berisiko rendah (yaitu tanpa faktor-faktor risiko), moderate (adanya satu atau dua faktor risiko) dan tinggi (faktor-faktor risiko multipel), riwayat komplikasi ulkus, atau penggunaan kortikosteroid atau antikoagulan secara bersamaan). Pendapat konsensus para ahli dalam bidang tersebut adalah bahwa pasien-pasien yang mempunyai riwayat ulkus peptikum berkomplikasi baru berada pada risiko sangat tinggi dan harus diobati dengan OAINS disertai dengan kehati-hatian tinggi dan dengan cara-cara protektif maksimal. Di antara pasien-pasien demikian, yang terbaik adalah menghindari pengobatan OAINS sama sekali; namun, jika pengobatan anti-inflamasi harus digunakan, inhibitor COX-2 plus misoprostol atau terapi PPI harus dilakukan. (50, 52)
Pasien-pasien yang mempunyai riwayat penyakit ulkus peptikum, yang disertai dengan atau tanpa komplikasi, dan penggunaan bersamaan aspirin (mencakup dosis rendah), obat antiplatelet (misalnya clopidrogel), antikoagulan (misalnya warfarin), atau kortikosteroid , atau dua atau lebih faktor risiko juga ditempatkan dalam kategori berisiko tinggi; pasien-pasien ini juga harus diobati dengan inhibitor COX-2 dan dikombinasi dengan misoprostol atau PPI.(3, 4, 15, 37-40) pasien-pasien yang dipertimbangkan berada pada risiko moderat (Tabel 1) dapat diobati dengan inhibitor COX-2 saja atau OAINS plus misoprostol atau PPI.(46, 47, 49) Pasien-pasien tanpa faktor-faktor risiko berada pada risiko rendah untuk komplikasi-komplikasi ulkus peptikum yang terkait dengan OAINS dan tidak ada cara protektif diperlukan.(64)
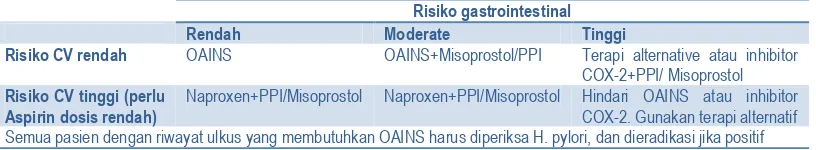
Pasien-pasien yang mempunyai faktor-faktor risiko penyakit kardiovaskuler (yaitu riwayat sebelumnya akan kejadian kardiovaskuler, diabetes, hipertensi, hiperlipidemia, dan obesitas) sering menerima aspirin profilaktik. Mereka dapat memperoleh manfaat dari substitusi suatu OAINS yang kurang kardiotoksik daripada inhibitor COX-2. Naproxen dapat merupakan suatu obat pilihan karena obat ini dapat mempunyai beberapa sifat kardioprotektif.(41, 54, 61, 62) Sebagai tambahan, pasien-pasien ini harus menerima PPI atau misoprostol karena kombinasi naproxen dan aspirin dosis rendah nyata meningkatkan risiko perdarahan gastrointestinal. Pasien-pasien yang sangat berisiko tinggi gastrointestinal yang juga mengalami peningkatan risiko kardiovaskuler tidak boleh diobati dengan OAINS atau coxib dan bentuk pengobatan lain harus dipertimbangkan. Rekomendasi ini diringkas pada Tabel 2.
Tabel 2. Ringkasan rekomendasi pencegahan komplikasi ulkus terkait OAINS
Risiko gastrointestinal
Rendah Moderate Tinggi
Risiko CV rendah OAINS OAINS+Misoprostol/PPI Terapi alternative atau inhibitor COX-2+PPI/ Misoprostol
Risiko CV tinggi (perlu Aspirin dosis rendah)
Naproxen+PPI/Misoprostol Naproxen+PPI/Misoprostol Hindari OAINS atau inhibitor COX-2. Gunakan terapi alternatif Semua pasien dengan riwayat ulkus yang membutuhkan OAINS harus diperiksa H. pylori, dan dieradikasi jika positif
REKOMENDASI
(i) Pasien-pasien yang memerlukan terapi OAINS yang berisiko tinggi (misalnya perdarahan ulkus sebelumnya atau banyak faktor risiko gastrointestinal) harus menerima terapi alternatif, atau jika pengobatan anti-inflamasi mutlak diperlukan, inhibitor COX-2, dan koterapi dengan misoprostol atau PPI dosis tinggi.
Level bukti 1. Kekuatan rekomendasi B.
(ii) Pasien-pasien yang berisiko moderate dapat diobati dengan inhibitor COX-2 saja atau dengan OAINS nonselektif tradisional plus misoprostol atau PPI. Level bukti 1. Kekuatan rekomendasi B.
(iii) Pasien-pasien yang berisiko rendah, yaitu tidak ada faktor risiko, dapat diobati dengan OAINS nonselektif.
Level bukti 1. Kekuatan rekomendasi A.
(iv) Pasien-pasien dimana analgesik anti-inflmasi direkomendasikan yang juga memerlukan terapi aspirin dosis rendah untuk penyakit kardiovaskuler dapat diobati dengan naproxen plus misoprostol atau PPI.
Level bukti 2. Kekuatan rekomendasi C.
(v) Pasien-pasien yang berisiko gastrointestinal moderate yang juga berisiko tinggi kardiovaskuler harus diobati dengan naproxen plus misoprostol atau PPI. Pasien-pasien yang berisiko tinggi gastrointestinal dan berisiko tinggi kardiovaskuler harus menghindari penggunaan OAINS atau coxib. Terapi alternatif harus digunakan.
Level bukti 2. Kekuatan rekomendasi C.
(vi) Semua pasien tanpa mempertimbangkan status risiko yang akan memulai terapi OAINS tradisional jangka panjang harus dipertimbangkan untuk tes H.pylori dan diobati jika positif.
Peringkat untuk level bukti dan kekuatan rekomendasi didasarkan pada kriteria yang telah disebutkan sebelumnya yang berasal dari rekomendasi dari the GRADE working group.(65)
Level Bukti:
(1) Level bukti secara kuat bersesuaian dengan rekomendasi. (2) Level bukti bersesuaian dengan rekomendasi.
(3) Level bukti yang bersesuaian dengan rekomendasi bersifat ekuivokal. (4) Level bukti tidak bersesuaian dengan rekomendasi.
Kekuatan rekomendasi:
(A) Bukti kuat untuk uji-klinik multipel yang telah dipublikasikan, terkontrol baik dan dirandom atau meta-analisis sistemik yang didesain baik
(B) Bukti kuat dari sedikitnya satu uji-klinik yang terkontrol, dirandom dan dipublikasi berdasarkan pada kualitas atau bukti dari penelitian-penelitian yang dipublikasi, didesain dengan baik, berupa kohort atau kasus-kontrol berpasangan.
DAFTAR PUSTAKA
1. Cryer B, Feldman M. Effects of nonsteroidal anti-inflammatory drugs on endogenous gastrointestinal prostaglandins and therapeutic strategies for prevention and treatment of nonsteroidal anti-inflammatory drug-induced damage. Arch Intern Med. 1992 Jun;152(6):1145-55.
2. Laine L. Nonsteroidal anti-inflammatory drug gastropathy. Gastrointest Endosc Clin N Am. 1996 Jul;6(3):489-504.
3. Silverstein FE, Faich G, Goldstein JL, Simon LS, Pincus T, Whelton A, et al. Gastrointestinal toxicity with celecoxib vs nonsteroidal anti-inflammatory drugs for osteoarthritis and rheumatoid arthritis: the CLASS study: A randomized controlled trial. Celecoxib Long-term Arthritis Safety Study. Jama. 2000 Sep 13;284(10):1247-55.
4. Bombardier C, Laine L, Reicin A, Shapiro D, Burgos-Vargas R, Davis B, et al. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. VIGOR Study Group. N Engl J Med. 2000 Nov 23;343(21):1520-8, 2 p following 8.
5. Wolfe MM, Lichtenstein DR, Singh G. Gastrointestinal toxicity of nonsteroidal antiinflammatory drugs. N Engl J Med. 1999 Jun 17;340(24):1888-99.
6. Gabriel SE, Jaakkimainen L, Bombardier C. Risk for serious gastrointestinal complications related to use of nonsteroidal anti-inflammatory drugs. A meta-analysis. Ann Intern Med. 1991 Nov 15;115(10):787-96.
7. Fries JF, Williams CA, Bloch DA, Michel BA. Nonsteroidal anti-inflammatory drug-associated gastropathy: incidence and risk factor models. Am J Med. 1991 Sep;91(3):213-22.
8. Fries JF, Murtagh KN, Bennett M, Zatarain E, Lingala B, Bruce B. The rise and decline of nonsteroidal antiinflammatory drug-associated gastropathy in rheumatoid arthritis. Arthritis Rheum. 2004 Aug;50(8):2433-40.
9. Dube C, Rostom A, Lewin G, Tsertsvadze A, Barrowman N, Code C, et al. The use of aspirin for primary prevention of colorectal cancer: a systematic review prepared for the U.S. Preventive Services Task Force. Ann Intern Med. 2007 Mar 6;146(5):365-75. 10. Rostom A, Dube C, Lewin G, Tsertsvadze A, Barrowman N, Code C, et al. Nonsteroidal anti-inflammatory drugs and cyclooxygenase-2 inhibitors for primary prevention of colorectal cancer: a systematic review prepared for the U.S. Preventive Services Task Force. Ann Intern Med. 2007 Mar 6;146(5):376-89.
11. Shorr RI, Ray WA, Daugherty JR, Griffin MR. Concurrent use of nonsteroidal anti-inflammatory drugs and oral anticoagulants places elderly persons at high risk for hemorrhagic peptic ulcer disease. Arch Intern Med. 1993 Jul 26;153(14):1665-70. 12. Allison MC, Howatson AG, Torrance CJ, Lee FD, Russell RI. Gastrointestinal
damage associated with the use of nonsteroidal antiinflammatory drugs. N Engl J Med. 1992 Sep 10;327(11):749-54.
13. Carson JL, Strom BL, Morse ML, West SL, Soper KA, Stolley PD, et al. The relative gastrointestinal toxicity of the nonsteroidal anti-inflammatory drugs. Arch Intern Med. 1987 Jun;147(6):1054-9.
14. Bloom BS. Risk and cost of gastrointestinal side effects associated with nonsteroidal anti-inflammatory drugs. Arch Intern Med. 1989 May;149(5):1019-22.
15. Silverstein FE, Graham DY, Senior JR, Davies HW, Struthers BJ, Bittman RM, et al. Misoprostol reduces serious gastrointestinal complications in patients with rheumatoid arthritis receiving nonsteroidal anti-inflammatory drugs. A randomized, double-blind, placebo-controlled trial. Ann Intern Med. 1995 Aug 15;123(4):241-9. 16. Hernandez-Diaz S, Rodriguez LA. Association between nonsteroidal
17. Ofman JJ, Maclean CH, Straus WL, Morton SC, Berger ML, Roth EA, et al. Meta-analysis of dyspepsia and nonsteroidal antiinflammatory drugs. Arthritis Rheum. 2003 Aug 15;49(4):508-18.
18. Simon LS, Mills JA. Nonsteroidal antiinflammatory drugs (second of two parts). N Engl J Med. 1980 May 29;302(22):1237-43.
19. Lanas A, Perez-Aisa MA, Feu F, Ponce J, Saperas E, Santolaria S, et al. A nationwide study of mortality associated with hospital admission due to severe gastrointestinal events and those associated with nonsteroidal antiinflammatory drug use. Am J Gastroenterol. 2005 Aug;100(8):1685-93.
20. McQuaid KR, Laine L. Systematic review and meta-analysis of adverse events of low-dose aspirin and clopidogrel in randomized controlled trials. Am J Med. 2006 Aug;119(8):624-38.
21. Laine L. Review article: gastrointestinal bleeding with low-dose aspirin - what's the risk? Aliment Pharmacol Ther. 2006 Sep 15;24(6):897-908.
22. Graham DY, Lew GM, Klein PD, Evans DG, Evans DJ, Jr., Saeed ZA, et al. Effect of treatment of Helicobacter pylori infection on the long-term recurrence of gastric or duodenal ulcer. A randomized, controlled study. Ann Intern Med. 1992 May 1;116(9):705-8.
23. Chan FK. Helicobacter pylori and nonsteroidal anti-inflammatory drugs. Gastroenterol Clin North Am. 2001 Dec;30(4):937-52.
24. Huang JQ, Sridhar S, Hunt RH. Role of Helicobacter pylori infection and non-steroidal anti-inflammatory drugs in peptic-ulcer disease: a meta-analysis. Lancet. 2002 Jan 5;359(9300):14-22.
25. Vergara M, Catalan M, Gisbert JP, Calvet X. Meta-analysis: role of Helicobacter pylori eradication in the prevention of peptic ulcer in NSAID users. Aliment Pharmacol Ther. 2005 Jun 15;21(12):1411-8.
26. Malfertheiner P, Megraud F, O'Morain C, Hungin AP, Jones R, Axon A, et al. Current concepts in the management of Helicobacter pylori infection--the Maastricht 2-2000 Consensus Report. Aliment Pharmacol Ther. 2002 Feb;16(2):167-80.
27. Chan FK, To KF, Wu JC, Yung MY, Leung WK, Kwok T, et al. Eradication of Helicobacter pylori and risk of peptic ulcers in patients starting long-term treatment with non-steroidal anti-inflammatory drugs: a randomised trial. Lancet. 2002 Jan 5;359(9300):9-13.
28. Leontiadis GI, Sreedharan A, Dorward S, Barton P, Delaney B, Howden CW, et al. Systematic reviews of the clinical effectiveness and cost-effectiveness of proton pump inhibitors in acute upper gastrointestinal bleeding. Health Technol Assess. 2007 Dec;11(51):iii-iv, 1-164.
29. Graham DY, Lidsky MD, Cox AM, Evans DJ, Jr., Evans DG, Alpert L, et al. Long-term nonsteroidal antiinflammatory drug use and Helicobacter pylori infection. Gastroenterology. 1991 Jun;100(6):1653-7.
30. Lai KC, Lam SK, Chu KM, Wong BC, Hui WM, Hu WH, et al. Lansoprazole for the prevention of recurrences of ulcer complications from long-term low-dose aspirin use. N Engl J Med. 2002 Jun 27;346(26):2033-8.
31. Chan FK, Chung SC, Suen BY, Lee YT, Leung WK, Leung VK, et al. Preventing recurrent upper gastrointestinal bleeding in patients with Helicobacter pylori infection who are taking low-dose aspirin or naproxen. N Engl J Med. 2001 Mar 29;344(13):967-73.
32. Rostom A, Dube C, Wells G, Tugwell P, Welch V, Jolicoeur E, et al. Prevention of NSAID-induced gastroduodenal ulcers. Cochrane Database Syst Rev. 2002(4):CD002296.
33. Derry S, Loke YK. Risk of gastrointestinal haemorrhage with long term use of aspirin: meta-analysis. Bmj. 2000 Nov 11;321(7270):1183-7.
35. Raskin JB, White RH, Jaszewski R, Korsten MA, Schubert TT, Fort JG. Misoprostol and ranitidine in the prevention of NSAID-induced ulcers: a prospective, double-blind, multicenter study. Am J Gastroenterol. 1996 Feb;91(2):223-7.
36. Koch M, Dezi A, Ferrario F, Capurso I. Prevention of nonsteroidal anti-inflammatory drug-induced gastrointestinal mucosal injury. A meta-analysis of randomized controlled clinical trials. Arch Intern Med. 1996 Nov 11;156(20):2321-32.
37. Graham DY, Agrawal NM, Campbell DR, Haber MM, Collis C, Lukasik NL, et al. Ulcer prevention in long-term users of nonsteroidal anti-inflammatory drugs: results of a double-blind, randomized, multicenter, active- and placebo-controlled study of misoprostol vs lansoprazole. Arch Intern Med. 2002 Jan 28;162(2):169-75.
38. Yeomans ND, Tulassay Z, Juhasz L, Racz I, Howard JM, van Rensburg CJ, et al. A comparison of omeprazole with ranitidine for ulcers associated with nonsteroidal antiinflammatory drugs. Acid Suppression Trial: Ranitidine versus Omeprazole for NSAID-associated Ulcer Treatment (ASTRONAUT) Study Group. N Engl J Med. 1998 Mar 12;338(11):719-26.
39. Hawkey CJ, Karrasch JA, Szczepanski L, Walker DG, Barkun A, Swannell AJ, et al. Omeprazole compared with misoprostol for ulcers associated with nonsteroidal antiinflammatory drugs. Omeprazole versus Misoprostol for NSAID-induced Ulcer Management (OMNIUM) Study Group. N Engl J Med. 1998 Mar 12;338(11):727-34. 40. Scheiman JM, Yeomans ND, Talley NJ, Vakil N, Chan FK, Tulassay Z, et al.
Prevention of ulcers by esomeprazole in at-risk patients using non-selective NSAIDs and COX-2 inhibitors. Am J Gastroenterol. 2006 Apr;101(4):701-10.
41. Lanas A, Garcia-Rodriguez LA, Arroyo MT, Bujanda L, Gomollon F, Forne M, et al. Effect of antisecretory drugs and nitrates on the risk of ulcer bleeding associated with nonsteroidal anti-inflammatory drugs, antiplatelet agents, and anticoagulants. Am J Gastroenterol. 2007 Mar;102(3):507-15.
42. Regula J, Butruk E, Dekkers CP, de Boer SY, Raps D, Simon L, et al. Prevention of NSAID-associated gastrointestinal lesions: a comparison study pantoprazole versus omeprazole. Am J Gastroenterol. 2006 Aug;101(8):1747-55.
43. Brown TJ, Hooper L, Elliott RA, Payne K, Webb R, Roberts C, et al. A comparison of the cost-effectiveness of five strategies for the prevention of non-steroidal anti-inflammatory drug-induced gastrointestinal toxicity: a systematic review with economic modelling. Health Technol Assess. 2006 Oct;10(38):iii-iv, xi-xiii, 1-183. 44. Elliott RA, Hooper L, Payne K, Brown TJ, Roberts C, Symmons D. Preventing
non-steroidal anti-inflammatory drug-induced gastrointestinal toxicity: are older strategies more cost-effective in the general population? Rheumatology (Oxford). 2006 May;45(5):606-13.
45. Laine L, Takeuchi K, Tarnawski A. Gastric mucosal defense and cytoprotection: bench to bedside. Gastroenterology. 2008 Jul;135(1):41-60.
46. Emery P, Zeidler H, Kvien TK, Guslandi M, Naudin R, Stead H, et al. Celecoxib versus diclofenac in long-term management of rheumatoid arthritis: randomised double-blind comparison. Lancet. 1999 Dec 18-25;354(9196):2106-11.
47. Laine L, Harper S, Simon T, Bath R, Johanson J, Schwartz H, et al. A randomized trial comparing the effect of rofecoxib, a cyclooxygenase 2-specific inhibitor, with that of ibuprofen on the gastroduodenal mucosa of patients with osteoarthritis. Rofecoxib Osteoarthritis Endoscopy Study Group. Gastroenterology. 1999 Oct;117(4):776-83. 48. Goldstein JL, Correa P, Zhao WW, Burr AM, Hubbard RC, Verburg KM, et al.
Reduced incidence of gastroduodenal ulcers with celecoxib, a novel cyclooxygenase-2 inhibitor, compared to naproxen in patients with arthritis. Am J Gastroenterol. cyclooxygenase-2001 Apr;96(4):1019-27.
50. Chan FK, Hung LC, Suen BY, Wong VW, Hui AJ, Wu JC, et al. Celecoxib versus diclofenac plus omeprazole in high-risk arthritis patients: results of a randomized double-blind trial. Gastroenterology. 2004 Oct;127(4):1038-43.
51. Spiegel BM, Farid M, Dulai GS, Gralnek IM, Kanwal F. Comparing rates of dyspepsia with Coxibs vs NSAID+PPI: a meta-analysis. Am J Med. 2006 May;119(5):448 e27-36.
52. Chan FK, Wong VW, Suen BY, Wu JC, Ching JY, Hung LC, et al. Combination of a cyclo-oxygenase-2 inhibitor and a proton-pump inhibitor for prevention of recurrent ulcer bleeding in patients at very high risk: a double-blind, randomised trial. Lancet. 2007 May 12;369(9573):1621-6.
53. Laine L, Maller ES, Yu C, Quan H, Simon T. Ulcer formation with low-dose enteric-coated aspirin and the effect of COX-2 selective inhibition: a double-blind trial. Gastroenterology. 2004 Aug;127(2):395-402.
54. Schnitzer TJ, Burmester GR, Mysler E, Hochberg MC, Doherty M, Ehrsam E, et al. Comparison of lumiracoxib with naproxen and ibuprofen in the Therapeutic Arthritis Research and Gastrointestinal Event Trial (TARGET), reduction in ulcer complications: randomised controlled trial. Lancet. 2004 Aug 21-27;364(9435):665-74.
55. Lanas A, Garcia-Rodriguez LA, Arroyo MT, Gomollon F, Feu F, Gonzalez-Perez A, et al. Risk of upper gastrointestinal ulcer bleeding associated with selective cyclo-oxygenase-2 inhibitors, traditional non-aspirin non-steroidal anti-inflammatory drugs, aspirin and combinations. Gut. 2006 Dec;55(12):1731-8.
56. Lanas A, Baron JA, Sandler RS, Horgan K, Bolognese J, Oxenius B, et al. Peptic ulcer and bleeding events associated with rofecoxib in a 3-year colorectal adenoma chemoprevention trial. Gastroenterology. 2007 Feb;132(2):490-7.
57. Laine L, Curtis SP, Cryer B, Kaur A, Cannon CP. Assessment of upper gastrointestinal safety of etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Long-term (MEDAL) programme: a randomised comparison. Lancet. 2007 Feb 10;369(9560):465-73.
58. Rostom A, Muir K, Dube C, Jolicoeur E, Boucher M, Joyce J, et al. Gastrointestinal safety of cyclooxygenase-2 inhibitors: a Cochrane Collaboration systematic review. Clin Gastroenterol Hepatol. 2007 Jul;5(7):818-28, 28 e1-5; quiz 768.
59. Becker JC, Domschke W, Pohle T. Current approaches to prevent NSAID-induced gastropathy--COX selectivity and beyond. Br J Clin Pharmacol. 2004 Dec;58(6):587-600.
60. Solomon SD, McMurray JJ, Pfeffer MA, Wittes J, Fowler R, Finn P, et al. Cardiovascular risk associated with celecoxib in a clinical trial for colorectal adenoma prevention. N Engl J Med. 2005 Mar 17;352(11):1071-80.
61. McGettigan P, Henry D. Cardiovascular risk and inhibition of cyclooxygenase: a systematic review of the observational studies of selective and nonselective inhibitors of cyclooxygenase 2. Jama. 2006 Oct 4;296(13):1633-44.
62. Kearney PM, Baigent C, Godwin J, Halls H, Emberson JR, Patrono C. Do selective cyclo-oxygenase-2 inhibitors and traditional non-steroidal anti-inflammatory drugs increase the risk of atherothrombosis? Meta-analysis of randomised trials. Bmj. 2006 Jun 3;332(7553):1302-8.
63. Graham DY, Chan FK. NSAIDs, risks, and gastroprotective strategies: current status and future. Gastroenterology. 2008 Apr;134(4):1240-6.
64. Lanza FL. A guideline for the treatment and prevention of NSAID-induced ulcers. Members of the Ad Hoc Committee on Practice Parameters of the American College of Gastroenterology. Am J Gastroenterol. 1998 Nov;93(11):2037-46.