A. Kompetensi Inti
1. Menghayati dan mengamalkan ajaran agama yang dianutnya.
2. Menghayati dan mengamalkan perilaku jujur, disiplin, tanggungjawab, peduli (gotong royong, kerjasama, toleran, damai), santun, responsif dan pro-aktif dan menunjukkan sikap sebagai bagian dari solusi atas berbagai permasalahan dalam berinteraksi secara efektif dengan lingkungan sosial dan alam serta dalam menempatkan diri sebagai cerminan bangsa dalam pergaulan dunia.
3. Memahami, menerapkan, menganalisis dan mengevaluasi pengetahuan faktual, konseptual, prosedural, dan metakognitif berdasarkan rasa ingin tahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah.
4. Mengolah, menalar, menyaji, dan mencipta dalam ranah konkret dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri serta bertindak secara efektif dan kreatif, dan mampu menggunakan metoda sesuai kaidah keilmuan.
B. Kompetensi Dasar dan Indikator
3.1 Menganalisis struktur dan sifat senyawa hidrokarbon berdasarkan pemahaman kekhasan atom karbon dan penggolongan senyawanya.
Indikator:
3.1.1 Mendeskripsikan kekhasan atom karbon dalam senyawa karbon.
3.1.2 Membedakan atom C primer, sekunder, tersier, dan kuartener.
3.1.3 Mengelompokkan senyawa hidrokarbon berdasarkan kejenuhan ikatan.
3.1.4 Memberi nama senyawa alkana, alkena, dan alkuna.
3.2 Memahami proses pembentukan dan teknik pemisahan fraksi-fraksi minyak bumi serta kegunaannya.
Indikator:
3.2.1 Mendeskripsikan proses pembentukan minyak bumi dan gas alam.
HIDROKARBON
3.2.2 Menjelaskan komponen-komponen utama penyusun minyak bumi.
3.2.3 Menafsirkan bagan penyulingan bertingkat untuk menjelaskan dasar dan teknik pemisahan fraksi-fraksi minyak bumi.
3.2.4 Membedakan kualitas bensin berdasarkan bilangan oktannya.
3.3 Mengevaluasi dampak pembakaran senyawa hidrokarbon terhadap lingkungan dan kesehatan serta cara mengatasinya.
Indikator:
3.3.1 Menganalisis dampak pembakaran bahan bakar terhadap lingkungan.
4.1 Mengolah dan menganalisis struktur dan sifat senyawa hidrokarbon berdasarkan pemahaman kekhasan atom karbon dan penggolongan senyawanya.
Indikator:
4.1.1 Merancang dan melakukan percobaan untuk mengidentifikasi unsur C, H, dan O dalam senyawa karbon dalam diskusi kelompok di laboratorium.
4.1.2 Dengan menggunakan molymood mendiskusikan kekhasan atom karbon dalam diskusi kelompok.
4.1.3 Menentukan atom C primer, sekunder, tersier, dan kuartener dalam diskusi kelompok di kelas.
4.1.4 Dengan menggunakan molymood mendiskusikan jenis ikatan atom karbon pada senyawa alkana, alkena, dan alkuna.
4.2 Menyajikan hasil pemahaman tentang proses pembentukan dan teknik pemisahan fraksi-fraksi minyak bumi beserta kegunaannya.
Indikator:
4.2.1 Mendiskusikan tentang eksplorasi minyak bumi, fraksi minyak bumi, mutu bensin, dan dampak hasil pembakaran bahan bakar.
4.2.2 Mendiskusikan tentang mengidentifikasi kegunaan senyawa hidrokarbon dalam bidang pangan, sandang, papan dan dalam bidang seni dan estetika.
4.2.3 Presentasi hasil kerja kelompok.
4.3 Menyajikan hasil evaluasi dampak pembakaran hidrokarbon terhadap lingkungan dan kesehatan serta upaya untuk mengatasinya.
Indikator:
4.3.1 Mendiskusikan tentang dampak pembakaran bahan bakar terhadap lingkungan.
4.3.2 Presentasi hasil diskusi.
C. Tujuan Pembelajaran
Melalui kegiatan mengamati, mempertanyakan, mengeksplorasi, mengasosiasikan, dan mengomunikasikan diharapkan peserta didik dapat:
1. Menganalisis struktur dan sifat senyawa hidrokarbon berdasarkan pemahaman kekhasan atom karbon dan penggolongan senyawanya.
2. Memahami proses pembentukan dan teknik pemisahan fraksi-fraksi minyak bumi serta kegunaannya.
3. Mengevaluasi dampak pembakaran senyawa hidrokarbon terhadap lingkungan dan kesehatan serta cara mengatasinya.
4. Mengolah dan menganalisis struktur dan sifat senyawa hidrokarbon berdasarkan pemahaman kekhasan atom karbon dan penggolongan senyawanya.
5. Menyajikan hasil pemahaman tentang proses pembentukan dan teknik pemisahan fraksi-fraksi minyak bumi beserta kegunaannya.
6. Menyajikan hasil evaluasi dampak pembakaran hidrokarbon terhadap lingkungan dan kesehatan serta upaya untuk mengatasinya.
HIDROKARBON
Mengapa atom karbon mampu membentuk senyawa karbon dengan jumlah dan jenis yang sangat banyak? Mengapa hal ini tidak terjadi pada unsur boron atau atom nitrogen yang letaknya berdekatan dengan atom karbon pada sistem periodik? Mengapa hal ini tidak terjadi pada silikon yang segolongan dengan atom karbon?
Atom karbon merupakan salah satu atom yang cukup banyak berada di alam.
Keberadaannya dalam bentuk karbon, grafit, maupun intan. Atom karbon memiliki nomor atom 6 dengan konfigurasi elektron 6C : 1s2 2s2 2p2. Oleh karena memiliki 4 elektron pada kulit terluar, atom karbon dapat membentuk empat buah ikatan kovalen dengan atom-atom yang lain. Karbon (C) merupakan unsur unik yang bisa berikatan dengan unsur lain untuk membentuk berbagai senyawa baru. Atom 6C memiliki konfigurasi 2 4. Keempat elektron valensi atom C terdistribusi pada empat posisi secara simetris
C
Selain dapat berikatan dengan atom-atom lain, atom karbon dapat juga berikatan kovalen dengan atom karbon lain, baik ikatan kovalen tunggal maupun rangkap dua dan tiga
Untuk memenuhi kaidah oktet, atom karbon dapat membentuk ikatan berikut.
1. Empat ikatan kovalen tunggal, contohnya CH4.
+
Keempat elektron valensi tersebut dapat membentuk empat ikatan kovalen melalui penggunaan bersama pasangan elektron dengan atom-atom lain. Atom karbon dapat berikatan kovalen tunggal dengan empat atom hidrogen membentuk molekul metana (CH4).
2. Satu ikatan kovalen rangkap dua, contohnya C2H4
Atom karbon juga dapat berikatan dengan atom karbon yang lain membentuk rantai karbon. Ikatan atom karbon dengan atom karbon yang lain tersebut dapat membentuk rantai panjang lurus, bercabang, maupun melingkar membentuk senyawa siklis.
Contoh:
1. Senyawa hidrokarbon rantai lurus
H3C – CH2 – CH2 – CH2 – CH3
2. Senyawa hidrokarbon rantai bercabang H3C – CH2 – CH – CH2 – CH3
| CH3
3. Senyawa hidrokarbon siklis
H2C – CH2
C H
H2C CH2
H2C – CH2
KLASIFIKASI ATOM KARBON
Atom karbon memiliki posisi yang berbeda-beda dalam sebuah rantai karbon.
Berdasarkan jumlah atom C yang diikatnya, ada 4 kemungkinan posisi atom karbon dalam rantai karbon, yaitu atom C primer, atom C sekunder, atom C tersier, dan atom C kuartener.
a. Atom C Primer (1°)
H C C H atau dapat dituliskan H3C CH3
Dari rantai karbon diatas, perhatikanlah jumlah atom C yang diikat oleh atom C yang bewarna merah. Atom C tersebut hanya mengikat 1 atom C lainnya, maka dinamakan dengan atom C primer.
b. Atom C Sekunder (2°) H H H H
H C C C C H atau ditulis H3C CH2 CH2 CH3
H H H H
Perhatikanlah jumlah atom C yang diikat oleh atom C yang bewarna merah.
Atom C tersebut mengikat 2 atom C lainnya, maka dinamakan dengan atom C sekunder.
c. Atom C Tersier (3°) H
H H C H H CH3
H C C C H atau ditulis H3C CH CH3
H H H
H H
H H
Perhatikanlah jumlah atom C yang diikat oleh atom C yang bewarna merah.
Atom C tersebut mengikat 3 atom C lainnya, maka dinamakan dengan atom C tersier.
d. Atom C kuartener (4°)
Atom C kuartener, yaitu atom C mengikat 4 atom C yang lain.
Contoh senyawa karbon yang lain.
Keterangan :
10 = atom C primer 30 = atom C tersier 20 = atom C sekunder 40 = atom C kuarterner 2. H3C – CH2 – CH – CH – CH2 – CH3
| | CH3 CH2 | CH3
Jenis atom Jumlah atom Dasar pengelompokan
Primer 4 Karena ada 5 atom C yang hanya terikat pada 1 atom C yang lainnya
Sekunder 3 Karena ada 3 atom C yang terikat pada 2 atom C yang lainnya
Tersier 2 Karena ada 2 atom C yang hanya terikat pada 3 atom C yang lainnya
Kuarterner - Karena tidak ada atom C yang terikat pada atom c lainnya.
3.
H3C – CH2 – CH2 – CH2 – CH3
Pada rantai karbon diatas, atom C primer ditunjukkan oleh nomor = 1 dan 5 atom C sekunder ditunjukkan oleh nomor = 2, 3, 4 atom C tersier dan atom C kuarterner tidak ada.
1
5 3 4
2 1
ALKANA
Alkana merupakan senyawa hidrokarbon jenuh dengan rantai terbuka dan semua ikatan karbon-karbon menggunakan ikatan tunggal.
Perhatikanlah beberapa senyawa alkana beserta rumus struktur dan rumus molekulnya berikut ini.
Rumus umum alkana
Hidrokarbon diberi nama berdasarkan jumlah atom C nya, yaitu Jika C = 1, meta C = 4, buta C = 7, hepta C = 10, deka
C = 2, eta C = 5, penta C = 8, okta C = 3, propa C = 6, heksa C = 9, nona Untuk alkana diberi akhiran ana
Deret Homolog pada alkana
Nama Rumus Struktur Rumus
molekul Metana
Etana Propana Butana Pentana Heksana Heptana Oktana Nonana Dekana
CH4
CH3 -CH3
CH3 – CH2 – CH3
CH3 – CH2 - CH2 - CH3
CH3– CH2 - CH2 – CH2 - CH3
CH3- CH2 - CH2 – CH2 – CH2 - CH3
CH3- CH2 - CH2 – CH2 – CH2 – CH2 - CH3
CH3- CH2 - CH2 – CH2 – CH2 – CH2 – CH2 - CH3
CH3- CH2 - CH2 – CH2 – CH2 – CH2 – CH2 – CH2 - CH3
CH3- CH2 - CH2 – CH2 – CH2 – CH2 - CH2 - CH2 – CH2 – CH3
CH4
C2H6
C3H8
C4H10
C5H12
C6H14
C7H16
C8H18
C9H20
C10H22
Dari rumus molekul di atas, jika n adalah jumlah atom C dalam alkana, maka rumus alkana dapat dinyatakan sebagai berikut :
Deret homolog adalah urutan dengan penambahan angka yang sama yaitu penambahan 1 atom C dan 2 atom H atau penambahan 1 molekul CH2.
1. Tata nama alkana
Semua akhiran alkana diberi akhiran ana
Jika rantai karbon tidak bercabang/lurus
- Nama alkana tergantung dari jumlah atom C dalam rantai karbon
- Jika atom karbon terdiri dari 4 atom C atau lebih, nama alkana diberi awalan n- (normal)
Jika rantai karbon bercabang
- Tentukan rantai induk,beri nomor pada rantai induk sehingga cabang mempunyai nomor sekecil mungkin.
- Cabang merupakan gugus alkil dan diberi nama alkil sesuai jumlah atom C dalam cabang tersebut.urutan penulisan nama alkana bercabang adalah sebagai berikut : nomor cabang diikuti tanda (-), lalu beri nama alkil dari cabang, nama alkil ditulis menyambung dengan nama rantai induk
- Jika terdapat 2 atau lebih jenis alkil, maka nama-nama alkil disusun menurut abjad.
Cabang alkil adalah alkana yang kehilangan 1 atom H nya.
RM alkana Nama alkana RM alkil Nama alkil CH4
C2H6
C3H8
Metana Etana Propana
CH3
C2H5
C3H7
Metil Etil Propil
Contoh: CH3– CH2 - CH2 – CH2 - CH3 n-pentana
C
nH
2 n+2ALKENA
Senyawa alkena biasanya dimanfaatkan untuk bahan baku pembuatan plastik polietilena.
Etilena merupakan senyawa alkena karena mengandung ikatan rangkap pada rantai karbonnya. Alkena merupakan hidrokarbon tak jenuh dengan ikatan rangkap dua. Dengan menggunakan molymood, paling sedikit dibutuhkan 2 atom C untuk membentuk senyawa alkena.
Dari tabel di atas terlihat bahwa :
Alkena merupakan senyawa hidrokarbon tak jenuh (ikatan antaratom C memiliki ikatan rangkap)
Alkena selalu diakhiri dengan –ena
jumlah atom H yang diikat adalah dua kali jumlah atom C. Jika terdapat n atom C, maka jumlah atom H adalah 2n sehingga rumus umum senyawa alkena adalahC
nH
2nTata Nama Alkena
Tata nama alkena menurui IUPAC
1. Rantai induk pada alkena adalah rantai karbon terpanjang yang mengandung ikatan rangkap dua C = C. Nama rantai induk berasal dari nama alkana dimana akhiran “ – ana” diganti “- ena”.
2. Penomoran pada rantai induk dimulai sedemikian sehingga atom C pertama yang terikat pada ikatan C = C memiliki nomor sekecil mungkin.
Nama rantai induk dimulai dengan nomor atom C pertama yang terikat ke ikatan C = C, diikuti tanda (-) kemudian nama rantai induk.
3. Jika terdapat cabang (gugus alkil) pada rantai induk, beri nama alkil yang sesuai. Aturan lainnya sesuai dengan tata nama alkana.
Rantai induk adalah butena
Rantai induk = 2 - butena
Rantai induk = 1 – pentena Cabang = 3,3 – dimetil 3,3 – dimetil – 1 - pentena
4. Jika terdapat lebih dari satu ikatan C = C, maka akhiran “ – ena” pada alkena diganti dengan “- diena” (ada 2 ikatan C = C), “triena ( ada 3 ikatan C = C) dan seterusnya. Kedua atom C pertama yang terikat pada ikatan C = C harus memiliki nomor sekecil mungkin.
ALKUNA
Salah satu senyawa alkuna yang paling sederhana yaitu asetilena yang biasa digunakan tukang las untuk mengelas logam. Asetilena (C2H2) adalah anggota pertama dari deret alkuna.
Alkuna merupakan hidrokarbon tak jenuh dengan ikatan rangkap tiga. Jika asetilena digambarkan dengan molymood, maka gambarnya sebagai berikut :
Tata Nama Alkuna
Tata nama alkuna menurut IUPAC:
1. Rantai induk pada pada alkena adalah rantai terpanjang yang mengandung ikatan rangkap tiga C ≡ C. Nama rantai iduk berasal dari nama alkana di mana akhiran “-ana” diganti “-una”.
1,3 - pentadiena
Dari tabel di atas, dapat terlihat bahwa :
Alkuna merupakan senyawa hidrokarbon tak jenuh yang memiliki ikatan rangkap tiga
Alkuna selalu diakhiri dengan –una
jika jumlah atom C pada senyawa alkuna adalah n, maka jumlah atom H nya adalah 2n-2, sehingga rumus umum senyawa alkuna adalahC
nH
2n-22. Penomoran pada rantai induk dimulai sedemikian sehingga atom C pertama terikat pada ikatan C ≡ C memiliki nomor sekecil mungkin.
3. Penomoran rantai induk dimulai dengan nomor atom C pertama yang terikat ke ikatan C ≡ C, diikuti tanda (-), baru nama dari rantai induk.
4. Jika terdapat cabang (gugus alkil) pada rantai induk, beri nama alkil yang sesuai. Aturan lainnya sesuai dengan tata nama alkana.
5. Jika terdapat lebih dari satu ikatan C ≡ C, maka akhiran “ – una” pada alkana diganti dengan “- diuna” (ada 2 ikatan C = C), “triuna ( ada 3 ikatan C ≡C) dan seterusnya. Kedua atom C pertama yang terikat pada ikatan C ≡ C harus memiliki nomor sekecil mungkin.
Penomoran memberikan nomor 1 untuk atom C pertama yang terikat ke ikatan C≡ C. (benar)
Penomoran memberikan nomor 4 untuk atom C pertama yang terikat ke ikatan C ≡ C. (salah)
Rantai induk : 1 - pentuna
Rantai induk = 1 – pentuna Cabang = 3 – etil – 4- metil 3 – etil – 4- metil – 1- pentuna
1,3-pentadiuna
ISOMER SENYAWA HIDROKARBON
Isomer adalah dua senyawa atau lebih yang mempunyai rumus kimia sama tetapi mempunyai struktur yang berbeda. Secara garis besar isomer dibagi menjadi dua, yaitu isomer, struktur, dan isomer geometri.
1. Isomer struktur
Isomer struktur dapat dikelompokkan menjadi: isomer rangka, isomer posisi, dan isomer gugus fungsi.
a). Isomer rangka adalah senyawa-senyawa yang mempunyai rumus molekul sama tetapi kerangkanya berbeda. Contoh pada alkana, alkena, dan alkuna.
b). Isomer posisi adalah senyawa-senyawa yang memiliki rumus molekul sama tetapi posisi gugus fungsinya berbeda. Contoh pada alkena dan alkuna.
c). Isomer gugus fungsi adalah senyawa-senyawa yang mempunyai rumus molekul sama tetapi gugus fungsinya berbeda. Contoh pada alkuna dan alkadiena.
2. Isomer geometri
Isomer geometri adalah senyawa-senyawa yang mempunyai rumus molekul sama tetapi struktur ruangnya berbeda. Contoh pada alkena mempunyai 2 isomer geometri yaitu cis dan trans.
SIFAT-SIFAT FISIK SENYAWA ALKANA, ALKENA DAN ALKUNA
1. Sifat Fisik Senyawa Alkana
Titik leleh adalah suhu pada saat zat padat berubah wujud menjadi zat cair pada tekanan satu atmosfer. Dengan kata lain, titik leleh merupakan suhu ketika fase padat dan cair sama-sama berada dalam kesetimbangan.
Titik didih adalah temperature pada saat zat cair mendidih dimana temperature tekanan uap yang meninggalkan cairan sama dengan tekanan luar.
Kerapatan adalah massa per unit volume suatu zat pada temperatur tertentu. Sifat ini merupakan salah satu sifat fisika yang paling sederhana dan sekaligus merupakan salah satu sifat fisika yang paling definitive, dengan demikian dapat digunakan untuk menentukan kemurnian suatu zat.
HIDROKARBON
SIFAT FISIK HIDROKARBON
ALKUNA ALKENA
ALKANA
KELARUTAN WUJUD
KERAPATAN TITIK DIDIH
TITIK LELEH
a. Sifat fisik alkana seperti titik leleh, titik didih, kerapatan dan wujudnya dapat dilihat pada tabel berikut.
Nama alkana Rumus molekul
Mr Titik leleh (0C)
Titik didih (0C)
Kerapatan (g/cm3)
Wujud pada 250C
Metana CH4 16 -182 -162 0,423 Gas
Etana C2H6 30 -183 -89 0,545 Gas
Propana C3H8 44 -188 -42 0,501 Gas
Butana C4H10 58 -138 -0. 5 0,573 Gas
Pentana C5H12 72 -130 36 0,526 Cair
Heksana C6H14 86 -95 69 0,655 Cair
Heptana C7H16 100 -91 99 0,684 Cair
Oktana C8H18 114 -57 126 0,699 Cair
Nonana C9H20 128 -54 151 0,718 Cair
Dekana C10H22 142 -30 174 0,730 Cair
Undekana C11H24 156 -26 196 0,740 Cair
Dodekana C12H26 170 -9,6 216 0,749 Cair
Tridekana C13H28 184 -5,4 235 0,756 Cair
Tetradekana C14H30 198 5,9 254 0,763 Cair
Pentadekana C15H32 212 9,9 271 0,769 Cair
Heksadekana C16H34 226 18 287 0,773 Cair
Heptadekana C17H36 240 22 302 0,778 Cair
Oktadekana C18H38 254 28 316 0,789 padat
Nonadekana C19H40 268 32 330 0,789 padat
Iikosana C20H42 282 37 343 0,789 padat
Dari tabel di atas dapat dilihat :
Titik leleh dan titik didih alkana
Dari metana sampai ikosana mengalami kenaikan titik leleh dan titik didih dikarenakan bertambahnya nilai Mr sehingga gaya antar molekul semakin kuat.
Besrrnya gaya antar molekul membutuhkan energi yang besar untuk mengatasi gaya tersebut.
Kerapatan Alkana
Bertambahnya jumlah atom C, alkana mengalami kenaikan kerapatan karena bertambahnya nilai Mr yang menyebabkan besarnya gaya antar molekul. Sehingga molekul-molekul alkana menjadi semakin rapat. Nilai kerapatan alkana lebih kecil dari air, sehingga bila dicampur dengan air akan membentuk lapisan yang saling tidak bercampur dimana alkana berada di atas lapisan air.
Wujud senyawa Alkana
Karena semakin bertambahnya kerapatan alkana seiring dengan pertambahan jumlah atom C, maka pada suhu kamar alkana rendah (C1 – C4) berwujud gas, yang sedang (C5 – C17) berwujud cair dan yang tinggi (>C17) berupa padat.
b. Kelarutan Alkana
Alkana bersifat non polar sehingga sukar larut dalam pelarut polar seperti air, tetapi mudah larut dalam pelarut organik non polar seperti etanol, dietil eter dan benzena.
Senyawa alkana yang bernilai Mr sama tetapi memiliki struktur bercabang
mempunyai sifat fisik berbeda dengan alkana rantai lurus. Contohnya nilai titik didih dan titik leleh dari n-butana dan isobutana yang memiliki rumus molekul C4H10, terlihat pada gambar di bawah.
Hal ini dikarenakan alkana rantai bercabang seperti isobutana memiliki susunan molekul yang lebih renggang dibandingkan alkana rantai lurus seperti n-butana.
Akibatnya interaksi antar molekul alkana rantai bercabang akan berkurang sehinngga energi yang dibutuhkan untuk mengatasi gaya antar molekul tersebut lebih kecil.
Akibatnya titik leleh dan titik didih alkana rantai bercabang lebih rendah dibandingkan senyawa dengan rantai lururs.
2. Sifat Fisik Senyawa Alkena
a. Sifat fisik alkana seperti titik leleh, titik didih, kerapatan dan wujudnya dapat dilihat pada tabel berikut.
Nama alkena Rumus
molekul Mr Titik leleh (oC)
Titik didih (0C)
Kerapatan (g/Cm3)
Fase pada 250C Etena
C2H4 28 -169 -104 0,568 Gas
Propena
C3H6 42 -185 -48 0,614 Gas
1-Butena
C4H8 56 -185 -6 0,630 Gas
1-Pentena
C5H10 70 -165 30 0,643 Cair
1-Heksena
C6H12 84 -140 63 0,675 Cair
1-Heptena
C7H14 98 -120 94 0,698 Cair
1-Oktena
C8H16 112 -102 122 0,716 Cair
1-Nonesa
C9H18 126 -81 147 0,731 Cair
1-Dekena
C10H20 140 -66 171 0,743 Cair
1-Undekena
C11H22 154 -49 193 0,750 Cair
1-Dodekena
C12H24 168 -35 214 0,758 Cair
1-Tridekena
C13H26 182 -23 233 0,760 Cair
1-Tetradekena
C14H28 196 -13 251 0,765 Cair
1-Pentadekena
C15H30 210 -4 269 0,775 Cair
1-Heksadekena
C16H32 224 3 287 0,783 Cair
1-Heptadekena
C17H34 238 10 300 0,785 Cair
1- Oktadekena
C18H36 252 17 314 0,790 Padat
1-Nonadekena
C19H38 266 23 329 0,791 Padat
1-Iikosena
C20H40 280 26 340 0,792 Padat
Dari tabel di atas dapat dilihat bahwa :
Titik leleh dan titik didih alkena cenderung mengalami kenaikan dengan bertambahnya nilai Mr
Kerapatan alkena naik dengan pertambahan nilai Mr. Tetapi nilai kerapatan senyawa alkena lebih kecil dari air, sehingga bila dicampur dengan air akan membentuk lapisan yang saling tidak bercampur dimana alkena berada di atas lapisan air.
Pada suhu kamar, senyawa alkena C2-C4 berwujud gas, alkena C5- C17 berwujud cair dan alkena dengan jumlah atom C lebih tinggi (> C17) berwujud padat.
b. Kelarutan alkena.
Seperti alkana, senyawa alkena bersifat non polar sehingga hanya bisa larut di dalam pelarut non polar seprti CCl4, benzena dan eter.
Sama halnya dengan alkana, alkena yang memiliki rantai bercabang memiliki titik leleh dan titik didih lebih tinggi dibandingkan senyawa alkena rantai lurus.
3. Sifat Fisik Senyawa Alkuna
a. Sifat fisik alkuna seperti titik leleh, titik didih, kerapatan dan wujudnya juga mirip dengan alkana, dan alkena. Perhatikan tabel berikut.
Nama Alkuna Rumus Molekul
Mr titik leleh (0C/1 atm)
Titik didih (0C)
Kerapatan (g/cm3)
Fase pada 250C
Etuna C2H2 26 -81 -82 - Gas
Propuna C3H4 40 -103 -23 - Gas
1-butuna C4H6 54 -126 9 - Gas
1-pentuna C5H8 68 -90 40 0,690 Cair
1-heksuna C6H10 82 -13 72 0,716 Cair
1-heptuna C7H12 96 -81 99 0,733 Cair
1-oktuna C8H14 110 -79 126 0,740 Cair
1-nonuna C9H16 124 -50 151 0,766 Cair
1-dekuna C10H18 138 -44 182 0,765 Cair
1-undekuna C11H20 152 -25 196 0,770 Cair
1-dodekuna C12H22 166 -19 215 0,778 Cair
1-tridekuna C13H24 180 -5 233 0,780 Padat
1-tetradekuna C14H26 194 7 249 0,790 Padat
1-pentadekuna C15H28 208 14 268 0,800 Padat
1-
heksadekuna
C16H30 222 15 284 0,801 Padat
1-heptadekuna C17H32 236 22 313 0,802 Padat
1-oktadekuna C18H34 250 23 329 0,803 Padat
1-nonadekuna C19H36 264 25 339 0,805 Padat
1-iikosuna C20H38 278 27 358 0,807 Padat
Dari tabel di atas dapat dilihat bahwa :
Titik leleh dan titik didih senyawa alkuna cenderung mengalami kenaikan seiring bertambahnya nilai Mr.
Kerapatan alkuna mengalami kenaikan dengan bertambahnya nilai Mr. tetapi kerapatan alkuna lebih kecili air, sehingga bila dicampur dengan air akan memebentuk dua lapisan yang saling tidak bercampur dan alkuna berada di atas lapisan air.
Alkuna C2-C4 berupa gas yang tak berwarna dan tak berbau, alkuna C5-C12 berwujud cair dan alkuna dengan jumlah atom C tinggi (> C12) berwujud padat.
b. Kelarutan alkuna
Alkuna bersifat non polar dan tidak larut di dalam air, tetapi larut dalam pelarut organik/non polar seperti etanol.
SENYAWA HIDROKARBON DALAM KEHIDUPAN SEHARI-HARI
Senyawa hidrokarbon banyak digunakan dalam kehidupan sehari-hari. Berikut ini akan diuraikan beberapa kegunaan senyawa Hidrokarbon dalam kehidupan sehari-hari, antara lain Alkana, Alkena, Alkuna dan contoh produknya yang banyak digunakan dalam kehidupan sehari-hari.
1. ALKANA
Gas Metana atau Gas Rawa ( CH4¿ A. Sifat Gas Metana
Metana berupa gas yang tidak berwarna, tidak berbau, dan tidak berasa.
Metana terbakar di udara atau dengan oksigen berlebih menghasilkan api biru pucat membentuk karbon dioksida dan uap air. Api tidak menghasilkan jelaga karena atom karbon terbakar sempurna.
Namun jika ada kekurangan pasokan udara, metana yang terbakar membentuk gas karbon monoksida dan uap air. Gas tersebut menyebabkan polusi dan berakibat buruk pada mesin kendaraan.
B. Sumber Gas Metana
Berikut ini beberapa sumber gas metana:
1. Metana dapat terbentuk dari aktivitas mikroba dalam bahan organik di alam.
2. Gas rawa dihasilkan dari penguraian bahan organik di daerah rawa.
3. Gas alam diproduksi dari pertambangan minyak bumi, gas alam mengandung 70% metana, 20% hidrogen, 10% etana, propana dan butana.
4. Biogas dihasilkan dari dekomposisi mikroba kotoran ternak, kotoran manusia, sampah, dan residu pertanian. Biogas mengandung sejumlah besar metana.
KEGUNAAN GAS METANA
H
│ H―C ― H
│
CH4( g) + 2 O2(g )→ CO2 (g)+2 H2O(g)+panasGambar 1. Struktur Senyawa Metana
2CH4 (g ) + 3 O2(g )→ 2CO(g)+4 H2O(g)
Adapun beberapa kegunaan metana yang banyak di gunakan dalam kehidupan sehari-hari adalah:
NO GAMBAR PRODUK KETERANGAN
1.
Gambar 2. Kendaraan Bermotor
Metana yang dikompres digunakan sebagai bahan bakar kendaraan bermotor.
2.
Gambar 3. Pupuk Urea Dan Industri Ban
Metana terurai menjadi Hidrogen dan Karbon dengan pirolisis. Hidrogen digunakan dalam pembuatan pupuk amonia dan pupuk nitrogen, sedangkan karbon dalam industri ban.
3.
Gambar 4. Formaldehida/formalin
Metana digunakan dalam pembuatan senyawa organik seperti metil organik, metil alkohol, formaldehida (formalin), asam format, kloroform (CHCl3), dan senyawa karbon tetraklorida (CCl4) yang banyak digunakan dalam industri.
Selain kegunaan dari metana, terdapat beberapa contoh produk yang merupakan hasil pengolahan senyawa Alkana yang banyak digunakan dalam kehidupan sehari-hari, yaitu:
Petroleum eter merupakan minyak bumi yang mengandung campuran senyawa alkana yang memiliki jumlah atom C sebanyak 5 hingga 6.
Senyawa ini banyak digunakan sebagai pelarut di laboratorium dan di industri kimia.
Bensin merupakan salah satu fraksi minyak bumi terpenting yang berguna sebagai bahan bakar mesin dan kendaraan bermotor. Bensin (gasolin) terdiri dari campuran isomer-isomer heptana ( C7H16¿ dan oktana ( C8H18¿ . Pada saat sekarang ini dikenal tiga jenis bensin yaitu premium, pertamax, dan pertamax plus. Mutu dari ketiganya ditentukan oleh knocking (ketukan) dan bilangan oktan.
Knocking (ketukan) adalah keadaan dimana bensin dapat terbakar secara spontan.
Bilangan oktan adalah angka yang menunjukkan tingkat ketukan (knocking) yang ditimbulkan bensin terhadap mesin saat terjadi pembakaran. Nilai oktan ditetapkan oleh dua jenis senyawa sebagai pembanding yaitu n-heptana (bilangan oktan = 0) dan isooktana (bilangan oktan = 100). Suatu campuran yang terdiri dari 80% isooktana dan 20% n-heptana mempunyai nilai oktan sebesar (80/100
1. Gas LPG (Liquified Petroleum Gas)
LPG bersumber dari gas alam. Komposisi LPG mengandung campuran propana ( C3H8 ) dan butana ( C4H10 ) sebesar 97% dan maksimum 2% merupakan campuran pentana ( C5H12 ) dan hidrokarbon yang lebih berat. LPG banyak digunakan sebagai bahan bakar pada rumah tangga dan industri. Namun, saat ini juga sedang digalakkan penggunaan bahan bakar LPG sebagai bahan bakar untuk kendaraan bermotor dengan tujuan mengurangi tingkat pencemaran udara.
Gambar 5. Gas LPG 2. Petroleum Eter
Gambar 6. Petroleum Eter
3. Bensin
Gambar 7. Bensin
x 100) + (20/100 x 0) = 80. Pertamax mempunyai bilangan oktan 92, premium mempunyai bilangan oktan 88 dan pertamax plus mempunyai bilangan oktan 95.
Minyak tanah (bahasa Inggris:
kerosene atau paraffin) adalah cairan hidrokarbon yang tak berwarna dan mudah terbakar. Minyak tanah merupakan komponen minyak bumi yang mengandung campuran senyawa alkana yang memiliki jumlah atom C sebanyak 12 hingga 15. Minyak tanah digunakan sebagai bahan bakar untuk keperluan rumah tangga.
Minyak tanah diperoleh dengan cara distilasi fraksional dari petroleum pada 150 °C dan 275 °C (rantai karbon dari C12 sampai C15). Nama kerosene diturunkan dari bahasa Yunani keros yang artinya malam. Biasanya, minyak tanah didestilasi langsung dari minyak mentah membutuhkan perawatan khusus, dalam sebuah unit merox atau hidrotreater, untuk mengurangi kadar belerang dan pengaratannya. Minyak tanah dapat juga diproduksi oleh hidrocracker, yang digunakan untuk memperbaiki kualitas bagian dari minyak mentah yang akan bagus untuk bahan bakar minyak.
Terdapat juga penggunaanya sebagai bahan bakar untuk memasak. Setelah melalui proses penyulingan seperlunya dan masih tidak murni dan bahkan memilki pengotor (debris). Berbeda dengan LPG, minyak tanah menghasilkan pembakaran yang kurang sempurna sehingga menimbulkan jelaga.
Solar yang juga dikenal dengan minyak diesel adalah komponen minyak bumi yang mengandung campuran alkana yang memiliki jumlah atom C sebanyak 15 hingga 18. Solar biasanya digunakan sebagai bahan bakar diesel atau kendaraan bermesin diesel, seperti bus dan truk.
Dibanding dengan bensin, solar memiliki 4. Minyak Tanah
Gambar 9. Minyak tanah
5. Solar
Gambar 10. Solar/minyak diesel
rantai atom C yang lebih panjang sehingga pembakarannya kurang sempurna. Hal ini ditandai dengan pembentukan asap hitam yang merupakan unsur karbon yang tidak terbakar.
Minyak pelumas merupakan residu minyak bumi yang tidak teruapkan tetapi masih berwujud cair. Minyak pelumas merupakan komponen minyak bumi yang mengandung alkana yang memiliki atom C sebanyak 16 hingga 24. Minyak pelumas biasa digunakan sebagai pelumas (lubrikasi) mesin-mesin.
Aspal merupakan residu minyak bumi yang memiliki jumlah atom C lebih dari 40. Aspal (bitumen) adalah suatu cairan kenyal yang merupakan senyawa hidrokarbon dengan sedikit mengandung sulfur, oksigen, dan klor. Aspal diperoleh sebagai produk sampingan dari penyulingan minyak bumi. Aspal digunakan untuk mengikat batuan 6. Minyak Pelumas
Gambar 11. Minyak Pelumas
Lilin merupakan residu minyak bumi yang berupa padatan yang mengandung campuran alkana yang memiliki jumlah atom C sebanyak 12 hingga 40. Lilin biasa digunakan dalam penerangan, pelapisan zat dan bahan pembuatan kosmetik.
7. Lilin
Gambar 12. Lilin
8. Aspal
Gambar 13.
Pengaspalan jalan
agar tidak lepas dari permukaan jalan akibat lalu lintas (pengeras jalan raya) dan juga melindungi batuan dari erosi akibat air hujan.
2.ALKENA
Gas Etena atau Gas Etilena ( C2H4¿ A. Sifat Gas Etana
Etena memiliki sifat tidak larut dalam air, tetapi larut dalam senyawa, tidak berwarna, memiliki bau, dan tidak berasa. Etena tidak larut dalam air tetapi larut dalam senyawa organik seperti eter, alkohol dan benzena. Etena dapat terbakar di udara membentuk api dan dan menghasilkan sejumlah panas.
Namun, jika kelebihan pasokan udara etena yang terbakar membentuk gas karbon dioksida dan uap air.
B. Sumber Gas Etena
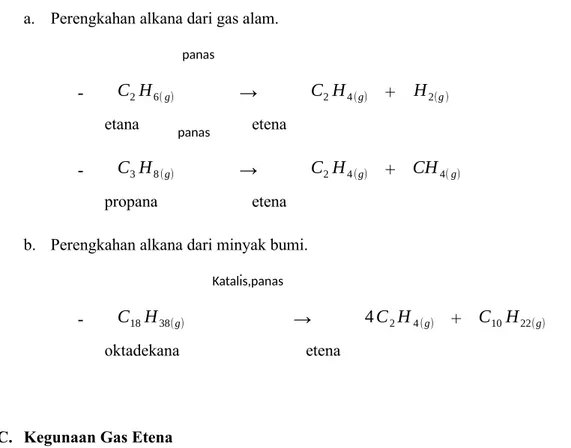
Pada tumbuhan, etena diproduksi sendiri oleh tumbuhan sebagai hormon untuk mematangkan buah. Sementara di alam alkena berada dalam jumlah kecil sehingga harus disintesis melalui perengkahan alkana dari gas alam dan minyak bumi. Berikut contoh sintesis etena:
a. Perengkahan alkana dari gas alam.
- C2H6( g) → C2H4 (g) + H2(g )
etana etena
- C3H8 (g) → C2H4 (g) + CH4( g)
propana etena
b. Perengkahan alkana dari minyak bumi.
- C18H38(g) → 4 C2H4 (g) + C10H22(g)
oktadekana etena
C. Kegunaan Gas Etena
Adapun beberapa kegunaan dari gas etena yang banyak digunakan dlam kehidupan sehari-hari:
Gambar 14. Struktur senyawa Etena
H H
│ │ C = C
panas
panas
Katalis,panas
NO GAMBAR PRODUK KETERANGAN 1.
Gambar 15. Botol Fleksible
Gas etena digunakan dalam pembuatan polimer polietena yang banyak digunakan dalam industri kemasan seperti pembuatan botol fleksible, pembungkus dan barang-barang mainan.
NO GAMBAR PRODUK KETERANGAN
2.
Gambar 16. Ethanol dan Asam Asetat
Gas etena digunakan dalam pembuatan senyawa organik seperti alkohol, asam asetat, etil glikol, dan asetal dehida
3.
Gambar 17. Pembuatan Obat Bius
Gas etena digunakan dalam pembuatan obat bius di bidang farmasi.
2. ALKUNA
Gas Etuna atau Gas Asetilena ( C2H2¿ A. Sifat-sifat Gas Asetilena
Gas asetilena merupakan gas tidak berwarna, tidak memiliki rasa dan memiliki bau yang tidak sedap karena gas asetilena yang dibuat dari batu karbit tidak murni tetapi memiliki campuran. Asetilena tidak larut di dalam air, tetapi larut dalam pelarut organik. Gas asetilena di udara akan menimbulkan nyala api. Namun
Gambar 18. Struktur Senyawa Etuna
H ― C ≡ C ― H
dalam udara berlebih, gas asetilena terbakar dengan nyala api putih cemerlang membentuk gas karbon dioksida dan uap air.
B. Sumber Gas Asetilena
Asetilena diproduksi oleh tumbuhan sebagai hormon untuk mematangkan buah-buahan. Gas asetilena diproduksi secara besar-besaran dengan produksi kalsium karbida ( CaC2 ) yang direaksikan dengan air untuk menghasilkan asetilena C2H2 , reaksinya adalah sebagai berikut:
Asetilena disebut juga sebagai gas karbit. Kalsium karbida ini dibuat dengan bahan dasar kapur yang diubah menjadi CaO dan batu bara sebagai sumber karbon.
C. Kegunaan Asetilena
Adapun beberapa kegunaan dari gas asetilena yang banyak digunakan dlam kehidupan sehari-hari:
NO GAMBAR PRODUK KETERANGAN
1.
Gambar 19. Pematangan buah dengan gas asetilena
Etilen adalah suatu gas yang dalam kehidupan tanaman yang dapat digolongkan sebagai hormon yang aktif dalam proses pematangan. Disebut hormon karena dapat memenuhi persyaratan sebagai hormon, yaitu dihasilkan oleh tanaman, bersifat mobil dalam jaringan tanaman dan merupakan senyawa organik. Dalam kadar yang sama, proses pematangan buah melalui zat etilen lebih cepat dibanding proses buatan atau melalui asetilena atau pengarbitan. Hanya saja kadar asetilen dapat diatur dan ditingkatkan sesuai keinginan, sehingga proses pematangan dengan asetilen bisa jauh lebih cepat dari pada dengan menggunakan etilen secara murni.
Sebenarnya pematangan secara buatan ini tidak membawa pengaruh negatif terhadap kadar gizi atau mutu buah. Peran zat asetilen yang berupa gas hanya
2 C2H2(g ) + 5 O2(g ) → 4
CO2 (g) + 2 H2O(g)
CaC2(s ) + 2 H2O(l)→ C2H2(g) + Ca(OH )2(aq)
berfungsi sebagai perangsang agar buah lebih cepat matang. Sedangkan karbit sebagai zat kimia hanya berfungsi menghasilkan asetilen. Dengan demikian, peran karbit tidak secara langsung sehingga buah melalui proses pengarbitan tidak berbahaya. Vitamin dan zat lain yang dikandungnya tetap ada dan tidak menimbulkan dampak negatif terhadap kesehatan konsumennya.
NO GAMBAR PRODUK KETERANGAN
2.
Gambar 20. Pemotongan logam dengan gas asetilena
Nyala oksi asetilena dapat digunakan untuk memotong dan mengelas logam.
3.
Gambar 21. Lampu Asetilena
Gas asetilena digunakan untuk penerangan dengan lampu asetilena yang dirancang khusus.
4.
Gambar 22. Botol Kemasan
Asetilena dapat dihidrogenasi dengan etena kemudian dipolimerisasi membentuk polietilen dan digunakan sebagai bahan kemasan.
MINYAK BUMI DAN GAS ALAM Asal Usul Minyak Bumi
Minyak bumi :
bahasa Inggris: petroleum,
bahasa Latin: petrus – karang dan oleum – minyak)
Minyak bumi yang dijuluki juga sebagai emas hitam, adalah suatu cairan kental yang berwarna coklat sampai hitam atau kehijauan, yang mudah terbakar dan berbau kurang sedap, yang berada di lapisan atas dari beberapa area di kerak bumi.
Proses Terbentuknya Minyak Bumi
Minyak bumi merupakan campuran kompleks dari senyawa-senyawa hidrokarbon,yaitu hidrokarbon jenuh (alkana dan sikloalkana) dan juga senyawa siklik (turunan siklopentana, sikloheksana dan juga nafta) tetapi bervariasi dalam penampilan, komposisi, dan kemurniannya, dengan komponen penyusunnya adalah senyawa karbon (83%- 87%), hidrogen (10% - 15 %), belerang (0,05-6%), oksigen (0,05-1,5%) dan senyawa logam dalam jumlah yang sangat kecil. Minyak bumi terbentuk paling sedikit 2 juta tahun yang lalu, dan ada juga yang berpendapat bahwa minyak bumi terbentuk 500-2500 juta tahun yang lalu.
Proses terbentuknya minyak bumi dapat dijelaskan sebagai berikut:
a. Pada zaman purba, di darat dan di dalam lautan hidup beraneka ragam binatang dan tumbuh-tumbuhan. Binatang serta tumbuh-tumbuhan yang mati ataupun punah itu akhirnya tertimbun di bawah endapan lumpur. Endapan lumpur ini kemudian dihanyutkan oleh arus sungai menuju lautan bersama bahan organik lainnya dari daratan.
b. Selama berjuta-juta tahun, sungai-sungai menghanyutkan pasir dan lumpur ke dasar laut dan membuat lapisan batuan yang bercampur dengan fosil-fosil binatang dan tumbuh-tumbuhan.
c. Akibat peristiwa alam, lapisan dan permukaan bumi mengalami perubahan besar berupa pergeseran-pergeseran sehingga fosil hewan dan tumbuhan yang terkubur di perut bumi masuk ke celah-celah lapisan bumi yang bersuhu dan bertekanan tinggi. Akibat pengaruh waktu, temperatur tinggi, dan tekanan beban lapisan batuan di atasnya, menyebabkan binatang dan tumbuh-tumbuhan yang mati tadi mengalami proses penguraian berupa perubahan kimia, berubah menjadi bintik - bintik dan gelembung minyak yang berbentuk cairan kental dan gas. Akibat pengaruh yang sama, maka endapan lumpur berubah menjadi batuan sedimen. Batuan lunak
yang berasal dari lumpur yang mengandung bintik-bintik minyak dikenal sebagai batuan induk atau “source rock”.
d. Karena ringan, minyak bumi akan terdorong dan terapung, lalu bergerak mencari tempat yang lebih baik (berimigrasi menuju tempat yang bertekanan lebih rendah) untuk berhenti dan terperangkap dalam batuan sedimen yang kedap atau kadang - kadang merembes ke luar permukaan bumi. Batuan sedimen tersusun atas fragmen – fragmen atau butiran mineral dari yang halus sampai yang kasar satu sama ain saling terikat oleh materi yang sangat halus dan berfungsi sebagai “semen”, sehingga di antaranya terdapat pori-pori. Pada kondisi tertentu, pori-pori ini dapat mengandung fluida minyak, gas, atau air. Peristiwa terperangkapnya minyak bumi dan gas alam dalam batuan sedimen disebut proses “akumulasi”.
PENGOLAHAN MINYAK BUMI
Minyak bumi terletak di dasar laut dan tertutupi oleh lapisan batuan tanah. Berikut adalah tahapan kegiatan yang dilakukan untuk mengolah minyak bumi dari dasar laut menjadi bahan-bahan yang bermanfaat.
a. Apakah eksplorasi itu?
Langkah awal untuk mendapatkan minyak bumi adalah eksplorasi, yaitu upaya mencari daerah yang mengandung minyak bumi dan prakiraan cadangan minyaknya.
Informasi tersebut dapat diperoleh dengan cara membuat peta topografi hasil pemotreran dari udara. Setelah mengetahui daerah-daerah yang akan diselidiki, para ahli geologi menyelidiki contoh-contoh batuan atau lapisan batuan yang terdapat di permukaan karang atau tebing-tebing. Pemeriksaan itu dilakukan di laboraturium.
Penyelidikan selanjutnya adalah penyelidikan secara geofisika yang dikenal dengan kegiatan seismik. Para ahli membuat semacam gempa kecil di bawah tanah. Getaran itu akan menghasilkan gelombang-gelombang menuju dasar laut. Gelombang yang dipantulkan kembali ke permukaan bumi sehingga posisi lokasi yang mengandung minyak bumi dapat diperkirakan.
Pengubahan Pemisahan
Eksploitas i
Eksplorasi
b. Apakah eksploitasi itu?
Setelah lokasi yang mengandung minyak bumi diketahui, langkah selanjutnya adalah melakukan kegiatan eksploitasi, yaitu rangkaian kegiatan untuk mengambil mimyak bumi yang akan diolah. Kegiatan utama eksploitasi adalah pengeboran. Pengeboran dapat dilakukan di lepas pantaai dan di tengah laut, bergantung pada lokasi sumber cadangan minyak
Sumber hidrokarbon di alam khususnya minyak bumi merupakan campuran alkana sebagai komponen utama dengan sebagian kecil alkena, alkuna, sikloalkana, aromatic dan senyawa anorganik, yang dipisahkan berdasarkan perbedaan titik didih melalui destilasi bertingkat sehingga diperoleh kelompok-kelompok hidrokarbon yang mempunyai kisaran titik didih tertentu yang disebut fraksi-fraksi, dan diproses lebih lanjut untuk memperoleh produk yang diinginkan
Destilasi adalah cara pemisahan campuran berdasarkan perbedaan nilai titik didih
Destilasi bertingkat( destilasi fraksionasi) adalah cara pemisahan campuran berdasarkan perbedaan nilai titik didih dengan menggunakan tahap-tahap atau fraksi-fraksi pendingin sesuai trayek titik didih campuran yang diinginkan ( kolom bertingkat)
Cara memisahkan fraksi-fraksi yang terkandung dalam minyak bumi:
Destilasi bertingkat
Minyak mentah mula-mula dipanaskan dalam pemanas (boiler) menggunakan uap air bertekanan tinggi sampai suhu 600°C. Hasil pemanasan berupa uap minyak kemudan dialirkan ke dasar menara destilasi.
Uap minyak akan bergerak ke atas melewati pelat-pelat (tray) yang terdapat dalam menara.
Pada saat mencapai suhu tertentu sesuai dengan titik didihnya, uap minyak mentah akan berubah menjadi zat cair ( dalam keadaan dingin). Perubahan uap air ( gas) menjadi zat cair disebut kondensasi. Zat cair hasil kondensasi ini yang diebut fraksi.
Proses pengubahan fraksi minyak bumi Proses Konversi
Proses konversi adalah penyusunan ulang struktur molekul hidrokarbon, yang bertujuan untuk memperoleh fraksi-fraksi dengan kuantitas dan kualitas ynga diinginkan atau sesuai permintaan pasar.
Jenis proses konversi:
Perengkahan (cracking) adalah penguraian (pemecahan) molekul-molekul senyawa hidrokarbon yang besar ( yang memiliki jumlah karbon terbanyak ) menjadi molekul- molekul senyawa yang lebih kecil. Contoh cracking ini adalah pengubahan minyak solar atau minyak tanah (kerosin) menjadi bensin dalam jumlah besar dan berkualitas lebih baik.
Terdapat dua cara proses cracking, yaitu:
Cara panas (thermal cracking) adalah proses cracking dengan menggunakan suhu tinggi serta tekanan rendah.
Cara katalis (catalytic cracking) adalah proses cracking dengan menggunakan bubuk katalis platina atau molibdenum oksida
Reforming (penyusunan ulang) adalah pengubahan bentuk molekul bensin yang bermutu kurang baik (rantai karbon lurus) menjadi bensin yang bermutu lebih baik (rantai karbon bercabang). Kedua jenis bensin ini memiliki rumus molekul sama, tetapi bentuk strukturnya berbeda sehingga proses ini disebut isomersisasi. Reforming dilakukan dengan menggunakan katalis dan pemanasan.
Contoh:
Alkilasi adalah proses penggabungan molekul-molekul kecil manjadi molekul besar.
Misalnya, penggabungan senyawa isobutena dengan senyawa isobutana yang menghasilkan bensin berkualitas tinggi, yaitu isooktana.
Treating adalah proses permurnian minyak bumi dengan cara menghilangkan pengotor-pengotornya. Cara-cara proses treating sebagai berikut.
a) Copper sweetening dan doctor treating adalah proses penghilangan pengotor yang dapat menimbulkan bau tidak sedap.
b) Acid treatment adalah proses penghilangan lumpur dan perbaikan warna.
c) Desulfurizing (desulfurisasi) adalah proses penghilangan unsur belerang.
Proses blending adalah penambahan bahan-bahan aditif kedalam fraksi minyak bumi dalam rangka untuk meningkatkan kualitas produk tersebut. Bensin yang memiliki
H
3C CH
2H
2C CH
3H
3C
CH CH
3CH
3Isobutana/2-metilpropana n-butana
H
3C
C CH
2+ H
3C
CH CH
3CH
3H
3C CH
H
2C C CH
3CH
3CH
3CH
32,2,4-Trimetil-pentana/Isooktana Isobutana
CH
3Isobutena
berbagai persyaratan kualitas merupakan contoh hasil minyak bumi yang paling banyak digunakan di barbagai negara dengan berbagai variasi cuaca. Untuk memenuhi kualitas bensin yang baik, terdapat sekitar 22 bahan pencampur yang dapat ditambanhkan pada proses pengolahannya. Diantara bahan-bahan pencampur yang terkenal adalah tetra ethyl lead (TEL). TEL berfungsi menaikkan bilangan oktan bensin. Demikian pula halnya dengan pelumas, agar diperoleh kualitas yang baik maka pada proses pengolahan diperlukan penambahan zat aditif. Penambahan TEL dapat meningkatkan bilangan oktan, tetapi dapat menimbulkan pencemaran udara.
Fraksi-fraksi dan Kegunaan minyak bumi
Fraksi Jumlah atom C
Titik didih (°C)
Kegunaan
Gas (LPG) C1-C4 < 20 a. Sebagai bahan bakar gas elpiji dan alat pemanas b. Bahan bakar endaraan bermotor gas
c. Bahan pendingin pengganti CFC (Chlorofluorocarbon)
Bensin (gasolin) C5-C10 40-180 a. Bahan bakar kendaraan bermotor non diesel Nafta C6-C10 70-180 Untuk sintesis senyawa organic yang digunakan
untuk pembuatan plastic, karet, deterjen, obat, cat, pakaian dan kosmetik
Kerosin C11-C14 180-250 a. bahan bakar kompor b. bahan bakar alat penerang Minyak solar dan
diesel
C15-C17 250-300 a. bahan bakar kendaraan bermesin diesel b. bahan bakar tungku di industri
Minyak pelumas C18-C20 300-350 a. Mencegah perkaratan pada logam b. Mengurangi gesekan pada mesin
Lilin > C20 > 350 Sebagai lilin paraffin untuk membuat lilin, korek
api dan bahan pengkilap
Minyak bakar > C20 > 350 Bahan bakar kapal, industry pemanas, dan pembangkit listrik
Bitumen > C40 > 350 Materi jalan aspal untuk melapisi permukaan jalan
MUTU BENSIN
Bensin merupakan salah satu fraksi minyak bumi terpenting yang berguna sebagai bahan bakar mesin dan kendaraan bermotor. Bensin (gasoline) terdiri dari campuran isomer-isomer heptana (C7H16) dan oktana (C8H18).
Dewasa ini, dikenal tiga jenis bensin yaitu premium, pertamax dan pertamax plus.
Ketiganya mempunyai mutu atau perilaku yang berbeda. Mutu bahan bakar bensin dikaitkan dengan jumlah ketukan (knocking) yang ditimbulkannya dan dinyatakan dengan bilangan oktan. Makin sedikit ketukan makin baik mutu bensin, makin tinggi nilai oktannya.
Ketukan(knocking) adalah keadaan dimana bensin dapat terbakar secara spontan. Hal ini merupakan suatu prilaku yang kurang baik dari bahan bakar, yaitu pembakaran yang terjadi terlalu dini sebelum piston berada pada posisi yang tepat.
Di dalam mesin, campuran udara dan bensin (dalam bentuk gas) ditekan oleh piston sampai dengan volume yang sangat kecil dan kemudian dibakar oleh percikan api yang dihasilkan busi. Karena besarnya tekanan ini, campuran udara dan bensin juga bisa terbakar secara spontan sebelum percikan api dari busi keluar. Jika campuran gas ini terbakar karena tekanan yang tinggi (dan bukan karena percikan api dari busi), maka akan terjadi knocking atau ketukan di dalam mesin. Knocking ini akan menyebabkan mesin cepat rusak, sehingga sebisa mungkin harus kita hindari.
Bilangan oktan adalah angka yang menunjukkan tingkat ketukan (knocking) yang ditimbulkan bensin terhadap mesin saat terjadi pembakaran. Nama oktan berasal dari oktana (C8), karena dari seluruh molekul penyusun bensin, oktana yang memiliki sifat kompresi paling bagus. Oktana dapat dikompres sampai volume kecil tanpa mengalami pembakaran spontan, tidak seperti yang terjadi pada heptana, misalnya, yang dapat terbakar spontan meskipun baru ditekan sedikit.
Untuk menentukan nilai oktan, ditetapkan dua jenis senyawa sebagai pembanding yaitu isooktana dan n-heptana dengan ketentuan sebagai berikut :
1. n-heptana mempunyai bilangan oktan = 0, mengakibatkan knocking sangat tinggi 2. isooktana mempunyai bilangan oktan = 100, tidak mengakibatkan knocking
Bensin yang tersusun oleh hidrokarbon berantai lurus, ternyata kualitasnya kurang baik.
Hal ini karena bensin tersebut dapat mengakibatkan penyalakan (knocking atau ketukan) tak terkendali pada mesin sehingga mesin bergetar sangat hebat dan menimbulkan panas yang terlalu tinggi.
Suatu campuran yang terdiri dari 80% isooktana dan 20% n-heptana mempunyai nilai oktan sebesar (80/100 x 100) + (20/100 x 0) = 80. Pertamax mempunyai nilai oktan 92, berarti mutu bahan bakar itu setara dengan campuran 92% isooktana dan 8% n-heptana.
Premium mempunyai nilai oktan 88 dan Pertamax Plus mempunyai nilai oktan 95.
Bilangan oktan bensin dapat ditingkatkan dengan cara menambah zat aditif antiketukan, seperti TEL, MTBE, dan etanol
1. Tetra Ethyl Lead (TEL)
TEL memiliki rumus molekul (Pb(C2H5)4). Pembakaran bensin yang diperkaya TEL akan menghasilkan oksida timbal hitam yang akan keluar bersama asap kendaraan atau menempel pada komponen mesin. Untuk mencegah oksida timbal menempel pada mesin, maka kedalam bensin bertimbal ditambahkan pula etilen btromida, C2H5Br. Atom bromin dari etilen bromida dapat membentuk timbal bromidaa, PbBr2 yang mudah menguap.
Sayangnya senyawa timbal ini merupakan racun yang dapat merusak otak.
2. Methyl Tertier Buthyl Ether (MTBE)
Senyawa MTBE ini lebih aman dibandingkan TEL karena tidak mengandung timbal.
Namun, tetap berpotensi mencemari lingkungan karena mempunyai sifat karsinogenik dan mudah bercampur dengan air, sehingga jika terjadi kebocoran pada tempat-tempat penampungan bensin (misalnya di pompa bensin) MTBE masuk ke air tanah bisa mencemari sumur dan sumber-sumber air minum lainnya.
3. Etanol
Etanol lebih unggul dibandingkan TEL dan MTBE karena tidak mencemari udara dengan timbal dan lebih mudah diuraikan oleh mikroorganisme. Selain itu, etanol juga dapat diperoleh dari fermentasi tumbuhan sehingga bahan baku untuk pembuatannya tersedia dalam jumlah yang cukup melimpah di alam dan dapat dibudidayakan.
Dampak Pembakaran Bahan Bakar Terhadap Lingkungan dan Kesehatan Serta Cara Untuk Mengatasinya
Tujuan pembelajaran:
1. Siswa dapat menjelaskan pengertian pencemaran udara yang disebabkan oleh pembakaran bahan bakar melalui media dan bahan ajar dengan benar.
2. Siswa dapat menjelaskan zat-zat pencemar hasil pembakaran bahan bakar yang berdampak terhadap lingkungan dan kesehatan melalui media dan bahan ajar dengan benar.
3. Siswa dapat menjelaskan cara untuk mengatasi dampak pembakaran bahan bakar terhadap lingkungan dan kesehatan melalui media dan bahan ajar dengan benar.
Salah satu dampak pembakaran bahan bakar yang berlebihan adalah pencemaran udara. Pencemaran udara atau polusi udara adalah masuknya zat-zat asing ke udara atau meningkatnya konsentrasi salah satu komponen udara dalam jumlah dan waktu yang secara karakteristik mengubah susunan udara normal sehingga mampu menimbulkan gangguan- gangguan bagi kehidupan maupun benda-benda lain. Zat-zat hasil pembakaran bahan bakar yang menimbulkan pencemaran udara antara lain karbon monoksida (CO), karbon dioksida (CO2), oksida belerang (SO2, SO3) dan oksida nitrogen (NO2,NO3)
1. Karbon Monoksida (CO)
Gas karbon monoksida adalah gas yang tidak berwarna, tidak berbau, tidak berasa, dan tidak merangsang. Hal ini menyebabkan keberadaannya sulit dideteksi. Pada hal gas ini sangat berbahaya bagi kesehatan karena pada kadar rendah dapat menimbulkan sesak napas dan pucat. Pada kadar yang lebih tinggi dapat menyebabkan pingsan dan pada kadar lebih dari 1.000 ppm dapat menimbulkan kematian. Gas CO ini berbahaya karena dapat membentuk senyawa dengan hemoglobin membentuk HbCO, dan ini merupakan racun bagi darah. Oleh karena yang diedarkan ke seluruh tubuh termasuk ke otak bukannya HbO, tetapi justru HbCO Keberadaan HbCO ini disebabkan karena persenyawaan HbCO memang lebih kuat ikatannya dibandingkan dengan HbO. Hal ini disebabkan karena afinitas HbCO lebih kuat 250 kali dibandingkan dengan HbO. Akibatnya Hb sulit melepas CO, sehingga tubuh bahkan otak akan mengalami kekurangan oksigen. Kekurangan oksigen dalam darah inilah yang akan menyebabkan terjadinya sesak napas, pingsan, atau bahkan kematian. Sumber
keberadaan gas CO ini adalah pembakaran yang tidak sempurna dari bahan bakar minyak bumi. Salah satunya adalah pembakaran bensin, di
mana pada pembakaran yang terjadi di mesin motor, dapat menghasilkan pembakaran tidak sempurna dengan reaksi sebagai berikut.
2 C8H18(g) + 17 O2(g) → 16 CO(g) + 18 H2O(g)
Sumber lain yang menyebabkan terjadinya gas CO, selain pembakaran tidak sempurna bensin adalah pembakaran tidak sempurna yang terjadi pada proses industri, pembakaran sampah, pembakaran hutan, kapal terbang, dan lain-lain. Namun demikian, penyebab utama banyaknya gas CO di udara adalah pembakaran tidak sempurna dari bensin, yang mencapai 59%. Sekarang ini para ahli mencoba mengembangkan alat yang berfungsi untuk mengurangi banyaknya gas CO, dengan merancang alat yang disebut catalytic converter, yang berfungsi mengubah gas pencemar udara seperti CO dan NO menjadi gas- gas yang tidak berbahaya, dengan reaksi:
Katalis Ni
2 CO(g) + O2(g) 2 CO2(g)
Katalis Ni
2 NO2(g) N2(g) + 2 O2(g)
2. Karbon Dioksida (CO2)
Sebagaimana gas CO, maka gas karbon dioksida juga mempunyai sifat tidak berwarna, tidak berasa, dan tidak merangsang. Gas CO2 merupakan hasil pembakaran sempurna bahan bakar minyak bumi maupun batu bara. Dengan semakin banyaknya jumlah kendaraan bermotor dan semakin banyaknya jumlah pabrik, berarti meningkat pula jumlah atau kadar CO2 di udara kita. Keberadaan CO2 yang berlebihan di udara memang tidak berakibat langsung pada manusia, sebagaimana gas CO. Akan tetapi berlebihnya kandungan CO2 menyebabkan sinar inframerah dari matahari diserap oleh bumi dan benda-benda di sekitarnya. Kelebihan sinar inframerah ini tidak dapat kembali ke atmosfer karena terhalang oleh lapisan CO2 yang ada di atmosfer. Akibatnya suhu di bumi menjadi semakin panas. Hal ini menyebabkan suhu di bumi, baik siang maupun malam hari tidak menunjukkan perbedaan yang berarti atau bahkan dapat dikatakan sama. Akibat yang ditimbulkan oleh berlebihnya kadar CO2 di udara ini dikenal sebagai
efek rumah kaca atau green house effect.