KANDIDAT
PROBE
DNA DARI URUTAN REPETITIF R529 UNTUK
DETEKSI
Toxoplasma gondii
Probe Designing from Repetitive Sequence (R529) for Detection of Toxoplasma gondii
Sri Hartati1, Asmarani Kusumawati2, Harto Widodo3, dan Dwi Priyo Widodo41Bagian Ilmu Penyakit Dalam Fakultas Kedokteran Hewan Universitas Gadjah Mada, Yogyakarta 2
Bagian Reproduksi Fakultas Kedokteran Hewan Universitas Gadjah Mada, Yogyakarta 3
Balai Besar Penelitian dan Pengembangan Tanaman Obat dan Obat Tradisional Tawangmangu, Tawangmangu 4
Bagian Parasitologi Fakultas Kedokteran Hewan Universitas Gadjah Mada, Yogyakarta E-mail: [email protected]
ABSTRAK
Penelitian ini bertujuan merancang kandidat probe dari urutan 529 bp (R529) yang terdapat 200-300 kopi dalam genom Toxoplasma gondii
(T. gondii). Untuk menguji spesifitas rancangan probe digunakan perangkat lunak basic local alignment search tool (BLASTN) dari national center for biotechnology information (NCBI) dan Geniuous. Probe DNA sebesar 237 bp dilabel yang dengan digoksigenin disintesis dengan
polymerase chain reaction (PCR). Kandidat probe yang dihasilkan berpotensi untuk digunakan lebih lanjut dalam deteksi keberadaan asam nukleat T. gondii pada berbagai teknik hibridisasi.
_________________________________________________________________________________________________________________ Kata kunci: Toxoplasma gondii, R529, kandidat probe
ABSTRACT
The aim of this study was to develop a probe candidate derived from R529, a repetitive 529 bp DNA fragment in the genome of T. gondii, that could be applied for nucleic acid detection. BLASTN program from NCBI was used to analyze its spesificity. A 237 bp digoxigenin labeled probe was successfully sintesized by PCR. Probe candidate has further potential usage for detection of T. gondii nucleic acid in many methods of hybridization.
_________________________________________________________________________________________________________________
Key words: Toxoplasma gondii, R529, probe candidate
PENDAHULUAN
Toksoplasmosis merupakan penyakit parasit menular yang disebabkan oleh protozoa, organisme bersel satu
Toxoplasma gondii (T. gondii) (Howard, 1987; Hökelek, 2009). Toxoplasma gondii bersifat ubiquitous yang diperkirakan menginfeksi 30-50% dari populasi manusia di dunia (Montoya dan Liesenfeld, 2004), dan hewan berdarah panas. Toxoplasma gondii merupakan parasit intraseluler yang dapat menginfeksi berbagai jaringan (WHO, 1979; Black, 2008).
Toksoplasmosis merupakan salah satu penyebab utama kegagalan reproduksi pada ruminansia kecil di dunia. Toksoplasmosis dapat menyebabkan resorpsi janin, aborsi, stillbirth, dan kematian neonatal. Hal ini mengakibatkan kerugian besar dalam pengelolaan hewan ternak (Ahmed et al., 2008). Selain menurunkan produktivitas ternak, infeksi T. gondii pada hewan juga dapat menjadi sumber penularan infeksi ke manusia (Dubey, 2008), yang berpengaruh sangat besar terhadap sosial-ekonomi (Roberts et al., 1994; Montoya dan Liesenfeld, 2004).
Diagnosis toksoplasmosis secara klasik masih bergantung kepada tes serologis dan demonstrasi patogen dalam sampel pasien. Cairan tubuh atau jaringan dapat juga digunakan pada tikus secara inokulasi intraperitoneal untuk menginfeksi kultur sel secara in vitro. Inokulasi pada tikus masih menjadi metode pilihan karena memiliki sensitivitas dan spesifisitas yang tinggi. Kelemahan teknik tersebut adalah lamanya waktu untuk mendapatkan hasil, yang berimplikasi terhadap kebutuhan untuk diagnosis prenatal. Selain itu, teknik tersebut membutuhkan laboran yang ahli (Homan et al., 2000).
Pemeriksaan serologis merupakan metode diagnosis yang penting untuk deteksi T. gondii pada kasus toksoplasmosis (Hedman et al., 1989). Metode ini mempunyai kelemahan yaitu tidak dapat menunjukkan fase aktif dari infeksi T. gondii dan tidak menunjukkan IgG atau IgM anti-Toxoplasma spesifik menyembunyikan infeksi karena hasil serum maternal negatif. Masalah ini juga terjadi pada pasien dengan kasus pasien yang mengalami imunosupresi(Nagy et al., 2006).
Polymerase chain reaction juga dapat digunakan untuk deteksi T. gondii dan untuk membandingkan sensitivitas deoxyribonucleic acid (DNA) target yang berbeda. Beberapa percobaan memberikan hasil negatif palsu pada diagnosis prenatal (Romand et al., 2001) atau perbedaan yang besar pada pasien imunokompromi dengan menggunakan assay PCR yang mungkin dikarenakan alasan patofisiologi, ketiadaan atau adanya intermiten parasit pada spesimen yang diuji, atau oleh karena rendahnya kemampuan kerja dari assay PCR. Penggunaan DNA target yang lebih repetitif namun bukan polimorfik mungkin dapat menyelesaikan permasalahan tersebut (Reischl et al., 2003).
Fragmen DNA repetitif R529 (gen R529) memiliki jumlah lebih dari 300 kopi dalam genom parasit T. gondii
dan dapat digunakan sebagai kandidat yang baik untuk diagnosis toksoplasmosis (Homan et al., 2000). Urutan tersebut cocok digunakan untuk analisis rutin yang sensitif karena merupakan urutan yang conserved dan memiliki jumlah kopi yang banyak (Reischl et al., 2003).
Pemanfaatan asam nukleat yang digunakan deteksi toksoplasmosis kali ini adalah teknik hibridasi menggunakan probe. Probe merupakan gen organisme yang conserved sehingga dapat digunakan untuk deteksi
dengan akurasi tinggi pada organisme target. Untuk deteksi penyakit maka probe harus memiliki homologi rendah dengan sel hospes, agar hibridisasi reaksi silang dengan gen hospes minimal. Perancangan probe yang ideal dapat menggunakan database bioinformatika dan analisis basic local alignment search tool (BLAST). Dengan menggunakan analisis BLAST maka kesamaan (similarity) urutan probe dengan organisme target dan genom hospes dapat diketahui sehingga syarat ideal
probe dapat dipenuhi (Pruitt et al., 2005).
Pelabelan probe menggunakan sistem digoksigenin (DIG) labelling untuk menghindari risiko radiasi elemen radioaktif. Probe dan metode yang digunakan akan memungkinkan puluhan hingga ratusan sampel dianalisis dalam waktu bersamaan menggunakan satu membran sehingga dapat digunakan dalam pemeriksaan rutin infeksi T. gondii.
MATERI DAN METODE Produksi Takizoit pada Mencit
Toxoplasma gondii (isolat lokal IS-1) diinfeksi secara intraperitoneal pada 5 ekor mencit (galur Balb/C) umur 8 minggu masing-masing 1x106 takizoit. Mencit yang menunjukkan asites (4-6 hari pasca-infeksi) dieutanasia. Takizoit dipanen dengan mencuci rongga perut menggunakan larutan natrium klorida (NaCl) fisiologis. Pelet takizoit didapat sesuai dengan metode yang digunakan Hartati (2007).
Isolasi DNA Total T. gondii
Takizoit T. gondii diekstraksi DNA dengan menggunakan DNAzol (Invitrogen) mengikuti cell pellet or suspension protocol. Pelet takizoit diresuspensi dalam 500 l reagen DNAzol, diikuti dengan setrifugasi (10.000 rpm, 10 menit, suhu ruang). Supernatan dipindahkan ke dalam tabung baru dan dilakukan penambahan 250 l etanol 100%, dicampur rata dan dibiarkan selama 3 menit, selanjutnya disentrifugasi (4000 rpm, 2 menit, suhu ruang) sehingga didapat pelet DNA. Pelet DNA dicuci 2 kali dengan 800 l etanol 75%, dikeringkan dengan udara kering selama 15 detik, dan dilarutkan kembali dalam 200 l 8 mM natrium hidroksida (NaOH ) dan 32 l 0,1 hydroxyethyl piperazine ethanesulfonic acid (HEPES).
Amplifikasi Urutan Repetitif R529 T. gondii dengan PCR
Fragmen urutan repetitif R529 diisolasi dan diamplifikasi dari DNA takizoit dengan PCR (Access
PCR system kit, Promega), menggunakan primer S1
upstream
5’-CTGCAGGGAGGAAGACGAAAG-3’dan primer C1 downstream:
5’-CTGCAGACACAGTGCACTCGG-3’ (Hartati, 2007). Reaksi PCR (PCR Thermal cycler, BioRad) dilakukan dengan program berikut: 1 siklus denaturasi (94° C, 2 menit), diikuti 30 siklus masing-masing dengan tahap denaturasi suhu (94° C, 30 detik), annealing (58° C, 30 detik), elongation (74° C, 1 menit), dan elongation
tambahan (72° C, 5 menit).
Perancangan dan Sintesis Probe Berlabel DIG Probe dirancang menggunakan program BLAST yang dapat diakses pada situs national center for biotechnology information (NCBI) dan perangkat lunak Geneious. Probe disintesis dengan PCR dan dilabel dengan menggunakan kit PCR DIG Labeling Mix (Roche), sesuai petunjuk perusahaan. Reaksi PCR dilakukan dalam 50 µl berisi 5 ng urutan repetitif R529, PCR DIG labeling mix (200 µM dNTP, digoksigenine-11-dUTP), 1-5 unit Taq DNA polymerase, dan 50 pmol setiap primer urutan repetitif R529. Desain probe
menggunakan primer upstream (TR-F):
ACTACAGACGCGATGCCG dan primer downstream
(TR-B): CTCCACTCTTCAATTCTCTCC (Hartati, 2007). Probe produk PCR dianalisis dengan elektroforesis gel agarosa.
HASIL DAN PEMBAHASAN
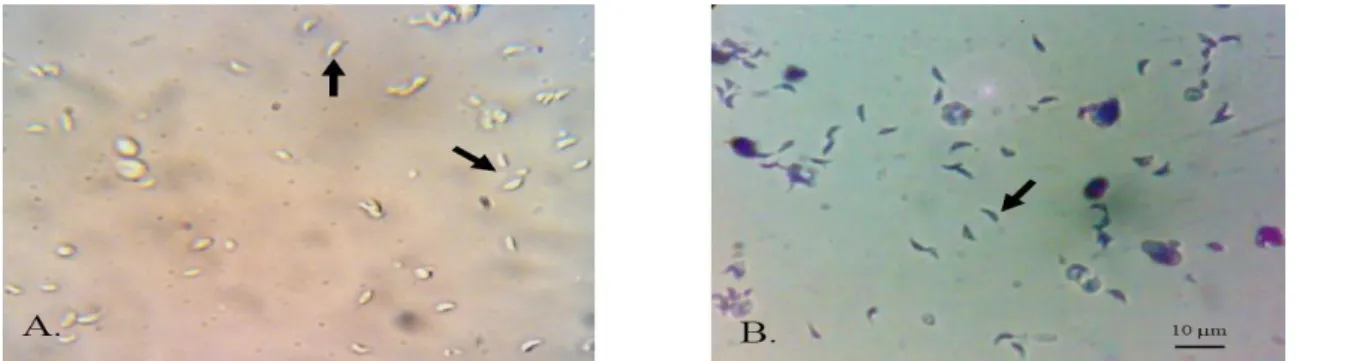
Produksi Takizoit Toxoplasma gondii pada Mencit Pengamatan T. gondii ekstrasel yang didapat dari cairan asites mencit menunjukkan stadium takizoit seperti yang disajikan pada Gambar 1. Takizoit berbentuk bulan sabit dengan salah satu ujungnya meruncing (conoidal anterior) dan ujung yang lainnya agak tumpul (rounded posterior), dengan panjang 5-7 µm dan lebar 2-3 µm (Ajioka, 2001; Seitz, 2009). Ujung meruncing dari takizoit ini memiliki peran penting dalam proses masuknya parasit ke dalam sel hospes. Takizoit merupakan bentuk proliferatif yang aktif membelah (Frenkel, 1990; Dubey et al., 1998; Ajioka, 2001).
Isolasi DNA Takizoit dan Amplifikasi Urutan Repetitif R529 T. gondii isolat IS-1 dengan PCR
Dengan menggunakan pasangan primer C1/S1, urutan repetitif R529 berhasil diamplifikasi dari genom
T. gondii isolat lokal IS-1 seperti yang disajikan pada Gambar 2. Pengurutan terhadap R529 dari T. gondii
isolat lokal IS-1 yang telah terdaftar dalam GenBank
dengan Acession Number EF195646 (Kusumawati et al., 2007), menunjukkan bahwa R529 sebenarnya hanya memiliki satu sisi pemotongan enzim PstI “ctgcag” dan tanpa nukleotida No. 371 berbeda dengan urutan yang pertama kali dilaporkan oleh Homan et al.
(2000) pada data GenBank dengan Acession Number
AF146527. Dengan demikian, satu set lengkap fragmen repetitif ini sebenarnya sepanjang 522 bp.
Analisis Kandidat Probe dari Urutan Repetitif 529 bp (R529) T. gondii
Suatu urutan gen atau fragmen DNA yang akan digunakan sebagai template untuk sintesis probe harus memiliki kestabilan yang tinggi dalam suatu organisme karena menurut Reue (1998) akurasi deteksi yang tinggi untuk organisme target dari suatu probe dapat dicapai apabila probe komplemen dengan DNA atau ribonucleic acid (RNA) organisme target sehingga urutan tersebut harus conserved selama evolusi. Pengurutan amplikon PCR dari berbagai isolat T. gondii menunjukkan bahwa urutan repetitif ini memiliki konservasi yang tinggi
(Reischl et al., 2002), bahkan konservasi alami yang tinggi mengakibatkan urutan ini tidak mungkin digunakan untuk identifikasi tipe T. gondii.
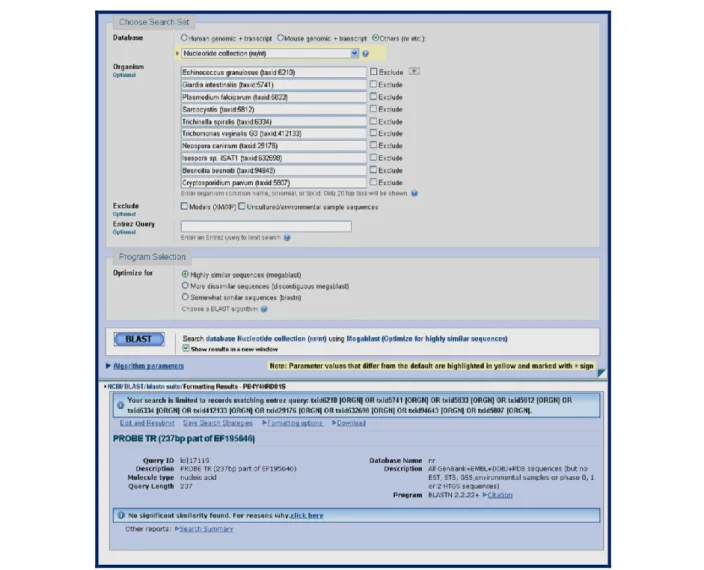
Kestabilan suatu gen atau fragmen DNA dari berbagai isolat suatu organisme dapat pula diketahui melalui analisis database bioinformatika yang dapat diakses pada Genbank. Analisis BLASTN dari urutan repetitif isolat lokal IS-1 terhadap berbagai isolat T. gondii menunjukkan tingkat kemiripan yang tinggi yaitu mencapai 97-100% seperti yang disajikan pada Gambar 3. Oleh karena itu, kandidat probe dapat dirancang berdasarkan urutan repetitif ini.
Probe untuk mendeteksi suatu penyakit harus memiliki kemiripan genetika tinggi dengan gen target dan kemiripan genetika yang rendah dengan genom
hospes (Rueue, 1998). Pruitt el al. (2005) menambahkan bahwa panjang urutan probe juga berpengaruh terhadap spesifitas probe. Spesifisitas
probe akan semakin tinggi dengan semakin panjangnya urutan, namun diperlukan waktu yang semakin lama untuk hibridisasi. Sebaliknya probe yang pendek
Gambar 2. Hasil elektroforesis DNA takizoit. A. Elektroforesis DNA takizoit T. gondii isolat IS-1 yang diisolasi dari cairan asites mencit (1, 2); B. Hasil amplifikasi gen repetitif R529 T. gondii isolat IS-1 dengan polymerase chain reaction (1, 2) dan kontrol negatif (3)
Gambar 3. Hasil analisis BLASTN dengan query kandidat probe TR yang berasal dari urutan repetitif 529 bp isolat lokal IS-1 ((EF 195646)
memiliki spesifitas yang rendah namun waktu hibridisasinya lebih cepat, sehingga perlu dirancang
probe dengan panjang tertentu dengan tingkat spesifitas masih tinggi namun waktu hibridisasi yang tidak terlalu lama. Umumnya panjang urutan probe adalah antara 100-1.000 bp.
Untuk memenuhi persyaratan pembuatan probe
yang ideal digunakan alat bantu program perangkat lunak Geneious. Kandidat probe yang dihasilkan adalah sebesar 237 bp yang merupakan bagian internal urutan repetitif 522 bp, yang selanjutnya disebut probe
TR. Sintesis kandidat probe TR dilakukan dengan PCR
dengan dengan rancangan sepasang primer TR-F dan TR-B seperti yang disajikan pada Gambar 4.
Selain memiliki tingkat kemiripan yang tinggi dengan organisme target yaitu berbagai galur T. gondii, kandidat probe TR memiliki tingkat kemiripan yang sangat rendah terhadap asam nukleat berbagai hospes. Analisis BLAST dengan optimasi program megablast
dan discontiguous megablast tidak menunjukkan adanya kesamaan yang bermakna. Demikian juga analisis BLASTN terhadap berbagai parasit lainnya, kandidat probe TR tidak memiliki kemiripan yang bermakna seperti yang disajikan pada Gambar 5.
Gambar 4. Perancangan probe dengan perangkat lunak Geneious. Daerah probe TR pada R529 ditunjukkan dengan pita warna merah, sedangkan primer TR-F dan TR-B ditunjukkan dengan warna hijau
Sintesis dan Analisis Probe Berlabel
Pelabelan probe DNA dengan DIG dapat dilakukan dengan metode random prime labeling, nick translation, 3’ end-labeling, 3’tailing, penambahan langsung DIG ke DNA (direct chemical labeling), dan PCR labeling. Metode PCR labeling memiliki beberapa kelebihan, diantaranya hanya dibutuhkan template
dalam jumlah kecil, kurang dibutuhkan optimasi dibanding metode lainnya, dapat dihasilkan probe
dalam jumlah besar, dapat dihasilkan probe yang sensitif dan metode ini sesuai untuk sintesis probe
pendek (<100 bp).
Hasil pelabelan probe TR perlu dievaluasi untuk mengetahui efisiensi setiap reaksi pelabelan dengan menentukan jumlah produk terlabel DIG. Hal ini sangat penting untuk menentukan jumlah yang tepat untuk pembuatan larutan hibridisasi. Terlalu banyak probe
akan menimbulkan terbentuknya latar belakang (back ground) yang dapat menyebabkan kesalahan dalam interpretasi hibridisasi. Sementara itu, terlalu rendah akan menghasilkan sinyal hibridisasi yang sangat lemah.
Efisiensi pelabelan sintesis probe melalui PCR dapat ditentukan tanpa melalui prosedur deteksi langsung. Estimasi secara cepat dapat dilakukan dengan analisis gel elektroforesis, yaitu dengan membandingkan migrasi probe terlabel DIG dengan yang tidak terlabel yaitu produk PCR tanpa adanya DIG-dUTP. Probe terlabel DIG akan tampak memiliki berat molekul yang lebih besar daripada produk tidak terlabel. Adanya DIG pada probe DNA akan menyebabkan migrasi pada gel lebih lambat dibandingkan DNA dengan ukuran yang sama tanpa dilabel DIG. Produk tidak terlabel akan menunjukkan migrasi sesuai dengan ukuran berat molekul sebenarnya
(237 bp). Adanya DIG pada campuran reaksi PCR akan memperlambat reaksi polimerasi dan mengurangi efisiensi pelabelan, hal ini ditunjukkan dengan intensitas pita pada gel elektroforesis kurang jelas dari dibandingkan dengan produk tanpa label seperti yang disajikan pada Gambar 6.
KESIMPULAN
Urutan gen repetitif R529 T. gondii isolat lokal IS-1 yang terdiri lebih dari 300 kopi dapat dijadikan kandidat probe untuk mendeteksi keberadaan T. gondii
pada penderita toksoplasmosis.
DAFTAR PUSTAKA
Ahmed, Y.F., S.M. Sokkar, H.M. Desouky, and A.H. Soror. 2008. Abortion due to toxoplasmosis in small ruminants. Global Vet.
2(6):337-342.
Ajioka, J.W., J.M. Fitzpatrick, and C.P. Reitter. 2001. Ultrastructure of a Toxoplasma gondii tachyzoite. http://journal.gambridge.org/. Black, J.G. 2008. Microbiology. 2nd ed. Wm. C. Brown Publisher,
USA.
Dubey, J.P. 2008. The history of Toxoplasma gondii: The first 100 years. J. Eukaryot. Microbiol. 55(6):467-475.
Dubey, J.P., D.S. Linsay, and C.A. Speer. 1998. Structures of
Toxoplasma gondii tachyzoites, bradyzoits, and sporozoites and biology and development of tissue cysts. Clin. Micro. Rev.
11(2):267-299.
Frenkel, J.K. 1990. Toxoplasmosis in human being. J. Am. Vet. Med. Assoc. 192(2):233-240.
Hartati, S. 2007. Karakterisasi Gen SAG1 dan R522 serta Produksi SAG1 Rekombinan Toxoplasma gondii Isolat Lokal IS-1 sebagai Dasar Pengembangan Diagnosa Toksoplasmosis. Disertasi. Universitas Gadjah Mada. Yogyakarta.
Hedman, K., M. Lappalainen, I. Seppala, and O. Makela. 1989. Recent primary Toxoplasma infection indicated by a low avidity of specific IgG. J. Infect. Dis. 159:736-739.
Hökelek, M. 2009. Toxoplasmosis: Overview-eMedicine Infectious Diseases. http://emedecine.medscape.com/infectious_disease. Gambar 6. Evaluasi hasil sintesis probe TR melalui metode PCR labeling dengan elektroforesis gel agarosa 1,5% dan arus 80 volt. Pada gel agarosa produk terlabel digoksigenin memiliki berat molekul yang lebih besar (1, 2) dibandingkan produk tidak terlabel (3)
Homan, W.L., M. Vercammen, J. De Breakeleer, and H. Verschueren. 2000. Identification of a 200- to 300-fold repetitive 529bp DNA fragment in Toxoplasma gondii, and its use for diagnostic and quantitive PCR. Int. J. Parasitol. 30:69-75. Howard, B.J. 1987. Clinical and Patology Microbiology. Mosby
Company St. Louis, Washington DC.
Kusumawati, A., S. Hartati, M. Toubiana, and S. Widada. 2007.
Toxoplasma gondii Repeat Region, a Duplex Repeat.
Unpublished.
Montoya, J.G. and O. Liesenfeld. 2004. Toxoplasmosis. Lancet.
263:1965-1975.
Nagy, B., Z. Ban, A. Beke, G.R. Nagy, L. Lazar, C. Papp, E. Toth-Pal, and Z. Papp. 2006. Detection of Toxoplasma gondii from amniotic fluid, a comparison of four different molecular biological methods. Clinica Chimica Acta. 368:131-137. Pruitt, K. D., T. Tatusova, and D.R. Maglott. 2005. NCBI Reference
Sequence (RefSeq): a curated non-redundant sequence database of genomes, transcripts and proteins. Nucleic Acids Res.
33(1):501-504.
Reischl, U., S. Bretagne, D. Kruger, P. Enault, and J-M. Costa. 2003. Comparison of two DNA target for diagnosis of Toxoplasmosis by real-time PCR using fluorescence resonance energy transfer hybridization probe. http://www.biomedcentral.com/1471-2334/3/7.
Reue, K. 1998. mRNA Quantitation techniques: Considerations for experimental design and application. J. Nutr. 128(11):2038-2044.
Roberts, T., K.D. Murrell, and S. Marks. 1994. Economic losses caused by foodborne parasitic diseases. Parasitol. Today.
10:419-423.
Salant, H., A. Markovics, D.T. Spira, and J. Hamburger. 2007. The development of molecular approach for copro diagnosis of
Toxoplama gondii. Vet. Parasitol. 146:214-220.
Seitz, R. 2009. Arboprotozoae. Transfus. Med. Hemother. 36:8- 31.
WHO. 1979. Parasitic Zoonosis. Report of A WHO Expert Committee with The Participation of FAO. WHO Technical Report Series.