Pembelajaran 8.1 Senyawa Aromatik A Materi Pelajaran
Senyawa organik secara umum diklasifikasikan ke dalam dua golongan yaitu, senyawa golongan alifatis dan senyawa aromatis. Penamaan aromatis dihubungkan dengan sifatnya yang memberi aroma pada senyawa tersebut. Senyawa aromatis mempunyai sifat kimia yang berbeda dengan senyawa alifatis. Senyawa aromatis dibagi menjadi dua golongan yaitu senyawa aromatik hidrokarbon dan senyawa aromatik heterosiklik. Kedua golongan senyawa tersebut memenuhi suatu hukum tentang kearomatik yang dikenal sebagai Hukum Huckel. Contoh senyawa aromatik heterosiklik antara lain piridin, puran, pirol, sedangkan senyawa aromatik hidrokarbon contoh yang umum adalah benzen dan turunannya.
1. Pengertian Senyawa Aromatik
Para kimiawan membagi semua senyawa organik ke dalam dua kelas yang lebih luas, yaitu senyawa alifatik dan senyawa aromatik. Berasal dari kata alifatis berarti bersifat lemak dan aromatik berarti harum. Senyawa alifatik adalah senyawa rantai terbuka atau senyawa siklik yang sifat kimianya mirip dengan senyawa rantai terbuka, sedangkan senyawa aromatik adalah benzena atau senyawa yang sifat kimianya menyerupai benzena.
Suatu senyawa aromatik mengandung orbital terdelokalisasi delokal yang berbentuk cincin. Banyaknya elektron p yang terlibat dalam orbital delokal harus tunduk pada rumus Huckel:
Elektron p = 4 n + 2
Dengan n = 0, 1, 2, 3,……….
Contoh senyawa aromatik adalah benzena dan naftalena. Adapun rumus strukturnya sebagai berikut:
Semua atom C dalam senyawa-senyawa di atas mempunyai hibrida sp2 dan terletak dalam satu bidang dengan orbital p yang tegak lurus pada bidang. Sejalan dengan konsep ikatan delokalisasi maka benzena mempunyai orbital terdelokalisasi yang berbentuk cincin, dan elektron p sebanyak 6 (mengikuti hokum Huckel dengan n = 1). Dalam naftalena, jumlah electron p-nya adalah 10. Hal ini mengikuti hokum Huckel dengan n = 2.
2. Tata nama dari Aromatik
Nama trivial asli dari sejumlah senyawa aromatik yang biasa telah diterima oleh IUPAC sebagai nama sistematik. Beberapa nama trivial ditulis pada Tabel 8.1
Ada cukup banyak senyawa aromatik yang ditemukan jauh sebelum metode pemberian nama secara sistematik (IUPAC) digunakan. Oleh karena itu pemberian nama umum yang tanpa aturan yang jelas cukup banyak digunakan hingga sekarang. Beberapa contoh diantaranya adalah:
Jika diperhatikan nama tiga senyawa pertama, yaitu benzena, toluena, dan stirena, tampak adanya kesamaan. Sebagai satu kelompok senyawa hidrokarbon aromatik tersebut dinamakan
arena.
Selain dari nama trivial biasanya kita juga memberi nama aromatik monosubstitusi dengan benzennya sebagai nama induk. Nama substitusi menjadi awalan bagi nama induk. Benzena monosubstitusi dinamakan sebagai turunan benzena, seperti:
Dalam hal benzena tersubstitusi dua gugus, ada tiga kemungkinan isomer yaitu isomer orto (o), meta (m) dan para (p). Contohnya adalah:
Pada beberapa contoh di atas, kedua substituen adalah sama. Awalan orto, meta, dan para tetap digunakan walaupun kedua subtituen berbeda, seperti:
Cara lain untuk mengetahui letak substituen adalah dengan memberi nomor pada atom karbon penyusun cincin. Metode penomoran ini sangat berguna jika terdapat lebih dari dua substituen, atau dengan sistem ortho, meta, para yang menunjukkan hubungan tempat antara kedua gugusan dalam cincin misalnya:
Gugus fenil dan benzil sering digunakan pada penamaan senyawa-senyawa aromatik. Struktur kedua gugus tersebut adalah:
Gugus fenil sering dituliskan dengan lambing Ph atau PE. Sedangkan lambing Ar digunakan untuk gugus aril (aromatik). Beberapa contoh disajikan berikut ini:
Tabel 8.1 Nama Trivial Dari Beberapa Benzena yang Bersubstitusi
3. Ikatan Dalam Aromatik
Dalam tahun 1825 Ahli Kimia Inggris Michael Faraday mengisolasi suatu cairan berminyak dari saluran gas London. Senyawa ini ternyata mempunyai rumus molekul C2H6dan diberi nama Benzena. 40 Tahun kemudian ahli Kimia Jerman, Friederich August Kekule menemukan struktur ini. Hampir 75 tahun kemudian baru dibentuk struktur benzen yang modern. Persoalan pertama dalam membuat struktur benzen yang dapat diterapkan berdasarkan fakta bahwa struktur yang adekuat tak dapat digambarkan apabila memakai garis ikatan yang biasa. Sekarang kiat emngetahui bahwa enam karbon atau benzen adalah sp2yang hibrid dan
disusun dalam bentuk cincin dengan 6 anggota. Tiap atom karbon mengandung sebauah elektron dalam orbit p. Kita harapkan bahwa enam elektron p ini ada dalam tiga ikatan.
Tetapi rumus bangun ini tidak menerangkan mengapa benzene tak mengalami reaksi seperti alkena. Lagi pula semua ikatan C-C dalam benzen panjangnya sama, tak mengandung tiga ikatan rangkap yang pendek dan tiga ikatan tunggal yang panjang. Semua ikatan C-C mempunyai panjang iaktan 1,40A, ikatan antara ikatan tunggal C-C (1,54 A) dan antara ikatan rangkap C=C (1,34A).
4. Aromatisasi dan Aturan Huckel
Struktur benzena dan turunannya seperti disebutkan diatas memperlihatkan adanya 6 elektron π dalam sistem siklik terkonjugasi. Siklobutadiena dan siklooktatetraena juga memiliki cincin siklik dengan ikatan rangkap dua terkonjugasi
Sekarang timbul pertanyaan yaitu apakah kedua senyawa tersebut termasuk senyawa aromatik? Ternyata keduanya tidak memiliki sifat aromatik walaupun terdapat ikatan terdelokalisasi pada cincinnya. Menurut Huckel, senyawa aromatik adalah senyawa yang memiliki sistem ikatan rangkap dua terkonjugasi dengan jumlah elektron π = (4n + 2), dengan n adalah bilangan bulat 0, 1, 2, 3 … jadi senyawa siklik dengan ikatan rangkap dua terkonjugasi memiliki jumlah elektron π = 2, 6, 10, 14 …. Adalah aromatik. Sedangkan siklobutadiena dan siklooktatetraena dengan 4 dan 8 elektron π, tidak memenuhi rumusan 4n + 2 sehingga bukan senyawa aromatik.
a. Ion-Ion Aromatik
Mencermati definisi Huckel di atas terlihat bahwa batasan tersebut tidak mempersyaratkan bahwa banyaknya orbital p harus sama dengan jumlah elektron π.Kenyataannya kedua hal ini dapat saja berbeda. Rumusan Huckel berlaku luas terhadap berbagai jenis spesies kimia, bukan hanya terhadap hidrokarbon netral.
Contoh:
anion siklopentadienil kation sikloheptatrienil Kedua spesies ini adalah aromatik
Molekul netral siklopentadiena sendiri tidak bersifat aromatis karena molekulnya tidak terkonjugasi penuh. Karbon gugus –CH2- dalam cincin adalah hibrida sp3, jadi menghalangi konjugasi –siklis orbital p. Akan tetapi bila satu atom H dari gugus –CH2- lepas maka karbon
sp3 berubah menjadi sp2 sehingga spesies sekarang mengandung 5 orbital p. Ada 3 cara pelepasan hidrogen dari gugus –CH2-, yaitu atom H pergi dengan membawa satu elektron, atom H pergi tanpa electron, dan atom H membentuk radikal.
H
+ H
Teori resonasi meramalkan ketiga spesies di atas sangat stabil sebab masing-masing mempunyai 5 struktur resonasi yang ekuivalen. Sedangkan teori Huckel meramalkan bahwa hanya anion yang dengan 6 elektron p adalah aromatik. Kenyataannya kation dan radikal siklopentadienil sulit dibuat, sedangkan karbanionnya dengan mudah dibuat dan karbanion ini sangat stabil. Fakta lain yang mendukung adalah bahwa siklopentadiena adalah hidrokarbon yang paling asam di antara hidrokarbon yang lain, pKa dari kebanyakan hidrokarbon 45, sedangkan siklopentadiena mempunyai pka = 16, harga yang sebanding dengan pKa air.
Siklopentadiena bersifat asam oleh karena anion yang terbentuk oleh ionisasi adalah cukup stabil. Tidak peduli bahwa anion siklopentadienil hanya mempunyai 5 orbital p.
Dengan alasan yang serupa dapat digunakan untuk meramalkan kestabilan kation, radikal dan anion sikloheptatrienil. Menurut teori resonansi ketiga spesies ini mempunyai kestabilan yang tinggi, akan tetapi menurut Huckel hanya kation sikloheptatrienil yang mempunyai kestabilan aromatik.
b. Pandangan Teori Resonansi
Pada mulanya struktur benzena dinyatakan oleh Kekule seperti berikut:
Akan tetapi karena panjang ikatan dalam molekul benzena semuanya sama, yaitu 1,39 A, dan benzena adalah senyawa tunggal (tidak mempunyai isomer); maka ikatan delokal dalam sistem benzena ditulis dengan struktur resonansi sebagai berikut:
Banyaknya ikatan p dan s adalah sama, karena itu dikatakan kedua struktur ekivalen dalam energi dan merupakan struktur resonansi yang penting. Masih ada struktur resonansi benzena yang lain, namun struktur resonansi tersebut tidak penting karena kandungan energinya tinggi. Misalnya yang dituliskan sebagai berikut:
Semakin banyak struktur resonansi yang dibuat untuk suatu senyawa, semakin besar pula energi resonansinya dan semakin stabil senyawa tersebut.
c. Energi Resonansi Pada Benzena
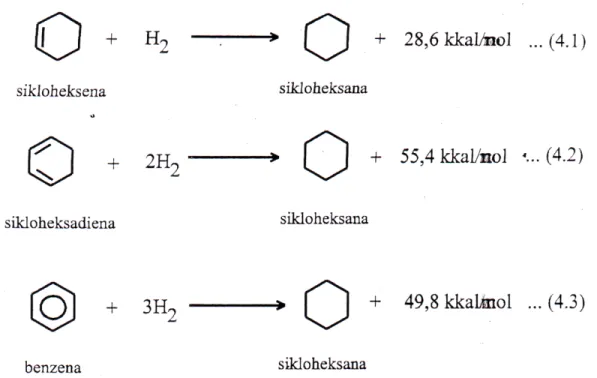
Untuk menghitung tentang apa yang dimaksud dengan energi resonansi, maka simaklah data panas hidrogenasi beberapa senyawa sebagai berikut:
Dari persamaan (4.1) terlihat bahwa untuk hidrogenasi satu ikatan rangkap dua dilepaskan kalor sebesar 28,6 kkal/mol. Sedangkan persamaan (4.2) menunjukkan bahwa hidrogenasi dua buah ikatan rangkap dua dilepaskan kalor sebesar 55,4 kkal/mol. Harga ini kira-kira sama dengan 2 x 28,6 kkal/mol.
Dengan demikian dapat diharapkan bahwa hidrogenasi tiga buah ikatan rangkap dua seperti struktur resonansi benzena akan melepaskan kalor sebesar 3 x 28,6 = 86 kkal/mol. Sedangkan dari persamaan (4.3) terlihat bahwa panas hidrogenasi molekul benzena yang sesungguhnya adalah 49,8 kkal/mol. Untuk lebih jelasnya harga-harga tersebut disajikan dalam Gambar 8.1.
Dari diagram di atas terlihat bahwa molekul benzena yang sesungguhnya memiliki energi lebih rendah dari pada struktur resonansi yang dibuat. Hal ini berarti bahwa struktur benzena yang sesungguhnya adalah lebih stabil disbanding struktur resonansinya yang paling stabil. Pada diagram juga tampak bahwa antara struktur benzena sesungguhnya dengan struktur resonansi terdapat selisih energi sebesar 36 kkal/mol. Harga selisih energi ini dinamakan energi kestabilan
atau energi resonansi. Jadi energi resonansi adalah perbedaan energi antara struktur sesungguhnya dengan struktur resonansi yang paling stabil. Semakin besar energi resonansi, maka senyawa bersangkutan semakin stabil.
5. Sifat Fisik dan Sifat Kimia Senyawa Aromatik Sifat Fisik:
1. Zat cair tidak berwarna 2. Memiliki bau yang khas 3. Mudah menguap
4. Tidak larut dalam pelarut polar seperti air air, tetapi larut dalam pelarut yang kurang polar atau nonpolar, seperti eter dan tetraklorometana
5. Titik Leleh : 5,5 derajat Celsius 6. Titik didih : 80,1derajat Celsius 7. Densitas : 0,88 .
8. Senyawanya berupa senyawa lingkar/siklis
10. Terjadi delokalisasi elektron pada struktur benzene 11. Mempunyai aroma yang khas .
Sifat Kimia:
1. Bersifat karsinogenik (racun) 2. Merupakan senyawa nonpolar
3. Tidak begitu reaktif, tapi mudah terbakar dengan menghasilkan banyak jelaga
4. Lebih mudah mengalami reaksi substitusi dari pada adisi.(untuk mengetahui beberapa reaksi subtitusi pada benzene)
5. Walaupun sukar diadisi tapi benzena masih dapat diadisi dengan katalis yang tepat, misalnya:
oAdisi dengan hidrogen dengan katalis Ni/Pt halus oAdisi dengan Cl2 atau Br2 dibawah sinar matahari
6. Sukar dioksidasi dengan senyawa oksidator seperti KMnO4, K2Cr2O7, dll.
7. Reaksi pada benzene harus menggunakan katalis karena kestabilan molekul benzene 6. Reaksi Substitusi Dari Senyawa Aromatik
a. Substitusi Elektrofilik Aromatik
Perbedaan sifat kimia antara struktur aromatik dengan struktur konjugasi rantai terbuka terlihat dari reaksinya terhadap halogen. Sistem aromatik mengalami reaksi substitusi sedangkan sistem konjugasi ploena mengalami reaksi adisi. Beberapa contoh reaksi substitusi terhadap benzena adalah sebagai berikut:
Mekanisme Substitusi Elektrofilik Aromatik Ditinjau reaksi klorinasi benzen berikut:
Dalam reaksi ini, klor digunakan sebagai sumber elektroifil, sedangkan feriklorida yang merupakan asam Lewis sebagai katalisator.
Tahap pertama dari reaksi klorinasi tersebut adalah pembentukan elektrofil dari klor. Reaksinya adalah:
Pada tahap kedua terjadi serangan elektrofil berupa ion kloronium tersebut terhadap cincin benzena, persamaannya:
Sebagai hasil adalah terbentuknya karbokation. Orbital kosong dari karbokation segera membentuk ikatan terdelokalisasi dengan orbital p atom karbon lain pada cincin seperti halnya ikatan terdelokalisasi pada ion afilik. Struktur ikatan terdelokalisasi yang bermuatan positif ini disebut ion benzenonium. Struktur hibrida resonansinya dituliskan sebagai berikut:
Ion FeCl4 yang terbentuk pada tahap pertama berada dalam keadaan kesetimbangan dengan ion klorida sesuai persamaan berikut:
Adanya nukleofil berupa ion klorida tersebut menyebabkan lepasnya satu proton, dan terbentuk lagi sistem terdelokalisasi cincin benzena, persamaannya:
Beberapa macam elektrofil disajikan dalam Tabel 8.2 di bawah ini: Tabel 8.2 Elektrofil Umum pada Substitusi Aromatik
Elektrofil Nama Proses
Cl+ Br+ NO2+ SO3 atau SO3H+ R+ Ion Kloronium Ion bromonium Ion nitronium
Ion sulfat trioksida (terprotonasi) Ion karbonium Klorinasi Brominasi Nitrasi Sulfonasi Alkilasi
Substituen Pengaktif dan Pen-Deaktif Cincin Diketahui struktur beberapa senyawa sebagai berikut:
Data kecepatan reaksi nitrasi (campuran HNO3 dan H2SO4) senyawa-senyawa di atas relatif terhadap benzena adalah sebagai berikut:
Toluena = 24,5 Benzena = 1,0
Klorobenzena = 0,003 Nitrobenzena = 0,0000001
Kesimpulan dari fakta tersebut adalah bahwa gugus –CH3 bersifat mengaktifkan cincin benzena terhadap substitusi elektrofilik, sedangkan gugus klor dan nitro bersifat mendeaktifkan cincin benzena terhadap reaksi elektrofilik. Gugus seperti CH3 disebut gugus pengaktif cincin, sedangkan gugus seperti klor dan nitro disebut gugus pendeaktif cincin benzena.
Gugus Pengarah Orto, Para Dan Meta
Apabila toluene dinitrasi maka NO2+ menyerang sebagian besar pada posisi orto dan para, sebaliknya hanya sedikit yang menyerang pada posisi meta. Reaksinya adalah:
Terlihat bahwa produk orto dan para lebih dominan dari pada meta. Dapatkah teori Kimia Organik menerangkan kenyataan ini?
Diketahui bahwa pada reaksi ini terbentuk zat antara reaktif yang disebut ion benzenonium. Postulat Hammond menyatakan bahwa arah dari reaksi ditentukan oleh kestabilan ion benzenonium, ion benzenonium yang terjadi pada serangan orto, para, dan meta sebagai berikut:
Serangan meta :
Dari gambar di atas dapat dilihat bahwa ion benzenonium pada penyerangan orto dan para mempunyai hibrida resonansi dengan karbokation tersier. Hal ini tidak terjadi pada serangan meta. Dapat diartikan bahwa ion benzenonium yang terbentuk pada penyerangan orto-para lebih stabil daripada ion benzenonium pada penyerangan meta. Berdasar pada postulat Hammond, penyerangan orto-para haruslah dominan.
Selanjutnya ditinjau reaksi brominasi nitrobenzene dengan reaksi berikut:
Hibrida resonansi dari ion benzenonium yang terbentuk pada serangan orto, para dan meta dapat digambarkan sebagai berikut:
Serangan meta :
Terlihat bahwa ion benzenonium yang terbentuk pada serangan orto dan para memiliki karbon positif yang berikatan langsung dengan atom N yang bermuatan positif pula. Struktur demikian adalah kurang stabil karena menyebabkan lemahnya ikatan C – N. Hal serupa tidak dijumpai pada penyerangan meta. Sehingga dapat disimpulkan bahwa ion benzenanonium pada penyerangan meta bersifat lebih stabil. Dengan mengacu pada prinsip Hammond di atas, maka penyerangan orto, para dan meta disajikan dalam Tabel 8.3 di bawah ini.
Tabel 8.3 Gugus Fungsi Pengarah
Pengarah orto, para Pengarah meta
-CH3, -CH2, -CH3 (alkil) -F, -Cl, -Br, -I
-OH, -OCH3, -OR -NH2, -NHR, -NR2
-NO2, -SO3H
-COR, -CO2H, -CO2R -CoN
Berkaitan dengan uraian di atas, gugus pengarah orto dan para umumnya adalah gugus pengaktif cincin, Sedangkan gugus pengarah meta adalah gugus pendeaktif cincin.
Perkecualian untuk gugus berupa atom halogen (F, Cl, Br dan I), halogen adalah pengarah orto dan para namun bersifat mendeaktifkan cincin.
b. Pentingnya Gugus Pengarah Dalam Sintesis
Fungsi gugus pengarah dan pengaktif cincin adalah penting dalam merancang sintesis bertahap yang melibatkan substitusi aromatik. Sebagai contoh diberikan soal berikut:
Rancang sintesis senyawa-senyawa berikut, dimulai dengan benzena! a. asam m-klorobenzenasulfonat
b. p=nitrotoluena Jawab:
a. Pembuatan asam m-klorobenzenasufonat dari benzena dimulai dengan reaksi sulfonasi terlebih dahulu, selanjutnya diikuti klorinasi. Hal ini dikerjakan mengingat gugus sulfonat adalah gugus pengarah meta, sehingga klor akan terikat pada posisi meta. Sebagai hasil dapat diperoleh senyawa seperti yang diharapkan.
Reaksi di atas tidak dapat dibalik seandainya dibalik yaitu klorinasi terlebih dahulu kemudian diikuti dengan sulfonasi maka akan terbentuk senyawa berbeda, yaitu asam orto dan para-klorobenzenasulfonat. Hal ini dapat terjadi karena klor adalah gugus pengarah orto dan para.
b. Mengingat metil adalah gugus orto dan para, maka sintesis p-nitrotoluena dikerjakan dengan alkilasi terlebih dahulu, kemudian diikuti dengan nitrasi.
Dalam hal ini hasil yang diperoleh merupakan campuran hasil substitusi orto dan para. Jika ada dua gugus yang telah terikat pada cincin maka dalam rangka pengikatan gugus ketiga, antara keduanya dapat saling menguatkan atau saling melemahkan, tergantung pada jenis gugus yang ada tersebut.
c. Hidrokarbon Aromatik Polisiklik
Pada uraian yang terdahulu telah disebutkan konsep aromatik yaitu kestabilan yang tinggi dari sistem siklik pada benzena dan turunannya. Pada senyawa-senyawa yang telah diterangkan di atas hanya terdapat sebuah cincin siklik.
Naftalena dengan rumus molekul C10H8, adalah senyawa aromatik polisiklik yang banyak ditemui dalam ter batubara. Struktur naftalena merupakan bidang datar dengan dua cincin benzena yang menyatu. Kedua cincin tersebut menggunakan bersama dua buah atom karbon. Salah satu struktur hibrida resonansinya.
Atas dasar konsep struktur delokal tersebut di atas maka resonansi hibrida naftalena dapat dituliskan sebagai berikut:
Hal ini berarti bahwa naftalena dapat menyerupai struktur alkena terbuka. Atas dasar itulah maka dapat diperkirakan bahwa naftalena lebih reaktif dari pada benzena.
d. Senyawa Aromatik Heterosiklik
Pada bagian ini akan diperkenalkan jenis senyawa aromatik yang penyusun cincin siklisnya bukan atom karbon saja, melainkan juga terdapat atom lain.
Atom yang sering ditemui antara lain nitrogen, oksigen, dan belerang. Perhatikan struktur berikut:
Pada kedua senyawa di atas, nitrogen dalam keadaan hibrida sp2. Lima atom karbon pada piridin masing-masing menyumbang 1 (satu) electron p, sehingga untuk memenuhi jumlah 6 elektron p dibutuhkan satu elektron dari atom N. Satu elektron ini berasal dari orbital p yang tegak lurus pada orbital sp2. Dengan demikian, satu orbital sp2 terisi dua electron dari atom N tidak termasuk pada sistem delokal. Sebagai akibat orbital sp2 terisi dua elektron tersebut, dia dapat menerima proton dari asam membentuk garam ataupun membentuk ikatan hidrogen dengan air.
Sedang pada pirol hanya ada 4 atom karbon dalam keadaan sp2, sehingga untuk melengkapi jumlah 6 elektron p, atom nitrogen harus menyumbang dua electron. Untuk itu atom N harus berada dalam keadaan sp2 dengan orbital p terisi dua elektron yang tegak lurus pada bidang. Ketiga orbital sp2 dari atom N terikat oleh dua tom C dan satu atom H. Karena itulah kebasaan pirol lebih lemah disbanding piridin.
Beberapa senyawa aromatik kelompok piridin, dimana heteroatomnya hanya menyumbangkan satu elektron kepada sistem aromatik diantaranya adalah:
Sedangkan beberapa contoh senyawa aromatik kelompok pirol dimana heteroatomnya hanya menyumbangkan dua electron kepada sistem delokal, diantaranya adalah:
7. Kegunaan senyawa aromatik
Kegunaan benzena yang terpenting adalah sebagai pelarut dan sebagai bahan baku pembuatan senyawa-senyawa aromatik lainnya yang merupakan senyawa turunan benzena.
Masing-masing dari senyawa turunan benzena tersebut memiliki kegunaan yang beragam bagi kehidupan manusia.
B. Latihan
1. Perhatikan reaksi berikut :
Rumus struktur dari senyawa hasil tersebut adalah ...
Dari beberapa kegunaan senyawa benzene berikut :
1. pelarut 2. Antiseptic 3. Bahan baku pembuatan plastic 4. pengawet mmakanan dan 5. Bahan baku obat gosok
2. Kegunaan dari senyawa dengan rumus struktur :
adalah …..
a. 1 b. 2 c. 3 d. 4 e. 5
C. Intisari Materi Pelajaran
Aromatisasi Kestabilan luar biasa dari suatu sistem siklik terkonjugasi penuh. Suatu senyawa aromatik mengandung orbital terdelokalisasi delokal yang berbentuk cincin. Banyaknya elektron p yang terlibat dalam orbital delokal harus tunduk pada rumus Huckel:
Elektron p = 4 n + 2
Dengan n = 0, 1, 2, 3,……….
Kegunaan benzena yang terpenting adalah sebagai pelarut dan sebagai bahan baku pembuatan senyawa-senyawa aromatik lainnya yang merupakan senyawa turunan benzena
D. Evaluasi
1. Tulislah struktur: (a) etilbenzena; (b) 2,4,6-tribromoanilina; (c) p-etilfenol; (d) 2-feniletanol; (e) benzil bromida!
2. Senyawa manakah berikut ini yang bersifat aromatik? Jelaskan!
a.
b.
3.Tuliskan reaksi yang terjadi:
a. Benzena + gas klor dengan katalis FeCl3. b. Benzena + asam sulfat pekat.
Cocokkanlah jawaban Anda dengan Kunci Jawaban Evaluasi 1 yang terdapat di bagian
akhir modul ini. Hitunglah jawaban yang benar. Kemudian, gunakan rumus berikut untuk mengetahui tingkat penguasaan Anda terhadap materi Pembelajaran 1.
Tingkat penguasaan: Jumlah Jawaban Ynag Benar
Jumlah Soal x100 %
Arti tingkat penguasaan:
90 - 100% = baik sekali 80 - 89% = baik 70 - 79% = cukup < 70% = kurang